快速鉴定假禾谷镰孢菌对Cyclobutrifluram和氟唑菌酰羟胺抗药性的方法
文献发布时间:2024-04-18 19:58:21
技术领域
本发明属于分子生物学技术领域。涉及一种假禾谷镰孢菌琥珀酸脱氢酶B(FpSdhB)和C
背景技术
小麦茎基腐病在我国发生日趋严重,威胁我国粮食安全的同时也存在真菌毒素污染的潜在风险。该病害是由多种病原菌引起的土传病害,其优势致病菌是假禾谷镰孢菌(Fusarium pseudograminearum)。遗憾的是,目前我国尚未有登记的化学药剂用于该病害的防治。由先正达公司研发的两种新型琥珀酸脱氢酶抑制剂Cyclobutrifluram和氟唑菌酰羟胺在室内和田间对F.pseudograminearum均表现出优异的抑制活性。
当前杀菌剂抗性行动委员会(Fungicide Resistance Raction Committee,FRAC)将其抗药性风险定为中等到高等,需要进行抗性的风险管理。本研究室通过药剂驯化的方法得到了对Cyclobutrifluram和氟唑菌酰羟胺产生高水平抗性的假禾谷镰孢菌菌株,并且有一些高水平抗性菌株的生存适合度较高。但是假禾谷镰孢菌引起的小麦茎基腐病属于土传病害,在该病害的防控过程中这两种杀菌剂常用于种子处理。推测假禾谷镰孢菌对Cyclobutrifluram和氟唑菌酰羟胺具有中等抗性风险。因此,未来在使用Cyclobutrifluram和氟唑菌酰羟胺防治植物病原真菌病害时,需要加强抗性监测,并对这两种SDHIs杀菌剂的抗性发生情况进行及时的预警,从而指导Cyclobutrifluram和氟唑菌酰羟胺的科学使用,延缓其抗药性的产生,延长药剂的使用年限。
杀菌剂抗性常规检测方法包括:菌丝生长速率法、菌丝干重测定法、孢子萌发测定法和琼脂展布法等。但是这些方法都需要先分离并纯化获得病原菌,然后将病原菌接种到带药培养基上或者接种于杀菌剂处理过的活体植株或组织上,一定时间之后才能调查结果。采用常规的方法,当田间抗药性菌株的频率大于1%时,才能被检测的到(如有95%的概率检测到1%频率的抗药性菌株,检测的样本量需要大于300),因此具有灵敏度低,工作量大,试验周期长等缺点。
随着分子生物学技术的飞速发展及其应用范围的不断扩展,限制性酶切PCR和等位特异PCR分子技术开始在病原菌抗药性检测中应用。与传统的检测方法比较,不但节省了检测时间提高了工作效率,而且增强了检测的灵敏度,检测频率在10
发明内容
为了解决现有技术中存在的问题,本发明的目的是提供一种假禾谷镰孢菌对Cyclobutrifluram和氟唑菌酰羟胺抗性相关蛋白及其编码基因,以及其作为假禾谷镰孢菌对这两种杀菌剂抗性筛选标记,在进行假禾谷镰孢菌对Cyclobutrifluram和氟唑菌酰羟胺抗性鉴定中的应用。
为了实现本发明目的,本发明的技术方案如下:
本发明的一个目的是提供假禾谷镰孢菌Cyclobutrifluram和氟唑菌酰羟胺抗性相关蛋白,是如下1))-4)中任意一项所示的蛋白质:
1)由序列表中的SEQ ID NO:20/SEQ ID NO:21的氨基酸残基序列组成的Cyclobutrifluram抗性相关蛋白质;
2)将序列表中的SEQ ID NO:20/SEQ ID NO:21的氨基酸残基序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加且与Cyclobutrifluram抗性功能相关的由SEQ IDNO:20/SEQ ID NO:21衍生的蛋白质;
3)由序列表中的SEQ ID NO:21的氨基酸残基序列组成的与Cyclobutrifluram和/或氟唑菌酰羟胺抗性相关蛋白质;
4)将序列表中的SEQ ID NO:21的氨基酸残基序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加且与Cyclobutrifluram和/或氟唑菌酰羟胺抗性功能相关的由SEQ ID NO:21衍生的蛋白质。
其中,所述假禾谷镰孢菌Cyclobutrifluram抗性相关蛋白,为FpSdhB蛋白,自N端第248位氨基酸为组氨酸时,对Cyclobutrifluram敏感型基因型,自N端起第248位氨基酸突变为酪氨酸时,假禾谷镰孢菌对Cyclobutrifluram表现抗药性。FpSdhC
在本发明的一种实施方案中,假禾谷镰孢菌抗性相关蛋白(FpSdhB蛋白)的序列如SEQ ID NO:20所示,当SEQ ID NO:20的N端第248位氨基酸为组氨酸(X=H)时,假禾谷镰孢菌对Cyclobutrifluram敏感,当SEQ ID NO:20的自N端起第248位氨基酸为酪氨酸(X=Y)时,假禾谷镰孢菌对Cyclobutrifluram表现抗药性。假禾谷镰孢菌抗性相关蛋白(FpSdhC
本发明还提供Cyclobutrifluram和/或氟唑菌酰羟胺抗性相关蛋白的编码基因。
所述编码基因的DNA核苷酸序列如下1)、2)或3)所示:
1)序列表中SEQ ID NO:22/SEQ ID NO:23的核苷酸序列;
2)在严格条件下可与1)所述的DNA序列重组且编码与Cyclobutrifluram和/或氟唑菌酰羟胺抗性功能相关蛋白的DNA分子;
3)与序列表中SEQ ID NO:22/SEQ ID NO:23的核苷酸序列具有90%以上的同源性的且编码与Cyclobutrifluram和/或氟唑菌酰羟胺抗性功能相关蛋白的DNA分子。
其中,SEQ ID NO:22为假禾谷镰孢菌FpSdhB蛋白编码基因(FpSdh B)。SEQ ID NO:22基因全长964bp,外显子总长837bp,分别为自5’端第1-358、432-583和638-964位核苷酸,编码278个氨基酸;包含2个内含子,内含子总长127bp,分别为自5’端第359-431和584-637位核苷酸。SEQ ID NO:23为假禾谷镰孢菌FpSdhC
假禾谷镰孢菌FpSdhB蛋白编码基因中,自5'端起第869位核苷酸为C,为对Cyclobutrifluram敏感的基因型。当自5'端起第869位核苷酸为T时,假禾谷镰孢菌对Cyclobutrifluram表现抗药性。
在本发明的一个实施方式中,所述编码基因如SEQ ID NO:22所示,自SEQ ID NO:22的5'端起第869位核苷酸为C(y=c),为对Cyclobutrifluram敏感的基因型。当自SEQ IDNO:22的5'端起第869位核苷酸为T(y=t)时,假禾谷镰孢菌表现抗药性。
假禾谷镰孢菌FpSdhC
含有上述的编码基因的表达盒、重组表达载体或转基因重组菌也属于本发明的保护范围。
本发明另一个目的是提供假禾谷镰孢菌琥珀酸脱氢酶蛋白或其编码基因在鉴定假禾谷镰孢菌抗药性中的应用。
在本发明的一个实施方式中,通过检测假禾谷镰孢菌FpSdhB蛋白自N端起第248位氨基酸是否由组氨酸变为酪氨酸,如果第248位氨基酸由组氨酸变为酪氨酸则其对Cyclobutrifluram抗性提高。通过检测假禾谷镰孢菌FpSdhC
通过检测假禾谷镰孢菌FpSdhB蛋白的编码基因自5'端起第869位核苷酸是否为T,如果第869位为T,则其对Cyclobutrifluram抗性提高;或通过检测假禾谷镰孢菌FpSdhC
本发明的再一个目的是提供一种检测或辅助检测假禾谷镰孢菌中FpSdh B基因是否存在突变位点的引物组,由序列表中SEQ ID NO:5和SEQ ID NO:6所述的DNA分子组成;以及一种检测或辅助检测假禾谷镰孢菌中FpSdh C
所述的引物组在鉴定假禾谷镰孢菌抗药性中的应用也属于本发明的保护范围;所述抗药性是指假禾谷镰孢菌对Cyclobutrifluram和氟唑菌酰羟胺的抗药性。
本发明还提供一种检测或辅助检测假禾谷镰孢菌中FpSdh B和FpSdh C
以待测假禾谷镰孢菌菌株的基因组DNA为模板,用SEQ ID NO:5和SEQ ID NO:6所示引物对进行PCR扩增,若SEQ ID NO:5和SEQ ID NO:6能扩增出578bp条带,则所述待测假禾谷镰孢菌中FpSdh B基因存在或候选存在突变位点。
以待测假禾谷镰孢菌菌株的基因组DNA为模板,利用SEQ ID NO:11和SEQ ID NO:14或SEQ ID NO:15和SEQ ID NO:17所示片段组成的引物对进行PCR扩增,若SEQ ID NO:11和SEQ ID NO:14所示片段组成的引物对能扩增出543bp条带,或者SEQ ID NO:15和SEQ IDNO:17所示片段组成的引物对能扩增出502bp条带,则所述待测假禾谷镰孢菌中FpSdh C
所述PCR扩增中,SEQ ID NO:5和SEQ ID NO:6的退火温度为63℃,SEQ ID NO:11和SEQ ID NO:14的退火温度为61.1℃,SEQ ID NO:15和SEQ ID NO:17的退火温度为58.8℃。
所述方法中,所述突变位点指假禾谷镰孢菌中FpSdh B基因的自5'端起第869位核苷酸为T,由此导致假禾谷镰孢菌FpSdhB蛋白的自N端起第248位氨基酸由组氨酸变为酪氨酸;或FpSdh C
所述方法中,突变后的假禾谷镰孢菌FpSdhB蛋白如SEQ ID NO:20所示,其中,SEQID NO:20的自N端起第248位氨基酸为酪氨酸(X=Y),突变后的假禾谷镰孢菌FpSdh B基因如SEQ ID NO:22所示,其中,自SEQ ID NO:22的5'端起第869位核苷酸为T(y=t)。突变后的假禾谷镰孢菌FpSdhC
本发明还提供上述方法在鉴定假禾谷镰孢菌抗药性中的应用;所述抗药性是指假禾谷镰孢菌对Cyclobutrifluram和氟唑菌酰羟胺的抗药性。
具有所述突变位点的假禾谷镰孢菌具有或候选具有抗药性。
本发明的另一个目的是提供假禾谷镰孢菌中FpSdh B和FpSdh C
本发明所提供的假禾谷镰孢菌中FpSdh B基因的一个突变位点,为假禾谷镰孢菌FpSdh B基因的基因组序列自5'端起第869位核苷酸为T;假禾谷镰孢菌FpSdh C
本发明所提供的假禾谷镰孢菌中琥珀酸脱氢酶蛋白的三个突变位点,为假禾谷镰孢菌中FpSdhB蛋白的自N端起第248位氨基酸为酪氨酸,FpSdhC
所述突变位点指相对于对Cyclobutrifluram敏感的基因型,假禾谷镰孢菌中FpSdh B基因的自5'端起第869位突变为T,由此导致假禾谷镰孢菌FpSdhB蛋白自N端起第248位氨基酸由组氨酸变为酪氨酸。另外,所述突变位点相对于对Cyclobutrifluram和氟唑菌酰羟胺敏感的基因型,假禾谷镰孢菌中FpSdh C
上述任一所述突变位点在鉴定假禾谷镰孢菌抗药性中的应用也属于本发明的保护范围;上述应用中,存在所述突变位点的假禾谷镰孢菌具有或候选具有抗药性。所述抗药性是指假禾谷镰孢菌对Cyclobutrifluram或氟唑菌酰羟胺的抗药性。
本发明提供的分子检测方法,灵敏度高、稳定性好、检测周期短,可用于高通量地监测田间假禾谷镰孢菌对杀菌剂Cyclobutrifluram和氟唑菌酰羟的抗性基因频率以及抗性发生和发展情况,实现抗性病害的早期预警,指导及时调整小麦茎基腐病的防治策略,促进科学用药,延缓抗药性的发生和发展,并在病害的可持续管理系统中发挥重要的作用。
本发明提供的检测假禾谷镰孢菌对Cyclobutrifluram和氟唑菌酰羟胺产生抗性的点突变的方法,可对抗性菌株进行高灵敏度、简单快速的分子检测,及时了解抗药性发生动态,对制定合理的病害管理方案、有效控制抗药性病害发展具有重要意义。
附图说明
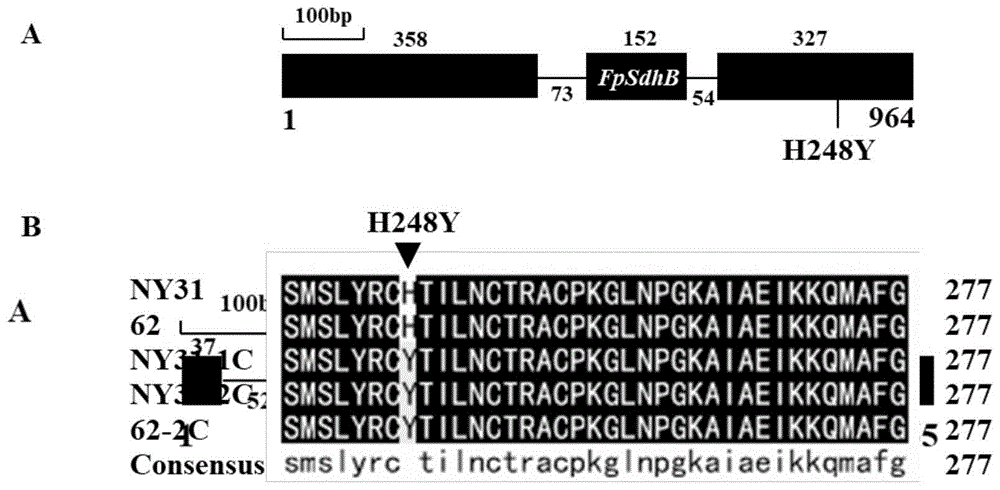
图1为假禾谷镰孢菌敏感和抗性菌株的氨基酸序列对比(H248Y)。A假禾谷镰孢菌FpSdh B基因模式图与H248Y点突变在基因上的位置;B假禾谷镰孢菌Cyclobutrifluram敏感和抗性菌株的FpSdh B蛋白氨基酸序列比对。NY31和62为敏感菌株;NY31-1C、NY31-2C和62-2C为抗性菌株。
图2为假禾谷镰孢菌敏感和抗性菌株的氨基酸序列对比(A83V和R86K)。A假禾谷镰孢菌FpSdh C
图3为Cyclobutrifluram与假禾谷镰孢菌FpSdh B蛋白突变前后结合模式(H248Y)ACyclobutrifluram与FpSdh B蛋白互作的氨基酸;B Cyclobutrifluram与FpSdh B蛋白结合姿态与结合能;C Cyclobutrifluram与H248Y-FpSdh B蛋白互作的氨基酸;DCyclobutrifluram与H248Y-FpSdh B结合姿态与结合能。
图4为Cyclobutrifluram与假禾谷镰孢菌FpSdh C
图5为氟唑菌酰羟胺与假禾谷镰孢菌FpSdh C
图6为H248Y点突变的AS-PCR引物和最适退火温度筛选A H248Y-R1;B H248Y-R2;CH248Y-R3;D H248Y-R4。
图7为A83V点突变的AS-PCR引物和最适退火温度筛选;A A83V-F1;B A83V-F2;CA83V-F3;D A83V-F4。
图8为R86K点突变的AS-PCR引物和最适退火温度筛选;A为R86K-R1;B R86K-R2;CR86K-R3;D R86K-R4。
图9为H248Y点突变AS-PCR检测假禾谷镰孢菌抗药性菌株(63℃);NY31、62、W6、DE2、H1、C-3和P16为敏感菌株,NY31-1C、NY31-2C和62-2C为Cyclobutrifluram抗性菌株,以及其它镰孢菌禾谷镰孢菌、层出镰孢菌、尖孢镰孢菌和藤仓镰孢菌。
图10为A83V点突变AS-PCR检测假禾谷镰孢菌抗药性菌株(61.1℃);NY31、62、W6、DE2、H1、C-3和P16为敏感菌株;62-1C为Cyclobutrifluram抗性菌株;62-AF、DE2-AF和W6-1F为氟唑菌酰羟胺抗性菌株;以及其它镰孢菌禾谷镰孢菌、层出镰孢菌、尖孢镰孢菌和藤仓镰孢菌。
图11为R86K点突变AS-PCR检测假禾谷镰孢菌抗药性菌株(58.8℃);NY31、62、W6、DE2、H1、C-3和P16为敏感菌株;W6-1C为Cyclobutrifluram抗性菌株;W6-2F为氟唑菌酰羟胺抗性菌株;以及其它镰孢菌禾谷镰孢菌、层出镰孢菌、尖孢镰孢菌和藤仓镰孢菌。
具体实施方式
下面将结合实施例子对本发明的优选实施方式进行详细说明。需要理解的是以下实施例的给出仅是为了起到说明的目的,并不是用于对本发明的范围进行限制。本领域的技术人员在不背离本发明的宗旨和精神的情况下,可以对本发明进行各种修改和替换。
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
以上菌株仅为本发明在实施例所使用的材料,事实上,在应用本发明所述筛选标记时,可使用任何商购途径获得的真菌菌株。
文中“抗性菌株”均指对杀菌剂Cyclobutrifluram或氟唑菌酰羟胺表现抗性的假禾谷镰孢菌;“敏感菌株”均指对杀菌剂Cyclobutrifluram和氟唑菌酰羟胺表现敏感的假禾谷镰孢菌。
下述实施例中使用的假禾谷镰孢菌菌株为:菌株NY31、62、W6、DE2、H1、C-3和P16为敏感菌株,NY31-1C、NY31-2C、62-1C、62-2C和W6-1C为Cyclobutrifluram抗性菌株,62-AF、DE2-AF、W6-1F和W6-2F氟唑菌酰羟胺抗性菌株。
上述菌株62、W6、H1、C-3和P16采自中国陕西省渭南市;DE2采自中国河南省长垣市;NY31采自中国河南省南阳市;NY31-1C和NY31-2C是由NY31在实验室条件下经药剂驯化得来的;62-1C、62-2C和62-AF是由62在实验室条件下经药剂驯化得来的;W6-1C、W6-1F和W6-2F是由W6在实验室条件下经药剂驯化得来的;DE2-AF是由DE2在实验室条件下经药剂驯化得来的;经过现有的形态学和分子生物学方法鉴定所有菌株均为假禾谷镰孢菌。上述各个菌株均经过菌落生长测定法进行抗药性验证。
本发明中,SEQ ID NO:20序列如下所示:
SEQ ID NO:20中,自氨基端第248位氨基酸X为H或Y。
本发明中,SEQ ID NO:21序列如下所示:
SEQ ID NO:21中,自氨基端第83位氨基酸X为A或V,自氨基端第86位氨基酸X为R或K。本发明中,SEQ ID NO:22序列如下所示:
SEQ ID NO:22中,自5'端起第869位核苷酸y=c或t。
本发明中,SEQ ID NO:23序列如下所示:
SEQ ID NO:23中,自5'端起第346位核苷酸y=c或t,自5'端起第355位核苷酸为r=g或a。
实施例l、假禾谷镰孢菌对Cyclobutrifluram和氟唑菌酰羟胺敏感性
假禾谷镰孢菌抗性突变体为NY31-1C,NY31-2C,62-1C,62-2C,W6-1C,62-AF,W6-1F,W6-2F和DE2-AF;敏感菌株为NY31,62,W6,DE2,H1、C-3和P16。
YBA培养基:细菌学蛋白胨10g,酵母提取物10g,无水乙酸钠20g,蒸馏水定容至lL,121℃,灭菌20min。
实验步骤如下:
1)Cyclobutrifluram或氟唑菌酰羟胺以二甲基亚砜(DMSO)为溶剂,配制成浓度为10
2)将已灭菌的YBA培养基冷却至45℃,向100mL YBA培养基中加入100μL相应的药剂工作液并混匀,将带药的培养基倒入直径为9cm的培养皿中,以DMSO的处理为空白对照,每个浓度的含药培养基设3次技术重复。
3)假禾谷镰孢菌在YBA平板上预培养3天后,使用打孔器沿菌落边缘打取直径为0.5cm的菌饼,菌丝面向下接种于按照步骤2)制备的带药和对照培养基平板上,置于25℃培养箱中避光培养,3天后测量菌落直径。
4)十字交叉法测量菌落直径,根据菌落直径计算出各浓度药剂对供试菌株的菌丝生长的抑制率。然后将抑制率转化成机率值(Y),药剂浓度转换成以10为底的对数值(X),使用DPS数据处理软件分别求出供试假禾谷镰孢菌的毒力回归方程Y=a+bX,以及相关系数R
抗性倍数=抗性菌株的EC
结果如表1和表2所示:
表1供试假禾谷镰孢菌菌株对Cyclobutrifluram的敏感性
通过假禾谷镰孢菌对Cyclobutrifluram的敏感性检测,结果发现假禾谷镰孢菌敏感菌株NY31,62,W6,DE2,H1、C-3和P16的平均EC
表2供试假禾谷镰孢菌菌株对氟唑菌酰羟胺的敏感性
通过假禾谷镰孢菌对氟唑菌酰羟胺的敏感性检测,结果发现假禾谷镰孢菌敏感菌株NY31,62,W6,DE2,H1、C-3和P16的平均EC
实施例2、假禾谷镰孢菌中FpSdhB/C
一、菌株培养
1、菌株:抗性菌株为NY31-1C,NY31-2C,62-1C,62-2C,W6-1C,62-AF,W6-1F,W6-2F和DE2-AF;敏感菌株为NY31,62,W6,DE2,H1、C-3和P16。
2、方法:
菌株培养:使用PDA培养基(土豆200g,葡萄糖20g,琼脂粉15g,蒸馏水定容至1L,121℃,20min灭菌备用),于25℃培养假禾谷镰孢菌。25℃黑暗培养4天后收集菌丝,液氮冰冻后于-80℃保存,用于提取基因组DNA。
二、分别提取假禾谷镰孢菌敏感菌株和抗性菌株的基因组DNA:
1)取适量经液氮冷冻的菌丝,用研钵研磨至粉末状,置于2mL离心管中;
2)向离心管中加入800μL 3%CTAB溶液(65℃预热),之后65℃水浴1h,期间颠倒混匀/15min;
3)向离心管中加入等体积的苯酚:氯仿:异戊醇=25:24:1,混合均匀后,12000g,室温,10min离心;
4)吸取600μL上清液置于新的2mL灭菌离心管中,加入等体积氯仿:异戊醇=24:1,置于3D摇床75r/min,室温,10min;
5)12000g,室温,10min离心后,取400μL上清到新离心管中,并加入0.6倍体积的异丙醇,置于-20℃冰箱30min;
6)12000g,4℃,10min,离心去上清,留沉淀,沉淀即为DNA;
7)向离心管中加入800μL 75%乙醇,轻弹离心管壁,洗涤DNA;
8)7500g,4℃,5min,离心去上清,减压干燥除尽酒精;
9)向含有DNA管中加入30-50μL ddH
三、假禾谷镰孢菌敏感菌株琥珀酸脱氢酶基因FpSdh B或FpSdh C
采用引物FpSdh B-F(5’-CGTTCCTGTCGATTCCGAGT-3’,SEQ ID NO:1)和FpSdh B-R(5’-ACCGGTAAGCCAAAACGTGA-3’,SEQ ID NO:2),扩增编码假禾谷镰孢菌FpSdh B基因的全长。采用FpSdh C
PCR反应体系(20μL反应体系):FastPfu buffer 4μL,dNTPs 2μL,FastPfu DNAPolymerase 0.5μL,FpSdh B-F(或FpSdh C
将PCR产物进行测序。假禾谷镰孢菌抗性菌株的SdhB蛋白FpSdh B基因全长964bp,包含2个内含子,序列如SEQ ID NO:22所示,自SEQ ID NO:11的5'端起第869位核苷酸为T(y=t),编码如SEQ ID NO:20所示氨基酸序列,SEQ ID NO:20的N端第248位氨基酸为酪氨酸(X=Y)。假禾谷镰孢菌抗性菌株的SdhC
四、序列比对
分别将抗性菌株NY31-1C、NY31-2C、62-1C、62-2C、W6-1C、62-AF、W6-1F、W6-2F和DE2-AF,以及敏感菌株为NY31、62、W6和DE2的FpSdh B和FpSdh C
敏感菌株中,基因FpSdh B的基因组序列自5'端起第869位核苷酸为C(自SEQ IDNO:22的5'端起第869位核苷酸为C(y=c),对应的Sdh B蛋白自N端起第248位氨基酸为组氨酸(His)(自SEQ ID NO:20的自N端起第248位氨基酸为组氨酸(X=H),而抗性菌株NY31-1C,NY31-2C和62-2C中基因FpSdh B的基因组序列自5'端起第869位核苷酸为T(自SEQ ID NO:22的5'端起第869位核苷酸为T(y=t),蛋白FpSdh B自N端起第248位氨基酸为酪氨酸(Tyr)(自SEQ ID NO:20的自N端起第248位氨基酸为酪氨酸(X=Y)(图1);敏感菌株FpSdh C
结果表明,抗性菌株在FpSdh B和FpSdh C
室内抗药性突变体的诱导研究中,抗性水平划分标准为:抗性菌株EC
实施例4、假禾谷镰孢菌中抗性相关突变位点的验证
一、序列比对
假禾谷镰孢菌FpSdh B和FpSdh C
二、同源建模
基于模板蛋白三维结构文件以及序列比对文件,由序列的相似性推测结构的相似性,采用Modeller v9.19程序对FpSdh B和FpSdh C
对FpSdh B和FpSdh C
三、分子对接
将构建得到的FpSdh B蛋白和FpSdh B-H248Y蛋白结构进行分子力学优化处理,作为分子对接的受体。分子对接采用AutoDock4.2.6软件包实现,分别获取底物Cyclobutrifluram的结构,加氢,并采用MOPAC程序优化结构,计算PM3原子电荷。最后,采用Autodock Tools 1.5.6分别处理配体和受体的结构,将对接的盒子包裹活性位点,XYZ个方向的格点数设为25.13×25.13×25.13,格点间距为
四、结果分析
1)Cyclobutrifluram与FpSdh B蛋白及其突变体H248Y的相互作用
为了分析Cyclobutrifluram与FpSdh B蛋白和突变体H248Y结合的驱动力,本文对Cyclobutrifluram-蛋白的相互作用模式进行了分析。Cyclobutrifluram在由His248、Cys27、Lys271、Tyr245、Asn240和Ser241共6个氨基酸残基组成的疏水口袋中(图3A)。其中His248和Lys271与Cyclobutrifluram结合成氢键,可以使Cyclobutrifluram与FpSdh B之间稳定结合,亲和力为-5.68kcal/moL(图3B)。然而,FpSdh B蛋白发生H248Y点突变后,Cyclobutrifluram结合在由Thr249、Tyr248、Cys247、Tyr245和Lys271共5个氨基酸残基组成的疏水口袋中(图3C),参与分子识别的残基数量减少,Thr249与Cyclobutrifluram结合成氢键。另外,由于H248Y突变之后,由于空间位阻的影响,导致Cyclobutrifluram的姿态发生改变,影响分子的结合构象,导致其与靶点的结合能力减弱至-4.54kcal/moL(图3D),从而使FpSdh B-H248Y(SEQ ID NO:20的自N端起第248位氨基酸为酪氨酸(X=Y))突变菌株表现出抗性。
2)Cyclobutrifluram与FpSdh C
为了分析Cyclobutrifluram与FpSdh C
3)氟唑菌酰羟胺与FpSdh C
为了分析氟唑菌酰羟胺与FpSdh C
五、结论
采用分子对接方法研究了突变体发生H248Y、A83V和R86K点突变后产生抗性的原因。分子对接结果表明Cyclobutrifluram和氟唑菌酰羟胺可以结合到蛋白的催化活性位点。His248突变为Tyr248、Ala83突变为Val83或Arg86突变为Lys86,均可导致Cyclobutrifluram或氟唑菌酰羟胺与靶点的结合模式发生改变,周围参与识别的氨基酸残基数量减少,疏水相互作用减弱,其与活性中心的结合能力降低,进而使FpSdh B-H248Y和FpSdh C
实施例4、检测假禾谷镰孢菌中突变位点的方法
一、引物设计
菌株为实施例1中所用菌株,引物如表2。根据突变体FpSdh B和FpSdh C
表2.AS-PCR检测假禾谷镰孢菌对Cyclobutrifluram和氟唑菌酰羟胺抗药性中使用的引物
/>
本方法在上游或下游引物的最后一个碱基与突变体一致,3'-端第二个碱基同时也进行改变,并结合不同退火温度进行扩增,提高引物特异性。
PCR反应体系如下:
20μL的PCR体系:2×Taq PCR Starmix 10μL,H248Y-F/A83V-F(1/2/3/4)/R86K-F1μL(10μM),H248Y-R(1/2/3/4)/A83V-R/R86K-R(1/2/3/4)1μL(10μM),基因组DNA 100ng(1μL),ddH
PCR反应条件如下:94℃3min;94℃30s,55-65℃30s,72℃40s,30个循环;72℃10min;12℃保存。
PCR产物扩增结果表明,引物H248Y-R2/R3在退火温度为55-65℃时不能区分抗性菌株与敏感菌株(图6B/C)。H248Y-R1/R4在退火温度为63℃时仅能从抗性菌株中扩增出578bp的条带,而不能在敏感菌株中扩增出条带(图6A/D)。引物A83V-F3和F4在退火温度为55-65℃时不能区分抗性菌株与敏感菌株(图7C/D)。A83V-F1/F2在退火温度为61.1℃时仅能从抗性菌株中扩增出543bp的条带,而不能在敏感菌株中扩增出条带(图7A/B)。引物R86K-R1、R3和R4在退火温度为55-65℃时不能明显区分抗性菌株与敏感菌株(图8A/C/D)。R86K-R2在退火温度为58.8℃时仅能从抗性菌株中扩增出502bp的条带,而不能在敏感菌株中扩增出条带(图8A)。
上述结果表明:引物对H248Y-F/H248Y-R1/R4、A83V-F1/F2/A83V-R和R86K-F/R86K-R2可以分别对H248Y、A83V和R86K抗性位点进行检测,从最适退火温度范围和引物通用性考虑,最终选择引物对H248Y-F/H248Y-R1(63℃)、A83V-F2/A83V-R(61.1℃)和R86K-F/R86K-R2(58.8℃)作为AS-PCR引物。对上述突变位点进行检测,引物H248Y-F/H248Y-R1扩增产物为SEQ ID N0:22中第314-891位核苷酸;引物A83V-F2/A83V-R扩增产物为SEQ ID N0:23中第325-865位核苷酸及下游2bp;引物R86K-F/R86K-R2扩增产物为SEQ ID N0:23中第1-376位核苷酸及上游126bp。
检测突变位点
以待测的假禾谷镰孢菌基因组DNA为模板,用引物对H248Y-F/H248Y-R1、A83V-F2/A83V-R和R86K-F/R86K-R2进行PCR扩增,然后进行琼脂糖凝胶电泳检测,若能够从菌株基因组DNA中扩增获得片段,判定所述菌株为抗性菌株,若不能扩增获得片段,则判定所检测的假禾谷镰孢菌为敏感菌株。
PCR扩增体系与反应条件与实验中一致,引物对H248Y-F/H248Y-R1的退火温度为63℃,引物对A83V-F2/A83V-R的退火温度为61.1℃,引物对R86K-F/R86K-R2的退火温度为58.8℃。
引物对H248Y-F/H248Y-R1的待测菌株为:敏感菌株NY31、62、W6、DE2、H1、C-3和P16,抗性菌株NY31-1C、NY31-2C和62-2C,以及其它镰孢菌禾谷镰孢菌、层出镰孢菌、尖孢镰孢菌和藤仓镰孢菌。
引物对A83V-F2/A83V-R的待测菌株为:敏感菌株NY31、62、W6、DE2、H1、C-3和P16,抗性菌株62-1C、62-AF、DE2-AF和W6-1F,以及其它镰孢菌禾谷镰孢菌、层出镰孢菌、尖孢镰孢菌和藤仓镰孢菌。
引物对R86K-F/R86K-R2的待测菌株为:敏感菌株NY31、62、W6、DE2、H1、C-3和P16,抗性菌株W6-1C和W6-2F,以及其它镰孢菌禾谷镰孢菌、层出镰孢菌、尖孢镰孢菌和藤仓镰孢菌。
结果表明,引物对H248Y-F/H248Y-R1在退火温度为63℃时仅能从抗性菌株中扩增出578bp的片段,而不能从敏感菌株中扩增出条带(图9)。引物对A83V-F2/A83V-R在退火温度为61.1℃时仅能从抗性菌株中扩增出543bp的片段,而不能从敏感菌株中扩增出条带(图10)。引物对R86K-F/R86K-R2在退火温度为58.8℃时仅能从抗性菌株中扩增出502bp的片段,而不能从敏感菌株中扩增出条带(图11)。且上述引物对均不能从其它镰孢菌如禾谷镰孢菌、层出镰孢菌、尖孢镰孢菌和藤仓镰孢菌中扩增出条带。
因此,采用引物对H248Y-F/H248Y-R1、A83V-F2/A83V-R和R86K-F/R86K-R2,分别在63℃、61.1℃和58.8℃的退火温度条件下,可以有效检测假禾谷镰孢菌对Cyclobutrifluram和氟唑菌酰羟胺的抗药性菌株。
- 禾谷镰孢菌鉴定及其对多菌灵产生中等抗药性水平确认的一管检测法
- 禾谷镰孢菌鉴定及其对多菌灵产生中等抗药性水平确认的一管检测法
