一种多花黄精多糖及其制备方法和应用
文献发布时间:2023-06-19 18:37:28
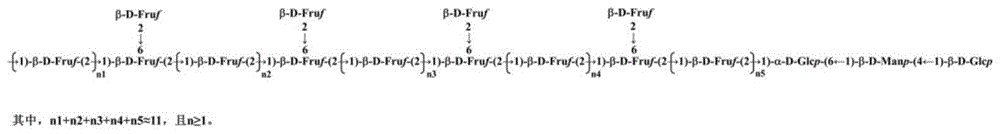
技术领域
本发明属于植物多糖领域,具体涉及一种多花黄精多糖及其制备方法和应用。
背景技术
多糖是构成生命的四大基本物质之一,通常由10个以上单糖通过不同类型的糖苷键相连。广泛存在于植物、动物和微生物的细胞壁中,天然多糖具有多种生物学效应,如降血脂、降血糖、抗氧化、抗肿瘤、免疫调节、抗炎等作用,能够直接影响机体物质和能量代谢,调节肠道菌群组成、维持身体健康,具有重要的药用价值。
非酒精性脂肪肝(Non-alcoholic fatty liver disease,NAFLD)一般是指除外酒精和其他有明确肝损害的因素所致的临床病理综合征。组织学主要是以弥漫性肝细胞大泡性脂肪变为主要特征。近年来NAFLD患病率呈逐年上升趋势,已经被认为是全球性的主要公共健康问题之一。目前在临床上没有治疗NAFLD的有效药物,一般采用抗氧化剂、胰岛素增敏剂、调脂药等用于NAFLD的临床治疗。
黄精中含有丰富的多糖成分,其化学结构复杂,不同来源、不同品种的黄精多糖含量、结构与活性有较大的差异,多花黄精(Polygonatum cyrtonema Hua,PCH)是百合科黄精属中的一种多年生草本植物,具有补肾益精、滋阴润燥的功效,是2020年版《中国药典》中收载的3种黄精之一,广泛分布于我国南方地区。多花黄精多糖是多花黄精中主要的活性成分,且已被证实具有抗氧化、降血糖、降血脂、抗动脉粥样硬化、抗肿瘤、抗疲劳等药理活性。
发明内容
本发明的目的在于提供一种多花黄精多糖及其制备方法,从多花黄精的根茎中提取分离出的一种多花黄精多糖均一组分,命名为PCP1,主要由果糖、葡萄糖和甘露糖组成。
本发明还有一个目的在于提供一种多花黄精多糖的应用,用于功能食品、保健品制备或者用于治疗非酒精性脂肪肝的药物制备。
本发明具体技术方案如下:
一种多花黄精多糖,重均分子量为4650Da,数均分子量为4420Da;纯度为98.68%;所述多花黄精多糖包括四种单糖,摩尔比为:果糖:葡萄糖:甘露糖:半乳糖=88.1:9.7:1.6:0.3;所述多花黄精多糖主链主要由→1)-β-D-Fruf-(2→、→1,6)-β-D-Fruf-(2→和少量的→6)-α-D-Glcp-(1→、→4)-β-D-Manp-(1→、β-D-Glcp-(1→组成,侧链主要由β-D-Fruf-(2→连接在→1,6)-β-D-Fruf-(2→的C-6位置组成,其中Fruf代表呋喃果糖,Glcp代表吡喃葡萄糖,Manp代表吡喃甘露糖。
本发明提供的一种多花黄精多糖的制备方法,包括以下步骤:
1)、将新鲜多花黄精根茎烘干、粉碎,获得多花黄精根茎粉末;
2)、将多花黄精根茎粉末加水加热提取,离心保留上清液;上清液浓缩后加入无水乙醇,低温条件下醇沉,离心,保留沉淀,得到多花黄精粗多糖;
3)、将多花黄精粗多糖加水加热复溶,离心后,上清液进行脱色、脱色液浓缩,并经滤膜过滤后,使用Sevag试剂脱除蛋白质,低温透析,最后,所得多糖溶液冷冻干燥,获得初步纯化多花黄精多糖粉末;
4)、将初步纯化多花黄精多糖粉末加水溶解后,过滤、去离子水洗脱,洗脱液经浓缩、低温透析后,冷冻干燥,获得多花黄精多糖水洗组分粉末;
5)、将多花黄精多糖水洗组分粉末加水溶解后,洗脱、浓缩、透析后,冷冻干燥,获得多花黄精多糖均一组分PCP1。
步骤1)具体为:新鲜多花黄精根茎经清洗和除须后,切成6~8mm薄片,于60℃烘干72~96h,然后用电动粉碎机粉碎,过60目筛,获得粒径均匀的多花黄精根茎粉末。
优选的,所述新鲜多花黄精根茎选自九华多花黄精的根茎。
步骤2)加热提取温度是75℃,提取时间1.5~2h;
优选的,步骤2)中,加热提取2次,第一次提取后,离心,保留上清液,沉淀继续加入去离子水按照相同的方法提取1.5~2h;
步骤2)中所述低温条件下醇沉,具体为:4℃冰箱内醇沉12h;醇沉时,加入无水乙醇,使混合溶液中乙醇体积分数为75%;
优选的,步骤2)具体为:取多花黄精根茎粉末,加入去离子水,料液比为1:20~24;加热至75℃,提取1.5~2h;冷却后,5000~8000r/min离心15~20min保留上清液,沉淀继续加入1000~1200mL去离子水重复提取1.5~2h,5000~8000r/min离心15~20min后,合并两次上清液;浓缩至200~300mL,缓慢加入无水乙醇至乙醇体积分数为75%,于4℃冰箱内醇沉12h后,8000r/min离心20min获得多花黄精粗多糖;
步骤3)具体为:多花黄精粗多糖中再加入200~300mL去离子水边加热至60℃并缓慢搅拌使其复溶,至溶液澄清,沉淀物不继续溶解后,12000~15000r/min离心15min,取上清液,用D101大孔树脂进行脱色,脱色液浓缩至原溶液体积的1/10~1/5,并经0.22μm微孔滤膜过滤后,使用Sevag试剂脱除蛋白质,经Bradford法测定后,证明蛋白质脱除干净即可,随后60℃旋转蒸发除去Sevag试剂,经0.22μm微孔滤膜过滤除菌后,使用截留分子量为1000Da的透析袋于0~4℃透析72h除去小分子物质;最后,多糖溶液于-80℃条件下冷冻干燥72h,获得初步纯化多花黄精多糖粉末。
步骤4)具体为:称量200mg初步纯化多花黄精多糖粉末加入20~40mL去离子水溶解后,0.22μm微孔滤膜过滤后上样DEAE-52纤维素阴离子交换层析柱,用去离子水以0.4mL/min流速进行洗脱,每10min收集一管,并使用蒽酮-硫酸试剂检测多糖是否洗脱完全,待多糖洗脱完全后,将洗脱液浓缩至原体积的1/10~1/5,用截留分子量1000Da的透析袋0~4℃透析72h后,-80℃冷冻干燥72h,获得多花黄精多糖水洗组分粉末;
步骤5)具体为:称量30mg多花黄精多糖水洗组分粉末,加入4~6mL去离子水常温溶解后,0.22μm微孔滤膜过滤,上样Sephadex G-75凝胶色谱柱,用去离子水进行洗脱,流速为0.38mL/min,每10min收集一管,洗脱液浓缩至原体积的1/10~1/5,再用截留分子量1000Da透析袋0~4℃透析72h后,-80℃冷冻干燥72h,获得多花黄精多糖均一组分PCP1。
本发明还有一个目的在于提供一种多花黄精多糖的应用,用于功能食品、保健品制备或者用于治疗非酒精性脂肪肝的药物制备。
多糖可通过减轻氧化应激损伤、平衡肠道菌群结构以及促进短链脂肪酸的产生修复肠道屏障。与现有技术相比,本发明从多花黄精中获得的均一多糖组分PCP1,可显著改善NAFLD的氧化应激与肠道菌群结构失衡,可作为治疗NAFLD的功能性食品或药品中的一种天然成分。
附图说明
图1为PCP1的纯度、分子量、红外检测结果;图中A为DEAE-52纤维素柱的洗脱曲线;B为Sephadex G-75凝胶色谱柱的洗脱曲线;C为PCP1的绝对分子量分布图;D为PCP1的红外光谱图;E为PCP1的高效凝胶渗透色谱(HPGPC)分析图;
图2为PCP1的单糖组成结果图;图中A是标准单糖的结果图;B是PCP1被2M TFA在121℃下水解2h的结果图;C是PCP1被2.5M TFA在60℃下水解1h的结果图;其中,标准单糖:岩藻糖(Fuc)、阿拉伯糖(Ara)、鼠李糖(Rha)、半乳糖(Gal)、葡萄糖(Glc)、木糖(Xyl)、甘露糖(Man)、果糖(Fru)、核糖(Rib)、半乳糖醛酸(Gal-UA)、古罗糖醛酸(Gul-UA)、葡萄糖醛酸(Glc-UA)、甘露糖醛酸(Man-UA);
图3为PCP1的甲基化结果;其中,A为PCP1的气相色谱-质谱(GC-MS)总离子流图;B为二级碎片离子流图;
图4A为PCP1的
图4B为
图4C为DEPT-135谱图;
图4D为COSY谱图;
图4E为HSQC谱图;
图4F为HMBC谱图;
图5为PCP1的主要糖链结构图;
图6为PCP1对肝脏损伤和脂质代谢的影响结果图;其中,A为H&E和油红O染色图;B为肝脏丙氨酸转氨酶(ALT)水平变化图;C为肝脏天门冬氨酸转氨酶(AST)水平变化图;D为肝脏指数(实验结束时小鼠的肝脏湿重占体重的百分比);E为血清甘油三酯(TG)水平变化图;F为血清总胆固醇(TC)水平变化图;G为血清低密度脂蛋白胆固醇(LDL-C)水平变化图;H为血清高密度脂蛋白胆固醇(HDL-C)水平变化图;数据表示为平均值±S.D.(n=6);与ND组相比,*P<0.05,**P<0.01;与HFD组相比,#P<0.05,##P<0.01;
图7为PCP1对小鼠氧化应激和口服糖耐量的影响;其中,A为肝脏超氧化物歧化酶(SOD)水平变化图;B为肝脏谷胱甘肽(GSH)水平变化图;C为肝脏丙二醛(MDA)水平变化图;D为小鼠口服糖耐量实验结果图;E为口服糖耐量实验时间-血糖曲线的曲线下面积;数据表示为平均值±S.D.(n=6);与ND组相比,*P<0.05,**P<0.01;与HFD组相比,#P<0.05,##P<0.01;
图8为PCP1对肠道菌群整体结构的影响;其中,A为多样性分析:Chao1、observedspecies、Simpson和Shannon指数图;B为基于UniFrac的未加权主坐标分析(PCoA)得分图;C为Venn图;数据显示为平均值±S.D.(n=5);与ND组相比,*P<0.05,**P<0.01;与HFD组相比,#P<0.05;
图9为PCP1在门和属水平上对肠道菌群和短链脂肪酸水平的影响;其中,A为门水平上菌群相对丰度变化图;B为Firmicutes/Bacteroidetes相对丰度的比值;C为几种代表属的相对丰度变化;D为LEfSe分析结果;E为PCP1对粪便短链脂肪酸的影响;数据显示为平均值±S.D.(n=5);与ND组相比,*P<0.05,**P<0.01;与HFD组相比,#P<0.05,##P<0.01。
具体实施方式
本发明所用的材料和试剂:
从安徽省九华山采挖的新鲜九华黄精由柳春燕副研究员(中国芜湖皖南医学院)鉴定为多花黄精(Polygonatum cyrtonema Hua,PCH)。DEAE-52阴离子交换纤维素和Sephadex G-75葡聚糖凝胶(北京索莱宝科技有限公司)。甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、丙氨酸转氨酶(ALT)、天门冬氨酸转氨酶(AST)、超氧化物歧化酶(SOD)、谷胱甘肽(GSH)和丙二醛(MDA)试剂盒(南京建成生物技术研究所)。除非另有说明,所有其他试剂都是分析级的。
实施例1
一种多花黄精多糖PCP1的制备方法,包括以下步骤:
1)新鲜九华多花黄精根茎经清洗和除须后,切成6~8mm薄片,于60℃烘干96h,用电动粉碎机粉碎,过60目筛,获得粒径均匀的多花黄精根茎粉末;
2)称量50g多花黄精根茎粉末,加入1200mL去离子水,加热至75℃,提取2h;冷却后,8000r/min离心15min保留上清液,沉淀继续加入1200mL去离子水重复提取2h,8000r/min离心15min后,合并两次上清液,并60℃减压浓缩至200~300mL,加入无水乙醇至乙醇终体积分数为75%,于4℃冰箱内醇沉12h后,8000r/min离心20min获得多花黄精粗多糖;
3)向步骤2)制备的多花黄精粗多糖加入300mL的60℃去离子水,边加热边搅拌(复溶),至溶液澄清,沉淀物不继续溶解后,15000r/min离心15min,取上清液,用D101大孔树脂进行脱色,脱色液浓缩至原溶液体积的1/10~1/5,并经0.22μm微孔滤膜过滤后,使用Sevag试剂脱除蛋白质,经Bradford法测定后,证明蛋白质脱除干净即可,随后60℃旋转蒸发除去Sevag试剂,经0.22μm微孔滤膜除菌后,使用截留分子量为1000Da的透析袋于4℃冰箱内透析72h以除去小分子物质;最后,多糖溶液于-80℃条件下冷冻干燥72h,获初步纯化多花黄精多糖粉末。
4)纯化:称量200mg初步纯化多花黄精多糖粉末加入20~40mL去离子水溶解后,0.22μm微孔滤膜过滤后上样DEAE-52纤维素阴离子交换层析柱,使用去离子水以0.4mL/min流速进行洗脱,每10min收集一管,然后使用蒽酮-硫酸试剂检测多糖是否洗脱完全,待多糖洗脱完全后,将洗脱液于60℃下减压浓缩至原体积的1/10~1/5,再使用截留分子量1000Da透析袋于4℃冰箱透析72h,然后-80℃冷冻干燥,获得多花黄精多糖水洗组分粉末;
5)称量30mg多花黄精多糖水洗组分粉末,加入4~6mL去离子水溶解,0.22μm微孔滤膜过滤,上样Sephadex G-75凝胶色谱柱,再用去离子水进行洗脱,流速为0.38mL/min,每10min收集一管,洗脱液浓缩至原体积的1/10-1/5,再使用截留分子量1000Da透析袋于4℃冰箱内透析72h后,再经-80℃冷冻干燥72h后,获得多花黄精多糖均一组分PCP1。
对上述制备的多花黄精多糖均一组分PCP1的纯度进行检测,具体如下:
使用LC-10Avp高效凝胶渗透色谱(HPGPC)系统(日本岛津公司)检测PCP1的纯度。色谱柱:TSKgel G3000PWXL(7.8mmID×300mm,日本Tosoh Corp);检测器:RID-10A示差折光检测器;流动相:去离子水;流速:0.7mL/min;柱温:40℃;进样量:20μL。
检测实验流程:准确称取PCP1样品溶解于去离子水中配制成5mg/mL溶液,经0.22μm微孔滤膜过滤后,取20μL进样,检测PCP1的纯度。
结果:多花黄精根茎粉末经水提醇沉、脱色和除蛋白质后得到多花黄精粗多糖,产率为8.37%,蛋白质含量为0.87%(<1%);粗多糖经DEAE-52和Sephadex G-75柱分离纯化后得到多花黄精多糖均一组分PCP1,得率为5.6%。洗脱曲线如图1中A和B所示,表明PCP1是多花黄精多糖中主要且易获得的组分。HPGPC分析结果(图1中E)表明,PCP1呈现出单一的对称窄峰,保留时间为12.17min,纯度为98.68%,这表明PCP1是一种纯度高且分子量集中的均质多糖。
进一步对PCP1的绝对分子量进行测定:
采用凝胶色谱-示差-多角度激光光散射(SEC-MALLS-RI)系统测定PCP1的绝对分子量。凝胶排阻色谱柱:Ohpak SB-805HQ(300×8mm)、Ohpak SB-804HQ(300×8mm)、OhpakSB-803HQ(300×8mm)串联;示差检测器:Optilab T-rEX(美国Wyatt科技);激发光散射检测器:DAWN HELEOSⅡ(美国Wyatt科技);流动相:0.1mol/L硝酸钠溶液;流速:0.4mL/min;柱温:45℃;进样量:100μL。
实验流程:准确称量PCP1样品溶解在含有0.02% NaN
结果:如图1中C所示,经SEC-MALLS-RI系统测定,PCP1的重均分子量(Mw)和数均分子量(Mn)分别为4650Da和4420Da,且多分散指数(Mw/Mn)约为1.05,再次证明了PCP1是一种分子量集中分布的多糖。
对PCP1的红外光谱分析,具体如下:
实验流程:准确称量PCP1粉末1(±0.05)mg与分析纯溴化钾粉末混合研磨后压制成片状,在红外光谱仪(Nexus IS10 FT-IR,Thermo Nicolet,美国)上检测4000-400cm
结果:红外分析结果(图1中D)表明,3390cm
进一步对PCP1单糖组成进行分析,具体实验过程如下:
采用两种方法检测PCP1的单糖组成。
方法一:准确称量PCP1样品5(±0.05)mg,加入1mL 2M三氟乙酸(TFA)溶液于121℃下水解2h,通氮气,吹干。加入甲醇清洗,再吹干,重复甲醇清洗2-3次。加入去离子水溶解后,取5μL(51.8μg/mL)上机检测。
方法二:准确称量PCP1样品5(±0.05)mg,加入1mL 2.5M TFA溶液于60℃下水解1h,通氮气,吹干。加入甲醇清洗,再吹干,重复甲醇清洗2-3次。加入去离子水溶解后,取5μL(51.8μg/mL)上机检测。其中,标准单糖被准确称量,并配制成50μg/mL的对照品溶液,所使用的标准单糖为岩藻糖,鼠李糖,阿拉伯糖,半乳糖,葡萄糖,木糖,甘露糖,果糖,核糖,半乳糖醛酸,葡萄糖醛酸,甘露糖醛酸,古罗糖醛酸(上海阿拉丁生物技术有限公司)。
离子色谱参数设定:色谱仪:Thermo ICS5000离子色谱仪(Thermo FisherScientific,美国);色谱柱:Dionex
结果:对比标准单糖(图2中A)、常规水解(图2中B)、低温水解(图2中C)的离子色谱图可知,PCP1主要包括四种单糖,摩尔比为:果糖:葡萄糖:甘露糖:半乳糖=88.1:9.7:1.6:0.3。
PCP1的甲基化分析,具体如下:
采用气相色谱-质谱(GC-MS,7890A-5977B,美国Agilent公司)进行分析。自动进样器型号:G4567A;气相色谱仪(Agilent 7890A,美国Agilent公司),进样量为1μL,分流比为10:1,载气为高纯氦气;温度:柱温箱的初始温度为140℃保持2min,以3℃/min程序升温至230℃,保持3min。四极杆质谱仪(Agilent 5977B,美国Agilent公司),电子轰击离子源(EI)和MassHunter工作站,分析物在全扫描模式下进行检测,质量扫描范围(m/z):30-600。
实验流程:单糖组成分析结果提示PCP1是一种中性多糖,且果糖占主要成分,因此甲基化实验设计如下:准确称取2(±0.05)mg PCP1样品溶解在500μL无水DMSO中,加入1mg固体氢氧化钠,反应0.5h。加入50μL碘化甲烷溶液并反应1h,用500μL二氯甲烷萃取后将样品蒸干。加入100μL 2mol/L TFA于60℃下水解0.5h,然后将干燥的水解产物溶解在50μL2mol/L氨水中,加入50μL1mol/L硼氢化钠,25℃下反应2.5h;再加入20μL乙酸酐于100℃下反应2.5h,终止反应。最后,加入500μL二氯甲烷混匀后,离心,弃水相,重复水洗3次,取二氯甲烷相上机检测。
结果:根据图3中PCP1的GC-MS数据信号,对比部分甲基化糖醇乙酸酯(PMAAs)公共数据库,得到了如表1所示的甲基化分析结果。
表1 PCP1的甲基化结果
PCP1的核磁共振分析:
实验流程:称取20mg PCP1样品溶于0.5mL的D
结果:
HSQC光谱中存在明显的相关信号,包括δ5.34/92.21、4.72/100.27、4.68/104.36(图4E)。结合文献和HSQC谱,可以推断δ5.34/92.21、4.72/100.27、4.68/104.36分别是→6)-α-D-Glcp-(1→、→4)-β-D-Manp-(1→和β-D-Glcp-(1→残基的H-1/C-1相关信号,并依次标记为残基D、E、F。→1)-β-D-Fruf-(2→(残基A)和→1,6)-β-D-Fruf-(2→(残基B)的同时存在表明PCP1的结构很可能有侧链。残基的连接顺序可由HMBC谱确定(图4F),相关信号δ3.63/104.08(A H-1/BC-2)表明残基A的H-1与残基B的C-2相连;相关信号δ3.80/103.52(AH-1/AC-2)表明残基A的H1与残基A的C2相连;相关信号δ3.65/103.77(A H-1/C C-2)表明残基B的H-6连接在残基C的C-2上。在δ5.34/103.52处的相关信号(D H-1/AC-2)表明残基D的H-1与残基A的C-2相连。在δ4.68/78.13(E H-1/F C-4)的相关信号表明残基E的H-1与残基F的C-4相连。在δ4.11/100.27(D H-6/F C-1)处的相关信号表明残基D的H-6与残基F的C-1相连。因此,可以得推断PCP1的骨架主要是由→1)-β-D-Fruf-(2→、→1,6)-β-D-Fruf-(2→、→6)-α-D-Glcp-(1→、→4)-β-D-Manp-(1→和β-D-Glcp-(1→残基组成;侧链为β-D-Fruf-(2→残基与→1,6)-β-D-Fruf-(2→残基相连,连接位置在C-6处。
由于果糖的易分解性质,所以单糖组成和甲基化分析不能很准确的反应单糖的比例,因此我们结合NMR谱图,以判断PCP1中各糖残基的比例。在
表2 PCP1的C和H的化学位移归属(ppm)
实施例2
一种多花黄精多糖PCP1的应用,用于保健品制备或者用于治疗非酒精性脂肪肝病的药物制备,具体研究如下:
PCP1对非酒精性脂肪肝小鼠改善作用的体内研究:
1)、动物和实验设计:
动物实验程序经皖南医学院动物实验伦理委员会批准(LLSC-2021-041)。
6周龄雄性C57BL/6J小鼠购自青龙山实验动物中心(中国江苏南京)(许可证号:SCXK(Yu)2020-0005)。小鼠被饲养在一个湿度为50-55%,温度为22-25℃的恒温恒湿环境中,12h的光/暗周期,自由饮食饮水。适应性喂养1周,6只小鼠饲喂正常饲料,即正常组饮食组(ND);其余18只小鼠饲喂8周高脂饲料(1%胆固醇、8%猪油、5%蛋黄粉、10%蔗糖和76%基础饲料)以诱导小鼠NAFLD模型。造模成功后,小鼠被随机分为3组,每组6只,即高脂饮食模型组(HFD)、高脂饮食+200mg/kg PCP1组(PCP1-L)、高脂饮食+400mg/kg PCP1组(PCP1-H)。ND组和HFD组每天灌胃一次生理盐水,PCP1-L和PCP1-H组小鼠每天灌胃一次PCP1,连续给药6周。实验结束时,所有小鼠禁食12h后安乐死。收集小鼠血液,于4℃下3000r/min离心10min以获得血清,称量肝脏并储存在-80℃冰箱中。
2)PCP1对HFD造成的肝脏损伤和血脂紊乱的改善作用:
组织病理学检查:将同一部位小鼠肝脏切除后浸泡在4%多聚甲醛溶液中固定24h以上,经石蜡或OCT包埋后制成8μm切片,分别用于苏木精-伊红(H&E)和油红O染色,并在光学显微镜下观察。
血脂水平的测定:取0.3~0.6mL小鼠血清,使用商业试剂盒直接进行测定,并取3~5g小鼠肝组织于4℃条件下加入生理盐水制备匀浆液,然后使用商业试剂盒进行血脂生化指标的测定。
结果:如图6中A所示,与ND组相比,HFD小鼠肝脏出现了广泛的气球状病变,中央静脉周围的肝索分布紊乱,脂肪严重堆积。此外,HFD组小鼠的肝脏指数、ALT、AST水平明显升高,表明长期HFD损伤了小鼠肝脏(图6中B-D)。然而,与HFD组相比,400mg/kg PCP1明显减少了肝脏重量、空泡和脂肪堆积的增加,同时也减轻了肝脏损伤。对生化指标检测结果显示,与ND组相比,长期HFD导致小鼠血清中TG、TC和LDL-C水平显著增加,而HDL-C水平明显下降(图6中E-H)。然而,在PCP1治疗6周后,这一趋势被显著逆转,特别是高剂量的PCP1,这表明NAFLD小鼠的血脂异常可以被PCP1改善。
3)PCP1对小鼠口服葡萄糖耐量(OGTT)和氧化应激的改善作用:
OGTT实验操作:所有小鼠禁食不禁水10h后,采集一滴尾静脉血测量血糖水平(0min),然后灌胃50%葡萄糖溶液(2g/kg),分别在30、60、90、120min时测量小鼠血糖水平。
氧化应激生化指标的测定:取3~5g小鼠肝组织于4℃条件下加入生理盐水制备匀浆液,并使用商业试剂盒测定肝组织中GSH、MDA、SOD水平。
结果:与ND组相比,14周的HFD明显降低了小鼠肝脏中SOD和GSH活性,且增加了MDA的活性(图7中A-C),表明小鼠肝脏中发生了严重的氧化应激反应。然而,与HFD小鼠相比,PCP1-H明显增加了SOD和GSH的水平,且降低了MDA水平(P<0.05)。此外,400mg/kg PCP1也明显增强了HFD小鼠的葡萄糖调节能力(图7中D),时间-血糖曲线下面积计算结果也证实了这一点(图7中E)。上述数据表明,PCP1可改善NAFLD小鼠的氧化应激和口服糖耐量。
4)肠道菌群16S rRNA分析:
实验流程:在实验的最后三天,收集粪便并在液氮中快速冷冻。提取粪便总DNA,进行16S rRNA基因的PCR扩增。使用Qiagen凝胶提取试剂盒(美国Germantown)纯化PCR产物,并进行文库质量检查和测序。经过质量控制,每个样品获得了50,000个高质量序列,相似度高于97%的序列被归入相同的操作分类单位(OTUs)。使用QIIME平台(1.7.0版)分析了α和β多样性。
结果:图8中A所示的α多样性(Chao1、observed species、Simpson、Shannon指数)分析结果显示,PCP1-H改善了HFD小鼠细菌群落的物种丰富度和多样性。图8中B和C所示的PCoA和Venn分析表明由于饮食和PCP1的影响,三组小鼠肠道菌群彼此分离,且共享9.52%的OTUs。多样性分析结果表明,PCP1可影响NAFLD小鼠的肠道菌群结构,并从整体上改善了NAFLD小鼠肠道细菌的微生物多样性和丰富度。
其次,PCP1从不同水平改善了NAFLD小鼠肠道菌群结构的失衡。门水平研究结果显示,厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)是小鼠肠道菌群中主要的门(图9中A)。在HFD组中,厚壁菌门与拟杆菌门相对丰度的比值显著增大(图9中B),提示小鼠体内发生了严重的肥胖或脂肪增多过程。然而,PCP1显著降低了厚壁菌门与拟杆菌门相对丰度的比值,这说明PCP1具有很好的抗肥胖作用。属水平分析结果显示,与HFD组相比,PCP1-H明显增加了Bifidobacterium、Allobaculum、Ruminococcus和Adlercreutzia等属的相对丰度,减少了Lactobacillus、Bacteroides、Helicobacter等属的相对丰度(图9中C),其中,Allobaculum的相对丰度与高脂饮食导致的糖尿病病理过程呈负相关;Bifidobacterium的相对丰度在高胆固醇饮食小鼠肠道中显著降低。这表明PCP1可对特定有益细菌产生促进作用,从而帮助调节肠道菌群结构。LEfSe分析结果表明,在HFD组和PCP1-H组分别有5个和12个显著差异物种(图9中D)。总之,上述数据共同表明,PCP1可在门和属水平上显著改善NAFLD小鼠的肠道细菌组成。
5)短链脂肪酸分析:
实验流程:借助Agilent 7890A/5975C(美国Agilent公司),使用GC-MS法对小鼠粪便中短链脂肪酸进行定量。简而言之,将100mg的粪便样品与1mL的0.005mol/L氢氧化钠溶液和50μL的2-甲基丁酸混合,在4℃下反应2h。将反应混合物离心并与蒸馏水和异丙醇/吡啶溶液(3:2,V/V)混合后进行衍生化。然后用正己烷提取样品,上机进行GC-MS分析,进样量为1μL。
结果:如图9中E所示,与ND组相比,HFD组的异丁酸盐和异戊酸盐含量明显下降,而PCP1大大改善了这种下降趋势。同时,PCP1也促进了乙酸盐、丙酸盐和戊酸盐的产生。这些结果表明,PCP1可显著促进短链脂肪酸的产生,特别是异丁酸盐和异戊酸盐。
综上所述,本发明从PCH中获得了一种均质中性多糖PCP1,重均分子量为4650Da。所述多花黄精多糖包括四种单糖,摩尔比为:果糖:葡萄糖:甘露糖:半乳糖=88.1:9.7:1.6:0.3。PCP1主链主要由→1)-β-D-Fruf-(2→、→1,6)-β-D-Fruf-(2→和少量的→6)-α-D-Glcp-(1→、→4)-β-D-Manp-(1→、β-D-Glcp-(1→组成,侧链主要由β-D-Fruf-(2→连接在→1,6)-β-D-Fruf-(2→的C-6位置组成。体内研究表明,PCP1对HFD诱导的NAFLD小鼠显示出显著的保护作用,主要体现在减轻小鼠肝脏损伤,改善脂质代谢紊乱,减轻氧化应激反应,促进短链脂肪酸的产生以及改善肠道菌群的结构。因此,PCP1可以作为一种功能性食品的天然成分来开发,用于预防和治疗NAFLD。
