基于丝素蛋白的C-SF-FA柔性导电薄膜和可穿戴式伤口监测传感器及其制备方法
文献发布时间:2023-06-19 09:49:27
技术领域
本发明涉及生物材料技术领域,具体涉及一种基于丝素蛋白的C-SF-FA柔性导电薄膜和可穿戴式伤口监测传感器及其制备方法。
背景技术
皮肤是人类免疫的第一道屏障,在守护人们的健康上起着举足轻重的作用。当皮肤受到不可修复的伤害时,将会对人体的免息系统造成极大的影响。慢性伤口是一种较为常见的皮肤损伤,对于较为轻微的烧伤,皮肤会进行有序的修复,但当伤口面积过大过深时,病人自身的愈合能力将不足以修复,这将会对病人的生命造成威胁。因此,针对慢性伤口的处理与监测得到了全球各国广泛的关注。
伤口的愈合是一个连续又重叠的动态过程,整个过程包括了三个阶段:炎症期,增殖期和重塑期。炎症期主要是负责启动免疫反应来发出伤口修复的各种信号;增殖期则是根据信号进行各种关键细胞的迁移,从而使伤口闭合以及血管重建;重塑期是肌成纤维细胞和创面瘢痕逐渐形成的时期。因为整个愈合过程极为复杂,如果处理不当将会造成愈合过程的重复以及伤口感染,从而加剧了炎症反应。所以,对于伤口的监测显得尤为重要。
为了在预防伤口感染,人们已经将多种指标作为监测伤口愈合的观测目标,例如蛋白酶,湿度,温度以及血氧水平等。伤口的湿度平衡是公认的关键性因素。任何伤口的愈合都与湿度相关,干燥的环境不利于伤口的愈合,过于潮湿也会增加伤口感染的风险。所以,医护人员需要实时的对伤口湿度进行监测。现如今已经研发出一些湿度传感器,但是这类传感器存在着不少的缺点,例如生物相容性差,透气性差以及数据实时性较差等。近年来,由于各类生物材料的高速发展,使得设计一种具有优良生物相容性以及高导电性的伤口实时监控传感器成为了可能。
蚕丝是一种常见的纯天然的生物有机材料。由于其具有良好的生物相容性以及机械性能,近几年来对于蚕丝的关注越来越高。丝素蛋白(SF)在蚕丝中占了70%的比重,是最主要的蛋白质。已经有研究表明丝素蛋白不会持续性的引起炎症反应,所以它在软骨细胞培养,骨组织支架以及抗菌敷料等方面起到了巨大的作用。同时,它优异的物理性能使它不仅可以作为添加剂添加到材料中来增强材料的机械性能,还可以制作成薄膜,水凝胶以及纤维等支架。
在纳米填料中,碳纳米管(CNT)具有显著的提高纳米复合材料性能的优点,是制备高质量纳米复合材料的理想材料。碳纳米管含有里迪直径(1-100nm)和大长度(1-10μm)的石墨层,产生较大的比表面积。此外,碳纳米管的拉伸模量为1000GPa,强度为10-50GPa。此外,超导电CNT(105-106S/m)在绝缘基体中引入所需的导电性。因此,CNT具有优异的物理、力学和导电性能,是一种很有前途的填充材料。
发明内容
本发明的目的是针对上述问题,提供一种具有优异的电学和力学性能和生物相容性的基于丝素蛋白的C-SF-FA柔性导电薄膜及其制备方法。
本发明为了实现其目的,采用的技术方案是:
一种基于丝素蛋白的C-SF-FA柔性导电薄膜的制备方法,包括如下步骤:
1)将蚕茧丝脱胶,将脱胶丝干燥后溶解于盐-甲酸溶解体系,溶解后得到丝素溶液,再将得到的丝素溶液干燥得到丝素蛋白,用去离子水浸泡丝素蛋白去除盐和甲酸,干燥后得到的丝素蛋白再次溶于甲酸得到SF-FA电纺溶液;
2)将多巴胺溶于水中,加入碳纳米管后分散均匀得到DA-CNT溶液;
3)通过静电纺丝将SF-FA电纺溶液制作成柔性薄膜,在静电纺丝过程中将DA-CNT溶液分多次喷涂到薄膜上;电纺结束后将薄膜晾干得到C-SF-FA导电薄膜;
4)将DA与CNT加入到碱性溶液溶液中得到PDA-CNT溶液,将C-SF-FA导电薄膜置于PDA-CNT溶液中浸泡2~10小时,取出后用超纯水清洗后进行干燥,待薄膜干燥后将其浸泡到乙醇或甲醇溶液中45~60分钟,取出后经干燥得到C-SF-FA导电薄膜。
所述盐-甲酸溶解体系中的盐选自氯化钙、溴化锂、氯化镁中的一种或几种;优选所述盐-甲酸溶解体系中的盐的浓度为2-10wv%,甲酸的浓度为90-98wv%;
步骤4)中所述碱性溶液的pH为8~11,优选为氢氧化钠水溶液或氨水溶液。
所述DA-CNT溶液或PDA-CNT溶液中,DA的浓度为5~20mg/ml,CNT浓度为1~10mg/ml。
步骤1)中所述SF-FA电纺溶液中的丝素蛋白的质量分数为15~25%;
步骤3)中DA-CNT溶液的使用量为,每5~10ml SF-FA电纺溶液使用1ml DA-CNT溶液。
步骤1)中丝素溶液干燥得到丝素蛋白是指丝素溶液在室温干燥12~24h;
步骤1)中用去离子水浸泡丝素蛋白去除氯化钙和甲酸的浸泡时间为10~24h。
步骤1)中蚕茧丝脱胶采用浓度为0.5-2.0mol/ml的碳酸钠溶液进行脱胶;
步骤4)中所述乙醇或甲醇溶液为体积百分比75%的乙醇或甲醇水溶液。
所述步骤3)中静电纺丝工作条件为:电压为10-24KV,电纺速度为0.002-0.015ml/min,接收距离为10-15cm,温度控制在20-25℃,湿度控制在40-60%。
一种基于丝素蛋白的C-SF-FA柔性导电薄膜,是采用上述任一项所述的方法制得的。
本发明的另一目的是提供一种基于丝素蛋白的柔性可穿戴式伤口监测传感器,是采用前述的基于丝素蛋白的C-SF-FA柔性导电薄膜制成的。
上述基于丝素蛋白的柔性可穿戴式伤口监测传感器的制备方法:将前述的基于丝素蛋白的C-SF-FA柔性导电薄膜和导线组装得到所述柔性可穿戴式伤口监测传感器。
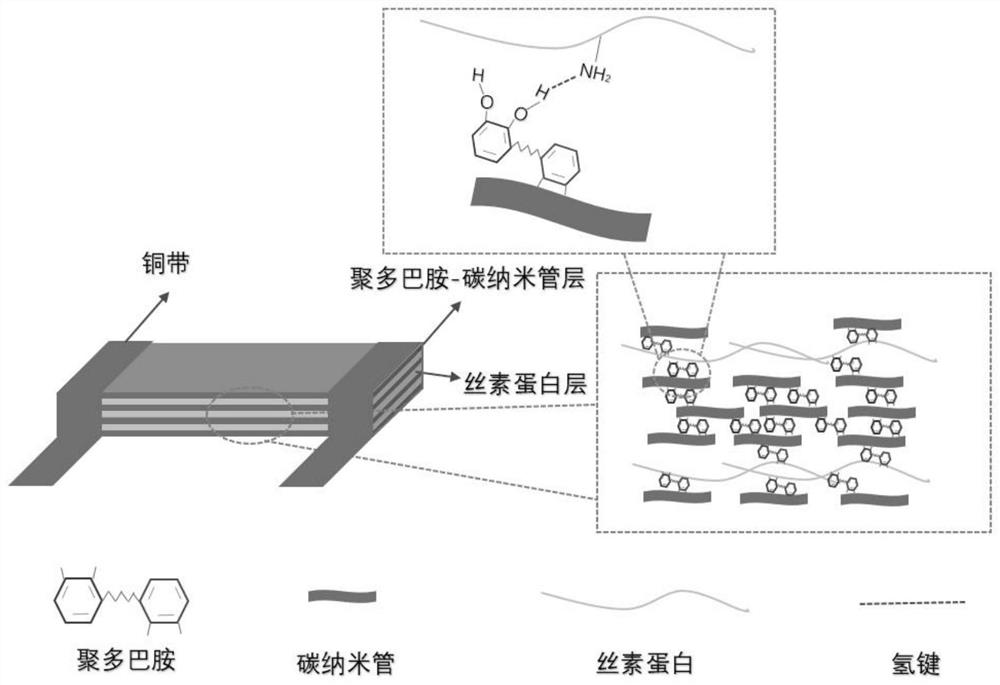
盐-甲酸体系能诱导丝素蛋白形成β-折叠,这可以增强丝素蛋白膜的机械性能,加入CNT后增强了其导电性能。通过将柔性可穿戴式传感器贴敷于伤口上,监测该传感器被组织液浸湿后电导率变化来判断伤口愈合程度变化。由于薄膜呈三维多孔网状结构,当伤口传感器接触伤口表面时,由于丝素蛋白薄膜的高溶胀性,使其在吸收伤口组织液后发生膨胀,然后电阻率发生变化。最后根据电阻率的变化可以判断伤口水环境的平衡程度,从而对伤口的愈合进行实时监控。
本发明的有益效果是:本发明使用简单的静电纺丝技术制作C-SF-FA导电薄膜,反应条件温和、操作简易;C-SF-FA柔性导电薄膜具有高度密集的网状支架结构,使其具有优异的力学性能;并且柔性薄膜内部的CNT导电夹层使其具备优异的导电性。本发明中的柔性传感器能够通过吸收伤口组织液后导致整体电导率变化来检测伤口湿度变化;使用的材料其优异的电学和力学性能和生物相容性,且检测方法具有高灵敏度,可有望应用于便携式、远程和实时健康监测系统中。
此外,本发明还具有以下显著的优点:1)高制造成本一直是困扰柔性传感器应用潜力的最大挑战。本发明在制作柔性传感器的整个过程中没有利用任何微制造技术,进一步降低了柔性传感器的制作成本。2)导电材料的均匀混合一直是一个巨大的难题,本发明使用的导电材料CNT以及喷涂法很好的解决了此问题。3)材料优良的柔韧性和生物相容性能够大大改善了组织与器件间不匹配的问题。4)制备的柔性传感器具有高灵敏度,良好的透气性以及优异的机械性能。该传感器可以对各类伤口的湿度平衡进行检测。
附图说明
图1是本发明的C-SF-FA导电薄膜的电镜扫描图。
图2是本发明的C-SF-FA导电薄膜与铜带组装成的传感器的结构原理图。
图3是应用实例1测量本发明的传感器对相同模拟体液量的响应结果,其中,(a)为电阻变化图,(b)为灵敏度变化图,(c)为C-SF-FA导电薄膜与模拟体液吸收量的拟合直线图。
图4是应用实例2测量本发明的传感器的检测重复性结果,其中,(a)为电阻变化图,(b)为灵敏度变化图,(c)为C-SF-FA导电薄膜与模拟体液吸收量的拟合直线图。
具体实施方式
下面结合实施例对本发明作进一步说明,但并不因此而限制本发明。
下述实施例中的实验方法,如无特别说明,均为常规方法。
主要试剂来源:
盐酸多巴胺(DA):CAS号62-31-7,购自生工生物工程(上海)股份有限公司;
碳纳米管(CNT):生产公司为南京吉仓纳米科技有限公司,货号:JCNT-95-50-15-W;
模拟体液:生产公司为北京酷来搏科技有限公司,货号:SL6710-500ml;
其余试剂如未表明,均未常规试剂,均可商购获得。
实施例1:
一种基于丝素蛋白的柔性可穿戴式伤口监测传感器的制备,按照以下步骤操作:
1)将家蚕茧丝用2mol/L的碳酸钠溶液煮沸脱胶,脱胶完成后洗净自然风干,风干后将其溶解于的氯化钙/甲酸(FA)溶解体系(其中,氯化钙浓度为2wv%,甲酸浓度为98wv%)溶解3h以上形成丝素溶液(SF溶液),再将得到的SF溶液在室温下干燥24h得到丝素蛋白。然后将得到的干燥的丝素蛋白放置于去离子水中浸泡10h去除多余的氯化钙和甲酸,晾干。然后将得到的丝素蛋白35℃烘干再次溶于甲酸得到丝素蛋白(SF)含量为20wv%的SF-FA电纺溶液。
2)将5mg多巴胺(DA)溶于1ml水中,加入5mg碳纳米管(CNT)后超声分散得到DA-CNT溶液。
3)通过静电纺丝将SF-FA电纺溶液制作成柔性薄膜,在静电纺丝过程中将1ml DA-CNT溶液分多次喷涂到薄膜上。静电纺丝工作条件为:电压为18KV,电纺速度为0.008ml/min,接收距离为12cm,温度控制在20-25℃,湿度控制在40-60%,电纺溶液量为8ml,电纺结束后将薄膜室温风干后得到C-SF-FA导电薄膜。
4)将50mg DA溶于10ml氢氧化钠溶液(pH为8)中,加入10mg CNT后超声分散得到PDA-CNT溶液。将C-SF-FA导电薄膜在PDA-CNT溶液中浸泡2h。取出后用超纯水清洗掉表面多余的CNT并室温干燥。待薄膜干燥后将其浸泡到75%的乙醇溶液中45min后取出,取出后待室温风干,最终得到C-SF-FA导电薄膜,其电镜扫描图如图1所示。
5)将C-SF-FA导电薄膜与铜带组装成柔性可穿戴式传感器,其结构示意图如图2所示。
实施例2:
一种基于丝素蛋白的柔性可穿戴式伤口监测传感器的制备,按照以下步骤操作:
1)将家蚕茧丝用2mol/L的碳酸钠溶液煮沸脱胶,脱胶完成后洗净自然风干,风干后将其溶解于溴化锂/甲酸(FA)溶解体系(其中,溴化锂浓度为10wv%,甲酸浓度为98wv%)溶解3h以上形成丝素溶液(SF溶液),再将得到的SF溶液在室温下干燥12h得到丝素蛋白。然后将得到的干燥的丝素蛋白放置于去离子水中浸泡10h去除多余的溴化锂和甲酸,晾干。然后将得到的丝素蛋白50℃烘干再次溶于甲酸得到丝素(SF)含量为20wv%的SF-FA电纺溶液。
2)将5mg多巴胺(DA)溶于1ml水中,加入1mg碳纳米管(CNT)后超声分散得到DA-CNT溶液。
3)通过静电纺丝将SF-FA电纺溶液制作成柔性薄膜,在静电纺丝过程中将1ml DA-CNT溶液分多次喷涂到薄膜上。电压为24KV,电纺速度为0.015ml/min,接收距离为15cm,温度控制在20-25℃,湿度控制在40-60%,电纺溶液量为10ml,电纺结束后将薄膜室温风干后得到C-SF-FA导电薄膜。
4)将200mgDA溶于10ml氨水溶液(pH为11)中,加入100mgCNT后超声分散得到PDA-CNT溶液。将C-SF-FA导电薄膜在PDA-CNT溶液中浸泡4h。取出后用超纯水清洗掉表面多余的CNT并室温干燥。待薄膜干燥后将其浸泡到75%的甲醇溶液中45min后取出,取出后待室温风干,最终得到C-SF-FA导电薄膜。
5)将C-SF-FA导电薄膜与铜带组装成柔性可穿戴式传感器。
实施例3:
一种基于丝素蛋白的柔性可穿戴式伤口监测传感器的制备,按照以下步骤操作:
1)将家蚕茧丝用2mol/L的碳酸钠溶液煮沸脱胶,脱胶完成后洗净自然风干,风干后将其溶解于的氯化钙/甲酸(FA)溶解体系(其中,氯化钙浓度为5wv%,甲酸浓度为98wv%)溶解3h以上形成丝素溶液(SF溶液),再将得到的SF溶液在室温下干燥24h得到丝素蛋白。然后将得到的干燥的丝素蛋白放置于去离子水中浸泡10h去除多余的氯化钙和甲酸,晾干。然后将得到的丝素蛋白45℃烘干再次溶于甲酸得到丝素(SF)含量为20wv%的SF-FA电纺溶液。
2)将20mg多巴胺(DA)溶于1ml水中,加入10mg碳纳米管(CNT)后超声分散得到DA-CNT溶液。
3)通过静电纺丝将SF-FA电纺溶液制作成柔性薄膜,在静电纺丝过程中将1ml DA-CNT溶液分多次喷涂到薄膜上。电压为18KV,电纺速度为0.008ml/min,接收距离为12cm,温度控制在20-25℃,湿度控制在40-60%,电纺溶液量为8ml,电纺结束后将薄膜室温风干后得到C-SF-FA导电薄膜。
4)将50mgDA溶于10ml氢氧化钠溶液(pH为10)中,加入10mgCNT后超声分散得到PDA-CNT溶液。将C-SF-FA导电薄膜在PDA-CNT溶液中浸泡2h。取出后用超纯水清洗掉表面多余的CNT并室温干燥。待薄膜干燥后将其浸泡到75%的乙醇溶液中45min后取出,取出后待室温风干,最终得到C-SF-FA导电薄膜。
5)将C-SF-FA导电薄膜与铜带组装成柔性可穿戴式传感器。
实施例4应用实例
应用实例1.柔性可穿戴式伤口监测传感器用于测量传感器对相同模拟体液量的响应:
将实施例1制得的C-SF-FA导电薄膜两端用铜带包裹,然后与电化学工作站连接测试C-SF-FA导电薄膜的电阻变化。用模拟体液代替人体伤口渗液,分别以5、10、15、20、25μl滴加到C-SF-FA导电薄膜。试验结果如图3所示,随着不同量模拟体液的滴入,C-SF-FA导电薄膜中的导电通路增加,电阻下降。并且由于模拟体液的滴加量不同,C-SF-FA导电薄膜的电阻变化呈线性变化,说明C-SF-FA导电薄膜可以测试伤口的湿度信号。
应用实例2.柔性可穿戴式伤口监测传感器用于测量传感器的重复性:
将实施例1制得的C-SF-FA导电薄膜两端用铜带包裹,然后与电化学工作站连接测试C-SF-FA导电薄膜的电阻变化。用模拟体液代替人体伤口渗液以10μl滴加到C-SF-FA导电薄膜,重复5次。试验结果如图4所示,结果表明,随着相同量模拟体液的滴入,C-SF-FA显示出了良好的重复性。
- 基于丝素蛋白的C-SF-FA柔性导电薄膜和可穿戴式伤口监测传感器及其制备方法
- 一种基于丝素蛋白的柔性透明电极薄膜及其制备方法和应用
