作为佐剂的溶瘤病毒
文献发布时间:2023-06-19 09:57:26
技术领域
本发明公开涉及用于增强免疫应答的佐剂。更具体地,本发明公开涉及作为佐剂的溶瘤病毒。
背景技术
病原体和疾病细胞包含可以通过免疫系统检测和靶向的抗原,因此提供了基于免疫的疗法的基础,其包括免疫原性疫苗和免疫疗法。在癌症治疗的背景中,例如,免疫疗法基于以下事实:癌细胞通常在它们的细胞表面上具有可以识别和靶向的分子。
部分出于它们直接杀死疾病细胞的能力,还已在癌症疗法中使用了病毒。例如,溶瘤病毒(OVs)特异性感染恶性细胞,在所述细胞中复制并杀死所述细胞,从而留下不受影响的正常组织。几种OVs已达到用于治疗多种赘生物的临床评价的晚期阶段(Russell SJ.等人,(2012)Nat Biotechnol 30:658-670)。除水泡性口膜炎病毒(VSV)之外(Stojdl DF.等人,(2000)Nat Med 6:821-825;Stojdl DF.等人,(2003)Cancer Cell4:263-275),最近已描述了显示出溶瘤活性的其它弹状病毒(Brun J.等人,(2010)Mol Ther 18:1440-1449;Mahoney DJ.等人,(2011)Cancer Cell 20:443-456)。其中,非VSV马拉巴病毒显示出最广泛的体外肿瘤趋性(WO 2009/016433)。工程设计了具有改善的肿瘤选择性和在正常细胞中具有低毒力的突变体马拉巴病毒。减毒株是含有G蛋白(Q242R)和M蛋白(L123W)突变两者的双重突变株。体内,称为MG1或马拉巴MG1的这种减毒株在小鼠中的异种移植和同基因肿瘤模型中显示出有效的抗-肿瘤活性,其具有优于减毒VSV,VSVΔM51(WO 2011/070440)的治疗效力。
已发展了多种策略来改善OV-引起的抗-肿瘤免疫性(Pol J.等人,(2012)VirusAdaptation and Treatment 4:1-21)。这些策略利用了OV本身的溶瘤活性和对肿瘤-相关抗原产生免疫性的能力两者。定义为溶瘤疫苗的一种策略包括从OV表达肿瘤抗原(RussellSJ.等人,(2012)Nat Biotechnol 30:658-670)。先前,已表明VSV也可以用作癌症疫苗载体(Bridle BW.等人,(2010)Mol Ther 184:4269-4275)。当在治疗鼠科黑素瘤模型的异源初免:加强免疫环境中应用时,VSV-人多巴色素互变异构酶(hDCT)溶瘤疫苗不仅引起对DCT的高肿瘤-特异性免疫,而且还引起了相伴的降低的抗病毒适应性免疫。因此,通过中值和长期存活两者的升高,显著改善了治疗效力(WO2010/105347)。在PCT专利申请No.PCT/CA2014/050118中公开了三种具体的初免:加强免疫组合疗法。组合疗法包括编码抗原:人乳头状瘤病毒(HPV)E6/E7融合蛋白、人前列腺6次跨膜上皮抗原(huSTEAP)蛋白或者癌症睾丸抗原1的慢病毒;和编码相同抗原的马拉巴MG1病毒。PCT专利申请No.PCT/CA2014/050118也公开了使用编码MAGEA3作为抗原的腺病毒和编码相同抗原的马拉巴MG1病毒的初免:加强免疫组合疗法。PCT专利申请No.PCT/IB2017/000622公开了包括感染、复制和杀死恶性细胞的溶瘤病毒的组合初免:加强免疫疗法。工程设计病毒以编码和表达基于肿瘤相关抗原的抗原性蛋白。抗原性蛋白(i)产生免疫性和(ii)引起获得治疗效果的免疫应答。
将期望提供更容易适合于靶标和/或对个体敏感的疗法。
发明简述
以下发明简述旨在向读者介绍本文所述的一种或多种发明,而不是限制它们中的任一种。
本发明公开的目标在于避免或降低先前方法的至少一种缺点。
意外地发现溶瘤病毒可以用作佐剂。本发明公开的作者发现施用于哺乳动物的溶瘤病毒可以辅佐对所施用的非所述病毒所编码的抗原性蛋白的免疫应答。因此,根据本发明公开的疗法不需要病毒-编码的抗原。在初免:加强免疫疗法的背景中,例如,初免、加强免疫或两者可以包括病毒和单独的非病毒编码的抗原性蛋白。这些结果是意外的,因为先前认为编码抗原的病毒表达对于对所述抗原性蛋白的免疫应答的刺激是重要的。由于不需要修饰编码抗原性蛋白的溶瘤病毒,因此疗法可以更适合于不同的靶标,例如,使用合成肽。它们可以更易于个体化,例如,以靶向给定肿瘤的肿瘤-相关抗原。
在一个方面,提供了用于在哺乳动物对象中引起免疫应答的组合初免:加强免疫疗法,其中:所述初免包括至少一种抗原性蛋白,其配制以在所述哺乳动物中产生免疫应答;并且所述加强免疫包括病毒和至少一种抗原性蛋白,其配制以在所述哺乳动物中引起免疫应答;其中所述初免的至少一种抗原性蛋白和所述加强免疫的至少一种抗原性蛋白基于相同的至少一种肿瘤相关抗原,并且其中所述加强免疫的至少一种抗原性蛋白不被所述加强免疫的病毒所编码。
在一个方面,在组合初免:加强免疫治疗中提供了用于在哺乳动物对象中引起免疫应答的包含初免或加强免疫的组合物,其中:所述初免包括至少一种抗原性蛋白,其配制以在所述哺乳动物中产生免疫应答;并且所述加强免疫包括病毒和至少一种抗原性蛋白,其配制以在所述哺乳动物中引起免疫应答;其中所述初免的至少一种抗原性蛋白和所述加强免疫的至少一种抗原性蛋白基于相同的至少一种肿瘤相关抗原,并且其中所述加强免疫的至少一种抗原性蛋白不被所述加强免疫的病毒所编码。
在一个方面,在组合初免:加强免疫治疗中提供了用于在哺乳动物对象中引起免疫应答的包含初免的组合物,其中:所述初免包括至少一种抗原性蛋白,其配制以在所述哺乳动物中产生免疫应答;并且所述加强免疫包括病毒和至少一种抗原性蛋白,其配制以在所述哺乳动物中引起免疫应答;其中所述初免的至少一种抗原性蛋白和所述加强免疫的至少一种抗原性蛋白基于相同的至少一种肿瘤相关抗原,并且其中所述加强免疫的至少一种抗原性蛋白不被所述加强免疫的病毒所编码。
在一个方面,在组合初免:加强免疫治疗中提供了用于在哺乳动物对象中引起免疫应答的包含加强免疫的组合物,其中:所述初免包括至少一种抗原性蛋白,其配制以在所述哺乳动物中产生免疫应答;并且所述加强免疫包括病毒和至少一种抗原性蛋白,其配制以在所述哺乳动物中引起免疫应答;其中所述初免的至少一种抗原性蛋白和所述加强免疫的至少一种抗原性蛋白基于相同的至少一种肿瘤相关抗原,并且其中所述加强免疫的至少一种抗原性蛋白不被所述加强免疫的病毒所编码。
在另一个方面,提供了用于在哺乳动物对象中引起免疫应答的试剂盒,其中所述试剂盒包含:包括至少一种抗原性蛋白的初免,所述抗原性蛋白配制以在所述哺乳动物中产生免疫应答;和包括病毒和至少一种抗原性蛋白的加强免疫,所述抗原性蛋白配制以在所述哺乳动物中引起免疫应答;其中所述初免的至少一种抗原性蛋白和所述加强免疫的至少一种抗原性蛋白基于相同的至少一种肿瘤相关抗原,并且其中所述加强免疫的至少一种抗原性蛋白不被所述加强免疫的病毒所编码。
在另一个方面,提供了本文所述的组合初免:加强免疫疗法用于治疗哺乳动物对象中的肿瘤的使用。
在另一个方面,提供了用于在哺乳动物对象中肿瘤的治疗中使用的本文所述的组合初免:加强免疫疗法。
在另一个方面,提供了治疗哺乳动物对象中肿瘤的方法,所述方法包括向所述对象施用本文所述的组合初免:加强免疫疗法。
在另一个方面,提供了用于产生本文所述的组合初免:加强免疫疗法的方法,所述方法包括:合成所述加强免疫的至少一种抗原性蛋白和产生所述组合初免:加强免疫疗法。
在另一个方面,提供了用于产生本文所述的组合初免:加强免疫疗法的方法,所述方法包括:合成所述初免的至少一种抗原性蛋白和产生所述组合初免:加强免疫疗法。
在另一个方面,提供了溶瘤病毒和至少一种抗原性蛋白用于引起哺乳动物对象中免疫应答的使用,其中所述至少一种抗原性蛋白不是溶瘤病毒所编码的。
在另一个方面,提供了溶瘤病毒用于辅佐对哺乳动物对象中至少一种抗原性蛋白的免疫应答的使用,其中所述至少一种抗原性蛋白不是溶瘤病毒所编码的。
在另一个方面,提供了辅佐对哺乳动物对象中至少一种抗原性蛋白的免疫应答的方法,所述方法包括向所述对象施用溶瘤病毒和所述至少一种抗原性蛋白,其中所述至少一种抗原性蛋白不是所述病毒所编码的。
在另一个方面,提供了包含溶瘤病毒和至少一种抗原性蛋白的免疫原性组合物,其中所述至少一种抗原性蛋白不是所述溶瘤病毒所编码的。
通过结合附图阅读以下具体实施方式的描述,本发明公开的其它方面和特征将对于本领域普通技术人员变得显而易见。
附图说明
现将仅通过举例,参考附图,描述本发明公开的实施方式。
图1显示了在实验中使用的处理程序的示意图。
图2显示了在第21天从用表达DCT肽的腺病毒(Ad)(称为“Ad-DCT”)初免并且用表达DCT肽的马拉巴病毒MG1(称为“MRB-DCT”,其中“-”表示病毒编码)或与DCT肽共施用的MRB(称为“MRB+DCT”,其中“+”表示非病毒编码或非病毒的一部分的肽的共施用)加强的小鼠收获的脾细胞的IFNγELISPOT分析。
图3显示单独的Ad-DCT引起了对DCT的免疫应答(左侧第二组),其通过MRB+DCT加强至与MRB-DCT相当的水平(最后一组)。
图4显示了与图3中相同的实验的流式细胞分析。
图5显示了在第21天从用Ad-DCT初免并且使用不同途径—静脉内(IV)、肿瘤内(IT)或肌内(IM)用与DCT肽共施用的MRB加强的小鼠收获的脾细胞的IFNγELISPOT分析。
图6显示了在第21天从用Ad-DCT初免并且用与DCT肽共施用的MRB或UV-灭活的MRB(UVMRB)加强的小鼠收获的脾细胞的IFNγELISPOT分析。
图7显示了在第21天从用Ad-DCT初免并且用与DCT肽共施用的VV、VSV或MV加强的小鼠收获的脾细胞的IFNγELISPOT分析。
图8显示了在第14天从用Ad-DCT或与DCT肽共施用的Ad或多聚I:C(均为IM)初免的小鼠收获的脾细胞的IFNγELISPOT分析。
图9显示了在第21天从用Ad-DCT初免和用与DCT肽共施用的MRB-DCT或MRB加强的小鼠收获的脾细胞的IFNγELISPOT分析。
图10显示了在第14天从用MRB、MRB-Ova或与Ova肽共施用的MRB初免的小鼠收获的脾细胞的IFNγELISPOT分析。
图11显示了在第21天从用与DCT肽一起或不一起的Ad-Ova初免并且用与DCT肽一起或不一起的MRB-Ova加强的小鼠收获的脾细胞的IFNγELISPOT分析。
图12显示了在第7和14天用多聚I:C和所指明的肽IM处理的具有确立的皮下B16F10-Ova肿瘤的小鼠的结果。
图13显示了在第7和14天用多聚I:C和所指明的肽IM处理的具有确立的皮下CT26肿瘤的小鼠的结果。
图14显示了在第14天从用多聚I:C或与DCT肽一起的MRB(SC和IV)初免的小鼠收获的脾细胞的IFNγELISPOT分析。
图15显示了在第14天从用多聚I:C(SC)或与所指明的B16Mut肽一起的MRB(IV)初免的小鼠收获的脾细胞的IFNγELISPOT分析。
图16显示MRB可以用作佐剂以用于免疫初免或加强免疫,但不能用于两者。它显示了在第21天从用Ad-DCT或与DCT肽一起的MRB初免并且用与DCT肽共施用的MRB加强的小鼠收获的脾细胞的IFNγELISPOT分析的结果。
图17显示当与肽一起IM或SC施用时,多聚I:C引起了更强的免疫应答。它显示了在第14天从按照不同途径(IP、IV、IM或SC),用与DCT肽共施用的多聚I:C初免的小鼠收获的脾细胞的IFNγELISPOT分析的结果。
图18显示了在第21天从用Ad-DCT或与DCT肽共施用的Ad或Ad-Ova或与Ova肽共施用的Ad初免(第7天)并且用MRB-DCT或与DCT肽共施用的MRB或MRB-Ova或与Ova肽共施用的MRB加强(第14天)的小鼠收获的脾细胞的IFNγELISPOT分析的结果。
图19显示了用Ad或与DCT肽共施用的Ad初免(第7天)并且用MRB或与DCT肽共施用的MRB加强(第14天)的小鼠的存活分析。
图20显示用Ad或与突变组肽(B16Mut20、B16Mut30、B16Mut44和B16Mut48)一起的Ad初免(第7天)并且用MRB或与突变组肽(B16Mut20、B16Mut30、B16Mut44和B16Mut48)共施用的MRB加强(第14天)的小鼠的存活分析。
图21显示了用Ad或与突变组肽(CT26Mut20、CT26Mut27和CT26Mut37)一起的Ad初免(第7天)并且用MRB或与突变组肽(CT26Mut20、CT26Mut27和CT26Mut37)共施用的MRB加强(第14天)的小鼠的肿瘤生长分析。
图22显示了图21中的实验的存活分析。它显示了用Ad或与突变组肽(CT26Mut20、CT26Mut27和CT26Mut37)一起的Ad初免(第7天)并且用MRB或与突变组肽(CT26Mut20、CT26Mut27和CT26Mut37)共施用的MRB加强(第14天)的小鼠的存活。
图23显示用Ad-Ova或与突变组肽(B16Mut20、B16Mut30、B16Mut44和B16Mut48)一起的Ad-Ova初免(第7天)并且用MRB-Ova或与突变组肽(B16Mut20、B16Mut30、B16Mut44和B16Mut48)共施用的MRB-Ova加强(第14天)的小鼠的肿瘤生长分析。
图24显示了图23中的实验的存活分析。它显示用Ad-Ova或与突变组肽(B16Mut20、B16Mut30、B16Mut44和B16Mut48)一起的Ad-Ova初免(第7天)并且用MRB-Ova或与突变组肽(B16Mut20、B16Mut30、B16Mut44和B16Mut48)共施用的MRB-Ova加强(第14天)的小鼠的存活。
发明详述
本发明公开提供了用作免疫佐剂的溶瘤病毒。通常,溶瘤病毒能够辅佐对非所述病毒所编码的抗原性蛋白的免疫应答。在初免:加强免疫疗法的背景中,(1)所述初免包含抗原性蛋白,和(2)所述加强免疫包含病毒和抗原性蛋白,所述抗原性蛋白不是所述病毒所编码的,其中所述初免的抗原性蛋白和所述加强免疫的抗原性蛋白基于相同抗原。事实上,所述病毒不编码所述抗原性蛋白意味着治疗方法可以容易地改变,可以容易地个体化或者可以容易地配制所述疗法。
在一个方面,提供了用于在哺乳动物对象中引起免疫应答的组合初免:加强免疫疗法,其中:所述初免包括至少一种抗原性蛋白,其配制以在所述哺乳动物中产生免疫应答;并且所述加强免疫包括病毒和至少一种抗原性蛋白,其配制以在所述哺乳动物中引起免疫应答;其中所述初免的至少一种抗原性蛋白和所述加强免疫的至少一种抗原性蛋白基于相同的至少一种肿瘤相关抗原,并且其中所述加强免疫的至少一种抗原性蛋白不被所述加强免疫的病毒所编码。
在本发明公开的背景中,“组合初免:加强免疫疗法”应理解为表示以下疗法:将作为初免:加强免疫治疗施用(1)所述初免的至少一种抗原性蛋白和(2)所述加强免疫的病毒和至少一种抗原性蛋白。初免和加强免疫不需要物理提供或包装在一起,因为将首先施用初免,并且仅在哺乳动物中已产生免疫应答后再施用加强免疫。在一些实例中,可以向医学机构,如医院或医务室以初免包装(或多个包装)和加强免疫包装(或多个包装)的形式提供所述组合。可以在不同时间提供所述包装。在其它实例中,向医学机构,如医院或医务室以包含初免和加强免疫两者的包装的形式提供所述组合。组合初免:加强免疫疗法也可以称为组合初免:加强免疫疫苗。
如本文所使用的术语“哺乳动物”是指人和非人哺乳动物。在一个实施方式中,所述哺乳动物可以是人。
术语“抗原性蛋白”表示包含能够引起生物学上明显的免疫应答的免疫原性(抗原性)序列的任何的肽。
“肿瘤相关抗原”表示与肿瘤细胞相关的并且在健康细胞或者相应健康细胞(基于应用和要求)中不存在或丰度较低的任何免疫原。例如,在生物背景中,所述肿瘤相关抗原对肿瘤细胞可以是唯一的。
如本文所使用的,“非所述病毒所编码的”表示所述加强免疫的至少一种抗原性蛋白不是通过所述加强免疫的病毒的核酸序列的转录和翻译产生的。当所述术语属于其中初免包括病毒且所述初免的至少一种抗原性蛋白不是通过所述初免的病毒编码的实施方式中的初免时,同样适用。可以理解的是,在任何情况下这都不阻碍病毒被修饰或工程设计。在某些实施方式中,所述抗原性蛋白不是病毒颗粒的一部分。在某些实施方式中,所述抗原性蛋白未连接、缀合或另外物理连接至病毒颗粒。这表示在抗原性蛋白和病毒颗粒之间不存在共价键。在一些实施方式中,所述抗原性蛋白未与病毒颗粒物理结合。在该背景中,物理结合表示非共价相互作用。
“基于相同的至少一种肿瘤相关抗原”表示设计或选择所述初免的至少一种抗原性蛋白和所述加强免疫的至少一种抗原性蛋白,从而它们分别包含引起对相同肿瘤相关抗原的免疫反应的序列。将理解为了实现该目标,所述初免的至少一种抗原性蛋白和所述加强免疫的至少一种抗原性蛋白不需要完全相同。例如,它们可以是肽,所述肽包含部分重叠的序列,其中重叠节段包含对应于肿瘤相关抗原的序列,或者设计以引起对所述肿瘤相关抗原的免疫反应的序列,借此使得能够实现对相同抗原的有效初免和加强免疫。然而,在一个实施方式中,所述初免的至少一种抗原性蛋白和所述加强免疫的至少一种抗原性蛋白是相同的。
在一个实施方式中,所述至少一种肿瘤相关抗原基于哺乳动物对象的肿瘤的突变组。
“突变组”表示单个哺乳动物的肿瘤-特异性变化和突变的集合,其编码了对对象特异的一组抗原。这些不同于“共有”抗原,其在来自多位患者的肿瘤中表达并且通常是正常、非突变的自体蛋白。由于对它们缺少胸腺耐受性,因此突变组-编码的肽可以引起更强烈的T细胞应答,并且这种免疫性可以受限于肿瘤,因为突变基因产物仅在肿瘤中表达(Overwijk等人:Mining the mutanome:developing highly personalizedImmunotherapies based on mutational analysis of tumours.Journal forImmunoTherapy of Cancer 2013 1:11)。可以容易地确定给定肿瘤的突变组,例如,通过下一代测序。
在一个实施方式中,所述初免的至少一种抗原性蛋白包含多种抗原性蛋白,并且所述加强免疫的至少一种抗原性蛋白包含多种抗原性蛋白,所述抗原性蛋白中的每一种不被所述加强免疫的病毒编码,并且所述初免的多种抗原性蛋白和所述加强免疫的多种抗原性蛋白基于相同的多种肿瘤相关抗原。
将“基于相同多种肿瘤相关抗原”理解为对于多种肿瘤相关抗原中的每一种,对于所述肿瘤相关抗原,在初免中将存在至少一种抗原性蛋白并且在加强免疫中将存在至少一种抗原性蛋白,从而所靶向的每种肿瘤相关抗原将具有至少一个相应的初免/加强免疫抗原性蛋白对。如上,将理解所述初免的多种抗原性蛋白和所述加强免疫的多种抗原性蛋白不需要是相同的,并且来自所述初免和加强免疫的一对抗原性蛋白可以引起对相同肿瘤相关抗原的免疫应答,而它们不是完全相同的。例如,所述抗原性蛋白对可以是部分重叠的,其具有包含对应于肿瘤相关抗原的序列或者设计以引起对肿瘤相关抗原的免疫应答的序列的重叠节段。然而,在一个实施方式中,所述初免的多种抗原性蛋白和所述加强免疫的多种抗原性蛋白是相同的。
在一个实施方式中,所述多种肿瘤相关抗原基于哺乳动物对象的肿瘤的突变组。
在一个实施方式中,所述加强免疫的病毒为溶瘤病毒。
“溶瘤病毒”是指当具有活性时,已显示出体外或体内复制和杀死肿瘤细胞的任何一种病毒。这些病毒可以是天然溶瘤病毒,或者已修饰以产生或改善溶瘤活性的病毒。如本文所使用的,在某些实施方式中,该术语可以涵盖适合于目的的溶瘤病毒的减毒、复制缺陷型、失活、工程或其它修饰形式。因此,在一些实施方式中,将理解出于描述的目的,所谓的“溶瘤病毒”实际上可以不保留溶瘤活性。在其中不期望施用活性或“活”病毒的背景中,非活性病毒的使用可以是所期望的。
在一个实施方式中,所述加强免疫的病毒为弹状病毒。
“弹状病毒”具体地包括以下病毒中的一种或多种或其变体:卡拉加斯病毒、金迪普拉病毒、科卡尔病毒、伊斯法罕病毒、帛黎病毒、阿拉戈斯水泡性口炎病毒、BeAn157575病毒、博特克病毒、卡尔查基病毒、美洲鳗病毒、格雷洛奇病毒、朱罗纳病毒、克拉马斯病毒、克瓦塔病毒、拉霍亚病毒、马尔佩斯泉病毒、芒特埃尔岗蝙蝠病毒、佩里内特病毒、图帕伊阿病毒、法明顿病毒、大巴伊亚病毒、Muir泉病毒、Reed Ranch病毒、哈特公园病毒、弗朗德病毒、Kamese病毒、Mosqueiro病毒、Mossuril病毒、Barur病毒、福冈病毒、克恩峡谷病毒、Nkolbisson病毒、勒当泰克氏病毒、Keuraliba病毒、康涅狄格病毒、新明托病毒、沙草病毒、Chaco病毒、Sena Madureira病毒、Timbo病毒、阿尔姆皮瓦病毒、阿鲁卡病毒、邦戈兰病毒、宾博病毒、毕文斯阿姆病毒、蓝蟹病毒、沙勒维尔病毒、Coastal Plain病毒、DakArK 7292病毒、阿米巴病毒、Garba病毒、Gossas病毒、Humpty Doo病毒、约英杰卡卡病毒、肯纳曼格拉姆病毒、科隆各病毒、库尔平耶病毒、科通考讷病毒、兰德几亚病毒、马尼托巴病毒、马可病毒、Nasoule病毒、Navarro病毒、Ngaingan病毒、奥克韦尔病毒、奥博德希延病毒、大分市病毒、万戈病毒、帕里河病毒、里奥格兰德鲷病毒、圣德吉姆巴病毒、西格马病毒、斯里布尔病毒、斯威特沃特科病毒、蒂布鲁加尔冈病毒、西布尔玛病毒、亚塔病毒、Rhode Island,AdelaideRiver病毒、贝里马病毒、金伯利病毒或牛暂时热病毒。在某些方面,弹状病毒可以是指双感染弹状病毒(Dimarhabdovirus,其被定义为能够感染昆虫细胞和哺乳动物细胞两者的弹状病毒)的超群。
在一个实施方式中,所述弹状病毒为马拉巴病毒或其工程变体。
将“工程变体”理解为已基因修饰的病毒,例如,通过DNA重组技术基因修饰的病毒。这些病毒可以包括(例如)相对于野生型病毒的突变、插入、缺失或重排。
在一个实施方式中,所述加强免疫的病毒是减毒的。
“减毒”病毒是毒力降低,但仍活着(或“活”)的病毒。
在一个实施方式中,所述加强免疫的病毒是复制缺陷型的。
在一个实施方式中,所述减毒病毒是包含其中氨基酸242突变的马拉巴G蛋白和其中氨基酸123突变的马拉巴M蛋白的减毒马拉巴病毒。在一个实施方式中,G蛋白的氨基酸242为精氨酸(Q242R),M蛋白的氨基酸123为色氨酸(L123W)。在PCT专利申请No.PCT/IB2010/003396中描述了马拉巴M蛋白的实例,以上专利申请作为参考并入本文,其中将其称为SEQ ID NO:4。在PCT专利申请No.PCT/IB2010/003396中描述了马拉巴G蛋白的实例,其中将其称为SEQ ID NO:5。在一个实施方式中,所述加强免疫的病毒为PCT专利申请No.PCT/IB2010/003396中所述的马拉巴双重突变型(“Maraba DM”)。在一个实施方式中,所述加强免疫的病毒为PCT专利申请No.PCT/CA2014/050118中所述的“Maraba MG1”,以上专利申请作为参考并入本文。
在一个实施方式中,所述加强免疫的病毒为腺病毒、牛痘病毒、麻疹病毒或者水泡性口膜炎病毒
在一个实施方式中,所述加强免疫的病毒为腺病毒、牛痘病毒或者水泡性口膜炎病毒
在一个实施方式中,将所述加强免疫配制用于静脉内、肌内或肿瘤内施用。
在一个实施方式中,将所述初免配制用于静脉内、肌内或肿瘤内施用。
在一个实施方式中,所述加强免疫的病毒是失活的。在一个实施方式中,所述加强免疫的病毒是UV-灭活的。
在一个实施方式中,所述初免还包含非病毒免疫佐剂。
将“免疫佐剂”理解为加强免疫对抗原的免疫应答和/或将它向所期望的免疫应答调节的分子。一个实例为多聚I:C。
在一个实施方式中,所述初免还包括病毒,其中所述初免的病毒与所述加强免疫的病毒是免疫原性相异的。
将“免疫原性相异的”理解为病毒不产生彼此交叉反应的抗血清。免疫原性相异的病毒在初免和加强免疫中的使用使得能够对初免和加强免疫共同靶向的靶标抗原进行有效的初免/加强免疫应答。所述初免的病毒可以是所述加强免疫的病毒的上述选择中的任一种,只要所述初免和加强免疫的病毒是免疫原性相异的。
在一个实施方式中,所述初免的病毒为腺病毒。所述初免的病毒可以是肿瘤选择性的。例如,所述初免的腺病毒可以包含E1和E3中的缺失,从而使得所述病毒对p53失活敏感。由于多种肿瘤缺少p53,因此这种修饰有效地使所述病毒是肿瘤-特异的,并因此是溶瘤的。在一个实施方式中,所述腺病毒具有血清5型。
所述初免的病毒可以编码所述初免的至少一种抗原性蛋白。当在所述初免中使用多个抗原性蛋白时,可以通过所述初免的病毒编码它们中的一些或全部。例如,所述初免的病毒可以包括多种病毒类型,每种类型工程设计以编码抗原性蛋白之一。然而,在一个实施方式中,所述初免的至少一种抗原性蛋白不是通过所述初免的病毒所编码的。当使用多种抗原性蛋白时,在一个实施方式中,它们均不是通过所述初免的病毒所编码的。
在一个实施方式中,所述初免的病毒可以是减毒的。在一个实施方式中,其中所述初免的病毒是失活的。在一个实施方式中,所述初免的病毒是UV灭活的。
在一个实施方式中,所述初免的至少一种抗原性蛋白包含合成肽。在一个实施方式中,所述初免的合成肽是合成的长肽(SLP)。所述初免的至少一种抗原性蛋白的长度可以为8至250个氨基酸。在该范围内,它的长度可以为至少10,至少20,至少30,至少40或至少50个氨基酸。对于所有这些适用的范围,长度可以是小于200,小于150,小于125,小于100,小于75,小于50,小于40或小于30个氨基酸。可以是所述上下限的任何组合。
在一个实施方式中,所述加强免疫的至少一种抗原性蛋白包含合成肽。在一个实施方式中,所述加强免疫的合成肽是合成的长肽(SLP)。所述加强免疫的至少一种抗原性蛋白的长度可以为8至250个氨基酸。在该范围内,它的长度可以为至少10,至少20,至少30,至少40或至少50个氨基酸。对于所有这些适用的范围,长度可以是小于200,小于150,小于125,小于100,小于75,小于50,小于40或小于30个氨基酸。可以是所述上下限的任何组合。
所述组合初免:加强免疫疗法还可以包含免疫-加强免疫化合物,如环磷酰胺(CPA),其提高了哺乳动物中通过施用第一病毒所产生的对肿瘤相关抗原性蛋白的初免免疫应答。环磷酰胺是可以导致对肿瘤相关抗原性蛋白的免疫应答提高的化疗剂。
在一个方面,在组合初免:加强免疫治疗中提供了用于在哺乳动物对象中引起免疫应答的包含初免或加强免疫的组合物,其中:所述初免包括至少一种抗原性蛋白,其配制以在所述哺乳动物中产生免疫应答;并且所述加强免疫包括病毒和至少一种抗原性蛋白,其配制以在所述哺乳动物中引起免疫应答;其中所述初免的至少一种抗原性蛋白和所述加强免疫的至少一种抗原性蛋白基于相同的至少一种肿瘤相关抗原,并且其中所述加强免疫的至少一种抗原性蛋白不被所述加强免疫的病毒所编码。
在一个方面,在组合初免:加强免疫治疗中提供了用于在哺乳动物对象中引起免疫应答的包含初免的组合物,其中:所述初免包括至少一种抗原性蛋白,其配制以在所述哺乳动物中产生免疫应答;并且所述加强免疫包括病毒和至少一种抗原性蛋白,其配制以在所述哺乳动物中引起免疫应答;其中所述初免的至少一种抗原性蛋白和所述加强免疫的至少一种抗原性蛋白基于相同的至少一种肿瘤相关抗原,并且其中所述加强免疫的至少一种抗原性蛋白不被所述加强免疫的病毒所编码。
在一个方面,在组合初免:加强免疫治疗中提供了用于在哺乳动物对象中引起免疫应答的包含加强免疫的组合物,其中:所述初免包括至少一种抗原性蛋白,其配制以在所述哺乳动物中产生免疫应答;并且所述加强免疫包括病毒和至少一种抗原性蛋白,其配制以在所述哺乳动物中引起免疫应答;其中所述初免的至少一种抗原性蛋白和所述加强免疫的至少一种抗原性蛋白基于相同的至少一种肿瘤相关抗原,并且其中所述加强免疫的至少一种抗原性蛋白不被所述加强免疫的病毒所编码。
在一个实施方式中,所述初免的至少一种抗原性蛋白和所述加强免疫的至少一种抗原性蛋白是相同的。
在一个实施方式中,所述至少一种肿瘤相关抗原基于哺乳动物对象的肿瘤的突变组。
在一个实施方式中,所述初免的至少一种抗原性蛋白包含多种抗原性蛋白,并且所述加强免疫的至少一种抗原性蛋白包含多种抗原性蛋白,所述抗原性蛋白中的每一种不被所述加强免疫的病毒编码,并且所述初免的多种抗原性蛋白和所述加强免疫的多种抗原性蛋白基于相同的多种肿瘤相关抗原。
在一个实施方式中,所述初免的多种抗原性蛋白和所述加强免疫的多种抗原性蛋白是相同的。
在一个实施方式中,所述多种肿瘤相关抗原基于哺乳动物对象的肿瘤的突变组。
在一个实施方式中,所述加强免疫的病毒为溶瘤病毒。
在一个实施方式中,所述加强免疫的病毒为弹状病毒。
在一个实施方式中,所述弹状病毒为马拉巴病毒或其工程变体。
在一个实施方式中,所述加强免疫的病毒是减毒的。
在一个实施方式中,所述加强免疫的病毒是复制缺陷型的。
在一个实施方式中,所述减毒病毒是包含其中氨基酸242突变的马拉巴G蛋白和其中氨基酸123突变的马拉巴M蛋白的减毒马拉巴病毒。在一个实施方式中,G蛋白的氨基酸242为精氨酸(Q242R),M蛋白的氨基酸123为色氨酸(L123W)。在PCT专利申请No.PCT/IB2010/003396中描述了马拉巴M蛋白的实例,以上专利申请作为参考并入本文,其中将其称为SEQ ID NO:4。在PCT专利申请No.PCT/IB2010/003396中描述了马拉巴G蛋白的实例,其中将其称为SEQ ID NO:5。在一个实施方式中,所述加强免疫的病毒为PCT专利申请No.PCT/IB2010/003396中所述的马拉巴双重突变型(“Maraba DM”)。在一个实施方式中,所述加强免疫的病毒为PCT专利申请No.PCT/CA2014/050118中所述的“Maraba MG1”,以上专利申请作为参考并入本文。
在一个实施方式中,所述加强免疫的病毒为腺病毒、牛痘病毒、麻疹病毒或者水泡性口膜炎病毒
在一个实施方式中,所述加强免疫的病毒为腺病毒、牛痘病毒或者水泡性口膜炎病毒
在一个实施方式中,将所述加强免疫配制用于静脉内、肌内或肿瘤内施用。
在一个实施方式中,将所述初免配制用于静脉内、肌内或肿瘤内施用。
在一个实施方式中,所述加强免疫的病毒是失活的。在一个实施方式中,所述加强免疫的病毒是UV-灭活的。
在一个实施方式中,所述初免还包含非病毒免疫佐剂。一个实例为多聚I:C。
在一个实施方式中,所述初免还包括病毒,其中所述初免的病毒与所述加强免疫的病毒是免疫原性相异的。
在一个实施方式中,所述初免的病毒为腺病毒。所述初免的病毒可以是肿瘤选择性的。例如,所述初免的腺病毒可以包含E1和E3中的缺失,从而使得所述病毒对p53失活敏感。由于多种肿瘤缺少p53,因此这种修饰有效地使所述病毒是肿瘤-特异的,并因此是溶瘤的。在一个实施方式中,所述腺病毒具有血清5型。
所述初免的病毒可以编码所述初免的至少一种抗原性蛋白。当在所述初免中使用多个抗原性蛋白时,可以通过所述初免的病毒编码它们中的一些或全部。例如,所述初免的病毒可以包括多种病毒类型,每种类型工程设计以编码抗原性蛋白之一。然而,在一个实施方式中,所述初免的至少一种抗原性蛋白不是通过所述初免的病毒所编码的。当使用多种抗原性蛋白时,在一个实施方式中,它们均不是通过所述初免的病毒所编码的。
在一个实施方式中,所述初免的病毒可以是减毒的。在一个实施方式中,其中所述初免的病毒是失活的。在一个实施方式中,所述初免的病毒是UV灭活的。
在一个实施方式中,所述初免的至少一种抗原性蛋白包含合成肽。在一个实施方式中,所述初免的合成肽是合成的长肽(SLP)。所述初免的至少一种抗原性蛋白的长度可以为8至250个氨基酸。在该范围内,它的长度可以为至少10,至少20,至少30,至少40或至少50个氨基酸。对于所有这些适用的范围,长度可以是小于200,小于150,小于125,小于100,小于75,小于50,小于40或小于30个氨基酸。可以是所述上下限的任何组合。
在一个实施方式中,所述加强免疫的至少一种抗原性蛋白包含合成肽。在一个实施方式中,所述加强免疫的合成肽是合成的长肽(SLP)。所述加强免疫的至少一种抗原性蛋白的长度可以为8至250个氨基酸。在该范围内,它的长度可以为至少10,至少20,至少30,至少40或至少50个氨基酸。对于所有这些适用的范围,长度可以是小于200,小于150,小于125,小于100,小于75,小于50,小于40或小于30个氨基酸。可以是所述上下限的任何组合。
用于使用的组合物还可以包含免疫-加强免疫化合物,如环磷酰胺(CPA),其提高了哺乳动物中通过施用第一病毒所产生的对肿瘤相关抗原性蛋白的初免免疫应答。环磷酰胺是可以导致对肿瘤相关抗原性蛋白的免疫应答提高的化疗剂。
在某些实施方式中,所述抗原性蛋白未连接、缀合或另外物理连接至病毒颗粒。在一些实施方式中,所述抗原性蛋白未与病毒颗粒物理结合。
在一个方面,提供了用于在哺乳动物对象中引起免疫应答的试剂盒,其中所述试剂盒包含包括至少一种抗原性蛋白的初免,所述抗原性蛋白配制以在所述哺乳动物中产生免疫应答;和包括病毒和至少一种抗原性蛋白的加强免疫,所述抗原性蛋白配制以在所述哺乳动物中引起免疫应答;其中所述初免的至少一种抗原性蛋白和所述加强免疫的至少一种抗原性蛋白基于相同的至少一种肿瘤相关抗原,并且其中所述加强免疫的至少一种抗原性蛋白不被所述加强免疫的病毒所编码。
在一个实施方式中,所述哺乳动物可以是人。
在一个实施方式中,所述初免的至少一种抗原性蛋白和所述加强免疫的至少一种抗原性蛋白是相同的。
在一个实施方式中,所述至少一种肿瘤相关抗原基于哺乳动物对象的肿瘤的突变组。
在一个实施方式中,所述初免的至少一种抗原性蛋白包含多种抗原性蛋白,并且所述加强免疫的至少一种抗原性蛋白包含多种抗原性蛋白,所述抗原性蛋白中的每一种不被所述加强免疫的病毒编码,并且所述初免的多种抗原性蛋白和所述加强免疫的多种抗原性蛋白基于相同的多种肿瘤相关抗原。如上,将理解所述初免的多种抗原性蛋白和所述加强免疫的多种抗原性蛋白不需要是相同的,并且来自所述初免和加强免疫的一对抗原性蛋白可以引起对相同肿瘤相关抗原的免疫应答,而它们不是相同的。例如,所述抗原性蛋白对可以是部分重叠的,其具有包含对应于肿瘤相关抗原的序列或者设计以引起对肿瘤相关抗原的免疫应答的序列的重叠节段。然而,在一个实施方式中,所述初免的多种抗原性蛋白和所述加强免疫的多种抗原性蛋白是相同的。
在一个实施方式中,所述多种肿瘤相关抗原基于哺乳动物对象的肿瘤的突变组。
在一个实施方式中,所述加强免疫的病毒为溶瘤病毒。
在一个实施方式中,所述加强免疫的病毒为弹状病毒。所述弹状病毒可以是任何以上所列的那些。
在一个实施方式中,所述弹状病毒为马拉巴病毒或其工程变体。
在一个实施方式中,所述加强免疫的病毒是减毒病毒。
在一个实施方式中,所述减毒病毒是包含其中氨基酸242突变的马拉巴G蛋白和其中氨基酸123突变的马拉巴M蛋白的减毒马拉巴病毒。在一个实施方式中,G蛋白的氨基酸242为精氨酸(Q242R),M蛋白的氨基酸123为色氨酸(L123W)。在PCT专利申请No.PCT/IB2010/003396中描述了马拉巴M蛋白的实例,其中将其称为SEQ ID NO:4。在PCT专利申请No.PCT/IB2010/003396中描述了马拉巴G蛋白的实例,其中将其称为SEQ ID NO:5。在一个实施方式中,所述加强免疫的病毒为PCT专利申请No.PCT/IB2010/003396中所述的马拉巴双重突变型(“Maraba DM”)。在一个实施方式中,所述加强免疫的病毒为PCT专利申请No.PCT/CA2014/050118中所述的“Maraba MG1”。
在一个实施方式中,所述加强免疫的病毒为腺病毒、牛痘病毒、麻疹病毒或者水泡性口膜炎病毒
在一个实施方式中,所述加强免疫的病毒为腺病毒、牛痘病毒或者水泡性口膜炎病毒
在一个实施方式中,将所述加强免疫配制用于静脉内、肌内或肿瘤内施用。
在一个实施方式中,将所述初免配制用于静脉内、肌内或肿瘤内施用。
在一个实施方式中,所述加强免疫的病毒是失活的。在一个实施方式中,所述加强免疫的病毒是UV-灭活的。
在一个实施方式中,所述初免还包含非病毒佐剂。
在一个实施方式中,所述初免还包括病毒,其中所述初免的病毒与所述加强免疫的病毒是免疫原性相异的。
在一个实施方式中,所述初免的病毒为腺病毒。所述初免的病毒可以是肿瘤选择性的。例如,所述初免的腺病毒可以包含E1和E3中的缺失,从而使得所述病毒对p53失活敏感。由于多种肿瘤缺少p53,因此这种修饰有效地使所述病毒是肿瘤-特异的,并因此是溶瘤的。
所述初免的病毒可以编码所述初免的至少一种抗原性蛋白。当在所述初免中使用多个抗原性蛋白时,可以通过所述初免的病毒编码它们中的一些或全部。例如,所述初免的病毒可以包括多种病毒类型,每种类型工程设计以编码抗原性蛋白之一。然而,在一个实施方式中,所述初免的至少一种抗原性蛋白不是通过所述初免的病毒所编码的。当使用多种抗原性蛋白时,在一个实施方式中,它们均不是通过所述初免的病毒所编码的。
在一个实施方式中,所述初免的病毒可以是减毒的。在一个实施方式中,其中所述初免的病毒是失活的。在一个实施方式中,所述初免的病毒是UV灭活的。
在一个实施方式中,所述初免的至少一种抗原性蛋白包含合成肽。在一个实施方式中,所述初免的合成肽是合成的长肽。所述初免的至少一种抗原性蛋白的长度可以为8至250个氨基酸。在该范围内,它的长度可以为至少10,至少20,至少30,至少40或至少50个氨基酸。对于所有这些适用的范围,长度可以是小于200,小于150,小于125,小于100,小于75,小于50,小于40或小于30个氨基酸。可以是所述上下限的任何组合。
在一个实施方式中,所述加强免疫的至少一种抗原性蛋白包含合成肽。在一个实施方式中,所述加强免疫的合成肽是合成的长肽。所述初免的至少一种抗原性蛋白的长度可以为8至250个氨基酸。在该范围内,它的长度可以为至少10,至少20,至少30,至少40或至少50个氨基酸。对于所有这些适用的范围,长度可以是小于200,小于150,小于125,小于100,小于75,小于50,小于40或小于30个氨基酸。可以是所述上下限的任何组合。
所述试剂盒还可以包含免疫-加强免疫化合物,如环磷酰胺(CPA),其提高了哺乳动物中通过施用第一病毒所产生的对肿瘤相关抗原性蛋白的初免免疫应答。环磷酰胺是可以导致对肿瘤相关抗原性蛋白的免疫应答提高的化疗剂。
在某些实施方式中,所述抗原性蛋白未连接、缀合或另外物理连接至病毒颗粒。在一些实施方式中,所述抗原性蛋白未与病毒颗粒物理结合。
在一个方面,提供了本文所述的组合初免:加强免疫疗法用于治疗哺乳动物对象中的肿瘤的使用。
在一个方面,提供了用于在哺乳动物对象中的肿瘤的治疗中的使用的本文所述的组合初免:加强免疫疗法。
在一个方面,提供了治疗哺乳动物对象中肿瘤的方法,所述方法包括向所述对象施用本文所述的组合初免:加强免疫。
在一个方面,提供了所述组合物用于如上定义的使用,用于治疗哺乳动物对象中的肿瘤的使用。
在一个方面,提供了用于如上定义的在治疗哺乳动物对象中的肿瘤中的使用的组合物。
在一个方面,提供了生产本文所述的组合初免:加强免疫疗法的方法,所述方法包括合成所述加强免疫的至少一种抗原性蛋白和产生所述组合初免:加强免疫疗法。
在一个方面,提供了生产本文所述的组合初免:加强免疫疗法的方法,所述方法包括合成所述初免的至少一种抗原性蛋白和产生所述组合初免:加强免疫疗法。
在一个实施方式中,所述合成步骤包括长肽合成。
在一个实施方式中,所述方法还包括在所述合成步骤之前,基于所述哺乳动物对象的肿瘤突变组选择至少一种肿瘤相关抗原。
在一个实施方式中,所述方法还可以包括确定对象的突变组以确定独特的肽。一旦确定,一些实施方式包括从所述突变组选择靶标肽。一些实施方式包括预测最优靶标,例如,基于预测的抗原性。
在一个方面,提供了溶瘤病毒和至少一种抗原性蛋白用于引起哺乳动物对象中免疫应答的使用,其中所述至少一种抗原性蛋白不是溶瘤病毒所编码的。
在一个方面,提供了用于在引起哺乳动物对象中免疫应答中使用的溶瘤病毒和至少一种抗原性蛋白,其中所述至少一种抗原性蛋白不是溶瘤病毒所编码的。
在一个方面,提供了溶瘤病毒用于辅佐对哺乳动物对象中至少一种抗原性蛋白的免疫应答的使用,其中所述至少一种抗原性蛋白不是溶瘤病毒所编码的。
在一个方面,提供了用于在辅佐对哺乳动物对象中至少一种抗原性蛋白的免疫应答中使用的溶瘤病毒,其中所述至少一种抗原性蛋白不是溶瘤病毒所编码的。
在一个实施方式中,所述哺乳动物是人。
在一个实施方式中,所述免疫应答是治疗性免疫应答。
在一个实施方式中,所述哺乳动物对象对至少一种抗原性蛋白具有预存免疫性。
“预存免疫性”将被理解为对特定抗原不是未免疫的对象,其限期已暴露于它。这可以(例如)由于用所述抗原使对象初免而产生。它还可以因为由于抗原存在于对象中而使所述对象具有低水平的免疫性而产生。例如,在癌症的背景中,由于肿瘤表达肿瘤相关抗原,因此对象可以具有低水平的在先免疫性。
在一个实施方式中,所述至少一种抗原性蛋白基于至少一种肿瘤相关抗原。
在一个实施方式中,所述至少一种肿瘤相关抗原基于哺乳动物对象的肿瘤的突变组。
在一个实施方式中,所述至少一种抗原性蛋白包括多种抗原性蛋白。
在一个实施方式中,所述多种抗原性蛋白基于哺乳动物对象的肿瘤的突变组。
在一个实施方式中,所述溶瘤病毒为弹状病毒。所述弹状病毒可以是上述的任何一种或多种。
在一个实施方式中,所述弹状病毒为马拉巴病毒或其工程变体。
在一个实施方式中,所述溶瘤病毒是减毒病毒。
在一个实施方式中,所述减毒病毒是包含其中氨基酸242突变的马拉巴G蛋白和其中氨基酸123突变的马拉巴M蛋白的减毒马拉巴病毒。在一个实施方式中,G蛋白的氨基酸242为精氨酸(Q242R),M蛋白的氨基酸123为色氨酸(L123W)。在PCT专利申请No.PCT/IB2010/003396中描述了马拉巴M蛋白的实例,其中将其称为SEQ ID NO:4。在PCT专利申请No.PCT/IB2010/003396中描述了马拉巴G蛋白的实例,其中将其称为SEQ ID NO:5。在一个实施方式中,所述加强免疫的病毒为PCT专利申请No.PCT/IB2010/003396中所述的马拉巴双重突变型(“Maraba DM”)。在一个实施方式中,所述加强免疫的病毒为PCT专利申请No.PCT/CA2014/050118中所述的“Maraba MG1”。
在一个实施方式中,所述病毒为腺病毒、牛痘病毒、麻疹病毒或者水泡性口膜炎病毒
在一个实施方式中,所述加强免疫的病毒为腺病毒、牛痘病毒或者水泡性口膜炎病毒
在一个实施方式中,将所述病毒和所述至少一种抗原性蛋白配制用于静脉内、肌内或肿瘤内施用。
在一个实施方式中,所述病毒是失活的。
在一个实施方式中,所述病毒是UV-灭活的。
在一个实施方式中,所述至少一种抗原性蛋白包含合成肽。在一个实施方式中,所述合成肽包括长合成肽。所述至少一种抗原性蛋白的长度可以为8至250个氨基酸。在该范围内,它的长度可以为至少10,至少20,至少30,至少40或至少50个氨基酸。对于所有这些适用的范围,长度可以是小于200,小于150,小于125,小于100,小于75,小于50,小于40或小于30个氨基酸。可以是所述上下限的任何组合。
在一个方面,提供了辅佐对哺乳动物对象中至少一种抗原性蛋白的免疫应答的方法,所述方法包括向所述对象施用溶瘤病毒和所述至少一种抗原性蛋白,其中所述至少一种抗原性蛋白不是所述溶瘤病毒所编码的。
在一个实施方式中,所述哺乳动物是人。
在一个实施方式中,所述施用步骤包括共施用。
在一个实施方式中,所述免疫应答是治疗性免疫应答。
在一个实施方式中,所述哺乳动物对象对至少一种抗原性蛋白具有预存免疫性。
在一个实施方式中,所述至少一种抗原性蛋白基于至少一种肿瘤相关抗原。
在一个实施方式中,所述至少一种肿瘤相关抗原基于哺乳动物对象的肿瘤的突变组。
在一个实施方式中,所述至少一种抗原性蛋白包括多种抗原性蛋白。
在一个实施方式中,所述多种抗原性蛋白基于哺乳动物对象的肿瘤的突变组。
在一个实施方式中,所述溶瘤病毒为弹状病毒。所述弹状病毒可以是上述的任何一种或多种。
在一个实施方式中,所述弹状病毒为马拉巴病毒或其工程变体。
在一个实施方式中,所述病毒是减毒病毒。
在一个实施方式中,所述减毒病毒是包含其中氨基酸242突变的马拉巴G蛋白和其中氨基酸123突变的马拉巴M蛋白的减毒马拉巴病毒。在一个实施方式中,G蛋白的氨基酸242为精氨酸(Q242R),M蛋白的氨基酸123为色氨酸(L123W)。在PCT专利申请No.PCT/IB2010/003396中描述了马拉巴M蛋白的实例,其中将其称为SEQ ID NO:4。在PCT专利申请No.PCT/IB2010/003396中描述了马拉巴G蛋白的实例,其中将其称为SEQ ID NO:5。在一个实施方式中,所述加强免疫的病毒为PCT专利申请No.PCT/IB2010/003396中所述的马拉巴双重突变型(“Maraba DM”)。在一个实施方式中,所述加强免疫的病毒为PCT专利申请No.PCT/CA2014/050118中所述的“Maraba MG1”。
在一个实施方式中,所述病毒为腺病毒、牛痘病毒、麻疹病毒或者水泡性口膜炎病毒
在一个实施方式中,所述加强免疫的病毒为腺病毒、牛痘病毒或者水泡性口膜炎病毒
在一个实施方式中,所述施用步骤为静脉内、肌内或肿瘤内施用。
在一个实施方式中,所述病毒是失活的。
在一个实施方式中,所述病毒是UV-灭活的。
在一个实施方式中,所述至少一种抗原性蛋白包含合成肽。在一个实施方式中,所述合成肽包括长合成肽。所述至少一种抗原性蛋白的长度可以为8至250个氨基酸。在该范围内,它的长度可以为至少10,至少20,至少30,至少40或至少50个氨基酸。对于所有这些适用的范围,长度可以是小于200,小于150,小于125,小于100,小于75,小于50,小于40或小于30个氨基酸。可以是可以是所述上下限的任何组合。
在一个方面,提供了包含溶瘤病毒和至少一种抗原性蛋白的免疫原性组合物,其中所述至少一种抗原性蛋白不是所述溶瘤病毒所编码的。
在一个实施方式中,所述至少一种抗原性蛋白基于至少一种肿瘤相关抗原。
在一个实施方式中,所述至少一种肿瘤相关抗原基于哺乳动物对象的肿瘤的突变组。
在一个实施方式中,所述至少一种抗原性蛋白包括多种抗原性蛋白。
在一个实施方式中,所述多种抗原性蛋白基于哺乳动物对象的肿瘤的突变组。
在一个实施方式中,所述溶瘤病毒为弹状病毒。所述弹状病毒可以是上述的任何一种或多种。
在一个实施方式中,所述弹状病毒为马拉巴病毒或其工程变体。
在一个实施方式中,所述病毒是减毒病毒。
在一个实施方式中,所述减毒病毒是包含其中氨基酸242突变的马拉巴G蛋白和其中氨基酸123突变的马拉巴M蛋白的减毒马拉巴病毒。在一个实施方式中,G蛋白的氨基酸242为精氨酸(Q242R),M蛋白的氨基酸123为色氨酸(L123W)。在PCT专利申请No.PCT/IB2010/003396中描述了马拉巴M蛋白的实例,其中将其称为SEQ ID NO:4。在PCT专利申请No.PCT/IB2010/003396中描述了马拉巴G蛋白的实例,其中将其称为SEQ ID NO:5。在一个实施方式中,所述加强免疫的病毒为PCT专利申请No.PCT/IB2010/003396中所述的马拉巴双重突变型(“Maraba DM”)。在一个实施方式中,所述加强免疫的病毒为PCT专利申请No.PCT/CA2014/050118中所述的“Maraba MG1”。
在一个实施方式中,所述病毒为腺病毒、牛痘病毒、麻疹病毒或者水泡性口膜炎病毒
在一个实施方式中,所述加强免疫的病毒为腺病毒、牛痘病毒或者水泡性口膜炎病毒
在一个实施方式中,所述病毒是失活的。
在一个实施方式中,所述病毒是UV-灭活的。
在一个实施方式中,所述至少一种抗原性蛋白包含合成肽。在一个实施方式中,所述合成肽包括长合成肽。所述至少一种抗原性蛋白的长度可以为8至250个氨基酸。在该范围内,它的长度可以为至少10,至少20,至少30,至少40或至少50个氨基酸。对于所有这些适用的范围,长度可以是小于200,小于150,小于125,小于100,小于75,小于50,小于40或小于30个氨基酸。可以是所述上下限的任何组合。
实施例
材料和方法
细胞系和培养
稳定表达卵清蛋白的B16F10来自Rebecca Auer博士。Vero、HEK 293T和HeLa细胞均来自美国模式培养物保藏所(ATCC)。将细胞系维持在补充有10%胎牛血清(FBS)(SigmaLife Science)的达尔伯克氏改良的伊格尔氏培养基(DMEM)(Corning Cellgro)中并在37℃,5%CO
病毒、生产和定量
在本研究中使用的马拉巴(MRB)病毒是临床候选变体MG1,从而在下文中,对‘MRB’的提及应理解为表示MG1。在本研究中使用的水泡性口膜炎病毒(VSV)是突变体Δ51。VSV和MRB的生产和纯化:以0.01的感染复数(MOI)感染Vero细胞24小时,然后收获、过滤[0.22μm瓶顶部过滤器(Millipore)]并离心(30100g,90分钟)培养上清液。将沉淀颗粒在达尔伯克氏磷酸盐缓冲盐水(DPBS)(Corning Cellgro)中再混悬并储存在-80℃。通过空斑测定确定病毒滴度。简要地,将依次稀释的样品转移到单层Vero细胞,培育1小时,然后覆盖0.5%的琼脂糖/补充有10%FBS的DMEM。24小时后对空斑计数。
在本研究中使用的腺病毒(Ad)(Ad、Ad-Ova和Ad-DCT)均得自B.Lichty(均为血清E5型)。Ad的生产和纯化:在补充有2%FBS的DMEM中,以1MOI感染HEK 293T细胞48h。然后,收集感染的细胞并将沉淀颗粒冷冻和融化3次。然后,通过离心除去碎片并在氯化铯梯度(1.4g/cm
在本研究中使用的牛痘病毒(VV)是野生型哥本哈根株。
在本研究中使用的麻疹病毒(MV)(Schwarts株)表达GFP并且是Guy Ungerechts博士慷慨赠送的。
辐照病毒
如上所述,使用Spectrolinker XL-1000UV交联仪,通过暴露于120mJ/cm
流式细胞术
收获脾脏并通过70μm过滤器(Fisher Scientific)压碎,然后使用ACK裂解缓冲液使红细胞溶胞,并在FACS缓冲液(PBS,3%FBS)中再混悬。使用2μg/mL相应的肽离体再刺激脾细胞并在1h后将golgi-plug(BD Bioscience)加入至混合物另外5h以避免细胞因子分泌。使用CD45、CD3、CD8、TNFα和IFNγ抗体(均来自BD Bioscience)对细胞染色。一旦使细胞固定和透性化(使用胞内固定和透性化缓冲液组(eBioscience)),实施胞内染色。在LSRFortessa流式细胞仪(BD biosciences)上进行流式细胞分析。
肽
所有的肽均得自Biomer Technology并且具有如表1所示的氨基酸序列。
表1:肽序列
ELISPOT
根据生产商的规程,使用最后一次免疫之后7天提取的脾细胞进行小鼠IFNγELISPOTs(MabTech)。使用2μg/mL的肽,在无血清DMEM中培育24h以进行再刺激。
体内实验和肿瘤模型
根据渥太华大学(University of Ottawa)的ACVS指南,进行所有实验。皮下肿瘤模型:对于SC和肺癌模型,分别将10
结果与讨论
在这些实验中,MRB表示MG1。所有实验均在患肿瘤动物中进行。初免将被理解为第7天的免疫,并且加强免疫发生在第14天。
结果表明抗原性蛋白不必需被病毒编码以刺激免疫应答。
病毒可以用作免疫加强的佐剂。
图1显示了在本研究中使用的处理程序的示意图。
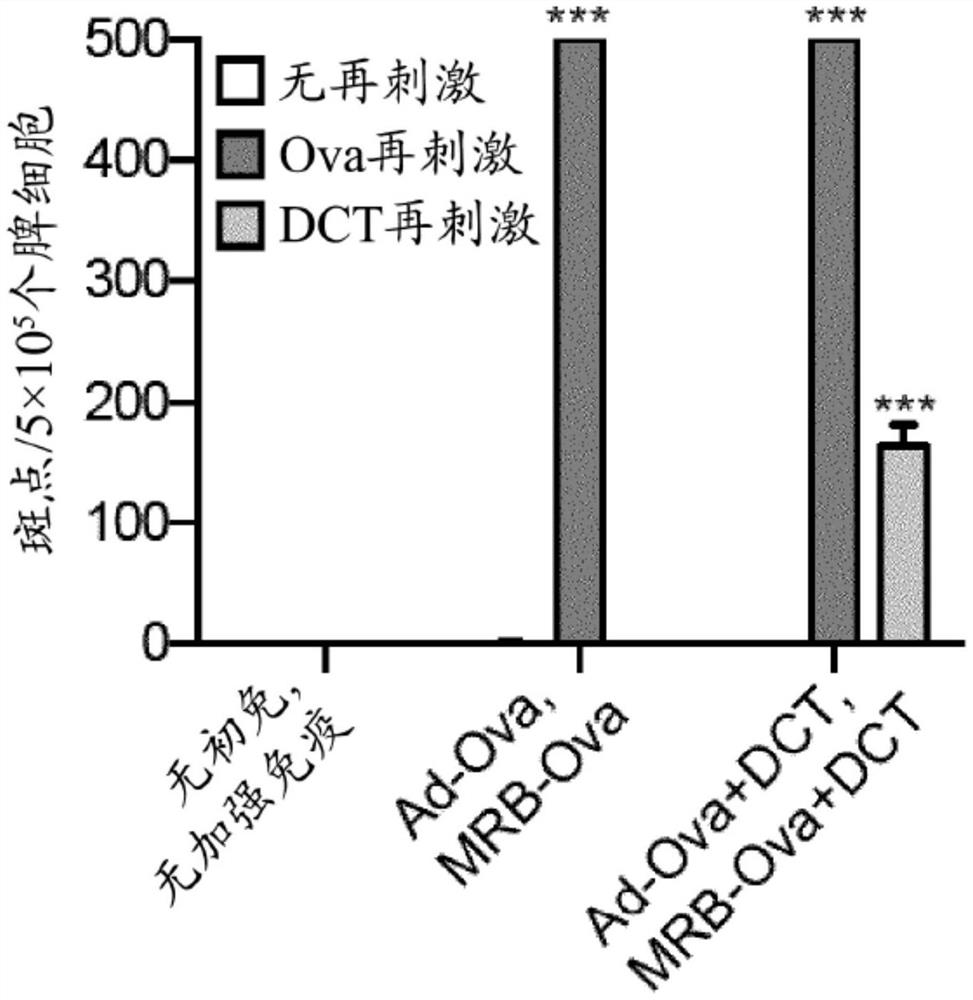
图2显示了在第21天从用表达DCT肽的腺病毒(Ad)(称为“Ad-DCT”)初免并且用表达DCT肽的马拉巴病毒MG1(称为“MRB-DCT”)或与DCT肽共施用的MRB(称为“MRB+DCT”,其中“+”表示非病毒编码或非病毒的一部分的肽的共施用)加强的小鼠收获的脾细胞的IFNγELISPOT分析。
图2的结果显示单独的Ad-DCT引起对DCT的免疫应答(左侧第二组)。使用MRB+DCT的免疫加强(右侧最后一组)将免疫应答改善至与MRB-DCT(左侧第三组)相当的水平。因此,图2显示在异源病毒加强免疫环境中,作为加强免疫,MRB+DCT与MRB-DCT一样好。不需要编码MRB的抗原性肽。除非另外说明,否则统计学分析表示“无再刺激(No restim)”和“DCT再刺激(DCT restim)”条件之间的比较。NS:p>0.05,***:p<0.001(非配对多重双尾t检验)。
图3显示在第21天从用Ad-Ova初免并且用MRB-Ova或与Ova肽共施用的MRB(MRB+Ova)加强的小鼠收获的脾细胞的IFNγELISPOT分析。结果显示单独的Ad-Ova引起对Ova的免疫应答(左侧第二组)。不可以通过单独的Ova肽的IV注射加强该免疫应答(左侧第三组)。使用MRB-Ova的免疫加强(最后一组)将该免疫应答改善至和与Ova肽共施用的MRB(左侧第四组)相当的水平。图3显示在异源病毒加强免疫免疫环境中,作为加强免疫,MRB+Ova与MRB-Ova一样好,从而确认了图2中对于DCT的上述结果。除非另外说明,否则统计学分析表示“无再刺激(No restim)”和“Ova再刺激(Ova restim)”条件之间的比较。NS:p>0.05,***:p<0.001(非配对多重双尾t检验)。
图4显示了与图3中相同的实验的流式细胞分析。同样,结果显示单独的Ad-Ova引起对Ova的免疫应答(左侧第二组)。不可以通过单独的Ova肽的IV注射加强该免疫应答(左侧第三组)。使用MRB-Ova的免疫加强(最后一组)将该免疫应答改善至和与Ova共施用的MRB(左侧第四组)相当的水平。因此,图4确认在异源病毒加强免疫免疫环境中,作为加强免疫,MRB+Ova与MRB-Ova一样好(再次确认了在另一种肽的背景中,对DCT所观察到的结果)。除非另外说明,否则统计学分析表示“无再刺激(No restim)”和“Ova再刺激(Ova restim)”条件之间的比较。NS:p>0.05,*:p<0.05,**:p<0.01,***:p<0.001(非配对多重双尾t检验)。
图5显示了在第21天从用Ad-DCT初免并且使用不同途径(IV、IT或IM)用与DCT肽共施用的MRB加强的小鼠收获的脾细胞的IFNγELISPOT分析。结果显示MRB+肽的所有施用途径引起了相当的免疫应答。除非另外说明,否则统计学分析表示“无再刺激(No restim)”和“DCT再刺激(DCT restim)”条件之间的比较。NS:p>0.05,*:p<0.05,**:p<0.01(非配对多重双尾t检验)。
图6显示了在第21天从用Ad-DCT初免并且用与DCT肽共施用的MRB或UV-灭活的MRB(UVMRB)加强的小鼠收获的脾细胞的IFNγELISPOT分析。结果显示MRB(左侧第三组)和UV-灭活的MRB(UVMRB)(最右侧组)两者提供了相当的免疫加强。因此,图6显示在佐剂环境中,MRB不必需复制(或者为溶瘤性的)以加强免疫抗原-特异性免疫应答。除非另外说明,否则统计学分析表示“无再刺激(No restim)”和“DCT再刺激(DCT restim)”条件之间的比较。NS:p>0.05,*:p<0.05,***:p<0.001(非配对多重双尾t检验)。
其它溶瘤病毒(OV)也可以用作免疫初免或加强免疫的佐剂。
图7显示了在第21天从用Ad-DCT初免并且用与DCT肽共施用的VV、VSV或MV加强的小鼠收获的脾细胞的IFNγELISPOT分析。结果同样显示单独的Ad-DCT引起对DCT的免疫应答(左侧第二组)。可以通过VV(左侧第三组)或VSV(左侧第四组),但不能通过MV(最后一组)与DCT肽一起的共施用有效加强该免疫应答。该图显示VSV和VV也可以用作免疫加强的佐剂。统计学分析表示“无再刺激(No restim)”和“DCT再刺激(DCT restim)”条件之间的比较。NS:p>0.05,*:p<0.05,**:p<0.01,***:p<0.001(非配对多重双尾t检验)。
图8显示了在第14天从用Ad-DCT或与DCT肽共施用的Ad或多聚I:C(均为IM)初免的小鼠收获的脾细胞的IFNγELISPOT分析。结果表明DCT肽与Ad(左侧第三组)或多聚I:C(最后一组)的共施用赋予了Ad-DCT相当的初免效率(左侧第二组)。该图显示Ad可以用作初免抗-肿瘤免疫性的佐剂。统计学分析表示“无再刺激(No restim)”和“DCT再刺激(DCTrestim)”条件之间的比较。NS:p>0.05,**:p<0.01,***:p<0.001(非配对多重双尾t检验)。
图9显示了在第21天从用Ad-DCT初免和用与DCT肽共施用的MRB-DCT或MRB加强的小鼠收获的脾细胞的IFNγELISPOT分析。结果显示在不存在上述免疫初免的情况下,DCT肽与MRB的共施用(左侧第四组),而不是MRB-DCT(左侧第三组)能够引起DCT-特异性免疫应答。该图显示MRB也可以用作佐剂以初免抗-肿瘤免疫性。统计学分析表示“无再刺激(Norestim)”和“DCT再刺激(DCT restim)”条件之间的比较。NS:p>0.05,***:p<0.001(非配对多重双尾t检验)。
图10显示了在第14天从用MRB、MRB-Ova或与Ova肽共施用的MRB初免的小鼠收获的脾细胞的IFNγELISPOT分析。结果显示在不存在上述免疫初免的情况下,仅Ova肽与MRB的共施用(左侧第三组)能够引起Ova-特异性免疫。该图显示MRB也可以用作佐剂以初免抗-肿瘤免疫性。统计学分析表示“无再刺激(No restim)”和“Ova再刺激(Ova restim)”条件之间的比较。NS:p>0.05,*:p<0.05(非配对多重双尾t检验)。
MRB可以与突变组表位一起用作佐剂。
图11显示了在第21天从用与DCT肽一起或不一起的Ad-Ova初免并且用与DCT肽一起或不一起的MRB-Ova加强的小鼠收获的脾细胞的IFNγELISPOT分析。结果显示肽的共施用不削弱对所编码抗原(Ova)所引起的免疫应答(最后一组vs第二组)。另外,DCT肽与Ad-Ova和MRB-Ova两者的共施用使得能够引起DCT免疫应答(最后一组),从而显示可以对非初免病毒或加强免疫病毒所编码的肽产生有效免疫应答。图11还显示编码抗原的Ad和MRB平台可以与其它肽一起使用以初免和加强免疫抗-肿瘤免疫性。统计学分析表示“无再刺激(No restim)”和“肽再刺激(peptide restim)”条件之间的比较。NS:p>0.05,***:p<0.001(非配对多重双尾t检验)。
图12显示了在第7和14天用多聚I:C和所指明的肽IM处理的具有确立的皮下B16F10-Ova肿瘤的小鼠的结果。在第21天测量肿瘤。肿瘤体积相对于对照小鼠的平均肿瘤体积(仅用多聚I:C处理)。结果表明B16Mut-20、-30、-44和48具有治疗活性。NS:p>0.05,***:p<0.001(非配对多重双尾t检验)。
图13显示了在第7和14天用多聚I:C和所指明的肽IM处理的具有确立的皮下CT26肿瘤的小鼠的结果。在第21天测量肿瘤。肿瘤体积相对于对照小鼠的平均肿瘤体积(仅用多聚I:C处理)。结果表明CT26Mut-02、-27和-37具有治疗活性。NS:p>0.05,*:p<0.05(非配对多重双尾t检验)。
图14显示了在第14天从用多聚I:C或与DCT肽一起的MRB(SC和IV)初免的小鼠收获的脾细胞的IFNγELISPOT分析。结果表明所有途径和佐剂可以引起DCT-特异性免疫应答。重要地,最佳施用途径是对于多聚I:C的SC(第一组)和对于MRB的IV(最后一组)。值得注意地,当比较多聚I:C SC(第一组)和MRB IV(最后一组)的免疫初免活性时,无统计学差异。该图显示作为佐剂,MRB IV与多聚I:C SC一样好。除非另外说明,否则统计学分析表示“无再刺激(No restim)”和“DCT再刺激(DCT restim)”条件之间的比较。NS:p>0.05,*:p<0.05,**:p<0.01(非配对多重双尾t检验)。
图15显示了在第14天从用多聚I:C(SC)或与所指明的B16Mut肽一起的MRB(IV)初免的小鼠收获的脾细胞的IFNγELISPOT分析。结果显示对于所测试的所有的B16Mut肽,MRBIV(第二组)在引起肽-特异性免疫应答方面与多聚I:C SC(第一组)一样有效。该图确认作为佐剂,MRB IV与多聚I:C SC一样好。统计学分析表示“无再刺激(No restim)”和“肽再刺激(peptide restim)”条件之间的比较。NS:p>0.05,*:p<0.05,**:p<0.01(非配对多重双尾t检验)。
图16显示MRB可以用作佐剂以用于免疫初免或加强免疫,但不能同时用于两者。它显示了在第21天从用Ad-DCT或与DCT肽一起的MRB初免并且用与DCT肽共施用的MRB加强的小鼠收获的脾细胞的IFNγELISPOT分析的结果。结果再次显示与DCT肽共施用的MRB可以在不存在上述免疫初免(左侧第二和第三组)的情况下引起DCT-特异性免疫应答。重要地是,与单次施用(左侧第二和第三组)相比,MRB与肽一起(左侧第四组)的反复施用(第7和14天)不会改善DCT-特异性免疫应答。该图显示MRB和肽的单次注射在引起抗原-特异性免疫方面与多次注射一样有效。除非另外说明,否则统计学分析表示“无再刺激(No restim)”和“DCT再刺激(DCT restim)”条件之间的比较。NS:p>0.05,*:p<0.05,**:p<0.01,***:p<0.001(非配对多重双尾t检验)。
图17显示当与肽一起IM或SC施用时,多聚I:C引起了更强的免疫应答。它显示了在第14天从按照不同途径(IP、IV、IM或SC),用与DCT肽共施用的多聚I:C初免的小鼠收获的脾细胞的IFNγELISPOT分析的结果。结果显示多聚I:C和肽的所有施用途径引起了DCT-特异性免疫。另外,使用IM(左侧第四组)或SC(最后一组)施用途径获得了最好的结果。该图显示对于多聚I:C的最佳施用途径为IM和SC。统计学分析表示“无再刺激(No restim)”和“DCT再刺激(DCT restim)”条件之间的比较。NS:p>0.05,*:p<0.05,**:p<0.01,***:p<0.001(非配对多重双尾t检验)。
图18显示Ad和MRB两者可以在异源病毒初免-加强免疫背景中用作佐剂。它显示了在第21天从用Ad-DCT或与DCT肽一起的Ad初免(第7天)并且用MRB-DCT与DCT肽共施用的MRB加强(第14天)(左图)的小鼠收获的脾细胞的IFNγELISPOT分析的结果。右图是使用Ova模型而不是DCT模型的实验重复。结果显示与DCT或Ova肽共施用的Ad和MRB可以与编码DCT或Ova的Ad和MRB一样有效地引起抗原-特异性免疫应答。统计学分析表示“无再刺激(Norestim)”和“再刺激(restim)”条件之间的比较。***:p<0.001(非配对多重双尾t检验)。
图19显示Ad和MRB两者可以在异源病毒加强免疫免疫背景中用作佐剂并赋予存活益处。它显示了用Ad或与DCT肽一起的Ad初免(第7天)并且用MRB或与DCT肽共施用的MRB加强(第14天)的小鼠的存活分析。结果显示Ad和与DCT肽共施用的MRB可以延长动物的存活并治愈30%的小鼠。统计学分析:p>0.05,*:p<0.05,**:p<0.01,***:p<0.001(Mantel-Cox检验)。
图20显示Ad和MRB两者可以在针对肿瘤-特异性突变的异源病毒加强免疫免疫背景中用作佐剂并且在B16F10肺癌模型中赋予存活益处。它显示用Ad或与突变组肽(B16Mut20、B16Mut30、B16Mut44和B16Mut48)一起的Ad初免(第7天)并且用MRB或与突变组肽(B16Mut20、B16Mut30、B16Mut44和B16Mut48)共施用的MRB加强(第14天)的小鼠的存活分析。结果显示与突变组肽共施用的Ad和MRB可以延长动物的存活并治愈20%的小鼠。统计学分析:NS:p>0.05,***:p<0.001(Mantel-Cox检验)。
图21显示Ad和MRB两者可以在针对肿瘤-特异性突变的异源病毒加强免疫免疫背景中用作佐剂并且在CT26 SC模型中赋予存活益处。它显示了用Ad或与突变组肽(CT26Mut20、CT26Mut27和CT26Mut37)一起的Ad初免(第7天)并且用MRB或与突变组肽(CT26Mut20、CT26Mut27和CT26Mut37)共施用的MRB加强(第14天)的小鼠的肿瘤生长分析。结果显示与突变组肽共施用的Ad和MRB可以控制SC肿瘤的生长。统计学分析:NS:p>0.05,***:p<0.001(非配对双尾t检验)。
图22显示Ad和MRB两者可以在针对肿瘤-特异性突变的异源病毒加强免疫免疫背景中用作佐剂并且在CT26 SC模型中赋予存活益处。这是图21中的实验的存活分析。它显示了用Ad或与突变组肽(CT26Mut20、CT26Mut27和CT26Mut37)一起的Ad初免(第7天)并且用MRB或与突变组肽(CT26Mut20、CT26Mut27和CT26Mut37)共施用的MRB加强(第14天)的小鼠的存活。结果显示与突变组肽共施用的Ad和MRB可以延长动物的存活并治愈大于20%的小鼠。统计学分析:NS:p>0.05,***:p<0.001(Mantel-Cox检验)。
图23显示编码Ova的Ad和MRB两者可以在针对肿瘤-特异性突变的异源病毒加强免疫免疫背景中用作佐剂并且在B16F10-Ova SC模型中赋予存活益处。它显示用Ad-Ova或与突变组肽(B16Mut20、B16Mut30、B16Mut44和B16Mut48)一起的Ad-Ova初免(第7天)并且用MRB-Ova或与突变组肽(B16Mut20、B16Mut30、B16Mut44和B16Mut48)共施用的MRB-Ova加强(第14天)的小鼠的肿瘤生长分析。结果显示与突变组肽共施用的Ad-Ova和MRB-Ova可以控制SC肿瘤的生长。统计学分析:*:p<0.05,***:p<0.001(非配对双尾t检验)。
图24显示Ad-Ova和MRB-Ova两者可以在针对肿瘤-特异性突变的异源病毒加强免疫免疫背景中用作佐剂并且在B16F10-Ova SC模型中赋予存活益处。这是图23中的实验的存活分析。它显示用Ad-Ova或与突变组肽(B16Mut20、B16Mut30、B16Mut44和B16Mut48)一起的Ad-Ova初免(第7天)并且用MRB-Ova或与突变组肽(B16Mut20、B16Mut30、B16Mut44和B16Mut48)共施用的MRB-Ova加强(第14天)的小鼠的存活。结果显示与突变组肽共施用的Ad-Ova和MRB-Ova可以赋予存活益处。统计学分析:***:p<0.001(Mantel-Cox检验)。
在先前描述中,出于解释的目的,描述了诸多详细信息以提供对实施方式的彻底理解。然而,对于本领域技术人员显而易见的是这些细节不是必需的。在其它实例中,以框图形式显示了熟知的电学结构和电路以避免使理解含糊不清。例如,未提供具体细节以便作为软件程序、硬件电路、固件或它们的组合实现本文所述的实施方式。
本发明公开的实施方式可以表示为储存在机器可读媒体(也称为计算机-可读媒体、处理器-可读媒体或者具有包含其中的计算机-可读程序代码的计算机可用媒体)中的计算机程序产品。机器可读媒体可以是任何适合的实体、永久性媒体,包括磁性、光学或电学存储媒体,包括磁盘、只读光盘(CD-ROM)、存储装置(非永久性或永久性)或者类似的存储机构。机器可读媒体可以含有多组指令、代码序列、构造信息或其它数据,当执行时,其导致处理器实施根据本发明公开的实施方式的方法中的步骤。本领域那些技术人员将理解执行所述实施过程所必需的其它指令和操作也可以存储在机器可读媒介上。可以通过处理器或其它适合的处理装置执行存储在机器可读媒介上的指令,并且可以与电路连接以实施所述任务。
上述实施方式仅旨在作为实例。本领域技术人员可以对具体实施方式实施改变、修改和变化。权利要求的范围不应受限于本文所述的具体实施方式,而应作为整体以与说明书一致的方式看待。
- 作为佐剂的溶瘤病毒
- 溶瘤病毒构建体、溶瘤病毒及其应用
