电致化学发光免疫传感器
文献发布时间:2023-06-19 10:19:37
技术领域
本发明属于检测领域。
背景技术
电致化学发光,简称ECL,是在电位激励下电极表面附近产生的化学发光现象。联吡啶钌Ru(bpy)
Han等通过将Ru(bpy)
发明内容
本发明要解决的问题是:提供一种发光信号强的电致化学发光免疫传感器。
本发明的技术方案如下:
一种增强Ru(bpy)
所述复合物为纳米银AgNPs与还原型谷胱甘肽GSH的复合物。
如前述的复合物AgNPs:GSH,其特征在于:
该复合物的制备方法为:
AgNPs与GSH混合后在2~8℃充分反应,即得;优选地,反应温度为4℃;
和/或,AgNPs与GSH的物质的量之比为1.07∶100~1.07∶1800;优选地,为1.07∶200。
一种电致化学发光免疫传感器,它自下而上包括:电极、石墨烯层、银单质层,银单质层上表面吸附Ru(bpy)
所述诱饵蛋白为抗原或抗体,用于免疫结合待检测的抗体或抗原。
如前述的传感器,在未与诱饵蛋白结合的AgNPs:GSH的Ag结合有封闭剂;优选地,所述封闭剂是BSA。
一种电致化学发光免疫传感器的制备方法,包括如下步骤:
(1)均匀地在电极表面涂抹石墨烯,干燥后,形成石墨烯层;
(2)在石墨烯层表面覆盖银单质;
(3)在Ru(bpy)
(4)在Ru(bpy)
(5)在复合物AgNPs:GSH的银颗粒上修饰抗原或抗体。
进一步地,所述步骤(2)为通过电沉积将银离子转化为银单质,覆盖到石墨烯层表面;
优选地,银离子浓度10mmol/L,电沉积电位-0.2V,时间100s。
进一步地,所述步骤(3)中吸附时间为8min;
和/或,Ru(bpy)
一种检测蛋白的方法,其特征在于,包括如下步骤:
1)将待检样本加到权利要求3或4所述传感器上孵育,如果样本中含有目标蛋白,则目标蛋白与诱饵蛋白免疫结合;
2)洗涤未免疫结合的蛋白;
3)将传感器置于缓冲液中,用电化学发光分析仪测定发光信号。
进一步地,所述缓冲液的pH为8。
本发明的有益效果:本发明的免疫传感器借助谷胱甘肽GSH聚集AgNPs(GSH-AgNPs)可增强Ru(bpy)
显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。
以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。
附图说明
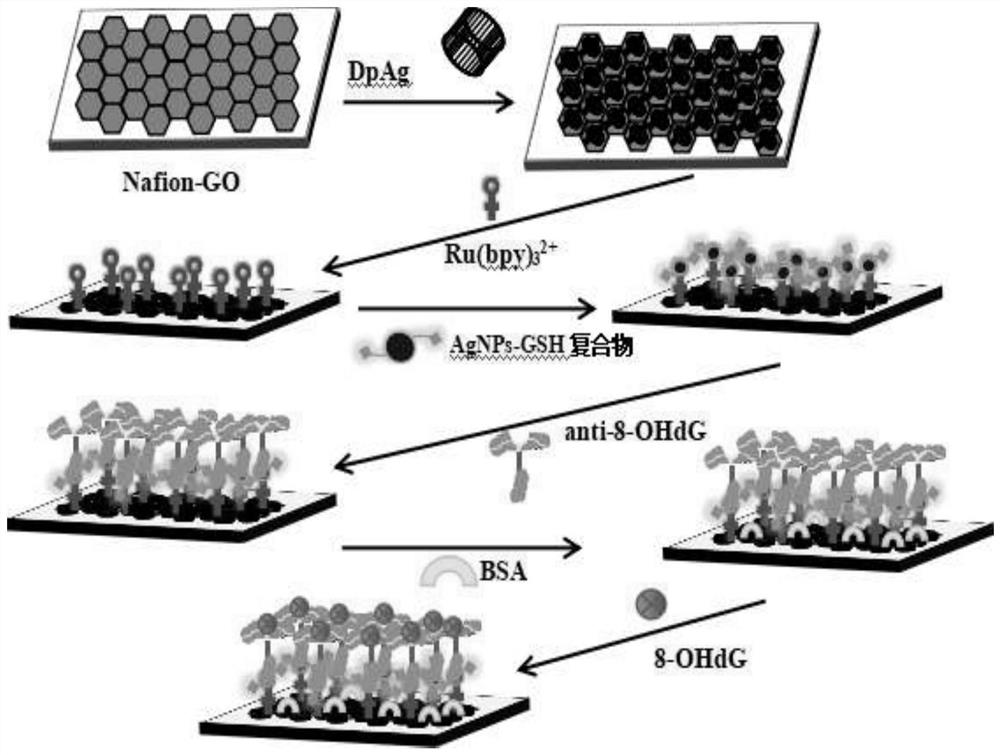
图1:8-OHdG免疫传感器层层自组装构建示意图。
图2:AgNPs与AgNPs:GSH形貌表征HRTEM图及其粒径分布图和电位图(A)AgNPs电镜图,(B)AgNPs:GSH电镜图,(C)AgNPs粒径分布图,(D)AgNPs的Zeta电位图,(E)AgNPs:GSH粒径分布图,(F)AgNPs:GSH的Zeta电位图。
图3:电极组装信号响应趋势图。(a)GCE/Nafion-GO,(b)GCE/Nafion-GO/AgNPs/Ru(bpy)
图4:梯度浓度8-OHdG检测的电位-发光强度(E-I)响应图(A)及标准曲线(B)。
图5:四支电极不同Ag
图6:AgNPs电沉积圈数优化(AgNO
图7:联吡啶钌修饰时间优化(c
图8:联吡啶钌修饰浓度优化。
图9:AgNPs:GSH复合物比例优化。
图10:AgNPs、GSH、AgNPs:GSH复合物信号比较。
图11:最佳pH值筛选。
具体实施方式
实施例1一种电致化学发光免疫传感器及其使用方法
本实施例的传感器以八羟基脱氧鸟苷(8-OHdG)为检测对象。8-OHdG是活性氧自由基如羟自由基、单线态氧等攻击DNA分子中的鸟嘌呤碱基第8位碳原子而产生的一种氧化性加合物,是一种DNA氧化性损伤的产物,现已作为多种炎症疾病的指标。
1.试剂的配制
磷酸缓冲液(PBS)的制备:配制0.1mol/L的PBS缓冲液,称取磷酸氢二钠7.098g、磷酸二氢钾6.805g和氯化钾3.728g置于烧杯内,加入一定量去离子水后,置于超声震荡仪中超声并搅拌至固体充分溶解,再全部转移到500mL量瓶内,定容至500mL。
石墨烯基底的制备:将200μL无水乙醇和300μL5%的Nation(全氟磺酸)加入1.5mL离心管内混合,再加入0.1g石墨烯固体,然后超声震荡至体系充分扩散。
10mmol/L AgNO
联吡啶钌(Ru(bpy)
还原型谷胱甘肽(GSH)的制备:配制浓度为0.2mol/L,精确称取GSH固体6.146g于50mL烧杯内,用加入10mL离子水溶解,4℃保存,使用期限为15天,过期后重新配制。
纳米银(AgNPs)的制备:合成制备前,把所有的玻璃仪器用铬酸清洗和浸泡,以保证所用的容器无杂质混入合成过程中。准备10mmol/L硼氢化钠75mL装于烧杯,再将烧杯置于磁力搅拌仪,设置1200r/min,同时逐滴加入提前配制的10mmol/L的AgNO
标准8-OHdG抗体:本实施例使用的标准8-OHdG抗体是8-OHdG ELISA试剂盒(上海雅吉生物科技有限公司,人8羟基脱氧鸟苷ELISA试剂盒)中的酶标抗体,按实验需求浓度1.5mg/mL,稀释比1∶300~1∶500稀释使用。试剂盒置于冰箱-20℃保存。
牛血清蛋白(BSA)的制备:固体药品置于冰箱-20℃保存,使用时,称取0.1g,用加入100mL去离子水,充分溶解后,取10mL该溶液加入90mL去离子水,配成0.01%的BSA溶液体系,用于封闭8-OHdG抗体蛋白质。使用期限为7天,过期后重新配制。
肝癌细胞(HepG2)提取液制备:本实施例使用的是实验室内培养的HepG2传代细胞。将HepG2细胞培养瓶置于超声频率为40±5kHz的超声仪,设置超声时间为10min来超声破壁,使培养瓶内的贴壁细胞脱落并破碎。再用移液枪吸取PBS缓冲液沿培养瓶底面反复吹洗5次,每次1mL,然后将液体全部转移至离心管,用高速离心机,设置转速为6000r/min,时间6min,制得HepG2的DNA悬浊液。向悬浊液加入蛋白裂解液2mL于55℃孵育过夜,然后加入10mL苯酚-酚-氯仿(25∶24∶1),离心10min,再加入醋酸钠1mL和异丙醇10mL析出DNA,最后用20mL 70%乙醇洗涤、离心、弃上清。本实施例使用的HepG2传代细胞,细胞总数量为1×10
8-OHdG梯度浓度标准使用液制备:本实施例使用的标准8-OHdG抗原是8-OHdG的ELISA试剂盒(上海雅吉生物科技有限公司,人8羟基脱氧鸟苷ELISA试剂盒)中的标准抗原。从ELISA试剂盒中取8-OHdG标准液10μL,定容至10mL,制成1000μg/mL,即1×10
2.传感器构建方法
每次实验前,先对工作电极进行如下处理:用0.5μm和50nm的Al
传感器构建方法原理如图1所示。实验时使用6μL上述石墨烯基底涂抹电极表面,至均匀分散且覆盖完全(借助Nation的成膜性),室温下使石墨烯干燥固定5分钟。然后将修饰电极没入AgNO
3.传感器使用方法
(1)标准曲线
将不同浓度的8-OHdG加到传感器上,37℃孵育60min,PBS洗涤,传感器置于0.1mol/L PBS(pH 8.0)溶液中,用电化学发光分析仪分别测定其ECL信号强度I
(2)检测
将样本加到传感器上,37℃孵育60min,PBS洗涤,传感器置于0.1mol/L PBS(pH8.0)溶液中,用电化学发光分析仪分别测定其ECL信号强度I
上述步骤(1)和(2)中,电化学发光分析仪参数设置如下:
电位设置参数为:正向扫描,初电位0.2V,低电位0.2V,高电位1.25V。
发光设置参数为:放大级数3,光电倍增管高压800V。
以下用实验例的形式对实施例1的传感器有益效果做进一步说明。
实验例1合成纳米材料的表征
采用高分辨透射电镜(HRTEM)对AgNPs(图2-A)和GSH聚集AgNPs之后的复合物(图2-B)的外观形貌进行表征。
由图2-A可知,在透射电镜下AgNPs呈斑点状散在分布,由图2-C,图2-D可以看出其优势分布粒径为10.10nm(23.41%),优势分布电位为-5.06mV。图2-B为AgNPs:GSH复合物,呈圆珠状团聚分布,从图2-E和图2-F可知该复合物优势粒径为68.06nm(31.57%),优势电位分布为-33.89mV。
说明GSH成功的通过共价结合聚集了AgNPs,负电荷增加,可增强复合物与Ru(bpy)
实验例2传感器每层材料叠加后的ECL信号强弱比较
分别在实施例1的基础上,将传感器构建过程中的石墨烯修饰后、电沉积纳米银并泡吸发光体Ru(bpy)
结果如图3所示。图中曲线a是裸电极修饰了Nation分散的石墨烯过后的ECL信号。曲线b是电极表面电沉积一层纳米银颗粒,并泡吸了发光体Ru(bpy)
本实验例的结果说明,AgNPs:GSH复合物可提高ECL信号,能保证抗体及BSA结合后电极仍能产生足够强的ECL信号,提高检测灵敏度。
实验例3标准曲线
取实施例1的传感器,检测不含抗原的缓冲液所得ECL信号值为2421(作为空白对照)。将8-OHdG标准配制液稀释到1×10
实验例4检出限
取实施例1的传感器,测出孵育抗原前的ECL信号,记为I
进行检出限的判定和计算。
实验结果:孵育8-OHdG抗原前,ECL信号I
表2为本方法同其他方法(安玲玲,路毛凤,邓玲玲等.8-羟基脱氧鸟苷在壳聚糖/石墨烯修饰电极上的电化学及DNA氧化损伤检测[J].应用化学,2014,31(2):200-205;刘慧.基于核酸适体的8-羟基脱氧鸟苷光学传感方法研究[D].南华大学,2014.)对8-OHdG检测的检出限的比较。
表2目标ECL免疫传感器检测8-OHdG与其他方法检出限的对比
本实验例结果表明,本发明的传感器检测灵敏度极高。
实验例5精密度
使用实施例1的传感器和方法,检测肝癌细胞提取液(制备方法见实施例1)中8-OHdG浓度。结果如表3所示,测得三次检测均值间相对标准偏差小于5%,说明本发明的传感器和方法具有良好的精密度。
表3目标免疫传感器测定8-OHdG信号均值的精密度
实验例6准确度
取8-OHdG标准液加入检测底液(PBS,pH 8.0)分别稀释至0.01ng/mL、0.1ng/mL、0.2ng/mL、0.5ng/mL、1ng/mL、5ng/mL、10ng/mL然后各取3mL,使用实施例1的传感器和方法进行加标回收检测。三次检测ECL信号分别为1446、1845、2176,扣除孵育含0ng/mL 8-OHdG缓冲底液基底信号后,根据标准方程得结果如表4。可以看出加标量为0.01ng/mL和0.1ng/mL时,回收率在85%-130%之间,加标量为0.2ng/mL-10ng/mL时,回收率在90%-120%之间。
表4目标ECL免疫传感器的加标回收检测
本实验例结果说明:
本发明传感器在检测范围内具有较好的准确度。本方法同其他方法(李栋,张芹,张圣虎等.自制混合型小柱净化-高效液相色谱-串联质谱法同时测定尿液中有机磷酸酯代谢物和8-羟基-2′-脱氧鸟苷[J].色谱,2020,38(6):647-654;杨明岐,袁悦,任建伟等.同位素稀释-亲水作用色谱串联质谱快速测定尿液中8-羟基脱氧鸟苷和可替宁的研究.四川大学学报(医学版),2020,51(1):74-80.)对8-OHdG的检测准确度相比,本发明传感器在0.2ng/mL-10ng/mL较高浓度检测范围具有更好的准确度(加标回收率更接近100%)。
实验例7实际样品检测
使用实施例1的传感器和方法,检测肝癌细胞HepG2提取液(制备方法见实施例1)中8-OHdG浓度。
检测所得ECL信号值分别为419、447、445,与孵育抗原前并扣除缓冲液空白值后ECL信号的差值ΔI分别为2266、2269、2262。因为提取时稀释到了10mL,所以带入标准曲线方程ΔI=2149+342.751gc,得三次检测结果为c
用SPSS软件对三次检测结果与正常细胞内8-OHdG含量做了单样本的t检验,得到双侧检验P值为0.001,则P<0.05,说明检测结果与正常值差异有统计学意义,可以认为用本免疫传感器检测的HepG2细胞内8-OHdG含量远高于正常细胞含量12.03±4.58ng/mL。
肝癌细胞中DNA损伤程度高于正常细胞,其内8-OHdG含量高于正常细胞,因此,本实验例检测结果符合本领域常识。
实验例8方法参数优化
本实验例中,除了已指明以外,未指明的参数与实施例1相同。本实验例同时选择了4个电极进行平行试验,电极编号分别为:4031、4032、GCE1、GCE6。
一、电沉积银修饰层条件优化
实验比较了浸泡吸附和电沉积两种方法固载AgNPs的效果。设置浸泡吸附时间为80s,电沉积圈数为4圈(8seg=80s),其他条件相同。
图5为两种修饰方法的信号结果比较。四组电极使用电沉积法响应信号都比使用浸泡吸附高,由此可知,修饰银使用电沉积方法比浸泡吸附效果更好。
在上述实验数据基础上,进行了电沉积AgNPs圈数优化。设置电沉积圈数(1圈=2seg=20s)优化系列为3圈(6seg)、4圈(8seg)、5圈(10seg)、6圈(12seg)、7圈(14seg)进行检测,结果如图6所示。由四组电极信号修饰结果可知,当电沉积AgNPs圈数(时间)为5圈时,即电沉积时间100s时,四组电极电致发光强度达到拐点。
本部分实验结果表明:对电极进行AgNPs修饰时,电沉积优于浸泡吸附,电极电沉积AgNPs最佳圈数(时间)为5圈。
二、联吡啶钌(Ru(bpy)
设置Ru(bpy)
在此基础上,对Ru(bpy)
本部分结果说明:Ru(bpy)
三、AgNPs:GSH复合物合成比例的优化
配制0.2mol/L的还原型谷胱甘肽(GSH)和1.07mmol/L的AgNP以备用。取一定量的AgNPs材料和一定量的还原型谷胱甘肽4℃混合搅拌反应30min制得复合物,再使用该复合物与电极进行4℃低温冷藏孵育,复合物孵育量为100μL,孵育时间为3-4小时。本次实验按AgNPs:GSH体积比为1∶9、1∶4、1∶2、1∶1、2∶1(物质的量之比依次为1.07∶1800、1.07∶800、1.07∶400、1.07∶200、1.07∶100)进行优化,用四组电极在相同条件下多次试验,实验结果如图9。
由结果可知,当AgNPs:GSH体积比为1∶1时,ECL信号进入平台期,所以确定AgNPs:GSH复合物的体积比为1∶1。
同时对该层的修饰材料进行比较选择,即在Ru(bpy)
本部分结果说明:GSH聚集AgNPs可以明显诱导阳极ECL信号增强。
四、检测底液pH优化
pH值影响着溶液中各物质的带电性,进而影响Ru(bpy)
本部分实验说明:pH=8的缓冲液为最适ECL信号检测用缓冲液。
综上,本发明的免疫传感器借助谷胱甘肽GSH聚集AgNPs(GSH-AgNPs)可增强Ru(bpy)
应当知晓的是,将本发明的免疫传感器中8-OHdG抗体换成其他抗体,同样能用于检测其他物质,并取得相似的效果。
- 一种检测肿瘤标志物的电致化学发光免疫传感器及其应用
- 一种基于NiCo2O4纳米片的热致增敏型甲状腺球蛋白电致化学发光免疫传感器
