一步法新型冠状病毒中和抗体磁性微球检测试剂盒及其应用
文献发布时间:2023-06-19 11:32:36
技术领域
本发明涉及一种新型冠状病毒(SARS-CoV-2)中和抗体的检测,尤其涉及一种一步法新 型冠状病毒中和抗体磁性微球检测试剂盒及其应用,属于临床检验技术领域。
背景技术
由新冠病毒(SARS-CoV-2)引起的新冠肺炎(COVID-19)大流行是一个世纪以 来人类面临的最严峻挑战。新型冠状病毒即“SARS-CoV-2”感染后常见体征有呼吸道 症状、发热、咳嗽、气促和呼吸困难等。在较严重病例中,感染可导致肺炎、严重急 性呼吸综合征、肾衰竭,甚至死亡。
研究表明,冠状病毒S蛋白是病毒毒力的关键因子,是决定病毒毒力、组织嗜性和宿主 范围的关键部分,也是中和抗体和疫苗设计的主要靶标。而评价疫苗接种后的效果,最直接 的检测方法为新冠中和抗体的检测。因为,能识别新冠病毒的S(刺突)蛋白上的RBD区(受 体结合域)的中和抗体,就可以阻断新冠病毒和人细胞上的ACE2受体结合,使得新冠病毒 无法感染人细胞。此外,中和抗体可以与其他免疫成分——例如补体、吞噬细胞和自然杀伤 细胞等——相互作用。这些效应反应都可以帮助清除病毒和被感染的细胞。中和抗体浓度越 高,一般保护作用越好。因此,早期预测疫苗好坏的指标之一,就是看它能诱发人体内产生 多少中和抗体。
传统的检测中和抗体的方法为活病毒或假病毒中和试验。试验方法需要专业细胞培养过 程,对实验等级要求高,周期长、操作复杂,不适合普通接种疫苗人群高通量筛查。
中和抗体滴度可以反映出血液样品中抗体水平的指标,即接种疫苗后人体内免疫应答的 好坏或强弱。随着新型冠状病毒疫苗的上市,对接种新冠疫苗人群和新冠感染后康复人群的 中和抗体评价需要快速、可靠的、稳定、安全的评价方法。目前已有关于新型冠状病毒中和 抗体酶联免疫的竞争抑制检测方法(CN202010919164.X、CN202010952237.5),但上述专 利中公布的实验检测方法均属酶联免疫法,在实验操作中存在操作时间长(2-3小时),手 工操作等缺点。因新冠病毒传染力很强,增加人工操作和反应时间,也相应增加了操作人员 被感染的可能性。此外,因竞争抑制法中,因加样时间和加样间隔的影响,易对最终检测结 果造成假阳结果,会影响最终对中和抗体含量的判断。
磁微粒化学发光技术是将磁性分离技术、化学发光技术、免疫分析技术三者结合起来的 一种新兴分析方法。该技术充分利用了磁性分离技术的快速易自动化性,化学发光技术的高 灵敏度性,以及免疫分析的特异性,是目前最受欢迎的标记免疫分析技术。
现有技术中,经检索以辣根过氧化物酶标记RBD蛋白(HRP-RBD)和重组人ACE2受体蛋 白(ACE2-hFc)之间的相互作用可以被SARS-CoV-2RBD中和抗体阻断为原理,制备有关基于磁微粒化学发光法的一步法新型冠状病毒中和抗体磁性微球检测试剂盒及其应用还未 见报道。
发明内容
针对现有技术的不足,本发明要解决的问题是提供一种一步法新型冠状病毒中和抗体磁 性微球检测试剂盒及其应用。
本发明所述的一步法新型冠状病毒中和抗体磁性微球检测试剂盒,由设在盒体内的偶联 有重组人ACE2受体蛋白(ACE2-hFc)的磁微球、作为阳性对照的RBD中和抗体标准品溶 液、阴性对照、样品稀释液、RBD蛋白(HRP-RBD)酶结合物、20×浓缩洗涤液、发光液构成;
其特征在于:
所述磁微球偶联有浓度为5-100μg/mg的重组人ACE2受体蛋白(ACE2-hFc);该磁性微球的工作浓度为0.2-0.5mg/mL,稀释液为保存液;
所述RBD中和抗体标准品溶液为:样品稀释液稀释的浓度为1000ng/ml的RBD中和抗 体溶液;
所述阴性对照为正常人新冠病毒SARS-CoV-2抗体阴性血清;
所述样品稀释液的配方是:除菌的1000mL纯水中,含NaCl 8g、NaH
所述RBD酶结合物是辣根过氧化物酶标记的重组RBD蛋白(HRP-RBD);HRP标记RBD使用量为其与包被抗原结合恰好饱和的量,该RBD酶结合物使用的效价浓度为1:10000,稀释液为酶结合物稀释液;所述RBD酶结合物的制备方法为:利用过碘酸钠法标记的RBD蛋 白与辣根过氧化物酶的结合物。制备方法不限于此方法,其余蛋白标记方法亦可。
所述20×浓缩洗涤液的配方是:除菌的50mL双蒸水中,含NaCl 8.0g、NaH
所述发光液包括A液和B液,浓度为3.0mmol/L的鲁米诺溶液与0.3mmol/L对碘苯酚溶 液等体积比的混合液命名为A液;浓度为7.5mmol/L的双氧水命名为B液;使用时将A液与B液按体积比1﹕1混合。
上述一步法新型冠状病毒中和抗体磁性微球检测试剂盒中,所述磁微球的制备方法是:
1.1)配制偶联缓冲液:即配制0.01mol/L的MES缓冲溶液,并调整pH值为6.0;
MES 1.95g
纯化水 定容至1000mL
过滤除菌,4℃保存;
1.2)配制洗涤液,洗涤液的配方及制法是:
过滤除菌,4℃保存;
1.3)配制保存液,保存液的配方及制法是:
过滤除菌,4℃保存;
1.4)偶联操作
(1)羧基磁性微球的活化:取10mg羧基磁性微球,加入500μL的EDC/NHS溶液室温下活化30min,磁分离,偶联缓冲液洗涤磁性微球,得活化后的磁性微球;
其中,所述EDC是:1-乙基-(3-二甲基胺基丙基)碳化二亚胺盐酸盐,所述NHS是:N-羟基丁二酰亚胺,其溶液使用偶联缓冲液为溶剂配制,其浓度均为2mg/mL,使用前将EDC 与NHS溶液等体积比混匀即得到EDC/NHS溶液;
(2)羧基磁性微球与ACE2-hFc偶联:向上述活化后的磁性微球中加入浓度为 1-10mg/mL的ACE2-hFc,使磁微球偶联ACE2-hFc的浓度为5-100μg/mg,室温反应3h, 磁分离,洗涤液洗涤,即得免疫磁性微球,加保存液于4℃保存,备用;使用时用保存液稀 释使磁性微球的工作浓度为0.2-0.5mg/mL。
上述一步法新型冠状病毒中和抗体磁性微球检测试剂盒中:所述重组人ACE2受体蛋白 (ACE2-hFc)是利用CHO细胞表达的人ACE2蛋白与人源化Fc融合的重组蛋白;所述RBD蛋白是利用CHO细胞表达的新型冠状病毒SARS-CoV-2全长RBD的重组蛋白;所述的RBD 中和抗体是用来自于测定的新冠康复患者中和抗体可变区序列并与人源化Fc融合,通过CHO 细胞重组表达形成的。
上述一步法新型冠状病毒中和抗体磁性微球检测试剂盒中:所述磁微球偶联有浓度优选 60-100μg/mg的重组人ACE2受体蛋白(ACE2-hFc);该磁性微球的工作浓度优选为0.3-0.5mg/mL,稀释液为保存液。
上述一步法新型冠状病毒中和抗体磁性微球检测试剂盒中,所述酶结合物稀释液的配方 是:除菌的1000mL纯水中,含NaCl 8g、NaH
本发明所述一步法新型冠状病毒中和抗体磁性微球检测试剂盒在检测含新型冠状病毒 中和抗体生物样品中的应用。
其中,检测含新型冠状病毒中和抗体样品优选的方法是:
a)利用全自动磁微粒化学发光分析仪向反应杯中加入样本5μL、HRP-RBD 50uL;
b)再向反应杯中加入浓度为0.2-0.5mg/mL的偶联有重组人ACE2受体蛋白(ACE2-hFc) 的磁微球磁微粒悬浮液50μL、样品稀释液50μL;阳性对照、阴性对照同样操作步骤;
c)混匀后37℃温育15分钟;
d)用磁性分离架或磁性分离器,清洗液洗涤4-5次;
e)每个反应杯中加入发光底物A液和发光底物B液各50μL;
f)混匀后1~5分钟检测发光强度;
g)读取样品、阳性对照、阴性对照的RLU值;
h)SARS-CoV-2中和抗体检测的阳性cutoff和阴性cutoff可以用来解释抑制率;
其中单次检测中阴性对照品及样本的RLU用于计算待测样本血清中的抗体抑制率,阳性 对照品RLU仅用于检测有效性判断;待测样本中抗体抑制率的计算方法如下:
抑制率=(1-样品RLU/阴性对照RLU)×100%
结果判定标准:
抑制率≥20%:阳性,抑制率<20%:阴性。
本发明所述一步法新型冠状病毒中和抗体磁性微球检测试剂盒的应用及该指标在接种新 冠疫苗人群和新冠感染后康复人群的中和抗体评价中的应用。
本发明提供的一步法新型冠状病毒中和抗体磁性微球检测试剂盒是基于磁微粒化学发 光法制备,在检测过程上全部实现机器自动化,具有高通量、灵敏度高、特异性好、重复性 好等特点,可在生物安全二级实验室或普通实验室开展的快速中和抗体检测方法,有利于疫 病流行病学调查、免疫抗体监测以及疫苗免疫效力评价。
本发明所述一步法新型冠状病毒中和抗体磁性微球检测试剂盒的检测原理为:模仿病毒 的中和过程,HRP-RBD和ACE2-hFc之间的相互作用可以被SARS-CoV-2RBD中和抗体阻 断。用重组人ACE2受体蛋白(ACE2-hFc)包被磁性微球,辣根过氧化物酶标记RBD蛋白(HRP-RBD)制备酶结合物,在一步反应中,将样本、HRP-RBD、重组人ACE2受体蛋白 (ACE2-hFc)包被磁性微球利用全自动磁微粒免疫分析仪依次加入至反应杯内,37℃温浴 15分钟,经洗涤后加入发光液,温浴3分钟,读取发光值。发光值与样本中RBD中和抗体 的有效浓度成反比。
本发明的有益效果是:提供了一种基于磁微粒化学发光法检测新型冠状病毒中和抗体的 产品及更便捷的检测方法,该方法具有稳定性高、灵敏度高、选择性强,检测速度快、费用 低廉、易于操作等优点。克服了现有技术中检测新型冠状病毒中和抗体时,操作复杂,操作 时长,结果易受加样时间影响等缺点,将操作时间由120分钟缩短至20分钟。具有极大的 临床应用前景。
附图说明
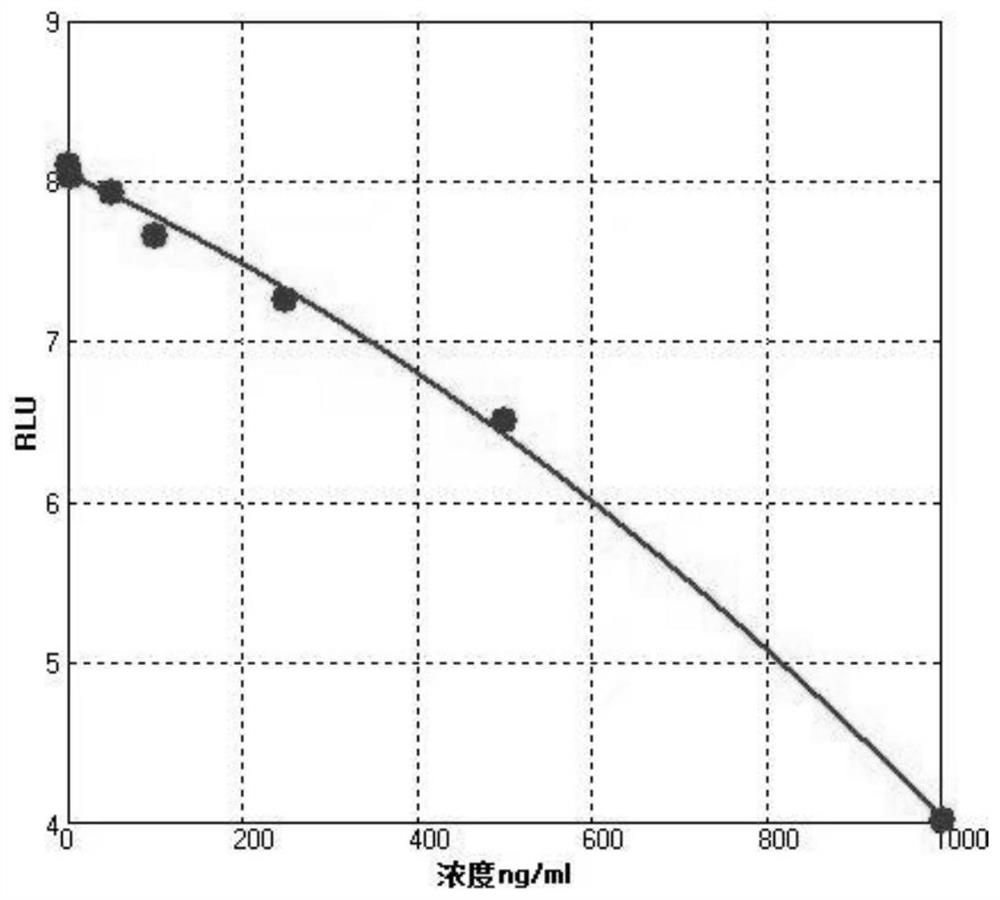
图1:本发明所述一步法新型冠状病毒中和抗体磁性微球检测试剂盒拟合曲线。
具体实施方式
下面结合具体附图和实施例对本发明内容进行详细说明。如下所述例子仅是本发明的较 佳实施方式而已,应该说明的是,下述说明仅仅是为了解释本发明,并非对本发明作任何形 式上的限制,凡是依据本发明的技术实质对实施方式所做的任何简单修改,等同变化与修饰, 均属于本发明技术方案的范围内。
下述实施例中,所使用的材料、试剂等,如无特殊说明,均从商业途径得到。
实施例1:本发明所述一步法新型冠状病毒中和抗体磁性微球检测试剂盒的制备
(一)磁微球的制备:
1.1)配制偶联缓冲液:即配制0.01mol/L的MES缓冲溶液,并调整pH值为6.0;
MES 1.95g
纯化水 定容至1000mL
过滤除菌,4℃保存;
1.2)配制洗涤液,洗涤液的配方及制法是:
过滤除菌,4℃保存;
1.3)配制保存液,保存液的配方及制法是:
过滤除菌,4℃保存;
1.4)偶联操作
(1)羧基磁性微球的活化:取10mg羧基磁性微球,加入500μL的EDC/NHS溶液室温下活化30min,磁分离,偶联缓冲液洗涤磁性微球,得活化后的磁性微球;
其中,所述EDC是:1-乙基-(3-二甲基胺基丙基)碳化二亚胺盐酸盐,所述NHS是:N-羟基丁二酰亚胺,其溶液使用偶联缓冲液为溶剂配制,其浓度均为2mg/mL,使用前将EDC 与NHS溶液等体积比混匀即得到EDC/NHS溶液;
(2)羧基磁性微球与ACE2-hFc偶联:向上述活化后的磁性微球中加入浓度为1-10mg/mL 的ACE2-hFc,使磁微球偶联ACE2-hFc的浓度为5-100μg/mg,室温反应3h,磁分离,洗涤 液洗涤,即得免疫磁性微球,加保存液于4℃保存,备用;使用时用保存液稀释使磁性微球 的工作浓度为0.2-0.5mg/mL。
(二)试剂盒溶液的配制:
样本稀释液配方是:
调整pH为7.4,过滤除菌,4℃保存;
20×浓缩洗涤液的配方是:除菌的50mL双蒸水中,含NaCl 8.0g、NaH
阴性对照为正常人新冠病毒SARS-CoV-2抗体阴性血清;
RBD中和抗体标准品溶液(阳性对照)为:样品稀释液稀释的浓度为1000ng/ml的RBD 中和抗体溶液;
重组人ACE2受体蛋白制备方法为利用CHO细胞表达的人ACE2蛋白与人源化Fc融合的重组ACE2-hFc;制备过程为生物领域人员熟知方法。
重组人ACE2-hFc蛋白的包被量采用棋盘法依照灵敏度,检测范围为指标进行选择。
RBD蛋白制备方法为利用CHO细胞表达的新型冠状病毒SARS-CoV-2全长RBD的重组蛋白;制备过程为生物领域人员熟知方法。
RBD中和抗体制备方法为用来自于测定的新冠康复患者中和抗体可变区序列并与人源 化Fc融合,通过CHO细胞重组表达形成的。
RBD酶结合物的制备方法为:利用过碘酸钠法标记的RBD蛋白与辣根过氧化物酶(HRP) 的结合物。制备方法不限于此方法,其余蛋白标记方法亦可。
HRP标记的新冠刺突蛋白RBD使用量的优化:在ACE2-hFc的磁微球溶液中加入不同浓 度的HRP标记的RBD,选择HRP标记RBD使用量为其与包被抗原结合恰好饱和的量。优 选的使用效价浓度为1:10000。
酶结合物稀释液的配方是:除菌的1000mL纯水中,含NaCl 8g、NaH
发光液包括A液和B液,浓度为3.0mmol/L的鲁米诺溶液与0.3mmol/L对碘苯酚溶液等 体积比的混合液命名为A液;浓度为7.5mmol/L的双氧水命名为B液;使用时将A液与B 液按体积比1﹕1混合。
(三)一步法新型冠状病毒中和抗体磁性微球检测试剂盒,由设在盒体内的偶联有重组 人ACE2受体蛋白(ACE2-hFc)的磁微球、作为阳性对照的RBD中和抗体标准品溶液、阴性对照、样品稀释液、RBD蛋白(HRP-RBD)酶结合物、20×浓缩洗涤液、发光液构成;
其中:所述磁微球偶联有浓度为5-100μg/mg的重组人ACE2受体蛋白(ACE2-hFc);该磁性微球的工作浓度为0.2-0.5mg/mL,稀释液为保存液;优选:所述磁微球偶联有浓度为60-100μg/mg的重组人ACE2受体蛋白(ACE2-hFc);该磁性微球的工作浓度为0.3-0.5mg/mL,稀释液为保存液。所述RBD酶结合物是辣根过氧化物酶标记的重组RBD蛋白(HRP-RBD); HRP标记RBD使用量为其与包被抗原结合恰好饱和的量,该RBD酶结合物使用的效价浓度 为1:10000,稀释液为酶结合物稀释液。
实施例2:本发明所述一步法新型冠状病毒中和抗体磁性微球检测试剂盒在检测含新型 冠状病毒中和抗体生物样品中的应用。
其中,检测含新型冠状病毒中和抗体样品优选的方法是:
a)利用全自动磁微粒化学发光分析仪向反应杯中加入样本5μL、HRP-RBD 50uL;
b)再向反应杯中加入浓度为0.2-0.5mg/mL的偶联有重组人ACE2受体蛋白(ACE2-hFc) 的磁微球磁微粒悬浮液50μL、样品稀释液50μL;阳性对照、阴性对照同样操作步骤;
c)混匀后37℃温育15分钟;
d)用磁性分离架或磁性分离器,清洗液洗涤4-5次;
e)每个反应杯中加入发光底物A液和发光底物B液各50μL;
f)混匀后1~5分钟检测发光强度;
g)读取样品、阳性对照、阴性对照的RLU值;
h)SARS-CoV-2中和抗体检测的阳性cutoff和阴性cutoff可以用来解释抑制率;
其中单次检测中阴性对照品及样本的RLU用于计算待测样本血清中的抗体抑制率,阳性 对照品RLU仅用于检测有效性判断;待测样本中抗体抑制率的计算方法如下:
抑制率=(1-样品RLU/阴性对照RLU)×100%
结果判定标准:
抑制率≥20%:阳性,抑制率<20%:阴性。
实施例3:本发明所述一步法新型冠状病毒中和抗体磁性微球检测试剂盒的线性、准确 性、精密度的检测
1)试剂盒的线性
(1)定标品配制:用样品稀释液分别将RBD中和抗体稀释至10ng/mL、20ng/mL、50ng/mL、 100ng/mL、250ng/mL、500ng/mL、1000ng/mL。
(2)定标品测试:将配制好的定标品通过实施例2所述方法检测,得到RLU值;
(3)标准曲线的建立:根据校准品的制备浓度和RLU值采用合适的拟合方式生成该批试 剂的校准曲线。见表1和图1。
表1试剂盒线性
2)精密性试验:
以100ng/mL RBD中和抗体标准品平行测试10次,结果统计见表2。
表2:精密性试验结果
精密性:CV%=3.02%
实施例4:本发明所述一步法新型冠状病毒中和抗体磁性微球检测试剂盒在注射疫苗临 床样本筛查中的应用
使用200例完成临床注射新冠疫苗免疫样本与500例未注射新冠疫苗样本,与临床细胞 中和实验比对,计算本发明试剂盒测定结果与中和实验结果符合或差异程度的统计学指标, 评价方法如表3。
表3本发明试剂盒与细胞中和试验对比
灵敏度计算:190/(190+7)×100%=96.4%。
特异性计算:499/(499+4)×100%=99.2%
总符合率:(190+499)/(190+7+499+4)×100%=98.4%
以上试验说明,本发明提供的检测新型冠状病毒中和抗体的试剂盒及其检测方法,与中 和抗体检测金标准有很好的一致性,可以用于接种新型冠状病毒疫苗后中和抗体产生评估, 其灵敏度、特异性均较好,利于临床准确评估疫苗效果。
- 一步法新型冠状病毒中和抗体磁性微球检测试剂盒及其应用
- 一种包含新型冠状病毒突变抗原的中和抗体检测试剂盒及其应用
