一种检测DNA甲基化转移酶的荧光生物传感器及其制备与应用
文献发布时间:2023-06-19 11:47:31
技术领域
本发明涉及荧光生物传感器及生物标志物检测技术领域,特别是涉及一种检测DNA甲基化转移酶的荧光生物传感器及其制备与应用。
背景技术
DNA甲基化是指DNA甲基化转移酶以S腺苷甲硫氨酸(SAM)作为甲基供体对基因组内、DNA核酸序列上CpG二核苷酸胞嘧啶的5’端碳原子进行催化从而通过共价键结合一个甲基基团的表观遗传学修饰方式。DNA甲基化在机体X染色体失活,基因组印迹和基因表达改变等遗传调控方面发挥重要功能。DNA甲基化是真核生物中常见的一种碱基共价修饰方式,也是哺乳动物的主要表观遗传学形式,DNA甲基化在重要的遗传调控如X染色体失活,基因组印迹和基因表达中起着至关重要的作用,而DNA甲基化转移酶可建立和维持基因组DNA序列甲基化状态的稳定。DNA甲基化转移酶是临床检测的重要生物标志物,相关研究表明多种遗传疾病和癌症等的发生发展都与其有着密切的联系。
传统的甲基化转移酶检测方法主要有HPLC、甲基化特异性PCR、放射标记法等,以上方法在检测中一般涉及实验操作繁杂、实验危害性较大、实验设备昂贵、样品制备过程复杂和假阳性高等缺点,因此我们关注到更多快速、简便的检测方法,如比色法、电化学检测法、电化学发光检测法、化学发光检测法等,这些方法都提高了DNA甲基化转移酶的检测效果,但检测的不稳定性、易受周围环境因素干扰等也影响了检测的准确性。
发明内容
鉴于以上所述现有技术的缺点,本发明的目的在于提供一种检测DNA甲基化转移酶的荧光生物传感器及其制备与应用,用于解决现有技术中DNA甲基化转移酶的检测方法稳定性和特异性不好等问题。
为实现上述目的及其他相关目的,本发明第一方面提供一种检测DNA甲基化转移酶的荧光生物传感器,包括对称双环哑铃(SDRDs)和3D四面体荧光支架(DTFS)结构,所述对称双环哑铃为含5’-GATC-3’DNA甲基化位点的对称型哑铃结构,所述位点能被Dam甲基化转移酶特异性识别,在DNA甲基化转移酶Dam甲基化转移酶催化下对称双环哑铃形成甲基化双链,再经酶切反应形成两半结构完全一致的单链哑铃环;所述3D四面体荧光支架由4条长链合成,所述4条长链的序列如SEQ ID NO.2-5所示,所述四面体每个顶端含有相同的发夹结构,同时修饰有荧光基团与荧光淬灭基团,荧光基团和荧光淬灭基团靠近而导致荧光淬灭,而被剪切的两半单链哑铃环能与四面体各顶端的发夹结合产生荧光,不同浓度的Dam甲基转移酶催化反应可产生不同强度的荧光信号。
进一步,所述对称双环哑铃的序列如SEQ ID NO.1所示。
进一步,所述DNA甲基化转移酶为Dam甲基化转移酶。
进一步,所述酶切反应使用的剪切酶为Dpn I核酸内切酶。
进一步,所述荧光基团为FAM,所述荧光淬灭基团为BHQ1。
本发明第二方面提供一种检测DNA甲基化转移酶的荧光生物传感器的制备方法,包括如下步骤:
(1)制备对称双环哑铃(SDRDs):采用如SEQ ID NO.1所示序列的哑铃单链,所述哑铃单链5’端修饰有磷酸基团P、3’端连接有OH,在T4 DNA连接酶的作用下,5’端磷酸基团P与3’端OH连接形成封闭环,连接端口处为5’-GACT-3’DNA甲基化位点,所述位点为DNA甲基化转移酶的识别位点;
(2)3D四面体荧光支架(DTFS):采用如SEQ ID NO.2-5所示序列的4条长链合成3D四面体荧光支架(DTFS),所述四面体四角末端修饰有荧光基团和荧光淬灭基团。
进一步,所述步骤(1)中,所述DNA甲基化转移酶为Dam甲基化转移酶。
进一步,所述步骤(1)中,对称双环哑铃(SDRDs)的制备方法包括如下步骤:取哑铃单链干粉,用TE缓冲液溶解,再加入10×T4 DNA连接酶反应缓冲液,进行反应,再加入T4DNA连接酶,反应使哑铃成环。
可选地,所述步骤(1)中,加入10×T4 DNA连接酶反应缓冲液后,先于95℃加热5分钟,再于37℃反应30分钟。
可选地,所述步骤(1)中,加入T4 DNA连接酶后,先于16℃反应1小时,再于70℃反应10分钟,使哑铃成环。
可选地,所述步骤(1)中,当哑铃环形成后,加入核酸外切酶I和核酸外切酶III于37℃反应1小时,再于90℃反应30分钟使核酸外切酶完全灭活,以保证体系中只存在哑铃环,避免存在不成环单双链。
进一步,所述步骤(2)中,3D四面体荧光支架(DTFS)的合成方法包括如下步骤:将4条长链的干粉分别用TE缓冲液溶解,在95℃加热后,于室温下放置使发夹完全形成后;然后将每条长链的溶液与TM缓冲液一起充分混匀,于95℃反应,然后快速降至4℃,孵育,最后取出置于冰上备用。
可选地,所述步骤(2)中,95℃下加热和/或反应时间为5分钟,孵育时间为30分钟。
进一步,所述步骤(2)中,在合成3D四面体荧光支架时,需要避光操作。
进一步,所述步骤(2)中,所述荧光基团为FAM,所述荧光淬灭基团为BHQ1。
进一步,所述荧光生物传感器的检测范围为0.002U/mL-100U/mL,最低检测限为0.00036U/mL。
本发明第三方面提供一种如第一方面所述的荧光生物传感器和/或如第二方面所述方法制备得到的荧光生物传感器在检测DNA甲基化转移酶上的应用。
本发明第四方面提供一种DNA甲基化转移酶检测方法,采用第一方面所述的荧光生物传感器和/或第二方面所述方法制备得到的荧光生物传感器,所述方法包括如下步骤:取对称双环哑铃,加入DNA甲基化转移酶、S腺苷甲硫氨酸(SAM),进行甲基化反应,然后进行DNA甲基化特异性酶切反应;然后在酶切反应得到的产物中加入由3D四面体荧光支架(DTFS)配制成的荧光检测体系,避光反应,然后检测荧光信号。
进一步,所述DNA甲基化转移酶为Dam甲基转移酶。
进一步,所述荧光检测体系中,3D四面体荧光支架(DTFS)的浓度为0.02-0.2μM,优选为0.06-0.2μM,更优选为0.1μM。
进一步,所述DNA甲基化转移酶浓度为0.002-100U/mL,优选为0.008-4U/mL,更优选为0.002-0.01U/mL。
可选地,当DNA甲基化转移酶浓度在0.008-4U/mL范围内时,荧光强度(y)与DNA甲基化转移酶浓度(x)的关系方程为y=33.98x+266.55,相关系数为0.9931;当DNA甲基化转移酶浓度在0.002-0.01U/mL范围内时,荧光强度(y)与DNA甲基化转移酶浓度(x)的关系方程为y=90.79x+388.26,相关系数为0.9891。
进一步,所述甲基化反应在10×Dam甲基转移酶缓冲液中进行。
进一步,所述甲基化反应时间为30-120分钟,优选为45-90分钟,更优选为60分钟。
进一步,所述DNA甲基化特异性酶切反应使用的剪切酶为Dpn I核酸内切酶;可选地,所述Dpn I核酸内切酶的浓度为4-12U,优选为6-10U,更优选为8U。
进一步,所述酶切反应时间为30-120分钟,优选为45-90分钟,更优选为60分钟。
进一步,所述避光反应时间(即哑铃与四面体的结合时间)为15-120分钟,优选为30-90分钟,更优选为60分钟。
进一步,所述甲基化反应、酶切反应、避光反应的反应温度均为37℃。
本发明第五方面提供一种如第一方面所述的荧光生物传感器和/或如第二方面所述方法制备得到的荧光生物传感器在筛选MTase抑制剂上的应用。
进一步,所述MTase抑制剂为5-氟尿嘧啶。
如上所述,本发明的检测DNA甲基化转移酶的荧光生物传感器及其制备与应用,具有以下有益效果:
本发明设计了一种基于对称双环哑铃辅助3D四面体空间结构的荧光生物传感器进行超灵敏检测DNA甲基转移酶(Dam甲基转移酶),实验合成含5’-GATC-3’DNA甲基化位点的对称型哑铃结构,该位点被Dam甲基化转移酶特异性识别,催化后形成甲基化双链,再进行Dpn I酶切反应使之形成结构完全一致的两半哑铃环,而荧光载体3D四面体荧光支架经4条长链快速合成,四面体每个顶端含有相同发夹同时修饰荧光基团与淬灭基团,荧光被淬灭,哑铃被剪切后与四面体各顶端发夹结合荧光产生,哑铃剪切后两单链均可与四面体4个顶端荧光发夹结合,提高了3D四面体荧光发夹的识别效率,因而本方案实现从0.002-100U/mL的检测范围和最低检测浓度达到0.00036U/mL。同时,M.SssI甲基转移酶与Hpa II甲基化限制性内切酶特异性实验,血清加标实验与5-氟尿嘧啶抑制实验也为Dam甲基转移酶的的早期灵敏检测、癌症的早期诊断治疗提供了至关重要的参考价值。
附图说明
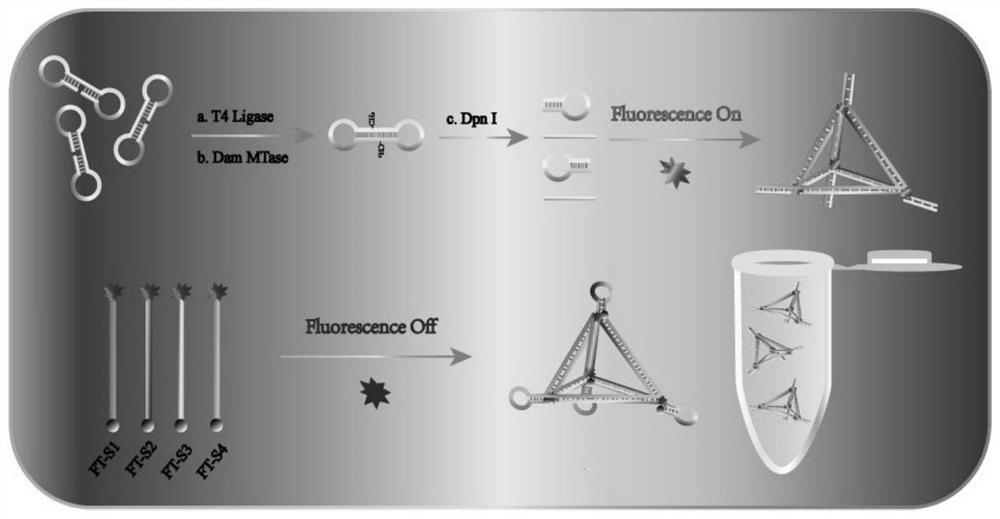
图1显示为本发明中基于对称双环哑铃辅助3D四面体空间结构支撑的荧光放大效应超灵敏检测DNA甲基化转移酶原理图。
图2显示为本发明中3D四面体的合成表征图,其中(A)8%native PAGE成像图,(B)AFM的3D四面体结构图。
图3显示为本发明中验证生物传感器构建的可行性结果图。
图4显示为本发明中实验中重要参数的优化结果图。
图5显示为本发明中The SDRDs辅助DTFS检测Dam甲基转移酶的浓度分析结果图。
图6显示为本发明中的特异性分析结果图。
图7显示为本发明中5-氟尿嘧啶抑制剂浓度变化对100U/mL Dam MTase活性的抑制情况结果图。
具体实施方式
以下通过特定的具体实例说明本发明的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本发明的其他优点与功效。本发明还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本发明的精神下进行各种修饰或改变。
检测DNA甲基化转移酶的荧光生物传感器及其制备与应用1实验部分
1.1试剂
Dam甲基转移酶、10×Dam甲基转移酶缓冲液、SAM,Dpn I甲基化限制性内切酶、HpaII甲基化限制性内切酶、10×CutSmart缓冲液,T4 DNA连接酶、10×T4 DNA连接酶反应缓冲液和核酸外切酶I(E.coli),核酸外切酶III(E.coli),CpG甲基转移酶(M.SssI)、1XNEBuffer 2均购买自NEB(北京)有限公司。5-氟尿嘧啶买自索莱宝生物公司。TE缓冲液,三(羟甲基)氨基甲烷(Tris)粉末,氯化镁六水(MgCl2·6H2O)试剂,过硫酸铵(APS),丙烯酰胺/甲叉双丙烯酰胺30%溶液(29∶1),N,N,N′,N′-四甲基乙二胺(TEMED),5×TBE缓冲液均购买自生工生物公司。1000DNA Marker,20bp DNA Ladder和6×loading缓冲液均购买自Takara生物公司。第三代Gelred核酸染液购自北京聚合美生物科技有限公司。荧光修饰核苷酸序列合成于深圳华大基因科技有限公司。普通寡核苷酸序列均合成于生工生物公司。实验用超纯水(18.2MΩ·cm)取自于密理博净水系统(Millipore公司)。
本实验中应用的相关核苷酸序列如表1所示。
表1核苷酸序列表
1.2仪器与设备
荧光检测在Cary Eclipse荧光分光光度计(安捷伦公司)上进行,激发波长为492nm,发射波长范围为505nm-650nm,激发带宽和发射带宽均为5nm。石英荧光比色皿光程为1.0cm,检测量为100μL。实验所有温控、加热实验均在T100热循环仪(Bio-Rad公司)中进行。DNA四面体发夹形成于HH-ZK420智能恒温水箱(予华仪器公司)。DYY-6C电泳槽购自北京六一仪器厂,电泳成像在ChemDoc XRS凝胶成像系统(Bio-Rad公司)中进行。寡核苷酸序列干粉溶解在Thermo Heraeus Fresco14高速离心机(赛默飞世尔科技公司)中预4℃离心。原子力显微镜成像在Dimension Icon仪器(德国布鲁克公司)进行。
1.3 3D四面体(DTS)合成
3D四面体(DTS)合成过程如下:首先,将DTS的4条链干粉在已预冷4℃高速离心机中以12000g离心10分钟后置于冰上,准确加入一定量TE缓冲液反复震旋3次使其充分溶解至100μM,在95℃水浴箱中加热5分钟后过夜将至室温使发夹完全形成后-20℃备用。然后每条链取0.5μL和48μL TM缓冲液(20mM Tris和50mM MgCl2·6H2O,pH=8.0)充分混匀后放入T100热循环仪中95℃反应5分钟,然后快速降至4℃孵育30分钟,最后取出置于冰上备用。合成3D荧光四面体时同时避光操作。
DTS结构的成功合成在8%native PAGE和原子力显微镜(AFM)中进行表征。
1.4 3D四面体(DTS)合成的电泳表征
已溶解的干粉DTS各单链分别稀释到1μM,取3条链用TM缓冲液分别合成0.1μM的DTS123,DTS124,DTS134,DTS234,4条链合成DTS1234,以验证DTS成功合成。同时单链稀释为0.1μM,取各稀释0.1μM单链10μL,已合成的0.1μM DTS123,DTS124,DTS134,DTS234,DTS123410μL,加2μL 6×loading buffer,混匀加入电泳槽,设置电压100V,电泳35分钟,取下凝胶于50mL 1×TBE缓冲液中加2μL Gelred核酸染液充分染色50分钟后成像。
1.5荧光生物传感器构建
反应哑铃产物制备,哑铃单链5’端修饰磷酸基团P,结构形成时可与3’端OH连接形成环。首先用TE缓冲液溶解干粉成100μM在-20℃保存,实验时取2μL哑铃和4μL 10×T4 DNA连接酶反应缓冲液配制40μL反应液,于95℃反应5分钟后随即37℃反应30分钟,然后加入100U的T4 DNA连接酶,于16℃反应1小时,70℃反应10分钟使哑铃成环,为保证不成环单双链的影响,加入1μL核酸外切酶I和1uL核酸外切酶III 37℃反应1小时,90℃反应30分钟使核酸外切酶完全灭活,此时体系中只存在哑铃环。
DNA甲基化反应,取10μL已形成哑铃环反应产物配制总100μL反应体系,体系中Dam甲基转移酶反应浓度为100U/mL,SAM浓度为160μM,及反应在10×Dam甲基转移酶缓冲液中完成,充分混匀后37℃反应1小时,接下来DNA甲基化特异性酶切反应,取50μL反应产物配制100μL反应体系,加入10μL 10×CutSmart缓冲液和8U Dpn I核酸内切酶,混匀后37℃同样充分反应1小时。DNA荧光四面体制备时应避光且-20℃保存,配制100μL荧光检测体系,取80μL经过Dpn I酶切后的产物加入10μL 1μM的DNA荧光四面体,避光混匀后37℃反应1小时后完成并尽快检测。
2结果及讨论
2.1荧光生物传感器的构建原理
图1显示为基于对称双环哑铃辅助3D四面体空间结构支撑的荧光放大效应超灵敏检测DNA甲基化转移酶原理图。
如图1所示,本实验所构建对称双环哑铃(SDRDs)辅助3D四面体荧光支架(DTFS)结构的荧光信号放大体系由两部分构成。首先对称哑铃环的制备,本实验中设计的哑铃环结构为5’端修饰P的40个碱基寡核苷酸单链,单链分为两部分20个碱基,形成哑铃环结构后,可成对称结构,在T4 DNA连接酶的作用下,5’端P与3’端OH连接可形成封闭环,连接端口处为5’-GACT-3’,此为Dam甲基转移酶的识别位点,没有T4 DNA连接酶的催化连接,将不能进行后续的甲基化反应。当哑铃环形成后,加入核酸外切酶I和核酸外切酶III消除其他干扰链的影响,并90℃完全灭活且不影响环的形成。加入DNA甲基转移酶,在SAM的催化作用下,甲基结合到双链5’-GACT-3’位点上,再加入Dpn I核酸内切酶对其识别剪切,可形成两部分完全一样均为20个碱基的链。
接着合成DTFS,该四面体支架由4条链合成,每条链共91碱基且分为两部分,四面体部分为55个碱基,各17碱基与其他链可进行碱基互补配对紧密形成四面体结构。四面体末端部分为相同的发夹结构,3D四面体四角末端修饰FAM荧光基团和BHQ1荧光淬灭基团,荧光四面体形成时经发夹的有效设计,FAM荧光基团和BHQ1荧光淬灭基团靠近不产生荧光,而当被剪切的哑铃单链出现时又可快速与四面体发夹杂交打开发夹极大地产生荧光信号,不同浓度的Dam甲基转移酶催化反应可产生不同强度的荧光信号。
2.2 3D四面体(DTS)的合成表征
DTS结构在电泳与原子力显微镜(AFM)中的表征。
图2显示为3D四面体的合成表征,其中(A)8%native PAGE成像图,(B)AFM的3D四面体结构图。
如图2A所示,8%native PAGE电泳中不同目标产物的分子量差异充分展示了DTS的成功合成,从左往右依次是泳道M为1000bp DNA marker,泳道1-4依次是DTS 4条单链DTFS-1、DTFS-2、DTFS-3和DTFS-4,而泳道5为DTFS-123,3条链成功形成的三面体,分子量却小于泳道9的DTFS-1234,为完全成功合成的DTS,以上单链、复合物浓度均为0.1μM。图2B的AFM中超清结构箭头标记为四面体的立体结构。
2.3荧光生物传感器可行性分析
基于对称哑铃(SDRDs)辅助3D四面体荧光支架(DTFS)的荧光策略检测DNA甲基转移酶,通过不同的荧光光谱变化进行验证。
图3显示为验证荧光生物传感器构建的可行性的结果图。(A)SDRDs辅助DTFS检测Dam甲基转移酶的荧光强度变化:单纯合成DTFS的荧光强度(a),SDRDs与DTFS在无Dam甲基转移酶的催化和Dpn I内切酶的识别剪切作用下反应的荧光强度(b),SDRDs在无Dam甲基转移酶催化,而在Dpn I核酸内切酶的作用下与DTFS进行反应后的荧光强度(c),SDRDs在Dam甲基转移酶催化和无Dpn I核酸内切酶的作用下与DTFS反应的荧光强度(d),SDRDs经Dam甲基转移酶催化和Dpn I核酸内切酶酶切作用后与DTFS结合的荧光强度(e)。(B)SDRDs的12%PAGE电泳结果:泳道M,20bp DNA Ladder。泳道1,未加核酸外切酶的SDRDs形成。泳道2,加入核酸外切酶消除干扰链影响的SDRDs。泳道3,在加入Dam甲基转移酶和Dpn I核酸内切酶后SDRDs被完全催化剪切。(C)哑铃环成功合成的AFM图。
如图3A,曲线a为只有DTFS存在时,荧光发夹没有被打开,无明显荧光产生,而曲线b为哑铃环形成后,无Dam甲基转移酶的催化作用和Dpn I内切酶的识别剪切直接与DTFS结合,此时并无强荧光信号产生,曲线c为哑铃环在无Dam甲基转移酶的催化作用但加入Dpn I酶进行剪切,然后直接与已合成的DTFS进行反应,完整的哑铃环不能打开荧光发夹,极微量的单链哑铃未形成环可与发夹反应,产生微弱荧光信号但不影响高信噪比F/F0产生,较高的信噪比使实验有较好的可行性与稳定性。而曲线d哑铃环形成后在经过Dam甲基转移酶催化但不加入Dpn I核酸内切酶反应也不能形成与3D四面体荧光支架反应的单链因此无荧光信号的产生,最后如曲线e,当Dam甲基转移酶催化和Dpn I核酸内切酶都进行反应时,剪切哑铃可与3D四面体荧光支架结合,于是产生了极高的荧光信号,验证了对称双环哑铃辅助3D荧光四面体体系的良好可行性。
图3B和图3C的表征分别为哑铃环的12%native PAGE和AFM成像结果,表示在酶的催化作用下对称哑铃环成功合成。图3B显示,泳道M为20bp DNA Ladder,泳道1为哑铃单链在T4 DNA连接酶的作用下形成环,而泳道2为加入核酸外切酶消除微量非特异性链的影响后的哑铃环,同时证明哑铃环没有形成成功时加入核酸外切酶将没有条带产生,最后泳道3为哑铃环在加入Dam甲基转移酶和Dpn I核酸内切酶后被完全识别剪切。图3C为哑铃的AFM成像结果,无链状细环结构证明哑铃的成功合成。
2.4实验条件优化
对实验中重要条件进行优化。图4显示了实验中重要参数的优化结果。(A)3D四面体荧光支架的浓度优化。(B)3D四面体荧光支架与酶切哑铃环的反应时间优化。(C)Dpn I核酸内切酶浓度优化。(D)Dpn I核酸内切酶酶切时间优化。(E)Dam甲基转移酶催化反应时间优化。
3D四面体荧光支架(DTFS)的稳固空间结构在捕获剪切哑铃单链起着重要作用,同时又要保证检测的高效使非特异性荧光信号最低,达到最佳信噪比F/F0,如图4A所示,首先对四面体浓度进行优化,随着浓度增加,荧光信号逐渐增强,当浓度达到0.1μM时荧光强度最高,与0.2μM哑铃环剪切后双倍浓度哑铃单链与0.1μM四面体充分结合的结果吻合,因此当荧光四面体支架浓度逐渐增加,检测F/F0降低,荧光四面体浓度越高,背景干扰信号也越高,0.1μM DTFS被选取为最佳实验检测浓度,F0为无Dam甲基转移酶时的空白荧光信号。
Dpn I核酸内切酶剪切后哑铃单链与荧光四面体的杂交时间在背景干扰最小的情况下进行高效检测也至关重要,如图4B所示,当哑铃单链与四面体在均相溶液中结合时快速反应产生荧光信号,时间优化设置15分钟、30分钟、45分钟、60分钟、90分钟和120分钟进行反应,15分钟时该反应即可发生,当反应时间达到60分钟时,产生了最强荧光,即F/F0最高值,继续增加反应时间荧光信号无明显变化,表明反应已完成。因此选取60分钟作为哑铃与四面体最佳结合时间。
Dpn I核酸内切酶对对称哑铃的剪切效率起着重要作用,哑铃环的充分剪切影响着Dam甲基转移酶的超灵敏检测,而酶的浓度过高也影响链的剪切效率,如图4C所示,不断增加Dpn I核酸内切酶浓度,使的荧光强度越来越高,当链浓度达到8U时,荧光信号稳定最高值,再增加浓度荧光不变或减低,因此8U为实验最佳Dpn I核酸内切酶剪切浓度。
酶浓度固定时Dpn I酶切时间也被优化,如图4D所示,随着剪切时间增加,哑铃剪切单链与荧光四面体结合率增加,产生逐渐高的荧光信号,当Dpn I酶切时间仅达到60分钟时,F最高,继续增加剪切时间,荧光强度无明显变化,因此选取60分钟为最佳反应时间进行Dam甲基转移酶检测。
最后,Dam甲基转移酶的充分反应对浓度检测起着至关重要的作用,如图4E所示,当反应时间达到60分钟时,荧光强度达到最高值,继续增加时间,荧光强度无明显变化,60分钟为Dam甲基转移酶催化反应最佳时间,无需再进行长时间反应以免产生高背景信号干扰。
以上实验参数为进行酶靶标检测时实验中的重要条件。在选定的优化条件下,实现检测靶标仅耗时3小时,充分体现本方案高效快速检测的优势。
2.5荧光生物传感器的灵敏度分析
在对相关重要条件进行优化后,对Dam甲基转移酶浓度进行线性分析。图5显示了The SDRDs辅助DTFS检测Dam甲基转移酶的浓度分析结果。(A)不同浓度检测的荧光光谱:0、0.002、0.004、0.006、0.008、0.01、0.05、0.1、0.5、1、2、4、6、8、10、25、100U/mL。(B)不同浓度Dam甲基转移酶检测的荧光散点图。(C)酶检测线性分析结果:0.008、0.01、0.05、0.1、0.5、1、2、4U/mL。(D)酶检测线性分析结果:0.002、0.004、0.006、0.008、0.01U/mL。误差棒为三次平行实验的标准偏差。
如图5A所示的不同浓度对应的各荧光光谱显示,稀释Dam甲基转移酶,当其浓度分别为0U/mL,0.002U/mL,0.004U/mL,0.006U/mL,0.008U/mL,0.01U/mL,0.05U/mL,0.1U/mL,0.5U/mL,1U/mL,2U/mL,4U/mL,6U/mL,8U/mL,10U/mL,25U/mL,100U/mL时进行检测,结果显示,随着酶浓度的增加,荧光强度也逐渐增加。
图5B将荧光强度值F与目标浓度做出相应关系图,而其中荧光强度在0.002-100U/mL的浓度呈现正向趋势变化,其中在0.008-4U/mL范围实现相关系数0.9931及一次函数方程y=33.98x+266.55,同时根据3σ规则:3倍空白值标准偏差加上空白信号值得出最低检测限为0.00036U/mL,而在0.002-0.01U/mL范围实现相关系数0.9891及一次函数方程y=90.79x+388.26。
实验方案建立以实现高灵敏度的检测为首要目标,在本方案中,哑铃环为极其简单稳定的DNA寡核苷酸形成,在检测中不易被降解,作为Dam甲基转移酶的催化模板,甲基化位点能被敏感识别,剪切后也能形成单链稳定于检测液中与3D结构的四面体结合,该四面体支架具有良好的空间稳定结构使背景干扰信号较低,各末端间具有一定距离,4个完全相同末端发夹稳定存在,只有在与链结合时才能发生杂交反应打开发夹,本方案中高信噪比检测对于酶的检测具有高效性,高灵敏度检测以至于达到相关系数0.9931的线性检测和0.00036的检测限。
同时,将本方案检测灵敏度与已有研究相关方法(论文[1]-[7])进行对比,结果如表2所示,再次证明了本方法建立的优势。
表2与靶Dam甲基转移酶的高灵敏荧光检测方案方法学比较
注:
[1]Chen S,Ma H,Li W,et al.An entropy-driven signal amplifyingstrategy for real-time monitoring of DNA methylation process and high-throughput screening of methyltransferase inhibitors.[J].Analytica ChimicaActa,2017,970:57-63.
[2]Du Y C,Wang S Y,Li X Y,et al.Tetminal deoxynucleotidyltransferase-activated nicking enzyme amplification reaction for specific andsensitive detection of DNA methyltransferase and polynucleotide kinase[J].Biosensors&Bioelectronics,2019,145:111700.
[3]MD A,Mak B,Bk C.A signal-on fluorescence based biosensing platformfor highly sensitive detection of DNA methyltransferase enzyme activity andinhibition[J].Spectrochimica Acta Part A:Moleculaur and BiomolecularSpectroscopy,228.
[4]Zhang H,Wang L J,Wang L,et al.Development of a cascade isothermalamplification approach for the sensitive detection of DNA methyltransferase[J].Journal of Materials Chemistry B,2019,7(1):157-162.
[5]Xiaowen,Xu,Lei,et al.Multiple sealed primers-mediated rollingcircle amplification strategy for sensitive and specific detection of DNAmethyltransferase activity[J].Talanta,2019,194:282-288.
[6]Zhang Y,Yan Z,Zhu L,et al.A microchip electrophoretic assay forDNA methyltransferase activity based on methylation-sensitive endonucleaseDpn[J].Electrophoresis,2018,40(3).
[7]Zhao Y,Chen F,Wu Y,et al.Highly sensitive fluorescence assay ofDNA methyltransferase activity via methylation-sensitive cleavage coupledwith nicking enzyme-assisted signal amplification[J].Biosensors&Bioelectronics,2013,42(Complete):56-61.
2.6特异性分析
为了评估检测的特异性,实验添加M.SssI甲基转移酶作为对照检测,本次实验中甲基转移酶识别位点为5’-GACT-’3,而M.SssI酶识别位点为5’-CG-3’,加入甲基转移酶进行催化反应后同样加入Dpn I核酸内切酶同样进行后续反应,图6显示了特异性分析结果:M.SssI MTase与Dam MTase的特异性甲基化酶催化情况比较,Hpa II与Dpn I核酸内切酶在识别Dam核酸内切酶催发甲基化位点的酶切情况。
如图6所示,从左往右依次为加入100U/mL M.SssI甲基转移酶与加入100U/mLDam甲基转移酶进行反应比较,在Dpn I核酸内切酶的识别剪切后的荧光强度F比较,只有Dam甲基转移酶存在时才能顺利反应。
同时验证了Dpn I核酸内切酶的特异性酶切反应,只有Dam甲基转移酶作用于相应位点后酶切反应才能顺利完成,加入20U Hpa II甲基化限制性内切酶进行反应,Hppa II识别位点为5’-CCGG-3’非甲基化位点,和荧光四面体支架反应后无法产生荧光,而最后实验在8U Dpn I核酸内切酶中进行,在此作用下产生了较大荧光强度,再次表明本方案建立具有良好的选择特异性。
2.7血清学实验
为验证本方案在人健康血清中对靶酶的检测性能,我们将酶分别稀释为0.05U/mL,0.5U/mL,1U/mL进行3组平行检测,结果如表3所示,并计算了酶检测的回收率分别为105.9%、94.6%、105.26%,而相对标准偏差RSD稳定在7.24%、0.7%、1.57%。上述结果表明,检测血清结果具有良好的重现性和稳定性,具有极大的临床参考价值。
表3 Dam甲基转移酶在血清中的检测效果
2.8 5-氟尿嘧啶(5-fluorouracil)抑制试验
由于Dam甲基转移酶的作用机制,在人体中的异常变化可引起各疾病、癌症肿瘤等的发生,因此对Dam甲基转移酶的有效控制可抑制DNA甲基化的异常发生,而5-氟尿嘧啶作为一种抗癌药物,对于抗生素类药物的研究起到重要作用,该药物可对Dam甲基转移酶起到一定的抑制作用,因此本实验中通过控制不同浓度的5-氟尿嘧啶观察其对Dam甲基转移酶的抑制情况,图7显示了5-氟尿嘧啶抑制剂浓度变化对100U/mL Dam MTase活性的抑制情况。
如图7所示,当5-氟尿嘧啶存在时即可对Dam甲基转移酶起到一定抑制作用,且满足相应剂量浓度的酶抑制剂与相对活性RA(%)呈现一定比例变化,RA的计算公式为:RA=(Fi-F0)/(Ft-F0),其中Fi,Ft和F0分别表示100U/mL Dam MTase和不同浓度5-氟尿嘧啶抑制剂存在时的荧光强度,Ft为存在100U/mL Dam MTase但无5-氟尿嘧啶存在时的荧光强度,F0为无Dam MTase存在且不加入5-氟尿嘧啶反应时的浓度,Ft与反应空白值F0为3组平行实验取其平均值而进行后续计算。当浓度逐渐升高达到6μM时,荧光信号接近空白不再变化,因此该浓度为酶抑制最佳浓度。
同时通过计算抑制剂对酶的作用IC50值(5-氟尿嘧啶浓度导致50%的Dam MTase活性抑制)为0.847μM,以上结果表明所提出的方案可用于筛选MTase抑制剂的抑制能力,再次证明本方案对重要的临床治疗诊断等重要的临床参考意义。
3结论
本发明的研究方案是基于对称双环哑铃辅助3D四面体荧光支架实现超灵敏检测Dam甲基转移酶,实验中配制足够浓度哑铃环,保证甲基化反应的顺利进行,其结构稳定,酶切反应后两对称单链使四面体荧光信号双倍放大,荧光检测背景信号低,干扰因素少,稳固的四面体结构4末端均结合目标链,极大地提高了目标链的识别效率;本方案具有实验操作简单、检测耗时短、特异性检测的优点,且具有极高的灵敏度,达到了0.00036U/mL的检测限,同时联合的特异性实验检测相应位点甲基化情况,利用5-氟尿嘧啶对Dam甲基转移酶的抑制作用,对于研发抗病菌药物及抗癌药物给予重要的参考意义,而血清标本检测体现良好重现性等多方面体现本发明检测体系的优势,有利于临床癌症的早期检测诊断及药物研究等的临床应用发展。
上述实施例仅例示性说明本发明的原理及其功效,而非用于限制本发明。任何熟悉此技术的人士皆可在不违背本发明的精神及范畴下,对上述实施例进行修饰或改变。因此,举凡所属技术领域中具有通常知识者在未脱离本发明所揭示的精神与技术思想下所完成的一切等效修饰或改变,仍应由本发明的权利要求所涵盖。
SEQUENCE LISTING
<110> 重庆医科大学
<120> 一种检测DNA甲基化转移酶的荧光生物传感器及其制备与应用
<130> PCQYK2110467-HZ
<160> 5
<170> PatentIn version 3.5
<210> 1
<211> 40
<212> DNA
<213> Artificial
<220>
<223> SDRD
<400> 1
tcagcttagt acattgctga tcagcttagt acattgctga 40
<210> 2
<211> 91
<212> DNA
<213> Artificial
<220>
<223> DTFS-1
<400> 2
tcaactgcct ggtgataaaa cgacactacg tgggaatcta ctatggcggc tcttcttttc 60
agcaatgtac taagctgagt gcttagtaca t 91
<210> 3
<211> 91
<212> DNA
<213> Artificial
<220>
<223> DTFS-2
<400> 3
acattcctaa gtctgaaaca ttacagcttg ctacacgaga agagccgcca tagtattttc 60
agcaatgtac taagctgagt gcttagtaca t 91
<210> 4
<211> 91
<212> DNA
<213> Artificial
<220>
<223> DTFS-3
<400> 4
tcaactgcct ggtgataaaa cgacactacg tgggaatcta ctatggcggc tcttcttttc 60
agcaatgtac taagctgagt gcttagtaca t 91
<210> 5
<211> 91
<212> DNA
<213> Artificial
<220>
<223> DTFS-4
<400> 5
ttcagactta ggaatgtgct tcccacgtag tgtcgtctgt attggaccct cgcatttttc 60
agcaatgtac taagctgagt gcttagtaca t 91
- 一种检测DNA甲基化转移酶的荧光生物传感器及其制备与应用
- 一种检测DNA甲基化的荧光生物传感器、检测方法和应用
