二硫键连接的可逆终止剂
文献发布时间:2023-06-19 12:02:28
本申请要求2018年9月28日提交的第62/738,627号美国临时专利申请、2019年2月21日提交的第62/808,413号美国临时专利申请、2019年4月17日提交的第62/835,007号美国临时专利申请和2019年5月14日提交的第62/847,458号美国临时专利申请的优先权,上述专利申请中的每一个均通过引用整体并入本文。
背景技术
高通量测序已在现代生物学的许多领域中得到应用,从生态学和进化到基因发现和发现医学。例如,为了推动个性化医学领域的发展,可能需要收集所有地理族群的完整基因型和表型信息。具有这样的信息可以允许医师为每个患者量身定制治疗。
通常被称为下一代测序(NGS)技术的新测序方法已有望通过测序提供快速、廉价且准确的基因组信息。例如,高通量NGS(HT-NGS)法可以使科学家以较快的速度和较低的成本获得所需的基因序列。临床上对个体的突变进行全基因组筛查可为追求个性化药物和揭示基因组对疾病的贡献均提供益处。然而,有时HT-NGS的效率是以牺牲测序结果的准确性为代价获得的。在这种情况下,合成测序(SBS)方法可以允许更准确地确定掺入的碱基的身份,由此在HT-NGS中提供更高的保真度。
发明内容
本公开提供了包含可逆终止剂分子即核苷和核苷酸类似物的化学化合物,该核苷和核苷酸类似物包含与该核苷酸糖部分的3'羟基共价连接的可切割化学基团。此外,所述可逆终止剂分子包含通过可切割连接体与核苷酸的碱基附接的可检测标记物。该可切割连接体包含二硫键,该二硫键可被还原剂切割。然后,该还原试或碱性试剂还可切割该核苷酸糖部分的3'羟基上的可切割化学基团。与3'羟基连接的共价键是可逆的,这意味着该可切割化学基团可通过化学和/或酶促过程去除。该可检测标记物可任选地是可猝灭的。该核苷酸类似物可以是核糖核苷酸或脱氧核糖核苷酸分子和类似物及其衍生物。共价结合的可切割化学基团的存在被设计用于阻碍在基于酶的多核苷酸合成方法中使用的聚合酶的行进。
本公开的第一方面提供了根据式(I)的核苷5’-三磷酸类似物:
或其盐或质子化形式,其中:
X为O、S或BH
LG为-X’-(C=O)-R
X’为O或S;
w为1、2、3、4或5;
R
R
碱基B为核苷酸碱基或其类似物;
L
L
L
D
所述二硫键(s)可被还原剂切割,从而在所述二硫键被还原剂切割后,不存在与所述碱基B(和3’-O)连接的游离巯基。
本公开的第二方面提供了根据式(II)的核苷5’-三磷酸类似物:
或其盐或质子化形式,其中:
X为O、S或BH
X’为O或S;
w为1、2、3、4或5;
R
碱基B为核苷酸碱基或其类似物;
L
L
L
D
所述二硫键可被还原剂切割,从而在所述二硫键被还原剂切割后,不存在与所述碱基B连接的游离巯基。
本公开的第三方面提供了根据式(III)的核苷5’-三磷酸类似物:
或其盐或质子化形式,其中:
X为O、S或BH
w为1、2、3、4或5;
碱基B为核苷酸碱基或其类似物;
R
L
L
L
D
所述二硫键可被还原剂切割,从而在所述二硫键被还原剂切割后,不存在与所述碱基B和3’-O连接的游离巯基。
在本文提供的方面的一些实施方案中,所述核苷5’-三磷酸类似物的碱基B选自
在本文提供的方面的一些实施方案中,式(I)、(II)和(III)的核苷5’-三磷酸类似物进一步被定义为:L
在本文提供的方面的一些实施方案中,式(I)、(II)和(III)的核苷5’-三磷酸类似物进一步被定义为:
L
n为0或1;
R
R
Z为O或NH。
在本文提供的方面的一些实施方案中,式(I)、(II)和(III)的核苷5’-三磷酸类似物进一步被定义为:
L
Q
R
在本文提供的方面的一些实施方案中,式(I)、(II)和(III)的核苷5’-三磷酸类似物进一步被定义为:
w为1;
X为O;
R
L
L
L
R
Q
在本文提供的方面的一些实施方案中,式(I)、(II)和(III)中的D
在本文提供的方面的一些实施方案中,用来切割式(I)、(II)和(III)化合物的还原剂为二硫苏糖醇(DTT)、2-巯基乙醇、三烷基膦、三芳基膦或三(2-羧基乙基)膦。在本文提供的方面的一些实施方案中,用来切割式(II)化合物的还原剂为三烷基膦、三芳基膦或三(2-羧基乙基)膦。在本文提供的方面的一些实施方案中,用来切割式(I)化合物的还原剂为二硫苏糖醇(DTT)或2-巯基乙醇。
本公开的第四方面提供了一种组合。所述组合物包含第一、第二、第三和第四核苷5’三磷酸类似物,其中所述类似物根据式(II)或其类似物定义,并且对于所述第一、第二、第三和第四核苷5’-三磷酸类似物中的每一个,所述碱基是不同的;并且对于每个不同的碱基,所述可检测标记物是不同的。
本公开的第五方面提供了一种组合物。该组合物包含四种作为可逆终止剂的核苷5’-三磷酸,其中每个可逆终止剂根据以上描述的式(III)。所述四种核苷5’-三磷酸中的每一种具有不同的碱基,其中每个不同的碱基具有不同的可检测标记物。由于每个不同的可逆终止剂可包含不同的可检测标记物,因此可以实现每种不同类型的可逆终止剂的检测和区分。另外,在所述二硫键被还原剂切割后,不存在与所述不同的碱基或3’-O连接的游离巯基。
在本文针对所述组合物提供的方面的一些实施方案中,可检测标记物D
本公开的第六方面提供了所述核苷5’-三磷酸类似物为式(IV):
或其盐和/或质子化形式,其中:
X’为O或S
R
碱基B选自
L
L
L
D
所述二硫键可被还原剂切割,从而在所述二硫键被还原剂切割后,不存在与所述碱基B或3’-O连接的游离巯基。
在本文提供的方面的一些实施方案中,式(IV)的核苷5’-三磷酸类似物进一步被定义为:L
在本文提供的方面的一些实施方案中,式(IV)的核苷5’-三磷酸类似物进一步被定义为:
L
n为0或1;
R
R
Z为O或NH。
在本文提供的方面的一些实施方案中,式(IV)的核苷5’-三磷酸类似物进一步被定义为:
L
Q
R
在本文提供的方面的一些实施方案中,式(IV)的核苷5’-三磷酸类似物进一步被定义为:
X’为O或S;
R
L
L
L
R
Q
在本文提供的方面的一些实施方案中,式(IV)中的D
本公开的第七方面提供了所述核苷5’-三磷酸类似物为式(V):
或其盐和/或质子化形式,其中:
R
碱基B选自
L
L
L
D
所述二硫键可被还原剂切割,从而在所述二硫键被还原剂切割后,不存在与所述碱基B或3’-O连接的游离巯基。
在本文提供的方面的一些实施方案中,式(V)的核苷5’-三磷酸类似物进一步被定义为:L
在本文提供的方面的一些实施方案中,式(V)的核苷5’-三磷酸类似物进一步被定义为:R
在本文提供的方面的一些实施方案中,式(V)的核苷5’-三磷酸类似物进一步被定义为:
L
Q
R
本公开的第六方面提供了一种对多核苷酸进行测序的方法,其包括:
在包含待测序的靶多核苷酸、与待测序的靶多核苷酸杂交的一种或多种多核苷酸引物、催化量的聚合酶以及一种或多种本文所述的式(I)、(II)、(III)、(IV)或(V)的核苷5’-三磷酸类似物的反应体系中进行聚合反应,从而生成一种或多种与靶多核苷酸互补的测序产物。
在本文针对测序方法提供的方面的一些实施方案中,所述一种或多种核苷5’-三磷酸类似物为式(II)。在本文针对测序方法提供的方面的一些实施方案中,所述一种或多种核苷5’-三磷酸类似物为式(III)。在本文针对测序方法提供的方面的一些实施方案中,所述一种或多种核苷5’-三磷酸类似物为式(IV)。在本文针对测序方法提供的方面的一些实施方案中,所述一种或多种核苷5’-三磷酸类似物为式(V)。
在本文针对测序方法提供的方面的一些实施方案中,所述一种或多种5’-三磷酸类似物的浓度不大于400μM。在本文针对测序方法提供的方面的一些实施方案中,所述一种或多种5’-三磷酸类似物的浓度不大于100μM。在本文针对测序方法提供的方面的一些实施方案中,所述一种或多种5’-三磷酸类似物的浓度不大于50μM。在本文针对测序方法提供的方面的一些实施方案中,所述一种或多种5’-三磷酸类似物的浓度不大于10μM。在本文针对测序方法提供的方面的一些实施方案中,所述一种或多种5’-三磷酸类似物的浓度不大于5μM。在本文针对测序方法提供的方面的一些实施方案中,所述一种或多种5’-三磷酸类似物的浓度不大于3μM。在本文针对测序方法提供的方面的一些实施方案中,所述一种或多种5’-三磷酸类似物的浓度不大于2μM。在本文针对测序方法提供的方面的一些实施方案中,所述方法进一步包括用还原剂二硫苏糖醇(DTT)、2-巯基乙醇、三烷基膦、三芳基膦或三(2-羧基乙基)膦处理所述一种或多种测序产物。在本文针对测序方法提供的方面的一些实施方案中,所述还原剂为三烷基膦、三芳基膦或三(2-羧基乙基)膦。在一些实施方案中,所述还原剂为二硫苏糖醇(DTT)或2-巯基乙醇。在本文针对测序方法提供的方面的一些实施方案中,在用所述还原剂处理后,所述一种或多种测序产物不具有与其任何碱基连接的游离巯。在本文针对测序方法提供的方面的一些实施方案中,当使用一种或多种本文所述的式(III)或(V)的核苷5’-三磷酸类似物时,在用所述还原剂处理后,所述一种或多种测序产物不具有与其任何碱基或其任何3’-O连接的游离巯基。
在本文针对测序方法提供的方面的一些实施方案中,当使用一种或多种本文所述的式(II)或(IV)的核苷5’-三磷酸类似物时,所述方法进一步包括在用所述还原剂处理后,用碱性试剂处理所述一种或多种测序产物。在本文针对测序方法提供的方面的一些实施方案中,用碱性试剂处理提供3’-OH。在本文针对测序方法提供的方面的一些实施方案中,所述碱性试剂为pH为约10至约11的缓冲液。在本文针对测序方法提供的方面的一些实施方案中,所述碱性试剂为碳酸钠/碳酸氢钠缓冲液。
基于仅示出并描述了本公开的说明性实施方案的以下详细描述,本公开的其他方面和优点对本领域技术人员而言将变得显而易见。应当认识到,本公开能够具有其他不同的实施方案,并且其若干细节能够在各个明显的方面进行修改,所有这些都不脱离本公开内容。因此,附图和说明书在本质上将被视为说明性的,而非限制性的。
本说明书中所提及的所有出版物、专利和专利申请均通过引用并入本文,其程度犹如具体地且单独地指出每个单独的出版物、专利或专利申请均通过引用而并入。
附图说明
本发明的新颖特征在所附权利要求书中具体阐述。通过参考以下对利用本发明原理的说明性实施方案加以阐述的详细描述以及附图,将会对本发明的特征和优点获得更好的理解,在这些附图中:
图1示出了本公开的核苷酸终止剂,其具有作为糖的脱氧核糖以及作为碱基的胸腺嘧啶/尿嘧啶、腺嘌呤、胞苷和鸟嘌呤。这些可逆终止剂可使用如本文提供的类似化学法进行制备,以得到标记的核苷酸可逆终止剂。
图2示出了使用化合物60使引物延伸成生长的DNA链。
图3示出了另一组本公开的核苷酸终止剂,其具有作为糖的脱氧核糖以及作为碱基的胸腺嘧啶/尿嘧啶、腺嘌呤、胞苷和鸟嘌呤。这些可逆终止剂可使用如本文提供的类似化学法进行制备,以得到标记的核苷酸可逆终止剂。
图4示出了使用本公开的化合物75使引物延伸成生长的DNA链。
具体实施方式
随着通过这些新技术所产生的数据迅速呈指数增长,涉及合成测序(SBS)的第二代测序(NGS)方法经历了快速的发展。SBS方法可能已显示出有望作为一种新的测序平台。尽管在过去的二十年中取得了令人瞩目的进步,但在将其付诸实践之前,仍有很大的发展空间。
SBS方法的一个步骤可以是将可移动的帽置于已经在生长链中的最后一个核苷酸的3’-OH位置处。因此,在其3’-OH位置带有可移动帽的标记核苷酸的合成可能对开发新的SBS技术有意义。
一些SBS方法可使用染料标记的修饰核苷酸。这些修饰核苷酸可被掺入酶(例如DNA聚合酶)特异性掺入,在荧光成像期间或之后切割,并在随后的循环中作为修饰或天然碱基在生长链中延伸。已经报道了两类主要的可逆终止剂:3’封闭的终止剂,其包含连接至脱氧核糖糖的3’-羟基的可切割基团;和3’-去封闭的终止剂,其在脱氧核糖上带有去封闭的3’-羟基。几个3’封闭基团可包括3’O-烯丙基和3’-O-叠氮基甲基。例如,某些可逆终止剂可具有3’封闭基团、3O-烯丙基(Intelligent bio)或3’-O-叠氮基甲基-dNTP(Illumina/Selexa),而标记物与碱基连接,这充当报告分子并可以切割。其他可逆终止剂可以是3’-去封闭的可逆终止剂,其中终止剂基团与碱基以及荧光基团相连,荧光基团不仅充当报告分子,而且还表现为可逆终止基团。
NGS平台中许多循环可逆终止剂(CRT)技术的一个问题可能是读取长度短,例如,读取长度介于约100至约150个碱基之间。造成这种短读长度限制的原因之一可能在于以下发现,到目前为止为CRT开发的许多修饰核苷酸在切割带有荧光团的连接体后可能会留下痕迹(或疤痕)。此痕迹或疤痕包含一些残留的连接体结构或其他化学实体,这些结构或化学实体附接至碱基分子,并随时间在随后的测序循环中积累。经过两轮测序延伸后,这样的疤痕沿着DNA双链体的大沟积累,可阻止进一步的聚合酶催化的延伸,例如,不利地损害DNA双螺旋结构的稳定性,并阻碍底物识别和引物延伸步骤。
因此,需要开发合适的化学部分或封端基团来对核苷酸的3’-OH进行封端,使得该化学部分或封端基团可以暂时终止聚合酶反应以允许鉴定掺入的核苷酸。这种发展可能有助于SBS方法的进一步发展。另外,可以从合成的DNA延伸产物中除去化学部分或封端基团,以在新掺入的核苷酸上再生3’-羟基,以供连续的聚合酶反应。
因此,存在开发与聚合酶良好协作并且能够在掺入生长链后终止链生长的核苷酸类似物的需要。由可逆终止剂核苷酸类似物引起的在链延伸期间聚合酶活性的中止允许准确确定所掺入的核酸的身份。通过可逆终止剂核苷酸类似物的随后修饰(其使聚合酶继续行进至生长的DNA链上的下一个位置),在进行该准确确定后继续链合成的能力将是理想的。阻滞DNA聚合、随后去除所掺入的非天然核苷酸上的封端基团的过程在本文中被称为连续可逆终止。连续可逆终止的另一个要求是非天然核苷酸类似物的3’-OH上的封端基团必须容易去除,而不破坏生长的DNA链或聚合酶,即在温和的反应条件下终止必须是可逆的。本公开的又一目的在于发现既切割附接在掺入的核苷酸上的可检测标记物又切割在掺入的非天然核苷酸上的封端基团的还原剂。
若干种技术可用于实现高通量测序。(参见,Ansorge;Metzker;和Pareek等人,“Sequencing technologies and genome sequencing,”J.Appl.Genet.,52(4):413-435,2011,以及其中引用的参考文献)。SBS方法是用于在短时间内快速并有效地确定多个核苷酸序列片段的序列的、结合PCR改进如乳液PCR(emPCR)的常用方法。在SBS中,核苷酸通过聚合酶掺入,并且由于核苷酸被差异性地标记,所以掺入的核苷酸的信号得以通过灵敏仪器如相机确定,由此确定被掺入生长的合成多核苷酸链中的核苷酸的身份。
SBS方法常采用可逆终止剂核酸,即含有共价修饰的碱基,该修饰一旦掺入生长链即阻碍通过聚合酶进行的进一步合成步骤。可随后例如采用化学品或特定的酶去除该共价修饰,以允许通过聚合酶添加下一个互补的核苷酸。其他方法采用连接测序技术,如Applied Biosystems SOLiD平台技术。其他公司如Helicos提供了通过使用非常灵敏的检测技术以及发射足以用于检测的光的特殊标记物,能够在SBS程序中检测单分子合成而无需预先样品扩增的技术。焦磷酸测序是一些可商购的NGS仪器采用的另一种技术。RocheApplied Science 454GenomeSequencer涉及焦磷酸的检测(焦磷酸测序)。(参见,Nyren等人,“Enzymatic method for continuous monitoring of inorganic pyrophosphatesynthesis,”Anal.Biochem.,151:504-509,1985;还参见,美国专利申请公开号2005/0130173和2006/0134633;美国专利号4,971,903、6,258,568和6,210,891)。
采用本文公开的可逆终止剂分子的测序可通过任何可用的手段进行。通常,可用技术的类别包括但不限于合成测序(SBS)、单碱基延伸测序(SBE)、连接测序、单分子测序和焦磷酸测序等。最适于本发明的化合物、组合物、方法和试剂盒的方法是SBS。许多可商购的仪器采用SBS来确定靶多核苷酸的序列。这些中的一些在下文简要概述。
Roche Applied Science 454GenomeSequencer采用的一种方法涉及焦磷酸的检测(焦磷酸测序)。(参见,Nyren等人,“Enzymatic method for continuous monitoring ofinorganic pyrophosphate synthesis,”Anal.Biochem.,151:504-509,1985)。与大多数方法一样,该过程从产生在所采用的系统中起作用的、可处理长度(即约400-500bp)的核苷酸片段开始。(参见,Metzker,Michael A.,“Sequencing technologies-the nextgeneration,”Nature Rev.Gen.,11:31-46,2010)。将核苷酸引物与片段的任一端连接,并且通过与珠子结合随后进行乳液PCR来单独地扩增序列。然后使扩增的DNA变性,并随后将每个珠子放置在由玻璃纤维束制成的光纤芯片中的刻蚀的纤维的顶端。该纤维束在相对端具有灵敏的电荷耦合器件(CCD)相机,以检测从载有珠子的纤维的另一端发射的光。每个独特的珠子均位于纤维的末端,其中纤维自身被锚定至空间可寻址的芯片,其中每个芯片含有几十万根这样的附接有珠子的纤维。接着,采用SBS技术,为珠子提供与连接至DNA的相对端的引物互补的引物、聚合酶和仅一种天然核苷酸,即C或T或A或G,并使该反应进行。通过聚合酶掺入下一个碱基释放出光,该光通过在珠子的相对端的CCD相机进行检测。(参见,Ansorge,Wilhelm J.,“Next-generation DNA sequencing techniques,”New Biotech.,25(4):195-203,2009)。该光通过使用ATP硫酸化酶、包含腺苷5'磷酸硫酸、萤光素酶和焦磷酸而产生。(参见,Ronaghi,M.,“Pyrosequencing sheds light on DNA sequencing,”Genome Res.,11(1):3-11,2001)。
被称为Genome Analyzer的可商购的仪器也采用SBS技术。(参见,Ansorge,第197页)。与Roche仪器相似,样品DNA首先被片段化成可处理的长度并进行扩增。扩增步骤有些独特,因为其包括形成单链DNA片段的约1,000个拷贝,这被称为聚合酶群落(polony)。简言之,将衔接子与DNA片段的两端连接,并随后将片段与共价连接有与该衔接子互补的引物的表面杂交,从而在表面上形成微桥。因此,这些杂交的片段的扩增产生了空间上共定位于表面的一个区域的扩增片段的小群落或簇。通过为表面提供聚合酶和各自采有不同染料进行荧光标记的可逆终止剂核苷酸来引发SBS。在通过聚合酶掺入新的生长链后,采用CCD相机检测荧光信号。随后去除与可逆终止剂核苷酸的3苷端共价连接的终止剂部分以及荧光染料,从而使聚合酶重新开始进行下一轮的合成。(同上,还参见,美国专利号8,399,188;Metzker,第34-36页)。
许多SBS策略依赖于对可检测地标记的核苷酸和核苷酸类似物的掺入的检测。这样的检测可能依赖于荧光或其他光信号,但这并不是必需的。其他可用的技术是针对测量围绕核苷酸掺入事件的热量和pH的变化。(参见,美国专利号7,932,034和8,262,900;美国专利申请公开号20090127589;以及Esfandyarpour等人,“Structural optimization forheat detection of DNA thermosequencing platform using finite elementanalysis,”Biomicrofluidics,2(2):024102(1-11),2008)。一家生命科技公司Ion Torent在其基于离子感应的SBS仪器中采用了这种技术。在Ion Torent仪器中,使用场效应晶体管(FET)检测发生SBS聚合酶反应的微孔中的pH的细微变化。在微孔阵列中的每个孔均为含有聚合酶、靶标/模板链和生长互补链的单独的单分子反应容器。四种核苷酸连续循环进入孔中使得当核苷酸掺入生长DNA链时,对准每个微孔下方的FET检测pH的变化。FET将这种信号转换成电压的变化,该变化在大小上与在该合成步骤中掺入的核苷酸的总数相当。
在基于SBS的NGS方法中,可能需要可逆终止剂核苷酸以便以有效且准确的方式获得多核苷酸靶序列的身份的关键。本文的可逆终止剂可通过置换在那些方法中先前描述的核苷酸和核苷酸类似物在任意这些情况下使用。即,本发明的可逆终止剂的置换可增强和改善所有这些SBS和SBE方法。这些方案中的大多数都采用脱氧核糖核苷酸三磷酸或dNTP。同样地,本发明的可逆终止剂可以以dNTP形式被置换。下文描述了在其他测序方法中有用的其他形式的本发明可逆终止剂。
在SBS、SBE和类似方法的情况下使用可逆终止剂分子的过程通常包括将标记的核苷酸类似物掺入生长的多核苷酸链,随后检测标记物,然后切割该核苷酸类似物以去除阻止继续合成的共价修饰。该切割步骤可采用酶或通过化学切割来完成。核苷酸的修饰可以在5′末端磷酸或3′羟基基团上进行。开发真正可逆的一组核苷酸终止剂是多年来的目标。尽管最近取得了进展,但仅提出了少数解决方案,其中大多数均引起其他的问题,包括通过聚合酶的低效或不完全掺入,可去除基团的低效或不完全切割,或者切割步骤需要苛刻的条件,从而引起与该测定的其余部分和/或靶序列的保真度有关的突出问题。在采用可逆终止剂的标准SBS方案中,聚合酶必须适应核苷酸上的、用于附接荧光信号传导部分的突出基团,以及在3′-OH上的封端基团。天然的聚合酶对这些修饰,特别是3′-封端基团具有低耐受性。聚合酶的诱变对于获得具有可接受的掺入效率的酶是必要的。在从碱基上切割荧光团后,许多目前的方法在剩余的核碱基上留下非天然的“疤痕”。(参见例如,Metzker,MichaelA.,“Sequencing technologies-the next generation,”Nature Rev.Gen.,11:31-46,2010以及Fuller等人,“The challenges of sequencing by synthesis,”Nat.Biotech.,27(11):1013-1023,2009)。
因此,已证明有限数目的适合于封闭3′-氧的基团在与某些使得酶能够耐受在3′-位置的修饰的突变聚合酶组合使用时是有用的。这些基团包括叠氮基甲基、烯丙基和烯丙氧基羰基。(参见例如,Metzker等人,“Termination of DNA synthesis by novel 3′-modified deoxyribonucleoside triphosphates,”Nucleic Acids Res.,22:4259-4267,1994;以及美国专利号5,872,244;6,232,465;6,214,987;5,808,045;5,763,594和5,302,509;以及美国专利申请公开号20030215862)。这些基团需要施加化学试剂来实现切割。已证明,在3'-位置的羧酸酯、碳酸酯或硫代碳酸酯基团太不稳定,以至于不能有效作为链终止剂,这在表面上是由于与外切核酸酶活性不同的聚合酶固有的编辑活性。(参见,CanardB&Sarfati R.,“DNA polymerase fluorescent substrates with reversible 3′-tags,”Gene,148:1-6,1994)。
本文公开了新的一类荧光标记的可逆终止剂。这种新类别的荧光标记的可逆终止剂在核苷酸的核糖环的3’-O上具有3’-酰氧基甲基或3’-酰硫基甲基封闭基团。3’-酰氧基甲基或3’-酰硫基甲基修饰的核苷酸可被DNA聚合酶识别为底物,以进行延伸反应,以在聚合酶反应过程中添加到生长链中,并在掺入到生长链中后,可在温和条件下裂解。另外,对于桥连碱基和二硫基的氨基甲酸酯连接体部分,荧光团标签可以通过二硫键与该碱基连接。荧光团标签可以在温和条件下裂解,以断裂二硫键。例如,用还原如三烷基膦、(三(2-羧基乙基)膦)(TCEP)、二硫苏糖醇(DTT)或2-巯基乙醇暴露新的可逆终止剂,不仅可以断裂荧光团连接体的二硫键,而且在二硫化物断裂生成的新生硫化物阴离子存在下,可通过分子内环化引发氨基甲酸酯键的同时断裂(方案1),从而在该过程中从核苷酸(以及不断生长的DNA链)中除去硫化物阴离子。然后可以使用碱性试剂切割核糖上的3’-酰氧基甲基或3’-酰硫基甲基封闭基团,并显露出游离的3’-OH,以进一步延长生长链。
如方案1所示,化合物A包含通过连接体L
尽管在化合物A中,方案1中所示的二硫基团与氨基甲酸酯基团之间被两个原子如1,2-乙二基隔开,但是当二硫基团与氨基甲酸酯基团被三个原子如1,3-丙二基隔开时,会发生类似的自发裂解。尽管方案1在可逆终止剂中显示了三磷酸酯,但是只要相同的酰氧基甲基或酰硫基甲基在3’位置且标记物D1以相同或类似的方式(即,经由通过1,2-乙二基或1,3-丙二基与氨基甲酸酯基团分开的二硫键)连接至核苷酸碱基B,则在其他类型的分子中也可发生类似的裂解机制。当可逆终止剂掺入生长链中时(即,化合物A中的三磷酸基团可能变为磷酸二酯基团),也可发生类似的机制。
方案1:
这些新型可逆终止剂在掺入到生长的链中和裂解反应后,可包含留在核苷酸碱基上的小(例如4-原子)疤痕。与在荧光团切割后留在核苷酸碱基上的Illumina的10原子疤痕相比,该4原子疤痕可能更小。与在所掺入的核苷酸上留有末端巯基的其他可逆终止剂相比,这种新型可逆终止剂可以提供许多优点。例如,残留的巯基对于测序反应可能是不希望的,因为残留的巯基可能以许多方式具有反应性。例如,当生长链进一步用额外的荧光团标记的、含二硫键的核苷酸延长时,反应性末端游离巯基官能团可与引入核苷酸碱基上的二硫键过早裂解相关。另外,如果末端游离巯基官能团与引入核苷酸(包含对游离巯基的反应性基团;例如,附接至引入核苷酸碱基的二硫键)反应,则可能形成新的共价交联(例如,与引入核苷酸碱基或染料形成二硫键),使得随着测序过程进行,引入核苷酸(或染料)可以随后添加到生长链上。这可能会过早地裂解那些二硫化物连接体,从而在其可被成像之前释放出染料,或者即使核苷酸碱基与模板上的碱基不互补也可能与染料错误地连接。此外,游离巯基可与含有游离巯基或二硫键的蛋白质(例如聚合酶)的氨基酸形成共价交联。这些副反应可通过阻止聚合酶沿着延长复合物前进或与之分离的能力,从而“扰乱”或干扰测序过程。另外,游离巯基可以与附接至相同生长链或被测序的相邻生长链上的核苷酸碱基的其他残留巯基形成共价交联。
使用本文公开的新型可逆终止剂,可以确定DNA序列。模板的DNA序列可以由附接至核苷酸碱基上的荧光团标签的独特荧光发射来确定。在与荧光团相连的二硫键断裂之后,与3’位连接的酰基或硫代酰基的裂解可触发甲醛或甲烷硫酮基团的自发裂解,从而再生出游离3’-羟基(方案1),以供进一步延长。生长链的持续延长可以描绘出模板的其他测序信息。
例如,如方案1所示,可将二硫基烷氧羰基氨基连接的荧光团标签添加至核苷酸的碱基。将终止剂暴露于还原剂如TCEP、二硫苏糖醇(DTT)或2-巯基乙醇可以还原并断裂二硫键,从而通过所得硫化物阴离子的分子内环化触发氨基甲酸酯键的同时裂解。用碱性试剂处理可以切割3’封端或封闭基团。荧光团的切割可在碱基上仅留下小(例如,4-原子)疤痕(方案1)。
应当注意,尽管方案1示出了本公开的可逆终止剂可以与还原剂如三烷基膦、TCEP、DTT或2-巯基乙醇反应的所提出的机制,但是当可逆终止剂掺入到DNA或RNA生长链中时,可能发生类似的机制。在这种情况下,方案1中示出的可逆终止剂的三磷酸部分可被与DNA或RNA生长链的末端连接的磷酸二酯键替代。相应地,在用还原剂处理之前,由于可逆终止剂的3’-OH基团被封闭/封端基团加帽,所以DNA或RNA链的生长可终止或停止。然而,与以上方案1中所阐述的相类似地,当用还原剂如三烷基膦、TCEP、DTT或2-巯基乙醇处理时,与碱基附接的荧光团可被切割,并且在用碱性试剂处理时糖的3’-OH基团上的封端部分可被切割。在DNA或RNA生长链的末端掺入的可逆终止剂的暴露的3’-OH基团可允许DNA和RNA继续链生长。
此外,尽管方案1中示出的可逆终止剂是三磷酸,但如本公开的其他部分所示,在核苷酸的5’位置处允许其他的三磷酸类似物。
具有可切割的二硫键连接的荧光标签的3’O-修饰的核苷可逆终止剂的设计与合成:
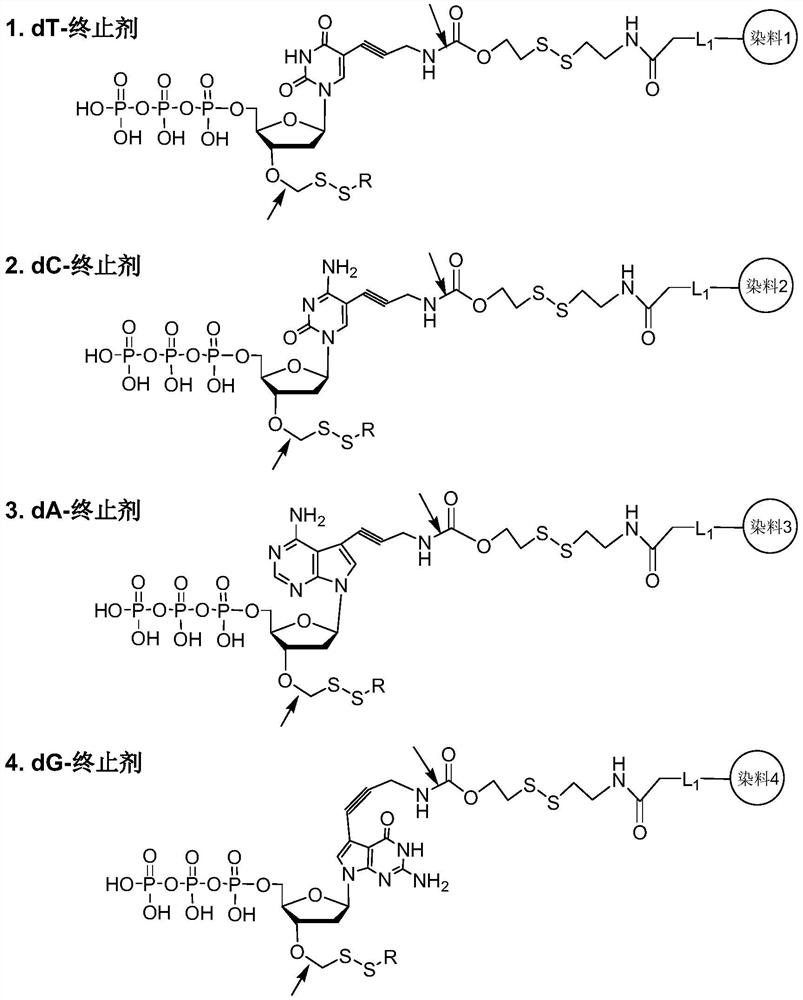
所公开的新型可逆终止剂可以在核糖或脱氧核糖的3’-OH基团上包含酰氧基或硫基酰氧基封闭基团,并且荧光团通过二硫键标记到嘧啶(C和U)的C-5位置或嘌呤碱基(A和G)的C-7位置,如图1所示。箭头指示可以从碱基上切割连接的荧光标签的位置。
方案2:
试剂和条件:(i)N-三氟乙酰基炔丙基胺,Pd(PPh
修饰的尿苷可逆终止剂的合成可以如方案2所示进行,该方案描述了导致合成(((2R,3S,5R)-5-(5-(3-氨基丙-1-炔-1-基)-2,4-二氧代-3,4-二氢嘧啶-1(2H)-基)-2-(((叔丁基二苯基甲硅烷基)氧基)甲基)四氢呋喃-3-基)氧基)甲基乙酸酯或硫代乙酸酯的反应方案,它可以是产生修饰的尿苷核苷酸的中间体。钯催化的5-碘-2'脱氧尿苷(1)与N-三氟乙酰基炔丙基胺的Sonogashira偶合提供2,2,2-三氟-N-(3-(1-((2R,4S,5R)-4-羟基-5-(羟基甲基)四氢呋喃-2-基)-2,4-二氧代-1,2,3,4-四氢嘧啶-5-基)丙-2-炔-1-基)乙酰胺(2)。2,2,2-三氟-N-(3-(1-((2R,4S,5R)-4-羟基-5-(羟基甲基)四氢呋喃-2-基)-2,4-二氧代-1,2,3,4-四氢嘧啶-5-基)丙-2-炔-1-基)乙酰胺(2)的甲硅烷基化产生N-(3-(,5R)-4-羟基-5-(羟基甲基)四氢呋喃-2-基)-2,4-二氧代-1,2,3,4-1-((2R,4S,5R)-5-(((叔丁基二苯基甲硅烷基)氧基)甲基)-4-羟基四氢呋喃-2-基)-2,4-二氧代-1,2,3,4-四氢嘧啶-5-基)丙-2-炔-1-基)-2,2,2-三氟乙酰胺(3)。去除三氟乙酰胺保护基,用叔丁氧羰基(BOC)保护基对游离伯胺进行重新保护,然后使用DMSO、乙酸和乙酸酐通过Pummerer重排将3中的3’-羟基转化为3’-O-甲氧基甲基硫醚,得到中间体4。然后在一锅反应中将中间体4转化为3’-酰氧基甲基或3’-酰硫基甲基衍生物6,其首先通过使用硫酰氯原位转化为3’-O-氯甲基中间体5,随后在18-冠-6的存在下,与乙酸钾盐或硫代乙酸钾盐反应,分别得到相应的3’-O-酰氧基甲基或3’-O-酰硫基甲基醚6。
方案3:
试剂和条件:(i)2-巯基乙醇,吡啶,无水MeOH,RT,12h;(ii)BOC-半胱胺,吡啶,MeOH,RT,12h;(iii)4-硝基苯基氯甲酸酯,Et
连接体前体10可以由活化的二硫化物7合成(方案3)。例如,将市售的2,2'-二硫基二吡啶7与2-巯基乙醇缩合可得到中间体8。中间体8可以进一步与N-叔丁氧基羰基-半胱胺反应以得到二硫化物氨基甲酸酯9。中间体9的游离末端羟基可与4-硝基苯基氯甲酸酯反应,得到碳酸2-(N-叔丁氧基酰胺基-乙基)-2-基-二硫基)乙基-4-硝基苯基碳酸酯10,其可以是活化的二硫化物连接体中间体。
在合成这两个中间体6和10之后,可以例如根据方案4中所示的步骤合成新型可逆终止剂。使用三氟乙酸从6中除去BOC基团,随后与活化的连接体10缩合,可得到12。通过用四丁基氟化铵处理12来去除5’-甲硅烷基,然后将核糖上的游离5’-OH进行磷酸化,可得到三磷酸酯14。最后,除去14上的BOC基团,并使15中所得的伯胺与染料的N-羟基琥珀酰亚胺(NHS)酯缩合,可得到核苷可逆终止剂16。由于3’封闭基团是可以通过碱性溶液除去的酯或硫酯,因此可以控制在3’封闭基团安装后后续反应的pH范围。例如,使用Alexa NHS酯安装可切割标记物的偶合反应可以在碳酸氢钠缓冲液(pH约8.3)中在室温下进行3小时。在这些条件下,先前安装的3’O-酰氧基甲基和3O-硫基酰氧基甲基封闭基团都是稳定的。
方案4:
试剂和条件:(i)TFA水溶液;(ii)10,NaHCO
可采用方案2-4中所示的类似的化学法制备其他具有脱氧腺嘌呤、胞苷和鸟嘌呤的核苷酸终止剂,以得到如图1中所示的标记的可逆终止剂。
例如,方案5-6描述了可以提供一些新型标记的可逆终止剂的合成路径。
方案5:
方案6:
方案5-6中所示的化学转化可以通过许多方式完成。例如,方案5中使用的试剂和条件可以是:(i)N-三氟乙酰基炔丙基胺,Pd(PPh
方案6中使用的试剂和条件可以是:(i)10,NaHCO
例如,方案7-8描述了可以提供一些新型标记的可逆终止剂的合成路径。
方案7:
方案8:
方案7-8中所示的化学转化可以通过许多方式完成。例如,方案7中使用的试剂和条件可以是:(i)4-氯-5-碘-7H-吡咯并[2.3-d]嘧啶,NaH,ACN;(ii)NH
试剂和条件:(i)4-氯-5-碘-7h-吡咯并[2.3-d]嘧啶,NaH,ACN;(ii)NH4OH,MeOH,(iii)N-三氟-丙-2-炔-基-乙酰胺,Pd(PPh3)4,CuI,三乙胺,DMF,RT;(iv)叔丁基-二苯基甲硅烷基氯化物,吡啶;(v).(a)氯三甲基硅烷,吡啶,(b)苯氧基乙酸酐;(vi)DMSO,AcOH,Ac2O;(vii)a)SOCl2,0℃,b)乙酸钾或硫代乙酸钾的钾盐,18-冠-6,DMF,4h;(viii)碳酸钾,甲醇,RT,1h。
方案8中使用的试剂和条件可以是:(i)10,NaHCO
例如,方案9-10描述了可以提供一些新型标记的可逆终止剂的合成路径。
方案9:
方案10:
方案9-10中所示的化学转化可以通过许多方式完成。例如,方案9中使用的试剂和条件可以是:(i)二碳酸二叔丁酯,催化DMAP,DMF,RT,12h;(b)NaOH水溶液,MeOH,RT,12hr;(ii)叔丁基-二苯基甲硅烷基氯化物,吡啶;(iii)NIS,DMF,RT,12h;(iv)N-三氟乙酰基炔丙基胺,Pd(PPh
方案10中使用的试剂和条件可以是:(i)10,NaHCO
本文公开了新的一类荧光标记的可逆终止剂。这种新类别的荧光标记的可逆终止剂可在核苷酸的核糖环的3’-O上具有3’-(烷基二硫基)甲基(-CH
如方案11所示,化合物A包含通过连接体L
尽管在化合物A中,二硫基团与氨基甲酸酯基团之间被两个原子如1,2-乙二基隔开,但是当二硫基团与氨基甲酸酯基被三个原子如1,3-丙二基隔开时,会发生类似的自发裂解。尽管方案11在可逆终止剂中显示了三磷酸酯,但是只要相同的(烷基二硫基)甲基在3’位置且标记物D1以相同或类似的方式(即,经由通过1,2-乙二基或1,3-丙二基与氨基甲酸酯基团分开的二硫键)连接至核苷酸碱基B,则在其他类型的分子中也可发生类似的裂解机制。当可逆终止剂掺入生长链中时(即,化合物A中的三磷酸基团可能变为磷酸二酯基团),也可发生类似的机制。
方案11:
这些新型可逆终止剂在掺入到生长的链中和裂解反应后,可包含留在核苷酸碱基上的小(例如4-原子)疤痕。反应性末端游离巯基官能团的消除可在荧光团裂解和/或3’封闭基团的同时裂解之后发生。与在荧光团裂解后留在核苷酸碱基上的Illumina的10原子疤痕相比,该4原子疤痕可能更小。由于新型可逆终止剂也可在与核苷酸碱基和3’封闭基团两者相关的二硫键裂解后从核苷酸的其余部分消除反应性游离巯基末端官能团,因此与在掺入的核苷酸上留有末端巯基的其他可逆终止剂相比,新型可逆终止剂可提供许多优点。例如,残留的巯基对于测序反应可能是不希望的,因为残留的巯基可能以许多方式具有反应性。例如,当生长链进一步用额外的荧光团标记的、含二硫键的核苷酸延长时,反应性末端游离巯基官能团可与引入核苷酸碱基上的二硫键过早裂解相关。另外,如果末端游离巯基官能团与引入核苷酸(包含对游离巯基的反应性基团;例如,附接至引入核苷酸碱基的二硫键)反应,则可能形成新的共价交联(例如,与引入核苷酸碱基或染料形成二硫键),使得随着测序过程进行,引入核苷酸(或染料)可以随后添加到生长链上。这可能会过早地裂解那些二硫键,从而在其可被成像之前释放出染料,或者即使核苷酸碱基与模板上的碱基不互补也可能与染料错误地连接。此外,游离巯基可与含有游离巯基或二硫键的蛋白质(例如聚合酶)的氨基酸形成共价交联。这些副反应可通过阻止聚合酶沿着延长复合物前进或与之分离的能力,从而“扰乱”或干扰测序过程。另外,游离巯基可以与附接至相同生长链或被测序的相邻生长链上的核苷酸碱基的其他残留巯基形成共价交联。
使用本文公开的新型可逆终止剂,可以确定DNA序列。模板的DNA序列可以由附接至核苷酸碱基上的荧光团标签的独特荧光发射来确定。随后与荧光团连接的二硫键的断裂和3’(烷基二硫基)甲基封闭基团的同时裂解可触发硫代亚甲基的自发裂解,从而再生游离的3’-羟基(方案11)。在两个二硫键连接体断裂并且除去两个末端巯基后,3’羟基得以再生以供延长。生长链的持续延长可以描绘出模板的其他测序信息。
如方案11所示,可将二硫基烷氧羰基氨基连接的荧光团标签添加至核苷酸的碱基。将终止剂暴露于还原剂如二硫苏糖醇(DTT)或2-巯基乙醇可以还原并断裂二硫键,从而通过所得硫化物阴离子的分子内环化触发氨基甲酸酯键的同时裂解。此外,DTT可与3’(烷基二硫基)甲基封闭基团的二硫键反应。随后,3’硫代亚甲基可以自发分解,以在3’位置提供游离羟基,并伴随有硫代甲酰乙醛的消除。荧光团的裂解可在碱基上仅留下小(例如4原子)疤痕(方案11)。
应当注意,尽管方案11示出了本公开的可逆终止剂可以与还原剂如DTT或2-巯基乙醇反应的所提出的机制,但是当将可逆终止剂掺入到DNA或RNA生长链中时,可能发生类似的机制。在这种情况下,方案11中示出的可逆终止剂的三磷酸部分可被与DNA或RNA生长链末端连接的磷酸二酯键替代。相应地,在用还原剂处理之前,由于可逆终止剂的3’-OH基团被封闭/封端基团加帽,因此DNA或RNA链的生长可终止或停止。然而,与以上方案11中所阐述的相类似地,当用还原剂如DTT或2-巯基乙醇处理时,与碱基附接的荧光团可被切割,并且糖的3’-OH基上的封端部分可被同时切割。在DNA或RNA生长链的末端掺入的可逆终止剂的暴露的3’-OH基团可允许DNA和RNA继续链生长。
此外,尽管方案11中示出的可逆终止剂是三磷酸,但是如本公开的其他部分所示,在核苷酸的5'位置处允许其他的三磷酸类似物。
具有可切割的二硫键连接的荧光标签的3’O-修饰的核苷可逆终止剂的设计与合成:
所公开的新型可逆终止剂可在核糖或脱氧核糖的3’-OH基团上包含(烷基二硫基)甲基封闭基团,并且荧光团通过二硫键标记到嘧啶(C和U)的C-5位置或嘌呤碱基(A和G)的C-7位置,如图3所示。箭头指示可以从碱基上切割连接的荧光标签或3’(烷基二硫基)甲基封闭基团的位置。
方案12:
试剂和条件:(i)N-三氟乙酰基炔丙基胺,Pd(PPh
修饰的尿苷可逆终止剂的合成可以如方案12所示进行,其描述了导致合成N-(3-(1-((2R,4S,5R)-5-(((叔丁基二苯基甲硅烷基)氧基)甲基)-4-((甲基二硫基)甲氧基)四氢呋喃-2-基)-2,4-二氧代-1,2,3,4-四氢嘧啶-5-基)丙-2-炔-1-基)-2,2,2-三氟乙酰胺(65)——一种导致形成修饰的尿苷核苷酸的中间体——的反应方案。钯催化的5-碘2’脱氧尿苷(1)与N-三氟乙酰基炔丙基胺的Sonogashira偶合产生2,2,2-三氟-N-(3-(1-((2R,4S,5R)-4-羟基-5-(羟基甲基)四氢呋喃-2-基)-2,4-二氧代-1,2,3,4-四氢嘧啶-5-基)丙-2-炔-1-基)乙酰胺(2)。2,2,2-三氟-N-(3-(1-((2R,4S,5R)-4-羟基-5-(羟基甲基)四氢呋喃-2-基)-2,4-二氧代-1,2,3,4-四氢嘧啶-5-基)丙-2-炔-1-基)乙酰胺(2)的甲硅烷基化产生N-(3-(,5R)-4-羟基-5-(羟基甲基)四氢呋喃-2-基)-2,4-二氧代-1,2,3,4-1-((2R,4S,5R)-5-(((叔丁基二苯基甲硅烷基)氧基)甲基)-4-羟基四氢呋喃-2-基)-2,4-二氧代-1,2,3,4-四氢嘧啶-5-基)丙-2-炔-1-基)-2,2,2-三氟乙酰胺(3)。使用DMSO、乙酸和乙酸酐通过Pummerer重排将3中的3’-羟基转化为3’-(甲基硫基)甲氧基,得到中间体N-(3-(1-((2R,4S,5R)-5-(((叔丁基二苯基甲硅烷基)氧基)甲基)-4-((甲基硫基)甲氧基)四氢呋喃-2-基)-2,4-二氧代-1,2,3,4-四氢嘧啶-5-基)丙-2-炔-1-基)-2,2,2-三氟乙酰胺(4)。然后,使用硫酰氯将3’官能团进一步原位转化为3’-O-氯甲基,随后用对甲苯硫代磺酸酯基团原位取代氯,对甲苯硫代磺酸酯基团进一步与甲硫醇盐反应(消除对甲苯亚磺酸酯),得到含二硫键的中间体(65)。
在合成这两个中间体65和10之后,可以例如根据方案13中所示的步骤合成新型可逆终止剂。使用甲醇氨从65中除去三氟乙酰基,随后与活化的连接体10缩合,可得到71。通过用四丁基氟化铵处理71来去除5’-甲硅烷基,然后将核糖上的游离5’-OH进行磷酸化,可得到三磷酸酯73。最后,除去73上的BOC基团,并使74中所得的伯胺与染料的N-羟基琥珀酰亚胺(NHS)酯缩合,可得到核苷可逆终止剂75。由于3’封闭基团是可以被还原剂去除的二硫化物,因此3’封闭基团可以在二硫键连接的染料连接到核苷酸碱基上的同时被去除。
方案13:
试剂和条件:(i)甲醇氨,RT,12h;(ii)10,NaHCO
具有脱氧腺嘌呤、胞苷和鸟嘌呤的其他核苷酸终止剂可以使用与方案12-13所示类似的化学法制备,以提供如图3所示的标记的可逆终止剂。
例如,方案14-15描述了可以提供一些新型标记的可逆终止剂的合成路径。
方案14:
方案15:
方案14-15中所示的化学转化可以通过许多方式完成。例如,方案14中使用的试剂和条件可以是:(i)N-三氟乙酰基炔丙基胺,Pd(PPh
例如,方案16-17描述了可以提供一些新型标记的可逆终止剂的合成路径。
方案16:
方案17:
方案16-17中所示的化学转化可以通过许多方式完成。例如,方案16中使用的试剂和条件可以是:(i)4-氯-5-碘-7H-吡咯并[2.3-d]嘧啶,NaH,ACN;(ii)NH
例如,方案18-19描述了可以提供一些新型标记的可逆终止剂的合成路径。
方案18:
方案19:
方案18-19中所示的化学转化可以通过许多方式完成。例如,方案18中使用的试剂和条件可以是:(i)叔丁基-二苯基甲硅烷基氯化物,吡啶,RT,12h;(ii)三氟乙酸酐,吡啶,RT,12h;(iii)N-碘代琥珀酰胺,DMF,80℃,2h;(iv)N-三氟乙酰基炔丙基胺,Pd(PPh
合成通式(II)或(III)的可逆终止剂可以有许多不同的路径:
其中w为1-5;X为O、S或BH
其中w为1-5;X为O、S或BH
在一些实施方案中,例如,L
为了制备根据本公开的可逆终止剂,核苷向相应的核苷5’-三磷酸的转化可采用实现该目的的多种公开方案中的任一种。(参见例如,Caton-Williams J等人,“Use of aNovel 5′-Regioselective Phosphitylating Reagent for One-Pot Synthesis ofNucleoside 5′-Triphosphates from Unprotected Nucleosides,”Current Protocolsin Nucleic Acid Chemistry,2013,1.30.1-1.30.21;Nagata S等人,“Improved methodfor the solid-phase synthesis of oligoribonucleotide 5′-triphosphates,”Chem.Pharm.Bull.,2012,60(9):1212-15;Abramova等人,“A facile and effectivesynthesis of dinucleotide 5′triphosphates,”Bioorg.Med.Chem.,15:6549-6555,2007;Abramova等人,“Synthesis of morpholine nucleoside triphosphates,”Tet.Lett.,45:4361,2004;Lebedev等人,“Preparation of oligodeoxyribonucleotide5'-triphosphates using solid support approach,”Nucleos.Nucleot.Nucleic.Acids,20:1403,2001;Hamel等人,“Synthesis of deoxyguanosine polyphosphates and theirinteractions with the guanosine5′-triphosphate requiring protein syntheticenzymes of Escherichia coli,”Biochemistry,1975,14(23):5055-5060;Vaghefi M.,“Chemical synthesis of nucleoside 5′-triphosphates,”In:NucleosideTriphosphates and their Analogs,pp.1-22,Taylor&Francis,2005;Burgess等人,“Synthesis of nucleoside triphosphates,”Chem.Rev.,100:2047-2059,2000)。
本公开中的可逆终止剂在糖部分的3′氧处包含(烷基二硫基)甲基基团。这种类型的可逆终止剂核苷酸在用于确定多核苷酸序列的方法中可能是有用的。这些可逆终止剂核苷酸在其中有用的方法可包括但不限于自动化Sanger测序、包括但不限于合成测序的NGS法,等等。许多分析或检测多核苷酸的方法可任选地采用本文公开的可逆终止剂核苷酸。这类方法可任选地采用与模板共价结合的固体基底。该固体基底可以是颗粒或微粒或在当前用于核酸测序的仪器中使用的该类型的平的固体表面。(参见例如,Ruparel等人,Proc.Natl.Acad.Sci.,102:5932-5937,2005;EP 1,974,057;WO 93/21340以及美国专利号5,302,509和5,547,839,以及其中引用的参考文献)。任选地,采用本文公开的可逆终止剂核苷酸的测序反应可以在溶液中进行,或者该反应在固相如微阵列或微珠上进行,其中DNA模板与固体支持物关联。固体支持物可包括但不限于板、珠子、微珠、须状物(whisker)、纤维、梳状物(comb)、杂交芯片、膜、单晶、陶瓷和自组装单层等。模板多核酸可以通过共价结合(如通过使用偶联剂的缀合)或通过非共价结合(如静电相互作用、氢键或抗体-抗原偶联)或通过其组合而附接至固体支持物。存在许多种将核酸附接至固体支持物的方法。
本文涉及的连接体具有足够的长度和稳定性,以允许通过化学或酶手段有效水解或去除。有用的连接体可以是容易获得的,并且可以能够与在连接体的一端上或在连接体中间的羟基部分(或碱基或亲核体)反应。连接体的一端可以能够被标记基团如对于可检测标记物的D1结合或修饰。如果连接体与封端基团附接或者如果连接体与可检测标记物附接,则任选地由其他官能团衍生的连接体中的碳或原子的数目必须具有足够的长度以允许封端基团的化学或酶切割。
尽管为了获得最佳结果,针对不同的反应体系,精确的距离或间距可以不同,但在一些情况下,可以提供保持大体积的标记物部分远离核苷酸一定距离的连接,例如长度为1到20nm的连接体,以减少酶结合位点的空间拥挤。因此,连接体的长度可以是例如1-50个原子长,或1-40个原子长,或2-35个原子长,或3到30个原子长,或5到25个原子长,或10到20个原子长,等等。
连接体可以由任意数目的基础化学起始块组成。例如,连接体可包含在糖基团与可检测标记物例如D
在一些情况下,连接体可选自亚烷基、亚烯基、亚炔基、亚杂烷基、亚环烷基、亚杂芳基烷基、亚杂环烷基、亚芳基、亚杂芳基或[R
K为键、-O-、-S-、-S(O)-、-S(O
每个R
连接体可以在性质上是刚性的或是柔性的。刚性结构包含横向刚性的化学基团,例如,环结构如芳族化合物、相邻基团之间的多个化学键例如双键或三键,以便防止基团相对于彼此旋转,以及由此导致的赋予整个连接体的柔性。因此,期望的刚性程度可以根据连接体的内含物或组成该连接体的单个原子之间的键的数目而改变。此外,沿连接体添加环状结构可以赋予刚性。环状结构可包括芳环或非芳环。环的大小可以是3个碳原子到4个碳原子、到5个碳原子或甚至6个碳原子中的任一个。环还可以任选地包含杂原子如氧或氮,并且也可以是芳族或非芳族的。环可以另外任选地被其他烷基基团和/或取代的烷基基团所取代。
包含环或芳香结构的连接体可包括例如芳基炔和芳基酰胺。本公开的连接体的其他实例包括寡肽连接体,该寡肽连接体还可任选地在其结构内包含环结构。
例如,在一些情况下,可以采用具有螺旋或其他刚性结构的多肽连接体。这类多肽可以由刚性单体组成(该单体从其一级结构以及从其螺旋二级结构两者衍生出刚性),或者可以由赋予刚性二级或三级结构如螺旋、原纤维、片层等的其他氨基酸或氨基酸组合或序列组成。举例而言,可以采用结构化的刚性蛋白质如纤维蛋白、胶原蛋白、微管蛋白等的多肽片段作为刚性连接体分子。
将可检测标记物与核苷酸的碱基附接的所有连接体均包含本公开的二硫化物部分。此外,第二可切割基团如碳酸酯或氨基甲酸酯被置于二硫键与碱基之间的二硫键附近。二硫键与第二可切割基团之间的间距可以是2或3个原子。在一些实施方案中,该间距可以是任选地具有1或2个取代的亚乙基基团。在其他实施方案中,该间距可以是任选地具有1-3个取代的亚丙基基团。
本发明的可逆终止剂的标记物或可检测标记物如D
例如,这类标记物中的一类是荧光标记物。荧光标记物具有以下优点:其以若干个不同的波长(颜色)出现,使得能够可区分地标记各个不同的终止剂分子。(参见例如,Welch等人,Chem.Eur.J.,5(3):951-960,1999)。这类标记物的一个实例是丹磺酰基-官能化的荧光部分。另一个实例是基于花青的荧光标记物Cy3和Cy5,其也可以在本公开中使用。(参见,Zhu等人,Cytometry,28:206-211,1997)。适合使用的标记物还公开于以下文献中:Prober等人,Science,238:336-341,1987;Connell等人,BioTechniques,5(4):342-384,1987;Ansorge等人,Nucl.Acids Res.,15(11):4593-4602,1987;以及Smith等人,Nature,321:674,1986。其他可商购的荧光标记物包括但不限于荧光素和相关的衍生物如异硫氰酸酯衍生物,例如FITC和TRITC、罗丹明,包括TMR、德克萨斯红和Rox、氟硼吡咯(bodipy)、吖啶、香豆素、芘、苯并蒽、花青苷、琥珀酰亚胺酯如NHS-荧光素、马来酰亚胺活化的荧光团如荧光素-5-马来酰亚胺、含有受保护的荧光素的亚磷酰胺试剂、硼-二吡咯亚甲基(BODIPY)染料以及其他荧光团,例如6-FAM亚磷酰胺2。根据需要并根据本申请,所有这些类型的荧光标记物可组合使用、混合使用以及分组使用。
多种可商购的荧光标记物是本领域已知的,如Alexa Fluor染料,例如,Alexa488、555、568、660、532、647和700(Invitrogen-Life Technologies,Inc.,California,USA,以很多种波长可用,参见例如,Panchuk等人,J.Hist.Cyto.,47:1179-1188,1999)。被称为ATTO染料的一大组荧光标记物也是可商购的(可从德国锡根(Siegen)的ATTO-TECGmbH获得)。由于如此之多的不同的吸收和发射谱是可商购的,因此这些荧光标记物可以组合或混合使用,以便为测定中使用的所有终止剂分子提供可区分的发射谱。
在各个示例性实施方案中,标记物包含荧光染料,诸如但不限于,罗丹明染料,例如R6G、R1 10、TAMRA和ROX;荧光素染料,例如JOE、VIC、TET、HEX、FAM等;卤代-荧光素染料;花青染料,例如CY3、CY3.5、CY5、CY5.5等;
本公开中也可以使用多个标记物。例如,双荧光团FRET盒(Tet.Letts.,46:8867-8871,2000)是本领域公知的,并且可在本文公开的方法中使用。还可以使用多氟(Multi-fluor)树枝状体系(J.Amer.Chem.Soc.,123:8101-8108,2001)。其他形式的可检测标记物也是可用的。例如,包括量子点(Empodocles等人,Nature,399:126-130,1999)、金纳米颗粒(Reichert等人,Anal.Chem.,72:6025-6029,2000)、微珠(Lacoste等人,Proc.Natl.Acad.Sci.USA,97(17):9461-9466,2000)在内的微粒以及可通过质谱法检测的标签均可以使用。
本公开中也可以使用多组分标记物。多组分标记物是依赖于与另一种化合物的相互作用进行检测的标记物。生物学中最常用的多组分标记物是生物素-链霉亲和素体系。生物素用作与核苷酸碱基附接的标记物。然后单独添加链霉亲和素以使得检测能够发生。其他的多组分体系是可获得的。例如,二硝基酚具有可商购的、可用于检测的荧光抗体。
因此,如本文定义的“标记物”是有利于分子的检测的部分。本公开的背景下的常见标记物包括荧光、发光、光散射和/或比色标记物。合适的标记物还可包括放射性核素、底物、辅因子、抑制剂、化学发光部分、磁性颗粒等。教导这类标记物的使用的专利包括美国专利号3,817,837;3,850,752;3,939,350;3,996,345;4,277,437;4,275,149;和4,366,241。作为其他非限制性实例,标记物可以是发光标记物、光散射标记物(例如,胶体金颗粒)或酶(例如,辣根过氧化物酶(HRP))。
也可以采用荧光能量转移(FRET)染料,如来自德国的Dyomics GmbH的DY-630/DY-675,Dyomics GmbH还在商业上供应许多不同类型的染料,包括基于酶的标记物、荧光标记物等(参见例如,Dohm等人,“Substantial biases in ultra-short read data sets fromhigh-throughput DNA sequencing,”Nucleic Acids Res.,36:e105,2008)。其他供体/接受体FRET标记物包括但不限于:
(还参见,Johansen,M.K.,“Choosing Reporter-Quencher Pairs for EfficientQuenching Through Formation of Intramolecular Dimers,”Methods in MolecularBiology,vol.335:Fluorescent Energy Transfer Nucleic Acid Probes:Designs andProtocols,由V.V.Didenko编著,Humana Press Inc.,Totowa,N.J.)。其他染料猝灭剂是可商购的,包括dabcyl、QSY猝灭剂等。(还参见,Black Hole Quencher Dyes,来自BiosearchTechnologies,Inc.,Novato,Calif.;Iowa Black Dark Quenchers,来自Integrated DNATechnologies,Inc.,Coralville,Iowa;以及由Santa Cruz Biotechnology,Inc,Dallas,Tex.出售的其他染料猝灭剂)。
标记物和连接体构建体可以具有足以阻止另外的核苷酸掺入到本公开的核苷酸上的大小或结构。这允许进行受控的聚合。该阻止可以是由于空间位阻,或者可以是由于大小、电荷和结构的组合而产生的。
如上文已经评论的,SBS或SBE技术面临的一个关键挑战是寻找能够被聚合酶有效掺入并且提供可以在掺入后容易去除的封端基团的可逆终止剂分子。因此,为了实现本发明请求保护的方法,必须选择对核苷类似物分子的糖部分的3’和5’端处的修饰耐受的聚合酶。这样的耐受的聚合酶是已知并且可商购的。
BB优选的聚合酶缺乏3′-外切核酸酶或其他编辑活性。如别处报道的,9°N-7(exo-)DNA聚合酶的突变形式可进一步改善对这类修饰的耐受性(WO 2005024010;WO2006120433),同时保持高活性和特异性。合适的聚合酶的一个实例是来源于热球菌属(Thermococcus)种9°N-7的THERMINATOR
当采用SBE测序时,合适的DNA聚合酶包括但不限于DNA聚合酶I的Klenow片段、SEQUENASE
此外,已经报道,改变聚合酶的反应条件可以影响其随意性(promiscuity),从而允许掺入修饰的碱基和可逆终止剂分子。例如,已经报道,向聚合酶反应缓冲液添加特定的金属离子例如Mn
随机或定向诱变也可用于产生衍生自天然物种的突变聚合酶的文库;并且可以筛查该文库以选择具有最佳特性如改善的效率、特异性和稳定性、pH以及最佳温度等的突变体。在测序方法中有用的聚合酶通常是衍生自天然来源的聚合酶。可对聚合酶进行修饰以改变其对修饰的核苷酸的特异性,如在例如WO 01/23411、美国专利号5,939,292和WO05/024010中所描述的。而且,聚合酶不必衍生自生物系统。
在掺入后,3'封端基团(即,(烷基二硫基)甲基基团)和经由二硫键与核苷酸的碱基附接的可检测标记物都可以通过包括但不限于化学手段的各种手段从可逆终止剂分子中去除。封端基团的去除将生长的多核苷酸链再活化或释放,从而使其游离以可用于随后通过聚合酶进行的延伸。这使得引物能够以顺序方式受控地延伸单个核苷酸。本文公开的可逆终止剂被设计为允许通过化学手段,并且在一些情况下通过酶手段进行这样的去除。
在一个实施方案中,进行二硫化物切割的还原剂可以是DTT或2-巯基乙醇。在另一个实施方案中,进行二硫化物切割的还原剂可以是DTT。在另一个实施方案中,进行二硫化物切割的还原剂可以是2-巯基乙醇。在一个实施方案中,还原剂可以是三烷基膦和三芳基膦。在另一个实施方案中,进行二硫化物切割的还原剂是三烷基膦。在一个实施方案中,进行二硫化物切割的还原剂是三(2-羧基乙基)膦。
DTT可用于还原二硫键。DTT可以还原溶剂可及的二硫键,例如本文公开的新型可逆终止剂的二硫键。可以控制反应的pH,使得DTT可以切割二硫键。例如,pH高于7。
三烷基膦可以在水中将有机二硫化物还原成硫醇。由于三烷基膦在水溶液中是动力学稳定的、对于二硫键还原是选择性的并且对许多其他官能团(除二硫化物或叠氮化物外)是非反应性的,因此它们在包括与核苷酸如DNA和RNA分子的反应在内的生物化学应用中可以是还原剂。
三烷基膦相对于三芳基膦(例如,Ph
本文使用的术语仅用于描述特定情况的目的,而非旨在限制。除非上下文另有明确规定,否则如本文所用的单数形式“一个”、“一种”和“该”可意欲包括复数形式。此外,就具体实施方式和/或权利要求书中可使用的术语“包括”、“包含”、“具有”或其变化形式而言,这些术语可能旨在以与术语“包含”类似的方式为包含性的。
术语“约”或“大约”可意指在本领域普通技术人员测定的特定值的可接受误差范围内,该可接受误差范围可部分取决于该值如何测量或测定,即,测量系统的局限性。例如,如本文所用的术语“约”表示给定量的值在该值的+/-10%内变化,或任选地在该值的+/-5%内变化,或者在一些实施方案中,在如此描述的值的+/-1%内变化。或者,“约”可指给定值的最多20%、最多10%、最多5%或最多1%的范围。或者,特别是对于生物系统或过程,该术语可指在数值的数量级内,在5倍以内,或在2倍以内。在本申请和权利要求书中可描述特定值的情况下,除非另有说明,否则应推定术语“约”意指在该特定值的可接受误差范围内。同样,在提供值的范围和/或子范围的情况下,范围和/或子范围可以包括范围和/或子范围的端点。。
如本文所用的,术语“基本上”可指接近给定值的100%的值。例如,“基本定位”于器官中的活性剂可以表示相对于活性剂、盐或代谢物的总量,约90重量%的该活性剂、盐或代谢物可以存在于器官中。在某些情况下,该术语可指可以是总量的至少约90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、99.9%或99.99%的量。在某些情况下,该术语可指可以是总量的约100%的量。
如本文所用的,核苷酸有3个字母进行缩写。第一个字母表示含氮碱基的身份(例如A代表腺嘌呤,G代表鸟嘌呤),第二个字母表示磷酸的数目(单、二、三),第三个字母是P,代表磷酸。含有核糖作为糖的核苷三磷酸——核糖核苷三磷酸常规地被缩写为NTP,而含有脱氧核糖作为糖的核苷三磷酸——脱氧核糖核苷三磷酸被缩写为dNTP。例如,dATP代表脱氧核糖腺嘌呤三磷酸。NTP是RNA的结构单元,而dNTP是DNA的结构单元。
如本文所用的术语“固定化”通常是指在两个反应性基团之间形成共价键。例如,反应性基团的聚合是固定化的一种形式。碳与碳的共价键的形成是固定化的一个示例。
如本文所用的术语“标记物”或“可检测标记物”通常是指可检测的或允许检测与该标记物相关联的实体的任何部分或性质。例如,包含荧光标记物的核苷酸、寡核苷酸或多核苷酸可以是可检测的。在某些情况下,标记的寡核苷酸或多核苷酸允许检测杂交复合物,例如在通过酶手段将标记的核苷酸掺入引物和模板核酸的杂交复合物中之后。标记物可以共价或非共价地附接至核苷酸、寡核苷酸或多核苷酸。在某些情况下,标记物可以替代或组合地:(i)提供可检测的信号;(ii)与第二标记物相互作用以修饰由第二标记物提供的可检测信号,例如FRET;(iii)稳定杂交,例如双链体形成;(iv)赋予捕获功能,例如疏水亲和力、抗体/抗原、离子络合,或(v)改变物理性质,如电泳迁移率、疏水性、亲水性、溶解度或色谱行为。标记物在其结构和作用机理上可能有很大差异。标记物的实例可以包括但不限于荧光标记物、非荧光标记物、比色标记物、化学发光标记物、生物发光标记物、放射性标记物、改变质量的基团、抗体、抗原、生物素、半抗原、酶(包括,例如,过氧化物酶、磷酸酶等)。荧光标记物可以包括荧光素家族的染料、罗丹明家族的染料、花菁家族的染料或香豆素、噁嗪、硼杂二氮杂引达省或其任何衍生物。荧光素家族的染料包括例如FAM、HEX、TET、JOE,NAN和ZOE。罗丹明家族的染料包括例如德克萨斯红、ROX、R110、R6G和TAMRA。FAM、HEX、TET、JOE、NAN、ZOE、ROX、R110、R6G和TAMRA可从例如Perkin-Elmer,Inc.(Wellesley,Mass.,USA)商购获得,得克萨斯红可从例如Thermo Fisher Scientific,Inc.(Grand Island,N.Y.,USA)商购获得。花青家族的染料包括例如CY2、CY3、CY5、CY5.5和CY7,并且可从例如GE HealthcareLife Sciences(Piscataway,N.J.,USA)商购获得。
如本文所用的术语“不同的可检测标记物”或“不同地标记的”通常是指这样的可检测标记物,其为不同的化学实体或区分标记物所附接至的不同碱基。
如本文所用的,固体基底可以是生物的、非生物的、有机的、无机的或任何这些的组合。例如,基底可作为颗粒、线、沉淀物、凝胶、片、管、球体、容器、毛细管、垫、切片、膜、板、载玻片或半导体集成芯片中的一种或多种而存在。固体基底可以是平坦的或可呈现替代的表面配置。例如,固体基底可含有在其上发生合成或沉积的凸起或凹陷区域。在一些实例中,可选择固体基底以提供适当的光吸收特性。例如,基底可以是聚合的LangmuirBlodgett膜,功能化玻璃(例如,可控孔度玻璃),二氧化硅,氧化钛,氧化铝,铟锡氧化物(ITO),Si、Ge、GaAs、GaP、SiO2、SiN4、改性硅,半导体集成电路(IC)芯片的顶部电介质层,或者多种凝胶或聚合物如(聚)四氟乙烯、(聚)亚乙烯基二氟化物、聚苯乙烯、聚碳酸酯、聚二甲基硅氧烷(PDMS)、聚甲基丙烯酸甲酯(PMMA)、聚环烯烃(polycyclicolefin)中的任一种,或其组合。
固体基底可包含聚合物涂层或凝胶,如聚丙烯酰胺凝胶或PDMS凝胶。凝胶和涂层可以额外地包含用于改变其物理化学性质例如疏水性的组分。例如,聚丙烯酰胺凝胶或涂层可以在其聚合物结构中包含改性的丙烯酰胺单体,如乙氧基化的丙烯酰胺单体、磷酰胆碱丙烯酰胺单体、甜菜碱丙烯酰胺单体及其组合。
如本文所用的术语“羟基保护基团”通常是指任何这样的基团:其形成对于预期反应稳定的羟基基团的衍生物,其中所述羟基保护基团随后可任选地被选择性地去除。所述羟基衍生物可以通过羟基保护剂与羟基基团的选择性反应来获得。
如本文所用的术语“互补的”通常是指例如在相关的测定条件下与其“互补序列”形成稳定双链体的多核苷酸。通常,彼此互补的两个多核苷酸序列具有少于约20%碱基、少于约10%碱基、优选少于约5%碱基的错配,并且更优选没有错配。
根据上下文,如本文所用的“多核苷酸序列”或“核苷酸序列”通常是指核苷酸的聚合物(寡核苷酸、DNA、核酸等)或是代表核苷酸聚合物的字符串。根据任何指定的多核苷酸序列,可以确定给定的核酸或互补多核苷酸序列(例如,互补核酸)。
如本文所用的“连接基团”或“连接体”通常是指如本公开中描述的可切割连接体,或者是选自亚烷基、亚烯基、亚炔基、亚杂烷基、亚环烷基、亚杂芳基烷基、亚杂环烷基、亚芳基、亚杂芳基或[R
如本文所用的“糖部分”通常是指核糖和脱氧核糖及其衍生物/类似物。
两个多核苷酸当例如在相关的测定条件下缔合形成稳定双链体时“杂交”。核酸杂交是由于多种良好表征的物理化学力,如氢键结合、溶剂排斥、碱基堆积等。核酸杂交的广泛指导见于Tijssen(1993)Laboratory Techniques in Biochemistry and MolecularBiology-Hybridization with Nucleic Acid Probes,第I部分第2章,“Overview ofprinciples of hybridization and the strategy of nucleic acid probe assays”(Elsevier,New York)以及下文的Ausubel。
术语“多核苷酸”(和等价术语“核酸”)包括可以与核苷酸串对应的单体单元的任何物理串,包括核苷酸的聚合物,例如,典型的DNA或RNA聚合物、肽核酸(PNA)、修饰的寡核苷酸,例如,包含对于生物学RNA或DNA不典型的核苷酸的寡核苷酸,如2′-O-甲基化的寡核苷酸,等。多核苷酸的核苷酸可以是脱氧核糖核苷酸、核糖核苷酸或核苷酸类似物,可以是天然的或非天然的,并且可以是未置换的、未修饰的、置换的或修饰的。核苷酸可以通过磷酸二酯键或通过硫代磷酸酯键、甲基膦酸酯键、硼烷磷酸酯键等连接。多核苷酸可另外包含非核苷酸元件,如标记物、猝灭剂、封端基团等。多核苷酸可以是例如单链的或双链的。
如本文所用的术语“寡核苷酸”通常是指核苷酸链。在一些情况下,寡核苷酸为少于200个残基的长度,例如15至100个核苷酸的长度。寡核苷酸可包含至少或大约1、2、3、4、5、6、7、8、9、10、15、20、25、30、35、40、45或50个碱基。寡核苷酸可以是约3至约5个碱基、约1至约50个碱基、约8至约12个碱基、约15至约25个碱基、约25至约35个碱基、约35至约45个碱基或约45至约55个碱基。寡核苷酸(也被称为“oligo”)可以是任何类型的寡核苷酸(例如,引物)。寡核苷酸可包含天然核苷酸、非天然核苷酸或其组合。
在核酸类似物的语境中,术语“类似物”意在表示多种已知核酸类似物中的任一种,诸如但不限于LNA、PNA等。此外,“核苷三磷酸类似物”可含有3-7个磷酸基团,其中磷酸上的一个氧(-O
其中Y为CH或N。嘌呤和嘧啶碱基或其类似物的一个氮原子连接至核糖或脱氧核糖的C-1位置。如上所示,嘌呤和嘧啶碱基或其类似物的一个碳原子连接至通向标记物的连接体。
在本申请中使用的术语“芳族”意指根据休克尔规则(Huckel'srule),具有至少一个具有共轭π电子体系的环(即,具有4n+2个离域电子的芳族碳分子)的芳族基团,并且包括碳环芳基(例如,苯基)和杂环芳基(例如,吡啶)。该术语包括单环或稠环多环(即,共享相邻的碳原子对的环)基团。
本文中使用的术语“杂环核酸碱基”意指DNA或RNA的含氮碱基。这些碱基可分为两类:嘌呤和嘧啶。前者包括鸟嘌呤和腺嘌呤,而后者包括胞嘧啶、胸腺嘧啶和尿嘧啶。
如在本公开中使用的,在“芳族溶剂”的语境中使用的术语“芳族”意指任何已知的和/或可商购的芳族溶剂,诸如但不限于甲苯、苯、二甲苯、任何的Kesol和/或GaroSOL,及其衍生物和混合物。
除非另有说明,术语“烷基”本身或作为另一个取代基的一部分意指直链或支链或环状烃基或它们的组合,其可以是完全饱和的、单不饱和的或多不饱和的,并且可包括二价和多价基团,具有指定的碳原子数,即,C
术语“亚烷基”本身或作为另一个取代基的一部分意指衍生自烷烃的二价基团,例如但不限于-CH
术语“烷氧基”、“烷基氨基”和“烷基硫基”(或硫代烷氧基)以它们的常规意义使用,并分别指经由氧原子、氨基基团或硫原子与分子的其余部分附接的那些烷基基团。
除非另有说明,术语“杂烷基”本身或与另一术语组合起来意指稳定的直链或支链或环状烃基,或它们的组合,其由规定数目的碳原子和至少一个选自O、N、Si和S的杂原子组成,并且其中氮和硫原子可任选地被氧化并且氮杂原子可任选地被季铵化。杂原子O、N和S和Si可以置于杂烷基基团的任何内部位置或烷基基团附接至分子的其余部分的位置。实例包括但不限于-CH
除非另有说明,术语“环烷基”和“杂环烷基”本身或与其他术语组合起来分别表示环状形式的“烷基”和“杂烷基”。此外,对于杂环烷基,杂原子可以占据杂环与分子的其余部分附接的位置。环烷基的实例包括但不限于环戊基、环己基、1-环己烯基、3-环己烯基、环庚基等。杂环烷基的实例包括但不限于1-(1,2,5,6-四氢吡啶基)、1-哌啶基、2-哌啶基、3-哌啶基、4-吗啉基、3-吗啉基、四氢呋喃-2-基、四氢呋喃-3-基、四氢噻吩-2-基、四氢噻吩-3-基、1-哌嗪基、2-哌嗪基等。
除非另有说明,术语“卤代”或“卤素”本身或作为另一个取代基的一部分意指氟、氯、溴或碘原子。此外,诸如“卤代烷基”的术语意在包括单卤代烷基和多卤代烷基。例如,术语“卤代(C
除非另有说明,术语“芳基”意指多不饱和的芳族取代基,该取代基可以是单环,诸如遵循休克尔规则(4n+2,其中n为任意整数)的那些,或稠合在一起或共价连接并且包括遵守Clar规则的那些的多环(优选1至5个环)。术语“杂芳基”指含有一至四个选自N、O和S的杂原子的芳基基团(或环),其中氮和硫原子任选地被氧化,并且氮原子任选地被季铵化。杂芳基基团可通过杂原子与分子的其余部分附接。芳基和杂芳基基团的非限制性实例包括苯基、1-萘基、2-萘基、4-联苯基、1-吡咯基、2-吡咯基、3-吡咯基、3-吡唑基、2-咪唑基、4-咪唑基、吡嗪基、2-噁唑基、4-噁唑基、2-苯基-4-噁唑基、5-噁唑基、3-异噁唑基、4-异噁唑基、5-异噁唑基、2-噻唑基、4-噻唑基、5-噻唑基、2-呋喃基、3-呋喃基、2-噻吩基、3-噻吩基、2-吡啶基、3-吡啶基、4-吡啶基、2-嘧啶基、4-嘧啶基、5-苯并噻唑基、嘌呤基、2-苯并咪唑基、5-吲哚基、1-异喹啉基、5-异喹啉基、2-喹喔啉基、5-喹喔啉基、3-喹啉基、四唑基、苯并[b]呋喃基、苯并[b]噻吩基、2,3-二氢苯并[1,4]二氧杂环己-6-基、苯并[1,3]二氧戊环-5-基和6-喹啉基。每一个以上所述芳基和杂芳基环系的取代基选自以下所述的可接受的取代基。
为简便起见,术语“芳基”当与其他术语组合使用时(例如芳氧基、芳基硫氧基(arylthioxy)、芳基烷基),包括如上定义的芳基和杂芳基环两者。因此,术语“芳基烷基”意在包括其中芳基基团与烷基基团附接的那些基团,例如,苄基、苯乙基、吡啶基甲基等,包括其中碳原子(例如,亚甲基基团)已经被例如氧原子替代的那些烷基基团,例如,苯氧基甲基、2-吡啶基氧基甲基、3-(1-萘基氧基)丙基等。
以上每一个术语,例如,“烷基”、“杂烷基”、“芳基”和“杂芳基”,意在包括所指示基团的取代和未取代形式。以下提供了每种类型的基团的优选取代基。
包括通常被称为亚烷基、烯基、亚杂烷基、杂烯基、炔基、环烷基、杂环烷基、环烯基和杂环烯基的那些基团在内的烷基和杂烷基基团的取代基通称为“烷基基团取代基”,并且它们可以是数目在零至(2M′+1)范围内的选自但不限于以下基团的多种基团中的一种或多种:-OR′、=O、=NR′、=N-OR′、-NR′R″、-SR′、-卤素、-SiR′R″R′″、-OC(O)R′、-C(O)R′、-CO
类似于针对烷基基团所述的取代基,芳基和杂芳基基团的取代基通称为“芳基基团取代基”。该取代基选自例如:数目在零至芳族环系上开放化合价总数范围内的卤素、-OR′、=O、=NR′、=N-OR′、-NR′R″、-SR′、-卤素、-SiR′R″R′″、-OC(O)R′、-C(O)R′、-CO
除非另有说明,如本文所用的术语“催化量”包括足以使本公开的方法的反应发生的反应物的量。因此,组成催化量的量是用来允许或提高反应速率的任意量,越大的量通常提供越大的提高。在任何特定应用中使用的量可在很大程度上由制造设施的单独需求来决定。纳入这样的决定的因素包括催化剂成本、回收成本、所需的反应时间以及系统容量。可以使用如下量的反应物:在约0.001至约0.5当量、约0.001至约0.25当量、约0.01至约0.25当量、约0.001至约0.1、约0.01至约0.1当量的范围内,包括约0.005、约0.05或约0.08当量的反应物/底物,或在约0.001至约1当量、约0.001至约0.5当量、约0.001至约0.25当量、约0.001至约0.1当量、约0.01至约0.5当量或约0.05至约0.1当量的范围内,包括约0.005、约0.02或约0.04当量。
除非另有说明,否则如本文所用的术语“可切割化学基团”包括对在核苷酸类似物中的核糖或脱氧核糖的3′-位置处的-OH基团加帽的化学基团。可切割化学基团可以是任何这样的化学基团,其1)在聚合酶反应期间是稳定的,2)不干扰核苷酸类似物作为底物被聚合酶的识别,并且3)可被碱性试剂切割。
申请人意识到,存在许多可以命名和以其他方式描述有机化合物的约定和体系,包括通用命名以及体系,如IUPAC体系。
在整个本申请中使用的缩写具有以下提供的含义。以下提供的含义并非意在限制,而是意在同时涵盖本领域技术人员所理解的任何等价的通用或系统名称。以下未列出的任何其他缩写名称应具有本领域技术人员通常所理解的含义。
I
TBDMS=叔丁基二甲基硅烷基
TBDPS=叔丁基二苯基硅烷基
BOC=叔丁氧羰基
Pyr=吡啶碱
THF=四氢呋喃
TsOH=对甲苯磺酸
DCA=二氯乙酸
Bu
DMF=二甲基甲酰胺
Py=吡啶
TEAB=三乙基碳酸氢铵
DMTO=4,4’-二甲氧基三苯基甲氧基
CEO=2-氰基乙氧基
TIPSCl=三异丙基硅烷醚氯化物
Et=乙基
EtOAc=乙酸乙酯
Ph=苯基
(PhO)
CEO-P(NiPr
iPr
DBU=1,8-二氮杂双环十一碳-7-烯
FMOC=芴基甲氧羰基
TCEP=(三(2-羧乙基)膦)
CDI=1,1′-羰基二咪唑
RT=室温
MeOH=甲醇
TBA=叔丁醇或2-甲基-2-丙醇
TEA=三乙醇胺
TFP=四氟丙醇或2,2,3,3-四氟-1-丙醇
BSA=牛血清白蛋白
DTT=二硫苏糖醇
ACN=乙腈
NaOH=氢氧化钠
IE HPLC=离子交换高效液相色谱法
TLC=薄层色谱法
TCEP=三(2-羧乙基)膦
合成方法的大小和规模可根据所需的终产物量而变化。应理解,尽管实施例中提供了具体的反应物和量,但本领域技术人员知晓同样可产生相同化合物的其他替代的和同样可行的成组反应物。因此,当使用一般的氧化剂、还原剂、不同性质(非质子性、非极性、极性等)的溶剂时,其等价物可在此考虑用于本发明的方法中。
例如,在所有情况下,当使用干燥剂时,所考虑的干燥剂包括在文献中报道以及技术人员已知的所有干燥剂,诸如但不限于硫酸镁、硫酸钠、硫酸钙、氯化钙、氯化钾、氢氧化钾、硫酸、生石灰、五氧化二磷、碳酸钾、钠、硅胶、氧化铝、氢化钙、氢化铝锂(LAH)、氢氧化钾等。(参见,Burfield等人,“Desiccant Efficiency in Solvent Drying.A Reappraisalby Application of a Novel Method for Solvent Water Assay,”J.Org.Chem.,42(18):3060-3065,1977)。在每个后处理(work up)中添加的干燥剂的量可以由本领域技术人员优化,并且没有特别地限制。此外,尽管针对每一步中的中间体的后处理提供了一般性指导,但技术人员通常理解,其他任选的溶剂和试剂可以在后处理步骤中等价地被替换。然而,在一些例外的情况下,发现需要非常特殊的后处理条件来保持不稳定的中间体。这些情况在下文中其出现的步骤中进行说明。
以下的多个步骤说明了反应终止后的各种后处理。后处理通常包括将反应猝灭以终止任何残留的催化活性和起始试剂。这之后通常为有机溶剂的添加,以及水层与有机层的分离。产物通常从有机层中获得,而未使用的反应物和其他假的副产物以及不想要的化学品通常留在水层中并丢弃。在整个文献中发现的标准有机合成程序中的后处理之后通常为以下操作:通过暴露于干燥剂来干燥产物以去除任何过量的水或剩余的、部分溶解在有机层中的水性副产物,并浓缩剩余的有机层。溶解在溶剂中的产物的浓缩可以通过任何已知的手段实现,如在压力下蒸发、在升高的温度和压力下蒸发等等。这样的浓缩可通过使用标准的实验室设备如旋转蒸发器蒸馏等来实现。这之后任选地为一个或多个纯化步骤,其可包括但不限于快速柱色谱法、通过各种介质过滤和/或本领域已知的其他制备性方法,和/或结晶/重结晶。(参见例如,Addison Ault,“Techniques and Experiments forOrganic Chemistry,”第6版.,University Science Books,Sausalito,Calif.,1998,AnnB.McGuire编著.,pp.45-59)。尽管可能在下文所述的步骤中指出了某些有机共溶剂和猝灭剂,但技术人员已知的其他等价的有机溶剂和猝灭剂也同样可被采用,并且是在本文中充分考虑到的。此外,大多数步骤中的大多数后处理可根据偏好和期望的最终用途或终产物而进一步改变。干燥和蒸发-有机合成化学实验员所做的常规步骤-不必使用,并且可被认为在所有步骤中都是可选的。根据期望的结果和反应规模,采用有机溶剂萃取的次数可以多达一次、两次、三次、四次、五次或十次或更多次。除非特别指出,在后处理中使用的猝灭剂的体积、量以及有机溶剂的体积可以根据具体的反应条件而变化,并进行优化,以产生最佳的结果。
另外,当指出惰性气体或稀有气体时,在本领域中常用的任何惰性气体均可替代所指出的惰性气体,如氩、氮、氦、氖等。
本文引用了多个专利和出版物,以便更全面地描述和公开本发明的方法、化合物、组合物和试剂盒,以及其所属领域的情况。为了说明背景、已知方法,以及特别地为了提供关于本发明方法、组合物和/或试剂盒的实施的额外细节而在本文中引用的参考文献、出版物、专利、书籍、手册和其他材料全部为了所有目的通过引用而全文并入本文,其引用程度如同特别地且单独地指明每个单独的参考文献通过引用而并入。
应当理解,本文所述的实施例和实施方案用于说明性目的,并且基于此的各种修改或变化将为本领域技术人员提供建议且包含在本申请的精神和范围以及权利要求书的范围内。相应地,提供以下实施例是为了说明而非限制所请求保护的发明。
以下实施例描述了方案2-4中所示的详细合成步骤。具体地,方案2中使用的试剂和条件为:(i)N-三氟乙酰基炔丙基胺、Pd(PPh
方案3中使用的试剂和条件为:(i)2-巯基乙醇、吡啶、无水MeOH,RT,12h,(ii)BOC-半胱胺、吡啶、MeOH,RT,12h,(iii)4-硝基苯基氯甲酸酯、Et
方案4中使用的试剂和条件为:(i)TFA水溶液;(ii)10、NaHCO
2,2,2-三氟-N-(3-(1-((2R,4S,5R)-4-羟基-5-(羟基甲基)四氢呋喃-2-基)-2,4-二氧代-1,2,3,4-四氢嘧啶-5-基)丙-2-炔-1-基)乙酰胺(2)的合成。在氮气下向5-碘尿苷1(5.0g,14.1mmol)在无水DMF(40mL)的溶液中添加CuI(0.20g,1.05mmol)和Pd(PPh
N-(3-(1-((2R,4S,5R)-5-(((叔丁基二苯基甲硅烷基)氧基)甲基)-4-羟基四氢呋喃-2-基)-2,4-二氧代-1,2,3,4-四氢嘧啶-5-基)丙-2-炔-1-基)-2,2,2-三氟乙酰胺(3)的合成。在N
N-(3-(1-((2R,4S,5R)-5-(((叔丁基二苯基甲硅烷基)氧基)甲基)-4-((甲基硫基)甲氧基)四氢呋喃-2-基)-2,4-二氧代-1,2,3,4-四氢嘧啶-5-基)丙-2-炔-1-基)-2,2,2-三氟乙酰胺(4)的合成。随后在N
化合物6的合成。将化合物4和环己烯在无水二氯甲烷中的溶液冷却至0℃,并在N
2-(吡啶-2-基二硫基)乙-1-醇(8)。将2-巯基乙醇(3.9g,49.9mmol)添加到1,2-二(吡啶-2-基)二硫烷7(10g,45.4mmol)在吡啶/甲醇(3:200mL)中的溶液中,并将混合物搅拌过夜。将混合物蒸发至干,并将残余物通过硅胶快速色谱法纯化。将残余物用在己烷中的30-50%乙酸乙酯洗脱,得到呈无色油状物的产物8(4.5g,53%)。1H-NMR(CDCl
(2-((2-羟基乙基)二硫基)乙基)氨基甲酸叔丁酯(9)。向化合物8(0.9g,4.8mmol)在甲醇/吡啶(40/1mL)中的溶液中添加BOC-半胱胺(2.1g,11.8mmol),并将混合物搅拌过夜。将反应浓缩,并将残余物通过硅胶快速色谱法进行纯化。采用在己烷中的40-60%乙醇梯度获得呈无色油的产物9(1.04g,86%)。1H-NMR(CDCl3)δ4.89(br s,1H,OH),3.88-3.91(t,J=5.6Hz,2H,OCH
(2-((2-(((4-硝基苯氧基)羰基)氧基)乙基)二硫基)乙基)-氨基甲酸叔丁酯(10)。在氮气下,在10分钟内向化合物9(0.80g,3.16mmol)在无水乙腈中的冷却(4℃)溶液中缓慢地添加三乙胺(540uL,3.82mmol)和4-硝基苯基碳酸酯(0.75g,3.72mmol)的乙腈溶液。将反应在室温下进一步搅拌过夜。在去除挥发物后,将粗残余物通过硅胶快速色谱法进行纯化。洗脱出呈白色结晶固体的产物10(1.05g,75%)。1H-NMR(CDCl
化合物11的合成。用TFA水溶液除去伯胺6上的BOC基团,得到中间体11。
化合物12的合成。向中间体11在乙腈中的溶液中添加10在乙腈中的溶液,并将反应搅拌过夜。用乙酸乙酯稀释反应物,并用盐水洗涤。分离有机层,用无水MgSO
化合物13的合成。向12在无水THF中的的溶液中加入三乙胺三氟化氢的溶液,并将混合物在55℃下加热3h。除去挥发物,残余物通过硅胶急骤色谱法纯化,得到中间体13。
化合物14的合成。在氮气下,向13在无水THF和无水吡啶(v/v=1:1)中的溶液中加入溶解于THF中的2-氯-4H-1,3,2-苯并二氧杂磷杂环己烷-4-酮的溶液,并搅拌持续1.5h。随后加入三丁胺和焦磷酸三丁基铵,并进一步搅拌3h。将叔丁基过氧化氢溶液加入反应中,并进一步搅拌1h。然后将反应用水猝灭,并放置过夜。粗产物通过离子交换HPLC纯化,其中使用Dionex DNA Pac柱(9x 250mm)和50mM TRIS作为缓冲液A,50mM Tris和800mM氯化铵作为缓冲液B,梯度为在30min内0-40%B,得到化合物14。
化合物15的合成。将三氟乙酸水溶液添加至14的水溶液中,并搅拌4h。通过反相HPLC分离所需产物,其中使用Hamilton PRP柱(21.2x250mm)和50mm碳酸三乙铵作为缓冲液A,乙腈作为缓冲液B,使用在30分钟内0-40%B的梯度。
荧光素标记的终止剂16的合成:向15的水溶液中添加含荧光标记物的琥珀酰亚胺酯在DMSO中的溶液。反应混合物的pH保持在约8.3。将反应搅拌过夜。粗产物通过反相HPLC纯化,其中使用50mM三乙基碳酸氢铵作为缓冲液A,使用乙腈作为缓冲液B,使用在30分钟内0-40%B的梯度,得到可逆终止剂16。
以下实施例描述了方案12-13中所示的详细合成步骤。具体而言,方案12中使用的试剂和条件为:(i)N-三氟乙酰基炔丙基胺,Pd(PPh
方案13中使用的试剂和条件为:(i)甲醇氨,RT,12h;(ii)10,NaHCO
N-(3-(1-((2R,4S,5R)-5-(((叔丁基二苯基甲硅烷基)氧基)甲基)-4-((甲基二硫基)甲氧基)四氢呋喃-2-基)-2,4-二氧代-1,2,3,4-四氢嘧啶-5-基)丙-2-炔-1-基)-2,2,2-三氟乙酰胺(65)的合成。将化合物4(2.23g,3.31mmol)的二氯甲烷(40mL)溶液冷却(-78℃)。加入环己烯(1.67mL,16.5mmol)和硫酰氯(8.27mL,8.26mmol),并将反应混合物搅拌1h,直到所有起始材料被消耗(通过TLC指示)。让反应升温至室温,并加入对甲苯硫代磺酸盐的乙腈溶液(12mL),并进一步搅拌2h。然后将甲醇钠加入到反应混合物中,并将反应混合物进一步搅拌1.5h。将反应混合物过滤,并将滤液在真空下浓缩。残余物通过使用乙酸乙酯的己烷溶液(5%至40%)的硅胶急骤色谱法纯化,得到呈白色泡沫的产物5(2.02g,86%)。1H-NMR(CDCl3)δ8.67(br s,1H,NH),8.17(s,1H,H-6),7.65-7.69(m,4H,Ar-H),7.42-7.50(m,6H,Ar-H),6.30(dd,J=5.6Hz and 2.8Hz,1H,H-1’),4.76-4.86(q,J=17.6and11.6Hz,2H,OCH
C
5-(3-氨基丙-1-炔-1-基)-1-((2R,4S,5R)-5-(((叔丁基二苯基甲硅烷基)氧基)甲基)-4-((甲基二硫基)甲氧基)四氢呋喃-2-基)嘧啶-2,4(1H,3H)-二酮(70)。在密封管中将化合物65(2.00g,2.83mmol)溶解于甲醇氨(40mL)中,并在室温下搅拌过夜。在真空下除去所有挥发物,并在高真空下进一步干燥1h,得到70的粗产物,其原样用于下一步。
(2-((2-(((3-(1-((2R,4S,5R)-5-(((叔丁基二苯基甲硅烷基)氧基)-甲基)-4-((甲基二硫基)甲氧基)四氢呋喃-2-基)-2,4-二氧代-1,2,3,4-四氢嘧啶-5-基)丙-2-炔-1-基)氨基甲酰基)氧基)乙基)二硫基)乙基)氨基甲酸叔丁酯(71)。将粗品70溶解在吡啶中,并向其中加入连接体10(3.55g,8.49mmol)。将反应在室温下进一步搅拌过夜。将反应混合物在真空下浓缩,并将残余物溶解于乙酸乙酯中,用饱和碳酸氢钠和盐水洗涤。分离有机层,经硫酸镁干燥并浓缩。残余物通过使用EA的己烷溶液(0至55%)的硅胶急骤色谱法纯化,得到呈白色固体的产物71(1.18g,47%)。
(2-((2-(((3-(1-((2R,4S,5R)-5-(羟基甲基)-4-((甲基二硫基)甲氧基)四氢呋喃-2-基)-2,4-二氧代-1,2,3,4-四氢嘧啶-5-基)丙-2-炔-1-基)氨基甲酰基)氧基)乙基)二硫基)乙基)氨基甲酸叔丁酯(72)。向71(1.15g,1.30mmol)在无水THF(10mL)中的溶液中加入三乙胺-三氟化氢(3.55g,8.49mmol)的溶液,并将混合物在室温下搅拌过夜。除去挥发物,并将油状残余物通过使用甲醇的二氯甲烷溶液(0至35%)的硅胶急骤色谱法纯化,得到呈白色固体的产物72(0.34g,40%)。
(2-((2-(((3-(1-((2R,4S,5R)-5-(((羟基((羟基(膦酰氧基)磷酰基)氧基)磷酰基)氧基)甲基)-4-((甲基二硫基)甲氧基)四氢呋喃-2-基)-2,4-二氧代-1,2,3,4-四氢嘧啶-5-基)丙-2-炔-1-基)氨基甲酰基)氧基)乙基)二硫基)乙基)氨基甲酸叔丁酯(73)。在氮气下,向72(0.15g,0.23mmol)在无水THF和吡啶(各5mL)中的溶液中加入2-氯-1H-1,3,2-苯并二氧杂磷杂环己烷-4-酮(0.060g,0.29mmol)溶解在1mL THF中的溶液,搅拌1h(当TLC没有显示出任何起始材料时)。随后加入三丁胺(0.17g,0.94mmol)和三丁基焦磷酸铵(在DMF中的0.5mmol溶液,0.7mL,0.35mmol),并进一步搅拌1.5h。将叔丁基过氧化氢溶液(癸烷中的5.5m溶液,210μl,1.1mmol)加入反应中,并进一步搅拌1h。然后将反应用水猝灭,并放置过夜。将反应混合物浓缩,并将残余物通过使用Hamilton PRP柱(21.2x 250mm)的反相HPLC纯化。梯度为在30min内在乙腈(B,0-20%)中的三乙基碳酸氢铵(A,25mM),得到产物73。针对C
2-((2-氨基乙基)二硫基)乙基(3-(1-((2R,4S,5R)-5-(((羟基((羟基(膦酰氧基)磷酰基)氧基)磷酰基)氧基)甲基)-4-((甲基二硫基)甲氧基)四氢呋喃-2-基)-2,4-二氧代-1,2,3,4-四氢嘧啶-5-基)丙-2-炔-1-基)氨基甲酸酯(74)。向冷却的13(33.30μmol)的水溶液中加入三氟乙酸水溶液(在52μL水中的410μL),并将所得混合物搅拌过夜。通过使用Hamilton PRP-柱(21.2x 250mm)的反相HPLC纯化混合物。梯度为在30min内在乙腈(B,0-20%)中的三乙基碳酸氢铵(A,25mM),得到产物74。针对C
(6-(3-羧基-4-((2-((2-(((3-(1-((2R,4R,5R)-5-(((羟基((羟基(膦酰氧基)磷酰基)氧基)磷酰基)氧基)甲基)-4-((甲基二硫基)甲氧基)四氢呋喃-2-基)-2,4-二氧代-1,2,3,4-四氢嘧啶-5-基)丙-2-炔-1-基)氨基甲酰基)氧基)乙基)二硫基)乙基)氨基甲酰基)苯基)-2,2,10,10-四甲基-8-(磺基甲基)-10,11-二氢-2H-吡喃并[3,2-g:5,6-g']二喹啉-1-鎓-4-基)甲磺酸酯(75)。向74(1.03mM)在碳酸钠/碳酸氢钠缓冲液(pH 9.2,280μL)中的溶液中加入ALEXA
酶促掺入和裂解研究:S-((((2R,3S,5R)-5-(5-(3-((叔丁氧羰基)氨基)丙-1-炔-1-基)-2,4-二氧代-3,4-二氢嘧啶-1(2H)-基)-2-(((羟基((羟基(膦酰氧基)磷酰基)氧基)磷酰基)氧基)甲基)四氢呋喃-3-基)氧基)甲基)硫代乙酸酯(60),一种模型化合物,以类似于方案2-4中公开的相关反应的条件进行合成。
图2显示了化合物60可以用于在DNA聚合酶(“CENT1”)(泳道3)的存在下的酶促掺入,通过在所有四种未修饰的dNTP和聚合酶存在下的“失控”反应中处理由此获得的酶产物阻断终止剂掺入后的进一步延伸(泳道4),标记和封闭基团的裂解(泳道5),以及裂解后由添加的下一个碱基的进一步延伸(泳道6)。
酶促掺入和裂解研究:(6-(3-羧基-4-((2-((2-(((3-(1-((2R,4R,5R)-5-(((羟基((羟基(膦酰氧基)磷酰基)氧基)磷酰基)氧基)-甲基)-4-((甲基二硫基)甲氧基)四氢呋喃-2-基)-2,4-二氧代-1,2,3,4-四氢嘧啶-5-基)丙-2-炔-1-基)氨基甲酰基)氧基)乙基)二硫基)乙基)氨基甲酰基)-苯基)-2,2,10,10-四甲基-8-(磺基甲基)-10,11-二氢-2H-吡喃并[3,2-g:5,6-g']二喹啉-1-鎓-4-基)甲磺酸酯(75),在图4(泳道3)中显示出极好的酶掺入,其在DNA聚合酶(“CENT1”)的存在下使用化合物75。它还显示出通过在“失控”反应中(在所有四种未修饰的dNTP和DNA聚合酶的存在下)处理由此获得的酶促产物,对终止剂掺入后的进一步延伸的极好阻断(泳道4)。然后,在用DTT处理(泳道5)后,可观察到3’封闭基团与标记的连接体标签的同时裂解,和在添加的碱基上的进一步延伸(泳道6),以及在所有四种未修饰的dNTP和DNA聚合酶存在下的“失控”反应中继续延伸(泳道7和8)。
虽然本文已经显示并描述了本发明的优选实施方案,但是对于本领域技术人员显而易见的是,这些实施方案仅以示例的方式提供。在不脱离本发明的情况下,本领域技术人员现将想到许多变化、改变和替换。应当理解,在实施本发明的过程中可以采用本文所述的本发明实施方案的各种替代方案。旨在以所附权利要求书限定本发明的范围,由此涵盖在这些权利要求范围内的方法和结构及其等同物。
- 二硫键连接的可逆终止剂
- 二硫键连接的可逆终止子
