铁死亡抑制剂在制备改善衰老个体运动功能的制剂中的应用
文献发布时间:2023-06-19 12:04:09
技术领域
本发明属于生物医药领域,具体涉及Ferrostaine-1在制备抑制衰老骨骼肌铁死亡,改善 衰老个体运动功能的制剂中的应用。
背景技术
程序性细胞死亡(PCD),例如凋亡,自噬和新发现的程序性坏死(也称为坏死性凋亡) 是在机体和器官发育/再生过程中清除死的、非必需或衰老细胞的关键过程。骨骼肌不仅是运 动的主要器官,而且还参与调节全身代谢。肌肉细胞死亡以多种形式发生,例如凋亡,坏死 和自噬。在再生条件下,细胞死亡,清除和再生受到精确调节,而这些过程的调节异常会导 致肌肉营养不良和肌肉减少症。骨骼肌坏死在各种病原性条件下发生,例如肌肉营养不良和 局部缺血。但是,急性或生理性损伤会激活细胞凋亡,而细胞凋亡受几种关键分子(例如抗 凋亡癌蛋白Bcl2,Caspase 3和死亡受体Fas/Apo1/Cd953)调节。该过程伴有炎性白细胞, 特别是巨噬细胞的浸润。在再生的初始阶段,M1巨噬细胞对于骨骼肌再生过程中的细胞因子 分泌,纤维碎片清除,铁循环以及成肌细胞分化,成纤维前体细胞(FAP)和免疫细胞平衡 都是必不可少的。纤维碎片清除完成后,M1转化为M2巨噬细胞,有助于分泌抗炎细胞因子 并促进再生。
除这些发现外,铁死亡是一种新近确定的独特的细胞死亡途径,它参与了多种疾病的发 生和发展,例如癌症,缺血再灌注引起的心肌病,变性疾病和中风。铁死亡是通过脂质过氧 化物的积累而依赖铁和活性氧(ROS)的氧化损伤。最近的一项研究表明,在心肌病死亡的 发展过程中,Nrf2介导的Hmox1的上调有助于血红素降解释放铁,导致线粒体脂质双层上的 脂质过氧化,这是肥大症引起的心脏损害的主要机制。其他疾病,例如肝纤维化或肝硬化也 与铁依赖性细胞死亡有关。肝硬化患者被诊断出铁含量较高和脂质过氧化,但转铁蛋白(Trf) 含量较低。在高铁饮食下,肝脏特异的Trf缺失小鼠容易患上由肥大病引起的肝纤维化。此 外,还没有在其他器官如骨骼肌中报道过肥大症的致病性。
骨骼肌的生长和再生依赖于从中胚层形成的成体干细胞的一种亚型,即卫星细胞。卫星 细胞被认为是成年干细胞,因为它们在骨骼肌中保持自我更新和显着的产后再生潜能。静态 的卫星细胞位于肌纤维的基底层和质膜之间。它们通过外部刺激或肌肉损伤被激活,然后进 入细胞周期,增殖和分化以修复受损的肌管。此过程受一组肌原性调节因子调节,包括但不 限于MyoD和肌生成素。其他一些新近发现的转录因子也参与调节卫星细胞生理,并进一步 扩展到骨骼肌的发育和再生,例如。阴阳蛋白1(YY1)和缺氧诱导因子2a(HIF2a),它们 的失调导致卫星细胞的功能障碍,并最终导致生长和再生障碍。
同时,骨骼肌的生长和再生伴随着各种营养素的精确调节,例如氨基酸,碳水化合物和 矿物质。微量矿物质作为关键营养成分,在骨骼肌的生理功能和能量代谢中起重要作用。铁 是必需的微量矿物质,它是维持骨骼肌适当功能(例如,肌肉细胞分化,骨骼肌生长和肌红 蛋白生物合成等)所必需的。铁从食物中释放出来并被小肠上皮细胞吸收。在血液循环中, 转铁蛋白结合铁(TBI)通过转铁蛋白受体1(Tfr1)的作用而被识别,内化和吸收,该蛋白 普遍存在于诸如肝脏,脂肪组织和骨骼肌等外周组织中。
发明内容
本发明的目的是提供铁死亡抑制剂在制备改善衰老个体运动功能的制剂中的应用。
本发明人最新研究发现Tfr1表达随着年龄的增长而在骨骼肌和肌卫星细胞中逐渐下降。 肌卫星细胞特异的Tfr1缺失导致再生潜力降低,表现为萎缩表型,铁和脂肪细胞蓄积,巨噬 细胞浸润,运行能力降低,线粒体应激和代谢功能障碍。来自Tfr1肌卫星细胞缺失的小鼠的 TA肌肉的基因表达谱鉴定出一组与不饱和脂肪酸的生物合成,谷胱甘肽代谢和铁死亡相关的 基因,这可能是导致肌卫星细胞的不可逆的耗竭,可能是由于Slc39a14表达上调所致。非转 铁蛋白结合铁的转运可加剧铁介导的细胞死亡。该遗传模型还模拟了一种与膜结合的Tfr1蛋 白减少但Slc39a14的膜富集的表型,以在老年小鼠骨骼肌中摄取非转铁蛋白结合铁,诱发骨 骼肌铁死亡的发生。此外,我们发现,Ferrostatin-1的腹腔注射能够缓解衰老骨骼肌铁死亡的 表型,改善骨骼肌运动功能。
因此,本发明提供了铁死亡抑制剂在制备改善衰老个体运动功能的制剂中的应用。
优选,铁死亡抑制剂在制备抑制骨骼肌铁死亡改善衰老个体运动功能的制剂中的应用。
优选,所述的铁死亡抑制剂是Ferrostatin-1。
本发明的第二个目的是提供Tfr1作为骨骼肌衰老和肌卫星细胞活性的生物标志物的应用。
本发明的第三个目的是检测Tfr1表达水平的制剂在制备检测骨骼肌衰老和肌卫星细胞活 性的试剂中的应用。
本发明的第四个目的是提供敲除Tfr1的制剂在制备抑制肌卫星细胞活化,增殖和分化、 延迟肌肉损伤修复、抑制骨骼肌再生功能障碍的药物中的应用。
所述的诱导Tfr1敲除的制剂是他莫昔芬。
本发明通过转录组测序分析发现,骨骼肌和肌卫星细胞中Tfr1表达随年龄增加而降低。 Tfr1肌卫星细胞特异性敲除导致肌卫星细胞不可逆转的失活。Tfr1肌卫星细胞特异性小鼠骨 骼肌再生过程伴随肌萎缩,铁离子累积,非饱和脂肪酸生物合成增加,进而诱发骨骼肌铁死 亡。衰老骨骼肌表现出Tfr1表达降低,而Slc39a14膜表面富集,促进非铁转运蛋白结合铁 的吸收增加,促进铁死亡的发生。Ferrostatin-1腹腔注射能够显著改善衰老小鼠骨骼肌铁死亡 导致的肌肉再生障碍和运动障碍。
附图说明:
图1是Tfr1是骨骼肌衰老和肌卫星细胞活性的关键生物标志物;
图2是肌卫星细胞特异性敲除Tfr1抑制肌卫星细胞活化,增殖和分化;
图3是肌卫星细胞特异性敲除Tfr1延迟肌肉损伤修复;
图4是肌卫星细胞特异性敲除Tfr1导致骨骼肌再生功能障碍;
图5是脂质和铁代谢失衡激活骨骼肌铁死亡;
图6是骨骼肌铁死亡抑制骨骼肌再生;
图7是铁死亡导致衰老骨骼肌功能障碍。
具体实施方式:
以下实施例是对本发明的进一步说明,而不是对本发明的限制。
实施例1:
实验方法:
1.动物模型
C57BL/6J小鼠购自广东省实验动物实验室中心,并置于广东省微生物研究所动物设 施的温度和湿度受控且通风的无特定病原体(SPF)笼中。所有动物的处理和程序均得到广东省微生物研究所动物保护和使用委员会的批准[许可号:GT-IACUC201704071]。 将所有实验小鼠置于12小时光照:黑暗周期中,随意取食和饮水。
通过携带Pax7-CreER(购买于JacksonLab,产品编码:017763)和Tfr1
为了引起肌肉损伤,TA肌肉注射心脏毒素(CTX,0.5nmol,100微升)。为了进 行药物治疗,将CTX损伤的小鼠连续腹腔注射(i.p.)注射生理盐水或Ferrostatin-1(一 种铁死亡抑制剂,2μmol/kg,SML0583,Sigma,100微升),时间是30天,每天一次。 对于慢病毒注射,将对照组(空白载体)或具有Tfr1表达的慢病毒(10^9cfu,100微 升,3次注射,每天一次)注射到CTX损伤的TA肌肉内。
2.慢病毒包装
用穿梭载体(pCDH-Tfr1)和病毒包装载体(pVSVg和psPax2)(Addgene)通过TransIT X2(MIR60000,MirusBio)瞬时转染的293T细胞。转染后12小时,将培养基 替换为新鲜DMEM,其中添加了10%胎牛血清(FBS,01010102,Trinity)。转染后 36和60小时分别收获含有慢病毒的培养基。将Lenti-X浓缩液(PT4421-2,Clontech) 以1:3的比例混合,并在4℃下孵育至少1小时。然后将混合物离心,获得高滴度的 含病毒沉淀,将其重悬于500μl冰冷的PBS溶液中,并保存在-80℃的冰箱中进行肌肉 注射。
3.RNA分离和实时荧光定量PCR
骨骼肌,肝脏,iBAT,iWAT,eWAT或C2C12成肌细胞的总RNA用TRIzol
4.骨骼肌铁含量测定
骨骼肌样本(TA,EDL,Sol和Gas)在H
5.油红O染色
4%PFA固定的TA切片在油红O(ORO)溶液中浸泡1小时。在用含甘油的封固剂 封固之前,细胞核用苏木精复染。
6.珀尔的普鲁士蓝染色
非血红素铁染色是通过使用标准Perl的普鲁士蓝染色方案进行的。将图像可视化并 用光学显微镜捕获。
7.Masson染色
按照制造商的说明(MA0123,Meilunbio),使用Masson的Trichrome染色套件(苯胺蓝)对Masson的Trichrome染色。简而言之,在用95%酒精固定的TA肌肉的10μm 冰冻切片上进行Masson的Trichrome染色。然后将切片在Masson的Trichrome Stain Kit 中的不同溶液中孵育。最后,将切片用95%酒精脱水10s,在无水酒精中漂洗两次,持 续10s,在二甲苯中漂洗两次,每次1分钟。将切片用中性香脂进行安装,以进行成像 和纤维化定量。通过使用Image J.CVF(胶原蛋白体积分数)进行TA纤维化定量,其 计算为胶原蛋白阳性蓝色面积与总组织面积之比。
8.苏木和曙红(H&E)染色
用苏木精和曙红溶液将10μm的TA切片染色。将切片脱水并用DPX固定剂(44581,Sigma)固定。将组织学图像可视化并通过光学显微镜捕获。
9.肌纤维分离,培养和免疫荧光染色
按照之前描述的方法从EDL肌肉中分离出单个肌纤维。简而言之,分离EDL肌肉 并在含有0.2%胶原酶的消化培养基中温育75分钟。消化后,将肌纤维转移至涂有马血 清的24孔板中,并用洗涤介质(补充有10%FBS:胎牛血清和1%P.S.:青霉素和链霉 素的DMEM)轻轻洗涤3次。对于未培养的肌纤维,每组至少100条肌纤维用4%多聚 甲醛(PFA,P6148,Sigma)固定,并按照标准规程进行免疫染色。单肌纤维在马血清 包被的24孔板(用于非附着培养)中培养,或在胶原蛋白包被的24孔板(用于附着培 养中)培养。在每个孔中,将约20条肌纤维洗涤3次,然后更换为培养基(补充有20% FBS,1%PS和1%CEE的DMSM:鸡胚提取物,(C19041654,USBiologic),含或不 含4-OH-他莫昔芬(1μm,H7904,Sigma)。对于非附着培养,培养72小时后,将具 有肌卫星细胞簇的单条肌纤维用4%PFA固定,并按照标准方案进行免疫染色;肌纤维 附着培养,在72小时后,肌卫星细胞簇附着在培养板上,增殖4-6天,直至达到85% 汇合,然后用2%马血清分化3天,肌管用4%PFA固定,然后进行免疫染色。肌纤维 或分化的肌管用0.5%Triton-100渗透10分钟,然后用含有3%BSA,5%山羊血清和0.5% 吐温20的无菌PBS封闭。一抗(DSHB:Pax7:PAX7,eMyHC:F1.652,MHC:20-s, Abcam:Tfr1:ab84036和Active Motif:MyoD:39991;Ki67:ZM-0167,ZSGB-Bio) 在4℃孵育过夜C和二级抗体在室温下黑暗处1小时。用含DAPI的固定介质(F6057, Sigma)固定肌纤维。为了量化SC的数量,对具有Tfr1,MyoD和Ki67表达的肌纤维 上的Pax7+SC进行计数。使用EVOS细胞成像系统(EVOS FL,Thermo Fisher)或共 聚焦显微镜(Zessie 710)将图像可视化并捕获。
10.成肌细胞的分离和培养
如前所述,从2周龄的Tfr1
11.冷冻切片和免疫荧光染色
固定,冷冻TA肌肉并切片成10μm。将TA切片用1%PFA固定,并用Tris-EDTA 缓冲液(Tris-EDTA缓冲液(Tris 1.21g和EDTA 0.37g溶于1L ddH2O,pH 9.0)在100℃ 下进行抗原修复1小时。将切片用0.5%Triton-100透化10分钟,并用封闭缓冲液(含 3%BSA和5%山羊血清的PBS)封闭1小时。一抗在O.N.在4℃(WGA:W32466, Thermo Fisher;LaminB2:05-206,Millipore;DSHB:Pax7:PAX7,I型:#BA-D5,IIA 型:SC-71,IIB型:BF)-F3和IIX型:6H1-s,Perilipin:9349,Cell Signaling Technology), 然后在室温下孵育二抗在暗室中放置1小时。细胞核用含有DAPI的固定培养基(F6057, Sigma)复染。图像被可视化并通过EVOS细胞成像系统(Thermo Fisher)捕获。
12.透射电子显微镜
Tfr1
13.跑步机疲劳测试
在CTX诱导的肌肉再生之前和之后,对Tfr1
14.流式细胞仪
解剖TA肌肉,切碎并在0.2%胶原酶中消化45分钟。将单细胞悬液与纯化的抗CD16/CD32 Abs(克隆2.4G2,Sungene Biotech)孵育15分钟,以阻断Fc受体。洗涤 后,细胞用eFluor 450-抗小鼠CD45(克隆30-F11,Invitrogen),Percp-Cy5.5-抗小鼠/ 人CD11b(M1/70,Biolegend),PE-Cy7-抗-染色。小鼠F4/80(BM8,Biolegend), APC抗小鼠CD86(GL-1,Biolegend),FITC抗小鼠CD206(C068C2,Biolegend)或 同种型对照在4℃下放置15分钟,并通过检测流式细胞仪(FACSVerse,BD)。使用 FlowJo软件(V10)分析数据。巨噬细胞被鉴定为CD45
15.统计分析
实验结果表示为平均值±SEM。条形图和统计分析是使用GraphPad Prism 7通过使用 的Student T检验或p<0.05的单向ANOVA产生的,被认为有显着差异。p值的表示 如下:*p<0.05,**p<0.01,***p≤0.001,N.S.:不显着(p≥0.05)。
实验结果:
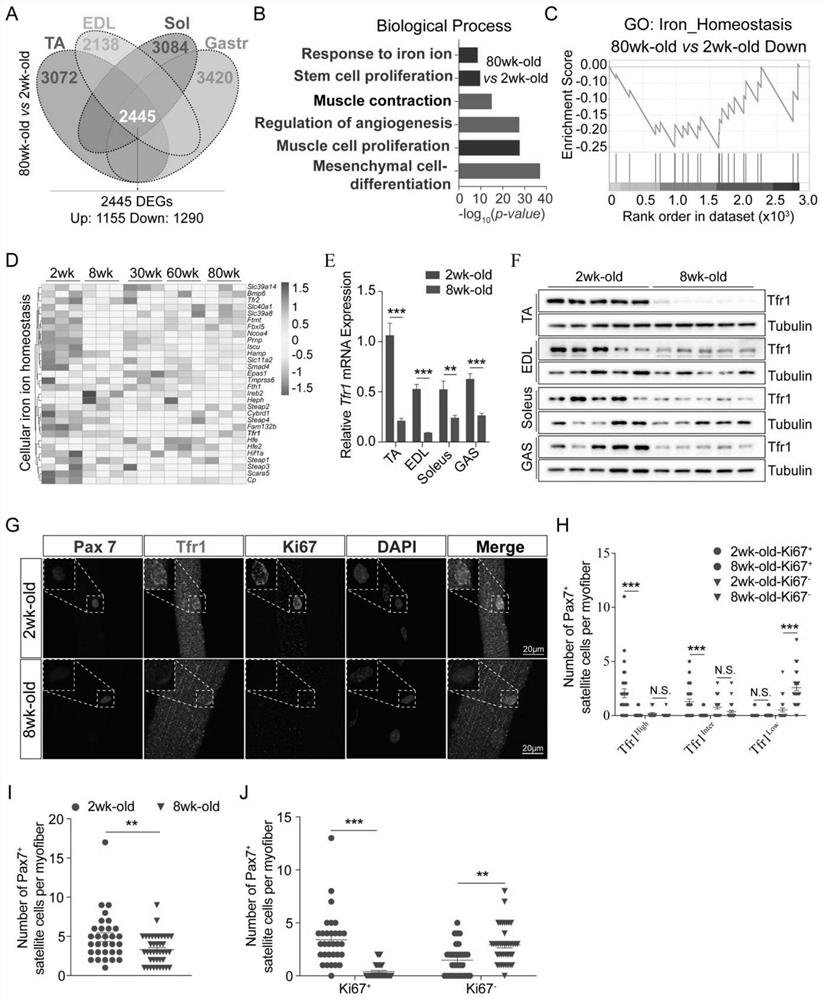
图1、Tfr1是骨骼肌衰老和肌卫星细胞活性的关键生物标志物:骨骼肌的发育,生长和 维持是精确调节的生理过程,这些过程紊乱可能会发生肌肉丢失和肌肉减少症。为了精准理 解这些过程,从五个不同年龄的C57BL/6J小鼠中收集了四种不同骨骼肌(TA:胫骨前肌, EDL:跖长伸肌,Sol:比目鱼肌,和Gast:腓肠肌)进行转录组测序和生物信息学分析,通 过对比2周龄(幼龄组)和80周龄(老年组)小鼠在四种类型的肌肉的差异基因,鉴定出2445个差异基因,其中1155个上调基因和1290个下调基因(图1A)。通过生物学过程基 因功能富集,老年组的TA肌肉中干细胞增殖和肌肉细胞分化相关基因功能显著下调(图1B)。 此外,老年组肌肉中铁代谢相关的生物学功能显著下降,这也通过基因集富集分析(GSEA) 所证实(图1B-C)。同时,细胞铁稳态相关基因受到差异调节,在这些基因中,Tfr1表达随 着年龄的增长而逐渐降低(从2周到8周,30周,60周甚至是80周)(图1D)。qPCR和 Westernblotting还证实了与2周龄组小鼠相比,8周龄小鼠的四个不同肌肉中Tfr1 mRNA和 蛋白表达降低,相应地伴随着非血红素铁减少(图1E-F)。这些数据表明,Tfr1介导的铁吸 收是骨骼肌中的限速步骤,可能与年龄相关的肌肉生理和功能有关。
SC不仅有助于骨骼肌的发育,而且有助于产后肌纤维的形成和骨骼肌的再生。但是,肌 卫星细胞中Tfr1-铁轴的生物学特性尚不清楚。在这里,通过进行单根肌纤维分离和免疫染色, 我们观察到2周龄小鼠的肌卫星细胞中Tfr1蛋白表达水平高于8周龄小鼠的Tfr1蛋白表达水 平(图1H)。对2周龄和8周龄的C57BL/6J小鼠均进行了单肌纤维的Pax7,Ki67和Tfr1 免疫染色。2周龄小鼠的肌纤维上大约70%的肌卫星细胞为Ki67
图2、肌卫星细胞特异性敲除Tfr1抑制肌卫星细胞活化,增殖和分化:为了进一步了解 Tfr1在肌卫星细胞中的生物学功能,通过将携带Tfr1
图3、肌卫星细胞特异性敲除Tfr1延迟肌肉损伤修复:为了了解Tfr1在骨骼肌生长和再 生中的生物学功能,我们利用成年小鼠肌卫星细胞中条件性切除Tfr1。注射他莫昔芬7天后, 通过TA肌肉注射CTX,并在再生完成后作进一步分析(CTX注射30天,图3A)。我们观察到肌卫星细胞中Tfr1敲除后出现的再生不良的表型,例如:肌肉萎缩,但对体重没有任何影响(图3B-C)。为了进一步评估TA肌肉再生过程中Tfr1的生物学功能,我们计算了Pax7
图4、肌卫星细胞特异性敲除Tfr1导致骨骼肌再生功能障碍:为了精确了解肌卫星细胞 特异性敲除Tfr1如何影响骨骼肌微环境,我们开展了转录组测序和生物信息学分析来进一步 评估损伤前后Tfr1
图5、脂质和铁代谢失衡激活骨骼肌铁死亡:GSEA分析进一步证实,脂肪形成在Tfr1
图6、骨骼肌铁死亡抑制骨骼肌再生:为了绘制出骨骼肌铁死亡发生的时间点,我们评 估了不同时间点(CTX注射后5、9和15天,Tfr1
图7、铁死亡导致衰老骨骼肌功能障碍:为了进一步分析老龄和年轻小鼠之间的2445个 差异基因和Tfr1
- 铁死亡抑制剂在制备改善衰老个体运动功能的制剂中的应用
- 铁死亡抑制剂Ferrostatin-1在制备治疗肺炎药物中的应用
