Hederasaponin C在制备治疗预防急性肺损伤的药物中的用途
文献发布时间:2023-06-19 12:25:57
技术领域
本发明涉及医药技术领域。更具体地说,本发明涉及一种Hederasaponin C在制备治疗预防急性肺损伤的药物中的用途。
背景技术
急性肺损伤(acute lung injury,ALI)是一类发病率和病死率高的临床常见危重疾病,是病原微生物感染等各种直接或间接致病因素所导致的,并以急性进行性呼吸窘迫和顽固性低氧血症为主要表现的临床综合征。ALI肺部中性粒细胞浸润、促炎细胞聚集等肺间质急性炎症能阻碍肺部气体交换。因此,ALI如果不及时治疗可进一步发展成更为严重的急性呼吸窘迫综合征(ARDS),死亡率高达40%。内毒素LPS感染可引发细胞因子风暴,进而导致严重的ALI、急性呼吸窘迫症,甚至多器官功能衰竭,直至死亡。然而,目前对于ALI的治疗仍无特效药。运用糖皮质激素并辅以机械通气治疗虽有较好的效果,但毒副作用大,治疗后还会产生较重的后遗效应。Hederasaponin C属于齐墩果烷型三萜皂苷,本发明主要探讨Hederasaponin C对ALI模型中肺脏组织的保护作用。
发明内容
本发明的一个目的是解决至少上述问题,并提供至少后面将说明的优点。
本发明还有一个目的是提供一种Hederasaponin C在制备治疗预防急性肺损伤的药物中的用途,其对LPS导致的小鼠ALI具有一定的保护作用,其作用不仅通过降低TNF-α、IL-6、IL-1β释放,降低中性粒细胞,淋巴细胞,白细胞的积聚于肺组织,也与抑制PIP2信号通路、NF-κB信号通路和NLRP3炎症小体的激活有关。
为了实现根据本发明的这些目的和其它优点,提供了一种Hederasaponin C在制备治疗预防急性肺损伤的药物中的用途,Hederasaponin C的结构式为式(I):
优选的是,所述急性肺损伤为由上呼吸道感染、慢性支气管炎、肺水肿、肺炎、肺脓肿以及由心脑缺血和器官移植引起的肺组织损伤、炎症和感染。
优选的是,所述急性肺损伤由流感病毒感染、细菌感染和/或真菌感染导致。
优选的是,所述药物含有治疗有效量的Hederasaponin C和药学上可接受的载体。
优选的是,所述药物被制成药学上允许的剂型。
优选的是,所述药物下调急性肺损伤受试者中炎症因子的水平,抑制PIP2信号通路、NF-κB信号通路和NLRP3炎症小体的激活。
优选的是,Hederasaponin C的给药剂量为不低于5mg/kg·d。
本发明至少包括以下有益效果:
本发明的研究结果表明Hederasaponin C保护LPS诱导急性肺损伤小鼠的死亡,抑制LPS导致的RL、Re升高、Cydn降低作用,降低LPS导致的肺指数、白细胞、中性粒细胞和淋巴细胞水平升高,降低LPS导致的血清、BLAF和肺组织炎症因子TNF-α、IL-6和IL-1β水平升高,抑制LPS刺激的ALI的肺组织中NF-κB、NLRP3炎症小体以及PIP2信号通路的激活。
本发明的其它优点、目标和特征将部分通过下面的说明体现,部分还将通过对本发明的研究和实践而为本领域的技术人员所理解。
附图说明
图1为本发明的Hederasaponin C对LPS诱导急性肺损伤小鼠生存率的影响(n=10);
图2为本发明的Hederasaponin C对LPS诱导急性肺损伤小鼠肺功能相关指标的影响;
图3为本发明的Hederasaponin C对LPS诱导急性肺损伤小鼠肺指数、白细胞、中性粒细胞和淋巴细胞的影响;
图4为本发明的Hederasaponin C对LPS诱导急性肺损伤小鼠24小时后通过H&E染色法评估肾组织病理学(200×);
图5为本发明的Hederasaponin C对LPS诱导急性肺损伤小鼠炎症反应的作用;
图6为本发明的Hederasaponin C对LPS诱导急性肺损伤小鼠组织相关蛋白的影响。
具体实施方式
下面结合附图对本发明做进一步的详细说明,以令本领域技术人员参照说明书文字能够据以实施。
应当理解,本文所使用的诸如“具有”、“包含”以及“包括”术语并不配出一个或多个其它元件或其组合的存在或添加。
需要说明的是,下述实施方案中所述实验方法,如无特殊说明,均为常规方法,所述试剂和材料,如无特殊说明,均可从商业途径获得。
1材料
1.1实验动物
SPF级健康BALB/C小鼠,体重20-22g,7-8周,雄性,购买于湖南斯莱克景达实验动物有限公司,所有实验动物均饲养于可控环境中,室温18-24℃、湿度40%-50%,实验期间动物自由进食、饮水,昼夜节律正常。
1.2主要药品和试剂
Hederasaponin C(广西中医药大学药学院杨世林科研平台提供);地塞米松磷酸钠注射液(河南润弘制药股份有限公司,国药准字H41020330);脂多糖(上海碧云天生物技术有限公司);多聚甲醛(国药分析纯);0.9%氯化钠注射液(四川科伦药业股份有限公司);肿瘤坏死因子(TNF-α)试剂盒、白介素(IL-6、IL-1β)试剂盒(美国invitrogen公司);PLCγ2(#3872),IP3 Receptor1(#8568),DAG Lipaα(#13626),PKCα(#2056S),p-PKCα(#9375S),p65(#8242T),p-p65(#3033),poly(ADP-ribose),polymerase(PARP)(#9532),NLRP3(#15101),ASC(#13833),IL-1β(#31202),Cleaved-Caspase-1(#89332),Cleaved-IL-1β(#63124),GAPDH(#5174)(美国Cell Signaling Technology公司)Caspase-1(ab1872)(美国Abcam公司);肺部给药定量雾化器(上海玉研科学仪器有限公司);AniRes2005动物肺功能分析系统(北京贝兰博科技有限公司;电子天平(梅特勒.托利多仪器上海有限公司);数字式移液器枪(德国Eppendorf公司);高速离心机(德国Eppendorf公司);倒置显微镜(德国Leica公司)4度冰箱、-20度冰箱、-80度冰箱(澳柯玛产品);酶标仪(美国Bio-Tek公司);兽用全自动血液细胞分析仪(深圳迈瑞生物医疗电子股份有限公司);恒温培养摇床(上海一恒科学仪器有限公司);数显恒温水浴锅(常州国华电器有限公司)。
2方法
2.1动物造模及给药
SPF级BALB/C小鼠168只,雄性,体重20-22g,适应性饲养3天,实验室室温为18-24℃,相对湿度40%-50%,SPF级饲料和纯净水喂养,自由饮食。造模前12h只提供水不提供饲料,分组(每组的体重分布均匀),按照LPS剂量为4mg/kg或者致死剂量15mg/kg,气管滴注(i.t)建立急性肺损伤小鼠模型。小鼠按照0.18mL/10g的剂量将0.4%戊巴比妥钠注射到小鼠的腹腔中,待小鼠麻醉后,将小鼠仰卧位于手术台上,用小鼠开口器打开小鼠口腔,用微量雾化器从会厌软骨开口处将LPS(对照组注入等量无菌生理盐水)注入肺脏,模型即建立完成,待其苏醒后给予水和饲料。
按照上述造模,给药方式,分别进行以下3批实验:
(1)用致死剂量的LPS(15mg/kg)造模,按照10只小鼠为一组,随机分为6组,分别设置为空白对照组、LPS模型组(15mg/kg)、Hederasaponin C(5、10、20mg/kg)组、阳性药组(地塞米松,DEX,5mg/kg),造模后0h、12h、24h、48h、72h尾静脉注射给予Hederasaponin C(5、10、20mg/kg),空白对照组以尾静脉注射方式注射等量无菌生理盐水到小鼠体内,DEX组按上述剂量造模,且于造模后0h将地塞米松注射液(5mg/kg)以腹腔注射的给药方式注射到小鼠体内1次后,12h、24h、48h、72h的给药时间将等量的生理盐水以腹腔注射的形式注射到小鼠体内。观察156h内小鼠生存情况;
(2)用4mg/kg的LPS造模,按照6只小鼠为一组,随机分为6组,分别设置为空白对照组、LPS模型组(4mg/kg)、Hederasaponin C(5、10、20mg/kg)组、阳性药组(地塞米松,DEX,5mg/kg),造模后0h、12h尾静脉注射给予Hederasaponin C(5、10、20mg/kg),空白对照组以尾静脉注射方式注射等量无菌生理盐水到小鼠体内,DEX组按上述剂量造模,且于造模后0h腹腔注射给予地塞米松注射液(5mg/kg)1次后,12h的给药时间将等量的生理盐水以腹腔注射的形式注射到小鼠体内。造模24h后,用呼吸机检测小鼠肺呼吸功能;
(3)用4mg/kg的LPS造模,按照12只小鼠为一组,随机分为6组,分别设置为空白对照组、LPS模型组(4mg/kg)、Hederasaponin C(5、10、20mg/kg)组、阳性药组(地塞米松,DEX,5mg/kg),造模后0h、12h尾静脉注射给予Hederasaponin C(5、10、20mg/kg),空白对照组以尾静脉注射方式注射等量无菌生理盐水到小鼠体内,DEX组按上述剂量造模,且于造模后0h腹腔注射给予地塞米松注射液(5mg/kg)1次后,12h的给药时间将等量的生理盐水以腹腔注射的形式注射到小鼠体内。造模24h后,造模眼球取血后,血常规检测白细胞、中性粒细胞的变化趋势,血清、肺泡灌洗液、肺组织中细胞因子TNF-α、IL-6、IL-1β的表达水平使用ELISA法检测,肺脏病理变化使用HE染色法检测,Western blotting法检测肺组织相关蛋白表达。
2.2检测指标
2.2.1小鼠生存率
LPS(15mg/kg)气管滴注(i.t)造模后,每隔12h观察并记录小鼠存活情况。
2.2.2小鼠肺呼吸功能检测
LPS(4mg/kg)气管滴注(i.t)造模后,24h后小鼠肺呼吸功能使用小动物肺功能分析仪。将0.4%戊巴比妥钠按照0.18mL/10g剂量以腹腔注射的形式注射到小鼠体内,麻醉后进行气管插管,连接小动物肺功能分析仪,检测小鼠肺阻力(RL)、呼吸阻力(Re)、动态肺顺应性(Cydn)。
2.2.3血常规分析
LPS(4mg/kg)气管滴注(i.t)造模24h后,小鼠眼球取血,取40μL血液,血液中淋巴细胞(Lym)、中性粒细胞(Neu)和白细胞(WBC)数量被迈瑞血液分析仪检测。
2.2.4血清TNF-α、IL-6及IL-1β的检测
LPS(4mg/kg)气管滴注(i.t)造模24h后,取小鼠眼球全血,待析出上清时,放在离心机中(4℃,3000rpm/min)离心15min,取上清液,严格按照ELISA操作说明检测血清IL-6、TNF-α、IL-1β炎症因子水平。
2.2.5肺泡灌洗液(BALF)炎症因子的检测
每组按照顺序选取6只,采血结束后,处死,迅速打开胸腔并暴露颈部气管,用1mL注射器由气管注入生理盐水(冰)0.3mL,反复回抽推注3-5次,操作重复3次,合并3次肺泡灌洗液并置于冰上。以4℃,1600rpm/min,离心15min,取上清,严格按照ELISA操作说明检测肺泡灌洗液中IL-6、TNF-α、IL-1β炎症因子水平。
2.2.6肺组织指标测定
(1)肺指数:取下整个肺,放在生理盐水中清洗,然后用滤纸吸干水分,并称其质量。(肺指数=肺质量/小鼠质量*100%)
(2)取右肺下叶,固定(右肺浸泡在4%多聚甲醛),24h后,将旧的多聚甲醛弃掉换成新鲜的4%多聚甲醛,然后依次进行脱水,透明,石蜡包埋,切片,伊红-苏木素(H&E)染色,显微镜观察取小鼠右肺组织形态变化。
(3)余肺用冰凉的生理盐水洗涤后,滤纸吸干表面水份,精密称取重量,用组织研磨机匀浆后,于-80℃冰箱保存,检测IL-6、IL-1β、TNF-α含量;Western blotting检测NF-κB、PIP2、NLRP3等信号通路相关蛋白表达等。
2.2.7统计学分析
采用GraphPad Prism 6.0软件进行统计学分析,通过单因素方差分析进行组间比较。P<0.05为显著性事件。
3实验结果
3.1 Hederasaponin C对LPS诱导急性肺损伤小鼠的死亡保护的作用
如图1所示,空白对照组用Control表示,LPS模型组(15mg/kg)用LPS表示、Hederasaponin C(5、10、20mg/kg)组分别用LPS+Hederasaponin C(5mg/kg)、LPS+Hederasaponin C(10mg/kg)、LPS+Hederasaponin C(20mg/kg)表示、阳性药组(地塞米松,DEX,5mg/kg)用LPS+DEX(5mg/kg)表示。LPS造模处理后60h时,LPS组死亡率为20%,Hederasaponin C(5mg/kg)组死亡率为10%,Hederasaponin C(10mg/kg)组死亡率为10%,DEX组死亡率为10%;72h时,LPS组死亡率为40%,Hederasaponin C(5mg/kg)组死亡率为20%;84h时,LPS组死亡率为50%,96h时,Hederasaponin C(10mg/kg)组死亡率为20%;120h时,LPS组死亡率为70%,Hederasaponin C(20mg/kg)组死亡率为20%,DEX组死亡率为20%;132h时,Hederasaponin C(5mg/kg)组死亡率为30%,Hederasaponin C(10mg/kg)组死亡率为30%,Hederasaponin C(20mg/kg)组死亡率为30%;144h时,LPS组死亡率为90%,Hederasaponin C(5mg/kg)组死亡率为50%,Hederasaponin C(10mg/kg)组死亡率为40%;156h时,LPS组死亡率为100%,Hederasaponin C(5mg/kg)组死亡率为60%,DEX组死亡率为30%。结果表明Hederasaponin C保护LPS诱导急性肺损伤小鼠的死亡。
3.2 Hederasaponin C对LPS诱导急性肺损伤小鼠呼吸功能的影响
如图2所示,空白对照组用Control表示,LPS模型组(15mg/kg)用LPS表示、Hederasaponin C(5、10、20mg/kg)组分别用LPS+Hederasaponin C(5mg/kg)、LPS+Hederasaponin C(10mg/kg)、LPS+Hederasaponin C(20mg/kg)表示、阳性药组(地塞米松,DEX,5mg/kg)用LPS+DEX(5mg/kg)表示,(A)小鼠肺阻力(RL);(B)小鼠呼吸阻力(Re);(C)小鼠动态肺顺应性(Cydn);与空白对照组相比,###p<0.001;与LPS组比较,*p<0.05,**p<0.01,***p<0.001(n=6)。与空白对照组比较,LPS组肺阻力(RL)、呼吸阻力(Re)显著增加,动态肺顺应性(Cydn)显著下降,与LPS模型组相比较,Hederasaponin C(5、10、20mg/kg)和DEX组RL、Re明显下降,Cdyn明显增加(*p<0.05,**p<0.01,***p<0.001)。
结果表明,LPS可导致小鼠呼吸功能的RL、Re升高、Cydn降低,而Hederasaponin C抑制LPS导致的RL、Re升高、Cydn降低作用,且Hederasaponin C(20mg/kg)对Re抑制和对Cydn升高的作用优于Dex组。
3.3 Hederasaponin C改善LPS诱导的小鼠ALI
在LPS诱导小鼠ALI过程中,白细胞,中性粒细胞和淋巴细胞被炎症因子和病原体激活后迅速进入肺泡腔中。如图3-4所示,空白对照组用Control表示,LPS模型组(15mg/kg)用LPS表示、Hederasaponin C(5、10、20mg/kg)组分别用LPS+Hederasaponin C(5mg/kg)、LPS+Hederasaponin C(10mg/kg)、LPS+Hederasaponin C(20mg/kg)表示、阳性药组(地塞米松,DEX,5mg/kg)用LPS+DEX(5mg/kg)表示,其中,图3中,(A)肺脏指数(=肺质量/小鼠质量×100%)(B)小鼠血液中白细胞(WBC)数量;(C)小鼠血液中中性粒细胞(Neutrophil)数量(D)淋巴细胞(Lymphocyte),图4中,与空白对照组比较,###p<0.001;与LPS组比较,*p<0.05,**p<0.01,***p<0.001(n=12)。如图3A-D所示,与空白对照组相比,LPS提高了小鼠血液中肺指数、白细胞、中性粒细胞和淋巴细胞,而DEX,Hederasaponin C可降低肺指数、白细胞、中性粒细胞和淋巴细胞水平(*p<0.05,**p<0.01,***p<0.001)。此外,如图4所示,H&E染色结果显示,与空白对照组相比,LPS导致肺组织的肺泡正常结构破坏,肺泡间质渗出肺泡隔增厚,部分肺泡结构紊乱,边界模糊不清,而DEX,Hederasaponin C处理后逆转LPS诱导的肺组织损伤。
结果表明,LPS可导致BALB/c小鼠肺指数、白细胞、中性粒细胞和淋巴细胞水平升高,Hederasaponin C具有降低肺指数、白细胞、中性粒细胞和淋巴细胞水平。
3.4 Hederasaponin C对LPS诱导ALI小鼠炎症因子的作用
如图5所示,空白对照组用Control表示,LPS模型组(15mg/kg)用LPS表示、Hederasaponin C(5、10、20mg/kg)组分别用LPS+Hederasaponin C(5mg/kg)、LPS+Hederasaponin C(10mg/kg)、LPS+Hederasaponin C(20mg/kg)表示、阳性药组(地塞米松,DEX,5mg/kg)用LPS+DEX(5mg/kg)表示,其中,(A)小鼠血清中TNF-α释放水平;(B)小鼠血清中IL-6释放水平;(C)小鼠血清中IL-1β释放水平;(D)小鼠肺泡灌洗液(BLAF)中TNF-α释放水平;(E)小鼠肺泡灌洗液(BLAF)中IL-6释放水平;(F)小鼠肺泡灌洗液中IL-1β释放水平;(G)小鼠肺组织中TNF-α释放水平;(H)小鼠肺组织中IL-6释放水平;(I)小鼠肺组织中IL-1β释放水平;与空白对照组比较,###p<0.001;与LPS组比较,**p<0.01,***p<0.001(n=12)。LPS诱导的肺部炎症是ALI的典型形式,会引起肺部炎性细胞因子如TNF-α、IL-1β和IL-6的释放。为检测Hederasaponin C对ALI炎症反应的影响,本研究采集血清、BALF和肺组织,用ELISA试剂盒检测炎症反应水平。结果显示,LPS处理24h后,LPS组BLAF、血清、肺组织中IL-6、IL-1β、TNF-α的表达明显高于对照组,说明LPS(4mg/kg,24h)诱导的ALI模型成功,而DEX、Hederasaponin C各剂量抑制了血清中TNF-α、IL-6和IL-1β的水平,BALF中TNF-α、IL-6和IL-1β的水平和肺组织中的TNF-α、IL-1β和IL-6(*P<0.05,**P<0.01,***P<0.001)。
结果表明,LPS可导致BALB/c小鼠血清、BLAF和肺组织TNF-α、IL-6和IL-1β水平升高,而DEX和Hederasaponin C降低这些炎症因子的升高作用,具有调节ALI炎症进展的作用。
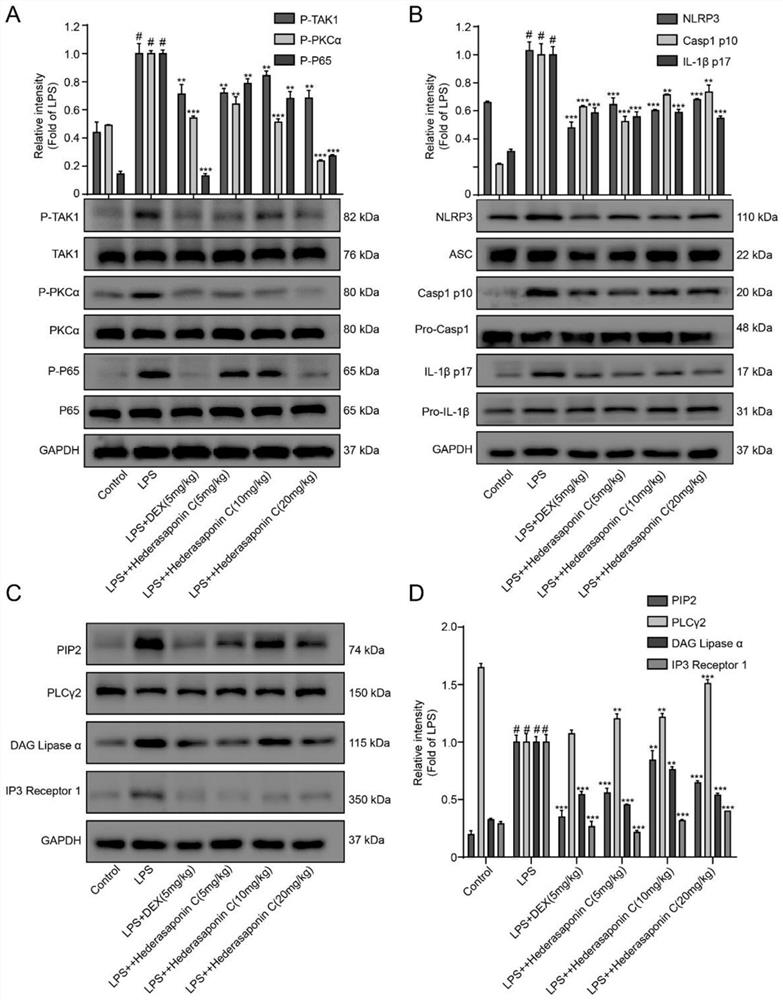
3.5 Hederasaponin C对LPS诱导ALI小鼠肺组织相关蛋白的影响
ALI是一种高致死性的肺病,可导致水肿、缺氧和呼吸衰竭。最近的研究表明,NF-κB对ALI的发展具有不可替代的作用。LPS激活肺组织中NF-κB信号通路,随后NF-κB被激活,导致肺组织中炎性细胞因子和趋化因子如IL-1β,IL-6和TNF-α释放,这些因子的产生对ALI的发展有着关键作用。如图6所示,空白对照组用Control表示,LPS模型组(15mg/kg)用LPS表示、Hederasaponin C(5、10、20mg/kg)组分别用LPS+Hederasaponin C(5mg/kg)、LPS+Hederasaponin C(10mg/kg)、LPS+Hederasaponin C(20mg/kg)表示、阳性药组(地塞米松,DEX,5mg/kg)用LPS+DEX(5mg/kg)表示,其中,(A)用Western blotting法检测肺组织中的TAK1/P-TAK1,PKCα/P-PKCα和P65/P-P65蛋白表达;(B)用Western blotting法检测肺组织中的NLRP3/ASC/pro-caspa/Caspa1 p10/IL-1β/IL-1βp17蛋白表达;(C)用Westernblotting法检测肺组织中的PIP2/PLCγ2/DAG/IP3蛋白表达,(D)PIP2/PLCγ2/DAG/IP3蛋白的统计学分析,对于任一实验组,自左至右的柱状图分别为PIP2、PLCγ2、DAG、IP3;与空白对照组比较,#p<0.05;与LPS组比较,*p<0.05,**p<0.01,***p<0.001(n=12)。如图6A所示,LPS组中肺组织的TAK1、PKCα和P65的磷酸化蛋白表达显著升高,总蛋白表达不变,而DEX组和Hederasaponin C组明显降低TAK1、PKCα和P65的磷酸化蛋白表达,不改变总蛋白的表达。
NLRP3炎症小体激活后,cleaved-caspase-1和成熟IL-1β的过表达,导致中性粒细胞募集,进而促进ALI的发展。因此,抑制NLRP3炎症小体的激活可能为ALI的治疗提供一种替代策略。如图6B所示,与空白对照组相比,LPS刺激肺组织中NLRP3炎症小体的激活,其中NLRP3,cleaved-caspase-1和成熟IL-1β过表达,DEX和Hederasaponin C处理后的肺组织中NLRP3、cleaved-caspase-1和cleaved-IL-1β的表达相比于LPS组明显降低。为了进一步探究ALI中NF-κB和NLRP3炎症小体激活的机制,我们用Western blotting法检测了肺组织中PIP2信号通路相关蛋白的表达,如图6C-D显示,在LPS刺激下上调了PIP2、DAG和IP3蛋白表达,下调了PLCγ2蛋白表达,而DEX组和Hederasaponin C组明显逆转了这些蛋白的表达,降低了PIP2信号通路的活化。
综上表明,在LPS刺激的ALI的肺组织中,NF-κB、NLRP3炎症小体以及PIP2信号通路的激活,而DEX和Hederasaponin C具有抑制了这些信号通路的激活。
空白对照组、LPS模型组(15mg/kg)、Hederasaponin C(5、10、20mg/kg)组、阳性药组(地塞米松,DEX,5mg/kg)
4讨论
ALI是一种丧失肺功能,死亡率高的疾病,是由不受控制的炎症反应引起的,会导致性缺氧呼吸功能不全,严重者伴有急性呼吸窘迫综合征(ARDS)。研究表明,ALI的发病机制概括为早期肺泡炎症伴肺损伤。本研究采用气管滴注LPS的方法模拟ALI模型,探究B5对ALI的保护作用及机制研究。死亡保护实验结果表明,Hederasaponin C可以提高ALI小鼠的存活率。肺功能检测结果表明,Hederasaponin C对ALI小鼠的呼吸功能有缓解作用。此外,通过HE染色可以观察到LPS组肺组织边界不清晰,肺泡结构破坏,出现了大量的炎性浸润,而Hederasaponin C组明显缓解了LPS导致的肺损伤。
在病原微生物的作用下,激活肺内靶细胞,促进细胞分泌TNF-α、IL-6、IL-1β等炎性细胞因子,从而激活内皮细胞,引起肺水肿。TNF-α水平在ALI患者血清、BALF及肺组织中均有升高,且TNF-α含量与肺损伤程度有直接关系。此外,ALI患者血清、BALF和肺组织中IL-6水平较高,预后差,死亡率高。IL-6可激活促炎反应,IL-6水平越高提示ALI死亡的风险越大。巨噬细胞释放具有活性的细胞因子IL-1β,在ALI患者血清、BALF和肺组织中IL-1β释放增加。已发现IL-1β水平持续不断增加与不良的预后有关。此外,中性粒细胞、淋巴细胞和白细胞在介导炎症反应和免疫反应中起着不可替代的作用,它们不仅能杀灭侵袭的病原微生物,而且能使组织和器官的损伤加重。因此,在ALI治疗中,降低炎性细胞因子、中性粒细胞、淋巴细胞和白细胞的药物是非常需要的。研究结果表明,Hederasaponin C可以抑制TNF-α、IL-6、IL-1β的释放,中性粒细胞,淋巴细胞,白细胞的大量募集而发挥抗炎作用。
NF-κB是多种细胞信号通路的多能调节因子,参与细胞对多种炎症刺激的反应。最近,NF-κB已被证明通过抑制LPS诱导ALI中炎症因子(TNF-α,IL-6)释放。研究证明,细胞内Ca2+平衡被破坏,过度释放引起NLRP3炎性小体的激活。活化的NLRP3炎症小体,介导caspase-1激活,分泌促炎细胞因子IL-1β/IL-18的分泌,促进中性粒细胞、淋巴细胞和白细胞向肺组织积聚,从而促进ALI的发生。因此,抑制NLRP3炎症小体的激活可能为ALI的治疗提供一种替代策略。研究结果显示,Hederasaponin C通过PIP2信号通路降低钙生成,从而抑制了NLRP3炎症小体的活化,也通过减少DAG的产生,阻止PKCα磷酸化激活,从而抑制NF-κB的激活。
本发明利用脂多糖(LPS)建立小鼠急性肺损伤(ALI)模型,探讨Hederasaponin C对急性肺脏损伤的保护作用及可能机制,为防治ALI提供依据。本发明将168只小鼠随机分为6组:对照组,模型组(LPS组),Hederasaponin C(5、10、20mg/kg)组(Hederasaponin C组),阳性药组(地塞米松,DEX组,5mg/kg),每组28只。(1)用致死剂量的LPS(15mg/kg)造模,观察156h内小鼠生存情况。与对照组相比,LPS组小鼠156h全部死亡,Hederasaponin C(5、10、20mg/kg)组小鼠死亡率分别为60%,50%,40%低于LPS组;(2)用4mg/kg的LPS造模,呼吸机检测小鼠肺呼吸功能。与对照组相比,LPS组肺阻力(RL)、呼吸阻力(Re)显著上升(p<0.05),动态肺顺应性(Cydn)显著下降(p<0.05),与LPS组相比较,Hederasaponin C组小鼠RL、Re显著下降(P<0.05),Cydn显著上升(p<0.05);(3)用4mg/kg的LPS造模,血常规检测白细胞(WBC),中性粒细胞(Neu),淋巴细胞(Lym)的变化趋势,H&E染色法观察肺脏病理组织学改变,ELISA检测血清、肺泡灌洗液、肺组织中TNF-α、IL-6、IL-1β的表达水平,Westernblotting法检测肺组织NF-κB/PIP2/NLRP3信号通路相关蛋白的表达。与对照组相比,LPS组小鼠全血中WBC、Neu和Lym均显著升高(p<0.05),血清、肺泡灌洗液以及肺组织中TNF-α、IL-6及IL-1β含量均显著升高(p<0.05)。而肺组织的病理改变主要表现为明显实变,肺泡损坏萎陷挤压明显,边界不清晰,有明显的炎性细胞浸润。与LPS组相比较,HederasaponinC组全血中WBC、Neu和Lym水平均明显下降(p<0.05),血清、肺泡灌洗液以及肺组织TNF-α、IL-6和IL-1β水肺组织的病理损害程度较LPS组明显减轻,且肺组织的p-TAK1、p-PKCα、p-P65、NLRP3、cleaved-caspase-1、cleaved-IL-1β、PIP2、DAG和IP3蛋白表达也明显减少,而PLCγ2的蛋白表达明显增加,表明Hederasaponin C明显抑制NF-κB/PIP2/NLRP3信号通路激活。因此Hederasaponin C对LPS诱导的小鼠急性肺损伤具有一定的保护作用,其机制可能与抑制肺内促炎性细胞因子释放以及抑制NF-κB/PIP2/NLRP3信号通路有关。
这里说明的设备数量和处理规模是用来简化本发明的说明的。对本发明的应用、修改和变化对本领域的技术人员来说是显而易见的。
尽管本发明的实施方案已公开如上,但其并不仅仅限于说明书和实施方式中所列运用,它完全可以被适用于各种适合本发明的领域,对于熟悉本领域的人员而言,可容易地实现另外的修改,因此在不背离权利要求及等同范围所限定的一般概念下,本发明并不限于特定的细节和这里示出与描述的图例。
- Hederasaponin C在制备治疗预防急性肺损伤的药物中的用途
- Hederasaponin C在制备治疗预防急性肾损伤的药物中的用途
