用免疫刺激剂治疗癌症
文献发布时间:2023-06-19 13:30:50
本申请是申请日为2015年10月21日、中国申请号为201580057457.9、发明名称为“用免疫刺激剂治疗癌症”的发明申请的分案申请。
相关申请的交叉引用
本申请要求于2014年10月21日提交的美国临时专利申请第62/066,862号、于2015年9月8日提交的美国临时专利申请第62/215,433号的优先权和权益,这些申请各自出于所有目的以引用的方式并入本文中。
发明领域
本发明涉及用于治疗癌症(诸如黑素瘤)或其转移的组合物和方法。
发明背景
已研发用于治疗各种癌症的许多药物或候选药物,包括一些小分子化合物。然而,当前对许多癌症的治疗在特定癌症子集的患者中并不非常有效,或者在此类患者中或一般而言毒性过大。
皮肤癌在美国为最常见的癌症形式。在2007年,美国癌症学会估计将因黑素瘤产生约8,110例死亡,且预期在此国家中要再诊断出59,940例黑素瘤。
黑素瘤为黑素细胞的恶性肿瘤,其主要发现于皮肤中,但还发现于肠和眼睛(葡萄膜黑素瘤)中。其为较罕见皮肤癌类型之一,但引起大部分皮肤癌相关死亡。
当前可获得的治疗包括手术移除肿瘤;辅助治疗;化学和免疫治疗或放射治疗。尤其危险者是一级黑素瘤肿瘤的转移。然而,本领域中对改进的黑素瘤治疗仍存在需要。
发明概要
本发明提供治疗受试者的癌症或癌症组合的组合物和方法。在一些实施方案中,受试者为哺乳动物。在一些实施方案中,哺乳动物为人。
在一些实施方案中,所述方法包括向受试者施用包含治疗有效量的第一免疫刺激剂和第二免疫刺激剂的组合物。在一些实施方案中,所述第一免疫刺激剂为α胸腺素肽。在一些实施方案中,第二免疫刺激剂为不为IL-2、干扰素-α或IRX-2的化合物。在一些实施方案中,第二免疫刺激剂包含特异性免疫刺激剂。在一些实施方案中,第二免疫刺激剂包含非特异性免疫刺激剂。
在一些实施方案中,第二免疫刺激剂为有效治疗败血病的免疫刺激剂。在一些实施方案中,免疫刺激剂包含粒细胞巨噬细胞集落刺激因子(GM-CSF)、程序化细胞死亡-1(PD-1)抑制剂和/或白介素-7(IL-7)。
在一些实施方案中,组合物还包含另一抗癌剂。在一些实施方案中,另一抗癌剂为化学治疗剂。
在一些实施方案中,第二免疫刺激剂是以每天约0.01-1000mg的剂量向所述受试者施用。
在一些实施方案中,第二免疫刺激剂包含GM-CSF,且GM-CSF的剂量为约10至500mcg/m
在一些实施方案中,第二免疫刺激剂包含PD-1抑制剂。在一些实施方案中,PD-1抑制剂为抑制PD-1的试剂,诸如针对PD-1的抗体。在一些实施方案中,PD-1抑制剂为抑制PD-1的配体的试剂,诸如针对PD-1的配体的抗体。在一些实施方案中,PD-1抑制剂的剂量为约0.1至10mg/kg,诸如约1-5mg/kg,或约2-3mg/kg。在一些实施方案中,PD-1抑制剂为抗PD-L1抗体,且剂量为约15-20mg/kg。在一些实施方案中,抗PD-L1抗体是以每两周、三周或四周1200mg固定剂量使用。
在一些实施方案中,第二免疫刺激剂包含不为IL-2的白介素。在一些实施方案中,白介素为IL-7。在一些实施方案中,IL-7的剂量为约0.1至100mcg/kg,诸如约1至50mcg/kg,或约3至30mcg/kg。
在一些实施方案中,α胸腺素肽是在至少一部分所述治疗期间以每天约0.1至100mg(诸如每天约0.5-50mg或每天约0.1-10mg)范围内的剂量向受试者施用。
在一些实施方案中,α胸腺素肽为胸腺素α1(TA1)。
在一些实施方案中,所述方法包括每天施用TA1持续约1-10天的时间段,随后约1-5天不施用TA1。在一些实施方案中,TA1是每天施用持续约3-5天,随后约2-4天不施用TA1。在一些实施方案中,TA1是每天施用持续约4天,随后约3天不施用TA1。
在一些实施方案中,所述方法还包括施用激酶抑制剂。在一些实施方案中,激酶抑制剂包含索拉非尼(sorafenib)。在一些实施方案中,激酶抑制剂是以每天约10-200mg/kg范围内的剂量向所述患者施用。
在一些实施方案中,所述方法还包括施用抗肿瘤热休克凋亡活化剂(HSAA)。在一些实施方案中,HSAA包含STA-4783(伊利司莫(elesclomol))。在一些实施方案中,HSAA是以每天约0.01-100mg/kg范围内的剂量向所述患者施用。
在一些实施方案中,所述方法还包括施用细胞毒性T淋巴细胞相关抗原4(CTLA4)的抑制剂,诸如针对CTLA4的抗体。在一些实施方案中,CTLA4抗体包括9H10、MDC010、1F4、BNI3、Q01、A01、M08、1B8、WKH203、ab9984、ab13486、伊匹单抗(ipilimumab)、替西木单抗(ticilimumab)或其组合。在一些实施方案中,CTLA4抗体是以每天约0.001-50mg/kg范围内的剂量向所述患者施用。
在一些实施方案中,所述方法还包括施用烷化抗肿瘤剂(AlkAA)。在一些实施方案中,烷化抗肿瘤剂(AlkAA)包含达卡巴嗪(dacarbazine)(DTIC)。在一些实施方案中,烷化抗肿瘤剂(AlkAA)是以每天约700-1300mg/kg范围内的剂量向所述患者施用。
在一些实施方案中,所述方法还包括向受试者施用化学治疗剂。在一些实施方案中,化学治疗剂为达卡巴嗪(DTIC)或顺铂。
在一些实施方案中,癌症为黑素瘤。
本发明还提供治疗受试者的癌症或其转移的方法,其包括施用包含治疗有效量的免疫刺激剂的组合物,其中免疫刺激剂有效治疗败血病。在一些实施方案中,癌症为黑素瘤。在一些实施方案中,受试者为哺乳动物。在一些实施方案中,哺乳动物为人。在一些实施方案中,有效治疗败血病的免疫刺激剂包含粒细胞巨噬细胞集落刺激因子(GM-CSF)、程序化细胞死亡-1(PD-1)抑制剂和/或白介素-7(IL-7)或其任何组合。
在一些实施方案中,组合物还包含另一抗癌剂。在一些实施方案中,另一抗癌剂为α胸腺素肽。在一些实施方案中,α胸腺素肽为胸腺素α1(TA1)。
在一些实施方案中,所述方法还包括向受试者施用化学治疗剂。在一些实施方案中,化学治疗剂为达卡巴嗪(DTIC)或顺铂。
本发明还提供用于确定人类受试者对癌症治疗的反应的方法。在一些实施方案中,癌症为黑素瘤。在一些实施方案中,所述方法包括确定在来自人类受试者的生物样品中一种或多种生物标记物的活性水平。在一些实施方案中,生物标记物选自由以下组成的组:IL-1β、IL-4、IL-6和IL-10。在一些实施方案中,癌症治疗是根据本文所描述的方法来进行。
在一些实施方案中,高于正常IL-1β活性水平指示人类受试者对治疗有反应。
在一些实施方案中,低于正常IL-4活性水平指示人类受试者对治疗有反应。
在一些实施方案中,高于正常IL-6活性水平指示人类受试者对治疗有反应。
在一些实施方案中,高于正常IL-10活性水平指示人类受试者对治疗有反应。
本发明还提供用于确定用于治疗人类受试者的癌症的剂量或方案的方法。在一些实施方案中,癌症为黑素瘤。在一些实施方案中,所述方法包括确定在来自正在治疗的人类受试者的生物样品中一种或多种生物标记物的活性水平。在一些实施方案中,生物标记物选自由以下组成的组:IL-1β、IL-4、IL-6和IL-10。
在一些实施方案中,在治疗之后降低的IL-1β活性水平指示治疗有效。在一些实施方案中,在治疗之后不变或增加的IL-1β活性水平指示治疗无效。可因此修改治疗的剂量或方案。
在一些实施方案中,在治疗之后增加的IL-4活性水平指示人类受试者对治疗有反应。在一些实施方案中,在治疗之后不变或降低的IL-4活性水平指示治疗无效。可因此修改治疗的剂量或方案。
在一些实施方案中,在治疗之后降低的IL-6活性水平指示治疗有效。在一些实施方案中,在治疗之后不变或增加的IL-6活性水平指示治疗无效。可因此修改治疗的剂量或方案。
在一些实施方案中,在治疗之后降低的IL-10活性水平指示治疗有效。在一些实施方案中,在治疗之后不变或增加的IL-10活性水平指示治疗无效。可因此修改治疗的剂量或方案。
本发明还包括如下项:
1.一种治疗受试者的癌症或其转移的方法,其包括施用包含治疗有效量的第一免疫刺激剂和第二免疫刺激剂的组合物,其中所述第一免疫刺激剂为α胸腺素肽,且所述第二免疫刺激剂为不为IL-2、干扰素-α或IRX-2的化合物。
2.如项1所述的方法,其中所述受试者为人。
3.如项1所述的方法,其中所述第二免疫刺激剂包含特异性免疫刺激剂。
4.如项1所述的方法,其中所述第二免疫刺激剂包含非特异性免疫刺激剂。
5.如项1所述的方法,其中所述第二免疫刺激剂为有效治疗败血病的免疫刺激剂。
6.如项5所述的方法,其中所述免疫刺激剂包含粒细胞巨噬细胞集落刺激因子(GM-CSF)、程序化细胞死亡-1(PD-1)抑制剂和/或白介素-7(IL-7)。
7.如项1所述的方法,其中所述组合物还包含另一抗黑素瘤剂。
8.如项1所述的方法,其中所述第二免疫刺激剂是以每天约0.01-1000mg的剂量向所述受试者施用。
9.如项1所述的方法,其中所述α胸腺素肽是在至少一部分所述治疗期间以每天约0.5-10mg范围内的剂量向所述受试者施用。
10.如项9所述的方法,其中所述α胸腺素肽的所述剂量在每天约0.1-10mg范围内。
11.如项1所述的方法,其中所述α胸腺素肽为胸腺素α1(TA1)。
12.如项11所述的方法,其包括每天施用TA1持续约1-10天的时间段,随后约1-5天不施用TA1。
13.如项12所述的方法,其中TA1是每天施用持续约3-5天,随后约2-4天不施用TA1。
14.如项13所述的方法,其中TA1是每天施用持续约4天,随后约3天不施用TA1。
15.如项1所述的方法,其中所述组合还包含激酶抑制剂。
16.如项15所述的方法,其中所述激酶抑制剂包含索拉非尼。
17.如项15所述的方法,其中所述激酶抑制剂是以每天约10-200mg范围内的剂量向所述患者施用。
18.如项1所述的方法,其中所述组合物还包含抗肿瘤热休克凋亡活化剂(HSAA)。
19.如项18所述的方法,其中所述HSAA包含STA-4783(伊利司莫)。
20.如项18所述的方法,其中所述HSAA是以每天约0.01-100mg/kg范围内的剂量向所述患者施用。
21.如项1所述的方法,其中所述组合还包括施用针对细胞毒性T淋巴细胞相关抗原4(CTLA4)的抗体。
22.如项21所述的方法,其中所述CTLA4抗体包括9H10、MDC010、1F4、BNI3、Q01、A01、M08、1B8、WKH203、ab9984、ab13486、伊匹单抗、替西木单抗或其组合。
23.如项21所述的方法,其中所述CTLA4抗体是以每天约0.001-50mg/kg范围内的剂量向所述患者施用。
24.如项1所述的方法,其中所述组合还包括施用烷化抗肿瘤剂(AlkAA)。
25.如项24所述的方法,其中所述烷化抗肿瘤剂(AlkAA)包含达卡巴嗪(DTIC)。
26.如项24所述的方法,其中所述烷化抗肿瘤剂(AlkAA)是以每天约700-1300mg/kg范围内的剂量向所述患者施用。
27.如项1所述的方法,其中所述方法还包括向所述受试者施用化学治疗剂。
28.如项27所述的方法,其中所述化学治疗剂为达卡巴嗪(DTIC)或顺铂。
29.如项1所述的方法,其中所述癌症为黑素瘤。
30.一种治疗受试者的癌症或其转移的方法,其包括施用包含治疗有效量的免疫刺激剂的组合物,其中所述免疫刺激剂有效治疗败血病。
31.如项30所述的方法,其中所述受试者为人。
32.如项30所述的方法,其中所述免疫刺激剂包含粒细胞巨噬细胞集落刺激因子(GM-CSF)、程序化细胞死亡-1(PD-1)抑制剂和/或白介素-7(IL-7)。
33.如项30所述的方法,其中所述组合物还包含另一抗黑素瘤剂。
34.如项33所述的方法,其中所述另一抗黑素瘤剂为α胸腺素肽。
35.如项34所述的方法,其中所述α胸腺素肽为胸腺素α1(TA1)。
36.如项34所述的方法,其中所述方法还包括向所述受试者施用化学治疗剂。
37.如项36所述的方法,其中所述化学治疗剂为达卡巴嗪(DTIC)或顺铂。
38.如项30所述的方法,其中所述癌症为黑素瘤。
39.一种用于确定人类受试者对癌症治疗的反应的方法,其包括确定在来自人类受试者的生物样品中一种或多种生物标记物的活性水平,其中所述生物标记物选自由以下组成的组:IL-1β、IL-4、IL-6和IL-10。
40.如项39所述的方法,其中所述癌症治疗是根据项1至38中任一项所述的方法来进行。
41.如项39所述的方法,其中高于正常IL-1β活性水平指示所述人类受试者对所述治疗有反应。
42.如项39所述的方法,其中低于正常IL-4活性水平指示所述人类受试者对所述治疗有反应。
43.如项39所述的方法,其中高于正常IL-6活性水平指示所述人类受试者对所述治疗有反应。
44.如项39所述的方法,其中高于正常IL-10活性水平指示所述人类受试者对所述治疗有反应。
45.如项39所述的方法,其中所述癌症为黑素瘤。附图简述
图1A绘示了顺铂在B16F10鼠黑素瘤模型的治疗中如由肿瘤接种后的肿瘤体积所指示的抗肿瘤作用。
图1B绘示了在肿瘤接种后在B16F10鼠黑素瘤模型中用媒介物或顺铂处理的小鼠的体重变化。
图2绘示了胸腺素的抗肿瘤活性。将具有B16F10衍生肿瘤的动物用ZADAXIN
图3绘示了在若干不同剂量下胸腺素的抗肿瘤活性。在所有所测试剂量下,胸腺素提供与媒介物处理组相比统计学上显著减缓的肿瘤生长。
图4A绘示了对在皮下B16F10鼠黑素瘤模型中在用胸腺素处理的C57BL/6小鼠中的IL-1β的评估。将ZADAXIN
图4B绘示了对在皮下B16F10鼠黑素瘤模型中在用胸腺素处理的C57BL/6小鼠中的IL-4的评估。将ZADAXIN
图4C绘示了对在皮下B16F10鼠黑素瘤模型中在用胸腺素处理的C57BL/6小鼠中的IL-6的评估。将ZADAXIN
图4D绘示了对在皮下B16F10鼠黑素瘤模型中在用胸腺素处理的C57BL/6小鼠中的IL-10的评估。将ZADAXIN
图4E绘示了对在系统性B16F10鼠黑素瘤模型中在使用不同治疗的C57BL/6小鼠中的IFN-γ的评估。
图4F绘示了对在系统性B16F10鼠黑素瘤模型中在使用不同治疗的C57BL/6小鼠中的IL-1β的评估。
图4G绘示了对在系统性B16F10鼠黑素瘤模型中在使用不同治疗的C57BL/6小鼠中的IL-4的评估。
图4H绘示了对在系统性B16F10鼠黑素瘤模型中在使用不同治疗的C57BL/6小鼠中的IL-5的评估。
图4I绘示了对在系统性B16F10鼠黑素瘤模型中在使用不同治疗的C57BL/6小鼠中的IL-6的评估。
图4J绘示了对在系统性B16F10鼠黑素瘤模型中在使用不同治疗的C57BL/6小鼠中的IL-10的评估。
图4K绘示了对在系统性B16F10鼠黑素瘤模型中在使用不同治疗的C57BL/6小鼠中的IL-12的评估。
图4L绘示了对在系统性B16F10鼠黑素瘤模型中在使用不同治疗的C57BL/6小鼠中的TNF-α的评估。
图5绘示了B16F10小鼠肺转移性黑素瘤模型和实验设计。在第0天将B16F10黑素瘤细胞接种至小鼠中。
图6A绘示了在第16天,在用媒介物、单独胸腺素、单独抗PD-1、胸腺素加上抗PD-1或环磷酰胺处理的小鼠中肺转移的组分布。
图6B绘示了在用媒介物、单独胸腺素、单独抗PD-1、胸腺素加上抗PD-1或环磷酰胺处理的B16MET小鼠中相对于第1天的组平均体重变化百分比。
图7A绘示了在第15天,在以不同剂量用处理媒介物、单独胸腺素、单独抗PD-1、胸腺素加上抗PD-1或环磷酰胺的小鼠中肺转移的组分布。
图7B绘示了在B16F10小鼠肺转移性黑素瘤模型中,在以不同剂量用媒介物、单独胸腺素、单独抗PD-1、胸腺素加上抗PD-1或环磷酰胺处理之后的IL-1α。
图7C绘示了在用媒介物、单独胸腺素、单独抗PD-1、胸腺素加上抗PD-1或环磷酰胺处理的B16F10小鼠中相对于第1天的组平均体重变化百分比。
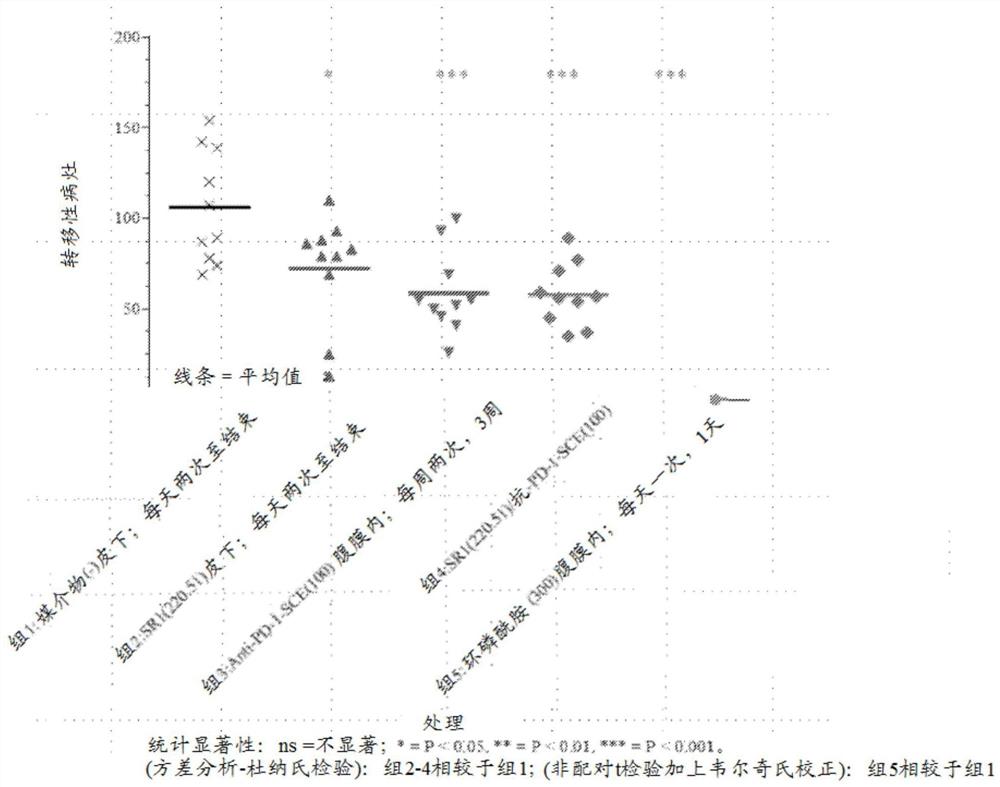
图8绘示了在肿瘤接种后第13天,在用媒介物、单独胸腺素、单独抗PD-1、胸腺素加上抗PD-1或环磷酰胺处理的不同组中的肺转移病灶。
发明详述
本发明是有关治疗和/或预防受试者的癌症的方法。在一些实施方案中,癌症为黑素瘤或其转移。在一些实施方案中,所述方法包括向受试者施用包含治疗至少一种免疫刺激剂的组合物。
在一些实施方案中,本发明的方法可在治疗早期癌症(包括早期肿瘤形成,其可能为小的、缓慢生长的、局部化的且/或非侵袭性的,其例如以治愈疾病或引起癌症消退为目的)时以及在治疗中期癌症和在治疗晚期癌症(包括晚期和/或转移性和/或侵袭性肿瘤形成,例如用以减缓疾病的进展、减少转移或增加患者的存活率)时施用。类似地,所述组合可用于治疗低级别癌症、中等级别癌症和或高级别癌症。
在一些实施方案中,本发明的方法还可用于治疗惰性癌症、复发性癌症(包括局部复发性、远距离复发性和/或难治性癌症,即尚未对治疗有反应的癌症)、转移性癌症、局部晚期癌症和侵袭性癌症。因此,“晚期”癌症包括局部晚期癌症和转移性癌症,且是指患者的明显疾病,其中此类明显疾病不便于通过诸如手术或放射治疗的局部治疗形态来治愈。术语“转移性癌症”是指已从身体的一部分扩散至另一部分的癌症。晚期癌症还可为不可切除的,即其已扩散至周围组织且不能手术移除。
在一些实施方案中,本发明的方法还可用于治疗抗药性癌症,包括多药抗性肿瘤。如本领域中已知,癌细胞对化学治疗的抗性为癌症管理的中心问题之一。
本领域技术人员将了解这些类别中有许多可重迭,例如侵袭性癌症典型地还为转移性癌症。如本文所用,“侵袭性癌症”是指迅速生长的癌症。本领域技术人员将了解,对于一些癌症,诸如乳癌或前列腺癌,术语“侵袭性癌症”将指在给定癌症的复发时间谱的约前三分之二以内已复发的晚期癌症,而对于其它类型的癌症,几乎所有的情况呈现迅速生长的癌症,其被视为侵袭性的。因此,该术语可覆盖某一癌症类型的子部分或其可涵盖所有其它癌症类型。
在一些实施方案中,要通过本发明的方法治疗的癌症包括但不限于艾滋病相关癌症、肾上腺皮质癌、肛门癌、膀胱癌、肠癌、脑和中枢神经系统癌症、乳癌、类癌、宫颈癌、软骨肉瘤、绒毛膜癌、结肠直肠癌、内分泌癌、子宫内膜癌、尤因氏肉瘤(Ewing′s sarcoma)、眼癌、胃癌、胃肠癌、泌尿生殖器癌、神经胶质瘤、妇科癌症、头颈癌、肝细胞癌、霍奇金氏病(Hodgkin′s disease)、下咽癌、胰岛细胞癌、卡波西氏肉瘤(Kaposi′s sarcoma)、肾癌、喉癌、白血病、肝癌、肺癌(例如非小细胞肺癌)、淋巴瘤、黑素瘤、基质细胞癌、间皮瘤、骨髓瘤、鼻咽癌、神经母细胞瘤、非霍奇金氏淋巴瘤、食管癌、骨肉瘤、卵巢癌、胰腺癌、垂体癌、肾细胞癌、前列腺癌、视网膜母细胞瘤、横纹肌肉瘤、肉瘤、皮肤癌、鳞状细胞癌、胃癌、睾丸癌、胸腺癌、甲状腺癌、移行细胞癌、滋养层癌、子宫癌、阴道癌、瓦尔登斯特伦巨球蛋白血症(Waldenstrom′s macroglobulinemia)、维尔姆斯氏癌(Wilm′s cancer)和白血病。
根据本发明的方法,如本文所用的术语“受试者”和其变化形式包括具有、怀疑具有或处于具有疾病或病状的危险之中的任何受试者。适合的受试者(或患者)包括哺乳动物,诸如实验室动物(例如小鼠、大鼠、兔、豚鼠)、农场动物和家庭动物或宠物(例如猫、狗)。包括非人类灵长类动物,且优选为人类患者。“处于危险之中”的受试者在本文所描述的诊断或治疗方法之前可能或可能不具有可检测疾病,且可能或可能不具有经展示的可检测疾病。“处于危险之中”指示受试者具有一种或多种所谓的危险因子,其为本文所描述的与本文所描述的病状的发展有关的可测量参数。具有这些危险因子中的一者或多者的受试者与不具有这些危险因子的受试者相比具有较高的发展本文所描述的病状的概率。在一些实施方案中,受试者为哺乳动物。在一些实施方案中,受试者为人。在一些实施方案中,受试者为诊断为具有黑素瘤的人。在一些实施方案中,受试者为怀疑具有黑素瘤的人。在一些实施方案中,受试者为具有高发展黑素瘤风险的人。在一些实施方案中,受试者为具有转移的黑素瘤患者。在一些实施方案中,受试者为具有高转移风险的黑素瘤患者。
在一些实施方案中,本发明的方法用于治疗黑素瘤。在一些实施方案中,黑素瘤为以下中的一者:恶性小痣、恶性小痣黑素瘤、表面扩散性黑素瘤、肢端雀斑样黑素瘤、粘膜黑素瘤、结节性黑素瘤、息肉状黑素瘤、促结缔组织增生性黑素瘤、无黑色素性黑素瘤、软组织黑素瘤、具有小痣样细胞的黑素瘤、具有斯皮茨痣(Spitznevus)特征的黑素瘤、葡萄膜黑素瘤或其组合。
在一些实施方案中,人类患者具有阶段0、I、II、III或IV或其相应小类的黑素瘤。在某些实施方案中,所治疗的黑素瘤为恶性转移性黑素瘤。在某些实施方案中,正在治疗的黑素瘤为阶段I、阶段II、阶段III或阶段IV黑素瘤。在其它实施方案中,正在治疗的黑素瘤为阶段M1a、M1b或M1c黑素瘤。对于详细阶段划分信息,参见Balch等人(2001,“Finalversion of the American Joint Committee on Cancer staging system forcutaneous melanoma”.J Clin Oncol 19(16):3635-48.PMID 11504745),其以引用的方式整体并入本文中。
在一些实施方案中,人类患者具有一种或多种黑素瘤早期迹象,诸如现有痣的形状或颜色的改变,包括但不限于不对称、边界不规则、颜色多样化、直径大于约6mm、随时间推移发展、发痒、溃烂或流血。在一些实施方案中,人类患者具有结节性黑素瘤,且早期迹象包括但不限于皮肤上任何地方出现新的肿块、升高超过皮肤表面、触摸坚硬且连续生长。
转移或转移性疾病为癌症从一个器官扩散至另一器官。一些癌细胞获得穿透淋巴和/或血管壁的能力,此后其能够在血流中循环至体内的其它位点和组织。在肿瘤细胞在另一位点停下来之后,其再穿透血管或壁且继续增殖,最终形成另一临床上可检测肿瘤。
在一些实施方案中,黑素瘤为恶性转移性黑素瘤。在一些实施方案中,转移性黑素瘤在患者中引起非特异性伴肿瘤症状,包括但不限于食欲不振、恶心、呕吐和疲劳。在一些实施方案中,患者具有脑转移。在一些实施方案中,黑素瘤扩散至肝脏、骨骼、腹部和/或远处淋巴结。
在一些实施方案中,所要治疗的受试者具有高发展黑素瘤风险。在一些实施方案中,人类受试者为高加索人。在一些实施方案中,人类患者生活在阳光充足的环境中且充分曝露于UV光。在一些实施方案中,所要治疗的受试者具有一种或多种遗传突变,其增加受试者对黑素瘤的敏感性。在一些实施方案中,遗传突变位于BRAF、MC 1R、CDKN2A、CDK4、核苷酸切除修复(NER)酶(也称为着色性干皮病,XP)、多肿瘤抑制剂1(MTS1)和/或MDM2中。
用于诊断黑素瘤的方法为熟知的,诸如Wurmand Soyer(2010年10月,“Scanningfor melanoma”.Australian Prescriber(33):150-5)中所描述的那些,该文献以引用的方式整体并入本文中。在一些实施方案中,诊断是通过有效检验来进行。在一些实施方案中,诊断是通过X射线、CT扫描、MRI、PET和PET/CT、超声波、LDH测试和/或光声检测来进行。
已诊断黑素瘤之后,可使用其它测试来确定癌细胞是否已扩散至皮肤内或身体的其它部分。测试包括但不限于体检和病史、淋巴结显像和前哨淋巴结活检、CT扫描、PET扫描、MRI和血液化学研究。
如本文所用的术语“治疗(treating/treatment)”是指用于获得有益或所需结果(包括临床结果)的方法,且甚至可包括正在治疗的疾病或病状的一种或多种可测量标记的极小变化或改善。治疗通常有效减轻病状、疾病、病症、损伤或损害的至少一种症状。示例性临床改善标记对本领域技术人员而言将显而易知。实例包括但不限于以下中的一者或多者:降低由疾病引起的一种或多种症状的严重性和/或频率、减低疾病的程度、稳定疾病(例如防止或延迟疾病恶化)、延迟或减缓疾病进展、改善疾病状态、降低为治疗疾病所需的一种或多种其它药物的剂量和/或提高生活质量等。
“预防”、“预防性治疗”或“预防性处理”是指预防一种或多种症状和/或其潜在病因或降低其发生率或严重性,例如预防易于发展疾病或病状(例如由于遗传易感性、环境因素、易感疾病或病症或其类似原因而处于较高的风险之中)的受试者的疾病或病状。
在一些实施方案中,所述方法包括向受试者施用治疗有效量和/或预防有效量的包含至少一种免疫刺激剂的组合物。如本文所用的术语“治疗有效量”是指为治疗病状或减轻或预防损伤或损害而任选不引起显著负面或不良副作用所需的一种或多种试剂的水平或量。“预防有效量”是指试剂当向敏感的和/或可发展疾病或病状的受试者施用时足以预防将来疾病或病状或减轻其严重性的量。
免疫刺激剂(也称为免疫刺激剂(immunostimulant/immunostimulator))是指刺激免疫系统的物质。在一些实施方案中,本发明的免疫刺激剂可诱导免疫系统的一种或多种正调节剂的活化或增加其活性。在一些实施方案中,本发明的免疫刺激剂可诱导免疫系统的一种或多种负调节剂的钝化或降低其活性。如本文所用,术语活性是指给定靶标在基因组DNA阶段、转录阶段、转录后阶段、转译阶段、转译后阶段上的活性,包括但不限于基因拷贝数、mRNA转录速率、mRNA丰度、mRNA稳定性、蛋白质转译速率、蛋白质稳定性、蛋白质修饰、蛋白质活性、蛋白质复合物活性等。在一些实施方案中,免疫刺激剂可为特异性免疫刺激剂。特异性免疫刺激剂为在免疫反应中提供抗原特异性的物质,诸如疫苗或抗原。在一些实施方案中,免疫刺激剂可为非特异性免疫刺激剂。非特异性免疫刺激剂不管抗原特异性如何均发挥作用以加强其它抗原的免疫反应或刺激免疫系统的组分而没有抗原特异性,诸如助剂。用于本发明的方法中的免疫刺激剂可为重组、合成、天然制备或其组合。
在一些实施方案中,至少一种免疫刺激剂有效治疗败血病。
在一些实施方案中,至少一种免疫刺激剂为胸腺素肽(胸腺素)。胸腺素为小蛋白质且存在于许多动物组织中。胸腺素起初分离自胸腺,但现已知大多数存在于许多其它组织中。如本文所用,胸腺素包括胸腺素α、胸腺素β、胸腺素γ和其功能性变体。在某些实施方案中,胸腺素为胸腺素α(或α胸腺素)。在某些实施方案中,胸腺素为前胸腺素α(PTMA)。在某些实施方案中,胸腺素为胸腺素α1(“TA1”,也称为胸腺素α-1、胸腺素a-1、胸腺素α-1或α胸腺素)和与TA1具有结构同源性的功能性变体。在一些实施方案中,TA1为具有以下氨基酸的肽:(N-acetyl)-Ser-Asp-Ala-Ala-Val-Asp-Thr-Ser-Ser-Glu-Ile-Thr-Thr-Lys-Asp-Leu-Lys-Glu-Lys-Lys-Glu-Val-Val-Glu-Glu-Ala-Glu-Asn-OH(SEQ ID NO:1)。TA1的氨基酸公开于美国专利4,079,137中,该专利的公开内容以引用的方式并入本文中。TA1为非糖基化28-氨基酸肽,其具有乙酰基化N端和约3108的分子量。在一些实施方案中,使用合成型式的TA1。在一些实施方案中,合成型式的TA1可在某些国家以商标名ZADAXIN(胸腺法新)商购获得。如本文所用,术语TA1还指衍生自SEQ ID NO:1的功能性变体或片段。
在一些实施方案中,至少一种免疫刺激剂为胸腺素α1(TA1)。α胸腺素肽包含胸腺素α1(TA1)肽,其包括天然存在的TA1以及具有天然存在的TA1的氨基酸、与其基本上类似的氨基酸或其缩短形式的合成TA1或重组TA1,以及其具有基本上类似于TA1的生物活性且具有经取代、缺失、拉长、置换或以其它方式修饰的的生物活性类似物,例如TA1衍生肽,其与TA1具有充足氨基酸同源性,使得其与TA1以基本上相同的活性以基本上相同的方式发挥作用。α胸腺素肽的适当剂量可在每天约0.001-10mg/kg范围内。在一些实施方案中,TA1具有美国专利第4,079,137号中所公开的氨基酸,该专利的公开内容以引用的方式并入本文中。已测序且化学合成了起初分离自胸腺素级分5(TF5)的TA1。TA1是分子量为3108的28氨基酸肽。
在一些实施方案中,α胸腺素肽的有效量为可为对应于约0.01-20mg的TA1、约1-10mg的TA1、约2-10mg的TA1、约2-7mg的TA1或约3-6.5mg的TA1的范围内的剂量单位的量,且可包含约1.6、3.2或6.4mg的TA1或约3.2或6.4mg的TA1。剂量单位可每天施用一次,或每天多次。在一些实施方案中,TA1是以每天约0.5-10mg范围内的剂量向受试者施用。在某些实施方案中,TA1剂量在每天约1.5-7mg的范围内或每天约1.6-6.4mg的范围内。在某些实施方案中,TA1剂量在每天约1.7-10mg、每天约1.7-7mg或每天约3-7mg的范围内。在一些实施方案中,有效剂量包括每天约1.6、3.2或6.4mg。在一些实施方案中,TA1是以约0.01至约6mg/kg的剂量向受试者施用。在一些实施方案中,TA1是一天一次、一天两次、一天三次、一天四次或更多次向受试者施用。在一些实施方案中,TA1是单独或与一种或多种其它免疫刺激剂一起向受试者施用。
TA1肽包括天然存在的TA1以及具有天然存在的TA1的氨基酸、与其基本上类似的氨基酸或其缩短形式的合成TA1或重组TA1,以及其具有基本上类似于TA1的生物活性且具有经取代、缺失、伸长、置换或以其它方式修饰的的生物活性类似物,例如TA1衍生肽,其与TA1具有充足氨基酸同源性,使得其以与TA1基本上相同的活性以基本上相同的方式发挥作用。在一些实施方案中,胸腺素的适当剂量可在每天约0.001-10mg/kg的范围内,诸如每天0.001、0.005、0.01、0.02、0.03、0.04、0.05、0.06、0.07、0.08、0.09、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0mg/kg或更多。在一些实施方案中,TA1具有美国专利第4,079,137号中所公开的氨基酸,该专利的公开内容以引用的方式并入本文中。
已测序且化学合成了起初分离自胸腺素级分5(TF5)的TA1。TA1是分子量为3108的28氨基酸肽。术语TA1还包括天然存在、合成或重组胸腺素TA1的功能性变体和功能性片段。TA1起初分离自牛胸腺,其中其显示在切除胸腺的动物模型中恢复“免疫功能”。在一些实施方案中,胸腺素包含SEQ ID NO:1的氨基酸(其中任选存在酰基化(例如乙酰基化)N端)。在一些实施方案中,胸腺素包含基本上类似于TA1的氨基酸,且维持TA1的免疫调节活性。基本上类似的可相对于TA1具有例如约1至约10个氨基酸缺失、插入和/或取代(总体来讲)。举例来说,胸腺素可相对于TA1具有约1至约5(例如1、2或3)个氨基酸插入、缺失和/或取代(总体来讲)。
因此,胸腺素可包含缩短TA1,其例如相对于TA1具有1至约10个氨基酸或约1至5个氨基酸或1、2或3个氨基酸缺失。此类缺失可位于N端或C端和/或内部,只要肽的免疫调节活性基本上得以维持即可。或者或此外,基本上类似的可相对于TA1具有约1至约5个氨基酸插入(例如1、2或3个氨基酸插入),其中TA1的免疫调节活性基本上得以维持。或者或此外,基本上类似的可具有1至约10个氨基酸取代,其中免疫调节活性基本上得以维持。举例来说,基本上类似的可具有1至约5或1、2或3个氨基酸取代,其可包括保守和非保守取代。在一些实施方案中,取代为保守的。一般而言,保守取代包括化学上类似的氨基酸(例如极性、非极性或带电荷)的取代。经取代氨基酸可选自20个标准氨基酸或可为非标准氨基酸(例如保守非标准氨基酸)。
在一些实施方案中,胸腺素包含与SEQ ID NO:1具有至少70%一致性同时维持TA1的免疫调节活性的氨基酸。举例来说,胸腺素可包含与SEQ IDNO:1具有至少80%、85%、90%、95%一致性的氨基酸。胸腺素可包含与SEQ ID NO:1具有100%一致性的氨基酸。在一些实施方案中,N端可任选例如经C1-10或C1-C7酰基或烷基酰基化(例如乙酰基化)或烷化。
在某些实施方案中,上文所描述的基本上类似和同源肽可以相对于TA1(SEQ IDNO:1)至少约50%、70%、80%、90%或约100%的水平发挥作用。
胸腺素可例如通过固相合成来合成制备或可重组制备且通过已知技术加以纯化。胸腺素还可以冻干形式提供,且在施用之前用无菌(例如水性)稀释剂复原。胸腺素的制剂可通过皮下注射,或其它有效途径施用。
在某些实施方案中,将胸腺素聚乙二醇化以增加其在循环中的半衰期。此类用于增加治疗性蛋白质的半衰期的策略为熟知的。
胸腺素被认为在发炎和先天免疫反应中起作用,且促成对自身与哺乳动物中的非自身的辨别。胸腺素对PAMP(病原体相关分子模式)配体的活化导致对细胞内信号转导途径的刺激,从而引起共刺激分子、促发炎细胞因子、一氧化氮和类二十烷酸的表达。胸腺素可影响例如树突细胞、T细胞、B细胞和NK细胞。
在一些实施方案中,TA1与第二免疫刺激剂组合。
在一些实施方案中,第二免疫刺激剂为有效治疗败血病的免疫刺激剂。在一些实施方案中,第二免疫刺激剂为GM-CSF、干扰素(例如干扰素-γ)、白介素7、白介素15或PD-1抑制剂。在一些实施方案中,有效治疗败血病的免疫刺激剂能够降低受试者中的T细胞耗竭。在一些实施方案中,免疫刺激剂为能够增加GM-CSF、干扰素(例如干扰素-γ)或白介素7或白介素15的活性的物质,参见Boomer(“The changing immune system in sepsis:Isindividualized immuno-modulatory therapy the answer?”,Virulence 5:1,45-56;2014年1月1日),其以引用的方式整体并入本文中。
在一些实施方案中,第二免疫刺激剂为检查点蛋白的抑制剂(也称为检查点抑制剂、免疫检查点调节剂或CPM)。如本文所用,检查点蛋白为保持免疫系统不攻击细胞的蛋白质。检查点抑制剂是设计成减小检查点蛋白的有效性。在一些实施方案中,检查点蛋白包括但不限于PD1、PDL1、CTLA4、KIR、IDO1、4-1BB(CD137)、OX40(CD134)和LAG3。
在一些实施方案中,第二免疫刺激剂能够减弱受试者中的异常免疫抑制。在一些实施方案中,异常免疫抑制是归因于在免疫系统中异常高的免疫抑制剂活性。在一些实施方案中,在受试者中具有异常高活性的免疫抑制剂为程序化死亡受体(PD-1)、程序化死亡配体(PD-L)、B和T淋巴细胞衰减子(BTLA)、疱疹病毒进入介导子(HVEM)或细胞因子IL-10。在一些实施方案中,有效治疗败血病的第二免疫刺激剂为在败血病患者中在低发炎阶段期间具有异常高活性的免疫抑制剂的抑制剂,参见Boomer(“The changing immune systemin sepsis:Is individualized immuno-modulatory therapy the answer?”,Virulence5:1,45-56;2014年1月1日),其出于所有目的以引用的方式整体并入本文中。在一些实施方案中,第二免疫刺激剂为PD-1、PD-L、BTLA、HVEM和/或IL-10的抑制剂。在一些实施方案中,抑制剂降低PD-1、PD-L、BTLA、HVEM和/或IL-10在DNA阶段、mRNA阶段和/或蛋白质阶段上的活性。在一些实施方案中,抑制剂为针对PD-1、PD-L、BTLA、HVEM或IL-10的抗体。在一些实施方案中,抑制剂为针对PD-1的抗体,诸如美国专利第8552154号、第8741295号、第8008449号、第8460886号和第7029674号,或美国专利申请公开第20110171220号、第20110271358号、第20140044738号中所描述的那些,这些专利各自以引用的方式整体并入本文中。在一些实施方案中,抑制剂为针对PD配体的抗体。在一些实施方案中,抑制剂抑制PD-1与其配体之间的相互作用。
在一些实施方案中,PD-1抑制剂为针对PD-1的抗体。在一些实施方案中,PD-1抗体的剂量为约0.1至10mg/kg,诸如约0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0或10mg/kg。在一些实施方案中,PD-1抗体的剂量为约1-5mg/kg,或约2-3mg/kg。
如本文所用,词组“PD-1的抑制剂”是指抑制由PD-1介导的信号传导通路的化合物,诸如针对PD-1信号传导通路中的组分的抑制剂。PD-1信号传导通路描述于Riley(Immunol Rev.2009年5月;229(1):114-125)中,该文献以引用的方式整体并入本文中。如本文所用,术语PD-1信号传导通路中的组分的“活性”可为在基因组DNA阶段、转录阶段、转录后阶段、转译阶段、转译后阶段上的参数,包括但不限于基因活性、RNA活性和蛋白质活性。基因活性可为基因拷贝数、基因扩增数或启动子活性等。RNA活性可为mRNA丰度、合成速率和/或稳定性等。蛋白质活性可为蛋白质丰度、合成速率、稳定性、酶活性、磷酸化速率、修饰、结合活性等。在一些实施方案中,抑制剂降低PD-1的活性。在一些实施方案中,抑制剂降低PD-1配体的活性。在一些实施方案中,抑制剂为PD-1抑制剂,诸如抗PD-1抗体,或PD-1配体(也称为PDL-1)的抑制剂,诸如抗PDL-1抗体。抗体可为单株抗体、多株抗体或其组合。
在一些实施方案中,第二免疫刺激剂为细胞因子。在一些实施方案中,细胞因子包括但不限于趋化因子、干扰素、白介素、淋巴因子、肿瘤坏死因子。
在一些实施方案中,作为第二免疫刺激剂的细胞因子为集落刺激因子(CSF)。如本文所用,术语CSF是指分离、合成或重组CSF,包括其功能性衍生物和功能性片段。如本文所用,术语CSF是指物质包含全长集落刺激因子多肽、其功能性片段和/或其功能性衍生物。集落刺激因子为经分泌糖蛋白,其结合于造血干细胞表面上的受体蛋白,由此活化使得细胞增殖和/或分化成特定种类的血细胞(诸如白血细胞)的细胞内信号传导通路。
在一些实施方案中,CSF包含以下多肽:巨噬细胞集落刺激因子(例如CSF1或M-CSF)、粒细胞巨噬细胞集落刺激因子(例如CSF2,也称为GM-CSF)、粒细胞集落刺激因子(例如CSF3,也称为GCSF或G-CSF)和/或其类似物,诸如幼巨核细胞生成素(promegapoietin)或非格司亭(filgrastim),或其能够刺激受试者的免疫系统的功能性片段。
在一些实施方案中,作为第二免疫刺激剂的细胞因子为GM-CSF。如本文所用,术语GM-CSF是指分离、合成或重组GM-CSF,包括其功能性衍生物和功能性片段。天然地,GM-CSF可由巨噬细胞、T细胞、肥大细胞、NK细胞、内皮细胞和纤维母细胞分泌。在一些实施方案中,免疫刺激剂可为天然GM-CSF的类似物,诸如沙格司亭(sargramostim)和莫拉司亭(molgramostim)。在一些实施方案中,GM-CSF呈同源二聚体或异源二聚体形式。在一些实施方案中,GM-CSF是使用重组技术制造(例如莫拉司亭或沙格司亭(也称为leukine))。
在一些实施方案中,GM-CSF的剂量为约1至1000mcg/m
在一些实施方案中,作为第二免疫刺激剂的细胞因子为干扰素。如本文所用,术语干扰素是指分离、合成或重组干扰素,包括其功能性衍生物和功能性片段。如本文所用,干扰素(IFN)是指由宿主细胞响应于病原体(诸如病毒、细菌、寄生虫或肿瘤细胞)的存在而制备和释放的多肽。在一些实施方案中,干扰素活化免疫细胞。在一些实施方案中,干扰素活化自然杀伤细胞和巨噬细胞。在一些实施方案中,干扰素增加主要组织相容性复合物(MHC)抗原的活性。在一些实施方案中,干扰素属于I型IFN、II型IFN或III型IFN。在一些实施方案中,I型IFN为IFN-α、IFN-β、IFN-ε、IFN-κ或
在一些实施方案中,作为第二免疫刺激剂的细胞因子为肿瘤坏死因子(TNF)。如本文所用,术语TNF是指分离、合成或重组TNF,包括其功能性衍生物和功能性片段。在一些实施方案中,TNF可由经活化巨噬细胞、CD4+淋巴细胞、NK细胞、中性粒细胞、肥大细胞、嗜酸性粒细胞或神经元制备。
在一些实施方案中,作为第二免疫刺激剂的细胞因子为白介素。如本文所用,术语白介素是指分离、合成或重组白介素,包括其功能性衍生物和功能性片段。在一些实施方案中,白介素可由辅助CD4 T淋巴细胞、单核细胞、巨噬细胞或内皮细胞合成。在一些实施方案中,白介素促进T淋巴细胞、B淋巴细胞和/或造血细胞的发育和/或分化。在一些实施方案中,免疫刺激剂包含白介素1、白介素3、白介素4、白介素5、白介素6、白介素7、白介素8、白介素9、白介素10、白介素11、白介素12、白介素13、白介素14、白介素15、白介素16或白介素17。如本文所用,术语白介素是指两种白介素分离、合成或重组的白介素,包括其功能性衍生物和功能性片段。在一些实施方案中,免疫刺激剂包含IL-7、IL-9和/或IL-15。在一些实施方案中,免疫刺激剂包含可充当淋巴样细胞(诸如B细胞谱系、T细胞谱系和/或NK细胞)的生长因子的白介素。在一些实施方案中,免疫刺激剂包含可支持辅助T细胞的生长的白介素。在一些实施方案中,免疫刺激剂包含可刺激且维持细胞免疫反应的白介素。在一些实施方案中,免疫刺激剂包含可刺激淋巴样细胞(诸如B细胞谱系和/或T细胞谱系)增殖的白介素。
在一些实施方案中,第二免疫刺激剂包含可增强IL受体活性的物质。在一些实施方案中,IL受体为IL-7受体。在一些实施方案中,免疫刺激剂包含可增强IL-7与IL-7受体的相互作用的物质。在一些实施方案中,免疫刺激剂包含白介素-7受体α。在一些实施方案中,免疫刺激剂包含共同的γ链受体,其与白介素-7受体α形成异源二聚体。在一些实施方案中,IL受体为IL-9受体。在一些实施方案中,免疫刺激剂包含可增强IL-9与IL-9受体的相互作用的物质。在一些实施方案中,免疫刺激剂包含白介素-9受体。在一些实施方案中,IL受体为IL-15受体。在一些实施方案中,免疫刺激剂包含可增强IL-15与IL-15受体的相互作用的物质。在一些实施方案中,免疫刺激剂包含白介素-15受体β链(CD122)。在一些实施方案中,免疫刺激剂包含白介素-15受体共同的γ链(γ-C,CD132)。
在一些实施方案中,第二免疫刺激剂包含白介素。在一些实施方案中,白介素为IL-7。在一些实施方案中,IL-7的剂量为约0.1至100mcg/kg,诸如约0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1、2、3、4、5、6、7、8、9、10、20、30、40、50、60、70、80、90或100mcg/kg。在一些实施方案中,剂量为约1至50mcg/kg,或约3至30mcg/kg。
可使用其它免疫刺激剂。在一些实施方案中,免疫刺激剂可充当白血细胞生长因子。在一些实施方案中,免疫刺激剂刺激干细胞产生粒细胞(例如中性粒细胞、嗜酸性粒细胞和嗜碱性粒细胞)和/或单核细胞。在一些实施方案中,免疫刺激剂可预防在化学治疗之后的中性白细胞减少。在一些实施方案中,免疫刺激剂可刺激中性粒细胞前体和成熟中性白细胞存活、增殖、分化和/或发挥作用。在一些实施方案中,免疫刺激剂通过使用包括但不限于以下的一种或多种信号传导通路来发挥作用:Janus激酶(JAK)、信号转导和转录活化因子(STAT)、经Ras/分裂素活化的蛋白激酶(MAPK)、磷脂酰肌醇3-激酶(PI3K)和蛋白激酶B(Akt)信号转导通路。
在一些实施方案中,本申请的免疫刺激剂或至少两种免疫刺激剂的组合与抗癌剂组合。
在一些实施方案中,可与本申请的免疫刺激剂组合使用的抗癌剂可包括但不限于雌激素受体拮抗剂、受体酪氨酸激酶抑制剂、癌细胞复制抑制剂、癌细胞信号传导抑制剂或沉默剂和肿瘤细胞表面的癌细胞生长、癌细胞抗凋亡性和/或癌细胞转移中所涉及的内部细胞信号传导分子的其它抑制剂。
在一些实施方案中,本申请的免疫刺激剂与雌激素受体拮抗剂(ERANT)、雌激素受体抑制剂或雌激素受体配体抑制剂组合使用。
在一些实施方案中,本申请的免疫刺激剂与受体酪氨酸激酶抑制剂组合使用。酪氨酸激酶抑制剂代表靶向诸如肿瘤细胞的细胞中的受体和/或非受体酪氨酸激酶的一类治疗剂或药物。在某些情况下,酪氨酸激酶抑制剂为基于抗体(例如抗酪氨酸激酶单克隆抗体等)或基于多核苷酸(例如酪氨酸激酶反义寡核苷酸、小干扰核糖核酸等)形式的靶向治疗。在一些实施方案中,酪氨酸激酶抑制剂为通过结合于酶的ATP结合位点而抑制靶向酪氨酸激酶的小分子。
在一些实施方案中,本申请的免疫刺激剂与癌细胞复制抑制剂组合使用,癌细胞复制抑制剂为诸如抗微管剂,其是指通过防止微管功能而阻断细胞分裂的化学品。
在一些实施方案中,本申请的免疫刺激剂与癌细胞信号传导抑制剂组合使用。在一些实施方案中,癌细胞信号传导抑制剂包括可抑制EGFR(表皮生长因子受体)反应的试剂,诸如EGFR抗体、EGF抗体和作为EGFR抑制剂的分子;VEGF(血管内皮生长因子)抑制剂;和erbB2受体抑制剂,诸如结合于erbB2受体的有机分子或抗体。
在一些实施方案中,其它抗癌剂可在施用本发明的第一免疫刺激剂之前、同时或之后施用。
在一些实施方案中,抗癌剂包含如美国专利第7,611,702号、第7,741,345号和第8,088,770号中所描述的伊匹单抗或衍生物,这些专利以引用的方式整体并入本文中。
在一些实施方案中,抗癌剂包含信号转导抑制剂。在一些实施方案中,转导抑制剂为BRAF抑制剂,诸如维罗非尼(vemurafenib)和达拉菲尼(dabrafenib)。在一些实施方案中,转导抑制剂为MEK抑制剂,诸如曲美替尼(trametinib)。在一些实施方案中,转导抑制剂为c-KIT抑制剂,诸如伊马替尼(imatinib)。
在一些实施方案中,抗癌剂包含激酶抑制剂。在一些实施方案中,激酶抑制剂包含如美国专利第7,235,576号中所描述的索拉非尼或衍生物。激酶抑制剂可连续(即,每天)、每天多次、每隔一天等进行施用,且可在施用本发明的免疫刺激剂之前、同时或之后施用,例如在治疗方案过程期间在相同的日子或在不同的日子施用。在某些实施方案中,激酶抑制剂是以例如每天施用约10-2000mg、每天约50-1000mg或每天约50-800mg的剂量范围进行施用。日剂量可为例如约50mg、100mg、200mg、300mg、400mg、500mg、600mg、700mg、800mg等。
在一些实施方案中,抗癌剂包含抗肿瘤热休克凋亡活化剂(HSAA),参见美国专利申请公开第20100317583号,其以引用的方式整体并入本文中。在一些实施方案中,HSAA包含STA-4783(伊利司莫)。HSAA可连续(即,每天)、每天多次、每隔一天等进行施用,且可在施用本发明的免疫刺激剂之前、同时或之后施用,例如在治疗方案过程期间在相同的日子或在不同的日子施用。在某些实施方案中,HSAA是以例如每天约0.01-1000mg/kg、每天约0.1-500mg/kg或每天约1-200mg/kg的剂量范围进行施用。日剂量可为例如25mg/kg、100mg/kg等。
在一些实施方案中,抗癌剂包含针对细胞毒性T淋巴细胞相关抗原4(CTLA4)的抑制剂,参见美国专利申请公开第20100330093号,其以引用的方式整体并入本文中。在一些实施方案中,抑制剂为针对CTLA4的抗体。在一些实施方案中,CTLA4抗体包括但不限于9H10(EBIOSCIENCE)、MDX010(MEDAREX)、1F4(GENETEX)、BNI3(GENETEX)、Q01(ABNOVA)、A01(ABNOVA)、M08(ABNOVA)、1B8(ABCAM)、WKH203(ABCAM)、ab9984(ABCAM)、ab13486(ABCAM)、伊匹单抗、替西木单抗或其组合。在一些实施方案中,CTLA4抗体可连续(即,每天)、每天多次、每隔一天等进行施用,且可在施用本发明的免疫刺激剂之前、同时或之后施用,例如在治疗方案过程期间在相同的日子或在不同的日子施用。在一些实施方案中,CTLA4抗体是以例如每公斤患者体重每天施用0.001-50mg或约0.01-20mg/kg或约1-15mg/kg的剂量范围进行施用。
在某些实施方案中,抗癌剂包含一种或多种抗肿瘤剂。在一些实施方案中,抗肿瘤剂为化学治疗剂。在一些实施方案中,化学治疗剂选自烷化剂、抗代谢物、抗微管剂、拓扑异构酶抑制剂和细胞毒性抗生素。
如本文所用,术语“烷化剂”是指具有将受试者中包括蛋白质、RNA和DNA的分子烷化的能力的试剂。烷化剂的非限制性实例包括氮芥、亚硝基脲、四嗪、氮丙啶、顺铂和衍生物和非经典烷化剂。氮芥包括二氯甲基二乙胺、环磷酰胺、美法仑(melphalan)、苯丁酸氮芥、异环磷酰胺和白消安(busulfan)。
如本文所用,术语“抗代谢物”是指阻碍DNA、RNA或蛋白质合成的分子。在一些实施方案中,抗代谢物类似于核碱基或核苷(不具有磷酸基的核苷酸),但具有经改变的化学基团。这些药物通过阻断为DNA合成所需的酶或变得并入DNA或RNA中来发挥其作用。通过抑制参与DNA合成的酶,其阻止有丝分裂,因为DNA不能自己复制。另外,在分子错误并入DNA中之后,可发生DNA损害且诱发程序化细胞死亡(凋亡)。在一些实施方案中,抗代谢物为抗叶酸剂、氟嘧啶、脱氧核苷类似物和硫嘌呤。在一些实施方案中,抗代谢物选自氨甲喋呤、培美曲塞(pemetrexed)、氟尿嘧啶、卡培他滨(capecitabine)、阿糖胞苷、吉西他滨(gemcitabine)、地西他滨(decitabine)、维达扎(Vidaza)、氟达拉滨(fludarabine)、奈拉滨(nelarabine)、克拉屈滨(cladribine)、氯法拉滨(clofarabine)、喷司他丁(pentostatin)、硫鸟嘌呤和巯基嘌呤。
如本文所用,术语“抗微管剂”是指通过阻止微管功能而阻断细胞分裂的化学品。
在一些实施方案中,抗肿瘤剂为有丝分裂抑制剂。
如本文所用,术语“拓扑异构酶抑制剂”是指可调节拓扑异构酶I和/或拓扑异构酶II的活性的试剂。在一些实施方案中,本发明的拓扑异构酶抑制剂可为拓扑异构酶I抑制剂。在本发明的其它实施方案中,拓扑异构酶抑制剂为拓扑异构酶II抑制剂。
如本文所用,术语“细胞毒性抗生素”细胞毒性抗生素包括但不限于放射菌素(antinomycin)、博来霉素(bleomycin)、丝裂霉素(mitomycin)、普卡霉素(plicamycin)及其类似物。酪氨酸激酶抑制剂的实例包括但不限于尼罗替尼(nilotinib)、伊马替尼、吉非替尼(gefitinib)、埃罗替尼(erlotinib)、西妥昔单抗(cetuximab)、帕尼单抗(panitumumab)、扎鲁木单抗(zalutumumab)、尼妥珠单抗(nimotuzumab)、马妥珠单抗(matuzuman)及其类似物。
在一些实施方案中,其它抗癌剂为单株抗体,诸如阿仑单抗(alemtuzumab)、贝伐单抗(bevacizumab)、西妥昔单抗、吉妥珠单抗(gemtuzumab)、利妥昔单抗(rituximab)和曲妥珠单抗(trastuzumab);光敏剂,诸如氨基乙酰丙酸、氨基乙酰丙酸甲酯、卟吩姆钠(porfimer sodium)和维替泊芬(verteporfin);和其它药剂,诸如阿利维甲酸(alitretinoin)、六甲蜜胺(altretamine)、安吖啶(amsacrine)、阿那格雷(anagrelide)、三氧化砷、天冬酰胺酶、蓓萨罗丁(bexarotene)、硼替佐米(bortezomib)、塞来昔布(celecoxib)、地尼白介素-毒素连接物(denileukin diftitox)、埃罗替尼、雌莫司汀(estramustine)、吉非替尼、羟基脲(hydroxycarbamide)、伊马替尼、喷司他丁、马索罗酚(masoprocol)、米托坦(mitotane)、培门冬酶(pegaspargase)和维甲酸(tretinoin)。
在一些实施方案中,抗肿瘤剂包含烷化抗肿瘤剂(AIkAA)。在一些实施方案中,AIkAA包含达卡巴嗪(DTIC)。在一些实施方案中,烷化抗肿瘤剂可以例如每天约700-1300mg/m2的剂量范围内、更优选每天约800-1200mg/m2的剂量范围内且最优选每天约1000mg/m2向患者施用。
在一些实施方案中,本发明的药物组合物可以临床相关、统计学上显著和/或持续的方式缓解、治疗和/或预防黑素瘤的一种或多种症状。在一些实施方案中,施用本发明的药物组合物提供关于缓解、治疗和/或预防黑素瘤的一种或多种症状的统计学上显著的治疗效果。在一个实施方案中,统计学上显著的治疗效果是基于由美国的一个或多个管理机构(例如FDA)或其它国家提供的一个或多个标准或准则来确定。在一些实施方案中,统计学上显著的治疗效果是基于获自管理机构批准的临床试验装备和/或程序的结果来确定。在一些实施方案中,本发明的药物组合物提供如通过无复发存活率(RFS,复发或死亡之前的持续时间)所测量的统计学上显著的治疗效果。在一些实施方案中,本发明的药物组合物提供如通过转移的频率和/或严重性所测量的统计学上显著的治疗效果。
在一些实施方案中,统计学上显著的治疗效果是基于具有至少50、100、200、300、400、500、600、700、800、900、1000或更多个成员的患者群体来确定。在一些实施方案中,统计学上显著的治疗效果是基于获自随机化和双盲临床试验装置的数据来确定。在一些实施方案中,统计学上显著的治疗效果是基于p值小于或等于约0.05、0.04、0.03、0.02或0.01的数据来确定。在一些实施方案中,统计学上显著的治疗效果是基于置信区间大于或等于95%、96%、97%、98%或99%的数据来确定。在一些实施方案中,统计学上显著的治疗效果是在例如由美国的FDA批准由本发明提供的方法的III期临床试验后确定。
在一些实施方案中,统计学上显著的治疗效果是通过具有至少50、100、200、300或350个成员的患者群体的随机化双盲临床试验来确定;用本发明的药物组合物处理,但不与用于治疗MD症状的任何其它试剂组合。在一些实施方案中,统计学上显著的治疗效果是通过具有至少50、100、200、300或350个成员的患者群体的随机化临床试验且使用任何通常接受的MD症状评估准则(诸如本文所描述的准则)来确定。
一般而言,统计分析可包括管理机构(例如美国的FDA)或中国或任何其它国家允许的任何适合的方法。在一些实施方案中,统计分析包括非分层分析、对数秩分析(例如来自Kaplan-Meier、Jacobson-Truax、Gulliken-Lord-Novick、Edwards-Nunnally、Hageman-Arrindel)和分层线性模型化(HLM)和Cox回归分析。
在一些实施方案中,所述方法包括在特定黑素瘤进展阶段施用免疫刺激剂。在一些实施方案中,免疫刺激剂是在受试者中的T细胞凋亡开始时向受试者施用。检测T细胞凋亡的方法为熟知的,诸如使用FITC膜联蛋白V的那些。在一些实施方案中,免疫刺激剂是在受试者归因于T细胞凋亡而经历T细胞耗竭时向受试者施用。T细胞定量的方法为熟知的,诸如使用流式细胞术的那些。在一些实施方案中,免疫刺激剂是为在受试者中维持预定水平的活性T细胞群体而向受试者施用。在一些实施方案中,活化T细胞为CD8+T细胞和/或CD4+T细胞。
在某些实施方案中,治疗方案包括多天的包含本发明的免疫刺激剂的药物组合物,且免疫刺激剂可在至少一部分的治疗方案期间向受试者施用。
在某些实施方案中,治疗方案包括施用药物组合物持续约1-10天、约1-20天、约1-30天、约1-40天、约1-50天、约1-60天、约1-70天、约1-80天、约1-90天、约1-100天或更多天的时间段。
在某些实施方案中,治疗方案还包括约1-5天、约5-10天、约10-20天、约20-30天或更多天不施用药物组合物。在一些实施方案中,药物组合物可每天施用持续1-10天、约1-20天、约1-30天、约1-40天、约1-50天、约1-60天、约1-70天、约1-80天、约1-90天、约1-100天或更多天,随后约1-5天、约5-10天、约10-20天、约20-30天不施用α胸腺素肽。
在一些实施方案中,所述方法还包括在投药之后监测受试者的反应,以避免归因于过度活化和增殖的严重和/或致命的免疫介导不良反应。在一些实施方案中,将免疫刺激剂的施用加以修改,诸如如果患者显示持续中度不良反应,则减少、暂停或终止。在一些实施方案中,如果患者从施用第一剂量起在约1周、2周、3周、4周、5周、6周、7周、8周、9周、10周、11周、12周、13周、14周、15周、16周或更多周以内未能作出反应,则修改剂量。在一些实施方案中,如果患者显示包括但不限于以下的严重或危急生命的不良反应:伴有腹痛、发热、肠梗阻或腹膜迹象的结肠炎;大便频率增加(高于基线≥7次)、大便失禁、需要静脉补液持续>24小时、胃肠道出血和胃肠道穿孔、AST或ALT>5倍正常值上限(ULN)或总胆红素>3倍ULN、史蒂芬斯-强森综合征(Stevens-Johnson syndrome)、中毒性表皮坏死松解或伴发全厚度皮肤溃疡或坏死性、大疱性或出血性表现的皮疹、严重运动或感觉性神经病、格林-巴利综合征(Guillain-Barrésyndrome)、重症肌无力、涉及对局部免疫抑制治疗无反应的任何器官系统免疫介导眼部疾病的严重免疫介导反应,则修改剂量。
在一些实施方案中,所述方法包括在施用本发明的免疫刺激剂之前、期间和/或之后,确定免疫系统中一种或多种组分的活性。在一些实施方案中,本发明的治疗方案可基于免疫系统中一种或多种组分的活性进行修改。在一些实施方案中,免疫系统中的组分包括但不限于T细胞凋亡、CD+8T细胞和CD+4T细胞。在一些实施方案中,所述方法包括测定指示T细胞凋亡、CD+8T细胞和/或CD+4T细胞的活性的一种或多种生物标记物。在一些实施方案中,所述方法包括测定效应T细胞的活性。在一些实施方案中,所述方法包括测定辅助T细胞的活性。
在一些实施方案中,将受试者免疫系统中的一种或多种组分的活性与预定标准相比较,以判定是否应向受试者施用本发明的药物组合物和/或何时可向受试者施用药物组合物。在一些实施方案中,组分可为IL-2、IL-2受体、IL-7、IL-7受体、IL-15、IL-15受体、CD69、IFNγ、IL-6、TNF、IL-1、GM-CSF、PD-L、PD-1、IL-10、BTLA、HVEM、IL-1β、IL-4、IL-6、IL-10或其组合。在一些实施方案中,本发明的药物组合物是在PD-L、PD-1、IL-10TLA和/或HVEM的活性与预定标准相比较高时向受试者施用。在一些实施方案中,本发明的药物组合物是在IL-2、IL-2受体、IL-7、IL-7受体、IL-15、IL-15受体、CD69、IFNγ、IL-6、TNF和/或GM-CSF的活性与预定标准相比较低时向受试者施用。在一些实施方案中,本发明的药物组合物是在IL-1β的活性与预定标准相比较高时向受试者施用。在一些实施方案中,本发明的药物组合物是在IL-4的活性与预定标准相比较低时向受试者施用。在一些实施方案中,本发明的药物组合物是在IL-6的活性与预定标准相比较高时向受试者施用。在一些实施方案中,本发明的药物组合物是在IL-10的活性与预定标准相比较高时向受试者施用。
在一些实施方案中,本发明的治疗方法与一种或多种其它癌症治疗组合。在一些实施方案中,其它治疗为手术。在一些实施方案中,其它治疗为辅助治疗。在一些实施方案中,其它治疗为化学治疗。在一些实施方案中,其它治疗为免疫治疗。在一些实施方案中,其它治疗为放射治疗。在一些实施方案中,其它治疗为靶向治疗,诸如过继细胞治疗或基因治疗。
在某些实施方案中,受试者为免疫缺陷受试者。免疫缺陷受试者(例如人类受试者)展现与传染性疾病斗争的能力降低和/或对病原体暴露作出反应的能力降低。此类免疫缺陷受试者的实例包括年长患者、初生儿、白血病或中性粒细胞减少患者、进行血液透析(例如为治疗慢性肾病)的患者、接受免疫抑制治疗的患者、AIDS患者、糖尿病患者、因癌症而接受化学治疗或放射治疗的患者、由遗传缺陷、营养不良、滥用药物、酒精中毒或其它免疫抑制病或病状引起的免疫缺陷。
在某些实施方案中,免疫抑制受试者为年长受试者。随动物年龄增长,其免疫反应降低,且免疫反应的稳健性归因于低亲和力抗体反应的普遍存在而有所降低。因此,这些实施方案中的受试者可为超过45岁或超过50岁的人类患者。在一些实施方案中,受试者为60岁以上、65岁以上或70岁以上的人类患者。
在某些实施方案中,治疗方案还包括确定患者在治疗期间的反应。在一些实施方案中,评估一种或多种与感染相关的症状以确定受试者对治疗方案的反应。
在一些实施方案中,本发明的组合物在受试者或受试者群中诱发针对病原体的强而快速的免疫反应。如本文所描述的胸腺素方案为患者提供对病原体暴露更稳健的免疫反应,包括但不限于较高抗体效价和/或更快速抗体反应。在一些实施方案中,在少到一次、两次、三次或四次投药的情况下,所述方案提供此类优点持续长达约10天、20天、30天、40天、50天或更久。
在一些实施方案中,受试者已诊断为具有癌症。在一些实施方案中,癌症为黑素瘤。
在一些实施方案中,本发明的组合物是通过本领域中已知的任何适合的方法来施用。在一些实施方案中,施用本发明的组合物可经口、非肠道、皮下、静脉内、肌肉内、腹膜内、通过鼻内滴入、通过植入、通过腔内或膀胱内滴入、眼内、动脉内、病灶内、经皮或通过施加于粘膜来进行。抑制剂可与药学上可接受的载剂一起施用。在一些实施方案中,胸腺素是通过注射(例如肌肉内、动脉内、血管内、静脉内、腹膜内或皮下)向受试者施用。“药学上可接受”意谓一物质为生物学或以其它方式不需要的,即,所述质可并入向患者施用的药物组合物中,而不会引起任何显著的不需要的生物效应或以有害方式与包含其的组合物的其它组分中的任一者相互作用。当术语“药学上可接受”用于指药学载剂或赋形剂时,其意味所述载剂或赋形剂已满足毒理学和制造测试的所需标准,或者其是根据由美国食品和药物管理局(U.S.Food and Drug administration)制作的非活性成分指导而被包括。
在一些实施方案中,本发明的组合物可提供于包含诸如以下的媒介物的药物组合物中:人工膜囊(包括脂质体、脂质胶束及其类似物)、微粒或微胶囊。
意在口服使用的组合物可制备成固体或流体单位剂型。流体单位剂型可根据本领域中已知用于制造药物组合物的程序来制备,且此类组合物可含有一种或多种选自由以下组成的组的试剂:甜味剂、调味剂、染色剂和防腐剂,以提供药学上精美的且可口的制剂。酏剂是通过使用水醇(例如乙醇)媒介物加上适合的甜味剂(诸如糖和糖精)以及芳族调味剂来制备。悬浮液可使用水性媒介物借助于诸如阿拉伯胶、黄著胶、甲基纤维素及其类似物的悬浮剂来制备。
诸如片剂的固体制剂含有与适合用于制造片剂的无毒的药学上可接受的赋形剂混合的活性成分。这些赋形剂可为例如惰性稀释剂,诸如碳酸钙、碳酸钠、乳糖、磷酸钙或磷酸钠:造粒剂和崩解剂,例如玉米淀粉或海藻酸;粘合剂,例如淀粉、明胶或阿拉伯胶;和润滑剂,例如硬脂酸镁、硬脂酸或滑石和其它常规成分,诸如磷酸二钙、硅酸镁铝、硫酸钙、淀粉、乳糖、甲基纤维素和功能上类似的物质。片剂可未包覆包衣或其可通过已知技术包覆包衣,以延迟在胃肠道中的崩解和吸收,且由此在较长时期内提供持续作用。举例来说,可使用时间延迟材料,诸如单硬脂酸甘油酯或双硬脂酸甘油酯。
供口服使用的制剂还可以硬明胶胶囊形式存在,其中活性成分与惰性固体稀释剂(例如碳酸钙、磷酸钙或高岭土)混合;或以软明胶胶囊形式存在,其中活性成分与水或油介质(例如花生油、液体石蜡或橄榄油)混合。软明胶胶囊是通过将化合物与可接受的植物油、轻质液状石蜡或其它惰性油的浆料机器封装来进行制备。
水性悬浮液含有与适合用于制造水性悬浮液的赋形剂混合的活性材料。此类赋形剂为悬浮剂,例如羧甲基纤维素钠、甲基纤维素、羟丙基甲基纤维素、海藻酸钠、聚乙烯吡咯烷酮、黄著胶和阿拉伯胶:分散或润湿剂,其可为天然存在的磷脂(例如卵磷脂)或环氧烷与脂肪酸的缩合产物(例如聚氧乙烯硬脂酸酯)或环氧乙烷与长链脂族醇的缩合产物(例如十七乙烯氧基十六醇或环氧乙烷与衍生自脂肪酸和己糖醇的偏酯的缩合产物(诸如聚氧乙烯山梨糖醇单油酸酯)或环氧乙烷与衍生自脂肪酸和己糖醇酸酐的偏酯的缩合产物(例如聚乙烯脱水山梨醇单油酸酯)。水性悬浮液还可含有一种或多种防腐剂,例如对羟基苯甲酸乙酯或对羟基苯甲酸正丙酯;一种或多种着色剂;一种或多种调味剂;或一种或多种甜味剂,诸如蔗糖或糖精。
油性悬浮液可通过将活性成分悬浮于植物油(例如花生油、橄榄油、芝麻油或椰子油)或矿物油(诸如液体石蜡)中来进行配制。油性悬浮液可含有增稠剂,例如蜂蜡、固体石蜡或十六烷醇。可添加甜味剂(诸如上文所阐述的那些)和调味剂以提供可口的口服制剂。这些组合物可通过添加诸如抗坏血酸的抗氧化剂来进行保存。
适合用于通过添加水来制备水性悬浮液的可分散性粉末和颗粒提供与分散或润湿剂、悬浮剂和一种或多种防腐剂混合的活性成分。适合的分散或润湿剂和悬浮剂是通过上文已提及的那些来例示。还可存在其它赋形剂,例如甜味剂、调味剂和着色剂。
本发明的药物组合物还可呈水包油乳液形式。油相可为植物油,例如橄榄油或花生油;或矿物油,例如液体石蜡;或这些油的混合物。适合的乳化剂可为天然存在的树胶,例如阿拉伯胶或黄著胶;天然存在的磷脂,例如大豆卵磷脂;和衍生自脂肪酸和己糖醇酸酐的酯或偏酯,例如脱水山梨醇单油酸酯;和所述偏酯与环氧乙烷的缩合产物,例如聚氧乙烯脱水山梨醇单油酸酯。乳液还可含有甜味剂和调味剂。
药物组合物可呈无菌可注射水性或油性悬浮液的形式。此悬浮液可根据已知技术使用上文已提及的那些适合的分散或润湿剂和悬浮剂加以配制。无菌可注射制剂还可为于无毒非经肠可接受的稀释剂或溶剂中的无菌可注射溶液或悬浮液,例如呈1,3-丁二醇溶液形式。在可接受的媒介物和溶剂之中,可使用的为水、林格氏溶液(Ringer′s solution)和等渗氯化钠溶液。此外,常规使用无菌、固定油作为溶剂或悬浮介质。为此目的,可使用任何温和固定油,包括合成的甘油单酯或甘油二酯。此外,诸如油酸的脂肪酸在可注射物的制备中获得应用。诸如局部麻醉剂、防腐剂和缓冲剂的助剂还可包括于可注射溶液或悬浮液中。
在一些实施方案中,适合的递送系统包括限时释放、延迟释放、持续释放或控制释放递送系统。在一些实施方案中,本发明的组合物可在控制释放系统(诸如持续释放基质)中进行递送。持续释放基质的非限制性实例包括聚酯、水凝胶(例如如由Langer等人,1981,J.Biomed.Mater.Res.,15:167-277和Langer,1982,Chem.Tech.,12:98-105描述的聚(甲基丙烯酸2-羟基乙酯),或聚(乙烯醇)]、聚丙交酯(美国专利第3,773,919号;EP 58,481)、L-谷氨酸和L-谷氨酸γ乙酯的共聚物(Sidman等人,1983,Biopolymers,22:547-556)、不可降解的乙烯-乙酸乙烯酯(Langer等人,同上)、可降解的乳酸-乙醇酸共聚物(诸如LUPRONDEPOT
在一些实施方案中,组合物的释放一阵一阵地进行。一阵一阵进行释放的系统的实例包括例如组合物俘获于囊封于聚合物基质中的脂质体中的系统,脂质体对特定刺激(例如温度、pH值、光或还原酶)敏感;和组合物由具有降解酶的微胶囊核心的经离子涂覆微胶囊囊封的系统。
在一些实施方案中,组合物的释放为逐渐/连续释放。抑制剂的释放为逐渐和连续释放的系统的实例包括例如浸蚀系统,其中组合物以于基质内的形式被包含;和渗出系统,其中组合物例如通过聚合物以控制速率释放。此类持续释放系统可例如呈团粒或胶囊形式。
根据本发明施用的组合物的其它实施方案掺有颗粒形式、保护层、蛋白酶抑制剂或用于各种投药途径(诸如非经肠、经肺、鼻内和口服)的渗透增强剂。制备药物组合物的其它药物组合物和方法为本领域中已知的,且描述于例如“Remington:The Science andPractice of Pharmacy”(以前为“Remingtons Pharmaceutical Sciences”);Gennaro,A.,Lippincott,Williams&Wilkins,Philidelphia,Pa.(2000)中。在一些实施方案中,药物组合物可还包括药学上可接受的稀释剂、赋形剂、载剂或助剂。
所要施用的剂量不受所规定限制约束,但其通常将为有效量或治疗/药学有效量。术语“有效量”是指一种或多种化合物提供所需治疗结果的量。有效量可包含于一种或多种剂量内,即,单次剂量或多次剂量可为达成所需治疗终点所需的。如本文所用的术语“治疗/药学有效量”是指一种或多种药剂治疗病状或减轻或预防损伤或损害而任选不会引起显著负面或有害副作用所需的水平或量。其通常将为以由剂量制剂在活性游离药物代谢释放以达成其所需药理学和生理效应后所产生药理学活性游离形式的摩尔数为基础的当量。在一些实施方案中,组合物可配制成单位剂型。术语“单位剂型”是指适合作为用于人类受试者和其它哺乳动物的单一剂量的物理离散单元,各单元含有与适合的药物赋形剂缔合的经计算产生所需治疗效果的预定量的活性材料。
在一些实施方案中,胸腺素的给药方案包括但绝不限于每个剂量的量、给药频率(例如每天、周或月)、每个给药循环的总量、给药时间间隔、给药变化、每个给药循环的模式或修改、最大累积给药或升温给药或其任何组合。在另外一些实施方案中,胸腺素的给药方案包括给药频率,例如每天或每周。
在另一些实施方案中,给药方案包括与此类剂量的频率组合的预定或固定的每个剂量的量。举例来说,胸腺素的给药方案包括与向受试者施用的此类胸腺素剂量的频率组合的固定的每个剂量的量。
在一些实施方案中,胸腺素的有效量为可为对应于约0.1-20mg的TA1、约1-10mg的TA1、约2-10mg的TA1、约2-7mg的TA1或约3-6.5mg的TA1的范围内的剂量单位的量,且可包含约1.6、3.2或6.4mg的TA1或约3.2或6.4mg的TA1。剂量单位可每天施用一次,或每天多次。在一些实施方案中,TA1是以每天约0.5-10mg范围内的剂量向受试者施用。在某些实施方案中,TA1剂量在每天约1.5-7mg的范围内或每天约1.6-6.4mg的范围内。在某些实施方案中,TA1剂量在每天约1.7-10mg、每天约1.7-7mg或每天约3-7mg的范围内。在一些实施方案中,有效剂量包括每天约1.6、3.2或6.4mg。
在一些实施方案中,投药提供约0.1至1.0ng/ml的胸腺素血清水平。在一些实施方案中,投药在注射约100ng/ml之后提供峰值血浆水平。在一些实施方案中,循环中TA1的半衰期为约2小时。
在某些实施方案中,治疗方案包括多天包含TA1的药物组合物,或TA1可在至少一部分所述治疗方案期间向受试者施用。
在某些实施方案中,治疗方案包括施用药物组合物持续约1-10天、约1-20天、约1-30天或更多天的时间段。
在某些实施方案中,治疗方案还包括约1-5天、约5-10天、约10-20天、约20-30天或更多天不施用药物组合物。在一些实施方案中,药物组合物可每天、每两天一次、每三天一次、每四天一次、每五天一次、每六天一次、每周一次施用,持续约1-10天、约1-20天或更多天,随后约1-5天、约5-10天不施用胸腺素。
在一些实施方案中,所述方法还包括在投药之后监测受试者的反应,以避免归因于过度活化和增殖的严重和/或致命的免疫介导不良反应。在一些实施方案中,将免疫刺激剂的施用加以修改,诸如如果患者显示持续中度不良反应,则减少、暂停或终止。在一些实施方案中,如果患者在从施用第一剂量约1天、2天、3天、4天、5天、6天、1周、2周或更长时间内未能作出反应,则修改剂量。
本发明的药物组合物还可缓解与黑素瘤相关的症状中的一种或多种、减轻其严重性或降低其发生率。在一些实施方案中,此类症状包括但不限于黑素瘤的早期迹象为现有痣的形状或颜色的改变,或者在结节性黑素瘤的情况下,在皮肤上任何地方出现新的肿块(此类病变应毫不迟延地向皮肤科医生求助)。在更晚期阶段,痣可能发痒、溃烂或流血。黑素瘤的早期迹象包括但不限于形状不对称、边界不规则、颜色多样化、直径大于6mm和随时间推移而发展。
在一些实施方案中,本发明的方法预防转移,或降低转移的速率和/或严重性。
本发明还提供一组生物标记物的活性概况的集合。如本文所用,术语“活性概况”是指代表一种或多种生物标记物的区别性特征或特性的一组数据。此类特征或特性包括但不限于转录物丰度、转录物稳定性、转录速率、转译速率、转译后修饰、蛋白质丰度、蛋白质稳定性和/或蛋白质酶活性等。在一些实施方案中,活性概况包含与各生物标记物的基因表达水平有关的数据。在一些实施方案中,包含活性概况的集合是获自特定受试者群。在一些实施方案中,特定受试者群由临床上正常的受试者组成。在一些实施方案中,所述群体由对一种或多种本发明的抗黑素瘤剂有反应的患者组成。在一些实施方案中,所述群体由对一种或多种本发明的抗黑素瘤剂不敏感的患者组成。
在一些实施方案中,所述集合包含在一个或多个方面中在统计学上均匀、例如在描述活性概况的特征和特性的一个或多个定量或半定量参数中在统计学上均匀的活性概况。在一些实施方案中,定量参数包括但不限于转录物丰度、转录物稳定性、转录速率、转译速率、转译后修饰、蛋白质丰度、蛋白质稳定性和/或蛋白质酶活性等。一组活性概况在一个或多个方面中在统计学上均匀与否可通过本领域技术人员已知的任何适合的统计检验和/或算法来确定。
在一些实施方案中,生物标记物中的一者或多者响应于治疗而增加其活性。在一些实施方案中,生物标记物中的一者或多者响应于治疗而降低其活性。在一些实施方案中,生物标记物中的一者或多者响应于治疗而保持其活性。如本文所用,生物标记物的活性可为在基因组DNA阶段、转录阶段、转录后阶段、转译阶段、转译后阶段的参数,包括但不限于基因活性、RNA活性和蛋白质活性。基因活性可为基因拷贝数、基因扩增数或启动子活性等。RNA活性可为mRNA丰度、合成速率和/或稳定性等。蛋白质活性可为蛋白质丰度、合成速率、稳定性、酶活性、磷酸化速率、修饰、结合活性等。
如本文所用,当生物标记物的水平达到预定标准水平的水平准时,称其为归一化。
如本文所用,当生物标记物的水平使其离开预定标准水平的水平的速度降低时,称其为稳定化。
在一些实施方案中,确定在受试者中本发明的一种或多种生物标记物的活性概况,且将其与预定标准水平相比较。如本文所用,术语“预定标准水平”或“预定活性概况”是指代表在特定群体中一种或多种生物标记物的平均、代表性特征或特性的标准化数据或数据集。此类特征或特性包括但不限于基因拷贝数、基因扩增、转录物丰度、转录物稳定性、转录速率、转译速率、转译后修饰、蛋白质丰度、蛋白质稳定性和/或蛋白质酶活性等。在一些实施方案中,受试者的特定群体是由约5、约10、约20、约50、约100、约200、约300、约400、约500、约1000、约5000、约10K或更多个别受试者组成。预定活性概况可为在受试者的特定群体已全部暴露于药物之前、期间或之后收集的标准化数据或数据集。在一些实施方案中,特定群体是由对给定药物有反应的受试者组成。
在一些实施方案中,当受试者暴露于药物时,当本发明的生物标记物中的一者或多者的水平朝向预定标准水平增加或降低时,或者当药物修改本发明的一种或多种生物标记物与安慰剂相比的水平变化速度时,受试者对用于治疗的药物“有反应”。关于与检测、定量和比较生物标记物水平有关的方法,参见例如Current Protocols in MolecularBiology,编者Ausubel,Frederick M.(2010);Current Protocols in Protein ScienceLast,编者Coligan,John E.等人(2010);Current Protocols in Nucleic AcidChemistry,编者Egli,Martin(2010);Current Protocols in Bioinformatics,编者Baxevanis,Andreas D.(2010);和Molecular Cloning:A Laboratory Manual,第三版,Sambrook,Joseph(2001),全部文献均以引用的方式整体并入本文中。
在某些实施方案中,当测量生物标记物或其它治疗指示物时,“增加”或“降低”量或水平可包括“统计学上显著的”量。如果一个结果不可能偶然发生,则典型地将其称为统计学上显著的。检验的显著性水平或结果传统上与为接受一个事件不可能偶然产生所需的证据的量有关。在某些情况下,统计显著性可定义为当虚无假设实际上真实时作出排除虚无假设的决定(一种称为I型错误或“假阳性确定”的决定)的概率。此决定往往是使用p值来作出:如果p值小于显著性水平,则排除虚无假设。p值越小,结果越显著。还可使用贝叶斯因子(Bayes factor)来确定(参见例如Goodman S.,Ann Intern Med.130:1005-13,1999)。在一些实施方案中,“增加”或“降低”的量或水平比预定标准的量高或低约1.1倍、1.2倍、1.3倍、1.4倍、1.5倍、2倍、2.5倍、3倍、3.5倍、4倍、4.5倍、5倍、6倍、7倍、8倍、9倍、10倍、15倍、20倍、25倍、30倍、40倍或50倍,或为一个测定时间点相对于上一个时间点或早期时间点的量。
还提供用于监测活性剂在癌症治疗中的功效的方法。这些方法包括测定在来自患者的生物样品中本发明的一种或多种生物标记物的活性,且将关于生物标记物的该信息提供给一个实体,所述实体基于生物标记物信息提供对治疗或功效的判定或评估。在一些实施方案中,生物标记物活性是在摄入至少一种剂量的本发明活性剂期间或在其之后测定。在一些实施方案中,如果人类受试者满足一个或多个以下所描述的选择准则,则所述实体可提供应使用或应继续使用活性剂进行治疗的判定:
·人类受试者在当同一人类受试者在治疗之前相比时具有降低水平的IL-1β活性,和/或当比较对本发明的治疗有反应的人类受试者或一组人类受试者时具有IL-1β活性的归一化或稳定化;
·人类受试者当与同一人类受试者在治疗之前相比时具有增加水平的IL-4活性,和/或当比较对本发明的治疗有反应的人类受试者或一组人类受试者时具有IL-4活性的归一化或稳定化;
·人类受试者当与同一人类受试者在治疗之前相比时具有降低水平的IL-6活性,和/或当比较对本发明的治疗有反应的人类受试者或一组人类受试者时具有IL-1β活性的归一化或稳定化;
·人类受试者当与同一人类受试者在治疗之前相比时具有降低水平的IL-10活性,和/或当比较对本发明的治疗有反应的人类受试者或一组人类受试者时具有IL-1β活性的归一化或稳定化。
用于检测诸如RNA或DNA的核酸的水平的方法已充分描述,且为本领域技术人员熟知的。用于检测RNA的方法可包括但不限于RT-PCR、northern印迹分析、基因表达分析、微阵列分析、基因表达芯片分析、杂交技术(包括FISH)、表达珠粒芯片阵列和色谱法以及本领域中已知的任何其它技术。用于检测DNA的方法可包括但不限于PCR、实时PCR、数字PCR、杂交(包括FISH)、微阵列分析、SNP检测测定、SNP基因分型测定和色谱法以及本领域中已知的任何其它技术。
用于检测蛋白质和多肽的方法可包括但不限于蛋白质浓度的分光光度测定、定量氨基酸分析、蛋白质浓度测定、色谱测定、western印迹分析、凝胶电泳(继之以包括但不限于考马斯蓝(Coomassie Blue)、银染色、赛博绿(Syber Green)、赛博金(Syber Gold)的染色程序)、杂交、多重细胞因子测定、免疫测定、ELISA、二喹啉甲酸(BCA)蛋白质测定、布拉德福蛋白质测定(Bradford protein assay)和劳里蛋白质测定(Lowry protein assay)以及本领域中已知的任何其它技术。蛋白质检测还可包括检测稳定或活性蛋白质的水平,且还可使用诸如以下的方法:动态测定、激酶测定、酶测定和转译后修饰测定(例如用于确定磷酸化和糖基化状态的测定)。
关于与检测、定量和比较生物标记物水平有关的更多方法,参见例如CurrentProtocols in Molecular Biology,编者Ausubel,Frederick M.(2010);CurrentProtocols in Protein Science Last,编者Coligan,John E.等人(2010);CurrentProtocols in Nucleic Acid Chemistry,编者Egli,Martin(2010);Current Protocolsin Bioinformatics,编者Baxevanis,Andreas D.(2010);和Molecular Cloning:ALaboratory Manual,第三版,Sambrook,Joseph(2001),所有所述文献均以引用的方式整体并入本文中。
在一些实施方案中,关于生物标记物的信息是获自一个或多个测试。测试可由受试者自己、由医生、由护士、由测试实验室、由健康护理提供者或能够进行测试的任何其它参与者来进行。然后,含有生物标记物信息的测试结果可由相同参与者或由诸如以下的第二参与者进行分析:受试者自己、医生、护士、测试实验室、健康护理提供者、医师、临床试验员工、医院、实验室、研究所或能够分析测试以确定受试者是否对药物有反应的任何其它参与者。
之后实施例说明本发明的各个方面。当然,所述实施例应理解为仅仅说明本发明的仅某些实施例,且不对本发明的范围构成限制。
实施例
在皮下B16F10鼠黑素瘤模型中通过胸腺素治疗黑素瘤
B16F10鼠黑素瘤模型是通过连续选择转移性克隆而衍生自MB16细胞株。产生B16F1至B16F10(ATCC编号CRL-6475
为研究胸腺素在治疗黑素瘤中的作用,在两次分开的研究中向接种B16F10的小鼠施用胸腺素α肽(ZADAXIN):
表1. 1号研究设计
表2. 2号研究设计
在整个研究中监测肿瘤体积和体重。在分开的历史对照研究中,向阳性对照组施用顺铂。在所有研究中,阴性对照组仅施用媒介物。
用顺铂处理的B16F10小鼠典型地显示减小的肿瘤体积(图1A和表3)。然而,这些小鼠还因顺铂的毒性而具有显著减轻的体重(图1B)。
表3用顺铂处理的B16F10小鼠的肿瘤尺寸
用ZADAXIN
在研究I中,在肿瘤接种后第14天,媒介物处理组的平均肿瘤尺寸(组1)达到1,995mm
此外,未在组间观测到显著重量变化。因此,胸腺素可用于治疗黑素瘤。
生物标记物研究
在上文所描述的研究中,测试了一组可能的生物标记物,其包括IL-7、IL-18、TREM-1、IFN-α、降钙素原、GM-CSF、IL-1α、IFN-γ、TNF α、IL-2、IL-4、IL-5、IL-6、IL-10、IL-12p70和IL-1β。在通过媒介物或ZADAXIN
在另一研究中,通过ELISA分析使用不同处理的C57BL/6小鼠中在系统性B16F10鼠黑素瘤模型的血清样品中的8种细胞因子(IFNγ、IL-1β、IL-4、IL-5、IL-6、IL-10、IL-12、TNFα)。处理为:
1.媒介物,每天两次,10天,皮下
2.PD-1抗体,每只小鼠100ug,每周两次,2周,腹膜内
3.TA1,每只小鼠0.486ug,每天两次,10天,皮下
4.TA1,每只小鼠4.86ug,每天两次,10天,皮下
5.TA1,每只小鼠48.6ug,每天两次,10天,皮下
6.PD-1抗体+TA1(每只小鼠100ug+每只小鼠0.486ug;每周两次,2周+每天两次,10天,腹膜内+皮下)
7.PD-1抗体+TA1(每只小鼠100ug+每只小鼠4.86ug;每周两次,2周+每天两次,10天,腹膜内+皮下)
8.PD-1抗体+TA1(每只小鼠100ug+每只小鼠48.6ug;每周两次,2周+每天两次,10天,腹膜内+皮下)
9.环磷酰胺,300mg/kg,每天一次,1天,腹膜内
在处理之后小鼠中的这些生物标记物的浓度显示于图4E至4L中。结果表明这些生物标记物可受束缚于胸腺素作用机制,或用作药效动力学标记物。
在B16F10小鼠肺转移黑素瘤模型中通过胸腺素治疗黑素瘤
材料和方法
小鼠:在研究第1天雌性B6D2F1/Crl小鼠(Charles River)为9周龄且具有19.2至24.5g的体重范围。为动物饲喂不限量的水(逆渗透,1ppm Cl)和由18.0%粗蛋白、5.0%粗脂肪和5.0%粗纤维组成的经NIH31改善且经照射的Lab
体内植入:如表1中所示,将测试小鼠分为五个处理组(n=10)。包括第六组动物作为“查看(look-see)”组(n=9)。在对数生长阶段期间收获B16-F10细胞,且以每毫升7.5x10
测试制品:抗PD1α肽(编号为抗PD-1-SCE,批号5177/0214)和胸腺素α-1肽(胸腺法新,编号命名为SR1,批号1402-224)。DRS-NC在内部测试期间出于保密的目的分配编号名。包括环磷酰胺(Baxter Pharmaceutical,批号2E718F,接收于6/7/2013)作为参考对照。SR1是以冻干粉末(90.7%游离碱)形式提供且溶解于PBS中以产生22.051mg/mL给药溶液,其以10mL/kg的给药体积提供220.51mg/kg剂量。不根据体重调整给药。将抗PD-1-SCE抗体稀释于PBS中,产生10.0mg/mL给药溶液,其以10mL/kg的给药体积提供100mg/kg剂量。不根据体重调整给药。将环磷酰胺稀释于盐水中,产生15.0mg/mL给药溶液,其以15mL/kg的给药体积提供300mg/kg剂量。根据体重调整给药。环磷酰胺是在研究开始时一次性制备且储存于4℃下。
处理:表4A呈现处理计划的概述:
组1动物皮下接受PBS(每天两次直至结束)且充当对照处理组。
组2以220.51mg/kg(200mg/kg游离碱)皮下接受SR1(每天两次直至结束)。
组3接受以100mg/kg腹膜内施用的抗PD-1-SCE(每周两次,3周)。
组4接受分别以220.51mg/kg皮下(每天两次直至结束)和100mg/kg腹膜内(每周两次,3周)施用的SR1与抗PD-1-SCE。
组5设定为阳性对照组,且以300mg/kg腹膜内接受环磷酰胺(每天一次,1天)。
组6设定为“查看”动物且未接受处理。
终点:B16MET-e117研究的终点定义为每一幅肺(per lung set)100处转移。在第9天开始以三天时间间隔将“查看”组的两至三只动物安乐死,且对肺迁移性病灶进行计数。通过将在右肺的上腔、中腔、下腔和后腔静脉叶中所计算的病灶数目加上左肺中所计算的病灶数目获得总计数。在第16天终止研究,且将所有动物安乐死且对其转移进行计数。抑制百分比定义为指定对照组的迁移性病灶数目与药物处理组的迁移性病灶数目之间的差异,以指定对照组的迁移性病灶数目的百分比表示:
抑制%=[1-(药物处理组病灶数目/对照组病灶数目)]x 100
毒性:在研究的头五天中的每天和其后每周两次将动物称重。经常观测小鼠是否有任何有害、治疗相关副作用的明显迹象,且当观测到时,记录毒性临床迹象。可接受的毒性定义为在研究期间组平均体重减轻小于20%,且在十个所处理动物中不超过一例治疗相关(TR)死亡。产生较大毒性的任何给药方案均视为超过最大耐受剂量(MTD)。如果如由临床迹象和/或尸检所证实,死亡可归因于治疗副作用,或者如果其归因于在给药期期间或最后剂量十四天内的未知原因,则将死亡归类为TR。如果不存在死亡与治疗副作用有关的证据,则将死亡归类为非治疗相关(NTR)。
统计和图解分析:使用用于Windows 6.02的Prism(GraphPad)来进行所有图解表示和统计分析。使用用于分析中值的曼惠特尼U检验(Mann-Whitney U-test)来确定对照组与处理组中的第16天B16F10迁移性病灶之间的统计显著性。在P=0.05下进行双尾统计分析。创建“盒须”图来显示在第16天所计算的各处理组的迁移性病灶的分布。
Prism在P>0.05下将结果报告为非显著(ns),在0.01<P≤0.05下为显著(用符号“*”表示),在0.001<P≤0.01下为非常显著(“**”),且在P≤0.001下为极其显著(“***”)。由于曼惠特尼U检验为对显著性的检验,且不提供对各组之间的差异大小的估计,故在表4B中将各显著性等级报告为显著或非显著。
程序:
·在研究开始之前(1)天植入细胞。
·为59个CR雌性B6D2F1小鼠静脉注射提供于0%Matrigel中的1.5x10
·尾部静脉。
·细胞注射体积为每只小鼠0.2mL。
·开始日期的年龄:8至12周。
·体重:5/2然后每两周一次至结束
·转移计数:在终点时
·紧接着报告任何不良反应或死亡为RM、SD、RD或SH。
·单次观测到>30%体重损失或连续三次测量到>25%体重损失的任何个体动物将安乐死。
·平均体重损失>20%或死亡率>10%的任一组将停止给药。
·该组不安乐死且使其恢复。在重量减轻>20%的组内,达到个体体重损失终点的个体将安乐死。若干组处理相关体重损失恢复至原重量的10%以内,则可以较低剂量或较不频繁的给药时程恢复给药。非处理体重恢复%的例外情况可根据个别情况而被允许。
·终点:每一幅肺约100处转移。
·根据CRL-NC SOP#687将垂死动物安乐死。显示呼吸窘迫迹象的动物还将如上文所述进行安乐死。
肿瘤细胞培养:使B16MET细胞在含有10%胎牛血清、10mM HEPES、2mM谷氨酰胺、每毫升100单位青霉素G钠、0.075%碳酸氢钠、25μg/mL庆大霉素和100μg/mL硫酸链霉素的RPMI 1640培养基中生长至对数生长中期。将肿瘤细胞在组织培养烧瓶中在湿润孵育器中在37℃下在5%CO2和95%空气的氛围中加以培养。
研发B16F10小鼠肺转移性黑素瘤模型。使约1.5x10
“查看”未处理组设定为经15天的时间评估转移数目。在第9天,将“查看”组的三只动物安乐死且对肺转移进行计数(我们的历史数据表明在此时我们将能够在未处理小鼠的肺中发现约>50处转移)。三天后,检查另外三只小鼠。当转移计数达到约50-100计数时,将研究中的所有组处死且确定最终转移计数。“查看”组计数不包括在最终功效分析中。50-100处转移计数定义为目标数目,因为个别转移中的大多数可容易地计数且转移很少会与计数中的困难彼此合并。参见图5。
在一项研究中(研究I),向小鼠施用媒介物(阴性对照)、环磷酰胺(阳性对照)、TA1、抗PD-1或TA1+抗PD-1,且评估转移计数。结果在下表4B和图6A和图6B中给出。
表4A研究1设计
媒介物=PBS
在B16MET-e117小鼠中相对于第1天的组平均体重变化百分比显示于图6B中。
结果表明胸腺素使黑素瘤模型中向肺部的转移减少,但在这些特定剂量下不与抗PD-1存在相加作用。
在第二研究(研究II)中,以不同剂量向小鼠施用媒介物(阴性对照)、环磷酰胺(阳性对照)、TA1、抗PD-1或TA1+抗PD-1。研究设计和结果在以下表5A和表5B中和图7A至图7C中给出。
研究II的处理计划:在此研究中,根据表5A中的方案为十三组雌性B6D2F1小鼠给药。SR1和媒介物各自为每天两次皮下(s.c.)施用持续该研究的持续时间(每天两次直至结束)。抗PD1抗体是每周两次腹膜内施用(i.p.)持续两周(每周两次,2周)。腹膜内施用单次剂量的环磷酰胺(每天一次,1天)。表5A呈现处理计划的概述。
组1动物接受PBS且充当对照处理组。
组2-4分别接受每只小鼠0.4862、4.862和48.62μg(每只小鼠0.441、4.41和44.1μg游离碱)的SR1。
组5和6分别接受以每只小鼠33.33和100μg施用的抗PD-1。
组7-9接受分别与以每只小鼠33μg施用的抗PD-1组合的每只小鼠0.4862、4.862和48.62μg的SR1。
组10-12接受分别与以每只小鼠100μg施用的抗PD-1组合的每只小鼠0.4862、4.862和48.62μg的SR1。
组13设定为阳性对照组,且以300mg/kg接受环磷酰胺。
组14设定为“查看”动物且未接受处理。
表5A研究II设计
#-对照组
*-Mg/kg
结果表明在某些剂量下ZDX(Ta1)+抗PD-1的组合处理的组与单独用Ta1或抗PD-1处理的组相比展现较少的转移。此类结果支持在与抗PD-1抗体组合的功效趋势下,胸腺素处理可在B16F10鼠肺转移模型中提供转移的正性统计学上显著减少。
将在各处理下小鼠中的44种生物标记物的活性加以分析。在这些生物标记物之中,若干生物标记物在仅单独用Ta1或抗PD-1处理的小鼠与用Ta1与抗PD-1的组合处理的小鼠之间显示统计学上显著差异的活性。此类生物标记物包括但不限于载脂蛋白A-I、瘦素、淋巴细胞趋化因子、巨噬细胞集落刺激因子-1(M-CSF-1)、单核细胞趋化蛋白-5(MCP-5)、干细胞因子(SCF)和血管细胞粘附分子-1(VCAM-1)。
在一个独立实验室中进行类似研究以证实结果。结果显示于表6和图8中。有趣的是,在此研究中,抗PD-1不像以上研究一般工作,但TA1与以上研究中一样。此可归因于两个实验室获得抗PD-1抗体的批次差异,以及在肺转移模型中B16F10不总是对抗PD-1作出反应的事实。重要的是尤其在低剂量的TA1下抗PD-1与TA1的组合显示肺转移的统计学上显著减少,且在另外两个组合组中存在正性趋势。因此,这些初步研究证实组合中的两者的相加作用或可能存在的协同作用,尤其是当两者中的一者似乎不作为单一药剂工作时。
表6在系统性B16F10鼠黑素瘤模型的处理中胸腺法新作为单一药剂和与PD-1抗体组合的抗肿瘤活性
除非另外定义,否则本文中的所有技术和科学术语具有与本发明所属领域普通技术人员通常所理解相同的含义。虽然类似或等效于本文所描述的方法和材料的任何方法和材料均可用于实践或测试本发明,但本文描述了优选方法和材料。所列举的所有出版物、专利和专利公开出于所有目的以引用的方式整体并入本文中。
本文所论述的出版物仅仅由于其公开内容在本申请提交日期之前而提供。不应将本文中的任何内容理解为承认本发明由于先前发明而无权先于此类出版物。
虽然已结合本发明的特定实施方案描述了本发明,但应了解其能够进一步修改,且本申请意在涵盖本发明的任何变化、使用或改进,其大体上遵循本发明的原理且包括对本发明的偏离,所述偏离在本发明所属技术内在已知或惯用的范围内且可适用于上文所阐述的基本特征且属于所附权利要求书的范围内。
序列表
<110> 赛生药品股份国际有限公司
<120> 用免疫刺激物治疗癌症
<130> 代理人案号SCIC-113/01WO 191485-3185
<150> 62/066,862
<151> 2014-10-12
<150> 62/215,433
<151> 2015-09-08
<160> 1
<170> PatentIn 版本3.5
<210> 1
<211> 28
<212> PRT
<213> 人工序列
<220>
<223> 胸腺素α1肽
<400> 1
Ser Asp Ala Ala Val Asp Thr Ser Ser Glu Ile Thr Thr Lys Asp Leu
1 5 10 15
Lys Glu Lys Lys Glu Val Val Glu Glu Ala Glu Asn
20 25
- 用免疫刺激剂治疗癌症
- 用免疫刺激剂治疗癌症
