一种重组表位蛋白、编码基因、重组质粒、制备方法、工程菌及应用
文献发布时间:2024-04-18 19:58:26
技术领域
本发明涉及猪冠状病毒疫苗的研发及应用技术领域,尤其涉及一种重组表位蛋白、编码基因、重组质粒、制备方法、工程菌及应用。
背景技术
猪冠状病毒是影响全球养猪业的重要病原体,目前已知能感染猪的冠状病毒主要有6种,包括猪传染性胃肠炎病毒(Transmissible Gastroenteritis of Swine virus,TGEV)、猪流行性腹泻病毒(Porcine Epidemic Diarrhea virus,PEDV)、猪呼吸道冠状病毒(Porcine Despiratory Coronavirus,PRCV)、猪急性腹泻综合征病毒(Swine AcuteDiarrhea Syndrome Coronavirus,SADS-CoV)、猪德尔塔冠状病毒(PorcineDeltacoronavirus,PDCoV)和猪血凝性脑脊髓炎病毒(Porcine HemagglutinatingEncephalomyelitis Virus,PHEV),这几种冠状病毒已对中国养猪业造成了巨大经济损失。
目前中国的猪冠状病毒商品化疫苗主要包括PEDV和TGEV的灭活疫苗及弱毒疫苗,这些疫苗有效降低了猪冠状病毒感染对养殖业的损失,但根据疫苗本身的性质,弱毒疫苗在临床应用中可能会存在毒株返强以及疫苗毒株与野生毒株基因重组等安全性问题,而灭活疫苗更倾向于诱导体液免疫而诱导细胞免疫的能力比较弱,因此需要更安全有效的疫苗抵抗冠状病毒的感染。
综上所述,急需一种重组表位蛋白、编码基因、重组质粒、制备方法、工程菌及应用以解决相关技术中存在的问题。
发明内容
本发明的主要目的是提供一种重组表位蛋白、编码基因、重组质粒、制备方法、工程菌及应用,以解决相关技术中弱毒疫苗在临床应用中可能会存在毒株返强以及疫苗毒株与野生毒株基因重组等安全性问题,而灭活疫苗更倾向于诱导体液免疫而诱导细胞免疫的能力比较弱的技术问题。
为实现上述目的,本发明提供了一种重组表位蛋白,所述重组表位蛋白的氨基酸序列如SEQ ID NO.24所示。
本发明的有益效果在于:提供的重组表达蛋白基于猪冠状病毒的RdRp蛋白以及S蛋白设计而成,其本身不具备病毒的感染能力且具有安全、无毒、稳定的优点,既能通过诱导体液免疫产生高亲和力中和抗体,阻止病毒与靶细胞的受体结合,又能诱导细胞免疫产生特异性的细胞毒性T细胞,从而有效地预防猪冠状病毒的感染,减少由病毒感染而导致的养殖损失,为新型疫苗的研制提供了抗原基础。
本发明还提供了一种用于编码上述重组表位蛋白的编码基因,所述编码基因的核苷酸序列如SEQ ID NO.25所示。
本发明的有益效果在于:提供的编码基因能够用于编码上述重组表位蛋白,通过将该编码基因用于合适的工程菌体内,能够源源不断的合成得到重组表位蛋白。
本发明还提供一种用于制备上述编码基因的制备方法,包括:收集猪冠状病毒的毒株序列信息,通过免疫生物信息学分析,筛选得到猪冠状病毒RdRp蛋白的B细胞表位编码基因、猪冠状病毒RdRp蛋白的T细胞表位编码基因以及猪冠状病毒S蛋白的B细胞表位编码基因,并基于接头序列进行串联,根据工程菌的密码子偏好进行优化,获得用于编码重组表位蛋白的编码基因。
优选的,所述RdRp蛋白的B细胞表位的氨基酸序列如SEQ ID NO.1-10所示;所述RdRp蛋白的T细胞表位的氨基酸序列如SEQ ID NO.13-22所示;所述S蛋白的B细胞表位的氨基酸序列如SEQ ID NO.11-12所示。
本发明还提供了一种含有上述编码基因的重组质粒。
本发明的有益效果在于:通过将含有编码基因的重组质粒转化至合适的工程菌内,能够使携带的编码基因在工程菌内得到表达,从而得到重组表位蛋白,用于后续的疫苗生产。
本发明还提供了一种用于制备上述重组质粒的制备方法,包括:将编码基因以
本发明的有益效果在于:提供了用于制备上述重组质粒的制备方法,操作便捷,且经过密码子优化后的编码基因表达效率高,为大规模生产重组表位蛋白以及相关疫苗打下基础。
本发明还提供了一种含有上述编码基因或上述重组质粒的工程菌。
优选的,所述工程菌为大肠杆菌。
本发明的有益效果在于:能够应用于上述重组表位蛋白的工业化生产,具有高生产效率以及高适应性,且该类工程菌的后代中也同样具备编码基因,能够生产重组表位蛋白,在使用工程菌进行生产的过程中,仅需提供工程菌生长所必需的营养物质以及重组表位蛋白的合成原料即可,管理便捷,生产成本低。
本发明还提供了一种用于制备上述重组表位蛋白的制备方法,包括:
将编码基因以
将重组质粒转化至工程菌感受态细胞,培养并诱导工程菌表达,表达产物经亲和层析纯化以及切胶纯化后得到重组表位蛋白。
本发明还提供了上述重组表位蛋白或上述编码基因或上述重组质粒或上述工程菌在制备猪冠状病毒疫苗中的应用,所述猪冠状病毒疫苗用于预防猪传染性胃肠炎病毒、猪流行性腹泻病毒、猪呼吸道冠状病毒、猪急性腹泻综合征病毒、猪德尔塔冠状病毒以及猪血凝性脑脊髓炎病毒中的至少一种病毒感染。
本发明的有益效果在于:通过上述重组表位蛋白或上述编码基因或上述重组质粒制备得到的猪冠状病毒疫苗不同于相关技术中的弱毒疫苗或灭活疫苗,其本身不具备病毒的感染能力,具有安全、无毒、稳定的优点,既能通过诱导体液免疫产生高亲和力中和抗体,阻止猪冠状病毒与靶细胞的受体结合,又能诱导细胞免疫产生特异性的细胞毒性T细胞(Cytotoxic T lymphocyte,CTL),通过CTL识别靶细胞后直接裂解靶细胞或者诱导靶细胞的凋亡,从而抑制病毒在体内的复制,遏制病毒在体内的传播过程。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图示出的结构获得其他的附图。
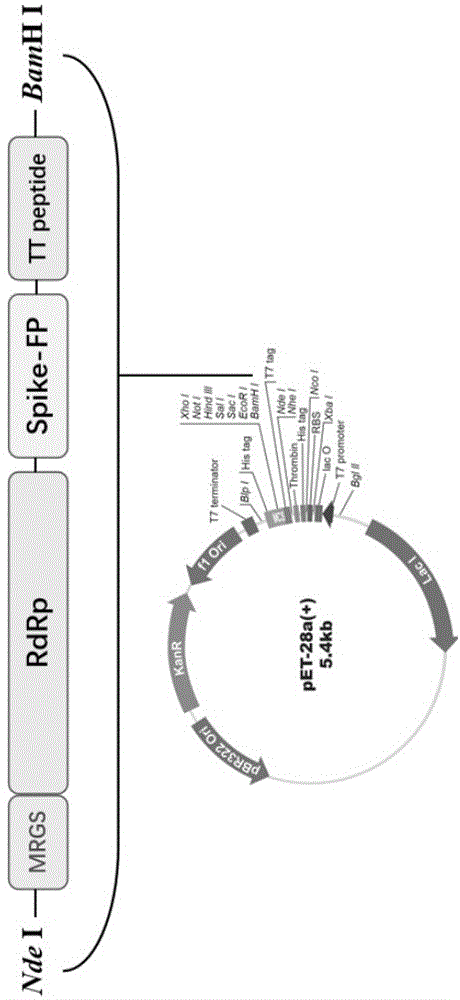
图1是本申请一实施方式的重组质粒的结构示意图;
图2是本申请一实施方式的Protein-sol预测可溶性结果示意图,可溶性(英文:Solubility),计算值(英文:Calculated value),平均值(英文:PopAvrSol表示“population average for the experimental dataset”),预测值(英文:QuerySol表示“scaled solubility value”);
图3是本申请一实施方式的SDS-PAGE和Western blot试验结果示意图,其中A为SDS-PAGE试验结果示意图,B为Western blot试验结果示意图,Marker表示标记,kDa表示千道尔顿;
图4是本申请一实施方式的重组表位蛋白的亲和层析法纯化SDS-PAGE结果示意图,PM2500表示蛋白质标记1,T表示总蛋白,S表示可溶性上清蛋白,FT表示流川液蛋白,Wash表示洗脱杂蛋白;
图5是是本申请一实施方式的重组表位蛋白的切胶纯化后的SDS-PAGE结果示意图,M表示蛋白质标记2,Protein表示目的蛋白;
图6是本申请一实施方式采用间接ELISA方法测定血清中重组表位蛋白特异性IgG抗体水平的柱状示意图,OD450nm表示450nm波长下测定的吸光度,初次免疫后天数(英文:Days after primary immunization);
图7是本申请一实施方式采用间接ELISA方法测定血清中重组表位蛋白特异性IgG抗体水平的折线示意图,血清稀释度(英文:Serum dilution);
图8是本申请一实施方式的PEDV中和试验和TGEV中和试验的几何平均滴度(GMT)计算结果图,A为PEDV中和试验的几何平均滴度(GMT)计算结果图,B为TGEV的中和试验的几何平均滴度(GMT)计算结果图,其中中和抗体滴度(英文:Neutrilization antibodytiter);
图9是本申请一实施方式采用ELISpot试剂盒检测不同组PEDV二次攻毒后第7天仔猪PBMC IFN-γ因子的分泌量的柱状示意图;将SFU≥100定义为截断值;RdRp-1~RdRp-10:合成多肽(对应10个T细胞表位);RdRp-Me:重组表位蛋白;PMA:阳性刺激物对照;NC:不加阳性刺激物对照;Background:背景孔;RdRP-Me(PBS):阴性外周血单核细胞对照。
本发明目的的实现、功能特点及优点将结合实施方式,参照附图做进一步说明。
具体实施方式
下面将结合本发明实施方式中的附图,对本发明实施方式中的技术方案进行清楚、完整地描述,显然,所描述的实施方式仅仅是本发明的一部分实施方式,而不是全部的实施方式。基于本发明中的实施方式,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施方式,都属于本发明保护的范围。
需要说明,本发明实施方式中所有方向性指示(诸如上、下……)仅用于解释在某一特定姿态下各部件之间的相对位置关系、运动情况等,如果该特定姿态发生改变时,则该方向性指示也相应地随之改变。
另外,在本发明中如涉及“第一”、“第二”等的描述仅用于描述目的,而不能理解为指示或暗示其相对重要性或者隐含指明所指示的技术特征的数量。由此,限定有“第一”、“第二”的特征可以明示或者隐含地包括至少一个该特征。
并且,本发明各个实施方式之间的技术方案可以相互结合,但是必须是以本领域普通技术人员能够实现为基础,当技术方案的结合出现相互矛盾或无法实现时应当认为这种技术方案的结合不存在,也不在本发明要求的保护范围之内。
表位疫苗是近些年发展起来的一种基于目标抗原表位设计的新型疫苗,与传统疫苗相比,具有安全、无毒、稳定的优点。
研究6种猪冠状病毒的基因组结构发现:几种病毒的蛋白质结构和病毒粒子结构均存在一定的相似性,即S蛋白和RdRp蛋白,因此基于6种猪冠状病毒的保守性表位序列进一步进行多表位疫苗的设计。
S(spike)蛋白为冠状病毒的重要结构蛋白,位于冠状病毒粒子表面,在病毒入侵宿主过程中发挥作用,其参与病毒识别并结合宿主受体的过程,以及病毒与宿主细胞的膜融合,由于S蛋白良好的免疫原性,可以作为冠状病毒疫苗设计的重要靶蛋白。
RdRp(RNA-dependent RNA polymerase)是冠状病毒的非结构蛋白,由冠状病毒nsp12编码,是RNA病毒复制/转录复合物的中心酶,负责催化病毒RNA的合成,是冠状病毒入侵宿主细胞之后,启动其他一切生命活动的关键蛋白质,其功能的重要性和序列的高保守性表明,它能够为疫苗的开发提供重要靶点/抗原。
一种重组表位蛋白,所述重组表位蛋白的氨基酸序列如SEQ ID NO.24所示。
该重组表位蛋白由猪冠状病毒RdRp蛋白的B细胞表位、猪冠状病毒RdRp蛋白的T细胞表位以及猪冠状病毒S蛋白的B细胞表位以柔性肽串联后形成。其本身不具备病毒的感染能力且具有安全、无毒、稳定的优点,既能通过诱导体液免疫产生高亲和力中和抗体,阻止病毒与靶细胞的受体结合,又能诱导细胞免疫产生特异性的细胞毒性T细胞,从而有效地预防猪冠状病毒的感染,减少由病毒感染而导致的养殖损失,为新型疫苗的研制提供了抗原基础。
本发明还提供了一种用于编码上述重组表位蛋白的编码基因,所述编码基因的核苷酸序列如SEQ ID NO.25所示。
本发明的有益效果在于:提供的编码基因能够用于编码上述重组表位蛋白,通过将该编码基因用于合适的工程菌体内,能够源源不断的合成得到重组表位蛋白。
本发明还提供了一种用于制备上述编码基因的制备方法,包括:收集猪冠状病毒的毒株序列信息,通过免疫生物信息学分析,筛选得到猪冠状病毒RdRp蛋白的B细胞表位编码基因、猪冠状病毒RdRp蛋白的T细胞表位编码基因以及猪冠状病毒S蛋白的B细胞表位编码基因,并基于接头序列进行串联,根据工程菌的密码子偏好进行优化,获得用于编码重组表位蛋白的编码基因。
优选的,所述RdRp蛋白的B细胞表位的氨基酸序列如SEQ ID NO.1-10所示;所述RdRp蛋白的T细胞表位的氨基酸序列如SEQ ID NO.13-22所示;所述S蛋白的B细胞表位的氨基酸序列如SEQ ID NO.11-12所示。
本发明还提供了一种含有上述编码基因的重组质粒。
本发明的有益效果在于:通过将含有编码基因的重组质粒转化至合适的工程菌内,能够使携带的编码基因在工程菌内得到表达,从而得到重组表位蛋白,用于后续的疫苗生产。
本发明还提供了一种用于制备上述重组质粒的制备方法,包括:将编码基因以
本发明的有益效果在于:提供了用于制备上述重组质粒的制备方法,操作便捷,且经过密码子优化后的编码基因表达效率高,为大规模生产重组表位蛋白以及相关疫苗打下基础。
本发明还提供了一种含有上述编码基因或上述重组质粒的工程菌。
在一些实施例中,所述工程菌为大肠杆菌。
本发明的有益效果在于:能够应用于上述重组表位蛋白的工业化生产,具有高生产效率以及高适应性,且该类工程菌的后代中也同样具备编码基因,能够生产重组表位蛋白,在使用工程菌进行生产的过程中,仅需提供工程菌生长所必需的营养物质以及重组表位蛋白的合成原料即可,管理便捷,生产成本低。
本发明还提供了一种用于制备上述重组表位蛋白的制备方法,包括:
将编码基因以
将重组质粒转化至工程菌感受态细胞,培养并诱导工程菌表达,表达产物经亲和层析纯化以及切胶纯化后得到重组表位蛋白。
本发明还提供了上述重组表位蛋白或上述编码基因或上述重组质粒或上述工程菌在制备猪冠状病毒疫苗中的应用,所述猪冠状病毒疫苗用于预防猪传染性胃肠炎病毒、猪流行性腹泻病毒、猪呼吸道冠状病毒、猪急性腹泻综合征病毒、猪德尔塔冠状病毒以及猪血凝性脑脊髓炎病毒中的至少一种病毒感染。
本发明的有益效果在于:通过上述重组表位蛋白或上述编码基因或上述重组质粒制备得到的猪冠状病毒疫苗不同于相关技术中的弱毒疫苗或灭活疫苗,其本身不具备病毒的感染能力,具有安全、无毒、稳定的优点,既能通过诱导体液免疫产生高亲和力中和抗体,阻止猪冠状病毒与靶细胞的受体结合,又能诱导细胞免疫产生特异性的细胞毒性T细胞(Cytotoxic T lymphocyte,CTL),通过CTL识别靶细胞后直接裂解靶细胞或者诱导靶细胞的凋亡,从而抑制病毒在体内的复制,遏制病毒在体内的传播过程。
实施例1
1、猪冠状病毒保守性抗原表位的筛选及串联
1.1 6种猪冠状病毒RdRp蛋白质序列比对
从NCBI数据库(https://www.ncbi.nlm.nih.gov/)中收集6种猪冠状病毒中具有代表性毒株的RdRp蛋白氨基酸序列,其中9株为PEDV参考毒株(GeneBank accessionnumber:AF353511,KF267450,KF452323,KF760557,KJ645695,LM645058,JX088695,JX560761,JN547228),6株为TGEV参考毒株(GeneBank accession number:FJ755618,DQ811788,DQ811785,KX499468,KX900411,KX900394),7株为PDCoV参考毒株(GeneBankaccession number:KJ601780,KX022605,KX022602,JQ065042,MK211169,KY513724,KU051649),7株为SADS-CoV参考毒株(GeneBank accession number为:MG557844,MT039231,MK994937,MG605090,MT294722,MK651076),3株为PRCV参考毒株(GeneBankaccession number:DQ811787,KY406735,KR270796),5株为PHEV参考毒株(GeneBankaccession number:MF083115,KY994645,DQ011855,KY419112,KY419113)。利用在线氨基酸序列比对服务器Multalin(http://multalin.toulouse.inra.fr/multalin)进行序列比对和分析。
1.2 RdRp蛋白和S蛋白保守性B细胞表位预测
利用在线预测工具BepiPred 2.0(http://www.cbs.dtu.dk/services/BepiPred/)和ABCPred(https://webs.iiitd.edu.in/raghava/abcpred/)对6种猪冠状病毒RdRp蛋白和S蛋白的保守性B细胞线性表位进行预测,采用VaxiJen v2.0(http://www.ddgpharmfac.net/ vaxijen/VaxiJen/VaxiJen.html )在线工具进行抗原性评估,采用AllerTOP v2.0(http:// www.ddg-pharmfac.net/AllerTOP)和Toxinpred server(https://webs.iiitd.edu.in /raghava/toxinpred/index.html)对表位的致敏性及毒性进行评估。
经序列比对发现6种猪冠状病毒RdRp序列的同源性约45%~75%(TGEV与PRCV同源性达到了99%),基于同源性高的区域,通过BepiPred 2.0和ABCPred的在线预测,共预测出10组B细胞表位,氨基酸序列如SEQ ID NO.1-10所示:
SEQ ID NO.1:NKSAGYPLN;
SEQ ID NO.2:SGKERARTV;
SEQ ID NO.3:TKFYGGWDNML;
SEQ ID NO.4:WDYPKCDR;
SEQ ID NO.5:PGGTTSGDATTA;
SEQ ID NO.6:MILSDDGVVC;
SEQ ID NO.7:LYYQNNVFMS;
SEQ ID NO.8:GPHEFCSQHT;
SEQ ID NO.9:YLPYPDPSRI;
SEQ ID NO.10:SLAIDAYPL;
其中有2个表位同源性达100%(612~619、803~812 aa),另有8个表位(494~502、544~552、587~597、672~683、751~760、781~790、823~832、856~864 aa)仅个别氨基酸残基具有差异,B细胞表位抗原性分析、致敏性分析结果见表1。
其中,No.表示编号,Epitope表示表位,Position表示位置,Vaxijen Score为抗原性评估得分,Allergenicity表示表位致敏性,Non-allergen表示非过敏原,Allergen表示过敏原,Toxicity表示毒性,Non-Toxin表示无毒性。
此外,还分析了两个来源于PEDV且已有研究报道的B细胞中和表位,分别是来源于PEDV S蛋白质的Fusion peptide序列如SEQ ID NO.11(KRSFIEDLLFNKVVTN)和SS2序列参见如SEQ ID NO.12(YSNIGVCK),经同源性分析发现这两个表位在多种猪冠状病毒中具有高保守性。
1.3 T细胞表位初步预测
使用IEDB(Immune Epitope Database)在线预测软件(https://www.iedb.org)对猪冠状病毒RdRp蛋白的T细胞表位进行预测,基于预测结果,筛选出6种猪冠状病毒的保守的T细胞表位序列,氨基酸序列如SEQ ID NO.13-22所示:
SEQ ID NO.13:NKSAGYPLNKF;
SEQ ID NO.14:SGKERARTV;
SEQ ID NO.15:TKFYGGWDNML;
SEQ ID NO.16:WDYPKCDRALPNMIRMI;
SEQ ID NO.17:PGGTTSGDATTAY;
SEQ ID NO.18:LRKHFSMMILSDDGVVC;
SEQ ID NO.19:LYYQNNVFMS;
SEQ ID NO.20:IEPDINKGPHEFCSQHT;
SEQ ID NO.21:YLPYPDPSRI;
SEQ ID NO.22:YVSLAIDAYPLSKHE。
使用IEDB在线算法共筛选了10个保守性高的T细胞候选表位,见表2,这10个T细胞候选表位序列与先前预测的10个B细胞表位的序列的位置重叠。因目前对SARS-CoV-2的T细胞表位鉴定的相关研究较多,将预测的T细胞候选表位与IEDB数据库中已鉴定的SARS-CoV-2的T细胞表位进行比对,发现两者具有较好的同源性。
1.4 猪冠状病毒抗原重组表位蛋白的设计
将预测的猪冠状病毒RdRp蛋白的B细胞表位、猪冠状病毒RdRp蛋白的T细胞表位以及猪冠状病毒S蛋白的B细胞表位用柔性肽“GGGS”串联构建重组表位蛋白,使用大肠杆菌表达的可溶性预测工具Prorein-sol(https://protein-sol.manchester.ac.uk/)对重组表位蛋白的可溶性进行预测,该网站提供了一种基于序列的快速预测大肠杆菌表达蛋白溶解度的方法,对Recombinant Protein Solubility预测结果进行验证。利用Expasy在线工具(https://www.expasy.org)对重组表位蛋白的等电点及相对分子质量等理化性质进行预测。
2 猪冠状病毒抗原重组表位蛋白的制备
2.1 用于编码重组表位蛋白的编码基因(以下简称为RdRp-Me基因)的优化合成和重组质粒的构建
1)本发明将设计并由金斯瑞生物科技技术有限公司合成重组表位蛋白的编码基因(以下简称为RdRp-Me基因),该编码基因已根据大肠杆菌密码子的偏好性进行优化,其核苷酸序列如SEQ ID NO.25所示。
2)将优化合成的RdRp-Me基因通过两端的酶切位点(
设计的重组表位蛋白共有13个多肽序列(见表3),为提高机体的体液免疫和细胞免疫应答,筛选了一个来源于破伤风类毒素的通用型T细胞辅助表位(TT)氨基酸序列如SEQID NO.23所示(TT830–843: QYIKANSKFIGITE)。用柔性肽(GGGS)将表位串联构建多表位肽,N端插入促进表达量的序列(MRGS),构建重组质粒pET28a(+)-RdRp-Me,参见图1。
重组表位蛋白(215aa,22.215KDa,等电点:8.63)氨基酸序列如SEQ ID NO.24所示:
MRGSNKSAGYPLNKFGGGSGKERARTVGGGSTKFYGGWDNMLGGGSWDYPKCDRALPNMIRMIGGGSPGGTTSGDATTAYGGGSLRKHFSMMILSDDGVVCGGGSLYYQNNVFMSGGGSIEPDINKGPHEFCSQHTGGGSYLPYPDPSRIGGGSYVSLAIDAYPLSKHEGGGSKRSFIEDLLFNKVVTNGGGSYSNIGVCKGGGSQYIKANSKFIGITE。
用于编码重组表位蛋白的编码基因(RdRp-Me基因)的核苷酸序列如SEQ ID NO.25所示:
ATGAGGGGGTCAAATAAAAGTGCTGGATATCCATTGAATAAGTTCGGTGGCGGCTCCGGTAAAGAACGTGCGCGTACCGTTGGTGGTGGTTCAACCAAATTCTATGGTGGCTGGGACAACATGCTGGGTGGAGGTAGCTGGGACTACCCGAAATGCGATAGAGCGCTGCCGAATATGATCCGTATGATCGGCGGCGGTTCGCCGGGTGGTACAACGAGTGGTGACGCTACCACGGCATACGGGGGAGGCTCTCTGCGCAAACACTTTAGCATGATGATCCTGAGCGATGATGGCGTGGTTTGCGGTGGCGGCTCCTTATATTACCAGAACAACGTCTTTATGAGCGGTGGAGGTTCCATCGAGCCGGACATCAACAAGGGTCCGCATGAATTTTGTAGCCAGCATACCGGTGGCGGTTCCTACCTGCCTTATCCGGACCCGAGCCGTATTGGTGGCGGTAGCTATGTTAGCCTTGCCATTGATGCTTACCCGTTGAGCAAGCACGAGGGCGGTGGCTCCAAGCGCTCGTTCATTGAGGACCTGCTGTTTAACAAGGTGGTGACCAATGGCGGCGGCTCTTACAGCAATATTGGGGTGTGCAAAGGTGGCGGCTCTCAATATATCAAAGCGAACAGCAAGTTCATCGGTATTACCGAATAA。其中最后3个核苷酸“TAA”为终止密码子。
Protein-sol预测可溶性结果为0.6169(满分为1,大于0.45时具有可溶性),参见图2。
2.2 重组表位蛋白的表达
1)将pET28a(+)-RdRp-Me重组质粒转化至BL21(DE3)大肠杆菌感受态细胞,涂布在浓度为100 μg/mL的卡那抗生素的LB培养基平板,37 ℃倒置培养12-14h。
2)分别随机挑取一个单克隆菌落至10mL含有100 μg/mL 的卡那抗生素的LB培养基,37℃ 220 rpm振荡培养12 h。
3)按照1:100的比例,将10 mL菌液加至1 L已高压灭菌处理的含有100 μg/mL的卡那抗生素的α乳糖发酵培养基(0.01 mol/L),37℃ 180rpm振荡培养3 h至OD600达到0.8-1.0,温度降至27 ℃,180 rpm振荡培养12 h后,4℃ 8,000g离心10 min,弃掉上清液,大肠杆菌沉淀置于-80℃保存用于蛋白纯化。
2.3 亲和层析方法纯化重组表位蛋白
1)大肠杆菌沉淀置于冰浴上,取100 mL PBS缓冲液(即溶解保护试剂,是生物化学研究中使用最为广泛的一种缓冲液,主要成分为Na
2)将悬浮的样品利用低温超高压连续流细胞破碎机进行破碎沉淀,1300bar压力,反复破碎6-8遍,破碎产物利用革兰氏染色方法,显微镜下观察大肠杆菌95%以上全部破碎,破碎后样品于4 ℃ 16,000g离心20 min,离心后收集上清和沉淀。
3)包涵体沉淀中加入20 mL包涵体洗涤液,于室温低速搅拌洗涤2 h,4 ℃条件下13,800 g离心30 min,收集未溶解沉淀。
所述包涵体洗涤液的成分如下表所示:
其中,Tris-HCl表示三羟甲基氨基甲烷盐酸盐,EDTA表示乙二胺四乙酸,β-Me表示β-巯基乙醇,Triton X-100表示聚乙二醇辛基苯基醚。
4)加入包涵体变性缓冲液20 mL,于4 ℃低速搅拌至包涵体溶解,4 ℃条件下 13,800 g离心20 min,收集上清,即为变性后蛋白。
所述包涵体变性缓冲液(pH 8.0)的成分如下表所示:
5)用ddH
裂解缓冲液的成分如下表所示:
其中,Imidazole表示咪唑。
6)放置摇床低速震荡1 h,使带有His tag(组氨酸标签)的重组表位蛋白与填料结合。
7)将结合后的溶液加入空的镍柱,收集流穿液(FT),向镍柱中缓缓滴加30 mL低浓度咪唑洗涤液(Wash buffer),pH 8.0,洗涤杂蛋白,并收集洗涤液(Wash),待低浓度咪唑洗涤液滴尽,用盖子堵住镍柱。
所述低浓度咪唑洗涤液的成分如下表所示:
8)加入30 mL高浓度咪唑洗涤液(Elution buffer),pH8.0,静置2 min,用干净的2mL离心管收集(前10滴左右含有杂蛋白不收集),依次标记离心管E1、E2、E3、E4、E5、E6、E7、E8、E9、E10。
所述高浓度咪唑洗涤液的成分如下表所示:
9)用5×SDS-PAGE sample buffer(SDS-PAGE 样品缓冲液)处理纯化后变性包涵体,煮沸后上样至10%的蛋白胶样品孔中,按常规方法进行蛋白电泳。
10)电泳结束,将分离胶切下放入干净的容器中,使用0.25 mol/L的KCl溶液浸泡分离胶约5 min。
11)用手术刀切下被染成银白色部分的胶块并转置另一干净的容器中,用PBS缓冲液冲洗后,将胶块放进洁净的封口袋中进行碾压,再将封口袋放入-20 ℃冰箱冷冻2 h,反复冻融3次。将溶于6 M尿素中的蛋白质经镍柱亲和层析法纯化后获得目的蛋白,蛋白质浓度最高可达5 mg/mL(见图4)。为保证动物试验的进行,采用切胶纯化去除变性蛋白质中的尿素,切胶纯化后获得了不含尿素的变性蛋白质(见图5)。
12)用3 mL PBS重悬凝胶至离心管中,10,000 g离心10 min取上清,再用0.45 μm滤膜过滤。
13)测定回收获得的蛋白浓度。
14)所有收集的样品加入5× SDS-PAGE sample buffer,100 ℃煮沸10 min,进行SDS-PAGE分析。
利用SDS-PAGE和Western blot试验对重组蛋白质的原核表达结果进行分析,重组蛋白质可溶性分析发现,细胞总蛋白质及沉淀样品中在25 kDa附近出现明显条带,与预测蛋白质大小一致,且与抗His的标签抗体产生了良好反应(见图3),证明串联重组蛋白质在大肠杆菌中成功表达,且表达量较高,主要以包涵体的形式表达在细胞沉淀中。
3 重组表位蛋白免疫原性评价
3.1小鼠免疫试验分组及免疫程序
选取15只6周龄的雌性BALB/c健康小鼠,随机分成3组,每组5只。第一组免疫重组表位蛋白 50 μg,其中重组表位蛋白与Gel 02 ST水性佐剂(现有技术)按照(9:1比例混合)配成250 μg/mL;第二组免疫商品化疫苗100 μL作为阳性对照;第三组免疫PBS 100 μL作为阴性对照。各试验组均采用皮下注射的免疫途径。第一次免疫后第14天和28天加强免疫一次,共免疫三次,并于分别第14天、28天和42天对小鼠眼眶后静脉丛进行采血,分离血清后测定抗体水平。
采集首免后第14天、28天及42天的小鼠血清,包被重组表位蛋白,使用间接ELISA方法测定血清中重组表位蛋白特异性IgG抗体(免疫球蛋白)水平。结果显示,免疫后第14天重组表位蛋白组(RdRp-Me)产生抗体,在第42天达到最高,特异性IgG抗体滴度达到了104,商品化疫苗组(Vaccine)产生的针对重组表位蛋白的特异性IgG抗体水平较低(见图6和图7),而PBS组无免疫反应。
3.2 免疫小鼠血清制备
1)在通风橱内用乙醚将小鼠进行麻醉;
2)食指和拇指向后捏住小鼠头部皮肤,使眼球充分暴露,手掌保定小鼠身体部位;
3)采血针刺入小鼠眼眶后静脉丛,使血液自然流入EP管(微型离心管);
4)将EP管收集的血清于4 ℃静置过夜;
5)4 ℃条件下,4,000 g离心10 min后,取上层血清,用已灭菌的EP管收集,标记后置于-20 ℃长期保存。
3.3 抗体ELISA检测方法的操作步骤
1)抗原包被:将纯化后的重组表位蛋白作为抗原进行包被(1 μg/mL),每孔包被100 μL,放置4 ℃过夜包被;
2)封闭:包被结束后用PBST(磷酸盐缓冲液)洗涤5次,5 min/次,用PBST作为稀释液配制5%的脱脂奶粉,每孔加入100 μL,于37 ℃封闭3 h;
3)一抗孵育:封闭结束后用PBST洗涤5次,5 min/次,将小鼠的血清用PBST稀释100倍,每孔加入100 μL血清,并做三个重复,于37 ℃孵育1 h;
4)二抗孵育:PBST洗涤5次,5 min/次,用PBST稀释HRP(辣根过氧化物酶)标记山羊抗小鼠IgG(1:5000),每孔加入100 μL,于37 ℃孵育1 h;
5)显色:PBST洗涤5次,5 min/次,提前取出TMB(3,3',5,5'-四甲基联苯胺)显色液恢复至室温,每孔加入50 μL TMB显色液,使用锡箔纸避光处理,37 ℃条件下孵育15 min;
6)终止反应:每孔加入50 μL 2 M浓H
7)读数:读取在OD450 nm波长处的OD值。
3.4病毒中和抗体测定步骤
1)细胞铺板:将Vero细胞接种至96孔板,待细胞密度生长至80%~90%进行病毒中和试验;
2)血清灭活:将血清置于56 ℃水浴锅灭活30 min;
3)血清稀释:使用DMEM培养基对血清进行倍比稀释,取25 μL血清稀释至200 μL,此时血清稀释度为1/8,再将血清逐一进行2倍稀释(1/8至1/1024);
4)病毒中和:每管加入200 μL PEDV病毒(200 TCID50),将血清与病毒混合后放置37 ℃培养箱孵育2 h,取出血清,加入接种Vero细胞的96孔板中,37 ℃培养箱孵育1 h,然后将96孔板内液体换成含有2%FBS的DMEM培养基;
5)病变观察:静置3~5天,待对照孔(只加病毒)全部出现细胞病变(CPE)时,观察各试验孔病变结果,以完全保护Vero细胞不出现CPE的最大血清稀释倍数的倒数判定为病毒中和抗体滴度。
6)针对TGEV的中和抗体试验采用PK细胞,步骤同上。
对第三次免疫后14天收集的小鼠血清进行PEDV和TGEV的中和试验。经几何平均滴度(GMT)计算结果显示,PEDV中和试验中重组表位蛋白组血清针对PEDV的中和抗体滴度为18.3,商品化疫苗组血清针对PEDV的中和抗体滴度为84.4,PBS组血清未产生保护(见图8A)。TGEV中和试验中重组表位蛋白组血清针对TGEV的中和抗体滴度为12.1,商品化疫苗组血清针对TGEV的中和抗体滴度为24.2,PBS组血清未产生保护(见图8B)。说明重组表位蛋白免疫后的血清能够诱导针对PEDV和TGEV的特异性中和抗体产生。
4 RdRp蛋白T细胞表位鉴定
1)外周血单核细胞(PBMC)复苏:台盼蓝染色测定细胞活率,要求细胞活率90%以上。
2)抗体包被:将捕获单抗(pIFNγ-I)使用无菌PBS稀释至10 μg/mL;向PVDF板中加入35%乙醇,每孔添加20 μL,孵育时长在1 min以内,再使用ddH
3)细胞铺板:使用无菌PBS冲洗PVDF板5次,每孔加入200 μL含10% FBS的RPMI-1640培养基,室温孵育30 min以上;试验组细胞密度调整至4×106个/mL,对照组细胞密度调整至1×106个/mL,各加入100 μL细胞悬液。
4)多肽刺激:阳性对照孔加入10 μL阳性刺激物(PMA+Ionomycin,佛波酯(Phorbol12-Myristate 13-Acetate, PMA)和离子霉素(ionomycin) 的混合物),阴性对照孔加入10μL RPMI-1640培养基,试验孔加入多肽/重组表位蛋白(不同的实验孔分别加入多肽(对应10个T细胞表位)和重组表位蛋白)。
5)孵育:将培养板放置于37 ℃ CO
6)检测抗体孵育:弃去板内液体,PBS洗涤5次,使用含0.5% FBS的PBS稀释检测单抗(P2C11-biotin)至0.5 μg/mL,每孔加入100 μL,37 ℃下孵育2 h;PBS洗涤5次,使用PBS对Streptavidin-ALP(碱性磷酸酶标记链酶亲和素)进行 1:1000稀释,每孔加入100 μL,37℃孵育1 h。
7)显色:PBS洗涤5次,每孔加入100 μL ELISpot显色液,37 ℃显色30 min。
8)终止显色:用自来水彻底冲洗,终止显色。
用重组表位蛋白及合成的多肽刺激仔猪PBMC(PEDV二次攻毒后第7天分离得到),使用ELISpot试剂盒检测IFN-γ因子的分泌量。结果显示10条预测的T细胞表位和重组表位蛋白均诱导了高水平IFN-γ的分泌(图9),而重组表位蛋白刺激阴性猪的PBMC未诱导IFN-γ分泌,进一步证实了这10条合成的多肽(RdRp-1-10)为基于猪冠状病毒RdRp的T细胞表位,见表9。
注:SFU/106≥100定义为阳性T细胞表位。
本发明的上述技术方案中,以上仅为本发明的优选实施例,并非因此限制本发明的专利范围,凡是在本发明的技术构思下,利用本发明说明书及附图内容所作的等效结构变换,或直接/间接运用在其他相关的技术领域均包括在本发明的专利保护范围。
- 一种Nucyep酶的编码基因、重组表达载体、重组工程菌及其制备方法和应用
- 一种台湾金线莲的苯丙氨酸解氨酶及其编码基因、重组载体、重组工程菌及应用
- 一种福建金线莲的苯丙氨酸解氨酶及其编码基因、重组载体、重组工程菌及应用
- 含有人SMIM25基因的重组质粒、基因工程菌、重组蛋白、多抗及制备方法和应用
- 含有人SMIM25基因的重组质粒、基因工程菌、重组蛋白、多抗及制备方法和应用
