用于子宫内膜癌早期检测的引物探针组合、甲基化检测试剂盒及其应用
文献发布时间:2024-05-31 01:29:11
技术领域
本发明属于生物医药技术领域,特别涉及用于子宫内膜癌早期检测的引物探针组合、甲基化检测试剂盒及其应用。
背景技术
子宫内膜癌是发生于子宫内膜的一种常见的上皮性恶性肿瘤,约占妇科恶性肿瘤的20%-30%。子宫内膜癌多见于围绝经期及绝经后妇女,高发年龄为50-70岁,诊断的中位年龄为61岁。近年来随着内膜癌危险因素的流行率上升,尤其是肥胖和人口老龄化,内膜癌发病率逐渐上升。此外,内膜癌发病出现年轻化趋势,绝经前女性内膜癌发病率明显增高。子宫内膜癌治疗效果与临床分期密切相关,早期子宫内膜癌病患通常有较好的预后。据统计,早期(I期、II期)病患的五年生存率可达70%以上,III期病患的五年生存率约为40-50%,而IV期病患的五年生存率仅为15-20%。早期诊断对子宫内膜癌具有重要意义。
大多数内膜癌患者的首发症状是不规则阴道流血或阴道排液,由于该症状并不特异,约14%的育龄期女性及4%-11%的绝经期女性出现此症状,其中仅有0.33%-1.04%最终被诊断为子宫内膜癌。基于此症状,就诊后往往需要通过大量临床检查以确认是否患有子宫内膜癌,包括但不限于影像学检查(如阴道超声检查)、实验室检查(检测常用的临床标记物如CA125和HE4)、子宫内膜活检(诊断性刮宫和宫腔镜刮宫,取出内膜组织并进一步进行组织病理活检)。影像学检查和实验室检查的灵敏度和特异度均较低,而子宫内膜活检则是一种有创性操作,易造成身体不适。因此,目前亟需开发一种方便快捷并能早期精准识别内膜癌的无创检测手段。
DNA甲基化是表观遗传修饰的一种,即在胞嘧啶碱基的5号碳原子上添加一个甲基,这种修饰通常跟基因的沉默相关。DNA甲基化是基因表达的关键表观遗传调节因子,通常导致基因表达缺陷。肿瘤抑制基因的甲基化增加是许多肿瘤的早期事件。甲基化信号是目前被普遍认可的肿瘤筛查标志物来源,具有在肿瘤发生早期出现、信号稳定、检测方法便捷等优势。但在子宫内膜癌的早筛早诊方面未见DNA甲基化实现有效的临床应用。
发明内容
为了克服上述现有技术的缺点与不足,本发明的首要目的在于提供一种用于子宫内膜癌早期检测的甲基化基因标志物。
本发明通过筛选获得了子宫内膜癌特异性甲基化早期筛查标志物,包括VSX1、SYT1、ZNF132、VWC2基因中的至少一个,检测这些基因的甲基化以区别子宫内膜癌与非癌症个体,并通过在多种无创采样的样本类型中进行检测,验证了本发明标志物的稳定性及有效性。
本发明另一目的在于提供一种用于子宫内膜癌诊断的试剂盒。
本发明发现了可于各类无创采集样本中均可排除本底信号干扰而准确区别子宫内膜癌及其他疾病/健康个体的位点,并基于其建立了稳定可靠的标志物检测试剂盒。
本发明再一目的在于提供上述试剂盒在制备子宫内膜癌诊断产品中的应用。
本发明的目的通过下述方案实现:
根据本发明的第一方面,本发明提出了一种用于子宫内膜癌检测的甲基化基因标志物,所述甲基化基因标志物具体包括VSX1、SYT1、ZNF132、VWC2基因中的至少一个。所述的检测指通对目标基因VSX1、SYT1、ZNF132、VWC2中至少一个的甲基化水平进行检测,实现对子宫内膜癌的诊断。
根据本发明的第二方面,本发明提出了一种用于子宫内膜癌检测的甲基化基因标志物,所述甲基化基因标志物包括目标基因VSX1、VWC2、ZNF132、SYT1中至少一个基因中的至少一个靶区域内甲基化的核酸序列,所述靶区域选自VSX1、VWC2、ZNF132、SYT1至少一个基因中以下至少一段的甲基化:
VSX1基因:Chr20:25058334-25058603;Chr20:25061937-25062310或Chr20:25061874-25062088;Chr20:25062398-25062760或Chr20:25062376-25062484;Chr20:25062681-25062788或Chr20:25062655-25062739;Chr20:25062736-25062940或Chr20:25062749-25062900;
SYT1基因:Chr12:79258369-79258486或Chr12:79258392-79258498;
ZNF132基因:Chr19:58951204-58951524或Chr19:58951402-58951524;Chr19:58951554-58951637;Chr19:58951672-58952006或Chr19:58951724-58951825;
VWC2基因:Chr7:49812992-49813086;Chr7:49813051-49813343或Chr7:49813066-49813161;Chr7:49813455-49813811或Chr7:49813387-49813537;Chr7:49814721-49815073或Chr7:49814765-49814936;Chr7:49815144-49815236;Chr7:49815290-49815635或Chr7:49815340-49815439。
本发明所述的基因以人类基因组版本GRCh37(hg19)为参考基因组。
本发明通过筛选获得了子宫内膜癌特异性甲基化早期筛查标志物,包括VSX1、SYT1、ZNF132、VWC2中的至少一个基因,通过检测这些基因的甲基化水平可以显著区别子宫内膜癌与非癌症个体,并通过在多种无创采样的样本类型中进行检测,验证了本发明标志物的稳定性及有效性。本发明为子宫内膜癌和其癌前病变的诊断提供了新的标志物和诊断策略。
进一步的,通过体外检测样本中任意至少一个目标基因对应的任意至少一个甲基化区域,即可实现对子宫内膜癌进行诊断。所述的样本可为任何体液和脱落细胞,及组织样本等,如包括尿液、血液等体液样本,拭子、刷片、灌洗液等脱落细胞采集样本。本发明的基因标志物在组织/尿液/刷片/拭子样本中均能较好地鉴别子宫内膜癌与非癌个体,单指标即能达到较好的检测效果,多指标联合能进一步提高检测效能。
根据本发明的第三方面,本发明提出了一种用于子宫内膜癌检测的检测引物,用于对应检测上述标志物基因甲基化区域的甲基化状态,所述检测引物的核苷酸序列如下所示至少之一:
VSX1基因:
Chr20:25058334-25058603对应检测引物为SEQ ID NO:1-2;
Chr20:25061937-25062310对应检测引物为SEQ ID NO:4-5;
Chr20:25061874-25062088对应检测引物为SEQ ID NO:6-7;
Chr20:25062398-25062760对应检测引物为SEQ ID NO:9-10;
Chr20:25062376-25062484对应检测引物为SEQ ID NO:12-13;
Chr20:25062681-25062788对应检测引物为SEQ ID NO:15-16;
Chr20:25062655-25062739对应检测引物为SEQ ID NO:18-19;
Chr20:25062736-25062940对应检测引物为SEQ ID NO:21-22;
Chr20:25062749-25062900对应检测引物为SEQ ID NO:23-24;
SYT1基因:
Chr12:79258369-79258486对应检测引物为SEQ ID NO:26-27;
Chr12:79258392-79258498对应检测引物为SEQ ID NO:29-30;
ZNF132基因:
Chr19:58951204-58951524对应检测引物为SEQ ID NO:32、SEQ ID NO:34;
Chr19:58951402-58951524对应检测引物为SEQ ID NO:33、SEQ ID NO:34;
Chr19:58951554-58951637对应检测引物为SEQ ID NO:36-37;
Chr19:58951672-58952006对应检测引物为SEQ ID NO:39-40;
Chr19:58951724-58951825对应检测引物为SEQ ID NO:41-42;
VWC2基因:
Chr7:49812992-49813086对应检测引物为SEQ ID NO:44-45;
Chr7:49813051-49813343对应检测引物为SEQ ID NO:47-48;
Chr7:49813066-49813161对应检测引物为SEQ ID NO:49-50;
Chr7:49813455-49813811对应检测引物为SEQ ID NO:52-53;
Chr7:49813387-49813537对应检测引物为SEQ ID NO:54-55;
Chr7:49814721-49815073对应检测引物为SEQ ID NO:57-58;
Chr7:49814765-49814936对应检测引物为SEQ ID NO:59-60;
Chr7:49815144-49815236对应检测引物为SEQ ID NO:62-63;
Chr7:49815290-49815635对应检测引物为SEQ ID NO:65-66;
Chr7:49815340-49815439对应检测引物为SEQ ID NO:67-68。
根据本发明的第四个方面,本发明提出了一种子宫内膜癌早期筛查诊断用的检测探针,用于对应检测上述标志物基因甲基化区域的甲基化状态,所述探针的核苷酸序列如下所示之一:
VSX1基因:
Chr20:25058334-25058603对应检测探针为SEQ ID NO:3;
Chr20:25061937-25062310对应检测探针为SEQ ID NO:8;
Chr20:25061874-25062088对应检测探针为SEQ ID NO:8;
Chr20:25062398-25062760对应检测探针为SEQ ID NO:11;
Chr20:25062376-25062484对应检测探针为SEQ ID NO:14;
Chr20:25062681-25062788对应检测探针为SEQ ID NO:17;
Chr20:25062655-25062739对应检测探针为SEQ ID NO:20;
Chr20:25062736-25062940对应检测探针为SEQ ID NO:25;
Chr20:25062749-25062900对应检测探针为SEQ ID NO:25;
SYT1基因:
Chr12:79258369-79258486对应检测探针为SEQ ID NO:28;
Chr12:79258392-79258498对应检测探针为SEQ ID NO:31;
ZNF132基因:
Chr19:58951204-58951524对应检测探针为SEQ ID NO:35;
Chr19:58951402-58951524对应检测探针为SEQ ID NO:35;
Chr19:58951554-58951637对应检测探针为SEQ ID NO:38;
Chr19:58951672-58952006对应检测探针为SEQ ID NO:43;
Chr19:58951724-58951825对应检测探针为SEQ ID NO:43;
VWC2基因:
Chr7:49812992-49813086对应检测探针为SEQ ID NO:46;
Chr7:49813051-49813343对应检测探针为SEQ ID NO:51;
Chr7:49813066-49813161对应检测探针为SEQ ID NO:51;
Chr7:49813455-49813811对应检测探针为SEQ ID NO:56;
Chr7:49813387-49813537对应检测探针为SEQ ID NO:56;
Chr7:49814721-49815073对应检测探针为SEQ ID NO:61;
Chr7:49814765-49814936对应检测探针为SEQ ID NO:61;
Chr7:49815144-49815236对应检测探针为SEQ ID NO:64;
Chr7:49815290-49815635对应检测探针为SEQ ID NO:69;
Chr7:49815340-49815439对应检测探针为SEQ ID NO:69。
根据本发明的第五个方面,本发明提出了一种检测目标基因甲基化的试剂在制备检测试剂盒或设备中的应用,所述的检测试剂盒或设备用于检测、筛查或诊断子宫内膜癌;所述目标基因选自如下基因中的至少一种:VSX1、SYT1、ZNF132、VWC2。
所述试剂包括特异性针对所述目标基因检测的抗体、探针、引物以及质谱检测试剂的至少之一。具体为试剂包括特异性检测目标基因的产品,该产品至少可为抗体、探针、引物以及质谱检测试剂中任一;其中,所述引物包括权利要求3所述的检测引物,同时还可为其他具有相似功能的试剂。另外,试剂盒的形式可为一些与现有产品类似的试剂盒,设备则可为一些序列检测设备。引物和探针均可选择其中任一,也可根据需要进行组合使用。
更为具体的,所述引物至少包括上述用于子宫内膜癌检测的检测引物之一。
更为具体的,所述探针至少包括上述子宫内膜癌早期筛查诊断用的检测探针之一。
进一步的,所述检测试剂盒或设备的检测样本可为任何体液和脱落细胞,及组织样本等。如包括尿液、血液等体液样本,拭子、刷片、灌洗液等脱落细胞采集样本。
根据本发明的第六个方面,本发明提出了一种用于子宫内膜癌诊断的试剂盒,其包括用于检测目标基因甲基化的试剂;所述目标基因选自如下基因中的至少一种:VSX1、SYT1、ZNF132、VWC2。
所述的试剂包括特异性针对所述目标基因检测的抗体、探针、引物以及质谱检测试剂的至少之一,其中,所述引物至少包括上述用于子宫内膜癌检测的检测引物之一。所述探针至少包括上述子宫内膜癌早期筛查诊断用的检测探针之一。
进一步的,上述的试剂可通过如下方法至少一种对所述目标基因进行甲基化水平检测:荧光定量甲基化特异性PCR、甲基化特异性PCR法、全基因组甲基化测序法、数字PCR法、亚硫酸氢盐测序法、焦磷酸测序法、甲基化特异性高分辨率溶解曲线法、甲基化特异性微阵列法、甲基化特异性高效液相层析法、甲基化敏感性限制性内切酶法或荧光定量法、简化甲基化基因组测序、基质辅助激光解吸电离飞行时间质谱等。
需要说明的是,实现基因甲基化的检测手段是本领域技术人员熟知的,例如包括但不限于上述列举的方法等,采用这些方法均可以实现目标基因的甲基化水平检测。基于此,适用于上述方法的试剂均可以制备成子宫内膜癌诊断的试剂盒。
进一步的,所述试剂盒中,还包括内参基因的引物对和探针,所述内参基因为ACTB基因,所述内参基因的引物对的核苷酸序列如下所示,探针的核苷酸序列如下所示:
正向引物:5’-TGGTGATGGAGGAGGTTTAGTAAGT-3’(SEQ ID NO:70)
反向引物:5’-AACCAATAAAACCTACTCCTCCCTTAA-3’(SEQ ID NO:71)
探针:5’-ACCACCACCCAACACACAATAACAAACACA-3’(SEQ ID NO:72)。
进一步的,上述的目标区域和内参基因特异的探针5’端报告荧光基团为FAM、VIC、HEX、NED、ROX、Red、TET、Texas、JOE、TAMRA、CY3、CY5中的一种或多种;所述目标区域和内参基因特异的探针3’端淬灭荧光基团为MGB、BHQ-1、BHQ-2、BHQ-3、IBRQ、MGB-NFQ、DABCYL、ECLIPSE中的一种或多种。
进一步的,所述试剂盒中,还包括阴性质控品、阳性质控品和无模板对照。所述无模板对照为ddH
本发明还提出了上述基因标志物在制备子宫内膜癌诊断产品中的应用。
本发明还提出了上述试剂盒在制备子宫内膜癌诊断产品中的应用。
进一步的,所述的诊断产品可包括试剂盒、制剂和芯片中的任意一种。本发明的基因标志物可以用于制备各种类型的诊断产品,可以根据实际情况进行灵活选择。
本发明通过筛选获得了子宫内膜癌特异性甲基化早期筛查标志物,包括VSX1、SYT1、ZNF132、VWC2中的至少一个基因,通过检测这些基因的甲基化水平可以显著区别子宫内膜癌与非癌症个体;通过体外检测样本中任意至少一个目标基因对应的任意至少一个甲基化区域,即可实现对子宫内膜癌进行诊断。本发明的基因标志物在组织/尿液/刷片/拭子/血液/灌洗液等样本中均能较好地鉴别子宫内膜癌与非癌个体,单指标即能达到较好的检测效果,多指标联合能进一步提高检测效能。
附图说明
为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
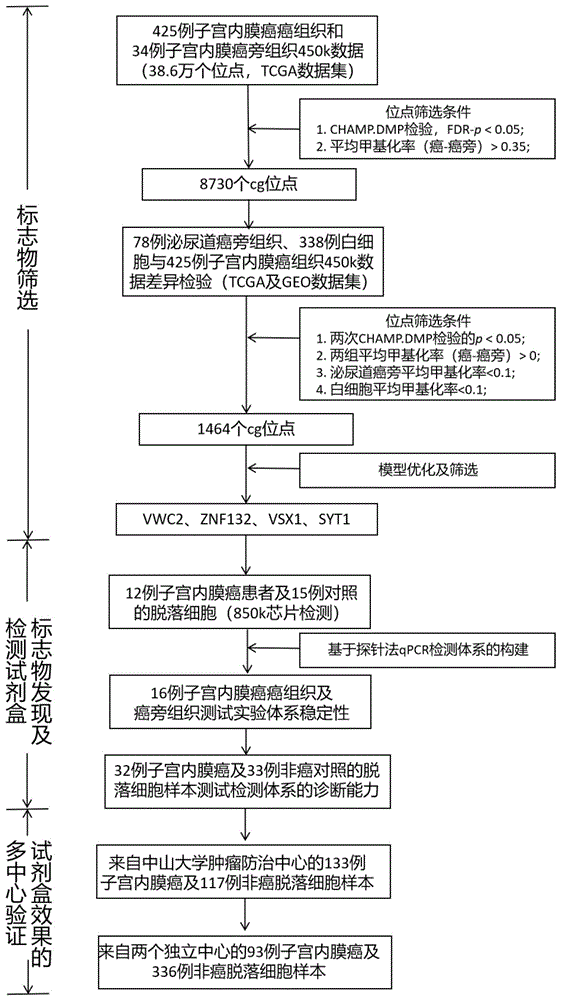
图1为本发明子宫内膜癌基因标志物筛选及体系构建的流程示意图。
图2-图3为实时荧光定量PCR扩增检测本发明基因标志物甲基化水平图。
图4为尿液样本中本发明4个基因标志物甲基化水平M-index分布图。
图5为多中心尿液样本中本发明4个基因标志物甲基化水平M-index分布图。
图6为多中心尿液样本子宫内膜癌及良性妇科疾病患者中本发明4个基因标志物甲基化水平M-index分布图。
图7为宫颈刷片样本中本发明4个基因标志物甲基化水平M-index分布图。
图8为阴道拭子样本中本发明4个基因标志物甲基化水平M-index分布图。
具体实施方式
下面结合实施例对本发明作进一步详细的描述,但本发明的实施方式不限于此。下列实施例中涉及的物料若无特殊说明均可从商业渠道获得。所述方法若无特别说明均为常规方法。
本发明利用癌症基因组图谱数据库(The Cancer GenomeAtlas,TCGA)(http://cancergenome.nih.gov/)中的子宫内膜癌450k开放数据,根据数据建模分析发现与子宫内膜癌发生有较强相关性的甲基化位点,筛选了4个基因的多个区域具有作为DNA甲基化生物标记物用以检测子宫内膜癌的潜力,包括VSX1、VWC2、ZNF132及SYT1。采用本发明的检测方法对上述甲基化位点在子宫内膜癌人群的癌组织及癌旁组织、子宫内膜癌人群(182例)及非癌症人群的尿液样本(334例)、子宫内膜癌人群及健康人群的宫颈刷片样本、子宫内膜癌人群及健康人群的阴道拭子样本进行检测。基于上述4个基因的多个区域设计的引物探针组合检测,在子宫内膜癌个体的癌组织/尿液/宫颈刷片/阴道拭子样本DNA的甲基化信号显著高于非癌症人群,说明这些甲基化位点的甲基化程度可以较灵敏及特异的反映子宫内膜癌的发生。进一步的,本发明收集的尿液样本包括一些良性妇科疾病患者(包括子宫肌瘤、卵巢巧克力囊肿、子宫息肉、子宫内膜炎等),上述位点也能将这些良性妇科疾病患者与子宫内膜癌患者区分开来,说明本发明所选甲基化位点组合在尿液DNA中与子宫内膜癌相关的信号较高,在区分子宫内膜癌及需要鉴别诊断的良性肿瘤中具有较好的效果,对子宫内膜癌的检出有优越的灵敏度。同时,采用尿液作为测试样本是非侵入的方式,可以较大程度减轻患者的负担,增加患者检测的依随性。因此,本发明的4个基因的甲基化标志物可作为子宫内膜癌早期诊断的无创检测标志物。
实施例1:子宫内膜癌的甲基化基因标志物的筛选
为筛选出可特征性区分子宫内膜癌患者与非癌群体的DNA甲基化标志物,本发明首先从TCGA公共数据库中获取子宫内膜癌的425例癌组织及34例癌旁组织的450K甲基化芯片数据,筛选在子宫内膜癌组织中显著高甲基化的位点。经数据质量控制后,有385577个甲基化位点纳入分析。进一步采用CHAMP.DMP方法进行差异位点筛选,以FDR校正后P值<0.05且癌组织平均甲基化率-癌旁组织平均甲基化率>0.35为筛选标准,共筛选出8730个差异位点。
由于尿液、宫颈刷片、阴道拭子及血液等采样方式除了采集到肿瘤来源的细胞或DNA外,不可避免地会有白细胞或泌尿道上皮细胞等成分的掺入。这些非目标的外源DNA的掺入可能作为背景信号干扰目标标志物的检出。因此,在筛选标志物时应细致处理背景信号的干扰。考虑到上述情况,本发明进一步纳入了TCGA及GEO数据库中来源于女性的78例泌尿道癌旁组织及338例白细胞450k甲基化芯片数据,分别与425例子宫内膜癌癌组织数据进行CHAMP.DMP差异检验。同时满足以下条件的位点纳入筛选范围:(1)两次差异检验FDR校正后P值<0.05且;(2)癌组织平均甲基化率-泌尿道癌旁组织平均甲基化率>0且;(3)癌组织平均甲基化率-白细胞平均甲基化率>0且;(4)泌尿道癌旁的平均甲基化率<0.1且;(5)白细胞的平均甲基化率<0.1。满足上述要求的位点与子宫内膜癌/癌旁差异筛选的差异位点取交集,共有1464个位点纳入下一步筛选过程。
为进一步评估上述1464个候选位点在实际样本中的甲基化水平情况,本发明对在中山大学肿瘤防治中心和佛山市第一人民医院采集的12例子宫内膜癌患者及15例对照的脱落细胞样本进行Illumina Epic850k芯片检测。该芯片是450K芯片的升级版,保留了大部分450K芯片位点的同时新加入了近40万个甲基化位点。最终,本发明筛选得到VSX1、SYT1、ZNF132及VWC2在内的4个基因作为子宫内膜癌诊断的检测基因。筛选流程见图1。上述基因对子宫内膜癌诊断效果最佳的甲基化位点及其效果信息见表1。
VSX1、SYT1、ZNF132及VWC2的4个基因的最佳位点的曲线下面积在0.906-0.972之间。其中,VWC2及ZNF132的AUC大于0.95,表现出优异的诊断效能;VSX1及SYT1的AUC在0.90以上,亦表现出很好的诊断效能。不同基因在检测灵敏度及特异度上展现出不同的优势,其中VWC2及ZNF132基因的特异度可达100%,VSX1基因的特异度可达91.7%。上述基因在子宫内膜癌与对照间表现出优秀的鉴别能力。此外,鉴别能力较强的位点围绕最优位点成簇出现,在最佳位点上下游500bp内,上述基因具有多个位点的AUC大于0.8,其中VWC2、ZNF132及VWC2个基因分别有8个、7个、5个及2个位点AUC高于0.8。多位点成簇出现进一步表明上述基因甲基化作为子宫内膜癌诊断标志物的确定性,并有利于甲基化位点检测方法的开发。以上结果表明,本发明选择的4个基因在子宫内膜癌和对照人群上中具有优秀的鉴别能力。
表1
备注:A为预测效果最佳甲基化位点;B为最佳位点所在位置;C为最佳位点上下游500bp内AUC>0.8的位点个数。
实施例2:子宫内膜癌检测方法体系的构建
1、检测区域的选择:用于子宫内膜癌诊断的甲基化位点所在区域序列如表2所示:
表2
注:*表示该区域的优选区域。
表2所示扩增区域的具体引物、探针位置及其检测的甲基化位点,各组引物探针覆盖7-10个甲基化位点。检测方案在探针覆盖密集甲基化位点的同时,在引物靠近3’端位置设计在高区分度甲基化位点上,进一步提升检测体系的检测精准性。
2、引物探针序列的设计与选择
针对上述四个基因区域经重亚硫酸盐处理后的序列作为模板,分析不同检测区域的扩增产物长度、退火温度、引物二聚体、发夹结构、特异性等一系列参数,设计筛选得到针对不同区域的引物探针组合,序列及其编号如表3所示。所设计的引物探针均由睿博兴科生物技术有限公司合成,“F”表示正向检测引物,“R”表示反向检测引物,“P”表示检测探针。
表3
/>
其中,上述探针序列的两端标记有修饰基团,包括5’基团及3’基团,其中5’基团选自FAM、VIC、HEX、NED、ROX、TET、JOE、TAMRA、CY3、CY5中的任一种,在本实施例中目的基因选用CY5,内参基因选用FAM。3’基团选自MGB、BHQ-1、BHQ-2、BHQ-3、IBRQ、MGB-NFQ中的任一种,在本实施例中目的基因选用BHQ-2,内参基因选用BHQ-1。
3、样本检测的试剂盒组分如下:PCR反应液:
4、样本检测:本发明所发现的甲基化标志物是子宫内膜癌特异性的标志物,可用于各类生物样本的检测,包括但不限于组织、尿液、拭子、刷片、血液等。本发明将进一步阐述其应用场景。本发明检测的是样本DNA甲基化,在检测甲基化信号前需对各类样本进行DNA提取以及对提取的DNA进行重亚硫酸盐转化操作,以便后续的荧光定量PCR检测。
4.1样本采集
4.1.1组织样本采集:在获得行全子宫及双附件切除手术患者知情同意后,取绿豆大小术后大体癌灶组织作为癌组织样本,取距离癌灶边缘3cm范围内的组织作为癌旁组织样本,取样后放入组织冻存管中冻存于-80℃冰箱;
4.1.2尿液样本采集:嘱受试者使用50mL尿杯收集晨起第一次小便的首段尿液,而后将尿液倒入预先加入Urine Conditioning Buffer(zymo,货号:D3061-1-140)的尿液收集管中,收集40-50mL体积的尿液用于检测;
4.1.3宫颈刷片样本采集:由经过统一培训过的医务人员在阴窥镜的辅助下将宫颈刷放入宫颈处,顺时针旋转5圈采集子宫颈细胞,并将宫颈刷置入已加入2mLPBS的脱落细胞收集瓶中,低温保存及运输;
4.1.4阴道拭子样本采集:由经过统一培训过的医务人员使用灭菌拭子于阴道侧壁上1/3处旋转采样,以能清晰看到分泌物附着在拭子上为准,并将附着分泌物的拭子置入已加入2mLPBS的脱落细胞收集管中,低温保存及运输。
4.2样本DNA提取
4.2.1组织/刷片/拭子样本:采用血液/细胞/组织基因组DNA提取试剂盒(天根生化(TIANGEN),货号:DP304-03)作为组织/刷片/拭子基因组DNA提取试剂进行提取。
4.2.2尿液样本:使用Quick-DNA
4.3样本DNA亚硫酸氢盐转化
DNA亚硫酸氢盐转化试剂盒购于Zymo公司,按照试剂盒说明书进行,对提取好的DNA进行重亚硫酸盐转化,DNA中未甲基化的胞嘧啶(C)转变为尿嘧啶(U),而甲基化的胞嘧啶(C)不变,得到转化后的bis-DNA。
4.4 Bis-DNA进行荧光定量PCR扩增
使用表2中不同的引物探针组合,分别对对应的不同区域进行扩增检测。具体如下所示:
4.4.1配制PCR反应液和引物探针混合液:2×EpiTect MethyLight Master Mix 5μL;正向检测引物F0.3-0.5μmol;反向检测引物R 0.3-0.5μmol;检测探针P 0.1-0.3μmol;样本DNA<100ng;纯化水补足至10μL。
4.4.2加样:将配置好的混合液分装至96孔板/384孔板中,每孔8μL,然后再将Bis-DNA加入样本孔,每个样本孔上样量2μL,每个样本1个复孔。同时增设3个质控品样本:阳性质控品、阴性质控品、无模板对照(NTC),加样方法同上。
4.4.3荧光定量PCR扩增检测:使用荧光定量PCR仪ROCHE 480仪器进行样本检测,样本扩增程序设置如下:先95℃60s;然后95℃15s,55-65℃*30s(荧光信号收集),40-50个循环*;最后4℃30s(*根据具体的基因和样本类型适当调整)。
4.4.4信号收集,55-65℃时收集FAM及CY5信号。
5、检测结果判读
5.1检测体系评估:阳性质控品有正常扩增曲线,阴性质控品和无模板对照样本无扩增曲线则认为本次检测结果有效。
5.2样本检测结果评估
5.2.1内标通道有S型扩增曲线且Ct值≤30为结果有效;
5.2.2未扩增Ct值赋值为50。
5.2.34个基因的甲基化水平用M-index=2^(-ΔCt)值表示:
M-index(VSX1)=2^(Ct(ACTB)-Ct(VSX1));
M-index(SYT1)=2^(Ct(ACTB)-Ct(SYT1));
M-index(ZNF132)=2^(Ct(ACTB)-Ct(ZNF132));
M-index(VWC2)=2^(Ct(ACTB)-Ct(VWC2))。
6、检测体系评估
为评价每次检测反应板的结果稳定性,该试剂盒通过人工合成对应扩增产物完全甲基化的序列,构建从10
7、检测效果评价
经过PCR检测后,可以得到每个样本的ACTB、VSX1、VWC2、ZNF132、SYT1基因甲基化位点的Ct值,无扩增的Ct值定为50,通过上述公式计算得到每个样本目标基因的M-index。在不同样本类型(组织/尿液/刷片/拭子)中,将上述检测的4个甲基化位点的M-index依次构建病例对照Logistic模型,由拟合方程计算每个样本的子宫内膜癌风险得分及判断子宫内膜癌发生的阈值,根据样本的得分与阈值相比较,将样本划分为子宫内膜癌阳性组及阴性组。将基于M-index的Logistic模型的分组与样本临床病理分组进行比较,得到用于判别甲基化程度模型诊断性能的ROC曲线,由ROC曲线计算曲线下面积AUC、灵敏度及特异度。根据AUC/灵敏度/特异度指标即能判断本发明试剂的检测效能。
实施例3:引物探针组合对组织样本的检测
为进一步优选实施例2中的引物探针组合,由临床医生从内膜癌患者术后大体标本取8对癌灶组织和癌旁组织用于检测。将组织标本按照实施例2所述的方法进行提取转化检测后,得到各样本不同基因的M-index(即,2^(-ΔCt)),检测结果如图2-图3所示。由图可见,与癌旁组织相比,子宫内膜癌患者的癌组织样本中VSX1、SYT1、ZNF132、VWC2基因检测位点甲基化水平均显著高于癌旁,差异显著。
实施例4:引物探针组合对脱落细胞样本的检测
本实施例采集32例子宫内膜癌及33例非癌对照的脱落细胞样本进行检测。结果发现,各引物探针组合在区分子宫内膜癌及对照人群的AUC均大于0.7,表现出较优的诊断效果,结果见表4。其中,VSX1_4_2、VSX1_5_2、VWC2_2_2、VWC2_4_2、VWC2_5_1、VWC2_6_2、ZNF132_1_1、ZNF132_2_1、ZNF132_3_2及SYT1_1_2等检测区域的AUC可达0.8以上,证明上述基因的多个区域都具备作为子宫内膜癌诊断标志物的诊断价值。
表4
综合考虑AUC、灵敏度及特异度等评价指标,选择了VSX1_4_2(Chr20:25062655-25062739)、VWC2_5_1(Chr7:49815144-49815236)、ZNF132_2_1(Chr19:58951554-58951637)、SYT1_1_2(Chr12:79258392-79258498)分别作为以上4个基因的代表性区域用于尿液样本的测试。
实施例5:检测尿液样本
在中山大学肿瘤防治中心收集尿液样本共计133例,其中包括子宫内膜癌组织病理确诊患者术前尿液样本65例、良性妇科疾病患者术前尿液样本16例(包括子宫肌瘤、卵巢巧克力囊肿)、健康志愿者(近一年来体检未见异常)尿液样本52例。根据样本对象是否患有内膜癌将尿液样本分为病例组(65例内膜癌患者)及对照组(68例良性妇科疾病患者和健康志愿者)。将尿液样本按照实施例2所述的方法进行提取转化检测后,得到各样本不同基因的M-index,检测结果如图4所示散点图,本发明所发现基因位点在尿液样本中也能达到区分病例组和对照组的效果,病例组的甲基化水平明显高于对照组的甲基化水平。进一步的,根据实施例2所述的检测效果评价方法进行建模分析,分析结果如下所述。
通过进一步的建模分析,得到单基因甲基化位点模型的检测效果如下表所示。
表5
如表所示,本发明所构建检测方法在尿液样本中对病例组和对照组有很好的鉴别能力,单基因指标建模后的AUC均在0.8以上,单基因指标中综合鉴别能力最强的是VSX1基因,其AUC为0.858,在灵敏度为81.5%时,相应的特异度达77.9%。不同基因表现出不同的区分优势,VSX1基因的甲基化位点具有较高的灵敏度,其最佳截断值下对应的灵敏度高达81.5%,表示其能识别更多的患癌病例;而VWC2基因的甲基化位点具有较高的特异度,其最佳截断值下对应的灵敏度高达98.5%,能识别较多的非癌患者。进一步的,将四个基因的甲基化指标进行二/三/四指标联合检测分析,可以得到如表6所示结果。
表6
由上表可知,在中山大学肿瘤防治中心所收集的133例尿液样本中,联合2-4个基因甲基化指标所构建模型对子宫内膜癌病例和对照的判别能力有了进一步的提升,多指标联合后模型的AUC可高达0.932(联合VSX1+VWC2+SYT1指标)。仅两指标联合时,VSX1及VWC2组合的AUC可达0.928,其灵敏度为84.6%,特异度为88.2%。VWC2及SYT1两指标联合的模型灵敏度可达89.2%;VWC2及ZNF132两指标联合的模型其特异度可高达98.5%。以上结果表明,各指标之间具有一定的互补效果,多指标联合可将各指标的优势互补,多指标联合模型的性能优于单指标模型。
实施例6:收集多中心尿液样本进行检测
为评估本发明所构建方法对于尿液样本检测的性能稳定性,进一步的,在其他中心:广州医科大学附属肿瘤医院、佛山市第一人民医院收集子宫内膜癌患者与非癌个体共计336例尿液样本进行检测,其中子宫内膜癌患者样本93例(病例组)、非癌患者样本243例(对照组)。具体检测方法同实施例2,检测后得到各样本不同基因的M-index,检测结果如图5所示散点图,本发明所发现基因甲基化指标在多中心收集的尿液样本中也能达到区分病例组和对照组的效果,病例组的甲基化水平明显高于对照组的甲基化水平。进一步的,根据实施例2所述的检测效果评价方法进行建模分析,分析结果如下所述。
如表7所示,本发明所构建检测方法在多中心收集的尿液样本中对病例组和对照组仍有很好的鉴别能力,单基因指标建模后的AUC在0.779-0.879之间,不同基因表现出不同的区分优势,在多中心收集的尿液样本中ZNF132指标具有较好的鉴别能力,其AUC为0.879,在特异度为94.7%时对应的灵敏度为64.5%。VSX1基因的甲基化指标仍然具有较高的灵敏度,其特异度为78.6%时对应的灵敏度高达81.7%,表示其能识别更多的患癌病例。综上,本发明发现的甲基化标志物单指标在多中心收集的尿液样本里依然有很好的检测效果。进一步的,将四个基因的甲基化指标进行二/三/四指标联合分析,得到如下表8所示结果。
表7
表8
由上表可知,在多中心所收集的336例尿液样本中,联合2-4个基因甲基化指标所构建模型对子宫内膜癌病例和对照的判别能力有所提升,多指标联合后模型的AUC除VWC2+SYT1模型组合外,其余均在0.8以上,最高的AUC达0.893,为VSX1+ZNF132+SYT1三指标联合模型,该模型在灵敏度为80.6%时对应的特异度为79.8%。以上结果表明,在多中心收集的尿液样本中,以上各指标之间具有一定的互补效果,多指标联合可进一步提高子宫内膜癌的检测效能。
实施例7:子宫内膜癌与良性疾病的鉴别
在实际临床工作中,子宫内膜癌患者早期通常会有异常阴道流血的症状,但该症状并不特异,在育龄期及绝经期妇女中大部分良性妇科疾病患者也存在异常阴道流血的症状。因此,本发明进一步的,评估该检测方法在子宫内膜癌患者及良性妇科疾病患者中的鉴别能力。通过将多中心的158例子宫内膜癌患者尿液样本定义为病例组,236例良性妇科疾病患者尿液样本定义为对照组,良性妇科疾病具体情况:13例子宫内膜增生;60例妇科炎症(包括宫颈炎,子宫内膜炎);103例子宫息肉;32例子宫肌瘤;28例其他(包括不孕不育、盆腔炎等)。
具体检测方法同实施例2,检测后得到各样本不同基因的M-index,检测结果如图6所示散点图,本发明所发现基因甲基化指标在内膜癌患者和良性妇科疾病具有明显差异,病例组的甲基化水平明显高于对照组的甲基化水平。进一步的,根据实施例2所述的检测效果评价方法进行建模分析,分析结果如下所述。
如表9所示,本发明所构建检测方法在多中心收集的尿液样本中对子宫内膜癌患者和良性疾病患者有很好的鉴别能力,单基因指标模型的AUC在0.831-0.916之间,VSX1指标具有较好的鉴别内膜癌患者与良性妇科疾病患者的能力,其AUC为0.916,在特异度为82.2%时对应的灵敏度为88.0%。VWC2基因的甲基化指标仍然具有较高的特异度,其特异度为97.5%时对应的灵敏度达63.9%,AUC为0.831。综上,本发明发现的甲基化标志物单指标在多中心收集的尿液样本里能很好的鉴别子宫内膜癌患者与其他良性妇科疾病患者。进一步的,将四个基因的甲基化指标进行二/三/四指标联合分析,得到如下表10所示结果。
表9
表10
由上表所示,在多中心所收集的394例尿液样本中,联合2-4个基因甲基化指标所构建模型对子宫内膜癌病例和良性妇科疾病的判别能力有所提升,多指标联合后模型的AUC最高可达0.927,在VSX1+ZNF132两指标联合模型和VSX1+ZNF132+SYT1三指标联合模型中AUC均为0.927,相应的在特异度为90.7%时对应的特异度为81.0%。以上结果表明,在多中心收集的尿液样本中,以上各指标之间具有一定的互补效果,多指标联合可进一步提高子宫内膜癌与良性妇科疾病的鉴别检测效能。
综上所述,通过在本中心收集尿液样本进行检测评估,并进一步收集多中心尿液样本扩大样本检测,均体现了本发明所保护的基因甲基化指标优越的检测性能,各指标各有优势,并且多指标联合能实现优势互补,进一步提高检测性能。此外,还进一步分析本发明在尿液样本中对子宫内膜癌与良性妇科疾病患者的鉴别能力,本发明在鉴别诊断方面也有较好的性能优势。以上均证明本发明所发现基因甲基化标志物在尿液样本即可对子宫内膜癌的检测具有很高的准确性。
实施例8:检测宫颈刷片样本
进一步的,为评估本发明所发现的基因甲基化标志物在宫颈刷片样本中的检测效能,从佛山市第一人民医院收集17例经组织病理确诊的子宫内膜癌患者及14例健康志愿者的宫颈刷片样本,样本采集如实施例2所述。通过将17例子宫内膜癌患者刷片样本定义为病例组,14例健康志愿者刷片样本定义为对照组。具体检测方法如实施例2所述,检测后得到各样本不同基因的M-index,检测结果如图7所示散点图,在刷片样本中,本发明所发现基因甲基化指标在内膜癌患者和健康志愿者中具有明显差异,病例组的甲基化水平明显高于对照组的甲基化水平。进一步的,根据实施例2所述的检测效果评价方法进行建模分析,分析结果如下所述。如表所示,本发明所构建检测方法在刷片样本中对子宫内膜癌患者和健康志愿者有很好的鉴别能力,单基因指标模型的AUC在0.718-0.891之间,ZNF132指标具有较好的鉴别能力,其AUC为0.891,在特异度为92.9%时对应的灵敏度为76.5%。VWC2基因的检测效果仅次于ZNF132基因,其AUC为0.882,特异度为85.7%时对应的灵敏度达88.2%。SYT1具有较高的特异度,为92.9%。
表11
进一步的,将四个基因的甲基化指标进行二/三/四指标联合分析,得到如下表所示结果。
表12
由上表可知,在31例刷片样本中,联合2-4个基因甲基化指标所构建模型对子宫内膜癌病例和对照的判别能力有了进一步的提升,多指标联合后模型的AUC可高达0.916(联合VWC2+ZNF132+SYT1指标),该模型特异度为100%时对应的灵敏度为76.5%,以上结果表明,在刷片样本中各指标之间也具有一定的互补效果,多指标联合可将各指标的优势互补,多指标联合模型的性能优于单指标模型。
实施例9:检测阴道拭子样本
如实施例8所述,同期在实施例8中采集宫颈刷片的人群中采集阴道拭子样本,样本采集及处理如实施例2所述。通过将17例子宫内膜癌患者拭子样本定义为病例组,14例健康志愿者拭子样本定义为对照组。具体检测方法如实施例2所述,检测后得到各样本不同基因的M-index,检测结果如图8所示散点图,在拭子样本中,本发明所发现基因甲基化指标在内膜癌患者和健康志愿者中具有明显差异,病例组的甲基化水平明显高于对照组的甲基化水平。进一步的,根据实施例2所述的检测效果评价方法进行建模分析,分析结果如下所述。如表13所示,本发明所构建检测方法在拭子样本中对子宫内膜癌患者和健康志愿者有很好的鉴别能力,单基因指标模型的AUC在0.769-0.853之间,ZNF132指标具有较好的鉴别能力,其AUC为0.853,在特异度为100%时对应的灵敏度为64.7%。VWC2基因的检测效果仅次于ZNF132基因,其AUC为0.849,特异度为100%时对应的灵敏度达64.7%。进一步的,将四个基因的甲基化指标进行二/三/四指标联合分析,可以得到如下表14所示结果。
表13
表14
由上表可知,在31例拭子样本中,联合2-4个基因甲基化指标所构建模型对子宫内膜癌病例和对照的判别能力有了较大的提升,多指标联合后模型的AUC可高达0.966(联合VSX1+ZNF132+SYT1指标及四指标联合),该模型特异度为100%时对应的灵敏度为88.2%。以上结果表明,在拭子样本中各指标之间也具有一定的互补效果,多指标联合可将各指标的优势互补,多指标联合模型的性能优于单指标模型。
综上所述,本发明所发现基因甲基化标志物在组织/尿液/刷片/拭子样本中均能较好地鉴别子宫内膜癌与非癌个体,单指标即能达到较好的检测效果,多指标联合能进一步提供检测效能。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 用于检测PIK3CD基因E1021K位点突变的探针和引物组合及试剂盒
- 一种用于检测多靶点基因突变、甲基化修饰和/或羟甲基化修饰的检测探针、方法和试剂盒
- 一种基于BTNAA体系检测犬瘟热病毒的引物对、引物和探针组合物、试剂及试剂盒
- 一种基于BTNAA体系检测犬细小病毒的引物对、引物和探针组合物、试剂及试剂盒
- 一种转基因玉米MON810的RPA检测引物与探针组合、试剂盒及检测方法
- DNA甲基化标志物组合及应用、卵巢癌早期检测引物探针及试剂盒
- 早期检测子宫内膜癌的甲基化基因标志物组合、多重PCR检测试剂盒及其应用
