一种新型冠状病毒中和活性纳米抗体
文献发布时间:2023-06-19 19:28:50
技术领域
本发明属于生物技术领域,具体涉及一种新型冠状病毒中和活性纳米抗体。
背景技术
导致新冠感染的病毒是新型冠状病毒(SARS-CoV-2),这是一种有包膜的正链RNA新型冠状病毒,能够编码尖峰(S)、包膜(E)、膜(M)和核衣壳(N)结构蛋白、16种非结构蛋白和5-8种辅助蛋白。病毒表面的S蛋白由1273个氨基酸组成,上面有一个弗林蛋白酶切割位点,弗林蛋白酶能够通过这个切割位点将S 蛋白切割成S1和S2两个亚单位。S1亚单位具有高度免疫原性,包含两个功能域,即受体结合域(RBD)和N末端域(NTD)。S1的结构域覆盖了S蛋白的上部,RBD位于尖端。RBD是病毒与靶细胞受体ACE2结合的重要位点,主要处于受体结合位点不可接近的“向下”构象,但它可以随机翻转,像铰链一样运动,短时转为“向上”构象时能够呈现ACE2受体结合位点。RBD作为抗原诱导产生的抗体具有良好的中和活性,目前已针对RBD研发了许多治疗药物、方法以及疫苗。但RBD作为中和抗体热点的同时也为病毒突变提供了大量机会。目前,出现了多种携带RBD突变的变异体,在奥密克戎毒株(B.1.1.529)上, RBD的变异位点就达到15个。这些变异体增加了新冠病毒的传播性或允许逃避抗体中和,导致大部分疫苗引发的抗体效力降低,或减弱了保护性中和抗体的效果。因此,为了对抗已经出现或即将出现的新冠变异株,急需一种针对保守表位的抗体来抵抗病毒变种,它应该能够识别S蛋白上高度保守的中和表位。
重链抗体存在于骆驼科物种中,是抗体的重链可变区,缺少常规抗体中出现的轻链和重链的第一个恒定区,所以大小通常只有12-14kDa,尺寸在纳米范围内(直径约2.5纳米,高约4纳米),也被称为纳米抗体。纳米抗体是保有常规抗体相当的抗原亲和力和特异性的最小单位,具有长于人类的互补决定区3 (CDR3),能够形成指状结构穿透到抗原表面的空腔中,使得纳米抗体能够结合传统抗体通常无法接触到的抗原表位。并且纳米抗体可以在微生物原核表达系统中大量生产,运转周期短,且通常非常稳定,可以被雾化用于直接肺部递送,是开发替代给药途径的优秀候选者。现有技术从超嗜热菌分离的4-二氧四氢喋啶合酶蛋白笼纳米颗粒(Aquifex aeolicus lumazine synthase,AaLS)(PDB ID: 1HQK)是一种开发递送、组装系统的一种具有潜力的蛋白质支架颗粒,可以作为支架来展示纳米抗体,提高纳米抗体的亲和力和中和活性。AaLS是一个由60 个相同的亚单位组成的内部中空十二面体,外径约为16纳米,内径约为8纳米,尺寸均匀、结构对称且具有热稳定性,Tm值约为120℃,并且由于AaLS中空的球形结构、良好的封装能力和呈现配体功能,AaLS的变体可以用于封装 RNA、蛋白质,也可以将小分子药物或者抗原抗体结合到AaLS的外表面从而递送到细胞中。为了把抗体连接到AaLS表面,我们改造了AaLS和纳米抗体,利用SpyCatcher003蛋白与其肽伴侣SpyTag003之间的自发形成异肽键将异质产生的抗体连接到AaLS支架上。SpyTag和SpyCatcher都可以位于蛋白质链的不同位置,在各种条件下(pH、缓冲液、温度)都能够反应。
尽管纳米抗体在生物医学研究中开辟了重要的可能性,但迄今为止,大部分的纳米抗体都是通过免疫驼类动物而获得,其研发过程漫长且昂贵,对大多数实验室来说是一个巨大的门槛。天然纳米抗体库无需免疫动物,节约时间及成本,2-3周可获得抗体序列,在筛选纳米抗体时表现出如下优势:(1)可以分离出多样性抗体单克隆;(2)可以分离出针对那些不引起机体免疫反应的弱抗原、自身抗原和具有毒性抗原的抗体;(3)可以用于多种抗原筛选而获得多种抗体产生;(4)在库容量足够大的时候可以获得高亲和力抗体。
发明内容
本发明的目的在于克服现有技术的不足,提供一种新型冠状病毒中和活性纳米抗体,本发明的纳米抗体具有分子量小、免疫原性小及稳定等特点,可以克服传统单克隆抗体无法在原核体系表达,研发周期长,生产成本高等劣势,该纳米抗体在治疗和预防新冠感染方面具有良好的发展前景。
为实现上述目的,本发明采取的技术方案为:一种新型冠状病毒中和活性纳米抗体,所述纳米抗体包括纳米抗体B1-4、纳米抗体C1-5或者纳米抗体B-B2 中的至少一种;所述纳米抗体B1-4的核苷酸序列如SEQ ID NO.1所示;所述纳米抗体C1-5的核苷酸序列如SEQID NO.2所示;所述纳米抗体B-B2的核苷酸序列如SEQ ID NO.3所示。
本发明所采用的天然纳米抗体文库共采集103只成年健康羊驼血样,血液数量为2660ml,分离的PBMC细胞数目约1.06×10
作为本发明所述的新型冠状病毒中和活性纳米抗体的优选实施方式,所述纳米抗体B1-4的氨基酸公开序列如SEQ ID NO.4所示;所述纳米抗体C1-5的氨基酸公开序列如SEQID NO.5所示;所述纳米抗体B-B2的氨基酸公开序列如 SEQ ID NO.6所示。
作为本发明所述的新型冠状病毒中和活性纳米抗体的优选实施方式,所述纳米抗体包含互补决定区;所述互补决定区由CDR1、CDR2和CDR3组成。
作为本发明所述的新型冠状病毒中和活性纳米抗体的优选实施方式,所述纳米抗体B1-4的CDR1、CDR2和CDR3氨基酸序列分别为SEQ ID NO.4自N 端第30-39位、第51-63位和第101-121位所示;所述纳米抗体C1-5的CDR1、 CDR2和CDR3氨基酸序列分别为SEQ ID NO.5自N端第30-39位、第51-63 位和第101-121位所示;所述纳米抗体B-B2的CDR1、CDR2和CDR3氨基酸序列分别为SEQ ID NO.6自N端第30-39位、第51-63位和第101-121位所示。
作为本发明所述的新型冠状病毒中和活性纳米抗体的优选实施方式,所述纳米抗体能够识别氨基酸序列如SEQ ID NO.7所示的抗原表位。本发明将提供的三株纳米抗体与AaLS纳米支架偶联后,SDS-PAGE和负染色电镜观察及证实其展示在自组装AaLS蛋白笼形结构表面。且三株纳米抗体连接到纳米支架上后均可以识别SARS-COV-2-RBD抗原结合表位。
本发明还提供一种核苷酸分子,所述核苷酸分子编码所述的纳米抗体。
本发明还提供一种含所述的核苷酸分子的重组载体质粒。本发明将所述纳米抗体基因序列插入到pET-28a(+)表达载体的NdeI和XhoI酶切位点之间,抗体序列的N端和C端都能够与pET-28a(+)载体上的6×His tag融合表达,便于纯化,获得可溶性纳米抗体片段,纯度>90%。
本发明还提供一种含有所述的重组载体质粒的宿主细胞。
本发明还提供所述的纳米抗体、所述的核苷酸分子、所述的重组载体质粒或所述的宿主细胞在制备预防或治疗新型冠状病毒感染的药物中的应用。
本发明还提供所述的纳米抗体、所述的核苷酸分子、所述的重组载体质粒或所述的宿主细胞在制备用于检测新型冠状病毒感染的试剂盒中的应用。
本发明的有益效果:提供了一种新型冠状病毒中和活性纳米抗体,本发明的三株纳米抗体B1-4、纳米抗体C1-5和纳米抗体B-B2,特异性针对 SARS-COV-2-RBD抗原,可利用原核表达系统进行大量表达,具备可溶性好、成本低及良好的生物活性。该纳米抗体针对SARS-COV-2-RBD上的一个保守表位,能够中和各种新冠变异株,具有应用于治疗和预防新冠感染的潜力。
附图说明
图1为pET-28a(+)-目的基因表达质粒载体图谱。
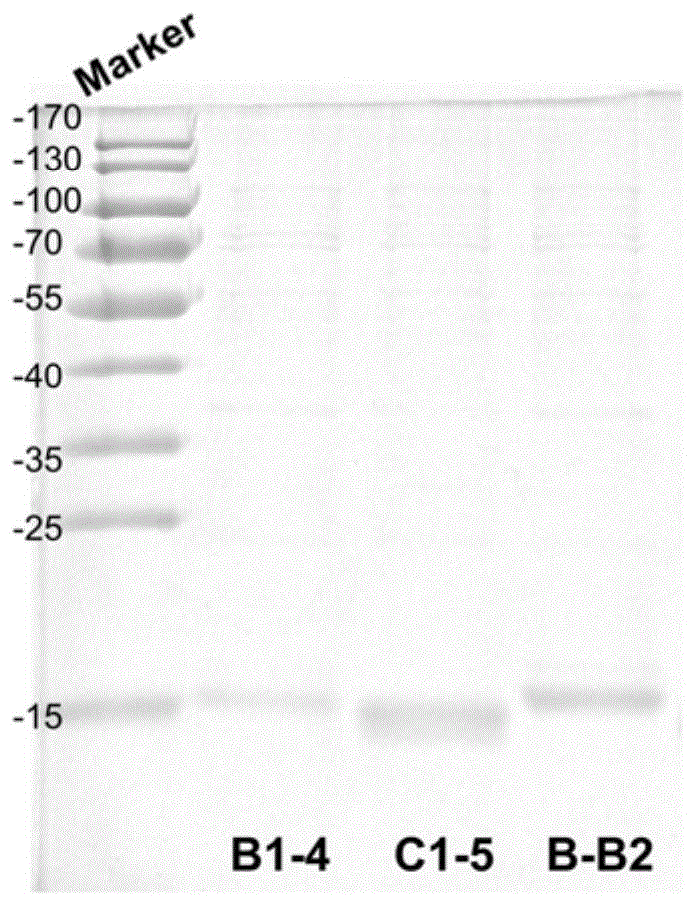
图2为纳米抗体纯化SDS-PAGE图。
图3为纳米抗体与抗原结合的活性鉴定。
图4为SPR检测纳米抗体结合动力学活性。
图5为替代中和试验检测纳米抗体中和活性。
图6为假病毒中和试验检测纳米抗体中和活性。
图7为纳米抗体与AaLS支架偶联SDS-PAGE图。
图8为纳米抗体与AaLS支架偶联负染色电镜图。
图9为纳米抗体与SARS-COV-2-RBD抗原结合的潜在抗原表位。
具体实施方式
为更好地说明本发明的目的、技术方案和优点,下面将结合具体实施例对本发明作进一步说明。
实施例1靶向SARS-COV-2-RBD蛋白纳米抗体的筛选及制备
1、纳米抗体天然噬菌体展示文库的构建
本实施例使用的天然纳米抗体文库由深圳康体生命科技有限公司提供,该天然纳米抗体文库采集103只成年健康羊驼外周血细胞(PBMC),提取总RNA,逆转录成cDNA,利用特异性引物扩增重链抗体VHH基因片段,将其连接至噬菌体质粒pADL-10b中,构建含有扩增纳米片段的噬菌体质粒库,通过多次电转化至SS320感受态细胞,在辅助噬菌体M13K07扩增、救援下,将VHH区片段展示在噬菌体表面,获得羊驼天然噬菌体文库,抗体文库容量为2×109cfu,效价为1.28×10
2、利用噬菌体展示技术淘选和富集SARS-COV-2-RBD纳米抗体
用pH为9.6的CBS包被液在免疫管中包被50μg SARS-COV-2-RBD (Arg319-Phe541)抗原,抗原菌株来源为新冠野生株,NCBI参考序列号为 YP_009724390.1(北京义翘神州科技股份有限公司提供),于4℃包被过夜。次日,弃去免疫管中未结合的抗原,用2ml PBS缓冲液室温清洗免疫管,3次,每次5min,然后用3%BSA封闭液于室温封闭2h,弃封闭液,2ml PBS缓冲液室温清洗免疫管3次,每次5min。每孔加入100μl噬菌体抗体库,室温孵育1h,弃去免疫管内未结合的噬菌体,用含0.1%Tween-20的PBS清洗免疫管20次,每次5min,加入1ml0.25mg/mL Trypsin溶液,室温洗脱30min。加入10μl 10% AEBSF终止洗脱液,收集免疫管中的溶液,即为第一轮筛选噬菌体洗脱液。将洗脱的噬菌体立即加入5ml OD600为0.5-0.6的SS320菌液中,37℃培养30min,涂布于2YT-GA(含终浓度100μg/ml AMP,2%葡萄糖)平板,37℃培养过夜。次日用涂布棒刮取过夜培养的全部菌落,取刮下的约400μl细菌转接至100ml 2×YT液体培养基中(含10μg/ml Tet和100μg/ml AMP),初始OD600为0.1, 37℃,250rpm培养至菌液生长至OD600为0.5-0.6,加入辅助噬菌体M13K07 (滴度为10
表1 SARS-COV-2-RBD三轮淘选噬菌体富集比
3、SARS-COV-2-RBD Phage-ELISA检测阳性克隆
ELISA板用pH为9.6的CBS包被1ng/μl SARS-COV-2-RBD抗原,同时平行包被BSA作对照,4℃包被过夜。挑取192个单个克隆至无菌96孔细胞板中,每孔加入200μl 2×YT液体培养基(含有100μg/ml AMP和10μg/ml Tet),37℃培养过夜,于次日取过夜菌液2μl转接至新的200μl 2×YT液体培养基(含有 100μg/ml AMP和10μg/ml Tet)96孔板中,37℃静置培养3-5h,加入辅助噬菌体M13K07,使噬菌体数:细菌个数达20:1,37℃静置培养30min,分别加入终浓度为50μg/ml KAN和0.2mM IPTG,30℃,250rpm培养过夜。于次日培养液离心后收集上清用来检测。取包被的ELISA板,每孔加入3%BSA室温封闭 1h,室温清洗酶标板3次后,实验组和对照组每孔分别加入等量单克隆上清噬菌体,室温孵育2h。每孔加入200μl PBST共洗3次,加入M13 Bacteriophage Antibody(HRP),室温1h。PBST洗5次,每孔加入TMB显色液,避光显色 2-3min,加入1M HCl终止液,用酶标仪读取OD450值,当实验孔与BSA对照比值大于10,且实验孔吸光值≥1时,判定为阳性克隆。
4、阳性克隆基因序列分析
通过phage-ELISA确定三株针对SARS-COV-2-RBD的纳米抗体,经DNA 测序分析,确定重链抗体的互补决定区(CDR),将其分别命名为“B1-4”、“C1-5”和“B-B2”。所述纳米抗体B1-4、C1-5和B-B2重链核苷酸序列分别为SEQ ID NO.1-NO.3所示,VHH区氨基酸序列分别为SEQ ID NO.4-SEQ ID NO.6所示,其中第30-39位氨基酸序列为CDR1,第51-63位氨基酸序列为CDR2,第101-121位氨基酸序列为CDR3。
实施例2 SARS-COV-2-RBD纳米抗体可溶性原核表达及纯化
1、pET-28a(+)原核表达载体质粒构建
将该株纳米抗体基因序列插入到pET-28a(+)表达载体的NdeI和XhoI酶切位点之间,纳米抗体序列的N端和C端均融合了表达载体上的6×His tag,可用于融合蛋白的纯化。pET-28a(+)-目的基因的载体图谱见图1,委托上海捷瑞生物工程有限公司合成该质粒。
2、纳米抗体可溶性原核表达
取构建成功的重组表达质粒穿刺菌均匀涂布于含LB固体平板(KAN终浓度为50μg/mL),37℃培养12-14h。挑单菌落扩大培养于含5mL的LB液体培养基的无菌试管中,250rpm、37℃条件下12-14h摇菌获取种子液;取种子菌液转接扩大培养,使初始OD600为0.1,37℃220rpm振荡培养。待菌体 OD600生长至0.6-0.8时,向菌液中加入终浓度为0.5mmol/L的IPTG诱导,18℃培养12-14h。12,000rpm 4℃离心8min弃上清,用预冷无菌PBS重悬菌体,采用超声波细胞粉碎机进行裂解,13,000rpm 4℃离心5min,分别收集上清和菌体沉淀。
3、纳米抗体Ni-NTA亲和层析柱纯化
融合蛋白亲和标签为6×His,利用上海生工公司的Ni-NTA亲和层析树脂纯化纳米抗体。取Ni柱沉淀树脂,灭菌ddH2O清洗2-3次,含10mM咪唑缓冲液平衡Ni柱,将制备的超声裂解物上清加入Ni柱中,4℃孵育1h后,使用2 倍柱体积的洗脱液(含20mM咪唑)洗去杂蛋白,最后用等体积的洗脱液(含 250mM咪唑)洗脱目的蛋白,并收集洗脱液;采用超滤浓缩管,进行样品浓缩。 15%SDS-PAGE检测蛋白纯化情况,结果如图2所示。由图2可知,本发明提供的纳米抗体可溶性好,易在原核系统表达与纯化,纯度>90%,制备成本低。
实施例3 Western Blot鉴定纳米抗体与RBD结合的抗原性
本实施例以SARS-COV-2-RBD抗原对纯化后的纳米抗体进行Western blot 验证。0.1ug SARS-COV-2-RBD抗原上样,进行15%SDS-PAGE并转膜。5%脱脂奶封闭液室温封闭1h,以纯化后纳米抗体作为一抗,用封闭液稀释至1:100,室温孵育1h后转移至4℃孵育过夜,以1:2000稀释的抗His-HRP抗体作为二抗室温孵育1h;洗膜,ECL显影,曝光,结果如图3所示。由图3可知,本发明提供的纳米抗体均能识别SARS-COV-2-RBD抗原,条带发光强烈,说明纯化获得的样品浓度和纯度都比较高。
实施例4 SPR检测纳米抗体结合RBD蛋白动力学特性
本实施例按照OpenSPRTM仪器标准操作程序安装COOH芯片。开始以最大流速(150μL/min)运行,检测缓冲液为PBS(PH7.4),达到信号基线后,上样200μL的异丙醇,运行10s排出气泡,达到基线后,使用缓冲液冲洗样本环,并用空气排空。在信号达到基线后,调整缓冲液流速到20μL/min。上样 EDC/NHS(1:1)溶液激活芯片。上样激活缓冲液稀释的200μL的SARS-COV-2-RBD运行4min,PBS冲洗样本环,并用空气排空。上样200μL Blocking溶液,PBS冲洗样本环,并用空气排空。观察基线5分钟,以确保稳定性。纳米抗体用缓冲液稀释,将所选的纳米抗体以20μL/min上样,蛋白与配体结合时间均为240s,自然解离360s。使用TraceDrawer软件计算和分析结合反应的动力学参数,One To One分析模型,结果如图4所示。结果显示,纳米抗体B1-4结合的亲和力为1.61×10
实施例5基于SARS-COV-2-RBD的替代中和实验
本实施例使用金斯瑞公司的SARS-CoV-2(新型冠状病毒)替代病毒中和检测(sVNT)试剂盒对纳米抗体的中和活性进行鉴定。按照说明书,将梯度稀释的纳米抗体与预先与HRP偶联的RBD等体积混合,本发明中使用了三种RBD 蛋白,分别为野生株、Delta株(B.1.617.2)和Omicron株(B.1.1.529)。将装有混合物的EP管在37℃孵育30分钟。然后将100μL混合物加入到预涂有 ACE2的微量滴定板上,在37℃孵育15分钟。HRP偶联的RBD蛋白与 SARS-CoV-2中和作用的纳米抗体之间发生了竞争性抑制反应。彻底洗涤后,将 TMB底物溶液加入孔中并孵育15分钟后加入等体积终止液停止反应,在450nm 分光光度法测量颜色强度,结果如图5所示。由此可见,本发明提供的纳米抗体对于三种SARS-CoV-2的RBD具有一定的阻断抑制效果。
实施例6假病毒中和试验
本实施例的SARS-CoV-2假病毒中和试验使用过表达ACE2的293T细胞 (293T-hACE2)。用完全培养基将待检测的纳米抗体稀释至100μg/ml。在细胞培养96孔板中将100μl纳米抗体与50μl 1.3×10
结果如图6所示,由图6可知,本发明提供的纳米抗体在100μg/ml浓度时,对SARS-COV-2野生株和Omicron(B.1.1.529)变异株假病毒具有抑制作用,且对野生株和Omicron(B.1.1.529)变异株的抑制率没有统计学差异。
实施例7抗体偶联到AaLS纳米支架蛋白形成多聚纳米抗体
将纳米抗体序列C端添加用柔性短肽(G4S)3连接的Spytag003(GenBank:MT945421.1),AaLS支架序列C端添加用柔性短肽(GGS)4连接的SpyCatcher003 GenBank:QGX07219.1),两种序列分别插入到pET-28a(+)表达载体上,委托上海捷瑞生物工程有限公司合成该质粒。将两种蛋白分别按实施例二的方法原核表达并纯化,按照纳米抗体:AaLS支架为2:1摩尔比进行偶联,用pH为8.5 的1M TBS缓冲液稀释抗体和支架,按摩尔比例混合后在4℃下孵育过夜, 12%SDS-PAGE分析偶联效率,并使用负染色电镜观察,结果如图7、图8所示。
SDS-PAGE图显示本发明提供的纳米抗体能够偶联到AaLS纳米支架上,蛋白条带大小符合,负染色电镜观察到纳米抗体能够偶联到AaLS纳米支架上,并且保持纳米支架的球状结构。
实施例8多肽ELISA鉴定纳米抗体与SARS-COV-2-RBD结合的潜在抗原表位
人工合成覆盖SARS-COV-2-RBD(320-553)蛋白,长度为9-30个氨基酸的17条短肽,纯度达90%以上。将以上17条多肽分别用ddH2O或DMSO溶解,然后用包被液稀释到1μg/ml作为捕获抗原包被ELISA板,以ZIKA EDIII多肽作为阴性对照,4℃孵育过夜。于次日用含3%BSA的PBST封闭液,37℃温育1h。PBST清洗3次,每次5min后,每孔加入100μg/ml的多聚纳米抗体,37℃温育1h后,PBST洗板3次,每孔加入1:2000稀释的抗His-HRP抗体,37℃孵育1小时,洗板3次;TMB室温避光反应10min,1M HCl终止反应,酶标仪读取OD450值,以检测结合的潜在表位。结果如图9所示。由此可见,本发明提供的三个纳米抗体均能和肽16反应,差异与对照组具有统计学意义,肽16可能是本发明提供的纳米抗体的潜在表位。
最后应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。
