用于防止或治疗病毒感染的组织蛋白酶抑制剂
文献发布时间:2024-04-18 19:52:40
共同研究协议各方名称
本文所述的发明是在2015年10月22日签署的葛兰素史克有限责任公司(GlaxoSmithKline LLC,GSK)与美国陆军传染病医学研究所(United States ArmyMedical Research Institute of Infectious Diseases,USAMRIID)之间的合作研究开发协议(Collaboration Research and Development Agreement,CRADA),以及在2018年12月21日签署的GSK与USAMRIID之间的合作研究开发协议(CRADA)的主题。
本发明是根据美国陆军传染病医学研究所(美国陆军医学研究与开发司令部(United States Army Medical Research and Development Command)的下属司令部)授予的W81XWH-16-0019和W81XWH-19-0083在政府的支持下完成的。政府具有本发明的某些权利。
序列表
随此提交的2021年3月26日创建的标题为PU66782WO_SEQ_LIST_ST25且大小为2KB的序列表据此以引用的方式全文并入本文。
技术领域
本发明涉及用于防止和/或治疗由病毒引起的病毒性疾病的某些组织蛋白酶抑制剂化合物、方法和药物组合物。还公开了用于制备这种化合物的方法和使用化合物的方法。特别地,公开了尤其由冠状病毒科(Coronaviridae)和丝状病毒科(Filoviridae)病毒引起的病毒性疾病的治疗和预防。
背景技术
每年病毒在世界各地造成数百万人死亡(参见例如Fact Sheets on HIV/AIDS,Hepatitis C Virus,and Influenza,World Health Organization)。由病毒感染引起的疾病是众多且多样的,引起疾病的病毒的结构、大小、基因组和感染周期也是如此;这些事实往往复杂化和割裂该领域的研究工作。病毒是通过对几种特征(包括病毒基因组的类型)进行评价来分类的。病毒基因组可由DNA或RNA组成,可以是双链或单链(其可进一步为正义、反义、或双义),并且可由于大小和基因组结构而有很大差异。
作为一个实例,埃博拉出血热是由五种不同的埃博拉病毒(Ebola viruses)中的一种引起的疾病。其中四种毒株可引起人类和动物的危重疾患。第五种赖斯顿病毒(Restonvirus)已在一些动物中引起疾患,但在人类中没有。埃博拉病毒性疾病的病死率高达90%,它是一种严重急性病毒性疾患,通常以突发的发热、极度虚弱、肌肉痛、头痛、恶心和咽喉痛为特征。这之后是呕吐、痢疾、肾脏和肝脏功能受损,并且在一些情况下内出血与外出血。实验室检查结果常常包括较低的白细胞和血小板计数以及升高的肝酶。这样的症状通常发生在初发感染后的2至21天之间。
2014年,在西非发生了埃博拉有史以来最大规模的爆发,导致超过28,000例病例,一年后才消退。参见Warren等人,Nature第531卷,第381-389页(2016)。在这次爆发期间获得埃博拉的人中有五分之二死亡。此外,显著缺乏经市场批准专门针对埃博拉病毒的药物。相反,绝大多数治疗局限于简单的姑息护理。参见Centers for Disease Control andPrevention,website,Ebola Outbreaks,2014.https://www.cdc.gov/vhf/ebola/outbreaks/2014-west-africa/。
2018年,又爆发了一次埃博拉,这次是在刚果民主共和国东部(EasternDemocratic Republic of Congo,DRC),蔓延到了乌干达(Ebola),目前仍持续存在。截至2019年7月,第二次埃博拉大爆发已导致2592例确诊病例和1743例死亡。
从2014年底到2016年,称为寨卡病毒(Zika virus)的原先休眠和/或轻型的蚊媒病毒在巴西爆发,在一年内就传播到了拉丁美洲和加勒比地区的几乎每个国家,这些地方是蚊种埃及伊蚊(Aedes aegypti)的栖息之地。寨卡病毒感染通常在受感染的人中产生轻型或无症状型疾病,但有些病例在感染寨卡病毒后导致格林-巴利综合征(一种罕见的神经障碍)的报告有所增加,并且产生持久的影响。更为麻烦的是,2015年,巴西向WHO报告称,在某些情况下,特别是在妊娠期间感染寨卡病毒的母亲分娩出的婴儿中,寨卡与隐匿和麻烦的不良后果有关。所观察到的不良后果为脑过小和严重脑部异常。到2016年初,WHO报告称,寨卡与脑过小病例和其他神经障碍之间的联系是国际关注的突发公共卫生事件(PublicHealth Emergency of International Concern),并得出的结论是,科学共识支持寨卡病毒是寨卡爆发的国家中所报告的脑过小和格林-巴利综合征障碍的病因(进一步讨论参见https://www.who.int/emergencies/zika-virus/articles/one-year-outbreak/en/index1.html)。截至2018年7月,已有86个国家报告了寨卡病毒感染,但针对该病毒或其相关联的神经疾病没有已知的治疗(https://www.who.int/news-room/fact-sheets/detail/zika-virus)。
在过去20-30年内,高度接触传染性、高度致病性冠状病毒感染的出现也导致了多重全球健康危机。2003年,出现了多国爆发的病因不明的非典型肺炎,并且称为严重急性呼吸综合征(SARS)。SARS与新的冠状病毒株有关(https://www.cdc.gov/mmwr/preview/mmwrhtml/mm5214a1.htm),并最终命名为SARS-CoV。29个国家报告称,SARS-CoV导致8,098人感染和774人死亡(https://www.cdc.gov/mmwr/preview/mmwrhtml/mm5249a2.htm)。
2012年9月,沙特阿拉伯(Saudi Arabia)报告了一例严重呼吸道疾患的患者。该疾病被确定为新的冠状病毒的严重并发症。往回追溯,据确定,首例疾病(后来命名为中东呼吸综合征(MERS))于2012年4月发生在约旦(Jordan),并且造成MERS的病毒被命名为MERS-CoV。MERS导致严重的呼吸道疾患,患者表现出发热、咳嗽和严重呼吸短促。MERS的发病率已确定接近35%,每10例MERS中有3-4例导致死亡。到2019年底,报告了2494例MERS确诊病例,有858例死亡(https://www.who.int/emergencies/mers-cov/en/),其中大多数病例和死亡报告在沙特阿拉伯。到目前为止,所有报告的MERS病例都与前往阿拉伯半岛(ArabianPeninsula)、从该地来、经过该地、或在该地或附近居住有关,尽管27个国家已报告了MERS-CoV病例。
最近,在2019年12月的最后一周,报告了另一种新的冠状病毒相关的疾病。在2020年1月30日,WHO宣布称COVID-19是国际关注的突发公共卫生事件(https://www.who.int/emergencies/diseases/novel-coronavirus-2019/events-as-they-happen)。作为产生这种新病毒性疾病的原因的冠状病毒最初被称为2019-nCoV,该疾病于2020年2月11日被世界卫生组织(World Health Organization)命名为COVID-19(https://www.who.int/emergencies/diseases/novel-coronavirus-2019/events-as-they-happen)。而且,在2020年2月11日,造成COVID-19的病毒由国际病毒分类学委员会(InternationalCommittee Taxonomy of Viruses,ICTV)正式重新命名为SARS-CoV-2(https://talk.ictvonline.org/)。在2020年3月11日,WHO宣布称COVID-19是一种大流行病(https://www.who.int/dg/speeches/detail/who-director-general-s-opening-remarks-at-the-media-briefing-on-covid-19---11-march-2020)。
自2019年12月以来,COVID-19已蔓延到190个国家,已报告超过531,000例确诊病例和超过24,000例死亡(https://experience.arcgis.com/experience/685d0ace521648f8a5beeeee1b9125cd)(截至2020年3月26日晚上11点(美国东部夏令时间)的现时数字),在范围和严重程度方面远远超过2003年的SARS-CoV冠状病毒爆发所观察到的影响,尽管死亡率为约2%的COVID-19(https://www.who.int/csr/sars/archive/2003_05_07a/en/)的致死性低于SARS或MERS(https://www.hindustantimes.com/world-news/who-warns-against-novel-coronavirus-blanket-measures/story-bbTlCTA9xwzC8fSWK4d9CN.html_)。SARS的死亡率为约15%(https://www.who.int/csr/sars/archive/2003_05_07a/en/),并且MERS的死亡率为约35%(https://www.who.int/news-room/q-a-detail/middle-east-respiratory-syndrome-coronavirus-(mers-cov))。
冠状病毒由长度为26至32kb的有包膜单链正义RNA基因组组成。它们根据系统发育相似性被分为四类:α(例如,229E和NL-63)、β(例如,SARS-CoV-2、SARS-CoV、MERS-CoV、HKU1和OC43)、γ和δ。还报道了SARS-CoV-2与SARS-CoV-1具有79%的序列同一性,然而,SARS-CoV-2基因组的某些区域表现出相对于SARS-CoV-1更大或更小程度的保守性。
冠状病毒(包括SARS-CoV-2)利用膜结合刺突(S)蛋白来结合宿主细胞表面受体ACE2,以进入细胞。三聚体S蛋白含有两个亚基S1和S2。S1亚基含有称为受体结合结构域(RBD)的片段,该片段能够结合ACE2。在进入宿主细胞后,RNA基因组被宿主核糖体机制翻译成两种较大多肽和几种较小多肽。两种较大多肽经两种蛋白酶(即冠状病毒主蛋白酶(3C样)和木瓜蛋白酶样蛋白酶)加工,以生成病毒复制和包装所需的蛋白质。
已经鉴定出SARS-CoV-2(毒株)的几种进化枝,命名为L(原始毒株)、S(以L向S的氨基酸变化-ORF8:L84S突变命名)、G(以刺突蛋白中的D向G的氨基酸变化-S:D614G突变命名)、V(以G向V的氨基酸变化-ORF3a:G251V突变命名),以及O(其它进化枝的与任何这些标准不匹配的序列)。进化枝G包含两个衍生进化枝GH(特征为ORF3a:Q57H突变)和GR(具有N:RG203KR突变)。一般来讲,进化枝G和GR在欧洲流行,而进化枝S和GH主要在美洲观察到。L进化枝主要由来自亚洲的序列代表。目前,进化枝G及其衍生后代进化枝GH和GR在序列SAR-CoV-2基因组中最为常见,在全球范围内占世界所有序列的74%。具有刺突D614G和核衣壳RG203KR突变两者的GR进化枝是世界范围内最常见的SARS-CoV-2基因组群体的代表。原始病毒株进化枝L仍继续占测序基因组的7%,而进化枝S和V在序列的全局数据集中具有相似的频率。对于SARS-CoV-2进化枝的略为不同的评估,参见Li,T.,Liu,D.,Yang,Y.等人Phylogenetic supertree reveals detailed evolution of SARS-CoV-2.Sci Rep 10,22366(2020).https://doi.org/10.1038/s41598-020-79484-8。
虽然几个团队已经确认SARS-CoV-2基因组的变异性相对较低,但尚不清楚在不同国家内观察到的不同致死率或传播速度是否与不同进化枝之间的毒力差异有关。最近在英国(201/501Y.V1/B.1.1.7)、南非(20H/501Y.V2/B.1.351)、巴西(P.1/20J/501Y.V3/B.1.1.248)出现了几种新变体,而加利福尼亚(California)的新型变体起源于cluster20C,由5种突变(ORF1a:I4205V、ORF1b:D1183Y、S:S13I;W152C;L452R)定义并且命名为CAL.20C(20C/S;452R;B.1.429)。
各种SARS-CoV-2疫苗类型目前正处于开发中,包括灭活疫苗、核酸疫苗、基于腺病毒的载体疫苗和重组亚单位疫苗。大多数疫苗包含或者编码S蛋白的一部分或全部。然而,非常令人关注的是,这些疫苗可能无法针对新出现的SARS-CoV-2变体(包括S蛋白中的突变)提供足够的防护。
减少SARS-CoV-2的病毒进入和复制的替代药剂将具有减少病毒感染程度的潜能,并可在这种快速演变的大流行中提供益处。
因此,本领域持续需要治疗或防止某些病毒性疾病的安全有效的药物,这些病毒性疾病包括但不限于由冠状病毒、埃博拉病毒、登革病毒(Dengue virus)和蚊媒病毒如寨卡(ZIKV)和西尼罗病毒(West Nile virus)引起的疾病。
组织蛋白酶在动物(包括人类)中的蛋白质降解的正常生理过程中(例如在结缔组织的降解中)发挥作用。然而,体内这些酶水平的升高可导致造成疾病的病理状况。特别地,一种组织蛋白酶K抑制剂已被报道治疗某些寄生虫病和/或骨或软骨退变。参见PCT公开的专利申请WO 2001070232和PCT公开的专利申请WO2002017924,以及Wang等人,Tetrahedron,65:32(2009)。组织蛋白酶K以不同的名称在文献中表示为组织蛋白酶O或组织蛋白酶02。然而,名称“组织蛋白酶K”被认为是最合适的一种。因此,组织蛋白酶被牵涉为各种疾病状态的致病因子。
组织蛋白酶L也称为组织蛋白酶L1,由CTSL1基因编码。它是造成蛋白质降解的溶酶体半胱氨酸蛋白酶,并且参与多种细胞过程,包括骨退变和血管生成。它还具有在MHC II类抗原呈递期间降解抗原肽的作用。如果存在于细胞外,已知其降解细胞外基质,包括胶原蛋白和弹性蛋白。也有报道称其参与病毒蛋白(包括埃博拉病毒的那些)的断裂和成熟。
组织蛋白酶B是由CTSB基因编码的溶酶体半胱氨酸蛋白酶。组织蛋白酶B对于细胞内和细胞外蛋白水解均很重要,并且与多种多样的疾患相关联,包括骨退变、癌症和阿尔茨海默病。
许多病毒劫持宿主细胞机制,以允许感染、复制和传播。已知称为组织蛋白酶的人半胱氨酸蛋白酶家族的成员负责活化来自数种病毒的蛋白质(Zhou等人,Proteaseinhibitors targeting coronavirus and filovirus entry,Antiviral Research,2015)。例如,宿主组织蛋白酶能够断裂和活化埃博拉病毒糖蛋白(K Schornburg等人,JVirol(2006)80,4174)和SARS冠状病毒刺突蛋白(B Bosch等人,J Virol(2008)82,8887)。最近,据报道,分解代谢途径的可能双重功能有可能在被寨卡病毒感染的宿主中起作用:自噬与先天免疫之间的协作,以及自噬对先天免疫的抑制(Shoji-Kawat等人Int.Immunopharmaco.l,2014;18:55-65)。因此,对自噬的晚期阶段(通过溶酶体酶来降解自噬体内容物)抑制的化合物可能是针对病毒(如寨卡病毒(ZIKV)和登革病毒)的有效药剂,包括可能通过直接结合至酶来抑制溶酶体组织蛋白酶B的活性的化合物(Gratton等人,Int.J.Mol.Sci,2019年3月;20(5):1048以及Balasubramian等人,Antiviral Res.2017;第137卷;第141-159页)。据报道,组织蛋白酶B参与病毒蛋白(包括埃博拉病毒的那些)的断裂和成熟。此外,已知SARS-CoV经由其刺突(S)糖蛋白来介导受体结合并进入细胞,并且该过程被组织蛋白酶L抑制剂抑制(Simmons,G.等人“Inhibitors of cathepsin L preventsevere acute respiratory syndrome coronavirus entry”PNAS,2005年8月16日,102(33)11876-11881;https://doi.org/10.1073/pnas.0505577102)。需要鉴定出可调节这些过程并干扰病毒复制周期,从而减少疾病的症状的抑制剂。
发明内容
本发明的一个目的是提供一种用于在受试者中治疗或预防由病毒引起的病毒性疾病的方法,该方法包括向有此需要的受试者给药治疗有效量的半胱氨酸蛋白酶的抑制剂,甚至更特别地给药治疗有效量的木瓜蛋白酶超家族半胱氨酸蛋白酶的抑制剂,还更特别地给药治疗有效量的组织蛋白酶家族的半胱氨酸蛋白酶的抑制剂。Relacatib(SB-462795)是有效的和口服生物可利用的组织蛋白酶K的小分子抑制剂,它在体外人组织和体内食蟹猴(cynomolgus monkeys)中均抑制骨吸收。SB-462795是人组织蛋白酶K、L和V的有效抑制剂(分别地Kiapp(表观抑制常数)=41、68和53pM),其表现出相对于其它组织蛋白酶而言39-300倍的选择性(参见S.Kumar等人,Bone(2007),第40卷(1),第122-131页)Epub2006年9月7日)。Relacatib(SB-462795)也是组织蛋白酶B(Cat B)的有效抑制剂,对于人类、猴和大鼠Cat B,K
本发明的一个方面提供了一种用于在有此需要的受试者中治疗或预防由病毒引起的病毒性疾病的方法,该方法包括向受试者给药治疗有效量的以下结构的化合物:
或其药学上可接受的盐,
其中:
X选自N或CR
R
本发明的一个方面提供了一种用于在有此需要的受试者中治疗或预防由病毒引起的病毒性疾病的方法,该方法包括向受试者给药治疗有效量的以下结构的化合物:
或其药学上可接受的盐。
本发明的一个特定方面提供了一种用于在有此需要的受试者中治疗或预防由病毒引起的病毒性疾病的方法,该方法包括向受试者给药治疗有效量的以下结构的化合物,其中该化合物是:
或其药学上可接受的盐。
本发明的一个方面提供了一种用于抗病毒疗法的以下结构的化合物:
或其药学上可接受的盐,
其中:
X选自N或CR
R
本发明的一个方面提供了一种用于抗病毒疗法的化合物,该化合物是
或其药学上可接受的盐。
本发明的一个方面提供了一种用于抗病毒疗法的与第二抗病毒化合物组合的第一抗病毒化合物,该第一抗病毒化合物是
或其药学上可接受的盐。
本发明的一个方面提供了一种用于在动物中治疗或预防由病毒引起的病毒性疾病的以下结构的化合物:
或其药学上可接受的盐,其中病毒是脊髓灰质炎病毒(poliovirus)、鼻病毒(rhinovirus)、柯萨奇病毒(coxsackievirus)、口蹄疫病毒(foot-and-mouth virus)(FMDV)、流感病毒(influenza virus)(甲型流感病毒(influenza Avirus)、乙型流感病毒(influenza B virus)、丙型流感病毒(influenza C virus)、禽流感病毒(avianinfluenza virus))、黄病毒(flavivirus)、肝炎病毒(hepatitis virus)(甲型肝炎病毒(hepatitis Avirus)、乙型肝炎病毒(hepatitis B virus)、丙型肝炎病毒(hepatitis Cvirus)、丁型肝炎病毒(hepatitis D virus)、戊型肝炎病毒(hepatitis Evirus))、冠状病毒(coronavirus)(CoV-SARS病毒、造成中东呼吸综合征(MERS)的冠状病毒、CoV-SARS-2)、埃博拉病毒(Ebola virus)、马尔堡病毒(Marburg virus)、尼帕病毒(Nipah virus)(NiV)、亨德拉病毒(Hendra virus)、沙粒病毒(arenavirus)、裂谷热病毒(Rift Valley Fevervirus)、黄热病毒(yellow fever virus)、呼吸道合胞病毒(respiratory syncytialvirus)(RSV)、西尼罗病毒(West Nile virus)、登革热病毒(Dengue fever virus)、爱知病毒(Aichi virus)、肠道病毒(enterovirus)、风疹病毒(rubella virus)、泰勒氏鼠脑脊髓炎病毒(Theiler’smurine encephalomyelitis virus)(TMEV)、埃可病毒(echovirus)、或人类免疫缺陷病毒(human immunodeficiency virus)(HIV)。
本发明的一个方面提供了一种用于治疗或防止COVID-19的化合物,该化合物是:
N-((2S)-4-甲基-1-(((4S,7R)-7-甲基-3-氧代-1-(吡啶-2-基磺酰基)氮杂环庚烷-4-基)氨基)-1-氧代戊-2-基)苯并呋喃-2-甲酰胺;
3-甲基-N-((S)-4-甲基-1-(((4S,7R)-7-甲基-3-氧代-1-(吡啶-2-基磺酰基)氮杂环庚烷-4-基)氨基)-1-氧代戊-2-基)呋喃并[3,2-b]吡啶-2-甲酰胺,
或其药学上可接受的盐。
在一个实施方案中,提供了化合物用于在受试者(例如人类)中治疗或防止COVID-19的用途,该化合物是:
N-((2S)-4-甲基-1-(((4S,7R)-7-甲基-3-氧代-1-(吡啶-2-基磺酰基)氮杂环庚烷-4-基)氨基)-1-氧代戊-2-基)苯并呋喃-2-甲酰胺;
3-甲基-N-((S)-4-甲基-1-(((4S,7R)-7-甲基-3-氧代-1-(吡啶-2-基磺酰基)氮杂环庚烷-4-基)氨基)-1-氧代戊-2-基)呋喃并[3,2-b]吡啶-2-甲酰胺,
或其药学上可接受的盐。
在一个实施方案中,受试者感染有SARS-CoV-2。
本发明还提供了一种用治疗有效量的选自以下的化合物治疗患有COVID-19的受试者的方法:
N-((2S)-4-甲基-1-(((4S,7R)-7-甲基-3-氧代-1-(吡啶-2-基磺酰基)氮杂环庚烷-4-基)氨基)-1-氧代戊-2-基)苯并呋喃-2-甲酰胺;
3-甲基-N-((S)-4-甲基-1-(((4S,7R)-7-甲基-3-氧代-1-(吡啶-2-基磺酰基)氮杂环庚烷-4-基)氨基)-1-氧代戊-2-基)呋喃并[3,2-b]吡啶-2-甲酰胺,
或其药学上可接受的盐。
在一个实施方案中,受试者是人类。
此外,本发明提供了一种根据本文所述的方法鉴定待治疗的受试者的方法,该方法包括测定来自受试者的标本中SARS-CoV-2RNA的存在的步骤。在一些实施方案中,该方法能够鉴定L毒株SARS-CoV-2RNA、S毒株SARS-CoV-2RNA、G毒株SARS-CoV-2RNA、GH毒株SARS-CoV-2RNA、GR毒株SARS-CoV-2RNA、V毒株SARS-CoV-2RNA、或O毒株SARS-CoV-2RNA。在检测SARS-CoV-2RNA的一些实施方案中,该方法还可包括如本文所述的治疗步骤。
在具体的实施方案中,本发明提供了对患有COVID-19的特定患者群体的治疗,例如感染有SARS-CoV-2的患者或受试者(即,对SARS-Co-2测试呈阳性的患者或受试者)、高风险类别的患者或受试者,以及患有继发性病症的患者或受试者。在具体实施方案中,患者或受试者患有肺炎或急性呼吸窘迫障碍。在额外的实施方案中,患者或受试者额外经历体外膜氧合、机械通气、无创通气、接受氧气治疗或接受抗病毒或类固醇治疗。
在一个实施方案中,本文所述的用途和方法用于治疗感染有选自以下的SARS-CoV-2的毒株(进化枝)的患者:SARS-CoV-2的L毒株(进化枝)、S毒株(进化枝)、G毒株(进化枝)、GH毒株(进化枝)、GR毒株(进化枝)、V毒株(进化枝)或O毒株(进化枝)。
在一个实施方案中,本文所述的用途和方法用于治疗感染有SARS-CoV-2的L毒株(进化枝)或其变体的患者。在另一个实施方案中,本文所述的用途和方法用于治疗感染有SARS-CoV-2的S毒株(进化枝)或其变体的患者。在另一个实施方案中,本文所述的用途和方法用于治疗感染有SARS-CoV-2的G毒株(进化枝)或其变体的患者。
在另一个实施方案中,本文所述的用途和方法用于治疗感染有SARS-CoV-2的GH毒株(进化枝)或其变体的患者。在另一个实施方案中,本文所述的用途和方法用于治疗感染有SARS-CoV-2的GR毒株(进化枝)或其变体的患者。在另一个实施方案中,本文所述的用途和方法用于治疗感染有SARS-CoV-2的V毒株(进化枝)或其变体的患者。在另一个实施方案中,本文所述的用途和方法用于治疗感染有SARS-CoV-2的O毒株(进化枝)或其变体的患者。在一个具体实施方案中,本文所述的用途和方法用于治疗感染有SARS-CoV-2的变体的受试者,包括UK变体(201/501Y.V1/B.1.1.7)、南非变体(20H/501Y.V2/B.1.351)、巴西变体(P.1/20J/501Y.V3/B.1.1.248)和新型加利福尼亚变体,该新型加利福尼亚变体起源于cluster 20C,由5种突变(ORF1a:I4205V、ORF1b:D1183Y、S:S13I;W152C;L452R)定义并且命名为CAL.20C(20C/S;452R;B.1.429)。
在另一个实施方案中,受试者未被SARS-CoV-2感染,使得用途在于防止COVID-19。适用于这种预防用途的受试者包括高风险类别的受试者、卫生保健专业人员以及感染有SARS-CoV-2的受试者的密切接触者。
本发明的一个方面提供了具有以下结构的化合物或其药学上可接受的盐在制造用于治疗由病毒引起的病毒性疾病的药物中的用途,
或其药学上可接受的盐,其中病毒是脊髓灰质炎病毒、鼻病毒、柯萨奇病毒、口蹄疫病毒(FMDV)、流感病毒(甲型流感病毒、乙型流感病毒、丙型流感病毒、禽流感病毒)、黄病毒、肝炎病毒(甲型肝炎病毒、乙型肝炎病毒、丙型肝炎病毒、丁型肝炎病毒、戊型肝炎病毒)、冠状病毒(SARS-CoV、SARS-CoV-2、造成中东呼吸综合征(MERS)病毒的冠状病毒)、埃博拉病毒、马尔堡病毒、尼帕病毒(NiV)、亨德拉病毒、沙粒病毒、裂谷热病毒、黄热病毒、呼吸道合胞病毒(RSV)、西尼罗病毒、登革热病毒、爱知病毒、肠道病毒、风疹病毒、泰勒氏鼠脑脊髓炎病毒(TMEV)、埃可病毒、或人类免疫缺陷病毒(HIV)。
还提供了一种用于在受试者中治疗或预防由病毒引起的病毒性疾病的方法,该方法包括向有此需要的受试者给药药物组合物,该药物组合物包含治疗有效量的本文所公开的化合物(特别是SB-462795)或其药学上可接受的盐,以及药学上可接受的载体或赋形剂。
附图说明
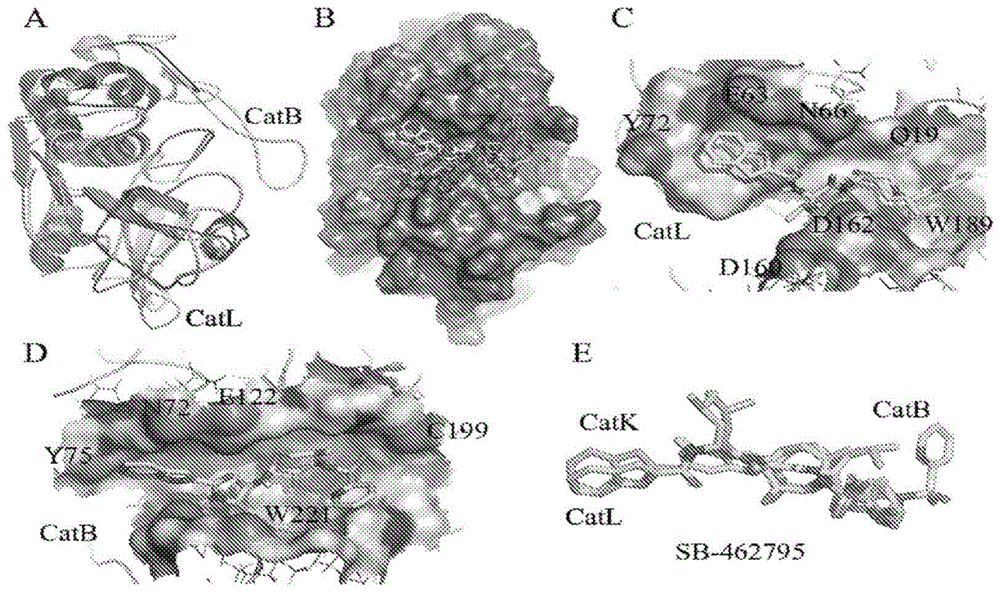
图1显示relacatib(SB-462795)以及组织蛋白酶结合的计算模型:
图1A显示(A)人CatL(蓝色,较深)和CatB(玫瑰色,较浅)的结构比对,得到
图1B显示SB-462795与人CatL(蓝色)的分子表面结合的对接位姿;最高等级的位姿为白色。黄色的表面区域(较浅右下区域)为残基Leu 144,并且为具有来自猕猴(Macacamulatta)的含残基Met的查询序列的变体。
图1C显示SB-462795与人CatL的形状填充模型结合的最高等级位姿;
图1D显示SB-462795与人CatB的形状填充模型结合的最高等级对接位姿;
图1E显示SB-462795对于人CatL(绿色,前景左侧,中上部)、人CatB(玫瑰色,背景左侧,中上部)和CatK(蓝绿色,右上分离环)的最高等级构象位姿。
图2显示SB-462795的广谱抗病毒活性。使用指定的病毒和细胞组合,在基于细胞的高含量测定中评估抗病毒活性:
图2A至2J显示在不存在(单独的DMSO,左侧图)和存在SB-462795(中图或右图,指定浓度)的情况下病毒感染的细胞。
图2K至2N显示成像测定,其中绿色(最浅成像区域)表示针对所指定病毒外壳蛋白的抗体,蓝色(不太浅成像区域)表示Hoechst染料;
图2K显示埃博拉Makona;
图2I显示马尔堡病毒;
图2M显示MERS冠状病毒;
图2N显示CoV-SARS;
图2O显示尼帕病毒,其在HeLa细胞的体外感染期间形成合胞体。
图3显示在不存在和存在埃博拉病毒(EBOV)感染的情况下的SB-462795药学。在大鼠(黑色)、恒河猴(rhesus macaques)(红色)以及不存在感染的正常健康人(蓝色)中执行的多递增剂量研究中,计算SB-462795的药代动力学参数。
图3A显示纵坐标上的血药浓度与时间曲线下面积(AUC)以及横坐标上的剂量;
图3B显示纵坐标上的血浆半衰期与横坐标上的剂量。
图3C显示纵坐标上的给药后最大血药浓度(C
图3D显示纵坐标上的最小血浆浓度(C
图3E显示感染有EBOV的恒河猴中的SB-462795血浆暴露。药物通过管饲法每天口服给药一次,持续14天。点图指示个体暴露水平,组平均值(竖线)和标准偏差以黑色显示。
图4显示恒河猴中针对EBOV的SB-462795暴露后防护。
图4A显示在暴露于埃博拉病毒的个体恒河猴中疾病的临床体征。由设盲的评价者每天观察动物多次,并基于反应性、姿态和活动来主观分配0-5范围内的临床疾病评分。将每天最大评分转换为颜色,较深的颜色对应于较严重的疾病征象。该示意图被截断以突出显示1-4天期间的临床评分。
图4B显示卡普兰-迈耶存活曲线。使用Log-ran Mantel-Cox测试,对于SB-462795治疗(蓝色)相对媒介物对照(黑色)组,*P=0.0565。
图4C显示治疗(蓝色)相对媒介物(黑色)中个体血浆病毒RNA浓度的点图。
图4D至图4I显示对于所选的分析物,包括d血小板,e部分活化凝血活酶时间(APTT),f纤维蛋白原,g C-反应蛋白(CRP),h血尿素氮(BUN),i天冬氨酸转氨酶(AAT),SB-462795治疗(蓝色)和媒介物(黑色)的临床病理学值。
图5显示经对照和SB-462795治疗的猴(恒河猴)存活者中存在的埃博拉病毒迹象:
图5A显示肝脏中的肝细胞坏死;
图5B显示(恒河猴)脾脏中的淋巴滤泡的纤维化、坏死和衰竭;
图5C显示经对照和SB-462795治疗的动物的结肠中观察到的GI病理学增强,包括粘膜溃疡、透壁性坏死、出血和多灶性梗死。
图6A显示卡莫司他在Calu-3细胞中针对SARS-CoV-2的抗病毒活性。
图6B显示relacatib在Calu-3细胞中针对SARS-CoV-2的抗病毒活性。
图7A显示与瑞德西韦主要血浆代谢产物相比,不同浓度的卡莫司他和relacatib在气液界面中培养的原代人肺细胞中的SARS-CoV-2抗病毒活性。
图7B显示特别是在第6天,与瑞德西韦主要血浆代谢产物相比,不同浓度的卡莫司他和relacatib在气液界面(ALI)中培养的原代人肺细胞中的SARS-CoV-2抗病毒活性。
图8A显示与单独的relacatib、单独的卡莫司他和瑞德西韦主要血浆代谢产物相比,组合的relacatib(4μM)和卡莫司他(30μM)在气液界面(ALI)中培养的原代人肺细胞的功效数据。
图8B显示与单独的relacatib、单独的卡莫司他和瑞德西韦主要血浆代谢产物相比,组合的relacatib(4μM)和卡莫司他(30μM)在气液界面(ALI)中培养的原代人肺细胞的细胞毒性数据(无病毒)。
具体实施方式
本发明的一个目的是提供用于在受试者中治疗或预防由病毒引起的病毒性疾病的用途或方法的抑制半胱氨酸蛋白酶的化合物,更特别地抑制木瓜蛋白酶超家族的半胱氨酸蛋白酶的化合物,还更特别地抑制组织蛋白酶家族的半胱氨酸蛋白酶的化合物,该方法包括向有此需要的受试者给药所述化合物或其药学上可接受的盐。本发明的具体实施方案提供了用于在受试者中治疗或预防由病毒引起的病毒性疾病的用途或方法的抑制组织蛋白酶K(Cat K)、组织蛋白酶L(Cat L)、组织蛋白酶V(Cat V(L2))、组织蛋白酶S(Cat S)、组织蛋白酶G(Cat G)、组织蛋白酶D(Cat D)、钙蛋白酶和/或胱天蛋白酶3-4中任一种的化合物,该方法包括向有此需要的受试者给药治疗有效量的如本文所述的化合物(特别是SB-462795)、或其药学上可接受的盐。
贯穿本申请,提及了涉及化合物、组合物和方法的各种实施方案。所描述的各种实施方案意在提供多种例示性实例,而不应解释为对替代物类的描述。相反,应当指出的是,本文所提供的各种实施方案的描述可以具有重叠的范围。本文所讨论的实施方案仅仅是例示性的,而不意在限制本发明的范围。
应当理解,本文使用的术语仅出于描述具体实施方案的目的,而不旨在限制本发明的范围。在本说明书和随后的权利要求书中,将提及许多术语,这些术语应被定义为具有以下含义。
除非另外指明,否则如本文所用,“烷基”是指具有1至8个碳原子,并且在一些实施方案中1至8个碳,并且在一些实施方案中1至6个碳原子的单价饱和脂族烃基。“(C
“密切接触者”和“感染有SARS-CoV-2的受试者的密切接触者”定义为(i)在与受感染的受试者同一家庭里生活的人;(ii)与受感染的受试者直接或物理接触的人;(iii)在受试者首次报告症状之日或之后,或者对于无症状受试者在检测试样前2天内,在受感染受试者的两米内逗留长于15分钟的人。
“化合物(Compound)”、“化合物(compounds)”、“化学实体(chemical entity)”和“化学实体(chemical entities)”是指由本文所公开的通式、那些通式的任何亚通式所涵盖的化合物,以及通式和亚通式内的化合物的任何形式,包括一种或多种化合物的外消旋体、立体异构体和互变异构体。
“COVID-19”是指感染有SARS-CoV-2的任何毒株或进化枝的患者所表现出的一系列症状(例如,https://www.cdc.gov/coronavirus/2019-ncov/symptoms-testing/symptoms.html)。症状通常包括咳嗽、发热和呼吸短促(呼吸困难),但一些患者无症状,在这种情况下COVID-19仅指SARS-CoV-2感染。
“与COVID-19相关联的继发性病症”或“与COVID-19相关联的继发性病症”意指与COVID-19相关联的大量症状中的任一种或多种,包括但不限于发热;寒战;咳嗽;呼吸短促;呼吸困难;疲劳;肌肉酸痛;身体疼痛;头痛;胸痛;红眼病(结膜炎);皮疹;味觉丧失;嗅觉丧失;咽喉痛;淤血;流鼻涕;恶心;呕吐;腹泻;心悸;心率加快;应激性心肌病;轻度头痛;感到晕眩;脑部迷糊;手指、手、脚、四肢麻木;体内刺痛感;体位性心动过速综合征(POTS);血液泵送不太有效;心脏炎症;心包膜炎症;血凝块;和神经学症状。
如本文所用,“细胞因子风暴”是指促炎细胞因子的过度和/或不受控制的释放,如观察到在多种多样的感染性和非感染性疾病中(特别是在病毒性疾病中)发生的,其中细胞和分子机制均可能促成在此类疾病(例如,冠状病毒疾病如SARS、COVID-19、MERS,以及流感、埃博拉和其它病毒性疾病)中所见的细胞因子风暴。如本文所用,细胞因子风暴是指由例如Tisoncik,J.R.等人在Microbiol.Mol.Biol Rev.(2012),76(1),16-32(“Into theEye of the Cytokine Storm”)中所描述的过度免疫反应。
“高风险”受试者和“高风险”类别包括如下:60岁及以上的受试者;高体质量指数(BMI)≥35的受试者;吸烟者、患有慢性医学病症(包括心脏病、肺病、糖尿病、癌症或高血压)的受试者;免疫受损的受试者,如正经历癌症或自身免疫疾病如类风湿性关节炎、系统性红斑狼疮、多发性硬化症和炎性肠病治疗的受试者;具有移植物的受试者,以及HIV阳性个体,包括在社区住所(如集体宿舍、辅助看护的养老院、疗养院、康复中心等)中生活的人,参加10、25、50、100、500、1000位或更多位未隔开约6英尺(2米)和/或未被面罩或防护罩防护的人员聚集的人,以及已经前往、来自于或经过具有高水平SARS-CoV-2和COVID-19病例的区域的人。
“药学上可接受的盐”是指衍生自多种有机和无机抗衡离子的药学上可接受的盐,并且仅以举例的方式包括钠、钾、钙、镁、铵和四烷基铵,且当分子含有碱性官能团时包括有机或无机酸的盐,如盐酸盐、氢溴酸盐、酒石酸盐、甲磺酸盐、乙酸盐、马来酸盐和草酸盐。合适的盐包括描述于P.Heinrich Stahl,Camille G.Wermuth(编辑),Handbook ofPharmaceutical Salts Properties,Selection,and Use;2002中的那些。其它合适的药学上可接受的盐在本文中有所描述。
“患者”或“受试者”是指动物,特别是哺乳动物,并且包括人类和非人动物。
“COVID-19的防止”根据词语“防止”的通常含义进行解释。
“外消旋体”是指对映体的混合物。在本发明的一个实施方案中,本文所述的化合物或其药学上可接受的盐对映体富集一种对映体,其中所有提及的手性碳呈一种构型。一般来讲,提及到的对映体富集的化合物或盐意在指示所指定对映体将占化合物或盐的所有对映体的总重量的超过50重量%。
“SARS-CoV-2”是β冠状病毒,它在RNA水平上与以入藏号NMDC10013002在中国国家微生物学数据中心(China National Microbiological Data Centre)保藏的任一种序列具有大于90%的序列同一性,或者在RNA水平上与以参考NC_045512.2SARS-CoV-2基因组(国际病毒分类命名委员会冠状病毒科研究组(Coronaviridae Study Group of theInternational Committee on Taxonomy of Viruses),2020年)在全球共享禽流感数据倡议组织(Global Initiative on Sharing All Influenza Data,GISAID)保藏的任一种序列具有大于90%的序列同一性。在另一个实施方案中,SARS-CoV-2冠状病毒在RNA水平上与以入藏号NMDC10013002在中国国家微生物学数据中心保藏的任一种序列或者与参考NC_045512.2SARS-CoV-2基因组(GISAID)具有大于95%的序列同一性。在其它实施方案中,SARS-CoV-2冠状病毒在RNA水平上与以入藏号NMDC10013002在中国国家微生物学数据中心保藏的任一种序列或者与参考NC_045512.2SARS-CoV-2基因组(GISAID)具有大于96%序列同一性、大于97%序列同一性、大于98%序列同一性或大于99%序列同一性。SARS-CoV-2的定义旨在涵盖SARS-CoV-2的所有毒株,包括L、S、G、GH、GR、V和O进化枝,以及它们的最近变体,包括UK变体(201/501Y.V1/B.1.1.7)、南非变体(20H/501Y.V2/B.1.351)、巴西变体(P.1/20J/501Y.V3/B.1.1.248)和新型加利福尼亚变体,该新型加利福尼亚变体起源于cluster 20C,由5种突变(ORF1a:I4205V、ORF1b:D1183Y、S:S13I;W152C;L452R)定义并且命名为CAL.20C(20C/S;452R;B.1.429)。如所定义的,S进化枝具有第8782位的T和第28144位的C;L进化枝具有第8782位的C和第28144位的T;G进化枝具有第23403位的G(A23403G);GH进化枝具有第25563位的T(G25563T);GR进化枝具有在第28881位开始的GGG向AAC的替换(GGG28881AAC);进化枝V具有第26144位的T(ORG2a:G251V);并且O具有未由进化枝L、S、G、GH、GR或V定义的序列变异和突变,其中编号涉及2019-nCoV-2的参考基因组(NC_045512)。值得注意的是,SARS-CoV-2基因组中的实际RNA碱基是U-尿嘧啶,但是为了与原始NCBI NC_045512.2参考基因组符号一致,在此使用T来表征遗传事件。SARS-CoV-2的定义也涵盖具有进化枝S(ORF8:L84S突变)、进化枝G(S:D614G突变)、进化枝GH(ORF3a:Q57H突变)、进化枝GR(S:D614G和N:RG203KR突变两者)、进化枝V(ORF3a:G251V突变),以及进化枝O(其它进化枝的与任何这些标准不匹配的序列和突变)的氨基酸变化的SARS-CoV-2进化枝,以及起源于以上所定义的进化枝的其它新出现的变体。
化合物的“溶剂化物(Solvate)”或“溶剂化物(solvates)”是指与化学计量或非化学计量的量的溶剂结合的如上定义的那些化合物。化合物的溶剂化物包括化合物的所有形式的溶剂化物。在某些实施方案中,溶剂是挥发性的、无毒的,并且/或者对于以痕量向人类给药是可接受的。合适的溶剂化物包括水。
“立体异构体(Stereoisomer)”或“立体异构体(stereoisomers)”是指一个或多个立体中心的手性有所不同的化合物。立体异构体包括对映体和非对映体。
“互变异构体”是指质子的位置不同的化合物的替代形式,如烯醇-酮和亚胺-烯胺互变异构体、或含有连接至环-NH-部分和环=N-部分两者上的环原子的杂芳基的互变异构形式,如吡唑、咪唑、苯并咪唑、三唑和四唑。
“治疗有效量”或如本文所用意指有效引起期望的生物学或医学反应的量,包括当向受试者给药以治疗疾病时足以实现对疾病的这种治疗的化合物的量。有效量将取决于具体化合物和待治疗的受试者的特征如年龄、体重等而变化。有效量可以包括一定范围的量。如本领域所理解,治疗有效量可以是一个或多个剂量,即,可能需要单剂量或多剂量以实现期望的治疗终点。治疗有效量可在给药一种或多种治疗剂的情境中考虑,并且如果与一种或多种其它药剂联合可以实现或实现期望或有益的结果,则可考虑以治疗有效量给予单一药剂。任何共同给药的化合物的合适剂量可任选地降低,这归因于化合物的联合作用(例如,累加或协同效应)。
“治疗或者治疗或预防受试者的疾病”是指1)防止疾病在易患或尚未显示疾病症状的受试者中发生;2)抑制疾病或阻止其发展;或者3)改善或引起疾病消退。
“COVID-19的治疗”是指SARS-CoV-2的病毒载量下降并且/或者SARS-CoV-2的病毒滴度下降,并且/或者疾病症状的严重程度或持续时间下降。病毒载量可以通过对来自患者的标本执行的合适的定量RT-PCR测定或合适的定性诊断测试(如基于LFIA的RDT)进行测量。在一个实施方案中,标本可以是来自上或下呼吸道的标本(如鼻咽或口咽拭子、痰、下呼吸道抽吸物、支气管肺泡灌洗物、支气管活体组织切片、经支气管活体组织切片和鼻咽冲洗物/抽吸物或鼻抽吸物)、唾液或血浆。在一个具体实施方案中,标本是粘液。在一个更特定的实施方案中,标本是唾液。许多定量RT-PCR测定的方案公开于https://www.who.int/emergencies/diseases/novel-coronavirus-2019/technical-guidance/laboratory-guidance。此外,Corman及其同事已公开了用于这样的测定的引物和探针(Corman等人,European communicable disease bulle tin,2020,DOI:10.2807/1560-7917)。在一个实施方案中,使用COVID-19RdRp/He1测定。这已经用临床标本得到验证,并且对基因组RNA的检出限为1.8TCID50/mL,对体外RNA转录物的检出限为11.2个RNA拷贝/反应(Chan等人,JClin Microbiol.,2020,doi:10.1128/JCM.00310-20)。病毒滴度可通过本领域公知的测定进行测量。
在一个实施方案中,COVID-19的治疗是指在单个患者中,通过相同的测定由治疗前(基线)和治疗期结束时获取的相同来源的标本所测得的病毒载量(RNA拷贝数/ml)下降至少5倍、10倍、50倍、100倍、500倍或1000倍。在一个实施方案中,COVID-19的治疗是指病毒载量下降大于0.5log单位。在另一个实施方案中,COVID-19的治疗是指与基线相比,在相同的测定中所测得的来自30名患者的相同来源的标本的平均病毒载量(RNA拷贝数/ml)在治疗期结束时下降至少5倍、10倍、50倍、100倍、500倍或1000倍的情况。
在一个实施方案中,COVID-19的治疗是指体征和症状的临床改善,如由患者生命、患者自我报告和临床观察所证实。
在一个实施方案中,COVID-19的治疗是指在治疗期结束时病毒载量下降到19RdRp/He1测定的检出限以下。
在绘制具有芳族环(如芳基或杂芳基环)的特定化合物或通式的情况下,本领域的技术人员应理解,任何双键的特定芳族位置是等同位置的共混物,即使它们在化合物与化合物之间或者式与式之间的不同位置绘制。例如,在以下两个吡啶环(A和B)中,双键绘制在不同的位置,然而,已知它们是相同的结构和化合物:
本发明涉及作为丝氨酸蛋白酶抑制剂,更具体地组织蛋白酶抑制剂的化合物、组合物和药物组合物,并且具有作为用于受试者中由病毒引起的病毒性疾病的治疗和/或预防性疗法的效用。
病毒是通过对几种特征(包括病毒基因组的类型)进行评价来分类的。病毒基因组可由DNA或RNA组成,可以是双链或单链(其可进一步为正义或反义),并且可由于大小和基因组结构而有很大差异。RNA病毒是具有RNA(核糖核酸)作为其遗传物质的病毒。该核酸通常是单链RNA(ssRNA)。RNA病毒可根据其RNA的意义(sense)或极性而进一步分为反义和正义。正义病毒RNA与mRNA相似,因此可由宿主细胞立即翻译。反义病毒RNA与mRNA互补,因此必须在翻译前由RNA聚合酶转化为正义RNA。因此,正义病毒的纯化RNA可直接引起感染,但它可能比完整病毒颗粒的感染性小。反义病毒的纯化RNA本身不具感染性,因为它需要转录成正义RNA;每个病毒体可转录成几种正义RNA。
正义单链RNA病毒(“正链RNA病毒”)构成了来自许多不同亚家族的病毒的较大超家族。这些病毒跨越植物和动物界两者,引起范围从轻度表型到严重衰竭性疾病的病理学。正链RNA病毒聚合酶超组的组成包括至少以下家族:轻小病毒属(levi-)、裸露核糖核酸病毒属(narna-)、小核糖核酸病毒属(picorna-)、双顺反子病毒(dicistro-)、海洋RNA病毒属(marna-)、伴生病毒属(sequi-)、豇豆花叶病毒属(como-)、马铃薯y病毒属(poty-)、杯状病毒属(calici-)、星状病毒属(astro-)、野田村病毒属(noda-)、四病毒属(tetra-)、黄症病毒属(luteo-)、番茄丛矮病毒属(tombus-)、冠状病毒属(corona-)、动脉炎病毒属(arteri-)、roni-、黄病毒属(flavi-)、披膜病毒属(toga-)、雀麦花叶病毒属(bromo-)、芜菁黄花叶病毒属(tymo-)、线性病毒属(clostero-)、flexi-、seco-、杆菌状核糖核酸病毒属(barna)、传染性软腐病病毒属(ifla-)、温州蜜柑矮缩病毒属(sadwa-)、樱桃锉叶病毒属(chera-)、肝炎病毒属(hepe-)、南方菜豆花叶病毒属(sobemo-)、幽影病毒属(umbra-)、烟草花叶病毒属(tobamo-)、烟草脆裂病毒属(tobra-)、大麦病毒属(hordei-)、真菌传杆状病毒属(furo-)、马铃薯病毒属(pomo-)、花生丛簇病毒属(peclu-)、甜菜坏死黄脉病毒属(beny-)、欧尔密病毒属(ourmia-)和悬钩子病毒属(idaeovirus)。
反义单链RNA病毒(“负链RNA病毒”)构成了来自不同亚家族的病毒的较小超家族。这些病毒也引起范围从轻度表型到严重衰竭性疾病和死亡的病理学。负链RNA病毒聚合酶超组的组成包括至少以下家族:玻那病毒科(Bornaviridae)、丝状病毒科(Filoviridae)、副黏液病毒科(Paramyxoviridae)、弹状病毒科(Rhabdoviridae)、Nyamiviridae、沙粒病毒科(Arenaviridae)、布尼雅病毒科(Bunyaviridae)、蛇形病毒科(Ophioviridae)、正黏液病毒科(Orthomyxoviridae)、δ病毒属(Deltavirus)、双索病毒属(Dichorhavirus)、欧洲山棒环斑病毒属(Emaravirus)、尼亚病毒属(Nyavirus)和叶脉曲张病毒属(Varicosavirus)。
感染有SARS-CoV-2的受试者的鉴定
感染有SARS-CoV-2的受试者可通过从获自该受试者的标本中检测SARS-CoV-2的病毒RNA进行鉴定。不旨在进行限制,标本可以是来自上或下呼吸道的标本(如鼻咽或口咽拭子、痰、下呼吸道抽吸物、支气管肺泡灌洗物和鼻咽冲洗物/抽吸物或鼻抽吸物)。可以使用任何已知的RNA检测方法,如高通量测序或实时逆转录聚合酶链反应(RT-PCR)测定。在一个实施方案中,该方法包括以下步骤:
·从标本中分离RNA;
·RNA的逆转录;
·在探针的存在下用正向和反向引物扩增;以及
·探针的检测;
其中如果循环阈值生长曲线在40个循环内越过阈值,则确认SARS-CoV-2的存在。
在一个更特定的实施方案中,步骤c)利用以下项:
正向引物5’GACCCCAAAATCAGCGAAAT 3’(SEQ ID NO:1)
反向引物5’TCTGGTTACTGCCAGTTGAATCTG 3’(SEQ ID NO:2)
探针5’FAM-ACCCCGCATTACGTTTGGTGGACC-BHQ-1 3’(SEQ ID NO:3)
在一个可替代的实施方案中,步骤c)利用以下项:
正向引物5’TTACAAACATTGGCCGCAAA3’(SEQ ID NO:4)
反向引物5’GCGCGACATTCCGAAGAA 3’(SEQ ID NO:5)
探针5’FAM-ACAATTTGCCCCCAGCGCTTCAG-BHQ-1 3’(SEQ ID NO:6)
这些引物和探针可从Integrated DNATechnologies(目录号10006606)和BioSearch Technologies(目录号KIT-nCoV-PP1-1000)商购获得。使用这些引物执行实时逆转录聚合酶链反应(RT-PCR)测定的详细说明已由CDC公开(https://www.cdc.gov/coronavirus/2019-nCoV/lab/index.html)。
因此,在一个实施方案中,本发明包括在受试者中治疗COVID-19的方法,包括从受试者获得的标本中检测SARS-CoV-2的病毒RNA的方法,以及在检测到病毒RNA的情况下如本文所述治疗COVID-19的步骤。
在一个方面,本发明提供了一种用于测试受试者中的SARS-CoV-2以及治疗受试者中的SARS-CoV-2感染的方法,该方法包括以下步骤:
·从源自受试者的标本中分离RNA;
·RNA的逆转录;
·在探针的存在下用正向和反向引物扩增;以及
·探针的检测;
其中如果循环阈值生长曲线在40个循环内越过阈值,则受试者被定义为患有SARS-CoV-2感染;以及
·用治疗有效量的化合物治疗患有SARS-CoV-2感染的受试者,该化合物是:
N-((2S)-4-甲基-1-(((4S,7R)-7-甲基-3-氧代-1-(吡啶-2-基磺酰基)氮杂环庚烷-4-基)氨基)-1-氧代戊-2-基)苯并呋喃-2-甲酰胺;
3-甲基-N-((S)-4-甲基-1-(((4S,7R)-7-甲基-3-氧代-1-(吡啶-2-基磺酰基)氮杂环庚烷-4-基)氨基)-1-氧代戊-2-基)呋喃并[3,2-b]吡啶-2-甲酰胺,
或其药学上可接受的盐。
在一个具体实施方案中,化合物是
或其药学上可接受的盐。
在该方法的具体实施方案中,受试者是人类,并且标本和/或引物和探针如上所述。治疗也可如本文所述进行。
在一些实施方案中,鉴定感染有SARS-CoV-2的受试者的方法能够鉴定受试者是否感染有L毒株SARS-CoV-2RNA、S毒株SARS-CoV-2RNA、G毒株SARS-CoV-2RNA、GH毒株SARS-CoV-2RNA、GR毒株SARS-CoV-2RNA、V毒株SARS-CoV-2RNA、或O毒株SARS-CoV-2RNA。本文所述的方法可以包括对扩增的cDNA测序以鉴定受试者是否感染有S毒株、L毒株、G毒株、GH毒株、GR毒株、V毒株或O毒株的另一步骤,以及鉴定受试者是否感染有它们的最近变体的另一步骤,所述最近变体包括UK变体(201/501Y.V1/B.1.1.7)、南非变体(20H/501Y.V2/B.1.351)、巴西变体(P.1/20J/501Y.V3/B.1.1.248)和新型加利福尼亚变体,该新型加利福尼亚变体起源于cluster 20C,由5种突变(ORF1a:I4205V、ORF1b:D1183Y、S:S13I;W152C;L452R)定义并且命名为CAL.20C(20C/S;452R;B.1.429)。
在一个可替代的实施方案中,感染有SARS-CoV-2的受试者可以通过在取自受试者的血液或粘液样本中检测SARS-CoV-2抗原或者针对SARS-CoV-2的受试者抗体来进行鉴定。在一个实施方案中,感染有SARS-CoV-2的受试者可以通过在取自受试者的血液或粘液样本中检测SARS-CoV-2抗原来进行鉴定。可以使用任何合适的测定。用于进行这种血清学测定的试剂盒已经可例如从Biomerica和Pharmact商购获得。授权的血清学测试的执行细节可获得于https://www.fda.gov/medical-devices/coronavirus-disease-2019-covid-19-emergency-use-authorizations-medical-devices/eua-authorized-serology-test-performance。
在一个实施方案中,用于鉴定感染有SARS-CoV-2的受试者的测定包括:
a)使至少一种来自SARS-CoV-2的固定化抗原与来自受试者的血液接触;以及
b)对针对该固定化抗原的受试者抗体与固定化抗原之间形成的复合物进行检测;
其中如果在步骤b)中检测到复合物,则鉴定受试者感染有SARS-CoV-2。
在该测定的一个具体实施方案中,来自SARS-CoV-2的抗原选自N蛋白和S蛋白或它们的片段。在一个更特定的实施方案中,来自SARS-CoV-2的抗原选自N蛋白、S蛋白的S1结构域以及S蛋白的S2结构域。在一个实施方案中,该测定包含超过一种固定化抗原。
在一个实施方案中,在步骤a)之后且在步骤b)之前,存在对固定化抗原进行洗涤的步骤。
在一个实施方案中,检测步骤b)包括使形成的复合物与识别相同抗原或多种抗原的一种或多种标记抗体接触,然后检测标记。在一个更特定的实施方案中,在加入一种或多种标记抗体之后洗涤复合物,然后检测标记。
在一个实施方案中,标记能够产生有色产物,使得能够视觉检测标记。
在一个实施方案中,测定是侧向层析测定(lateral flow assay)。在更特定的实施方案中,侧向层析测定在试纸条(dipstick)上具有一种或多种固定化抗原。
在一个实施方案中,本发明提供了一种用于测试受试者中的SARS-CoV-2以及治疗受试者中的SARS-CoV-2感染的方法,该方法包括以下步骤:
a)使至少一种来自SARS-CoV-2的固定化抗原与来自受试者的血液接触;以及
b)对针对该固定化抗原的受试者抗体与固定化抗原之间形成的复合物进行检测;
其中如果在步骤b)中检测到复合物,则鉴定受试者感染有SARS-CoV-2,以及
c)用治疗有效量的化合物治疗患有SARS-CoV-2感染的受试者,该化合物选自:
N-((2S)-4-甲基-1-(((4S,7R)-7-甲基-3-氧代-1-(吡啶-2-基磺酰基)氮杂环庚烷-4-基)氨基)-1-氧代戊-2-基)苯并呋喃-2-甲酰胺;
3-甲基-N-((S)-4-甲基-1-(((4S,7R)-7-甲基-3-氧代-1-(吡啶-2-基磺酰基)氮杂环庚烷-4-基)氨基)-1-氧代戊-2-基)呋喃并[3,2-b]吡啶-2-甲酰胺,
或其药学上可接受的盐。
在一个具体实施方案中,化合物是
或其药学上可接受的盐。在该方法的具体实施方案中,受试者是人类,并且测定如上所述进行。治疗也可如本文所述进行。
在一个实施方案中,用于鉴定感染有SARS-CoV-2的受试者的测定包括:
a)使识别来自SARS-CoV-2的抗原的固定化抗体与受试者的血液接触;以及
b)对来自SARS-CoV-2的抗原与识别所述抗原的固定化抗体之间形成的复合物进行检测;
其中如果在步骤b)中检测到复合物,则鉴定受试者感染有SARS-CoV-2。
在该测定的一个具体实施方案中,来自SARS-CoV-2的抗原选自N蛋白和S蛋白或它们的片段。
在一个更特定的实施方案中,来自SARS-CoV-2的抗原选自N蛋白、S蛋白的S1结构域以及S蛋白的S2结构域。在一个实施方案中,测定包含超过一种固定化抗体,每种抗体识别不同的抗原。
在一个实施方案中,在步骤a)之后且在步骤b)之前,存在洗涤固定化抗体的步骤。
在一个实施方案中,检测步骤b)包括使步骤a)中形成的复合物与识别相同抗原或多种抗原的标记抗体接触,然后检测标记。在一个更特定的实施方案中,步骤b)在检测标记之前包括洗涤步骤。
在一个实施方案中,标记能够产生有色产物,使得能够视觉检测标记。
在一个实施方案中,测定是侧向层析测定。在更具体的实施方案中,侧向层析测定在试纸条上具有一种或多种固定化抗体。
在一个实施方案中,本发明提供了一种用于测试并治疗SARS-CoV-2感染的方法,该方法包括以下步骤:
a)使识别来自SARS-CoV-2的抗原的固定化抗体与受试者的血液接触;以及
b)对来自SARS-CoV-2的抗原与识别所述抗原的固定化抗体之间形成的复合物进行检测;
其中如果在步骤b)中检测到复合物,则鉴定受试者感染有SARS-CoV-2,以及用治疗有效量的化合物治疗患有SARS-CoV-2感染的受试者,该化合物选自:
N-((2S)-4-甲基-1-(((4S,7R)-7-甲基-3-氧代-1-(吡啶-2-基磺酰基)氮杂环庚烷-4-基)氨基)-1-氧代戊-2-基)苯并呋喃-2-甲酰胺;
3-甲基-N-((S)-4-甲基-1-(((4S,7R)-7-甲基-3-氧代-1-(吡啶-2-基磺酰基)氮杂环庚烷-4-基)氨基)-1-氧代戊-2-基)呋喃并[3,2-b]吡啶-2-甲酰胺,
或其药学上可接受的盐。
在一个具体实施方案中,化合物是N-((2S)-4-甲基-1-(((4S,7R)-7-甲基-3-氧代-1-(吡啶-2-基磺酰基)氮杂环庚烷-4-基)氨基)-1-氧代戊-2-基)苯并呋喃-2-甲酰胺
或其药学上可接受的盐。在该方法的具体实施方案中,受试者是人类,并且测定如上所述进行。治疗也可如本文所述进行。
本发明的一个方面提供了一种用于在有此需要的受试者中治疗或预防病毒性疾病的方法,该方法包括向受试者给药治疗有效量的以下结构的化合物:
或其药学上可接受的盐,
其中:
X选自N或CR
R
具体实施方案提供了一种如所述用于在有此需要的受试者中治疗或预防病毒性疾病的方法,其中R
具体实施方案提供了一种如所述用于在有此需要的受试者中治疗或预防病毒性疾病的方法,其中R
具体实施方案提供了一种如所述用于在有此需要的受试者中治疗或预防病毒性疾病的方法,其中R
一个具体实施方案提供了一种用于在有此需要的受试者中治疗或预防病毒性疾病的方法,该方法包括向受试者给药治疗有效量的如所述的化合物,其中该化合物是:
或其药学上可接受的盐。
一个具体实施方案提供了一种用于在有此需要的受试者中治疗或预防病毒性疾病的方法,该方法包括向受试者给药治疗有效量的如所述的化合物,其中该化合物是:
或其药学上可接受的盐。
相关的实施方案提供了一种用于在有此需要的受试者中治疗或预防病毒性疾病的方法,该方法包括向受试者给药治疗有效量的如本文所述的第一治疗剂(特别是SB-462795)或其药学上可接受的盐与治疗有效量的第二治疗剂的组合,其中第二治疗剂不同于第一治疗剂。
在相关的实施方案中,第二治疗剂是阻断病毒进入动物的细胞的药剂;如通过调节病毒蛋白而直接作用于病毒的药剂;通过调节动物中除组织蛋白酶以外的蛋白质、受体或靶标来抑制病毒的药剂;调节弗林蛋白酶和相关前蛋白转换酶(PC)蛋白酶的药剂(参见Cheng等人,Furin Inhibitors Block SARS-CoV-2Spike Protein Cleavage to SuppressVirus Production and Cytopathic Effects,Cell Reports,33,第108254页,2020),例如肽抑制剂如癸酰基-RVKR-氯甲基酮(CMK)或小分子抑制剂如萘并荧光素;调节跨膜丝氨酸蛋白酶2(TMPRSS2)的药剂,例如卡莫司他、萘莫司他或其药学上可接受的盐;调节动物中的受体的药剂,例如血管紧张素转化酶2(ACE 2)抑制剂;充当免疫调节剂并且防止或改善受试者中的细胞因子风暴的药剂,例如4-氨基喹啉化合物或8-氨基喹啉化合物,包括氯喹、羟氯喹、他非诺喹、伯氨喹、或其药学上可接受的盐,特别地其中受试者是动物,更特别地人类。
具体实施方案提供了一种用于在有此需要的受试者中治疗或预防病毒性疾病的方法,该方法包括向受试者给药治疗有效量的如本文所述的第一治疗剂(特别是SB-462795)或其药学上可接受的盐,其中病毒性疾病由负链RNA病毒或正链RNA病毒引起。
具体实施方案提供了一种用于在有此需要的受试者中治疗或预防病毒性疾病的方法,该方法包括向受试者给药治疗有效量的如本文所述的第一治疗剂(特别是SB-462795)或其药学上可接受的盐,其中病毒性疾病由选自小核糖核酸病毒科(picornaviridae family)、黄病毒科(flaviviridae family)、丝状病毒科(filoviridaefamily)和冠状病毒科(coronaviridae family)的病毒引起。
具体实施方案提供了一种用于在有此需要的受试者中治疗或预防病毒性疾病的方法,该方法包括向受试者给药治疗有效量的如本文所述的第一治疗剂(特别是SB-462795)或其药学上可接受的盐,其中病毒性疾病由以下项引起:脊髓灰质炎病毒、鼻病毒、柯萨奇病毒(口蹄疫病毒(FMDV))、流感病毒(甲型流感病毒、乙型流感病毒、丙型流感病毒、禽流感病毒)、黄病毒、肝炎病毒(甲型肝炎病毒、乙型肝炎病毒、丙型肝炎病毒、丁型肝炎病毒、戊型肝炎病毒)、冠状病毒(SARS-CoV、SARS-CoV-2、造成中东呼吸综合征(MERS)的冠状病毒)、埃博拉病毒、马尔堡病毒、尼帕病毒(NiV)、亨德拉病毒、沙粒病毒、裂谷热病毒、黄热病毒、呼吸道合胞病毒(RSV)、西尼罗病毒、登革热病毒、爱知病毒、肠道病毒、风疹病毒、泰勒氏鼠脑脊髓炎病毒(TMEV)、埃可病毒、或人类免疫缺陷病毒(HIV)。
在相关的实施方案中,提供了一种用于在有此需要的受试者中治疗或预防病毒性疾病的方法,该方法包括向受试者给药治疗有效量的如本文所述的第一治疗剂(特别是SB-462795)或其药学上可接受的盐,其中病毒是冠状病毒,特别是SARS-CoV,更特别地SARS-CoV-2。
在相关的实施方案中,提供了一种用于在有此需要的受试者中治疗或预防病毒性疾病的方法,该方法包括向受试者给药治疗有效量的如本文所述的第一治疗剂(特别是SB-462795)或其药学上可接受的盐,其中病毒性疾病是COVID-19、严重急性呼吸综合症(SARS)、或(MERS)。
具体实施方案提供了一种用于抗病毒疗法的以下结构的化合物:
或其药学上可接受的盐,
其中:
X选自N或CR
R
另一个实施方案提供了一种用于治疗或预防病毒性疾病的以下结构的化合物:
或其药学上可接受的盐,其用于抗病毒疗法,
其中:
X选自N或CR
R
在具体实施方案中,用于治疗或预防的化合物如所描述,其中R
在具体实施方案中,用于治疗或预防的化合物如所描述,其中R
在具体实施方案中,用于治疗或预防的化合物如所描述,其中R
在具体实施方案中,用于治疗或预防的化合物如所描述,其中化合物是:
其中病毒是脊髓灰质炎病毒、鼻病毒、柯萨奇病毒、口蹄疫病毒(FMDV)、流感病毒(甲型流感病毒、乙型流感病毒、丙型流感病毒、禽流感病毒)、黄病毒、肝炎病毒(甲型肝炎病毒、乙型肝炎病毒、丙型肝炎病毒、丁型肝炎病毒、戊型肝炎病毒)、冠状病毒(CoV-SARS病毒、造成中东呼吸综合征(MERS)的冠状病毒、CoV-SARS-2)、埃博拉病毒、马尔堡病毒、尼帕病毒(NiV)、亨德拉病毒、沙粒病毒、裂谷热病毒、黄热病毒、呼吸道合胞病毒(RSV)、西尼罗病毒、登革热病毒、爱知病毒、肠道病毒、风疹病毒、泰勒氏鼠脑脊髓炎病毒(TMEV)、埃可病毒或人类免疫缺陷病毒(HIV)。
在具体实施方案中,用于治疗或预防的化合物如所描述,其中化合物是:
在具体实施方案中,用于治疗或预防的化合物如所述用作第一治疗剂,其中化合物是:
其中第一治疗剂与第二治疗剂组合给药,其中第二治疗剂不同于第一治疗剂。
在相关的实施方案中,在治疗或预防病毒性疾病中用作第一治疗剂的化合物是:
并且第二治疗剂是阻断病毒进入动物的细胞的药剂;如通过调节病毒蛋白而直接作用于病毒的药剂;通过调节动物中除组织蛋白酶以外的蛋白质、受体或靶标来抑制病毒的药剂;调节弗林蛋白酶和相关前蛋白转换酶(PC)蛋白酶的药剂,例如肽抑制剂如癸酰基-RVKR-氯甲基酮(CMK)或小分子抑制剂如萘并荧光素;调节胰蛋白酶或胰蛋白酶样蛋白酶的药剂;调节跨膜丝氨酸蛋白酶2(TMPSS2)的药剂,例如卡莫司他、萘莫司他或其药学上可接受的盐;以及调节动物中的受体的药剂,例如血管紧张素转化酶2(ACE 2)抑制剂;充当免疫调节剂并且防止或改善受试者中的细胞因子风暴的药剂,例如,充当免疫调节剂的药剂是4-氨基喹啉化合物或8-氨基喹啉化合物、或其药学上可接受的盐,包括氯喹、羟氯喹、他非诺喹、伯氨喹或其治疗上可接受的盐。
在具体实施方案中,用于治疗或预防的化合物如所描述,其中化合物是:
并且其中病毒是冠状病毒,例如SARS-CoV或SARS-CoV-2。
在具体实施方案中,用于治疗或预防的化合物如所描述,其中化合物是:
其中病毒性疾病是COVID-19、SARS或MERS。
在具体实施方案中,用于治疗或预防的化合物如所描述,其中化合物是:
其中病毒是埃博拉病毒、尼帕病毒、肠道病毒、流感病毒、人类免疫缺陷病毒、或寨卡病毒中的任一种,其中病毒性疾病是脑过小、格林-巴利综合征、严重脑部异常、或神经障碍。
一个实施方案提供了具有以下结构的化合物或其药学上可接受的盐在制造用于治疗病毒性疾病的药物中的用途,
其中病毒是脊髓灰质炎病毒、鼻病毒、柯萨奇病毒、口蹄疫病毒(FMDV)、流感病毒(甲型流感病毒、乙型流感病毒、丙型流感病毒、禽流感病毒)、黄病毒、肝炎病毒(甲型肝炎病毒、乙型肝炎病毒、丙型肝炎病毒、丁型肝炎病毒、戊型肝炎病毒)、冠状病毒(SARS-CoV、SARS-CoV-2、造成中东呼吸综合征(MERS)病毒的冠状病毒)、埃博拉病毒、马尔堡病毒、尼帕病毒(NiV)、亨德拉病毒、沙粒病毒、裂谷热病毒、黄热病毒、呼吸道合胞病毒(RSV)、西尼罗病毒、登革热病毒、爱知病毒、肠道病毒、风疹病毒、泰勒氏鼠脑脊髓炎病毒(TMEV)、埃可病毒、或人类免疫缺陷病毒(HIV)。
在相关的实施方案中,提供了治疗有效量的第一治疗剂与治疗有效量的第二治疗剂的组合在制造用于治疗如所述的病毒性疾病的药物中的用途,该第一治疗剂为具有以下结构的化合物或其药学上可接受的盐,
其中第二治疗剂为不同于第一治疗剂的治疗剂。
一个实施方案提供了如本文所述的化合物(特别是SB-462795)或其药学上可接受的盐在制造用于治疗由病毒引起的病毒性疾病的药物中的用途,其中病毒是冠状病毒。更特别地,冠状病毒是SARS-CoV、SARS-CoV-2或引起MERS的冠状病毒。
一个具体实施方案提供了如本文所述的化合物(特别是SB-462795)或其药学上可接受的盐在制造用于治疗由病毒引起的病毒性疾病的药物中的用途,其中病毒是冠状病毒,并且其中病毒性疾病是SARS、COVID-19或MERS。
一个实施方案提供了如本文所述的化合物(特别是SB-462795)或其药学上可接受的盐在制造用于治疗由病毒引起的病毒性疾病的药物中的用途,其中病毒是冠状病毒,其中病毒是埃博拉病毒。
一个实施方案提供了如本文所述的化合物(特别是SB-462795)或其药学上可接受的盐在制造用于治疗由病毒引起的病毒性疾病的药物中的用途,其中病毒是冠状病毒,其中病毒是寨卡病毒。
在一个具体实施方案中,提供了如本文所述的化合物(特别是SB-462795)或其药学上可接受的盐在制造用于治疗由病毒引起的病毒性疾病的药物中的用途,其中病毒是冠状病毒,其中病毒是寨卡病毒,并且病毒性疾病是脑过小、格林-巴利综合征、严重脑部异常、或神经障碍。
一个实施方案提供了如本文所述的化合物(特别是SB-462795)或其药学上可接受的盐在制造用于治疗由病毒引起的病毒性疾病的药物中的用途,其中病毒是冠状病毒,其中病毒是尼帕病毒、肠道病毒、或流感病毒。
在一个实施方案中,提供了一种用于在受试者中治疗或预防由病毒引起的病毒性疾病的方法,该方法包括向有此需要的受试者给药治疗有效量的化合物,即N-[(2S)-4-甲基-1-[[(4S,7R)-7-甲基-3-氧代-1-吡啶-2-基磺酰基氮杂环庚烷-4-基]氨基]-1-氧代戊-2-基]-1-苯并呋喃-2-甲酰胺、或其药学上可接受的盐,其也称为SB-462795或relacatib。对于relacatib的命名如PubChem美国国家医学图书馆的国家生物技术信息中心(PubChemU.S.National Library of Medicine,National Center for BiotechnologyInformation)所提供(https://pubchem.ncbi.nlm.nih.gov/compound/Relacatib)。
在本发明的一个实施方案中,本文所述的化合物可用于在受试者中防止或治疗病毒性疾病,其中病毒性疾病由单链RNA病毒引起。
在本发明的某些实施方案中,本文所述的化合物可用于在受试者中防止或治疗病毒性疾病,其中病毒性疾病由正义单链RNA病毒引起,或者病毒性疾病由反义单链RNA病毒引起。
在某些实施方案中,提供了一种用于在有此需要的受试者中治疗病毒性疾病的方法,其中病毒性疾病由来自巢病毒目(nidovirales)、小核糖核酸病毒目(picornavirales)、芜菁黄花叶病毒目(tymovirales)、单股反链病毒目(mononegavirales)、呼肠孤病毒科(reoviridae)、pycobirnaviridae、细小病毒科(parvoviridae)、腺病毒科(adenoviridae)、痘病毒科(poxviridae)、多瘤病毒科(polyomaviridae)、疱疹病毒科(herpesviridae)、副黏液病毒科病毒的病毒引起,该方法包括向受试者给药包含本文所述的任何化合物(特别是SB-462795)或其药学上可接受的盐的组合物。
实施方案提供了用于治疗病毒性疾病的化合物、方法和药物组合物,其中病毒性疾病由病毒引起,该方法包括向有此需要的受试者给药治疗有效量的如本文所述的化合物(特别是SB-462795)、或其药学上可接受的盐。还公开了用于制备这样的化合物的方法以及使用该化合物及其药物组合物的方法。特别地,公开了在受试者中治疗和预防由RNA或DNA病毒引起的病毒性疾病的实施方案。
在其它实施方案中,本文所述的化合物(特别是SB-462795)可用于在受试者中治疗病毒性疾病,其中病毒性疾病由属于小核糖核酸病毒科、黄病毒科、丝状病毒科、副黏液病毒科、或冠状病毒科的病毒引起。在其它实施方案中,本文所述的化合物可用于在受试者中治疗病毒性疾病,其中病毒性疾病由属于小核糖核酸病毒科的病毒引起。在其它实施方案中,本文所述的化合物(特别是SB-462795)可用于在受试者中治疗病毒性疾病,其中病毒性疾病由属于冠状病毒科的病毒引起。
在另一些实施方案中,本文所述的化合物可用于防止或治疗由来自任何系统发育目、属、科或特定物种(包括但不限于下表A中所列的那些)的病毒引起的病毒性疾病。
表A
/>
/>
/>
在另一些实施方案中,用于治疗方法或用途的如本文所述的化合物或其药学上可接受的盐选自下表B列出的化合物。
化合物的制备
表B
本文所述的化合物和上述化合物1(SB-462795/relacatib)和2所示可以由本领域的技术人员通过阅读以下参考文献中所述的合成方法、一般路线和实施例来合成,这些参考文献据此全文以引用方式并入:授予Cummings等人的PCT公开的专利申请WO 2001070232和授予Tew等人的PCT公开的专利申请WO2002017924,以及如Wang等人,Tetrahedron,65:32(2009)中所述。
本文所述的化学实体和中间体的分离和纯化可根据需要通过任何合适的分离或纯化程序来实现,例如过滤、萃取、结晶、柱色谱法、薄层色谱法或厚层色谱法、或这些程序的组合。合适的分离和离析程序的具体例示可参考下文的实施例。然而,也可以使用其它等同的分离或离析程序。
当期望时,(R)-和(S)-异构体可以通过本领域的技术人员已知的方法进行拆分,例如,通过形成非对映盐或复合物,其可例如通过结晶分离;经由形成非对映衍生物,其可例如通过结晶、气-液或液相色谱法分离;一种对映体与对映体特异性试剂的选择性反应,例如酶促氧化或还原,随后分离改性和未改性对映体;或者在手性环境中的气-液或液相色谱法,例如在手性载体(如具有结合的手性配体的二氧化硅)上或者在手性溶剂的存在下。另选地,特定对映体可通过使用光学活性试剂、底物、催化剂或溶剂的不对称合成,或者通过不对称转化使一种对映体转化为另一种对映体来合成。
给药和制剂
在一个实施方案中,提供了用于给药包含药学上可接受的稀释剂以及治疗有效量的如本文所述的化合物(特别是SB-462795)或其药学上可接受的盐的药物组合物的方法。
用于本文所述的本发明的方面和实施方案的化合物能够以药学上可接受的盐的形式提供。
本发明的化合物的例示性药学上可接受的酸盐可由以下酸制备,包括但不限于甲酸、乙酸、丙酸、苯甲酸、琥珀酸、乙醇酸、葡糖酸、戊二酸、乳酸、马来酸、苹果酸、酒石酸、柠檬酸、硝酸、抗坏血酸、葡糖醛酸、马来酸、富马酸、丙酮酸、天冬氨酸、谷氨酸、苯甲酸、盐酸、氢溴酸、氢碘酸、异柠檬酸、三氟乙酸、双羟萘酸、丙酸、邻氨基苯甲酸、甲磺酸、草酰乙酸、油酸、硬脂酸、水杨酸、对羟基苯甲酸、烟酸、苯乙酸、扁桃酸、扑酸(双羟萘酸)、甲烷磺酸、磷酸、膦酸、乙烷磺酸、苯磺酸、泛酸、甲苯磺酸、2-羟基乙烷磺酸、磺胺酸、硫酸、水杨酸、环己基氨基磺酸、海藻酸、β-羟基丁酸、半乳糖二酸和半乳糖醛酸。优选的药学上可接受的盐包括盐酸和三氟乙酸的盐。
本发明的化合物的例示性药学上可接受的无机碱盐包括金属离子。更优选的金属离子包括但不限于适当的碱金属盐、碱土金属盐和其它生理上可接受的金属离子。衍生自无机碱的盐包括铝、铵、钙、铜、铁、亚铁、锂、镁、锰盐、二价锰(manganous)、钾、钠、锌盐等以及它们的常见化合价。示例性的碱盐包括铝、钙、锂、镁、钾、钠和锌。其它示例性碱盐包括铵、钙、镁、钾和钠盐。另一些示例性碱盐包括例如氢氧化物、碳酸盐、氢化物和醇盐,包括NaOH、KOH、Na
衍生自药学上可接受的有机无毒碱的盐包括伯、仲和叔胺的盐,部分地包括三甲胺、二乙胺、N,N'-二苄基乙二胺、氯普鲁卡因、胆碱、二乙醇胺、乙二胺、葡甲胺(N-甲葡糖胺)和普鲁卡因;取代的胺,包括天然存在的取代的胺;环胺;季铵阳离子;和碱性离子交换树脂,如精氨酸、甜菜碱、咖啡因、胆碱、N,N-二苄基乙二胺、二乙胺、2-二乙氨基乙醇、2-二甲氨基乙醇、乙醇胺、乙二胺、N-乙基吗啉、N-乙基哌啶、还原葡糖胺、葡糖胺、组氨酸、海巴明哈胺(hydrabamine)、异丙胺、赖氨酸、甲葡糖胺、吗啉、哌嗪、哌啶、多胺树脂、普鲁卡因、嘌呤、可可碱、三乙胺、三甲胺、三丙胺、氨丁三醇等。
本领域的技术人员可以通过常规方式由本文所述的相应化合物(特别是由化合物SB-462795)制备本文所述的上述盐。例如,如本文所述的药学上可接受的盐可以通过常规化学方法由含有碱性或酸性部分的母体化合物进行合成。一般来讲,这样的盐可以通过使这些化合物的游离酸或碱形式与化学计量的量的适当碱或酸在水中或在有机溶剂中或在两者的混合物中反应来制备;一般来讲,非水介质如醚、乙酸乙酯、乙醇、异丙醇、或乙腈是优选的。盐可从溶液中沉淀并且经由过滤收集或者可通过蒸发溶剂来回收。盐的电离度可以从完全电离到几乎不电离变化。其它合适的盐的列表可见于
用于如本文所述的本发明的方面和实施方案中的化合物能够以非溶剂化和溶剂化形式存在。术语“溶剂化物”在本文中用于描述包含本发明的化合物和一种或多种药学上可接受的溶剂分子(例如乙醇)的分子复合物。当所述溶剂是水时,采用术语“水合物”。药学上可接受的溶剂化物包括水合物和其它溶剂化物,其中结晶的溶剂可以是同位素取代的,例如D
用于如本文所述的本发明的方面和实施方案的化合物可以含有一个或多个不对称碳原子并且可以作为两种或更多种立体异构体存在。
在本发明要求保护的化合物的范围内包括本文所述的化合物的所有立体异构体、几何异构体和互变异构形式,包括表现出超过一种类型的同分异构现象的化合物以及它们的一种或多种的混合物。还包括酸加成盐或碱盐,其中抗衡离子是光学活性性的,例如D-乳酸盐或L-赖氨酸,或者外消旋的,例如DL-酒石酸盐或DL-精氨酸。
用于制备/分离单个对映体的常规技术包括从合适的光学纯前体进行手性合成,或使用例如手性高压液相色谱法(HPLC)来拆分外消旋体(或盐或衍生物的外消旋体)。
替代地,外消旋物(或外消旋前体)可以与合适的光学活性化合物(例如醇)反应,或者在本文所述的化合物含有酸性或碱性部分的情况下,与酸或碱(如酒石酸或1-苯乙胺)反应。所得的非对映混合物可以通过色谱法和/或分级结晶进行分离,且非对映体中的一者或两者通过技术人员公知的方式转化为相应的纯对映体。
本发明的手性化合物(及其手性前体)可以使用色谱法(通常HPLC)在具有不对称固定相和流动相的树脂上以对映体富集的形式获得,该流动相由含有0至50%(通常2至20%)异丙醇的烃(通常庚烷或己烷)以及0至5%的烷基胺(通常0.1%二乙胺)组成。浓缩洗脱液,得到富集的混合物。
立体异构体的混合物可以通过本领域的技术人员已知的常规技术进行分离[参见例如“Stereochemistry of Organic Compounds”,E L Eliel(Wiley,New York,1994)]。
本发明包括本文所述的化合物的药学上可接受的同位素标记形式,其中一个或多个原子被原子序数相同但原子质量或质量数不同于自然界中通常存在的原子质量或质量数的原子所替代。
如本文所述的化合物(特别是SB-46-2795)或其药学上可接受的盐以及如本文所述的药物制剂可以与一种或多种其它治疗剂组合使用,或者包括一种或多种其它治疗剂,以用于在有此需要的受试者中治疗或预防由病毒引起的病毒性疾病。一种或多种其它治疗剂可选自抗炎剂、抗胆碱能剂(特别是M
适于与如本文所述的化合物(特别是SB-462795)组合使用的β
与如本文所述的化合物(特别是SB-462785)组合使用的合适的抗炎剂包括抗炎类风湿性关节炎免疫疗法,包括托珠单抗以及sarilumab、皮质类固醇。可与本文所述的化合物组合使用的皮质类固醇的实例是那些具有抗炎活性的口服和吸入型皮质类固醇及其前药。实例包括甲基泼尼松龙、泼尼松龙、地塞米松、丙酸氟替卡松、6α,9α-二氟-11β-羟基-16α-甲基-17α-[(4-甲基-1,3-噻唑-5-羰基)氧基]-3-氧代-雄甾-1,4-二烯-17β-硫代羧酸S-氟甲酯、6α,9α-二氟-17α-[(2-呋喃基羰基)氧基]-11β-羟基-16α-甲基-3-氧代-雄甾-1,4-二烯-17β-硫代羧酸S-氟甲酯(糠酸氟替卡松)、6α,9α-二氟-11β-羟基-16α-甲基-3-氧代-17α-丙酰氧基-雄甾-1,4-二烯-17β-硫代羧酸-(2-氧代-四氢-呋喃-3S-基)酯、6α,9α-二氟-11β-羟基-16α-甲基-3-氧代-17α-(2,2,3,3-四甲基环丙基羰基)氧基-雄甾-1,4-二烯-17β-羧酸氰甲基酯以及6α,9α-二氟-11β-羟基-16α-甲基-17α-(1-甲基环丙基羰基)氧基-3-氧代-雄甾-1,4-二烯-17β-硫代羧酸S-氟甲酯、倍氯米松酯类(例如,17-丙酸酯或17,21-二丙酸酯)、布地奈德、氟尼缩松、莫米松酯类(例如糠酸莫米松)、曲安奈德、罗氟奈德、环索奈德(16α,17-[[(R)-环己基亚甲基]双(氧基)]-11β,21-二羟基-孕甾-1,4-二烯-3,20-二酮)、布替可特丙酸酯、RPR-106541和ST-126。在一个实施方案中,皮质类固醇包括丙酸氟替卡松、6α,9α-二氟-11β-羟基-16α-甲基-17α-[(4-甲基-1,3-噻唑-5-羰基)氧基]-3-氧代-雄甾-1,4-二烯-17β-硫代羧酸S-氟甲酯、6α,9α-二氟-17α-[(2-呋喃基羰基)氧基]-11β-羟基-16α-甲基-3-氧代-雄甾-1,4-二烯-17β-硫代羧酸S-氟甲酯、6α,9α-二氟-11β-羟基-16α-甲基-3-氧代-17α-(2,2,3,3-四甲基环丙基羰基)氧基-雄甾-1,4-二烯-17β-羧酸氰甲基酯和6α,9α-二氟-11β-羟基-16α-甲基-17α-(1-甲基环丙基羰基)氧基-3-氧代-雄甾-1,4-二烯-17β-硫代羧酸S-氟甲酯。在一个实施方案中,皮质类固醇是6α,9α-二氟-17α-[(2-呋喃基羰基)氧基]-11β-羟基-16α-甲基-3-氧代-雄甾-1,4-二烯-17β-硫代羧酸S-氟甲酯。
适于与如本文所述的化合物组合用于在受试者中治疗或预防由病毒引起的病毒性疾病的皮质类固醇的实例可包括WO2002/088167、WO2002/100879、WO2002/12265、WO2002/12266、WO2005/005451、WO2005/005452、WO2006/072599和WO2006/072600中所述的那些。
具有糖皮质激素激动作用的非甾体化合物可对反式抑制具有选择性(相对于非反式激活),并且可用于与如本文所述的化合物(包括SB-462795)组合用于在受试者中治疗或预防由病毒引起的病毒性疾病,包括以下公开的专利申请和专利中所涵盖的那些:WO1998/54159、WO2000/66590、WO2001/16128、WO2002/02565、WO2003/059899、WO2003/061651、WO2003/082280、WO2003/082787、WO2003/082827、WO2003/086294、WO2003/101932、WO2003/104195、WO2004/005229、WO2004/009017、WO2004/018429、WO2004/026248、WO2006/000398、WO2006/000401、WO2006/015870、WO2006/108699、WO2007/000334、WO2007/054294、WO2007/122165、WO2007/144327和WO2008/000777。
适于与如本文所述的化合物(特别是SB-462795)组合用于在受试者中治疗或预防由病毒引起的病毒性疾病的抗炎剂的实例包括非甾体抗炎药(NSAID)。
合适的NSAID的实例包括色甘酸钠、奈多罗米钠、磷酸二酯酶(PDE)抑制剂(例如,茶碱、PDE4抑制剂或混合PDE3/PDE4抑制剂)、白三烯拮抗剂、白三烯合成抑制剂(例如孟鲁司特)、iNOS抑制剂、类胰蛋白酶和弹性蛋白酶抑制剂、β-2整联蛋白拮抗剂和腺苷受体激动剂或拮抗剂(例如腺苷2a激动剂)、细胞因子拮抗剂(例如趋化因子拮抗剂,如CCR3拮抗剂)或细胞因子合成抑制剂、或5-脂氧合酶抑制剂。
在一个实施方案中,与如本文所述的化合物(特别是SB-462795)组合用于在受试者中治疗或预防由病毒引起的病毒性疾病的iNOS(诱导型一氧化氮合酶)抑制剂包括WO1993/13055、WO1998/30537、WO2002/50021、WO1995/34534和WO1999/62875中所公开的iNOS抑制剂。
与如本文所述的化合物(特别是SB-462795)组合用于在受试者中治疗或预防由病毒引起的病毒性疾病的CCR3抑制剂的实例包括WO2002/26722中所公开的那些。
与如本文所述的化合物(特别是SB-462795)组合用于在受试者中治疗或预防由病毒引起的病毒性疾病的PDE4抑制化合物的实例包括顺式-4-氰基-4-(3-环戊氧基-4-甲氧基苯基)环己烷-1-甲酸、2-甲氧羰基-4-氰基-4-(3-环丙基甲氧基-4-二氟甲氧基苯基)环己烷-1-酮和顺式-[4-氰基-4-(3-环丙基甲氧基-4-二氟甲氧基苯基)环己烷-1-醇]。而且有顺式-4-氰基-4-[3-(环戊氧基)-4-甲氧基苯基]环己烷-1-甲酸(也称为西洛司特)及其盐、酯、前药或物理形式,其描述于1996年9月03日授予的美国专利5,552,438中;该专利及其公开的化合物全文以引用方式并入本文。
与如本文所述的化合物(特别是SB-462795)组合用于在受试者中治疗或预防由病毒引起的病毒性疾病的抗胆碱能剂的实例包括充当毒蕈碱型受体的拮抗剂的那些化合物,特别是作为M
额外合适的抗胆碱能化合物公开于WO2005/037280、WO2005/046586、WO2005/104745和WO2005/009439,它们以引用的方式并入本文。本发明的组合包括但不限于:(3-内-)-3-(2,2-二-2-噻吩基乙烯基)-8,8-二甲基-8-氮杂双环[3.2.1]辛烷碘化物;(3-内)-3-(2-氰基-2,2-二苯基乙基)-8,8-二甲基-8-氮杂双环[3.2.1]辛烷溴化物;4-[羟基(二苯基)甲基]-1-{2-[(苯基甲基)氧基]乙基}-1-氮杂双环[2.2.2]辛烷溴化物;和(1R,5S)-3-(2-氰基-2,2-二苯基乙基)-8-甲基-8-{2-[(苯基甲基)氧基]乙基}-8-氮杂双环[3.2.1]辛烷溴化物。
适于与本文所述的化合物(特别是SB-462795)或其药学上可接受的盐组合用于在受试者中治疗或预防由病毒引起的病毒性疾病的抗病毒剂的实例包括但不限于衣壳抑制剂、利巴韦林、帕利珠单抗、GS-5806、AL-8176、MEDI-8897、REGN-2222、ALX-0171、ALN-RSV01、AK0529、法匹拉韦(T-705)、VX-878(JNJ-872)、S-033188、FI6、CR9114、MHAA4549A(39.29)、VIS410、拉米夫定、干扰素、核苷类似物,以及无环核苷膦酸酯类似物、NS3/4A蛋白酶抑制剂、NS5A抑制剂、NS5B聚合酶抑制剂、5-取代的2′-脱氧尿苷类似物、进入抑制剂、核苷类似物、焦磷酸酯类似物、无环鸟苷类似物、基质蛋白2抑制剂、RNA聚合酶抑制剂,以及神经氨酸酶抑制剂、无环鸟苷类似物、无环核苷膦酸酯类似物、焦磷酸酯类似物、寡核苷酸、核苷类似物、5-取代的2′-脱氧尿苷类似物、抗体、咪喹莫特、sinecatechins、普达非洛、阿昔洛韦、TMPRSS2抑制剂、PI4KB抑制剂、3C蛋白酶和3CL-蛋白酶抑制剂、卡莫司他、萘莫司他和他非诺喹。适于与本文所述的组织蛋白酶抑制剂化合物(特别是SB-462795)组合用于在受试者中治疗或预防由病毒引起的病毒性疾病的额外抗病毒剂包括E.de Clercq和G.Li在Clin Microbiol Rev(2016),29:695-747(“Approved Antiviral Drugs over the Past50Years”)中描述的抗病毒化合物。
适于与本文所述的化合物(特别是SB-462795)或其药学上可接受的盐组合用于在受试者中治疗或预防由病毒引起的病毒性疾病的抗逆转录病毒剂的实例包括度鲁特韦、卡博特韦、卡博特韦LA、瑞德西韦、齐多夫定、地达诺新、拉米夫定、扎西他滨、阿巴卡韦、司他夫定、阿德福韦、阿德福韦酯、福齐夫定替酯、elsufavirine、VM-1500A、ABX464、利匹韦林、todoxil、恩曲他滨、阿洛夫定、氨多索韦、艾夫他滨、奈韦拉平、地拉夫定、依非韦伦、洛韦胺、元复宝(immunocal)、奥替普拉、卡普韦林、lersivirine、多拉维林、3TC、AZT、TMC-278、TMC-125、依曲韦林、沙奎那韦、利托那韦、茚地那韦、奈非那韦、安普那韦、膦沙那韦、福斯特沙韦(fostemsavir)、EFdA(MK-8591)、MK-8583、MK-8527、MK-8558、GS-9131、GS-9148、GS-PI1、GS-CA1、GS-PS1、贝卡那韦(brecanavir)、达芦那韦、阿扎那韦、替拉那韦、帕利那韦、拉西那韦、恩夫韦地、T-20、T-1249、PRO-542、PRO-140、TNX-355、BMS-806、BMS-663068和BMS-626529、5-Helix、雷特格韦、埃替拉韦、GSK2248761、GSK3640254、GSK1349572、GSK1265744、GSK3732394(Combinectin)、vicriviroc(Sch-C)、Sch-D、TAK779、马拉韦罗、TAK449、地达诺新、替诺福韦、洛匹那韦、达芦那韦、ibulizamab、PRO-140(leronlimab)、UB-421、VRC01、VRC01/LS、VRC07-523LS、3BNC117/LS、10-1074/LS、PGDM1400、PGT121、10E8.4/iMab。
适于与本文所述的化合物(特别是SB-462795)或其药学上可接受的盐组合用于在受试者中治疗或预防由病毒引起的病毒性疾病的抗菌剂的实例包括The Pew CharitableTrusts在https://www.pewtrusts.org/en/research-and-analysis/data-visualizations/2014/antibiotics-currently-in-clinical-development中所述的那些。特别地,与如本文所述的化合物组合用于治疗本文所述的病毒性疾病的用途或方法的合适的抗菌剂的实例包括但不限于依拉环素、奥马环素、艾拉普林、S-649266、亚胺培南、西司他丁、脱氢肽酶抑制剂、碳青霉烯、relabactam、来法莫林(BC-3781)、拉库沙星(KRP-AM1977)、CRS3123、delp azolid(LCB01-0371)、ETX0282CPDP、SPR741、TP-271、TP-6076、WCK5222、ACX-362E、afabidin、ARV-1801、brilacidin、CG-549、非那沙星、MDB-BP-3、gepotidacin(GSK2140944)、头孢菌素、β-内酰胺酶抑制剂、四环素、截短侧耳素、氟喹诺酮、2,4-氨基嘧啶、二芳基二胺、噁唑烷酮、多粘菌素、苯并呋喃萘啶、梭链孢烷(fusidane)、防御素模拟物、苄基吡啶酮、偏端霉素、喹诺酮、利福霉素-喹诺酮混杂物、三氮杂苊烯、双苯并咪唑、抗微生物肽模拟物和大环内酯。
适于与本文所述的化合物(特别是SB-462795)或其药学上可接受的盐组合用于在受试者中治疗或预防由病毒引起的病毒性疾病的3C蛋白酶或3CL抑制剂的实例包括于2018年4月19日公开的WO2018/042343中所公开的化合物。
适于与本文所述的化合物(特别是SB-462795)或其药学上可接受的盐组合用于在受试者中治疗或预防由病毒引起的病毒性疾病的PI4KB抑制剂的实例包括于2019年7月25日公开的WO2019/141694中所公开的化合物。
一个实施方案提供了一种用于在受试者中治疗或预防由病毒引起的病毒性疾病的组合,该组合包含本文所述的化合物(更特别地SB-462705)或其药学上可接受的盐,以及H1拮抗剂。合适的H1拮抗剂的实例包括但不限于氨来占诺、阿司咪唑、阿扎他啶、氮卓斯汀、阿伐斯汀、溴苯那敏、西替利嗪、左西替利嗪、乙氟利嗪、扑尔敏、克立马丁、赛克利嗪、卡瑞斯汀、赛庚啶、卡比沙明、去羧乙氧基氯雷他定、抗敏安、二甲茚定、依巴斯汀、依匹斯汀、乙氟利嗪、非索非那定、羟嗪、酮替芬、氯雷他定、左卡巴斯汀、咪唑斯汀、美喹他嗪、米安色林、诺柏斯汀、氯苯甲嗪、诺阿司咪唑、奥洛他定、哌香豆司特、吡拉明、异丙嗪、特非那定、曲吡那敏、替美斯汀、异丁嗪和曲普利啶,特别是氮卓斯汀、西替利嗪、左西替利嗪、乙氟利嗪和非索非那定。
在另一个实施方案中,本发明提供了一种用于在受试者中治疗或预防由病毒引起的病毒性疾病的组合,该组合包含本文所述的化合物(更特别地SB-462705)或其药学上可接受的盐,以及H3拮抗剂(和/或反向激动剂)。合适的H3拮抗剂的实例包括例如WO2004/035556、WO2006/045416、WO2006/090142、WO2006/125665、WO2007/009739和WO2007/009741中所公开的那些化合物。在另一个实施方案中,本发明提供了一种用于在受试者中治疗或预防由病毒引起的病毒性疾病的组合,该组合包含本文所述的化合物或其药学上可接受的盐,以及H1/H3双重拮抗剂(和/或反向激动剂)。H1/H3双重拮抗剂的实例包括例如WO2004/035556、WO2007/071691、WO2007/122156和WO2007/135081中所公开的那些化合物。
本领域的技术人员将清楚的是,在适当的情况下,一种或多种额外的治疗剂能够以盐的形式使用,例如作为碱金属或胺盐或者作为酸加成盐、或前药,或者作为酯(例如低级烷基酯),或者作为溶剂化物(例如水合物),以最优化治疗剂的活性和/或稳定性和/或物理特征,如溶解度。还将清楚的是,在适当的情况下,治疗剂能够以光学纯的形式使用。
因此,本发明的一个实施方案提供了一种用于在受试者中治疗或预防由病毒引起的病毒性疾病的组合,该组合包含用于在受试者中治疗或预防由病毒引起的病毒性疾病的本文所述的化合物(更特别地SB-462705)、或其药学上可接受的盐、溶剂化物或生理功能衍生物,以及PDE4抑制剂。
因此,本发明的一个实施方案提供了一种用于在受试者中治疗或预防由病毒引起的病毒性疾病的组合,该组合包含本文所述的化合物或其药学上可接受的盐、溶剂化物或生理功能衍生物,以及β
因此,本发明的一个实施方案提供了一种用于在受试者中治疗或预防由病毒引起的病毒性疾病的组合,该组合包含本文所述的化合物或其药学上可接受的盐、溶剂化物或生理功能衍生物,以及皮质类固醇。
因此,本发明的一个实施方案提供了一种用于在受试者中治疗或预防由病毒引起的病毒性疾病的组合,该组合包含本文所述的化合物或其药学上可接受的盐、溶剂化物或生理功能衍生物,以及非甾体GR激动剂。
因此,本发明的一个实施方案提供了一种用于在受试者中治疗或预防由病毒引起的病毒性疾病的组合,该组合包含本文所述的化合物或其药学上可接受的盐、溶剂化物或生理功能衍生物,以及抗胆碱能剂。
因此,本发明的一个实施方案提供了一种用于在受试者中治疗或预防由病毒引起的病毒性疾病的组合,该组合包含本文所述的化合物或其药学上可接受的盐、溶剂化物或生理功能衍生物,以及抗组胺剂。
因此,本发明的一个实施方案提供了一种用于在受试者中治疗或预防由病毒引起的病毒性疾病的组合,该组合包含本文所述的化合物或其药学上可接受的盐、溶剂化物或生理功能衍生物,以及PDE4抑制剂和β
一个实施方案提供了一种用于在受试者中治疗或预防由病毒引起的病毒性疾病的组合,该组合包含本文所述的化合物(特别是SB-462795)或其药学上可接受的盐,以及3C蛋白酶抑制剂。
一个实施方案提供了一种用于在受试者中治疗或预防由病毒引起的病毒性疾病的组合,该组合包含本文所述的化合物(特别是SB-462795)或其药学上可接受的盐,以及PI4KB抑制剂。
一个实施方案提供了一种用于在受试者中治疗或预防由病毒引起的病毒性疾病的组合,该组合包含本文所述的化合物(特别是SB-462795)或其药学上可接受的盐,以及TMPRSS2抑制剂。
一个实施方案提供了一种用于在受试者中治疗或预防由病毒引起的病毒性疾病的组合,该组合包含本文所述的化合物(特别是SB-462795)或其药学上可接受的盐,以及胰蛋白酶抑制剂或胰蛋白酶样蛋白酶抑制剂。
一个实施方案提供了一种用于在受试者中治疗或预防由病毒引起的病毒性疾病的组合,该组合包含本文所述的化合物(特别是SB-462795)或其药学上可接受的盐,以及弗林蛋白酶抑制剂或相关前蛋白转换酶(PC)蛋白酶抑制剂,例如肽抑制剂如癸酰基-RVKR-氯甲基酮(CMK)或小分子抑制剂如萘并荧光素。
以上所提及的组合可方便地提供成以药物制剂的形式使用,因此包含如上所定义的组合以及药学上可接受的稀释剂或载体的药物制剂代表了本发明的另一方面。
这样的组合的各化合物能够以单独或组合的药物制剂顺序或同时地给药。在一个实施方案中,各化合物将以组合的药物制剂同时地给药。本领域的技术人员容易理解已知治疗剂的适当剂量。
本发明的化合物可作为前药给药。因此,本身可能几乎没有或没有药理活性的本文所述的任何化合物的某些衍生物可以在给药到体内或身体上时例如通过水解断裂转化为具有期望活性的化合物。这样的衍生物称为“前药”。
药物组合物或制剂包括固体、半固体、液体和气雾剂剂型,如片剂、胶囊剂、散剂、液体、混悬剂、气雾剂等。化学实体还能够以持续或控制释放剂型给药,用于以预定速率延长和/或定时、脉冲式给药。在某些实施方案中,组合物以适于精确剂量的单次给药的单位剂型提供。
本文所述的化合物(特别是SB-462795)或其药学上可接受的盐可单独给药,或者更典型地与常规药物载体、赋形剂等(例如,甘露糖醇、乳糖、淀粉、硬脂酸镁、糖精钠、滑石、纤维素、交联羧甲基纤维素钠、葡萄糖、明胶、蔗糖、碳酸镁等)组合给药。用于可注射溶液剂的液体载体包括水、盐水、右旋糖水溶液和二醇类。
如果需要,包含本文所述的化合物(特别是SB-462795)或其药学上可接受的盐的药物组合物还可含有微量的无毒辅助物质,如润湿剂、乳化剂、增溶剂、pH缓冲剂等(例如,乙酸钠、柠檬酸钠、环糊精衍生物、脱水山梨糖醇单月桂酸酯、三乙醇胺乙酸盐、三乙醇胺油酸盐等)。一般来讲,取决于预期的给药模式,药物组合物将含有约0.005重量%至95重量%;在某些实施方案中约0.5重量%至50重量%的化学实体。制备这样的剂型的实际方法是本领域的技术人员已知的,或者将对于他们是显而易见的;例如参见Remington'sPharmaceutical Sciences,Mack Publishing Company,Easton,Pennsylvania。
在某些实施方案中,包含本文所述的化合物(特别是SB-462795)或其药学上可接受的盐的药物组合物将采取丸剂或片剂的形式,并因此组合物将含有稀释剂,如乳糖、蔗糖、磷酸二钙等;润滑剂,如硬脂酸镁等;和粘合剂,如淀粉、阿拉伯树胶、聚维酮、明胶、纤维素、纤维素衍生物等,以及活性成分。在另一种固体剂型中,可将散剂、粉末、丸粒剂(marume)、溶液剂或混悬剂(例如,处于碳酸丙二酯、植物油或甘油三酯中)包封在明胶胶囊中。
包含本文所述的化合物(特别是SB-462795)或其药学上可接受的盐的液体药学上可给药的组合物可以例如通过将至少一种化学实体和任选的药物佐剂在载体(例如,水、盐水、右旋糖水溶液、甘油、二醇类、乙醇等)中溶解、分散等以形成溶液或悬浮液进行制备。注射剂能够以常规形式制备,作为液体溶液剂或混悬剂、乳剂,或是适于在注射前溶解或悬浮在液体中的固体形式。包含在这种肠胃外组合物中的化学实体的百分比高度取决于其具体性质,以及化学实体的活性和受试者的需求。然而,溶液中0.01%至10%的活性成分百分比是可采用的,并且如果组合物是后续稀释至以上百分比的固体,则将会更高。在某些实施方案中,组合物在溶液中包含约0.2至2%的活性剂。用于可注射溶液剂的液体载体包括水、盐水、右旋糖水溶液和二醇类。
包含本文所述的化合物(特别是SB-462795)或其药学上可接受的盐的药物组合物也可作为用于喷雾器的气雾剂或溶液剂,或者作为用于吹入的微细散剂,单独地或与惰性载体(如乳糖)组合给药至呼吸道。在这种情况下,药物组合物的颗粒的直径小于50微米,在某些实施方案中小于10微米。
一般来讲,本文所述的化合物(特别是SB-462795)或其药学上可接受的盐将以治疗有效量通过用于提供类似效用的药剂的任何接受的给药模式进行给药。化学实体(即活性成分)的实际量将取决于多种因素,如待治疗疾病的严重程度、受试者的年龄和相对健康状况、所用化学实体的效力、给药途径和形式以及其它因素。药物可每天给药一次以上,如每天一次或两次。
本文所述的化合物(特别是SB-462795)或其药学上可接受的盐的治疗有效量可在约0.01至200mg/千克接受者体重/天的范围内;如约0.01-100mg/kg/天,例如约0.1至50mg/kg/天。因此,对于70kg人的给药,剂量范围可为约7-3500mg/天。
在某些实施方案中,如本文所述的化合物(更特别地SB-462795)或其药学上可接受的盐可经由鼻或口服途径局部给药。这包括通过吸入肺或鼻来施用本文所述的化合物。适于吸入局部给药的制剂包括液体或半液体制备剂(包括适于通过渗透通过鼻道和/或至肺或至炎症部位而吸入的制剂),包括如合适的滴剂的制剂。对于通过吸入的局部给药,活性成分可占按制剂的重量计0.001%至10%w/w,例如1%至2%。然而,它可以占制剂的多达10%w/w,但优选地占少于5%w/w,更优选地0.1%至1%w/w。
在某些实施方案中,滴剂可包含无菌水性或油性溶液剂或混悬剂,并且可通过将包含如本文所述的化合物(更特别地SB-462795)或其药学上可接受的盐的活性成分溶解在杀细菌剂和/或杀真菌剂和/或任何其他合适的防腐剂并优选地包括表面活性剂的合适水溶液中进行制备。然后,可通过过滤使所得的溶液澄清,转移至合适的容器中,然后将其密封,并通过高压灭菌或维持在98-100℃下灭菌,持续半小时。在实施方案中,用于与如本文所述的化合物(更特别地SB-462795)或其药学上可接受的盐混合的溶液可通过过滤灭菌并通过无菌技术转移至容器中。在实施方案中,适于包含在滴剂中的杀细菌剂和杀真菌剂的实例是硝酸苯汞或醋酸苯汞(0.002%)、苯扎氯铵(0.01%)和醋酸氯己定(0.01%)。适于制备油性溶液剂的溶剂包括甘油、稀释的醇和丙二醇。
本文的任何化合物均可肠胃外给药,即通过静脉内、肌内或皮下给药。肠胃外给药的皮下和肌内形式是通常优选的。用于这样的给药的适当剂型可通过常规技术进行制备。本文所述的任何化合物也可经吸入给药,即经鼻内和口腔吸入给药。用于这样的给药的适当剂型(如气雾剂制剂或定量吸入剂)可通过常规技术进行制备。在本发明的一个实施方案,本发明的任何化合物经由口腔吸入或鼻内给药进行递送。用于这样的给药的适当剂型(如气雾剂制剂或定量吸入剂)可通过常规技术进行制备。
本发明的实施方案提供了用于通过吸入如本文所述的化合物(更特别地SB-462795)或其药学上可接受的盐而给药的制剂,其使用合适的抛射剂(例如二氯二氟甲烷、三氯氟甲烷、二氯四氟乙烷、氢氟烷烃如四氟乙烷或七氟丙烷、二氧化碳、或其他合适的气体)从加压包装或喷雾器以气雾喷雾呈现形式递送。某些实施方案提供了使用加压气雾剂的吸入用制剂,其中剂量单位可通过提供阀以递送计量的量的如本文所述的化合物(更特别地SB-462795)或其药学上可接受的盐来确定。在某些实施方案中,用于吸入器或吹入器的例如明胶的胶囊和药筒可以配制成含有如本文所述的化合物(更特别地SB-462795)或其药学上可接受的盐与合适的粉末基料(如乳糖或淀粉)的粉末混合物。
本发明的某些实施方案提供了作为经吸入而局部递送至肺的干粉组合物的如本文所述的化合物(更特别地SB-462795)或其药学上可接受的盐。优选地,干粉组合物可例如存在于例如明胶的胶囊和药筒、或例如层压铝箔的泡罩中,以用于吸入器或吹入器中。在某些实施方案中,粉末共混物制剂含有如本文所述的化合物(更特别地SB-462795)或其药学上可接受的盐与合适的粉末基料(载体/稀释剂/赋形剂物质)如单糖、二糖或多糖(例如乳糖或淀粉)的吸入用粉末混合物。在某些实施方案中,在粉末组合物中使用乳糖是优选的。
在其它实施方案中,用于粉末组合物的每个胶囊或药筒通常可含有任选地与另一种治疗活性成分组合的20μg-10mg的如本文所述的任何化合物(更特别地SB-462795)或其药学上可接受的盐。替代地,用于粉末组合物的如本文所述的本发明的化合物(更特别地SB-462795)或其药学上可接受的盐可以在没有赋形剂的情况下提供。在实施方案中,包装/药物分配器是如储库式干粉吸入器(RDPI)、多剂量干粉吸入器(MDPI)和定量吸入器(MDI)的类型。
储库式干粉吸入器(RDPI)意指这样的吸入器:它具有适于包含多种(未计量剂量的)干粉形式的药物的储库形式包装,并且包括用于计量从储库到递送位置的药物剂量的装置。
在实施方案中,可以使用适于分配药物的药物分配器的定量吸入器(MDI),该药物包含气雾剂形式的如本文所述的化合物(更特别地SB-462795)或其药学上可接受的盐,其中药物包含在适于容纳基于抛射剂的气雾剂药物制剂的气雾剂容器中。在某些实施方案中,气雾剂容器可设置有用于向患者释放气雾剂形式的药物制剂的计量阀,例如滑动阀。在某些实施方案中,气雾剂容器可设计成在每次借助于阀致动时递送预定剂量的药物,阀可通过在容器保持固定时下压阀或者通过在阀保持固定时下压容器而打开。在实施方案中,计量体积通常为10至100μL,如25μL、50μL或63μL。
在某些实施方案中,阀可为滑动阀,其中打开/关闭机构包括密封环和可由密封环接纳的具有分配通道的阀杆,阀杆在环内从阀关闭位置到阀打开位置可滑动地移动,在该阀打开位置中,阀体的内部经由分配通道与阀体的外部连通。
在某些实施方案中,阀还可包括“易流气雾剂阀”,该易流气雾剂阀具有腔室以及延伸到该腔室中并且可相对于该腔室在分配与非分配位置之间移动的阀杆。该阀杆具有一定构型并且该腔室具有一定内部构型,使得在它们之间限定了计量的体积,并且使得在非分配位置与分配位置之间移动期间,该阀杆顺序地:(i)允许气雾剂制剂自由流入腔室,(ii)在阀杆的外表面与腔室的内表面之间限定了用于加压气雾剂制剂的封闭的计量体积,以及(iii)在不减小封闭的计量体积的体积的情况下,封闭的计量体积在腔室内移动,直到计量体积与出口通道连通,从而允许分配计量体积的加压气雾剂制剂。该类型的阀描述于美国专利5,772,085中。
多剂量干粉吸入器(MDPI)意指适于分配干粉形式的药物的吸入器,该药物包含如本文所述的化合物(更特别地SB-462795)或其药学上可接受的盐,其中药物包含在含有(或以其他方式携带)多个限定剂量(或其部分)的药物的多剂量包装内。在一个优选的实施方案中,载体具有泡罩包装形式,但是其也可例如包含基于胶囊的包装形式或载体,在其上已经通过包括印刷、涂装和真空包藏在内的任何合适的方法施加药物。
在如本文所述的药物的多剂量递送的实施方案中,包含如本文所述的化合物(更特别地SB-462795)或其药学上可接受的盐的干粉组合物的制剂可预先计量或在使用时计量。单位剂量装置的实例是旋转吸入器(Rotahaler)(参见美国专利4,353,656和5,724,959,它们的公开内容据此以引用方式并入)。
本发明的实施方案提供了配制为有效的药物鼻用组合物的如本文所述的化合物(更特别地SB-462795)或其药学上可接受的盐,其中药物易于递送至鼻腔的所有部分(目标组织),在该处它执行其药理学功能。在实施方案中,包含如本文所述的化合物(更特别地SB-462795)或其药学上可接受的盐的药物与目标组织保持接触相对长的时间段。优选地,药物与目标组织保持长时间接触。在实施方案中,包含如本文所述的化合物(更特别地SB-462795)或其药学上可接受的盐的药物能够抵抗鼻道中起到从鼻中移除颗粒的作用的力。这种称为“黏膜纤毛清除功能”的力被认为极其有效地以快速方式从鼻中移除颗粒,例如在颗粒进入鼻时起10-30分钟内。
本发明的实施方案提供了用于经吸入局部递送至肺的喷雾组合物,并且可以例如配制成水溶液剂或混悬剂,或者配制成使用合适的液化抛射剂从加压包装(如定量吸入器)递送的气雾剂。适于吸入的气雾剂组合物可为混悬剂或溶液剂,并且通常含有本文所述的化合物(优选地SB-462795)或其药学上可接受的盐,任选地与另一种治疗活性成分和合适的抛射剂组合,如碳氟化合物或含氢氯氟烃或它们的混合物,特别是氢氟烷烃,例如二氯二氟甲烷、三氯氟甲烷、二氯四氟乙烷,尤其是1,1,1,2-四氟乙烷、1,1,1,2,3,3,3-七氟-正丙烷或它们的混合物。二氧化碳或其它合适的气体也可用作抛射剂。气雾剂组合物可以不含赋形剂,或者可以任选地含有本领域公知的额外制剂赋形剂,如表面活性剂,例如油酸或卵磷脂和共溶剂(例如乙醇)。加压制剂通常保留在用阀(例如计量阀)封闭的罐(例如铝罐)中,该阀装配到设置有接口的致动器中。
本发明的一个实施方案提供了用于经吸入给药的SB-462795或其药学上可接受的盐的喷雾干燥的分散体制剂。用于经吸入给药的药物理想地具有受控的粒度。吸入支气管系统中的最佳粒度通常为1-10μm,优选地2-5μm。尺寸大于20μm的颗粒通常在吸入到达小气道时过大。为了实现这些粒度,如所生产的活性成分的颗粒可以通过常规方式(例如通过微粉化)来减小尺寸。可以通过空气分级或筛分来分离出期望的级分。合适地,颗粒将呈结晶形式。当采用赋形剂如乳糖时,一般来讲,赋形剂的粒度比本发明内的吸入药物大得多。当赋形剂是乳糖时,它通常以磨碎的乳糖存在,其中不超过85%的乳糖颗粒将具有60-90μm的MMD,并且不低于15%将具有低于15μm的MMD。鼻内喷雾剂可用水性或非水性媒介物配制,其中加入试剂如增稠剂、缓冲盐或酸或碱以调节pH、等渗调节剂或抗氧化剂。
用于雾化吸入的溶液可以用水性媒介物配制,其中加入试剂如酸或碱、缓冲盐、等渗调节剂或抗微生物剂。它们可以通过过滤或者在高压灭菌器中加热进行灭菌,或者作为非无菌产物提供。合适地,经吸入给药可以优选地针对呼吸道疾病的关注器官(即肺),并且在这样做时可减少需要向患者递送的有效剂量。此外,经吸入给药可以减少化合物的全身暴露,从而避免化合物在肺之外的效应。
以下实施例描述了支持如本文所述的本发明的方面和实施方案的方法和实验实施例。
生物学实施例
实施例1.组织蛋白酶的生化抑制
组织蛋白酶活性的抑制基本上如(B Votta等人,J.Bone Miner.Res.(2015)16,478)所述进行。将酶与在一端含有荧光标签且在另一端含有淬灭剂标签的肽底物一起孵育,并且通过荧光信号的增加来定量催化作用。在2% DMSO中的50mM MES pH 6.5、5mMEDTA、10mM半胱氨酸的反应缓冲液中,使用Cbz-Phe-Arg-AMC的底物。分析初始速度曲线的线性部分以生成稳态动力学常数。
表1.relacatib(SB-462795)的蛋白酶抑制剂活性(Ki,nM)(参见Yamashita J MedChem,2006 49,1597-1612)
实施例2.relacatib(SB-462795)对病毒的抑制
细胞
HeLa(CCL-2)、MRC5(CCL-171)、HFF(SCRC-1041)、Vero(CCL-81)、BHK-21(CCL-10)细胞购自美国典型培养物保藏中心(American Type Culture Collection)。将HeLa、Vero和HFF细胞在T225(Corning Life Sciences)烧瓶中的最小必需培养基(MEM,Corning LifeSciences)中培养,该最小必需培养基补充有10%胎牛血清(FBS,Hyclone,GE LifeSciences)、1% L-谷氨酰胺、10mM HEPES(Sigma Aldrich)、1%非必需氨基酸(ThermoFischer Scientific)和1%青霉素/链霉素(Corning)。HFF细胞还补充有丙酮酸钠溶液(Sigma Aldrich)。将MRC5和BHK-21细胞在T225(Corning)烧瓶中的补充有10%胎牛血清(FBS,Hyclone)的最小必需培养基(MEM,Corning Cellgro)中培养。近汇合培养物每3天传代和分裂,不超过16-19代。将细胞用0.25%胰蛋白酶/0.5mM EDTA溶液(Sigma Aldrich)分离,并在处理前24小时接种在用于剂量反应研究的测定板中(接种密度参见表2)。全血购自纽约血液中心(New York Blood Center),并且使用Ficoll Paque Plus(GEHealthcare)分离人PBMC。在指明的情况下,使用人CD14微珠(Miltenyi Biotec)进一步分离CD14阳性单核细胞。为了使细胞分化为巨噬细胞,将PBMC或CD14+单核细胞接种在10cm板中的RPMI 1640培养基(FisherScientific)中,该培养基补充有10%热灭活的FBS(ThermoFisher Scientific)和1%青霉素-链霉素(Corning),并在3天后用重组人粒细胞-单核细胞集落刺激因子(GM-CSF,10ng/ml)处理。两天后,用新鲜培养基和GM-CSF对细胞进行补充。在接种后六或七天,将细胞分离,计数,并且接种在96孔板(Greiner Bio-One)中用于doe反应研究。
基于细胞的感染测定:
在适当的生物控制条件下,在USAMRIID执行感染性病毒的实验。将病毒原液都准备好并且在USAMRIID进行表征。
使用自动Multidrop Combi分配器(ThermoFisher Scientific)在处理前20-24小时,将细胞以指定密度(表2)接种在384孔成像板(Aurora)或96孔板(Greiner Bio-One)中。将SB-462795以8-10种剂量测试,至少平行测定两次,以10-100μM起始,按2或3倍梯度稀释(各研究的起始浓度和稀释倍数参见表2)。使用HP D300数字分配器(Hewlett Packard),各剂量从100% DMSO中的10mM储液直接添加到测定孔中。将各孔中的最终DMSO浓度归一化为1%。在每个板上,十六个孔未感染病毒,并充当用于归一化的“无病毒”对照(0%病毒感染)。将额外的十六个孔用病毒感染,但仅用1% DMSO处理,并充当用于归一化的高感染对照(100%病毒感染)。在处理后两小时,将测定板转移至生物安全等级(BSL)-3或4的套件中,并以指定感染复数(MOI)接种指定病毒。MOI基于细胞的平均倍增时间(16小时)来计算,并且选择成在测定终点实现60-80%感染率。在病毒接种后,将测定板在37℃和5% CO
表2.relacatib(SB-462795)的广谱抗病毒活性.
EC
CC
高含量成像测定.
使用高含量成像(HCl)测定,通过在免疫荧光标记后测量病毒抗原产生来执行培养细胞中的病毒感染的检测和定量。采用以封闭缓冲液(含有3%BSA的1xPBS)稀释1,000倍的鼠或兔单克隆抗体(表3),将测定孔染色1小时。在孵育后,移除第一抗体,用1xPBS洗涤细胞3次。随后,将细胞与以封闭缓冲液稀释1,000倍的DyLight-488-缀合的山羊抗小鼠/兔IgG(ThermoFisher Scientific)一起孵育1小时。细胞核和细胞质分别用以1xPBS稀释的Draq5(HeLa和U2OS细胞;ThermoFisher Scientific)或者Hoechst和CellMask(ThermoFisher Scientific)染色。使用Perkin Elmer Opera共聚焦读板器,用10X空气物镜获取细胞图像,每孔采集5至15个图像。使用Acapella(Harmony)PE软件来分析获取的图像。将表现出高于所选阈值的抗原信号的细胞计数为对病毒感染呈阳性。使用病毒阳性细胞与分析细胞总数的比率来确定测定板中各孔的感染百分比。使用Genedata软件评估化合物对病毒感染的效应,并且计算为基于各板上的16个未感染的(0%感染)和16个DMSO处理过的(100%感染)对照孔的感染抑制百分比。计算各孔的所得感染抑制%,并用于剂量-反应曲线分析。多参数回归分析利用Levenberg-Marquardt算法来选择最佳模型和数据点排除。R
表3:用于剂量反应研究的第一抗体
SARS-CoV-2的抑制
抗病毒评价–Vero E6细胞中SARS-CoV1、SARS-CoV2和MERS的基于体外细胞的测定
申请人如下所述在Vero E6细胞中通过CPE测定来分别评价SB-462795(relacatib)和卡莫司他对SARS-CoV-1、SARS-CoV-2和MERS的抑制效应。
用于冠状病毒测定的材料和方法
SB-462795和卡莫司他以固体供应,并且以DMSO稀释至50mM或10mM储液并在4℃下储存直至测定当天。在所执行的各测定中包括一组阳性对照抗病毒化合物。
病毒株和细胞系
用于这些评价的病毒和细胞系分别获自WRCEVA和美国典型培养物保藏中心(ATCC)(随后分选和亚克隆高表达ACE2的细胞),如表4和表5所列。使用测量抗病毒效应的CPE减少测定以及测量化合物的细胞毒性效应的细胞活力测定(非GLP测定)来执行评价。在各测定的当天,从冷冻机(-80℃)中取出病毒的预滴定等分试样,并允许在生物学安全橱中解冻至室温。将病毒重悬并稀释到组织培养基中。使用标准细胞培养技术以及如下表5所指定的细胞培养基,将细胞以1:2至1:5的扩增倍数(split ratio)每周传代培养两次。使用Luna细胞活力分析仪和台盼蓝染料排除法来执行总细胞数和活力百分比测定。待用于测定的细胞的细胞活力大于95%(对于各测定,每孔接种的细胞数参见表5)。
表4.用于抗病毒评价的病毒株
BSL-生物安全等级
表5.用于抗病毒评价的细胞和培养基
1
2
3
材料:
1.Corning 3764BC黑壁、透明底部和Greiner 784076黑壁、低体积384板
2.Promega CellTiter Glo(CTG)(G7573,Promega)
3.培养基:
a.MEM Gibco(#11095)
b.HI FBS Gibco(#14000)
c.Pen/Strep Gibco(#15140);10U/ml青霉素和10ug/ml链霉素
4.PBS-/-(w/o Ca
5.胰蛋白酶-EDTA Gibco(#25300-054)
6.细胞-选择用于高ACE2表达的Vero E6细胞。
7.阳性对照:
a.钙蛋白酶抑制剂IV(Calbiochem#208724)
b.氯喹(申请人储存库)
c.瑞德西韦(Selleck)
设备:
1.Beckman FX
2.Echo和Thermo Combi液体处理系统
3.Matrix WellMate
4.Thermo Fisher Steri-Cult孵化器
5.酶标仪-Envision,Spectromax M2、M5或Gemini或PheraSTAR
化合物准备:
将化合物储液(50μL,10或50mM,在100% DMSO中)转移到空ECHO板(保种平板,stock plate)的孔中。通过将17μL的来自保种平板的各样品转移到在各孔中含有34μLDMSO的相邻孔中并混合,将化合物稀释3倍。重复该过程以创建8个以上连续稀释样品的孔,每个孔含有前一个孔的3倍稀释样品。使用ECHO555声学液体处理系统,将各样品的30nL等分试样分配到测定准备板的相应孔中。最终测定浓度范围如下:对于10mM储液,10-0.0005μM;对于50mM储液,50-0.003μM。向对照孔中添加DMSO以维持所有孔中0.1%的一致测定浓度。
用于测量化合物的抗病毒效应的方法:
使Vero E6细胞在补充有10% HI FBS的MEM中生长,并且在测定当天在补充有2%HI FBS的MEM/1% PS中收获。在BSL-2实验室中,通过向各孔中添加5μL测定培养基,准备好测试化合物预先加药的测定准备板。然后将板和细胞转到BSL3设施中。用适当的冠状病毒(SARS CoV-1、SARS CoV-2或MERS)以M.O.I.约0.002分批接种细胞,这导致了感染后72(对于SARS)或96(对于MERS)小时5%的细胞活力。将25μL的病毒接种的细胞等分试样(4,000个Vero E6细胞/孔)添加到测定板的第3-24列中的各孔。第23-24列中的孔仅含有病毒感染的细胞,用于0% CPE减少对照。在病毒接种之前,将25μL的细胞等分试样添加到各板的第1-2列中,用于仅细胞的100% CPE减少对照。在37℃/5%CO
用于测量化合物的细胞毒性效应的方法:
如下在BSL-2柜台隔屏(counter screen)中评估化合物细胞毒性:将培养基中的VeroE6细胞以25μl等分试样(4,000个细胞/孔)添加到用上述测试化合物准备好的测定准备板的各孔中。仅细胞(100%活力)和用100μM终浓度的海亚敏(hyamine)处理的细胞(0%活力)分别充当测定中细胞毒性效应的高和低信号对照。对于所有孔,将DMSO维持在恒定浓度,如由储备测试化合物浓度的稀释因子所决定。在37℃/5%CO
结果—Vero E6细胞中SARS-CoV1、SARS-CoV2和MERS的基于体外细胞的测定
参考化合物和供试品的汇总数据提供于表6-8和9-12中。表13显示了来自所有四个测定的综合数据。
表6.参考化合物在SARS-CoV-1CPE测定中的抗病毒活性
表7.参考化合物在SARS-CoV-2CPE测定中的抗病毒活性
表8.参考化合物在MERS CPE测定中的抗病毒活性(标准孵育)
表9.测试化合物在SARS-CoV-1CPE测定中的抗病毒活性
/>
表10.测试化合物在SARS-CoV-2CPE测定中的抗病毒活性
表11.测试化合物在MERS CPE测定中的抗病毒活性(标准孵育)
表12.测试化合物在MERS CPE测定中的抗病毒活性的比较(标准vs预孵育方法*)
*预孵育方法改良:将在25μL培养基中的未感染细胞添加到预先加药的测定准备板中并孵育四小时,然后添加培养基中稀释的5μL MERS病毒。
表13.测试化合物在SARS-CoV-1、SARS-CoV-2、MERS中的抗病毒活性的综合概述
如表6-12中所见和表13中所汇总,以及如图6A(relacatib)和图6B(卡莫司他)中所示,Relacatib分别在感染有SARS-CoV-1、SARS-CoV-2和MERS的Vero E6细胞中显示出0.23、0.02和0.60μM的IC
抗病毒评价:SARS-CoV-2在Calu-3细胞中的体外抑制
抗病毒评价—Calu3细胞中SARS-CoV-2的体外抑制(Operetta高内涵成像系统)
申请人如下所述在使用Calu3永生化人肺细胞的细胞测定中分别评价了SB-462795与卡莫司他和瑞德西韦相比对SARS-CoV-2的抑制效应:
SARS-CoV-2冠状病毒细胞测定方案
SB-462795(relacatib)和卡莫司他经由细胞测定进行测试,利用冠状病毒N蛋白和细胞核的表达作为成像的终点(分别为功效和毒性的指标)。使Calu3细胞(ATCC,HTB-55)感染SARS-CoV-2冠状病毒(βCoV/KOR/KCDC03/2020)。如下所示,虽然瑞德西韦和卡莫司他降低了N蛋白的表达,如免疫学所测量(参见表14),但relacatib在Calu-3细胞中没有可测量的SARS-CoV-2活性(比较图6A中的卡莫司他活性与图6B中的relacatib活性)。SB-462795在Calu-3细胞中不存在对SARS-CoV-2的抗病毒活性指示出,病毒使用了不受组织蛋白酶抑制剂relacatib影响的替代进入机制,可能是由于利用了SARS-CoV-2细胞表面的刺突蛋白的TMPRSS2依赖性加工,而不是SARS-CoV-2核内体中的组织蛋白酶依赖性刺突蛋白加工。在测定准备中,针对化合物浓度范围为0.0025至50μM的DMSO中的测试化合物,生成十点的三倍剂量反应曲线(DRC)。
在实验前24小时,将Calu-3细胞以2.0×10
在用MOI为0.03的SARS-CoV-2感染前,用浓度范围为0.0025至50μM的relacatib、卡莫司他或瑞德西韦处理细胞1至48小时。将反应孔中的DMSO归一化至0.5%的最终浓度。将板在37℃下孵育24小时,然后用4%多聚甲醛(PFA)、0.25%tritonX-100溶液固定。
在免疫荧光之前,添加抗-SARS-CoV-2核衣壳(N)第一抗体、488-缀合的山羊抗兔IgG第二抗体和Hoechst 33342。用Operetta高通量成像装置(Perkin Elmer)获取图像,并使用Columbus软件(Perkin Elmer)分析,以定量细胞数和感染率。对于Operetta终点,在各测定板中,将抗病毒活性归一化为感染对照(0.5% DMSO)。通过计数各孔中的细胞核并将其归一化为感染对照来测量细胞活力。IC
结果—Calu-3
表14
GSK-C:卡莫司他
GSK-D:relacatib
如可从表14看出,在表达TRPMSS2的Calu-3细胞中,relacatib对SARS-CoV-2没有活性,但是对于Calu-3细胞中的卡莫司他,实验1和实验2的IC
抗病毒评价:ALI模型中SARS-CoV-2的体外抑制
申请人如下所述使用人肺细胞在气液界面(ALI)测定中通过CPE测定来分别评价采用和不采用卡莫司他的情况下SB-462795对SARS-CoV-2的抑制效应:
使用原代人肺细胞在基本上如Randell,S.H和Fulcher,M.L.(编辑)在EpithelialCell Culture Protocols第八章中:第二版,Methods in Molecular Biology,vo.945,DOI10.1007/978-1-62703-125-7_8
结果—ALI模型
结果显示于图8A中。可以看出,与10μM瑞德西韦(RDV,图8A中)相比,卡莫司他(GSKC,图8A中)在4μM(较浅直立三角形)和10μM(较深直立三角形)下表现出剂量依赖性SARS-CoV-2抗病毒活性,而relacatib(GSKD,图8A中)在30μM(倒置三角形)或4μM(方形)下表现出基本上无活性。然而,与单独的relacatib或单独的卡莫司他相比,relacatib(30μM)与卡莫司他(4μM)的组合(菱形)在ALI研究中显示出对SARS-CoV-2增加的活性(参见图8A)。每个符号代表来自一种培养物的滴度。
图8B显示与瑞德西韦主要血浆代谢产物(方形)和星形孢菌素(阳性对照)(圆形)相比,如在ALI研究中所测量的relacatib(倒置三角形)、卡莫司他(直立三角形)以及relacatib与卡莫司他的组合(菱形)的细胞毒性。
序列表
SEQ ID NO:1:N1正向引物
5’GACCCCAAAATCAGCGAAAT 3’
SEQ ID NO:2:N1反向引物
5’TCTGGTTACTGCCAGTTGAATCTG 3’
SEQ ID NO:3:N1探针序列
5’FAM-ACCCCGCATTACGTTTGGTGGACC-BHQ-1 3’
SEQ ID NO:4:N2正向引物
5’TTACAAACATTGGCCGCAAA 3’
SEQ ID NO:5:N2反向引物
5’GCGCGACATTCCGAAGAA 3’
SEQ ID NO:6N2探针序列
5’FAM-ACAATTTGCCCCCAGCGCTTCAG-BHQ-1 3’
序列表
<110> 葛兰素史密斯克莱知识产权发展有限公司
亨利.M.杰克逊军事医学促进基金会
美国政府,由陆军部部长代表
<120> 用于防止或治疗病毒感染的组织蛋白酶抑制剂
<130> PU66872WO
<150> 63000487
<151> 2020-03-26
<160> 6
<170> PatentIn版本3.5
<210> 1
<211> 20
<212> DNA
<213> RT-PCR引物
<400> 1
gaccccaaaa tcagcgaaat 20
<210> 2
<211> 24
<212> DNA
<213> 人工序列
<220>
<223> RT-PCR引物
<400> 2
tctggttact gccagttgaa tctg 24
<210> 3
<211> 24
<212> DNA
<213> RT-PCR Probe
<400> 3
accccgcatt acgtttggtg gacc 24
<210> 4
<211> 20
<212> DNA
<213> RT-PCR引物
<400> 4
ttacaaacat tggccgcaaa 20
<210> 5
<211> 18
<212> DNA
<213> RT-PCR引物
<400> 5
gcgcgacatt ccgaagaa 18
<210> 6
<211> 23
<212> DNA
<213> RT-PCR探针
<400> 6
acaatttgcc cccagcgctt cag 23
