一种表达猫疱疹病毒蛋白的mRNA疫苗及其制备方法
文献发布时间:2024-04-18 20:01:23
技术领域
本发明涉及核酸疫苗领域,具体而言涉及一种表达猫疱疹病毒蛋白的mRNA疫苗及其制备方法。
背景技术
猫病毒性鼻气管炎(FVRs),又称猫传染性鼻气管炎,是由猫疱疹病毒(Felineherpesvirus,FHV)感染引起猫的一种急性、高度接触性传染病。FHV感染的典型临床症状是体温升高、打喷嚏、咳嗽、角膜结膜炎、鼻眼浆液性或脓性分泌物和眼周皮肤溃疡。在幼猫和成年猫中均可发生,主要感染2-4个月龄,发病率高达100%,成年猫不引起死亡,幼猫死亡率可达50%,是目前已知最严重的猫呼吸道疾病之一。1957年Crandell R.A于美国首次在患病幼猫体内分离得到FHV。随后在越南、荷兰、英国、日本、匈牙利等地分离到此病。之后我国多次检测并分离到该病毒,该病在我国呈上升趋势。受感染的猫会建立潜伏期,病毒粒子会潜伏于猫的三叉神经节和视神经节内等部位,在外界环境的刺激下容易引发再次感染,且间歇性向外排毒,不利于该病的防控。FHV属于属疱疹病毒科(herpesviridae)、α-疱疹病毒亚科(alpha herpesvirinae)、水痘疱疹病毒属(varicellovirus)成员,病毒粒子为有囊膜包裹、直径约为128-168nm的球形粒子。FHV是基因组长约126-134kb的线性双股DNA病毒。基因组是典型的D型DNA分子结构,由1个99kbp的长独特区(UL)和1个27Kbp的短独特区(US)组成,共包含78个开放型阅读框,UL区含有63个,US区含有12个,共编码74种蛋白质。其中gB、gC、gD、gE、gG、gH和gI 7种糖蛋白已得到鉴定,他们在病毒识别、侵入、导致感染,在细胞间传播和感染释放中发挥着重要作用。
gB蛋白是由UL27基因编码的949个氨基酸组成的囊膜糖蛋白,是FHV囊膜表面的重要组成部分,同时gB糖蛋白也是最主要的免疫抗原性蛋白,对于病毒入侵细胞、病毒复制、细胞融合以及在细胞间传播起着决定性作用。gB蛋白是疱疹病毒中高度保守的结构蛋白,其氨基酸序列比对分析结果表明,FHV与α-疱疹病毒亚科的其他成员具有较高的同源性,但不同病毒株之间存在一定的抗原差异gB主要介导病毒与宿主细胞的融合以及多核体的形成,与gC结合形成的糖蛋白复合物可以特异性识别宿主细胞肝素样受体。同时gB蛋白是可以刺激机体产生高水平的中和抗体、补体介导的抗体依赖性细胞溶解、抗体依赖性细胞毒性的靶抗原。
gD蛋白是病毒囊膜的主要成分,存在于感染的细胞膜上,具有高度的保守性和抗原性,能够与细胞表面的分子特异性结合。诱导机体产生细胞免疫和体液免疫,在病毒穿入易感细胞中起重要作用,是宿主细胞免疫和体液免疫反应的主要靶细胞之一。gD蛋白具有血凝特性,能产生血凝于血凝抑制反应。gD糖蛋白被认为是病毒粒子表面和病毒感染细胞的主要分子,此糖蛋白的单克隆抗体在病毒吸附后中和病毒,并显示出较高的中和效价,表明gD可能参与病毒进入细胞,并为病毒复制的必需基因。gD蛋白也是极为保守的免疫原性蛋白,作为研究疱疹病毒亚单位疫苗常选择的靶蛋白,具有较好的免疫原性。
相比传统疫苗,mRNA疫苗作为新型疫苗的形式,具有生产工艺简单、开发速度快、无需细胞培养、成本低。相较与DNA疫苗,mRNA疫苗无需进入细胞核,没有整合至宿主基因组的风险,半衰期可以通过修饰进行调整。mRNA疫苗可提供对适应性和先天免疫力的综合刺激,即原位抗原表达和危险信号传递;可以诱导“平衡”免疫反应,包括体液和细胞效应因子以及免疫记忆。
发明内容
本发明针对现有猫疱疹病毒疫苗产品中存在的不足,提供了一种预防或治疗的猫病毒性鼻气管炎病的表达猫疱疹病毒蛋白的mRNA疫苗制备方法及其应用,所述猫疱疹病毒蛋白为猫疱疹病毒gB蛋白或猫疱疹病毒gD蛋白。
本发明的技术方案:
一种重组mRNA合成质粒,包括质粒骨架序列、编码猫疱疹病毒gB蛋白的基因或编码猫疱疹病毒gD蛋白的基因;所述编码猫疱疹病毒gB蛋白的基因序列如SEQ ID NO.1所示,所述编码猫疱疹病毒gD蛋白的基因序列如SEQ ID NO.2所示;所述编码猫疱疹病毒gB蛋白的基因为缺失3’端第2440-2847位核苷酸序列,所述编码猫疱疹病毒gD蛋白的基因为缺失3’端第988-1125位核苷酸序列。
其中,猫疱疹病毒(Feline Herpesvirus,FHV)属于疱疹病毒科病毒(Herpesviridae),主要侵害2-4月龄幼猫,引起角膜结膜炎、鼻眼浆液性或脓性分泌物和眼周皮肤溃疡为主要症状。
其中,FHV的gB蛋白是最主要的免疫抗原性蛋白,是主要的抗体免疫点。由于gB蛋白属于跨膜蛋白,结构包含胞外区、跨膜区和胞内区,其中跨膜区和胞内区位于gB的羧基末端,不利于蛋白的可溶性表达,为此对gB蛋白基因第2440-2847位核苷酸序列进行缺失改造。FHV的gD蛋白是最主要的免疫抗原性蛋白,是主要的抗体免疫点。由于gD蛋白属于跨膜蛋白,结构包含胞外区、跨膜区和胞内区,其中跨膜区和胞内区位于gD的羧基末端,不利于蛋白的可溶性表达,为此对gD蛋白基因第988-1125位核苷酸序列进行缺失改造。
所述质粒骨架序列包括T7启动子序列、5’UTR区、3’UTR区和3’末端PolyA尾。重组mRNA合成质粒可构建于任意克隆载体,PolyA尾末端保留一个Bsa I限制性内切酶位点,用于质粒线性化制备。
优选的,所述限制性内切酶位点为BspQ I、Bsa I或Mlu I。
还包括甲病毒非结构蛋白基因编码区;所述甲病毒非结构蛋白基因编码区为非结构蛋白1-4基因编码区,编码猫疱疹病毒gB蛋白基因序列或编码猫疱疹病毒gD蛋白基因序列经过密码子优化;优选地,所述甲病毒为委内瑞拉马脑炎病毒(VEE)。VEE复制酶基因nsp1-4区,包含VEE病毒复制酶基因序列,表达的VEE病毒复制酶能够在体内合成mRNA,起到复制mRNA的功能。
本发明还提供了所述的重组mRNA合成质粒在制备预防猫疱疹病毒引起的猫病毒性鼻气管炎病的疫苗中应用。
本发明还提供了一种表达猫疱疹病毒蛋白的mRNA,包括5’UTR区、3’UTR区和3’末端PolyA尾、编码猫疱疹病毒gB突变蛋白或猫疱疹病毒gD突变蛋白的mRNA;所述猫疱疹病毒gB突变蛋白和猫疱疹病毒gD突变蛋白为缺失改造,猫疱疹病毒gB突变蛋白的氨基酸序列如SEQ ID NO.3所示,所述猫疱疹病毒gD突变蛋白的氨基酸序列如SEQ ID NO.4所示。
还包括委内瑞拉马脑炎病毒复制酶1-4编码区的mRNA。
优选的,还包含5’帽结构,所述5’帽结构为7-甲基鸟苷帽结构。
其中,表达gB蛋白的基因mRNA序列大小为2704bp(序列如SEQ ID NO.5所示),表达gB蛋白基因复制型mRNA序列大小为10215bp(序列如SEQ ID NO.7所示)。表达gD蛋白的基因mRNA序列大小为1186bp(序列如SEQ ID NO.6所示),表达gD蛋白基因复制型mRNA序列大小为8697bp(序列如SEQ ID NO.8所示)
本发明还提供了一种表达猫疱疹病毒蛋白的mRNA疫苗,包含所述表达猫疱疹病毒蛋白的mRNA。
目前,mRNA疫苗主要以两种序列结构存在,传统的非复制型mRNA序列和自扩增型(复制型)的mRNA疫苗序列。自扩增型mRNA序列含有复制酶基因,可在细胞内扩增mRNA,从而以较少的mRNA剂量生产较多的抗原。非复制型的mRNA疫苗结构简单,在人体内无法自我复制,需要成熟的优化工艺才能在较低的剂量诱发有效的免疫应答。
本发明还提供了所述的mRNA疫苗的制备方法,将所述表达猫疱疹病毒蛋白的mRNA与阳离子脂质、二硬脂酰基磷脂酰胆碱、聚乙二醇脂质和胆固醇混合制备成脂质纳米颗粒,通过微流控装置或混合透析后获得所述复制型mRNA疫苗。
具体步骤为:
(1)将所述重组mRNA合成质粒T7-gB或T7-gD使用限制性内切酶进行线性化处理;
(2)对线性化的T7-gB或T7-gD质粒利用T7启动子序列进行体外转录反应,提纯获得gB-mRNA或gD-mRNA;
(3)对获得gB-mRNA或gD-mRNA使用牛痘病毒加帽酶和2′-O-甲基转移酶通过酶法进行Cap加帽修饰反应,提纯获得cap-gB-mRNA或cap-gD-mRNA;
(4)加帽修饰的cap-gB-mRNA或cap-gD-mRNA与阳离子脂质(SM-102)、二硬脂酰基磷脂酰胆碱(DSPC)、胆固醇、聚乙二醇脂质(DMG-PEG2000)按照比例通过微流控装置或混合透析后获得LNP-gB-mRNA或LNP-gD-mRNA疫苗。
本发明还提供了所述猫疱疹病毒gB蛋白或猫疱疹病毒gD蛋白的mRNA疫苗作为预防猫疱疹病毒感染中的应用。使用LNP-gB-mRNA或LNP-gD-mRNA疫苗免疫后的动物体内存在针对猫疱疹病毒gB蛋白或猫疱疹病毒gD蛋白的特异性抗体,具有预防猫疱疹病毒感染的作用。
本发明的有益效果:
本发明制备了一种表达猫疱疹病毒gB蛋白或猫疱疹病毒gD蛋白的mRNA疫苗,构建包含猫疱疹病毒gB蛋白或猫疱疹病毒gD蛋白的mRNA载体质粒,并用于制备mRNA,结合脂质体包裹方案制备mRNA疫苗,并应用于猫疱疹病毒的免疫。该方法在猫疱疹病毒研究和疫苗创制上具有应用价值,能够大力推进疫苗的转化应用。
附图说明
图1为表达猫疱疹病毒gB基因的重组mRNA合成质粒T7-gB的示意图。
图2为表达猫疱疹病毒gD基因的重组mRNA合成质粒T7-gD的示意图。
图3为表达猫疱疹病毒gB基因的重组复制型mRNA合成质粒VEE-gB的示意图。
图4为表达猫疱疹病毒gD基因的重组复制型mRNA合成质粒VEE-gD的示意图。
图5为mRNA合成质粒T7-gB酶切线性化的琼脂糖凝胶电泳验证结果图;其中,M:DNAMaker,1:T7-FHV-gB质粒,2:T7-FHV-gB质粒酶切线性化。
图6为mRNA合成质粒T7-gD酶切线性化的琼脂糖凝胶电泳验证结果图;其中,M:DNAMaker,1:T7-FHV-gD质粒,2:T7-FHV-gD质粒酶切线性化。
图7为复制型mRNA合成质粒VEE-gB酶切线性化的琼脂糖凝胶电泳验证结果图;其中,M:DNA Maker,1:VEE-gB质粒,2:VEE-FHV-gB质粒酶切线性化。
图8为复制型mRNA合成质粒VEE-gD酶切线性化的琼脂糖凝胶电泳验证结果图;其中,M:DNA Maker,1:VEE-gD质粒,2:VEE-FHV-gD质粒酶切线性化。
图9为制备加帽修饰后的猫疱疹病毒gB蛋白cap-gB-mRNA的琼脂糖凝胶电泳验证结果图;其中,M:DNA Maker,1:T7-FHV-gB质粒,2:cap-gB-mRNA。
图10为制备加帽修饰后的猫疱疹病毒gD蛋白cap-gD-mRNA的琼脂糖凝胶电泳验证结果图;其中,M:DNA Maker,1:T7-FHV-gD质粒,2:cap-gD-mRNA。
图11为制备加帽修饰后的猫疱疹病毒gB蛋白复制型cap-VEE-gB-mRNA的琼脂糖凝胶电泳验证结果图;其中,M:DNA Maker,1:VEE-gB质粒,2:cap-VEE-gB-mRNA。
图12为制备加帽修饰后的猫疱疹病毒GD蛋白复制型cap-VEE-gD-mRNA的琼脂糖凝胶电泳验证结果图;其中,M:DNA Maker,1:VEE-gD质粒,2:cap-VEE-gD-mRNA。
图13为细胞转染cap-gB-mRNA表达猫疱疹病毒gB蛋白的间接免疫荧光法检测结果图。
图14为细胞转染cap-gD-mRNA表达猫疱疹病毒gD蛋白的间接免疫荧光法检测结果图。
图15为细胞转染cap-VEE-gB-mRNA表达猫疱疹病毒gB蛋白的间接免疫荧光法检测结果图。
图16为细胞转染cap-VEE-gD-mRNA表达猫疱疹病毒gD蛋白的间接免疫荧光法检测结果图。
图17为通过酶联免疫吸附测定免疫LNP-gB-mRNA疫苗后血清中gB蛋白特异性抗体水平的结果图。
图18为通过酶联免疫吸附测定免疫LNP-gD-mRNA疫苗后血清中gD蛋白特异性抗体水平的结果图。
图19为通过酶联免疫吸附测定免疫复制型LNP-VEE-gB-mRNA疫苗后血清中gB蛋白特异性抗体水平的结果图。
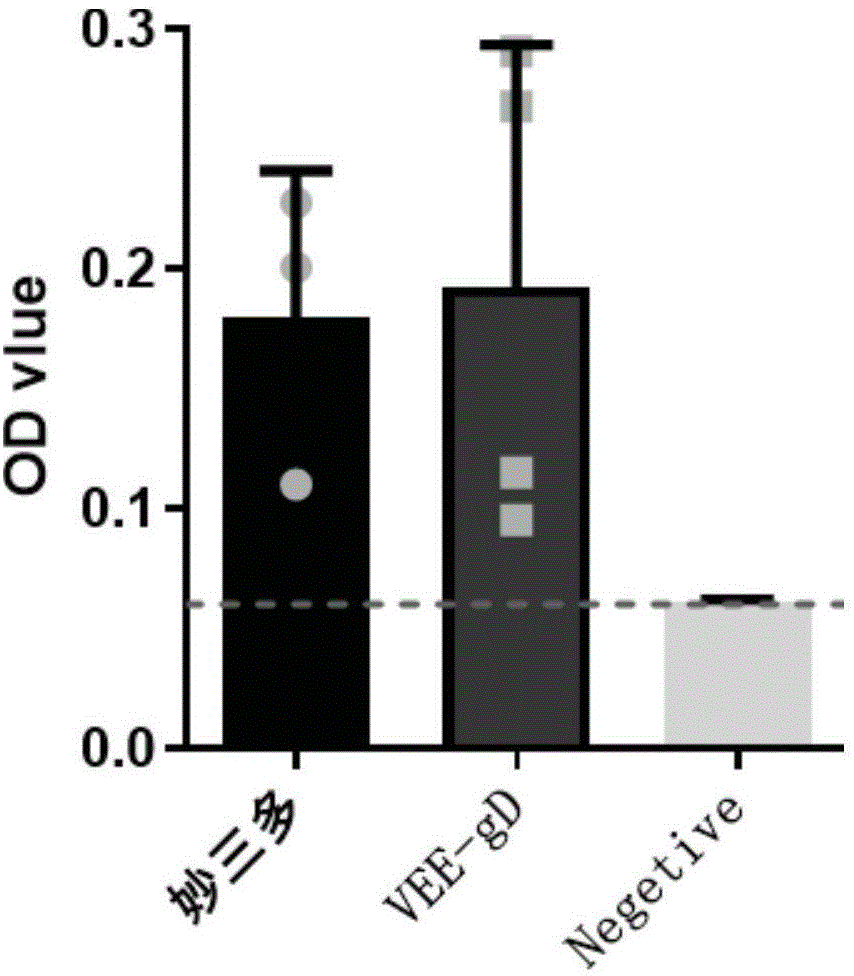
图20为通过酶联免疫吸附测定免疫复制型LNP-VEE-gD-mRNA疫苗后血清中gD蛋白特异性抗体水平的结果图。
具体实施方式
下面通过具体实施方式,对本发明的技术方案作进一步的详细说明,但并不因此将本发明限制在所述的实施例范围之中。
本发明针对猫疱疹病毒开发的mRNA疫苗,主要采用(1)制备加帽修饰的表达猫疱疹病毒gB蛋白或猫疱疹病毒gD蛋白的mRNA和复制型mRNA;(2)制备新型LNP-gB-mRNA或LNP-gD-mRNA疫苗,和LNP-VEE-gB-mRNA或LNP-VEE-gD-mRNA疫苗这两种方式。
实施例1构建猫疱疹病毒gB基因和猫疱疹病毒gD基因的重组mRNA和复制型mRNA合成质粒
猫疱疹病毒阳性的猫鼻拭子样本采集自中国广东省广州市某宠物医院于2021年6月收治患鼻气管炎的病猫。为提取猫疱疹病毒样本,通过DNA提取试剂盒提取病毒基因组DNA,使用引物序列如下:
FHV-gB-F:5’-ATGTCCACTCGTGGCGATCTTG-3’:
FHV-gB-R:5’-TTAGACAAGATTTGTTTCAGTA-3’;
FHV-gD-F:5’-ATGATGACACGTCTACATTT-3’;
FHV-gD-R:5’-TTAAGGATGGTGAGTTGTAT-3’;
通过PCR扩增获得gB基因序列(序列如SEQ ID NO.1所示)和gD基因序列(序列如SEQ ID NO.2所示)。
按照T7启动子序列、5’UTR区、编码缺失第2440-2847位核苷酸序列后的猫疱疹病毒gB蛋白(氨基酸序列如SEQ ID NO.3所示)的基因序列、3’UTR区和3’末端Poly(A)尾顺序构建于pUC克隆载体,基因合成猫疱疹病毒gB蛋白基因的重组mRNA合成质粒T7-FHV-gB,图谱如图1所示,序列如SEQ ID NO.17所示。其中Poly(A)尾末端存在一个Bsa I限制性内切酶位点,用于质粒线性化制备。
按照T7启动子序列、5’UTR区、编码缺失3’端第988-1125位核苷酸序列后的猫疱疹病毒gD蛋白(氨基酸序列如SEQ ID NO.4所示)基因、3’UTR区和3’末端Poly(A)尾顺序构建于pUC克隆载体,基因合成猫疱疹病毒gD蛋白基因的重组mRNA合成质粒T7-FHV-gD,图谱如图2所示,序列如SEQ ID NO.18所示。其中Poly(A)尾末端存在一个Bsa I限制性内切酶位点,用于质粒线性化制备。
按照T7启动子序列、5’UTR区、VEE复制酶基因nsp 1-4区、缺失3’端第2440-2847位核苷酸序列后密码子优化的猫疱疹病gB蛋白基因(将gB基因序列进行哺乳动物蛋白表达密码子序列优化)、3’UTR区和3’末端Poly(A)尾顺序构建于VEE克隆载体,构建获得复制型mRNA质粒VEE-gB,图谱如图3所示。其中Poly(A)尾末端存在一个Mlu I限制性内切酶位点,用于质粒线性化制备。
按照T7启动子序列、5’UTR区、VEE复制酶基因nsp 1-4区、缺失3’端第988-1125核苷酸序列后密码子优化的猫疱疹病gD蛋白基因(将gD基因序列进行哺乳动物蛋白表达密码子序列优化)、3’UTR区和3’末端Poly(A)尾顺序构建于VEE克隆载体,构建获得复制型mRNA质粒VEE-gD,图谱如图4所示。其中Poly(A)尾末端存在一个Mlu I限制性内切酶位点,用于质粒线性化制备。
质粒T7-FHV-gB、T7-FHV-gD、质粒VEE-gB或质粒VEE-gD保存于大肠杆菌T1感受态菌株中,随机挑取单个克隆,分别接种到200mL含有氨苄青霉素抗性的LB液体培养基中,37℃摇床培养,按照Omega质粒DNA大量试剂盒说明书提取所克隆获得的T7-FHV-gB质粒、T7-FHV-gD、质粒VEE-gB或质粒VEE-gD,测定浓度后保存使用。
实施例2体外转录制备gB-mRNA、gD-mRNA和复制型VEE-gB-mRNA、VEE-gD-mRNA
如图1所示,猫疱疹病毒gB蛋白基因的重组mRNA合成质粒T7-FHV-gB的Poly(A)尾末端保留一个Bsa I限制性内切酶位点,使用限制性内切酶Bsa I将载体质粒进行酶切线性化反应;如图2所示,猫疱疹病毒gD蛋白基因的重组mRNA合成质粒T7-FHV-gD的Poly(A)尾末端保留一个Bsa I限制性内切酶位点,使用限制性内切酶Bsa I将载体质粒进行酶切线性化反应;如图3所示,猫疱疹病毒gB蛋白基因的重组复制型mRNA合成质粒VEE-gB的Poly(A)尾末端保留一个Mlu I限制性内切酶位点,使用限制性内切酶Mlu I将载体质粒进行酶切线性化反应;如图2所示,猫疱疹病毒gD蛋白基因的重组复制型mRNA合成质粒VEE-gD的Poly(A)尾末端保留一个Mlu I限制性内切酶位点,使用限制性内切酶Mlu I将载体质粒进行酶切线性化反应。四种酶切线性化反应按照如下步骤操作:
(1)根据实施例1构建的T7-FHV-gB质粒、T7-FHV-gD质粒、VEE-gB质粒和VEE-gD质粒,通过Bsa I酶或Mlu I酶切线性化。
a)首先取25μg的T7-FHV-gB质粒或T7-FHV-gD质粒,37℃下用Bsa I酶切2h,配制的酶切反应体系如下:
取25μg的VEE-gB质粒或VEE-gD质粒,37℃下用Mlu I酶切2h,配制的酶切反应体系如下:
b)酶切后加入5μL的10%SDS溶液,使得SDS终浓度为0.5%;
c)加入0.5μL的20mg/μL的蛋白酶K,使得蛋白酶终浓度为50-100μg/mL;
d)37℃孵育1 h,后置于冰上,加入200μL无核酸酶水,300μL的Phenol/CHCl
e)在12000rpm转速下室温离心10min,吸取上清液,加入750μL无水乙醇,于-20℃冰箱静置30min;
f)在12000rpm转速下4℃离心15min,弃去上清液;
g)加入75%的乙醇1mL,在12000rpm转速下4℃离心5min,重复此步骤2次后弃去上清液,将离心管晾干;
h)加20μL无核酸酶水,溶解DNA,取1μL稀释10倍后测定线性化DNA浓度,保存于-20℃;
i)通过琼脂糖凝胶电泳验证质粒T7-FHV-gB、质粒T7-FHV-gD、质粒VEE-gB和质粒VEE-gD酶切线性化。
如图5所示,T7-FHV-gB质粒琼脂糖凝胶电泳条带大小要小于T7-FHV-gB酶切线性化DNA片段,证明T7-FHV-gB质粒线性化完成;
如图6所示,T7-FHV-gD质粒琼脂糖凝胶电泳条带大小要小于T7-FHV-gD酶切线性化DNA片段,证明T7-FHV-gD质粒线性化完成;
如图7所示,VEE-gB质粒琼脂糖凝胶电泳条带大小要小于VEE-gB酶切线性化DNA片段,证明VEE-gB质粒线性化完成;
如图8所示,VEE-gD质粒琼脂糖凝胶电泳条带大小要小于VEE-gD酶切线性化DNA片段,证明VEE-gD质粒线性化完成。
(2)以步骤(1)线性化DNA为模板,体外转录获得gB-mRNA、gD-mRNA、VEE-gB-mRNA和VEE-gD-mRNA。
利用mRNA合成质粒T7-FHV-gB、T7-FHV-gD、VEE-gB和VEE-gD目的基因上游的T7启动子,通过体外转录反应制备并表达目的基因猫疱疹病毒gB蛋白或猫疱疹病毒gD蛋白的mRNA。
a)首先取1~2μg的线性化T7-FHV-gB质粒、T7-FHV-gD质粒、VEE-gB质粒或VEE-gD质粒,37℃下用T7 RNA聚合酶合成mRNA,配制的体外转录反应体系如下:
b)体外转录体系在37℃下孵育4h,随后加入1μL DNase,37℃孵育15min,消化DNA模板;
c)通过Trizol法或亲和层析法提取gB-mRNA(序列如SEQ ID NO.5所示)、gD-mRNA(序列如SEQ ID NO.6所示)、VEE-gB-mRNA(序列如SEQ ID NO.7所示)或VEE-gD-mRNA(序列如SEQ ID NO.8所示),取1μL稀释10倍后测定mRNA浓度,保存于-80℃。
实施例3 mRNA加帽修饰反应制备cap-gB-mRNA、cap-gD-mRNA和复制型cap-VEE-gB-mRNA、cap-VEE-gD-mRNA
利用牛痘病毒加帽酶及相关组分,将7-甲基鸟苷帽结构加到mRNA的5’末端。使得mRNA更稳定、有利于转运和翻译。
a)体外转录获得的gB-mRNA、gD-mRNA、VEE-gB-mRNA或VEE-gD-mRNA,37℃下用牛痘病毒加帽酶和Cap 2′-O-甲基转移酶进行加帽修饰反应,配制的加帽修饰反应体系如下:
b)加帽修饰反应体系在37℃下孵育60min;
c)通过Trizol法或亲和层析法提取cap-gB-mRNA、cap-gD-mRNA、cap-VEE-gB-mRNA或cap-VEE-gD-mRNA,取1μL稀释10倍后测定mRNA浓度,保存于-80℃;
d)通过琼脂糖凝胶电泳验证加帽修饰后的猫疱疹病毒gB蛋白cap-gB-mRNA或cap-VEE-gB-mRNA,猫疱疹病毒gD蛋白cap-gD-mRNA或cap-VEE-gD-mRNA。
如图9所示,琼脂糖凝胶电泳显示mRNA的条带大小,T7-FHV-gB质粒作为对照,证明有效合成了猫疱疹病毒gB蛋白cap-gB-mRNA。
如图10所示,琼脂糖凝胶电泳显示mRNA的条带大小,T7-FHV-gD质粒作为对照,证明有效合成了猫疱疹病毒gD蛋白cap-gD-mRNA。
如图11所示,琼脂糖凝胶电泳显示mRNA的条带大小,VEE-gB质粒作为对照,证明有效合成了猫疱疹病毒gB蛋白复制型cap-VEE-gB-mRNA。
如图12所示,琼脂糖凝胶电泳显示mRNA的条带大小,VEE-gD质粒作为对照,证明有效合成了猫疱疹病毒gD蛋白复制型cap-VEE-gD-mRNA。
实施例4
免疫荧光实验检测转染cap-gB-mRNA和cap-VEE-gB-mRNA表达的猫疱疹病毒gB蛋白,免疫荧光实验检测转染cap-gD-mRNA和cap-VEE-gD-mRNA表达的猫疱疹病毒gD蛋白。
在细胞中转染cap-gB-mRNA或cap-VEE-gB-mRNA能够表达猫疱疹病毒gB蛋白,利用猫疱疹病毒gB蛋白的特异性抗体能够检测gB-mRNA或VEE-gB-mRNA的翻译有效;在细胞中转染cap-gD-mRNA或cap-VEE-gD-mRNA能够表达猫疱疹病毒gD蛋白,利用猫疱疹病毒gD蛋白的特异性抗体能够检测gD-mRNA或VEE-gD-mRNA的翻译有效,按照如下步骤操作:
a)在48孔板铺贴壁细胞如BHK-21,置于5%CO
b)取洁净的EP管,加入300μL的Opti-MEM培养基和4μL的DMRIE-C转染试剂,涡旋混匀,室温孵育30min,加入2μg的cap-gB-mRNA或cap-VEE-gB-mRNA,或者加入2μg的cap-gD-mRNA或cap-VEE-gD-mRNA,轻轻敲打混匀,孵育10min;
c)用Opti-MEM培养基将细胞清洗一遍,加入孵育好的混合物,24h后使用猫疱疹病毒gB蛋白或猫疱疹病毒gD蛋白的特异性兔多克隆抗体,通过间接免疫荧光检测gB蛋白或gD蛋白的表达情况;
其中gB蛋白的特异性兔多克隆抗体来源于使用gB蛋白多肽区段TPPKPTTDPTDMSDC和GKRRRGSRWQGHSGC合成肽偶联免疫新西兰大白兔制备获得的抗体血清;gD蛋白的特异性兔多克隆抗体来源于使用gD蛋白多肽区段KRSNDSRGESSGPNC和CDDDVPTAPPKGMNNQSV合成肽偶联免疫新西兰大白兔制备获得的抗体血清。
如图13所示,结果显示转染cap-gB-mRNA的BHK-21细胞在荧光显微镜下能够明显的观察到绿色荧光信号,表明cap-gB-mRNA能够有效表达猫疱疹病毒gB蛋白。
如图14所示,结果显示转染cap-gD-mRNA的BHK-21细胞在荧光显微镜下能够明显的观察到绿色荧光信号,表明cap-gD-mRNA能够有效表达猫疱疹病毒gD蛋白。
如图15所示,结果显示转染cap-VEE-gB-mRNA的BHK-21细胞在荧光显微镜下能够明显的观察到绿色荧光信号,表明cap-VEE-gB-mRNA能够有效表达猫疱疹病毒gB蛋白。
如图16所示,结果显示转染cap-VEE-gD-mRNA的BHK-21细胞在荧光显微镜下能够明显的观察到绿色荧光信号,表明cap-VEE-gD-mRNA能够有效表达猫疱疹病毒gD蛋白。
实施例5脂质纳米颗粒mRNA疫苗LNP-gB-mRNA、LNP-gD-mRNA和脂质纳米颗粒复制型mRNA疫苗LNP-VEE-gB-mRNA、LNP-VEE-gD-mRNA的制备
mRNA是带负电的生物大分子,难以通过被动运输穿过带负电细胞膜。脂质纳米颗粒(LNP)能够用来递送RNA,是mRNA疫苗的有效载药方式。
脂质纳米颗粒mRNA疫苗LNP-gB-mRNA、LNP-gD-mRNA或脂质纳米颗粒复制型mRNA疫苗LNP-VEE-gB-mRNA、LNP-VEE-gD-mRNA的制备,按照如下步骤操作:
a)将SM-102、DSPC、DMG-PEG2000和胆固醇按照摩尔比50:10:38.5:1.5,总质量为200μg的配方,溶于30μL无水乙醇中;
b)在涡旋的条件下,将该乙醇溶液快速注入90μL含有5μg实施例3制备获得的cap-gB-mRNA、cap-gD-mRNA、cap-VEE-gB-mRNA或cap-VEE-gD-mRNA的20mM醋酸钠缓冲液中,剧烈搅拌20s,然后静置10分钟,制得纳米颗粒;
c)将制得的含有纳米颗粒的乙醇醋酸钠混合溶液,在10mM的PBS溶液中透析2~4小时除去乙醇,经过超滤浓缩后得到最终产品LNP-gB-mRNA、LNP-gD-mRNA、复制型LNP-VEE-gB-mRNA、LNP-VEE-gD-mRNA。
实施例6猫疱疹病毒蛋白的mRNA疫苗LNP-gB-mRNA、LNP-gD-mRNA和复制型mRNA疫苗LNP-VEE-gB-mRNA、LNP-VEE-gD-mRNA免疫实验
通过实施例3制备的cap-gB-mRNA或复制型cap-VEE-gB-mRNA,或者cap-gD-mRNA或复制型cap-VEE-gD-mRNA能够有效表达猫疱疹病毒gB蛋白或猫疱疹病毒gD蛋白,结合实施例5脂质纳米颗粒mRNA疫苗的制备方法,制备猫疱疹病毒蛋白的LNP-gB-mRNA疫苗、LNP-gD-mRNA疫苗、复制型LNP-VEE-gB-mRNA疫苗或复制型LNP-VEE-gD-mRNA疫苗,通过免疫实验检测疫苗效果。
LNP-gB-mRNA疫苗、LNP-gD-mRNA疫苗、复制型LNP-VEE-gB-mRNA疫苗或复制型LNP-VEE-gD-mRNA疫苗的免疫效用评估,按照如下步骤操作:
a)将12只6周龄的雌性BALB/c品系小鼠随性等分为3组(阴性对照组,LNP-gB-mRNA疫苗组(或LNP-gD-mRNA疫苗、复制型LNP-VEE-gB-mRNA疫苗、复制型LNP-VEE-gD-mRNA疫苗)和妙三多疫苗组),BALB/c小鼠在第0天和第30天以5μg/只肌内途径注射LNP-gB-mRNA疫苗(或LNP-gD-mRNA疫苗、复制型LNP-VEE-gB-mRNA疫苗、复制型LNP-VEE-gD-mRNA疫苗),或现有妙三多灭活疫苗;
b)第二次免疫后的第7天,通过眼眶途径采血,收集采集的血清样品;
c)通过双抗一步夹心法酶联免疫吸附试验测定免疫LNP-gB-mRNA疫苗LNP-gD-mRNA疫苗、复制型LNP-VEE-gB-mRNA疫苗或复制型LNP-VEE-gD-mRNA疫苗后血清中gB蛋白特异性抗体水平:预先包被猫疱疹病毒抗原的包被微孔中,依次加入血清样品、HRP标记的检测抗体,经过温育并彻底洗涤。用底物TMB显色,并在1M硫酸的作用下转化成最终的黄色,用酶标仪在450nm波长下测定吸光度(OD值)。
如图17所示,判定样品中猫疱疹病毒特异性抗体水平。免疫过LNP-gB-mRNA疫苗组,和妙三多对照组相比分别产生不同水平的猫疱疹病毒特异性抗体,其中妙三多对照组抗体相对水平较高,因此通过免疫表达猫疱疹病毒gB蛋白的mRNA疫苗能够有效激活体液免疫,产生猫疱疹病毒特异性抗体。
如图18所示,判定样品中猫疱疹病毒特异性抗体水平。免疫过LNP-gD-mRNA疫苗组,和妙三多对照组相比分别产生不同水平的猫疱疹病毒特异性抗体,其中妙三多对照组抗体相对水平较高,因此通过免疫表达猫疱疹病毒gD蛋白的mRNA疫苗能够有效激活体液免疫,产生猫疱疹病毒特异性抗体。
如图19所示,判定样品中猫疱疹病毒特异性抗体水平。免疫过LNP-VEE-gB-mRNA疫苗组,和妙三多对照组相比分别产生不同水平的猫疱疹病毒特异性抗体,其中LNP-VEE-gB-mRNA疫苗组抗体相对水平较高,因此通过免疫表达猫疱疹病毒gB蛋白的复制型mRNA疫苗能够有效激活体液免疫产生猫疱疹病毒特异性抗体。
如图20所示,判定样品中猫疱疹病毒特异性抗体水平。免疫过LNP-VEE-gD-mRNA疫苗组,和妙三多对照组相比分别产生不同水平的猫疱疹病毒特异性抗体,其中LNP-VEE-gD-mRNA疫苗组抗体相对水平较高,因此通过免疫表达猫疱疹病毒gD蛋白的复制型mRNA疫苗能够有效激活体液免疫产生猫疱疹病毒特异性抗体。
- 车险续保的处理方法、装置及相关设备
- 车险案件中从图片区分多车的处理方法、装置及电子设备
