一种自然杀伤细胞的冻存制剂组合物
文献发布时间:2024-04-18 20:02:18
技术领域
本发明属于细胞工程领域,涉及冻存制剂组合物,具体地,涉及自然杀伤细胞的冻存制剂组合物。
背景技术
利用液氮冻存各种哺乳动物细胞,是当前应用较广的一种方法,然而细胞冻融过程对所有细胞和组织都有一定伤害。
细胞内保护剂的作用机制为保护剂自由进入细胞,取代水,使冰点下降,作为盐的二次溶剂,提高细胞膜对水的通透性。但是,部分低温保护剂在缓慢冷冻过程中(尤其是在室温下)虽然会保护细胞,却也会使细胞具有毒性。因为血清可以降低细胞毒性,目前冻存液中会含有血清;然而血清并不是完美的成分,因为血清中含有生长因子激素等,增加污染几率且成本较大,所以不推荐临床应用。采用甲基纤维素、右旋糖酐等替代血清;其不仅对细胞有保护性,且化学成分明确,较易向临床推广。
自然杀伤细胞(natural killer cells,NK cells)是天然免疫细胞的重要组成部分,与T细胞不同,缺少表面的T细胞受体(T cell receptors,TCRs),不会引发移植物抗宿主疾病(graft-versus-host disease,GVHD)反应,因此,NK细胞被认为是“现成的”细胞治疗产品,可以提前制备冻存备用,即可根据多个病人的需要进行优化和分配。这一应用前景得到临床级的多种来源的NK细胞制备方法的支持,包括外周血、脐带血和脐带血诱导多能干细胞(induced pluripotent stem cells,iPSCs)。NK细胞属于先天性淋巴样细胞家族,在人类外周血、骨髓和组织中,NK细胞可以通过表面TCR和相关的CD3分子的缺失,以及CD56的表达来鉴定。自然杀伤细胞(NK)在宿主抗肿瘤免疫中具有重要作用。
免疫细胞冻存液制剂相关专利申请中的冻存液制剂配方的缓冲液主要有注射用生理盐水、勃脉力A或其它复方电解质溶液。其中专利中采用培养基或血清来保护低温保存的细胞,冻存液中其它试剂包括DMSO、右旋糖酐40、海藻糖、维生素C、人血白蛋白、丙二醇、香菇多糖、甘油、IL-2、聚乙二醇、白酒草皂苷R、羟乙基淀粉、葡萄糖、拟缺香茶菜酮、非必需氨基酸,乙酰胺、茶多酚、甲基纤维素、谷胱甘肽、丙酮酸钠,gamma聚谷氨酸、珍珠草提取液、多元醇、氯化钙、氯化钾、乳酸钠、纤维蛋白原,且在试验阶段,尚未用于临床。
不同细胞的特异性差异非常大,采用现有的冻存液配方冻存自然杀伤细胞达不到理想的保存效果。不同的细胞需要不同的保护剂,而且要求的浓度也不尽相同。现有技术中自然杀伤细胞的制剂配方中含有培养基或血清,达不到临床级别的应用要求。
目前亟需一种针对自然杀伤细胞,可应用于临床的冻存液。
发明内容
本发明提供一种自然杀伤细胞的冻存制剂组合物,所述冻存制剂组合物包括CS10、右旋糖酐40、人血白蛋白(HSA)与复方电解质,所述复方电解质选自复方电解质注射液(Ⅰ)或复方电解质注射液(Ⅱ),复方电解质注射液(Ⅰ)选自氯化钠、葡萄糖酸钠、醋酸钠、氯化钾与氯化镁中的几种;复方电解质注射液(Ⅱ)选自氯化钠、氯化钾、氯化钙、氯化镁、醋酸钠、L-苹果酸、氢氧化钠中的几种。
进一步地,所述右旋糖酐40为右旋糖酐40氯化钠注射液。
进一步地,所述冻存制剂组合物包括体积百分含量50%~75%CS10、质量浓度0.5%~1.5%右旋糖酐40、质量浓度1.0%~5.0%人血白蛋白(HSA)与复方电解质。
进一步地,所述冻存制剂组合物包括体积百分含量为50%的CS10,质量浓度为1.5%的右旋糖酐40,质量浓度为5%的人血白蛋白,缓冲液为复方电解质。
进一步地,所述复方电解质浓度为质量百分含量为0.526%的氯化钠、质量百分含量为0.502%的葡萄糖酸钠、质量百分含量为0.368%的醋酸钠、质量百分含量为0.037%的氯化钾和质量百分含量为0.030%的氯化镁。
本发明还提供如上所述的任一自然杀伤细胞的冻存制剂组合物的制备方法,其特征在于,在室温下,无菌环境避光,依次加入复方电解质、CS10、右旋糖酐40、HSA,混匀。
进一步地,每mL所述冻存液中包含3×10
进一步地,在等于或低于零下130℃的液氮气相或液相中保存不低于6个月
本发明选择CS10,及临床级别的Dextran 40和人血白蛋白(HSA),制备出一种用于自然杀伤细胞在液氮中至少保存不低于6个月的冻存制剂。
本发明通过正交试验,筛查出对自然杀伤细胞效果最好的冻存制剂组合物。
本发明对自然杀伤细胞有保护作用的冻存制剂组合物可静脉输注应用于临床,不含血清和培养基成份。
本发明的冻存制剂对于自然杀伤细胞冻存6个月后,细胞活力无明显变化,表型中NK细胞比例升高,对靶细胞杀伤能力提高。
附图说明
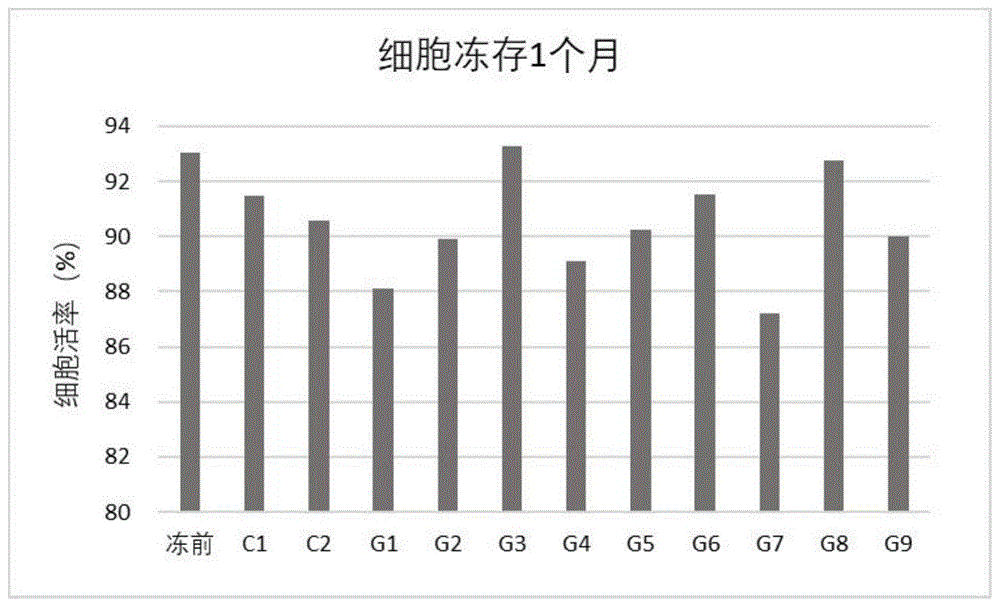
图1为NK细胞(自然杀伤细胞)冻存前和冻存1个月后细胞活力变化。
图2为NK细胞冻存前和冻存2个月后细胞活力变化。
图3为NK细胞冻存前和冻存3个月后细胞活力变化。
图4为NK细胞冻存前和冻存4个月后细胞活力变化。
图5为NK细胞冻存前和冻存5个月后细胞活力变化。
图6为NK细胞冻存前和冻存6个月后细胞活力变化。
图7为NK细胞冻存前与冻存1个月后比例变化。
图8为NK细胞冻存前与冻存2个月后比例变化。
图9为NK细胞冻存前与冻存3个月后比例变化。
图10为NK细胞冻存前与冻存4个月后比例变化。
图11为NK细胞冻存前与冻存5个月后比例变化。
图12为NK细胞冻存前与冻存6个月后比例变化。
图13为T细胞冻存前与冻存1个月后比例变化。
图14为T细胞冻存前与冻存2个月后比例变化。
图15为T细胞冻存前与冻存3个月后比例变化。
图16为T细胞冻存前与冻存4个月后比例变化。
图17为T细胞冻存前与冻存5个月后比例变化。
图18为T细胞冻存前与冻存6个月后比例变化。
图19为冻存前与冻存1个月后NK细胞对H358肿瘤靶细胞的杀伤率变化。
图20为冻存前与冻存2个月后NK细胞对H358肿瘤靶细胞的杀伤率变化。
图21为冻存前与冻存3个月后NK细胞对H358肿瘤靶细胞的杀伤率变化。
图22为冻存前与冻存4个月后NK细胞对H358肿瘤靶细胞的杀伤率变化。
图23为冻存前与冻存5个月后NK细胞对H358肿瘤靶细胞的杀伤率变化。
图24为冻存前与冻存6个月后NK细胞对H358肿瘤靶细胞的杀伤率变化。
具体实施方式
以下实施例进一步说明本发明的内容,但不应理解为对本发明的限制。在不背离本发明精神和实质的情况下,对本发明方法、步骤或条件所作的修改或替换,均属于本发明的范围。
自然杀伤细胞(Natural killer cells,NK cells),是人体天然免疫细胞中的重要组分,NK细胞可以通过表面TCR和相关的CD3分子的缺失,以及CD56的表达来鉴定,在宿主抗肿瘤免疫中具有重要作用。
右旋糖酐40(Dextran40),是细胞的非穿透性保护剂,在细胞冻存过程中起到保护作用。
人血白蛋白(Human serum albumin,HSA),在细胞冻存过程中,对其细胞起保护作用。
CS10是一种独特配方的无血清,无动物成分的明确冷冻保存培养基,其中含有10%二甲基亚砜(DMSO);
试验用试剂:
人血白蛋白静脉输注溶液,10g/瓶(20%,50mL),购自杰特贝林;
CS10购自上海华雅思创生物科技有限公司;
复方电解质购自上海百特医疗用品有限公司;
右旋糖酐40氯化钠注射液购自山东齐都药业有限公司。
实施例1
体积百分含量为50%的CS10,质量浓度为1.0%的人血白蛋白,质量浓度为0.5%的右旋糖酐40氯化钠注射液,缓冲液为复方电解质注射液。
在室温下,在无菌工作台内避光配置冻存制剂,分别将复方电解质溶液、
实施例2
体积百分含量为50%的CS10,质量浓度为2.5%的人血白蛋白,质量浓度为1.0%的右旋糖酐40氯化钠注射液,缓冲液为复方电解质注射液。
制备方法同实施例1
实施例3
体积百分含量为50%的CS10,质量浓度为5.0%的人血白蛋白,质量浓度为1.5%的右旋糖酐40氯化钠注射液,缓冲液为复方电解质注射液。
制备方法同实施例1实施例4
体积百分含量为60%的CS10,质量浓度为1.0%的人血白蛋白,质量浓度为1.0%的右旋糖酐40氯化钠注射液,缓冲液为复方电解质注射液。
制备方法同实施例1
实施例5
体积百分含量为60%的CS10,质量浓度为2.5%的人血白蛋白,质量浓度为1.5%的右旋糖酐40氯化钠注射液,缓冲液为复方电解质注射液。
制备方法同实施例1
实施例6
体积百分含量为60%的CS10,质量浓度为5.0%的人血白蛋白,质量浓度为0.5%的右旋糖酐40氯化钠注射液,缓冲液为复方电解质注射液。
制备方法同实施例1
实施例7
体积百分含量为75%的CS10,质量浓度为1.0%的人血白蛋白,质量浓度为1.5%的右旋糖酐40氯化钠注射液,缓冲液为复方电解质注射液。
制备方法同实施例1
实施例8
体积百分含量为75%的CS10,质量浓度为2.5%的人血白蛋白,质量浓度为0.5%的右旋糖酐40氯化钠注射液,缓冲液为复方电解质注射液。
制备方法同实施例1
实施例9
体积百分含量为75%的CS10,质量浓度为5.0%的人血白蛋白,质量浓度为1.0%的右旋糖酐40氯化钠注射液,缓冲液为复方电解质注射液。
制备方法同实施例1
对照例1(C1)
采用CS10(Stemcell,
对照例2(C2)
体积百分含量为10%DMSO,质量浓度为1%的右旋糖酐40(Dextran 40),缓冲液为复方电解质注射液。
在室温下,在无菌工作台内避光配置冻存制剂,分别将复方电解质溶液、Dextran40、DMSO依次加入,每加入其一后轻轻晃动混匀。
冻存液成分各组之间的浓度作用可能存在交互作用,为此设计了冻存液中CS10、Dextran与HSA三种成分不同浓度水平之间的正交实验,各因素浓度水平如表1所示,CS10浓度范围为50%~75%,Dextran40的浓度范围为0.5%~1.5%,HSA的浓度范围为1.0%~5.0%。如表2所示,实施例1至实施例9的冻存制剂组合物的9组组合。
表1正交实验三因素三水平表
表2 L9(3
试验例1
冻存液的配置:在生物安全柜中,避光环境下,按表1和表2配置冻存液,备用。
NK细胞洗涤和收集:收获期的细胞原液计数后,将200mL NK细胞悬液转移至250mL离心管中,2000g,室温,离心10min,弃掉上清液;用100mL 0.9%生理盐水重悬细胞,2000g,室温,离心10min,弃掉上清液;重复用0.9%生理盐水洗涤一次,加入培养好的冻存液,分装至2mL冻存管中,细胞密度为1×10
降温冻存细胞:将NK细胞洗涤,之后加入冻存液,然后以-1℃/min速率梯度降温至-80℃,再以-5℃/min速率梯度降温至-130,然后转移至液氮中保存。
检测冷冻后细胞活力变化
细胞活力检测方法:冻存的细胞从液氮中取出后,立即放入37度水浴锅中溶解细胞,待细胞刚刚溶解后,立即从水浴锅中取出,酒精擦拭细胞管,在无菌超净台内将冻存管中的细胞转移至已备好的复方电解质溶液中(50mL离心管中备有10mL复方电解质溶液),混合均匀后,取10μL细胞悬液加入10μL ViaStain
如图1-6所示,NK细胞冻存前细胞活力值为93.05%,冻存6个月,每个月细胞复苏后,各组细胞活力均有不同程度的降低,实施例3的G3组、与实施例8的G8组细胞的活力分别为90.32%,和85.59%,两组之间差异无统计学意义(P>0.05),且与冻存前细胞活力无明显差异(P>0.05)。
试验例2
冻存后对细胞表型影响
细胞表型为CD3-CD56+是NK细胞,细胞表型为CD3+CD56-的为T细胞,通过检测表型来确定NK细胞与T细胞在细胞群中的比例。如图7-12所示,冻存前NK细胞的比例为85.2%,冻存6个月,每个月复苏检测检测后发现,不同组中NK细胞比例都略有升高,细胞冻存6个月后复苏检测发现,NK细胞比例上升至91%~93%,实施例3的G3组NK细胞比例最高,为92.19%。如图13-18所示,冻存前T细胞比例为4.09%,冻存1-6月后具有不同程度的降低,冻存6个月后细胞复苏检测发现,T细胞比例在1%~2%之间;其中实施例3的G3组T细胞比例最低,为1.27%。
可以解释为,细胞群中除NK细胞外的其它细胞死亡后,NK细胞的比例相对上升,因此本发明的冻存液对于NK细胞有保护作用。
试验例3
冻存后对靶细胞杀伤的影响
如图19-24所示,当效靶比为10:1时,冻存前NK细胞对肺癌肿瘤细胞中的靶细胞358的杀伤效率为71%。冻存1-6个月后,不同组对靶细胞的杀伤效率相比于冻存前有的升高,有的降低。其中实施例的G2组和实施例3的G3组冻存1-4个月复苏后对靶细胞的杀伤效率与对照组相比略有升高,细胞冻存4个月复苏后,G3组最高,为75.38%,其原因可能为冻存后NK细胞比例升高所致。细胞冻存5-6个月后复苏检测对肿瘤靶细胞的杀伤,杀伤效率略有降低,细胞冻存6个月后,G3组对肿瘤靶细胞的杀伤效率为64.58%,是细胞冻存前对肿瘤靶细胞杀伤效率的90.96%。
综上所述,NK细胞的冻存液优选实施例为50%CS10+5%HSA+1.5%Dextran 40。相比于冻存前,NK细胞经冻存6个月后结果显示,细胞活率无变化,NK细胞比例略升高,T细胞比例降低,冻存1-4个月对靶细胞的杀伤功能略有升高,冻存至5-6个月,对靶细胞的杀伤效率略有降低。
虽然,上文中已经用一般性说明、具体实施方式及试验,对本发明作了详尽的描述,但在本发明基础上,可以对其作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
- 枸橼酸在制备帕瑞昔布钠冻干制剂组合物中的应用及其组合物和制备方法
- 一种利用蛋白酶抑制剂提高拟南芥幼苗玻璃化法冻存效果的方法
- 一种牙周膜干细胞冻存液及其冻存方法
- 一种小肠黏膜干细胞冻存液及冻存方法
- 一种脂肪颗粒组织冻存液及其配制方法和冻存方法
- 一种冻存液组合物、冻存液及类器官冻存方法
- 一种冻存液组合物、冻存液及类器官冻存方法
