用于预防或治疗非酒精性脂肪肝病的含有GPR119配体作为活性成分的药物组合物
文献发布时间:2023-06-19 10:58:46
技术领域
本发明涉及用于预防或治疗非酒精性脂肪肝病的药物组合物、食品组合物和饲料组合物,其包含GPR119(G蛋白偶联受体119)配体作为有效成分;涉及用于治疗和改善非酒精性脂肪肝病的方法;或所述组合物在预防或治疗非酒精性脂肪肝病中的用途。
背景技术
脂肪肝是其中甘油三酯在肝细胞中过度积累的病理状态,在医学上定义为其中甘油三酯占肝重的5%或更多的状态。根据脂肪肝是否由过量酒精摄入引起,脂肪肝分为酒精性脂肪肝和非酒精性脂肪肝。非酒精性脂肪肝病(non-alcoholic fatty liver disease;NAFLD)是涵盖该疾病的范围从非酒精性脂肪肝到脂肪性肝炎和肝硬化的所有方面的一组疾病。单纯性非酒精性脂肪肝(non-alcoholic fatty liver)(仅在肝脏中有脂肪沉积,并且表现为因胰岛素抗性等导致肝脏组织中的脂肪沉积增加,而无任何肝细胞损伤和纤维化的发现)可发展为非酒精性脂肪性肝炎(non-alchoholic steatohepatitis;NASH)(伴有因氧化应激引起的炎症应答所导致的肝细胞损伤,有时还伴有纤维化),并且可能发展为肝硬化(liver cirrhosis)(如果治疗不当,则会伴随不可逆的肝损伤)。
近来,全世界非酒精性脂肪肝的患病率迅速上升,单纯性脂肪肝的患病率估计为6.3~33%,据报道非酒精性脂肪性肝炎伴发炎症的患病率为3~5%(Hepatology,2012(55):2005-2023)。单纯性脂肪肝非常缓慢地发展为严重的肝病,不会增加与肝病相关的死亡率,但是脂肪性肝炎可能会导致肝硬化和肝癌,并且会增加与肝病相关的死亡率以及整体死亡率。此外,如果通过改变一般生活习惯使体重减轻3~5%,则单纯性脂肪肝可能会容易地得到改善,不过建议使体重减轻至少10%,以减少炎症。然而,尚不清楚这种体重减轻是否可使得肝脏的炎症和纤维化改善(Korean J Gastroenterol,2012(60):64-66)。
迄今为止,还没有用于非酒精性脂肪性肝炎的治疗剂。如果疾病恶化,则进行肝移植。根据美国统计数据,截至2013年,丙型肝炎被认为是肝移植的最常见原因,其次是非酒精性脂肪性肝炎。此外,从2004年开始的10年中,针对丙型肝炎的肝移植增长率为14%,而针对非酒精性脂肪性肝炎的肝移植增长率为170%,呈快速增长,并且从2020年起NASH也预期成为肝移植的第一原因,超过丙型肝炎,因此迫切需要开发一种有效的治疗剂,以用于包括非酒精性脂肪性肝炎的非酒精性脂肪肝病。
目前,用于非酒精性脂肪性肝炎的药物疗法包括使用胰岛素抗性增强剂(例如吡格列酮)或抗氧化剂(例如维生素E)的方法,其中脂肪积累和炎症改善的发现已通过对非酒精性脂肪性肝炎患者的小规模临床试验得以证实。然而,这种方法未能表现出明显的改善炎症和纤维化的效果,并且由于长期使用的安全性考虑,仍然不可能提供这些药物作为强化治疗选择。
GPR119(G蛋白偶联受体119)分布在小肠的L细胞和K细胞中。如果GPR119被甘油三酯代谢物(2-单酰基甘油(2-monoacylglycerol))等活化,则GPR119会增加如GLP-1(胰高血糖素样肽-1)或GIP(葡萄糖依赖性促胰岛素多肽)的肠促胰岛素激素的分泌。GPR119也分布在胰腺β细胞和α细胞中,并通过以葡萄糖依赖性方式控制胰岛素和胰高血糖素的分泌来有助于维持血糖水平。此外,据报道,如果在人巨噬细胞系中过表达GPR119,则GLP-1受体的表达会增加,使得作为将胆固醇从细胞中带出的转运蛋白的ABCA1(ATP结合盒式蛋白A1)增加,从而增加ApoA1介导的胆固醇回流,改善脂质代谢以及降低血液中炎症细胞因子的浓度(J Lipid Res,2014(55):681-697)。
然而,尚未报道GPR119配体是否直接抑制炎症应答并因此抑制作为非酒精性脂肪肝病中肝细胞损伤的核心的炎症应答。而且,也没有报道GPR119配体是否可在非酒精性脂肪肝病被诱发后改善炎症和纤维化。
发明内容
技术问题
本发明的一个目的是提供一种用于预防或治疗非酒精性脂肪肝病的药物组合物,其包含GPR119配体作为有效成分。
技术方案
本发明可以提供用于预防或治疗非酒精性脂肪肝病的药物组合物,其包含由以下化学式1所示的化合物、其药学上可接受的盐、其旋光异构体、其水合物或溶剂化物、或其混合物作为有效成分:
[化学式1]
根据本发明的药物组合物可以用于通过显著抑制肝组织中的甘油三酯沉积、炎症和纤维化来预防或治疗非酒精性脂肪肝病。
在化学式1中,
A为噁二唑(oxadiazole)、二氢噁唑(dihydrooxazole)、噻唑(thiazole)或噻二唑(thiadiazole),A独立地为未取代或者被选自卤素、C1-C6直链或支链烷基和C1-C6醇基的至少一个取代基所取代,所述烷基或醇基独立地为未取代或者被卤素或C1-C6烷氧基所取代;
B为吡啶(pyridine)、嘧啶(pyrimidine)、吡嗪(pyrazine)或噁二唑(oxadiazole),B独立地为未取代或者被选自卤素、C1-C6直链或支链烷基、C1-C6醇基、C1-C6烷氧基和噁二唑基的至少一个取代基所取代,所述C1-C6直链或支链烷基、C1-C6醇基、C1-C6烷氧基或噁二唑基独立地为未取代或者被卤素、C1-C6烷基或C1-C6烷氧基所取代;和
X各自独立地为F、Cl、Br或I,但不限于此。
根据本发明的一个实施方案,在化学式1中,
可以提供:
A为
R1至R3、R5和R6各自独立地为选自氢、卤素、C1-C6直链或支链烷基和C1-C6醇基的一个或多个取代基,所述烷基或醇基独立地为未取代或者被卤素或C1-C6烷氧基取代。
根据本发明的另一个实施方案,在化学式1中,
可以提供:
B为
R7至R11独立地被选自氢、卤素、C1-C6直链或支链烷基、C1-C6醇基、C1-C6烷氧基和噁二唑基的至少一个取代基所取代,所述烷基、醇基、烷氧基或噁二唑基独立地为未取代或者被卤素、C1-C6烷基或C1-C6烷氧基取代。
根据本发明的一个实施方案,在化学式1中,可以提供A为被C1-C6直链或支链烷基取代的噁二唑,B为被C1-C6直链或支链烷基取代的嘧啶,并且X为F。
在本发明中,术语“卤素”可以指氟、氯、溴或碘。
在本发明中,除非另有说明,否则术语“烷基”可以指直链或支链烃残基。C1-C6烷基的示例可以包括甲基、乙基、丙基、异丙基、丁基、异丁基、戊基、己基等。
在本发明中,除非另有说明,否则术语“烷氧基”可以包括具有如上限定的烷基的烷基-氧基。C1-C6烷氧基的示例可以包括甲氧基、乙氧基、丙氧基、丁氧基、戊氧基等。
在本发明中,除非另有说明,否则术语“杂环”或“杂环的”可以指包含一至三个选自N、O和S的杂原子的5至13元杂芳族或非芳族化合物。
在本发明中,由化学式1所示的化合物可以是具体选自以下化合物的化合物:
2-(4-(3-(1-(5-乙基嘧啶-2-基)哌啶-4-基)丙氧基)-2,6-二氟苯基)-4,5-二氢噁唑,
(R)-2-(4-(3-(1-(5-乙基嘧啶-2-基)哌啶-4-基)丙氧基)-2,6-二氟苯基)-4-甲基-4,5-二氢噁唑,
(S)-2-(4-(3-(1-(5-乙基嘧啶-2-基)哌啶-4-基)丙氧基)-2,6-二氟苯基)-4-甲基-4,5-二氢噁唑,
(S)-2-(4-(3-(1-(5-乙基嘧啶-2-基)哌啶-4-基)丙氧基)-2,6-二氟苯基)-5-甲基-4,5-二氢噁唑,
(R)-2-(4-(3-(1-(5-乙基嘧啶-2-基)哌啶-4-基)丙氧基)-2,6-二氟苯基)-5-甲基-4,5-二氢噁唑,
2-(4-(3-(1-(5-乙基嘧啶-2-基)哌啶-4-基)丙氧基)-2,6-二氟苯基)-5,5-二甲基-4,5-二氢噁唑,
(R)-(2-(4-(3-(1-(5-乙基嘧啶-2-基)哌啶-4-基)丙氧基)-2,6-二氟苯基)-4,5-二氢噁唑-5-基)甲醇,
(S)-(2-(4-(3-(1-(5-乙基嘧啶-2-基)哌啶-4-基)丙氧基)-2,6-二氟苯基)-4,5-二氢噁唑-5-基)甲醇,
(R)-3-(2-(4-(3-(3,5-二氟-4-(5-甲基-4,5-二氢噁唑-2-基)苯氧基)丙基)哌啶-1-基)嘧啶-5-基)-5-异丁基-1,2,4-噁二唑,
(R)-5-(4-(3-(3,5-二氟-4-(4-甲基-4,5-二氢噁唑-2-基)苯氧基)丙基)哌啶-1-基)-3-异丙基-1,2,4-噁二唑,
(S)-5-(4-(3-(3,5-二氟-4-(5-甲基-4,5-二氢噁唑-2-基)苯氧基)丙基)哌啶-1-基)-3-异丙基-1,2,4-噁二唑,
5-(4-(3-(4-(5,5-二甲基-4,5-二氢噁唑-2-基)-3,5-二氟苯氧基)丙基)哌啶-1-基)-3-异丙基-1,2,4-噁二唑,
3-(4-(3-(1-(5-乙基嘧啶-2-基)哌啶-4-基)丙氧基)-2,6-二氟苯基)-5-甲基-1,2,4-噁二唑,
3-(4-(3-(1-(5-乙基嘧啶-2-基)哌啶-4-基)丙氧基)-2,6-二氟苯基)-5-丙基-1,2,4-噁二唑,
3-(4-(3-(1-(5-乙基嘧啶-2-基)哌啶-4-基)丙氧基)-2,6-二氟苯基)-5-异丙基-1,2,4-噁二唑,
5-(叔丁基)-3-(4-(3-(1-(1-(5-乙基嘧啶-2-基)哌啶-4-基)丙氧基)-2,6-二氟苯基)-1,2,4-噁二唑,
(3-(4-(3-(1-(5-乙基嘧啶-2-基)哌啶-4-基)丙氧基)-2,6-二氟苯基)-1,2,4-噁二唑-5-基)甲醇,
2-(3-(4-(3-(1-(5-乙基嘧啶-2-基)哌啶-4-基)丙氧基)-2,6-二氟苯基)-1,2,4-噁二唑-5-基)乙-1-醇,
(S)-1-(3-(4-(3-(1-(5-乙基嘧啶-2-基)哌啶-4-基)丙氧基)-2,6-二氟苯基)-1,2,4-噁二唑-5-基)丙-1-醇,
(R)-1-(3-(4-(3-(1-(5-乙基嘧啶-2-基)哌啶-4-基)丙氧基)-2,6-二氟苯基)-1,2,4-噁二唑-5-基)丙-2-醇,
(S)-1-(3-(4-(3-(1-(5-乙基嘧啶-2-基)哌啶-4-基)丙氧基)-2,6-二氟苯基)-1,2,4-噁二唑-5-基)丙-2-醇,
2-(3-(4-(3-(1-(5-乙基嘧啶-2-基)哌啶-4-基)丙氧基)-2,6-二氟苯基)-1,2,4-噁二唑-5-基)-2-甲基丙-1-醇,
3-(2,6-二氟-4-(3-(1-(5-丙基嘧啶-2-基)哌啶-4-基)丙氧基)苯基)-5-异丙基-1,2,4-噁二唑,
3-(2,6-二氟-4-(3-(1-(5-戊基嘧啶-2-基)哌啶-4-基)丙氧基)苯基)-5-异丙基-1,2,4-噁二唑,
3-(2,6-二氟-4-(3-(1-(5-(三氟甲基)嘧啶-2-基)哌啶-4-基)丙氧基)苯基)-5-异丙基-1,2,4-噁二唑,
3-(2,6-二氟-4-(3-(1-(5-甲氧基嘧啶-2-基)哌啶-4-基)丙氧基)苯基)-5-异丙基-1,2,4-噁二唑,
3-(2,6-二氟-4-(3-(1-(5-异丙氧基嘧啶-2-基)哌啶-4-基)丙氧基)苯基)-5-异丙基-1,2,4-噁二唑,
3-(4-(3-(1-(5-氯嘧啶-2-基)哌啶-4-基)丙氧基)-2,6-二氟苯基)-5-异丙基-1,2,4-噁二唑,
3-(4-(3-(1-(5-溴嘧啶-2-基)哌啶-4-基)丙氧基)-2,6-二氟苯基)-5-异丙基-1,2,4-噁二唑,
3-(2,6-二氟-4-(3-(1-(5-(5-异丁基-1,2,4-噁二唑-3-基)嘧啶-2-基)哌啶-4-基)丙氧基)苯基)-5-甲基-1,2,4-噁二唑,
3-(2,6-二氟-4-(3-(1-(5-(5-异丁基-1,2,4-噁二唑-3-基)嘧啶-2-基)哌啶-4-基)丙氧基)苯基)-5-乙基-1,2,4-噁二唑,
3-(2,6-二氟-4-(3-(1-(5-(5-异丁基-1,2,4-噁二唑-3-基)嘧啶-2-基)哌啶-4-基)丙氧基)苯基)-5-异丙基-1,2,4-噁二唑,
5-(仲丁基)-3-(2,6-二氟-4-(3-(1-(5-(5-异丁基-1,2,4-噁二唑-3-基)嘧啶-2-基)哌啶-4-基)丙氧基)苯基)-1,2,4-噁二唑,
3-(2,6-二氟-4-(3-(1-(5-(5-异丁基-1,2,4-噁二唑-3-基)嘧啶-2-基)哌啶-4-基)丙氧基)苯基)-5-(甲氧基甲基)-1,2,4-噁二唑,
(S)-1-(3-(2,6-二氟-4-(3-(1-(5-(5-异丁基-1,2,4-噁二唑-3-基)嘧啶-2-基)哌啶-4-基)丙氧基)苯基)-1,2,4-噁二唑-5-基)丙-1-醇,
2-(3-(2,6-二氟-4-(3-(1-(5-(5-异丁基-1,2,4-噁二唑-3-基)嘧啶-2-基)哌啶-4-基)丙氧基)苯基)-1,2,4-噁二唑-5-基)-2-甲基丙-1-醇,
3-(4-(3-(1-(5-氯吡嗪-2-基)哌啶-4-基)丙氧基)-2,6-二氟苯基)-5-异丙基-1,2,4-噁二唑,
3-(2,6-二氟-4-(3-(1-(5-(三氟甲基)吡啶-2-基)哌啶-4-基)丙氧基)苯基)-5-异丙基-1,2,4-噁二唑,
3-(2,6-二氟-4-(3-(1-(3-异丙基-1,2,4-噁二唑-5-基)哌啶-4-基)丙氧基)苯基)-5-甲基-1,2,4-噁二唑,
3-(2,6-二氟-4-(3-(1-(3-异丙基-1,2,4-噁二唑-5-基)哌啶-4-基)丙氧基)苯基)-5-异丙基-1,2,4-噁二唑,
(3-(2,6-二氟-4-(3-(1-(3-异丙基-1,2,4-噁二唑-5-基)哌啶-4-基)丙氧基)苯基)-1,2,4-噁二唑-5-基)甲醇,
2-(4-(3-(1-(5-乙基嘧啶-2-基)哌啶-4-基)丙氧基)-2,6-二氟苯基)-5-甲基-1,3,4-噁二唑,
2-乙基-5-(4-(3-(1-(5-乙基嘧啶-2-基)哌啶-4-基)丙氧基)-2,6-二氟苯基)-1,3,4-噁二唑,
2-(4-(3-(1-(5-乙基嘧啶-2-基)哌啶-4-基)丙氧基)-2,6-二氟苯基)-5-异丙基-1,3,4-噁二唑,
5-(4-(3-(1-(5-乙基嘧啶-2-基)哌啶-4-基)丙氧基)-2,6-二氟苯基)-N-异丙基-1,3,4-噁二唑-2-胺,
2-(2,6-二氟-4-(3-(1-(5-(三氟甲基)嘧啶-2-基)哌啶-4-基)丙氧基)苯基)-5-甲基-1,3,4-噁二唑,
2-(2,6-二氟-4-(3-(1-(5-(三氟甲基)嘧啶-2-基)哌啶-4-基)丙氧基)苯基)-5-乙基-1,3,4-噁二唑,
2-(2,6-二氟-4-(3-(1-(5-(三氟甲基)嘧啶-2-基)哌啶-4-基)丙氧基)苯基)-5-异丙基-1,3,4-噁二唑,
2-(4-(3-(1-(5-氯吡嗪-2-基)哌啶-4-基)丙氧基)-2,6-二氟苯基)-5-甲基-1,3,4-噁二唑,
2-(4-(3-(1-(5-氯吡嗪-2-基)哌啶-4-基)丙氧基)-2,6-二氟苯基)-5-乙基-1,3,4-噁二唑,
2-(4-(3-(1-(5-氯吡嗪-2-基)哌啶-4-基)丙氧基)-2,6-二氟苯基)-5-异丙基-1,3,4-噁二唑,
5-(4-(3-(3,5-二氟-4-(5-甲基-1,3,4-噁二唑-2-基)苯氧基)丙基)哌啶-1-基)-3-丙基-1,2,4-噁二唑,
5-(4-(3-(3,5-二氟-4-(5-乙基-1,3,4-噁二唑-2-基)苯氧基)丙基)哌啶-1-基)-3-丙基-1,2,4-噁二唑,
5-(4-(3-(3,5-二氟-4-(5-异丙基-1,3,4-噁二唑-2-基)苯氧基)丙基)哌啶-1-基)-3-丙基-1,2,4-噁二唑,
5-(4-(3-(3,5-二氟-4-(5-甲基-1,3,4-噁二唑-2-基)苯氧基)丙基)哌啶-1-基)-3-异丙基-1,2,4-噁二唑,
5-(4-(3-(4-(5-乙基-1,3,4-噁二唑-2-基)-3,5-二氟苯氧基)丙基)哌啶-1-基)-3-异丙基-1,2,4-噁二唑,
5-(4-(3-(3,5-二氟-4-(5-异丙基-1,3,4-噁二唑-2-基)苯氧基)丙基)哌啶-1-基)-3-异丙基-1,2,4-噁二唑,
5-(4-(3-(3,5-二氟-4-(5-甲基-1,3,4-噁二唑-2-基)苯氧基)丙基)哌啶-1-基)-3-(2,2,2-三氟乙基)-1,2,4-噁二唑,
3-(4-(3-(3,5-二氟-4-(5-异丙基-1,3,4-噁二唑-2-基)苯氧基)丙基)哌啶-1-基)-5-异丙基-1,2,4-噁二唑,
2-(4-(3-(1-(5-乙基嘧啶-2-基)哌啶-4-基)丙氧基)-2,6-二氟苯基)-5-异丙基-1,3,4-噻二唑,
2-(2,6-二氟-4-(3-(1-(5-丙基嘧啶-2-基)哌啶-4-基)丙氧基)苯基)-5-异丙基-1,3,4-噻二唑,
2-(2,6-二氟-4-(3-(1-(5-戊基嘧啶-2-基)哌啶-4-基)丙氧基)苯基)-5-异丙基-1,3,4-噻二唑,
2-(2,6-二氟-4-(3-(1-(5-氟嘧啶-2-基)哌啶-4-基)丙氧基)苯基)-5-异丙基-1,3,4-噻二唑,
2-(2,6-二氟-4-(3-(1-(5-(三氟甲基)嘧啶-2-基)哌啶-4-基)丙氧基)苯基)-5-异丙基-1,3,4-噻二唑,
2-(2,6-二氟-4-(3-(1-(5-(三氟甲基)吡啶-2-基)哌啶-4-基)丙氧基)苯基)-5-异丙基-1,3,4-噻二唑,和
4-乙基-2-(4-(3-(1-(5-乙基嘧啶-2-基)哌啶-4-基)丙氧基)-2,6-二氟苯基)噻唑。
在本发明的一个实施方案中,由本发明的化学式1所示的化合物可以具体为3-(4-(3-(1-(5-乙基嘧啶-2-基)哌啶-4-基)丙氧基)-2,6-二氟苯基)-5-异丙基-1,2,4-噁二唑。
在本发明中,由化学式1所示的化合物的在药学上可接受的盐的非限制性示例可以包括:无机酸盐如盐酸、氢溴酸、磷酸或硫酸;有机羧酸盐如乙酸、三氟乙酸、柠檬酸、马来酸、草酸、琥珀酸、苯甲酸、酒石酸、富马酸、扁桃酸、抗坏血酸或苹果酸,或磺酸盐如甲磺酸或对甲苯磺酸;碱金属盐如钠、钾或锂;已知能够形成其它药学上可接受的盐的各种酸式盐;等等。
在本发明的一个具体实施方案中,通过进行组织学检查、测量血液中ALT和AST的浓度、测量与炎症和纤维化有关的基因和蛋白质的表达水平等的实验证实了:在ob/ob小鼠模型(其中通过特殊膳食诱发了非酒精性脂肪肝病)中,通过在诱发疾病的过程中施用由化学式1所示的化合物,显著抑制肝组织的损伤、甘油三酯在肝组织中的沉积、炎症细胞的浸润和纤维化(实施例1)。
在本发明的一个具体实施方案中,首次证实了:由化学式1所示的化合物通过抑制炎症应答的机制以浓度依赖性方式抑制由炎症因子引起的人单核细胞的分化和分化的巨噬细胞的活化(实施例2)。
在本发明的一个具体实施方案中,证实了:在C57BL6小鼠模型(其中通过特殊膳食诱发了非酒精性脂肪肝病)中,通过在诱发疾病之后施用由化学式1所示的化合物,显著改善肝组织的损伤、甘油三酯在肝组织中的沉积、炎症细胞的浸润和纤维化(实施例3)。
根据本发明的用于预防或治疗非酒精性脂肪肝病的药物组合物可以常规药物制剂的形式使用。在施用时可以各种口服和肠胃外剂型施用药物制剂,并且可以根据使用方法确定不同的剂型。
如果将药物制剂配制成各种口服和肠胃外剂型,则可以使用常用的赋形剂如填充剂、稀释剂、增量剂、粘合剂、湿润剂、崩解剂、表面活性剂等。
用于口服施用的固体制剂可以包括片剂、丸剂、粉末剂、颗粒剂、胶囊等,并且该固体制剂可以通过在药物组合物中混合至少一种赋形剂如淀粉、碳酸钙(calciumcarbonate)、蔗糖(sucrose)、乳糖(lactose)、明胶等来制备。另外,除简单的赋形剂外,还可以使用润滑剂如硬脂酸镁、滑石粉等。
此外,用于口服施用的液体制剂可以包括助悬剂、内服的液体、乳剂、糖浆等,但除了水和液体石蜡(它们是常用的简单稀释剂)之外,液体制剂还可以包含各种赋形剂,例如湿润剂、甜味剂、增味剂、防腐剂等。
用于肠胃外施用的制剂可以包括无菌水溶液、非水溶剂、混悬剂、乳剂、冻干制剂和栓剂。非水溶剂和混悬剂可以包括丙二醇(propylene glycol)、聚乙二醇、植物油(如橄榄油)、可注射酯(如油酸乙酯)等。栓剂的基质可以包括witepsol、聚乙二醇、吐温(tween)61、可可脂、月桂油、甘油明胶等。
此外,根据本发明的用于预防或治疗非酒精性脂肪肝病的药物组合物可以表现出在约1至约1000mg的施用范围内的有效量。施用量或摄入量可以以多种施用剂量和方法施用,通过根据受试者的体重、年龄、性别、健康状况、膳食、施用时间、施用方法、排泄率和疾病严重程度来分配组合物,例如每天一次或每天多次。
在本发明中,非酒精性脂肪肝病(non-alcoholic fatty liver disease,NAFLD)可以包括原发性和继发性非酒精性脂肪肝病。具体地,在本发明中,非酒精性脂肪肝病(non-alcoholic fatty liver disease,NAFLD)可以包括单纯性脂肪变性(simplesteatosis)、非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)和肝纤维化(liver fibrosis)以及由这些疾病的进展引起的肝硬化(liver cirrhosis),但不限于此。
本发明的药物组合物可以包含由化学式1所示的化合物或者一种或多种具有相似功能的有效成分。
本发明还可以提供用于预防或治疗非酒精性脂肪肝病的方法,所述方法包括向需要治疗的受试者施用治疗有效量的由化学式1所示的化合物、其药学上可接受的盐、其旋光异构体、其水合物或溶剂化物、或其混合物。
在本发明中,术语“需要治疗的受试者”可以指包括人的哺乳动物,并且术语“施用”可以是指通过任何适当的方法向受试者提供预定的物质。术语“治疗有效量”可以指诱导动物或人表现出研究者、兽医、医生或其他临床医生所考虑的生物学或医学应答的活性成分或药物组合物的量,并且这种量可以包括用于诱导减轻待治疗的疾病或病症的活性成分或药物组合物的量。对于本领域技术人员显而易见的是,本发明的有效成分的治疗有效剂量和施用次数可以根据期望的效果而变化。
在本发明中,本发明的药物组合物的施用途径可以通过任何一般途径进行施用,只要它可以到达靶组织即可。
可以经口、腹膜内、静脉内、肌内、皮下、内皮、鼻内、肺内、直肠、腔内、腹膜内和鞘内进行施用,但不限于此。
可以每天一次或每天至少两次以一定的时间间隔施用本发明的药物组合物。
为了预防和治疗非酒精性脂肪肝病,本发明的药物组合物可以单独使用或与外科手术、内分泌疗法、药物治疗和使用生物应答调节剂的方法组合使用。
本发明还可以提供用于预防或改善非酒精性脂肪肝病的食品组合物,所述食品组合物包含由化学式1所示的化合物、其药学上可接受的盐、其旋光异构体、其水合物或溶剂化物、或其混合物作为有效成分。
在本发明中,术语“缓解”可以指通过施用所述组合物使疾病变好或好转的所有行为。
在本发明中,术语“食品”可以是指肉、香肠、面包、巧克力、糖果、零食、蜜饯、比萨、速食面、其它面、口香糖、乳制品(包括冰淇淋)、各种汤、饮料、茶、保健饮料、酒精饮料、维生素复合物、保健功能食品、保健食品、保健补品等,并且包括常规意义上的所有食品。
术语“健康功能食品(functional food)”可以是与用于特殊保健用途的食品(food for special health use,FoSHU)相同的术语,并且是指具有高的医学和医疗作用的食品,其经过加工以除了提供营养素外还有效地显示出生物调节功能。在这种情况中,就人体的结构和功能而言,术语“功能(性)”可以指控制营养素或获得对健康如生理作用有益的效果等。
“保健食品(health food)”可以指与一般食品相比具有有效维持或增强健康的效果的食品,“保健补品(health supplement food)”可以指用于健康补充目的的食品。在一些情况中,术语保健功能食品、保健食品和保健补品可以互换使用。
本发明的食品可以通过本领域中常规使用的方法来制备,并且可以在制备过程中添加本领域中常规添加的原料和成分来制备所述食品。具体地,可以包括蛋白质、碳水化合物、脂肪、营养素、调味剂和增味剂,碳水化合物的示例可以包括葡萄糖、果糖、麦芽糖、蔗糖、寡糖、糊精、环糊精、木糖醇、山梨糖醇、赤藓醇、糖精或合成增味剂,但不限于此。本发明的食品组合物可以无限制地被制成各种剂型,只要该剂型被认为是食品即可。
本发明还可以提供用于预防或改善非酒精性脂肪肝病的方法,所述方法包括向需要改善的受试者施用食品组合物,所述食品组合物包含由化学式1所示的化合物、其药学上可接受的盐、其旋光异构体、其水合物或溶剂化物、或其混合物作为有效成分。
本发明还可以提供用于预防或改善非酒精性脂肪肝病的饲料组合物,所述饲料组合物包含由化学式1所示的化合物、其药学上可接受的盐、其旋光异构体、其水合物或溶剂化物、或其混合物作为有效成分。
在本发明中,术语“饲料”可以指将被牲畜食用或消化或者适用于牲畜的任何天然或人工膳食、一餐等、或者一餐的成分。饲料可以包含饲料添加剂或辅助饲料。
饲料的种类没有特别限制,可以使用本领域中常规使用的饲料。饲料的非限制性示例可以包括:植物饲料如谷物、根果、食品加工副产物、藻类、纤维、药物副产物、油和脂肪、淀粉、油粕粉、谷物副产物等;动物饲料如蛋白质、无机物、油和脂肪、矿物质、单细胞蛋白质、浮游动物、食物等。可以单独使用饲料或通过将至少两种饲料混合来使用饲料。
本发明还可以提供由化学式1所示的化合物、其药学上可接受的盐、其旋光异构体、其水合物或溶剂化物、或其混合物在预防或治疗非酒精性脂肪肝病中的用途。
本发明还可以提供由化学式1所示的化合物、其药学上可接受的盐、其旋光异构体、其水合物或溶剂化物、或其混合物在制备用于预防或治疗非酒精性脂肪肝病的药物制剂中的用途。
在治疗方法、食品组合物、缓解方法、饲料组合物及其用途中,由化学式1所示的化合物可以具体地为3-(4-(3-(1-(5-乙基嘧啶-2-基)哌啶-4-基)丙氧基)-2,6-二氟苯基)-5-异丙基-1,2,4-噁二唑。
如果彼此不矛盾,则在根据本发明的药物组合物、治疗方法、食品组合物、缓解方法、饲料组合物及其用途中提到的事项相同地适用。
有利效果
根据本发明的药物组合物显示出缓解脂质代谢、减少肝组织中的脂肪积累以及预防由肝组织的炎症和纤维化引起的组织学损伤的优异效果,因此可以被用于预防或治疗非酒精性脂肪肝病。
附图说明
图1是组织样品的照片,其示出在诱发有非酒精性脂肪性肝炎的小鼠模型中本发明的化合物减少甘油三酯和抑制炎症细胞浸润的效果。
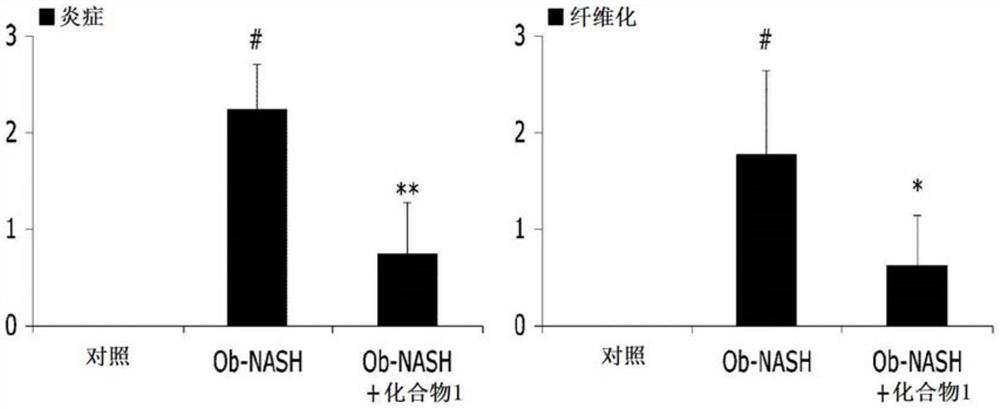
图2为示出在诱发有非酒精性脂肪性肝炎的小鼠模型中本发明化合物抑制炎症细胞浸润和抑制纤维化的效果的分析图(#,p<0.05vs.正常;*&**,p<0.05&p<0.01vs.Ob-NASH)。
图3是组织样品的照片,其示出在诱发有非酒精性脂肪性肝炎的小鼠模型中本发明的化合物抑制纤维化的效果。
图4为示出在诱发有非酒精性脂肪性肝炎的小鼠模型中本发明化合物减少AST和ALT的效果的视图(#,p<0.05vs.正常;*,p<0.05vs.Ob-NASH)。
图5为示出在诱发有非酒精性脂肪性肝炎的小鼠模型中测量与炎症和纤维化相关的蛋白质的浓度的结果的视图(###,p<0.001vs.正常;**&***,p<0.01&p<0.001vs.Ob-NASH)。
图6为示出在诱发有非酒精性脂肪性肝炎的小鼠模型中测量与炎症和纤维化相关的基因的表达水平的结果的视图。
图7为示出在将人单核细胞分化为巨噬细胞之前以及在分化24小时和48小时之后的时间点评估细胞中GPR119的基因表达的结果的视图。
图8为示出根据用本发明化合物的处理评估对人单核细胞向巨噬细胞分化的作用的结果的视图。
图9为示出根据用本发明化合物的处理评估对分化的巨噬细胞活化的作用的结果的视图。
图10是组织样品的照片,其示出在诱发有非酒精性脂肪性肝炎的小鼠模型中本发明的化合物减少甘油三酯和抑制肝组织中炎症细胞浸润的效果。
图11为示出在诱发有非酒精性脂肪性肝炎的小鼠模型中测量肝组织中甘油三酯的含量的结果的视图(**&***,p<0.01&p<0.001vs.DIO-NASH)。
图12为示出在诱发有非酒精性脂肪性肝炎的小鼠模型中向同一个体施用之前和之后的NAFLD活动分(NAS)的变化的视图。
图13是组织样品的照片,其示出在诱发有非酒精性脂肪性肝炎的小鼠模型通过本发明的化合物抑制纤维化的效果。
图14为示出在诱发有非酒精性脂肪性肝炎的小鼠模型中测量肝组织中I型胶原蛋白的含量的结果的视图(*&***,p<0.05&p<0.001vs.DIO-NASH)。
图15为示出在诱发有非酒精性脂肪性肝炎的小鼠模型中测量血液中AST和ALT的浓度的结果的视图(**&***,p<0.01&p<0.001vs.DIO-NASH)。
图16为示出测量在诱发有非酒精性脂肪性肝炎的小鼠模型的肝组织中单核细胞引诱物、巨噬细胞标记物和纤维化标记物的基因表达水平的结果的视图(*、**&***,p<0.05,p<0.01&p<0.001vs.DIO-NASH)。
具体实施方式
参考下文中详细描述的示例性实施方案,本发明的特征和优点以及实现它们的方法将是显而易见的。然而,本发明并不限于下文公开的实施例,而是将以各种不同的形式实施。在下文中,将提出以下实施例来更好地理解本发明,并且提供这些实施例仅是为了向本领域技术人员彻底地说明本发明的范围,因此本发明将仅由权利要求的范围限定。
<实施例1>GPR119配体在因供应特殊膳食而诱发脂肪性肝炎的小鼠模型中的功效的确定
为了确定根据本发明的GPR119配体化合物在预防非酒精性脂肪肝病中的效果,进行了以下实验。
将六周大的具有瘦素缺乏症的雄性ob/ob小鼠用含有高脂肪、高果糖和高胆固醇的特殊膳食喂养10周,从而诱发其发展成非酒精性脂肪性肝炎。制备混合形式的膳食,使得在由化学式1所示的化合物中,3-(4-(3-(1-(5-乙基嘧啶-2-基)哌啶-4-基)丙氧基)-2,6-二氟苯基)-5-异丙基-1,2,4-噁二唑(3-(4-(3-(1-(5-ethylpyrimidin-2-yl)piperidin-4-yl)propoxy)-2,6difluorophenyl)-5-isopropyl-1,2,4-oxadiazole)(在下文为“化合物1”)的每日剂量达到100mg/kg/天,并且从开始供应特殊膳食10周的时间点起向小鼠供应所述混合形式的膳食。
为了进行组织学检查,将制备的诱发有非酒精性脂肪性肝炎的小鼠模型进行尸体解剖以将分离的肝组织固定在10%福尔马林中并制备石蜡块,从而获得2μm厚的组织切片。为了确定炎症细胞的浸润,使用自动染色机(Autostainner XL,Leica)进行苏木精和曙红(HE)染色,其结果示于图1和图2中。
如从图1和图2可理解,与用正常膳食喂养的C57BL/6小鼠(正常)相比,用特殊膳食喂养10周的ob/ob小鼠(Ob-NASH)表现出肝脏组织中的甘油三酯脂滴明显增加,并且还确定了炎症细胞的浸润。相反,已证实,当与特殊膳食同时供应本发明的化合物1(Ob-NASH+化合物1)时,炎症细胞的浸润受到显著抑制。
然后,为了评估纤维化,使用马松三色染色剂或Sirius Res染色剂对肝组织中的纤维进行特异性染色,其结果示于图2和图3中。
如从图2和图3可理解,与用正常膳食喂养的C57BL/6小鼠不同,用特殊膳食喂养10周的ob/ob小鼠表现出紫色肝组织整体具有明显的纤维化进展,但是当与特殊膳食同时供应本发明的化合物1时,肝组织的纤维化受到显著抑制。
将诱发有非酒精性脂肪性肝炎的小鼠模型进行尸体解剖,然后从其中分离出血浆,从而使用自动血液分析仪(Konelab 20i)对AST(天冬氨酸转氨酶)和ALT(丙氨酸转氨酶)进行定量,其结果示于图4中。
如在图4中所示,已证实,与用正常膳食喂养的C57BL/6小鼠不同,用特殊膳食喂养10周的ob/ob小鼠因肝组织受到损伤而表现出血液中的ALT和AST水平显著增加(这是肝损伤的标志)。另一方面,已证实,本发明的化合物1与特殊膳食一起施用的ob/ob小鼠表现出对ALT和AST增加的显著抑制,这意味着缓解了肝细胞损伤。
为了评估对肝组织中炎症相关基因和纤维化相关蛋白的表达的作用,将从小鼠模型获得的肝组织放入RIPA缓冲液(Cell Signaling)中,用TissueLyser IITM(Quiagen)粉碎,然后用Pierce BCA蛋白质检测试剂盒(Thermo Fisher Scientific)对总蛋白浓度进行定量,并使用市售ELISA试剂盒对肝组织中小鼠Ccl2(=Mcp1;R&D Systems,MJE00)和Timp1(R&D Systems,MTM100)的蛋白浓度进行定量,其结果示于图5中。
如在图5中所示,已证实,用特殊膳食喂养的小鼠表现出肝组织中Ccl2(=Mcp1)和Timp1的蛋白浓度增加,所述Ccl2(=Mcp1)是诱导炎症细胞进入肝组织的因子,所述Timp1为降解沉积在肝组织中的纤维的酶的内源性抑制剂,而当本发明的化合物1与特殊膳食一起施用时,Ccl2和Timp1的蛋白水平受到显著抑制。
为了测量肝组织中炎症相关基因和纤维化相关基因的表达水平,将
如在图6中所示,已证实,用特殊膳食喂养10周的小鼠表现出与炎症相关的小鼠基因(Ccl2、Lgals3、Tnfa)和纤维化相关基因(Tgfb1、Col1a、Timp1、Timp2、Acta2)的表达增加,而当本发明的化合物1与特殊膳食一起施用时,与炎症和纤维化相关的基因的表达增加受到显著抑制。
上述结果表明,本发明的化合物通过抑制肝组织的损伤、炎症和纤维化从而对非酒精性脂肪肝病产生优异效果。
<实施例2>对人单核细胞分化和分化的巨噬细胞活化的抑制作用的确定
为了评估根据本发明的化合物的直接抗炎作用,确定了对人单核细胞分化及其活化的作用。
首先,作为在将人单核细胞(THP-1,
然后,将THP-1单核细胞用PMA(50ng/ml)处理48小时以分化为巨噬细胞,同时用化合物1进行共处理,然后用无血清培养基代替,而后用LPS(脂多糖),0.5ng/ml)处理4小时,从而使用商业化的ELISKA试剂盒对分泌到培养基中的IL-1β(白介素-1β,R&D Systems,DY201)进行定量,并且评估对单核细胞分化的作用,其结果示于图8中。
如在图8中所示,已证实,在将单核细胞分化为巨噬细胞的过程中,用本发明的化合物处理时,由巨噬细胞活化引起的IL-1β分泌以浓度依赖性的方式降低。
此外,在用化合物1处理分化的巨噬细胞48小时后,通过与上述相同的针对免疫细胞通过LPS活化的方法对分泌的IL-1β进行定量,从而评估对分化的巨噬细胞的活化的作用。因此,其结果示于图9中。
如在图9中所示,已证实,即使当用本发明的化合物处理分化的巨噬细胞时,由巨噬细胞活化引起的IL-1β分泌也以浓度依赖性的方式降低。
上述结果表明,本发明的化合物通过直接抑制免疫细胞的分化和活化从而在预防和治疗非酒精性脂肪肝病中产生优异效果。
<实施例3>GPR119配体在因供应特殊膳食而诱发脂肪性肝炎的小鼠模型中的功效的确定
为了确定根据本发明的GPR119配体化合物在治疗非酒精性脂肪肝病中的效果,进行了以下实验。
将六周大的雄性C57BL/6J小鼠用包含高脂肪、高果糖和高胆固醇的特殊膳食喂养至少26周,从而诱发其发展成非酒精性脂肪性肝炎。在药物供应前三周,通过对肝组织进行活检,证实了诱发脂肪肝和炎症性纤维化,并且基于肝组织中染色的胶原蛋白面积将小鼠平均分配到每组中。通过在特殊膳食中混合根据本发明的化合物来制备饲料,并另外供应八周。根据供应给小鼠的膳食,将各组分为:以正常膳食喂养的对照组(正常);其中因特殊膳食而诱发非酒精性脂肪性肝炎的小鼠未被供应药物的阳性对照组(DIO-NASH);以及其中向诱发有非酒精性脂肪性肝炎的小鼠以30mg/kg/天(L)和100mg/mg/天(H)供应化合物1的组(分别为化合物1(L)和化合物1(H))。
为了进行组织学检查,将制备的C57BL/6J小鼠模型进行尸体解剖以将分离的肝组织固定在10%福尔马林中并制备石蜡块,从而获得2μm厚的组织切片。然后,使用自动染色机(Autostainner XL,Leica)进行苏木精和曙红(HE)染色,其结果示于图10中。此外,使用从C57BL/6J小鼠模型分离出的肝组织,通过使用甘油三酯试剂(Roche Diagnotics,#22-045-795)来测量肝组织中的甘油三酯的含量,其结果示于图11中。
如从图10和图11可理解,与用正常膳食喂养的小鼠(正常)相比,仅用特殊膳食喂养的小鼠(DIO-NASH)表现出脂肪沉积和炎症细胞的浸润在肝组织中显著增加,而用本发明的化合物1与特殊膳食一起喂养的DIO-NASH_化合物1(H)组表现出脂肪沉积和炎症细胞的浸润显著减少。
此外,作为基于上述组织学检查评估施用之前和之后的NAS(NAFLD活动分)(其反映脂肪细胞比例、炎症细胞的浸润和对肝细胞的损伤)的结果,该病在50%的DIO-NASH组中有恶化,而在施用化合物的情况中没有个体恶化,并且该病在约50%的DIO-NASH_化合物1组中得到改善(图12)。
然后,为了评估纤维化,在各组小鼠中用Sirius Res染色剂对肝组织的纤维进行特异性染色,并在免疫染色后通过图像分析法测量肝组织中的I型胶原蛋白的含量,其结果示于图13和图14中。
如在图13和图14中所示,与用正常膳食喂养的小鼠(正常)相比,仅用特殊膳食喂养的小鼠(DIO-NASH)表现出肝组织中的纤维化进展显著,而用本发明的化合物1与特殊膳食一起喂养的组(DIO-NASH_化合物1)表现出肝组织的纤维中的交联形成显著降低,并且还表现出I型胶原蛋白显著减少。
将每组小鼠进行尸体解剖,然后从其中分离出血浆,从而使用自动血液分析仪(Konelab 20i)对AST(天冬氨酸转氨酶)和ALT(丙氨酸转氨酶)进行定量。因此,其结果示于图15中。
如在图15中所示,与用正常膳食喂养的小鼠相比,仅用特殊膳食喂养的小鼠组(DIO-NASH)表现出血液中ALT和AST的浓度显著增加,而用本发明的化合物1与特殊膳食一起喂养的小鼠组(DIO-NASH_化合物1)表现出ALT和AST的增加受到显著抑制。
为了分析施用药物后八周内从上述小鼠模型分离出的肝组织中总基因表达的变化,使用NeoPrep(Illumina)将分离的RNA级分用于生成文库,并通过NexSeq 500(Illumina)进行RNA测序分析,然后进行生物信息学分析并针对每种功能对主要基因组的变化进行分类,其结果示于图16中。
如在图16中所示,与用正常膳食喂养的小鼠(正常)相比,仅用特殊膳食喂养的小鼠(DIO-NASH)表现出肝组织中单核细胞引诱物、巨噬细胞标记物和纤维化标记物的表达增加,而用本发明的化合物1与特殊膳食一起喂养的小鼠DIO-NASH_化合物1组表现出上述标记物显著减少。
上述结果表明,本发明的化合物通过抑制肝组织的损伤、炎症和纤维化从而对非酒精性脂肪肝病产生作用,并且通过联合施用DPPIV抑制剂从而产生更优异的治疗效果。
- 用于预防或治疗非酒精性脂肪肝病的含有GPR119配体作为活性成分的药物组合物
- 具有抗癌活性的肽以及均含有该肽作为活性成分的用于预防和治疗癌症的药物组合物和膳食补充组合物
