磷脂在调控血管生成方面的应用
文献发布时间:2023-06-19 11:09:54
技术领域
本发明涉及磷脂在血管生成方面的应用,属于生物医药技术领域。
背景技术
血管生成是指基于原始血管丛或现有血管使新的血管系统萌芽的过程,它是维持循环系统功能并确保能量供应的必要机制。该过程受血管新生诱导因子和抑制因子的平衡调控,若调控失衡便会引发各种疾病的发生。当血管生成不足时,会引起心肌缺血、脑缺血、创伤和骨折愈合缓慢、闭塞性血管炎、糖尿病性周围血管病变等疾病。寻找具有促进血管生成作用的治疗药物是治疗这些缺血性疾病的重要策略,这也是当今临床研究的热点。
血管生成药物的发现需要借助血管生成模型,常见的血管生成模型包括体外模型(内皮细胞模型和大鼠动脉环模型)、体内模型(角膜微囊、鸡胚绒毛尿囊膜、圆盘血管生成模型和海绵-基质胶模型等)、以及整体动物模型(斑马鱼模型和爪蟾蝌蚪模型)。斑马鱼具有个体小、产卵多、发育快、胚胎透明、饲养简便等诸多特点,具有细胞的高通量性和整体动物的高内涵性,在国际上已成为药物筛选评价体系中衔接细胞和哺乳动物模型的重要环节。而标记绿色血管荧光的转基因斑马鱼使得在活体胚胎中观察样品作用于血管生成的过程更加的直观而快捷。因此,斑马鱼模型是血管生成活性评价的优势模型。
磷脂具有广泛的生物活性和保健功能,例如,降血脂、抗衰老、促进神经传导、提高大脑活力、预防心脑血管疾病、保肝、增强免疫力、抗疲劳、促进血液循环、增强细胞膜透过性、抗癌、改善氧化稳定性、抗炎等。研究人员曾发现补充长链多不饱和脂肪酸可以促进新生血管性黄斑变性小鼠模型脉络膜新生血管的消退,提示增加膳食中多不饱和脂肪酸含量有益于体内病理性血管生成的减弱(Ryoji Yanai等,Cytochrome P450-generatedmetabolites derived from ω-3 fatty acids attenuate neovascularization,PNAS,2014,111,9603-9608)。但以血管生成作为靶点评价磷脂的生物活性,目前尚未见报道。
中国文献《溶血磷脂酰胆碱对血管平滑肌细胞的增殖作用及其信号通路》(包良,内蒙古大学,硕士论文,2010年6月)讲述了溶血磷脂酰胆碱可以刺激血管平滑肌细胞的增殖。但血管生成机制复杂,主要跟内皮细胞的增殖、迁移有关。血管平滑肌细胞的增殖可使血管壁增厚,增加血管的强度和韧性。血管平滑肌细胞增殖与血管生成并非呈直接对应关系。另外,本发明中涉及的磷脂包括各类磷脂标准品、磷脂类市售药品及保健产品、自制磷脂提取物等,组成成分复杂,其主要评价指标是斑马鱼模型的血管生成长度。且磷脂来源不同,即使同类型磷脂的脂肪酸侧链长度、不饱和键的数量和位置也不一样,结构差异较大。
发明内容
本发明针对现有技术的不足,提供磷脂在调控血管生成方面的应用。
本发明技术方案如下:
磷脂在调控血管生成方面的应用。
磷脂作为药效成分在制备治疗血管生成相关疾病药物中的应用。
根据本发明优选的,所述血管生成相关疾病为因血管受损或血管生成受抑制导致的疾病。
磷脂作为有效成分在制备促进血管生成相关药物中的应用。
根据本发明优选的,磷脂作为有效成分在制备增加血管长度相关药物中的应用。
磷脂作为有效成分在制备血管生成相关的保健食品、特医食品等功能性食品中的应用。
根据本发明优选的,所述磷脂为总磷脂纯度大于80%的蛋黄磷脂提取物;
进一步优选的,所述蛋黄磷脂提取物中磷脂成分按相对含量计包括:PC占总磷脂的51.78%,PE占总磷脂的37.31%,PS占总磷脂的5.61%、SM占总磷脂的4.47%。
根据本发明优选的,所述磷脂为总磷脂纯度大于45%的大豆磷脂提取物;
进一步优选的,所述大豆磷脂提取物中磷脂成分按相对含量计包括:PC占总磷脂的37.06%,PE占总磷脂的45.19%,PS占总磷脂的11.78%、PI占总磷脂的2.17%。
根据本发明优选的,所述磷脂为总磷脂纯度大于70%的南美白对虾磷脂提取物;
进一步优选的,所述南美白对虾磷脂提取物中磷脂成分按相对含量计包括:PC占总磷脂的86.63%,PE占总磷脂的7.29%,LPC占总磷脂的5.37%,LPE占总磷脂的0.62%。
上述磷脂提取物的制备方法,包括如下步骤:
将样品粉碎、匀浆,按质量体积比g/mL为1:(7-10)的量加入浓度为90%以上的乙醇溶液,搅拌提取获得提取液,将提取液固液分离,将分离的液体浓缩为粗磷脂,将粗磷脂用浓度为50%-70%的乙醇溶液溶解,静置12-24h后,固液分离,保留固态部分,用正己烷配成质量浓度为0.3-1.0g/mL的溶液,按所述溶液与丙酮的体积比为1:(5-15)加入丙酮,静置沉淀,然后固液分离获得最终固体,将最终固体干燥即得磷脂提取物。
根据本发明优选的,上述制备方法中,所述样品为蛋黄、大豆或南美白对虾虾头。
根据本发明优选的,上述制备方法中,均匀搅拌提取两次,每次6h获得提取液,合并提取液,将提取液减压抽滤固液分离。
根据本发明优选的,上述制备方法中,将分离的液体经45℃减压浓度得到粗磷脂。
根据本发明优选的,上述制备方法中,加入丙酮后,于4℃条件下静置24h。
进一步优选的,将最终固体真空干燥获得磷脂提取物。
根据本发明优选的,所述磷脂为PC(磷脂酰胆碱)纯品。
根据本发明优选的,所述磷脂为PS(磷脂酰丝氨酸)纯品。
根据本发明优选的,所述磷脂为卵磷脂络合碘片。
根据本发明优选的,所述磷脂为多烯磷脂酰胺胆碱胶囊。
本发明技术方案的有益效果
本发明通过将磷脂应用于斑马鱼模型,评价其对血管内皮细胞生长因子受体抑制剂(PTK787)诱导的斑马鱼体节间血管(Intersegmental vessel,ISV)损伤和对斑马鱼肠下静脉(Subintestinal vein vessel,SIV)生长情况的影响。检测后首次发现,不同磷脂可以调控PTK787诱导的斑马鱼ISVs损伤,并对斑马鱼SIVs生长有不同程度的促进或抑制作用。本发明可为血管性疾病药物提供候选,具有广阔的市场前景。
附图说明
图1为蛋黄磷脂的液质分析基峰图。
图2为大豆磷脂的液质分析基峰图。
图3为南美白对虾磷脂的液质分析基峰图。
图4为不同磷脂提取物、药品及保健产品处理斑马鱼后,ISVs生长的照片;
图中:20、40、80μg/mL分别表示对应浓度下各磷脂样品处理组;样品1表示蛋黄磷脂提取物,即三种浓度的样品1为:1-20、1-40、1-80;样品2表示大豆磷脂提取物,即三种浓度的样品2为:2-20、2-40、2-80;样品3表示南美白对虾磷脂提取物,即三种浓度的样品3为:3-20、3-40、3-80;样品4表示卵磷脂络合碘片,即三种浓度的样品4为:4-20、4-40、4-80;样品5表示多烯磷脂酰胺胆碱胶囊,即三种浓度的样品5为:5-20、5-40、5-80;样品6表示大豆磷脂软胶囊,即三种浓度的样品6为:6-20、6-40、6-80;样品7表示鱼油软胶囊,即三种浓度的样品7为:7-20、7-40、7-80。
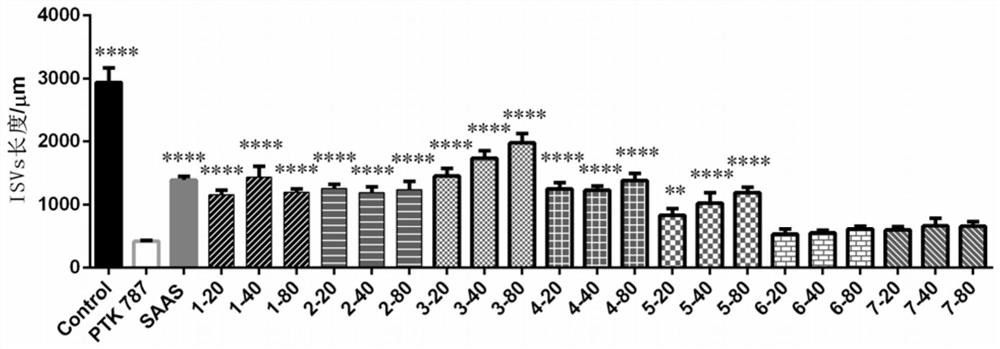
图5为不同磷脂提取物、药品及保健产品处理斑马鱼后,ISVs长度统计的柱状图;
图中:Control代表空白对照组;PTK787代表模型组;SAAS(丹参素钠)代表阳性对照组;20、40、80μg/mL分别表示对应浓度下各磷脂样品处理组;各样品编号代表意义同图4;与模型组相比,
图6为不同磷脂提取物、药品及保健产品处理斑马鱼后,SIVs生长的照片;
图中:20、40、80μg/mL分别表示对应浓度下各磷脂样品处理组;各样品编号代表意义同图4。
图7为不同磷脂提取物、药品及保健产品处理斑马鱼后,SIVs长度统计的柱状图;
图中:Control代表空白对照组;20、40、80μg/mL分别表示对应浓度下各磷脂样品处理组;各样品编号代表意义同图4;与模型组相比,
图8为不同磷脂标准品处理斑马鱼后,ISVs生长的照片;
图中20、40、80μg/mL分别表示对应浓度下各磷脂标准品处理组。
图9为不同磷脂标准品处理斑马鱼后,ISVs长度统计的柱状图;
图中:Control代表空白对照组;PTK787代表模型组;SAAS(丹参素钠)代表阳性对照组;20、40、80μg/mL分别表示对应浓度下各磷脂标准品处理组;与模型组相比,
图10为不同磷脂标准品处理斑马鱼后,SIVs生长的照片;
图中20、40、80μg/mL分别表示对应浓度下各磷脂标准品处理组。
图11为不同磷脂标准品处理斑马鱼后,SIVs长度统计的柱状图;
图中:Control代表空白对照组;20、40、80μg/mL分别表示对应浓度下各磷脂标准品处理组;与模型组相比,
具体实施方式
下面结合具体试验方法和附图对本发明的技术方案及其所产生的技术效果进行进一步的阐述。下述说明仅是为了解释本发明,但不以任何方式对本发明加以限制,基于本发明教导所作的任何变换或替换,均属于本发明的保护范围。
实施例中未注明具体条件的内容,按照常规条件进行;所用试剂或仪器未注明生产厂商的,均为普通市售产品。
材料的来源
实施例中所述南美白对虾购自当地海鲜市场,为普通市售产品;鸡蛋和大豆购自当地超市,为普通市售产品;大豆磷脂软胶囊、鱼油软胶囊、卵磷脂络合碘片、多烯磷脂酰胺胆碱胶囊购自当地药店,为普通市售产品;斑马鱼为山东省科学院生物研究所药物筛选研究室提供,为普通市售产品;链酶蛋白酶E、PTK787(N-(4-chlorophenyl)-4-(pyridin-4-ylmethyl)phthalazin-1-amine succinate)、丹参素钠、PE(磷脂酰乙醇胺)、PC(磷脂酰胆碱)、PI(磷脂酰肌醇)、PS(磷脂酰丝氨酸)、SM(鞘磷脂)等均购自Sigma公司,丹红注射液(10mL/支)由山东步长制药股份有限公司生产,为普通市售产品。
实验例1
磷脂含量的测定
本发明采用分光光度法(钼蓝比色法)测定磷脂的含量。做出的磷酸二氢钾的标准曲线方程为:y=0.8458x+0.0057(R
准确量取0.3mL磷脂样品溶液(以二氯甲烷作为溶剂,将磷脂样品溶于二氯甲烷中,制得质量浓度为0.5mg/mL的磷脂样品溶液)置于10mL的刻度试管中(空白对照量取0.3mL二氯甲烷溶剂),水浴挥干溶剂,加入4滴浓硫酸、3滴高氯酸于电炉上消化至无色澄清,冷却后补水至2mL,加入1滴酚酞指示剂,用50%氢氧化钠溶液中和至溶液显红色,缓慢滴加稀硫酸(5/200,v/v)使红色消失,补水至5mL,摇匀,依次加入1.0mL调节酸度的硫酸,摇匀,1.0mL钼酸铵溶液,摇匀,0.6mL抗坏血酸溶液,补水至10mL,加塞混匀,迅速放入70℃的水浴中显色30min取出置冷水中冷却10min,以空白对照组作为参比,在波长820nm处测定吸光值,代入标准曲线,得到无机磷的含量,再乘以系数26.3即得总磷脂的含量。
实验例2
采用UPLC-Q-Exactive Orbitrap/MS方法测定磷脂样品中各类磷脂的组成和相对含量,所述相对含量的计算方法具体参考文献为:Xiaobin Li,et al.Lipidfingerprinting of different material sources by UPLC-Q-Exactive Orbitrap/MSapproach and their zebrafish-based activities comparison,Journal ofAgricultural and Food Chemistry,2020,68,2007-2015。
实验例3
磷脂促进斑马鱼ISVs生成的活性评价
(1)斑马鱼前处理
本发明所用实验动物为血管荧光转基因Tg(fli-1:EGFP)系斑马鱼,在28℃、10h黑暗/14h照明周期的条件下饲养,每天定时定量喂食丰年虾。按雌雄1:2的比例取健康成熟的斑马鱼放入交配缸内,中间放置隔板,置于黑暗环境中。次日亮灯前抽去隔板,光照刺激使其排卵,排卵1h后收集受精卵,并用新的斑马鱼胚胎培养液冲洗3遍。为避免发育过程中的色素沉着影响结果,在胚胎的养鱼水中加入3%的1-苯基-2-硫脲(1-phenyl-2-thiourea,PTU,Sigma),放入28℃光照培养箱中控光培养,中间每24h换约1/3培养液,并及时吸出死亡胚胎。
(2)斑马鱼ISVs生成实验
将发育至24hpf(hours post fertilization)的斑马鱼胚胎,用1mg/mL的链酶蛋白酶E溶液脱去卵膜。将胚胎随机分为6组,即空白对照组、模型组、阳性对照组和磷脂样品组(三个剂量),置于24孔板中每组3个平行孔,每孔10枚胚胎。空白对照组加2mL培养液,造模组2mL培养液中加入终浓度为0.25μg/mL的PTK787,阳性对照组2mL培养液中同时加入PTK787(终浓度为0.25μg/mL)和丹参素钠(终浓度100μg/mL),磷脂三个剂量组2mL培养液中分别同时加入PTK787(终浓度为0.25μg/mL)和磷脂样品(终浓度分别为20、40、80μg/mL)。将以上各组分别放入28℃恒温培养箱中,培养24h。
(4)数据处理
给药24h后,利用荧光显微镜观察斑马鱼ISVs生成情况并采集其图像,采用ImagePro Plus 5.0软件测量ISVs长度后,使用GraphPad Prism 6.01软件进行数据统计。
实验例4
磷脂促进斑马鱼SIVs生成的活性评价
(1)斑马鱼前处理同实验例3。
(2)斑马鱼SIVs生成实验
将发育至72hpf的斑马鱼胚胎随机分为4组,即空白对照组和磷脂三个剂量组,置于24孔板中每组3个平行孔,每孔10枚胚胎。空白对照组加2mL培养液,磷脂三个剂量组2mL培养液中分别加入各磷脂样品(终浓度分别为20、40、80μg/mL)。将以上各组分别放入28℃恒温培养箱中,培养24h。
(3)数据处理
给药24h后,利用荧光显微镜观察斑马鱼SIVs生成情况并采集其图像,采用ImagePro Plus 5.0软件测量ISVs长度后,使用GraphPad Prism 6.01软件进行数据统计。
实施例1
蛋黄磷脂提取物对斑马鱼血管生成的影响
将新鲜购买鸡蛋的蛋清蛋黄分离,称取蛋黄100g,匀浆,加入浓度为90%的乙醇-水溶液800mL,匀速搅拌提取2次,每次6h,合并提取液,减压抽滤后,滤液经45℃减压浓缩,得到粗磷脂。粗磷脂加浓度为60%的乙醇-水溶液作为溶剂溶解,溶剂体积为200mL,静置24h后,离心15min,保留沉淀部分。用正己烷配成0.5g/mL的溶液,加入50mL丙酮,于4℃冰箱内静置使其沉淀24h。离心15min去除上清液,最终不溶物真空干燥,得到蛋黄磷脂,其收率为4.63%(对投料蛋黄计),总磷脂纯度按质量分数计为83.79%,按照实验例2的实验方法测定蛋黄磷脂的组成和各类磷脂的相对含量,其中磷脂成分按相对含量计包括:PC占总磷脂的51.78%,PE占总磷脂的37.31%,PS占总磷脂的5.61%、SM占总磷脂的4.47%。
蛋黄磷脂的液质分析检测图谱见图1。
按照实验例3的实验方法测定蛋黄磷脂对斑马鱼ISVs生成的促进作用,实验结果如图4、图5所示。由实验结果可知,与空白对照组相比,模型组的斑马鱼ISVs长度显著性降低(P<0.0001),表明模型药显著抑制了斑马鱼的血管生成,造模成功。与模型组相比,各剂量的蛋黄磷脂组中斑马鱼ISVs长度明显增加,具有统计学差异,证明蛋黄磷脂可有效促进ISVs生长。
按照实验例4的实验方法测定蛋黄磷脂对斑马鱼SIVs生成的促进作用,实验结果如图6、图7所示。由实验结果可知,与空白对照组相比,中浓度(40μg/mL)的蛋黄磷脂组中斑马鱼SIVs长度明显增加,具有显著性差异(P<0.01),其余浓度组活性不明显。
实施例2
大豆磷脂提取物对斑马鱼血管生成的影响
称取大豆100g,粉碎,匀浆,加入浓度为90%的乙醇-水溶液900mL,匀速搅拌提取2次,每次6h,合并提取液,减压抽滤后,滤液经45℃减压浓缩,得到粗磷脂。粗磷脂加浓度为62%的乙醇-水溶液作为溶剂溶解,溶剂体积为200mL,静置24h后,离心15min,保留沉淀部分。用正己烷配成0.5g/mL的溶液,加入60mL丙酮,于4℃冰箱内静置使其沉淀24h。离心15min去除上清液,最终不溶物真空干燥,得到大豆磷脂,其收率为0.15%(对投料大豆计),总磷脂纯度按质量分数计为47.32%;按照实验例2的实验方法测定大豆磷脂的组成和各类磷脂的相对含量,其中磷脂成分按相对含量计包括:PC占总磷脂的37.06%,PE占总磷脂的45.19%,PS占总磷脂的11.78%、PI占总磷脂的2.17%。
大豆磷脂的液质分析检测图谱见图2。
按照实验例3的实验方法测定大豆磷脂对斑马鱼ISVs生成的促进作用,实验结果如图4、图5所示。由实验结果可知,与模型组相比,各剂量的大豆磷脂组中斑马鱼ISVs长度明显增加,具有统计学差异,证明大豆磷脂可有效促进ISVs生长。
按照实验例4的实验方法测定大豆磷脂对斑马鱼SIVs生成的促进作用,实验结果如图6、图7所示。由实验结果可知,与空白对照组相比,各大豆磷脂组中斑马鱼SIVs长度明显增加,具有统计学差异,证明大豆磷脂可有效促进SIVs生长。
实施例3
南美白对虾磷脂提取物对斑马鱼血管生成的影响
称取冷冻保存30天的南美白对虾虾头100g,粉碎,匀浆,加入浓度为90%的乙醇-水溶液850mL,匀速搅拌提取2次,每次6h,合并提取液,减压抽滤后,滤液经45℃减压浓缩,得到粗磷脂。粗磷脂加浓度为62%的乙醇-水溶液作为溶剂溶解,溶剂体积为200mL,静置24h后,离心15min,保留沉淀部分。用正己烷配成0.5g/mL的溶液,加入56mL丙酮,于4℃冰箱内静置使其沉淀24h。离心15min去除上清液,最终不溶物真空干燥,得到南美白对虾磷脂,其收率为0.43%(对投料冷冻南美白对虾虾头计),总磷脂纯度按质量分数计为73.28%,按照实验例2的实验方法测定南美白对虾磷脂的组成和各类磷脂的相对含量,其中磷脂成分按相对含量计包括:PC占总磷脂的86.63%,PE占总磷脂的7.29%,LPC(溶血性磷脂酰胆碱)占总磷脂的5.37%,LPE(溶血性磷脂酰乙醇胺)占总磷脂的0.62%。
南美白对虾磷脂的液质分析检测图谱见图3。
按照实验例3的实验方法测定南美白对虾磷脂对斑马鱼ISVs生成的促进作用,实验结果如图4、图5所示。由实验结果可知,与模型组相比,各剂量的南美白对虾磷脂组中斑马鱼ISVs长度明显增加,具有统计学差异,证明南美白对虾磷脂可有效促进ISVs生长,且随着剂量的增加,磷脂促血管生成活性呈增强趋势。另外,南美白对虾磷脂的促血管生成活性明显强于蛋黄磷脂和大豆磷脂。
按照实验例4的实验方法测定南美白对虾磷脂对斑马鱼SIVs生成的促进作用,实验结果如图6、图7所示。由实验结果可知,与空白对照组相比,各南美白对虾磷脂组中斑马鱼SIVs长度明显增加,具有统计学差异,证明南美白对虾磷脂可有效促进SIVs生长。
实施例4
药品卵磷脂络合碘片对斑马鱼血管生成的影响
按照实验例3的实验方法测定卵磷脂络合碘片对斑马鱼ISVs生成的促进作用。实验结果如图4、图5所示。结果表明,与模型组相比,各剂量的卵磷脂络合碘片可显著促进斑马鱼ISVs的生长,具有统计学差异。
按照实验例4的实验方法测定卵磷脂络合碘片对斑马鱼SIVs生成的促进作用,实验结果如图6、图7所示。由实验结果可知,与空白对照组相比,只有中浓度组(40μg/mL)的卵磷脂络合碘片对斑马鱼SIVs的生长有明显促进作用,具有统计学差异。
实施例5
药品多烯磷脂酰胺胆碱胶囊对斑马鱼血管生成的影响
将多烯磷脂酰胺胆碱胶囊内容物取出,按照实验例3的实验方法测定多烯磷脂酰胺胆碱胶囊对斑马鱼ISVs生成的促进作用。实验结果如图4、图5所示。结果表明,与模型组相比,各剂量的多烯磷脂酰胺胆碱可显著促进斑马鱼ISVs的生长,具有统计学差异,且随着剂量的增加,磷脂促血管生成活性呈增强趋势。
按照实验例4的实验方法测定多烯磷脂酰胺胆碱胶囊对斑马鱼SIVs生成的促进作用,实验结果如图6、图7所示。由实验结果可知,与空白对照组相比,中浓度组(40μg/mL)和高浓度组(80μg/mL)的斑马鱼SIVs长度明显增加,具有统计学差异,低浓度组(20μg/mL)无促进SIVs生长的活性。
实施例6
保健产品大豆磷脂软胶囊对斑马鱼血管生成的影响
将大豆磷脂软胶囊内容物取出,按照实验例3的实验方法测定大豆磷脂软胶囊内容物对斑马鱼ISVs生成的促进作用。实验结果如图4、图5所示。结果表明,与模型组相比,大豆磷脂软胶囊对斑马鱼ISVs生成无明显促进作用。
按照实验例4的实验方法测定大豆磷脂软胶囊内容物对斑马鱼SIVs生成的促进作用。实验结果如图6、图7所示。结果表明,与模型组相比,大豆磷脂软胶囊的中浓度组(40μg/mL)和高浓度组(80μg/mL)对斑马鱼SIVs生成有促进作用。
实施例7
保健产品鱼油软胶囊对斑马鱼血管生成的影响
将鱼油软胶囊内容物取出,按照实验例3的实验方法测定鱼油软胶囊内容物对斑马鱼ISVs生成的促进作用。实验结果如图4、图5所示。结果表明,与模型组相比,鱼油软胶囊对斑马鱼ISVs生成无明显促进作用。
按照实验例4的实验方法测定鱼油软胶囊内容物对斑马鱼SIVs生成的促进作用。实验结果如图6、图7所示。结果表明,与模型组相比,鱼油软胶囊仅中浓度组(40μg/mL)对斑马鱼SIVs生成有促进作用,其余两个浓度组无活性。
对比例
磷脂标准品对斑马鱼血管生成的影响
按照实验例3和实验例4中实验方法分别评价各类磷脂标准品(PC、PE、PS、PI、SM)对斑马鱼ISVs和SIVs生长的促进作用。实验结果详见图8~11。
由图8、图9可知,与模型组相比,除PI外,各磷脂标准品均表现出不同程度的促进斑马鱼ISVs生长的活性。其中,PC和PE的活性均较为显著,但PC活性表现出明显的浓度依赖性,PE则随着浓度增加活性降低。PS的低、中、高浓度组活性差异不大,SM只有高浓度(80μg/mL)组表现出明显的促进ISVs生长活性。
由图10、图11可知,与模型组相比,5类磷脂标准品均表现出不同程度的促进斑马鱼SIVs生长的活性。其中,PI各浓度组均有促进SIVs生长的活性,PC、PS、SM的中、高浓度组表现出明显的活性,PE只有高浓度组有活性。
综上,本发明首次发现,磷脂及磷脂类产品可以逆转PTK787诱导的斑马鱼ISVs损伤,并对斑马鱼SIVs生长有显著的促进作用,能明显的增加血管长度,且毒副作用小。相比而言,南美白对虾磷脂的促ISVs活性明显强于大豆磷脂和蛋黄磷脂,大豆磷脂软胶囊和鱼油软胶囊内容物活性相对不明显,可能因为软胶囊内容物中磷脂含量相对较低的原因。综合各磷脂标准品对ISVs和SIVs的血管促进作用,PC和PS的活性相对更好。本发明可为血管性疾病药物提供候选,具有广阔的市场前景。
以上所述,仅是本发明的优选实施方式,并非是对本发明作其它形式的限制,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,依据本发明的技术实质对以上实施例还可以做出若干改进和润饰,这些改进和润饰也属于本发明的保护范围。
- 磷脂在调控血管生成方面的应用
- 海洋来源磷脂在促进血管生成方面的应用
