包含溶剂/去污剂处理过的血浆(S/D血浆)的制剂及其用途
文献发布时间:2023-06-19 11:34:14
本申请是申请日为2013年9月26日、申请号为201380050163.4、发明名称为“包含溶剂/去污剂处理过的血浆(S/D血浆)的制剂及其用途”的中国发明专利申请的分案申请。
技术领域
本发明涉及药物制剂和它们用于治疗疾病诸如肌骨骼疾病(且更具体地是骨或关节疾病)的用途。
背景技术
肌骨骼疾病或障碍可以影响骨、肌肉、关节、软骨、腱(tendon)、韧带以及支持组织和器官并将组织与器官结合在一起的其它结缔组织。这些疾病可以随时间而发展,或可以例如由肌骨骼系统的过度使用或由创伤引起。肌骨骼疾病可以由于肌骨骼系统与其它内部系统的密切关系而难以诊断和/或治疗。
用于治疗肌骨骼疾病、特别是骨疾病和关节疾病的可能的和有前景的方案是,移植能够经历成骨性的或软骨形成性的分化的间充质干细胞(MSC)或被定向至成骨细胞谱系或成软骨细胞谱系的细胞。
MSC先前已被用于治疗骨障碍(Gangji等人.Expert Opin Biol Ther,2005,第5卷,437-42)。但是,尽管这样的相对未分化的干细胞可被移植,但它们未被定向至成骨细胞谱系或成软骨细胞谱系,因此相当大部分的如此移植的干细胞最终可能对期望的组织的形成没有贡献。此外,可从任何可能的来源组织获得的此类干细胞的量经常是令人不满意的。
药物活性成分的局部递送,尤其是它们局部骨内或骨周或关节内或关节周施用,在肌骨骼疾病中具有巨大益处,辅助增加所述成分的局部浓度和有效性并避免潜在的全身性副作用。例如,高分子量的透明质酸(HA)的关节内注射可有效地恢复受骨关节炎影响的关节的机械完整性。但是,高分子量的HA具有以下缺点:由于胶凝作用而不能提供完全令人满意的支架。在另一个实施例中,植入骨坏死地带中的骨髓在遭受股骨头的无菌非创伤性骨坏死的患者中表现出有益效果(Gangji等人.2005,出处同上)。
因此,持续需要另外的和/或改进的药物制剂,其被构造用于局部施用,诸如用于骨内、骨周、关节内或关节周施用,或用于腱内的、腱周的、韧带内的或韧带周的施用。特别有用的制剂在施用后可以表现出或达到凝胶稠度,由此使在该制剂内包含的药物活性成分在原位被保留在凝胶中并从凝胶逐渐释放,即,持续的或缓慢的释放。并且,在所述制剂含有治疗性细胞的情况下,凝胶稠度可以提供细胞支持环境,且可以确保接近细胞和任选的有益物质(诸如刺激细胞的存活、增殖(繁殖)和/或分化的生长因子)。
在全世界在血库中制备新鲜冷冻血浆(FFP)主要作为红细胞浓缩制品的副产物。为了提高FFP的安全性,在二十世纪八十年代期间已经开发出了血浆的溶剂/去污剂(S/D)处理,从而导致在1992年的制备产品。S/D处理和S/D处理过的血浆尤其描述在Horowitz等人.1992;US 4,764,369;EP 0 322 786;和US 2002/018777中。血浆的S/D处理会破坏脂质包膜病毒、细胞和大多数原生动物的膜,同时剩下完整的不稳定的凝血因子。所述处理对细菌具有可变的效力,且对非脂质包膜病毒基本上无效。与FFP相比,S/D处理过的血浆显示出就输血相关的急性肺损伤(TRALI)而言极高的安全性、显著降低的引起变态反应的可能性和较低的凝血因子血浆水平在批次之间的变化。JP2011229508(摘要)涉及细胞组合物,其包含嵌入在凝胶(包括血浆)中的骨架成肌细胞。
WO 2009/016451涉及单独的或与透明质酸组合的同源或自体血液衍生的物质用于治疗关节疾病、关节疼痛或皮肤的用途。Park等人.2009涉及纤维蛋白和透明质酸的组合,其作为用于软骨修复的兔软骨细胞的细胞递送媒介物。
发明内容
本发明的发明人已经发现了解决本领域中的一个或多个上述问题的药物制剂。
本发明的一个方面涉及一种药物制剂,其包含溶剂/去污剂处理过的血浆(S/D血浆)和糖胺聚糖。
如在实施例部分中证实的,应用本发明的原理的制剂具有以下有利性质:在体外与受试者(诸如人受试者)的体液(特别是血清或滑液,例如来自遭受膝骨关节炎或骨疾病的患者)接触发生胶凝(gelify)。这样的应用本发明的原理的制剂被证实在体外与体液(诸如全血)接触发生胶凝,并因此具有当与体液(诸如全血)接触时在原位胶凝(原位凝固)的性质。例如,本发明的制剂可以有利地提供来自全血的自体生长因子的天然环境。所述制剂表现出特别好的原位凝胶形成性能(即,当在受试者的身体的给定地方或部位(例如,骨、关节、腱或韧带)施用时),有利地产生粘稠制剂。例如,一旦注射进关节缺损中,本发明的制剂允许原位胶凝和恢复关节炎性关节(诸如关节炎性膝关节)的生理学和流变学状态。此外,该粘稠性质可以确保制剂的组分(即S/D血浆,其可以包含有益的生物物质诸如内源性生长因子)和/或糖胺聚糖的局部递送和/或持续释放。所述粘稠性质还可以允许在所述制剂中掺入另外的药物活性成分(例如,但不限于,细胞组合物、药物活性化合物、蛋白、肽和/或小有机分子),并由此实现这样的成分的局部递送和/或持续释放。发明人还预见到,所述粘稠性质可以保护制剂的组分和/或在其中包含的另外的药物活性成分免于物理环境,由此提高所述组分和成分在体内的总稳定性(例如,对抗酶促降解的稳定性)。发明人进一步假定,所述粘稠性质可以允许通过对关节的长期润滑作用而改善关节功能,由此更好地恢复关节的机械完整性。发明人还预见到,所述制剂可以允许通过骨诱导作用而改善骨愈合。
所述药物制剂通常可以包含一种或多种药学上可接受的赋形剂(例如,溶剂、载体、稀释剂等),特别是与所述制剂的预期施用模式相容的赋形剂,诸如尤其是所述制剂的胃肠外和优选骨内、骨周、关节内或关节周施用,或所述制剂的腱内、腱周、韧带内或韧带周施用。
所述药物制剂可以通过包含将S/D血浆和糖胺聚糖组合(例如,混合或包含在多组分试剂盒(kits of parts)中)的方法来生产;这样的方法被包括在本文中。因此,糖胺聚糖可以适当地被表示为外源的,或外源性地加入S/D血浆中,或在S/D血浆的基础上另外提供。
所述药物制剂可以被构造成用于S/D血浆和糖胺聚糖和当被包含时的另外的药物活性成分的单独、同时或先后以任意次序施用。因此,所述药物制剂可以是所有它的各种组分的混合物,或它可以是组合,诸如多组分试剂盒,其分别包含各种组分或包含2种或更多种、但并非所有各种组分的混合物。因此,可以将所述制剂构造为包含S/D血浆和糖胺聚糖的多组分试剂盒。
所述药物制剂可以在医疗装置中提供。这样的医疗装置有利地允许所述制剂向有此需要的受试者的胃肠外施用,诸如骨内、骨周、关节内或关节周施用或腱内、腱周、韧带内或韧带周施用。
优选地,所述S/D血浆可以是人S/D血浆,使得包含人S/D血浆的药物制剂特别适用于施用给人受试者。
在某些实施方案中,所述糖胺聚糖可以选自:透明质酸及其衍生物、蛋白聚糖及其衍生物、硫酸软骨素、硫酸角质素、脱乙酰壳多糖(chitosan)及其衍生物、甲壳质(chitin)及其衍生物。所述制剂可以包含一种或多种糖胺聚糖。所述制剂因而可以包含一种糖胺聚糖或选自以下的糖胺聚糖的混合物:透明质酸及其衍生物、蛋白聚糖及其衍生物、硫酸软骨素、硫酸角质素、脱乙酰壳多糖及其衍生物、甲壳质及其衍生物。
非限制性地,所述药物制剂可以包含在以下浓度范围内的糖胺聚糖:约0.10mg/ml至约200mg/ml,优选约1.0mg/ml至约100mg/ml,更优选约2.0mg/ml至约50mg/ml,例如,约10mg/ml、约20mg/ml、约30mg/ml或约40mg/ml。
通常,骨内或骨周注射或关节内或关节周注射可以具有约2ml至约4ml的体积。
在糖胺聚糖表现出它自身的治疗益处的情况下,它可以以治疗有效量包含,诸如在该段落中列举的示例性量。
在特别优选的实施方案中,所述糖胺聚糖可以是透明质酸或其衍生物。
非限制性地,合适的衍生物可以是透明质酸的盐,诸如优选地是透明质酸钠。透明质酸或其衍生物可以具有低(<900kDa)或高(>900kDa)分子质量。特别优选的可以是具有高(>900kDa)分子质量的透明质酸或其衍生物。例如,透明质酸或其衍生物可以具有在约1×10
非限制性地,所述药物制剂可以包含在以下浓度范围内的透明质酸或其衍生物:约0.10mg/ml至约200mg/ml,优选约1.0mg/ml至约100mg/ml,更优选约2.0mg/ml至约50mg/ml。
在某些实施方案中,所述药物制剂可以包含除了S/D血浆和糖胺聚糖以外的一种或多种其它成分。在其它实施方案中,所述S/D血浆和糖胺聚糖可以是所述制剂的唯一组分;因此,在这样的实施方案中,所述药物制剂可以由S/D血浆和糖胺聚糖组成或基本上由S/D血浆和糖胺聚糖组成。在其它实施方案中,所述药物制剂可以包含除了S/D血浆和糖胺聚糖以外的一种或多种其它成分,但是这样的其它成分不是药物活性成分。
在某些实施方案中,所述药物制剂可以有利地进一步包含一种或多种药物活性成分。
本发明的适用性不限于任何药物活性成分或药物活性成分类别。所述药物活性成分本身可以是药理学上有活性的,或可以通过化学或酶促过程在体内转化成药理学上有活性的物质,即,所述药物活性成分可以是前药。本发明的药物制剂对于稳定性较差的药物活性成分而言可能是特别有用的。稳定性较差的药物活性成分的示例性的非限制性例子包括肽和蛋白诸如生长因子、肽样活性成分、抗体和疫苗、小干扰RNA(siRNA)、DNA、激素等。
术语“药物活性成分”也包括标题化合物或物质的任何药理学上有活性的盐、酯、N-氧化物或前药。
此外,可以包括两种或更多种药物活性成分或剂量组合的组合(combination)作为药物组分。在该情况下,每种活性成分的释放可以是相同的或不同的,例如在2种活性成分的组合的情况下,其中第一种活性成分以立即释放形式呈现,第二种活性成分以控释形式呈现。类似地,也可以得到相同活性成分的立即释放和控释形式的组合,以便提供快速的且持续的效应。
在某些实施方案中,所述药物制剂可以进一步包含血清。血清向本发明的制剂中的添加可以允许在某种程度上改善所述制剂的胶凝作用。
例如,所述血清可以就接受制剂的受试者而言是同种异体的或自体的。优选地,所述血清可以是人血清,使得进一步包含人血清的药物制剂特别适用于施用给人受试者。例如,所述制剂可以含有血清和S/D血浆,使得计算为(制剂中的血清的体积)/(制剂中的血清的体积+制剂中的S/D血浆的体积)的值是在约0.01至约0.40之间,优选地在约0.05至约0.15之间,更优选约0.10。
在某些实施方案中,所述药物制剂可以进一步包含全血或全血的分级分离组分。全血或所述分级分离组分(优选全血的分级分离组分)向本发明的制剂中的添加可以允许至少部分地改善所述制剂的胶凝作用。
本发明的包含全血或所述全血的分级分离组分的制剂有利地包含在再生医学中有用的血小板衍生的生长因子,尤其是用于刺激骨、软骨、腱或韧带缺陷的修复,或用于替换受损伤的骨、软骨、腱或韧带(Gobbi等人,2009;Grimaud等人,2002;Cole等人,2010)。
例如,所述全血就接受制剂的受试者而言可以是同种异体的或自体的。优选地,所述全血可以是人全血,使得进一步包含人全血的药物制剂特别适用于施用给人受试者。例如,所述制剂可以含有全血和S/D血浆,使得计算为(制剂中的全血的体积)/(制剂中的全血的体积+制剂中的S/D血浆的体积)的值是在约0.01至约0.40之间,优选地在约0.05至约0.15之间,更优选约0.10。
在优选的实施方案中,所述一种或多种药物活性成分各自独立地选自:细胞组合物、药物活性化合物、蛋白、肽和小有机分子。
优选地,所述细胞组合物可以包含间充质干细胞(MSC)、骨原细胞、成骨细胞、骨细胞、成软骨细胞和/或软骨细胞。所述药物制剂因而允许递送这样的细胞组合物。本发明的药物制剂的该粘稠性质可以确保递送的细胞的局部递送和合适的支持环境。
特别优选地,所述细胞组合物的细胞可以是动物细胞,优选温血动物细胞,更优选哺乳动物细胞,诸如人细胞或非人哺乳动物细胞,最优选人细胞。
在其它实施方案中,所述药物活性化合物可以是抗炎物质。在优选的实施方案中,所述药物活性化合物可以是α-2肾上腺素能受体激动剂。优选地,所述α-2肾上腺素能受体激动剂可以选自可乐定及其衍生物。
在某些实施方案中,所述α-2肾上腺素能受体激动剂可以选自可乐定及其衍生物,包括2,6-二甲基可乐定、4-叠氮基可乐定、3,5-二氯酪氨酸-4-羧基可乐定-甲酯、4-羟基可乐定、4-碘可乐定、烯丙尼定、安普乐定、氯乙基可乐定、4-异硫氰酸可乐定(clonidine4-isothiocyanate)、4-甲基异硫氰酸可乐定、可乐定受体、可乐定置换物质、羟基苯乙酰基氨基可乐定、N,N'-二甲基可乐定、对氨基可乐定和噻美尼定;咪唑烷类,包括咪唑啉类、英普咪定、地托咪定、美托咪定、右美托咪定、左旋咪唑、氯沙坦、洛非西定、咪康唑、萘甲唑林、尼立达唑、硝基咪唑、昂丹司琼、羟甲唑啉、酚妥拉明、四米唑、甲巯咪唑、替扎尼定、妥拉唑林、阿方纳特;咪唑类,包括4-(3-丁氧基-4-甲氧基苄基)咪唑烷-2-酮、尿刊酸、氨基-咪唑羧酰胺、安他唑啉、生物素、双(4-甲基-1-高哌嗪基硫羰基)二硫化物、卡比马唑、西咪替丁、克霉唑、肌酸酐、达卡巴嗪、右美托咪定、益康唑、依诺昔酮、依替咪唑(ethymizol)、依托咪酯、法倔唑、氟司必林、咪唑克生、米伐折醇;胍类,包括胍丁胺、倍他尼定、双胍类、西咪替丁、肌酸、加贝酯、胍乙啶、胍乙啶硫酸盐、胍氯芳、胍法辛、胍、胍诺沙苄、英普咪定、碘-3苄基胍、甲基胍、米托胍腙、亚硝基胍、吡那地尔、罗贝胍、磺胺脒、扎那米韦;α-methyinorepherine、氮卓克唑、5-溴-6-(2咪唑烷-2-基氨基)喹喔啉、富马酸福莫特罗、吲哚拉明、二盐酸6-烯丙基-2-氨基-5,6,7,8-四氢4H-噻唑并[4,5-d]氮杂环庚三烯、尼麦角林、利美尼定和赛拉嗪。
在某些实施方案中,所述药物制剂可以进一步包含一种或多种具有成骨性能、骨诱导性能和/或骨传导性能的物质。在优选的实施方案中,这样的物质可以选自包含以下成员或由以下成员组成的集合:成纤维细胞生长因子(FGF)、优选FGF-2、转化生长因子β(TGFB)、优选TGFB-1、血小板衍生的生长因子(PDGF)、白介素-8(IL-8)、骨形态发生蛋白(BMP),例如BMP-2、BMP-4、BMP-6和BMP-7、甲状旁腺激素(PTH)、甲状旁腺激素相关的蛋白(PTHrp)和干细胞因子(SCF)中的任意一种或多种。
因此,在某些实施方案中,所述药物活性蛋白或肽可以是生长因子,优选选自FGF、TGFB、PDGF、IL-8、BMP、PTH、PTHrp和SCF的生长因子,更优选选自FGF-2、TGFB-1、PDGF、IL-8、BMP-2、BMP-4、BMP-6、BMP-7、PTH、PTHrp和SCF的生长因子。
优选地,所述药物制剂可以构造成用于胃肠外施用,诸如胃肠外注射,更优选地用于骨内、骨周、关节内或关节周施用,诸如骨内、骨周、关节内或关节周注射,或用于腱内、腱周、韧带内或韧带周施用,例如,腱内、腱周、韧带内或韧带周注射。
一个有关的方面涉及在肌骨骼疾病的治疗(贯穿本说明书,包括治疗性和/或预防性措施)中使用的如上所述的药物制剂。优选地,所述肌骨骼疾病可以是骨疾病或关节疾病。可替换地或额外地,所述肌骨骼疾病可以影响腱和/或韧带。
也预见到如上所述的药物制剂用于制备药物的用途,所述药物用于治疗肌骨骼疾病,优选骨疾病或关节疾病。可替换地或额外地,所述肌骨骼疾病可以影响腱和/或韧带。
进一步预见到在需要这种治疗的受试者中治疗肌骨骼疾病、优选骨疾病或关节疾病(可替换地或额外地,所述疾病可以影响腱和/或韧带)的方法,所述方法包括:给所述受试者施用治疗或预防有效量的如上所述的药物制剂。
扩展这些发现,本发明的发明人已经实现了前述制剂作为药物赋形剂、更优选地作为持续释放或缓释药物赋形剂的用途。因此,一个有关的方面提供了包含S/D血浆和糖胺聚糖的制剂的用途,所述S/D血浆和糖胺聚糖作为药物赋形剂,优选地作为被构造成用于胃肠外施用、更优选地用于骨内、骨周、关节内或关节周施用、或用于腱内、腱周、韧带内或韧带周施用的药物制剂中的药物赋形剂。
因此,也公开了包含S/D血浆和糖胺聚糖的制剂,所述S/D血浆和糖胺聚糖用作药物赋形剂,更优选地用作持续释放或缓释药物赋形剂,优选地用作用于治疗肌骨骼疾病、优选骨疾病或关节疾病(可替换地或额外地,所述疾病可以影响腱和/或韧带)的药物赋形剂。进一步公开了包含S/D血浆和糖胺聚糖的制剂的以下用途:用于制备药物赋形剂、更优选持续释放或缓释药物赋形剂,优选地用于制备治疗肌骨骼疾病、优选骨疾病或关节疾病(可替换地或额外地,所述疾病可以影响腱和/或韧带)所用的药物赋形剂。再进一步提供了在需要这种治疗的受试者中治疗肌骨骼疾病、优选骨疾病或关节疾病(可替换地或额外地,所述疾病可以影响腱和/或韧带)的方法,所述方法包括:给所述受试者施用包含S/D血浆和糖胺聚糖的制剂,所述S/D血浆和糖胺聚糖作为药物赋形剂,更优选地作为持续释放或缓释药物赋形剂。
优选地,所述S/D血浆可以是人S/D血浆,使得包含人S/D血浆的药物制剂特别适用于施用给人受试者。
还在本文中公开了S/D血浆的以下用途:作为药物赋形剂,优选地作为被构造成用于胃肠外施用、更优选地用于骨内、骨周、关节内或关节周施用、或用于腱内、腱周、韧带内或韧带周施用的药物制剂中的药物赋形剂。
因此,进一步公开了用于以下用途的S/D血浆:用作药物赋形剂,更优选地用作持续释放或缓释药物赋形剂,优选地用作用于治疗肌骨骼疾病、优选骨疾病或关节疾病(可替换地或额外地,所述疾病可以影响腱和/或韧带)的药物赋形剂。此外,在本文中公开了S/D血浆的以下用途:用于制备药物赋形剂、更优选持续释放或缓释药物赋形剂,优选地用于制备治疗肌骨骼疾病、优选骨疾病或关节疾病(可替换地或额外地,所述疾病可以影响腱和/或韧带)所用的药物赋形剂。更进一步提供了在需要这种治疗的受试者中治疗肌骨骼疾病、优选骨疾病或关节疾病(可替换地或额外地,所述疾病可以影响腱和/或韧带)的方法,所述方法包括:给所述受试者施用S/D血浆作为药物赋形剂,更优选地作为持续释放或缓释药物赋形剂。
优选地,所述S/D血浆可以是人S/D血浆,使得包含人S/D血浆的药物制剂特别适用于施用给人受试者。
还在本文中公开了前述制剂作为细胞培养基补充物的用途。因此,一个有关的方面提供了包含S/D血浆和糖胺聚糖的制剂作为细胞培养基补充物的用途。这样的制剂可以有利地允许得到具有改善的性能的细胞或细胞培养物。
贯穿本发明的该方面和任意它的实施方案,所述S/D血浆可以优选地是哺乳动物S/D血浆,更优选地是人S/D血浆。也贯穿本发明的该方面和任意它的实施方案,所述血清可以是哺乳动物血清,更优选地是人血清。也优选地,所述S/D血浆可以是哺乳动物S/D血浆,且所述血清可以是哺乳动物血清,或所述S/D血浆可以是人S/D血浆,且所述血清可以是人血清。人血浆和/或血清就施用给人受试者而言可以是特别有利的。也贯穿本发明的该方面和任意它的实施方案,所述全血可以是哺乳动物全血,更优选地是人全血。也优选地,所述S/D血浆可以是哺乳动物S/D血浆,且所述全血可以是哺乳动物全血,或所述S/D血浆可以是人S/D血浆,且所述全血可以是人全血。人血浆和/或全血就施用给人受试者而言可以是特别有利的。
还在本文中公开了如上教导的药物制剂及其对应的用途,其中所述糖胺聚糖从制剂中省略。因此,这样的制剂可以具体地包含S/D血浆(优选人S/D血浆)和任意一种或多种如上教导的组分,具体地是以下的任意一种或多种:血清、全血或其分级分离组分、一种或多种药物活性成分(例如,各自独立地选自细胞组合物、药物活性化合物、蛋白、肽和小有机分子)。这样的制剂也可以表现出令人满意的凝胶形成性能。
在以下部分中和在所附权利要求中描述了本发明的以上方面和其它方面以及优选实施方案。所附权利要求的主题特此明确地并入本说明书中。
附图说明
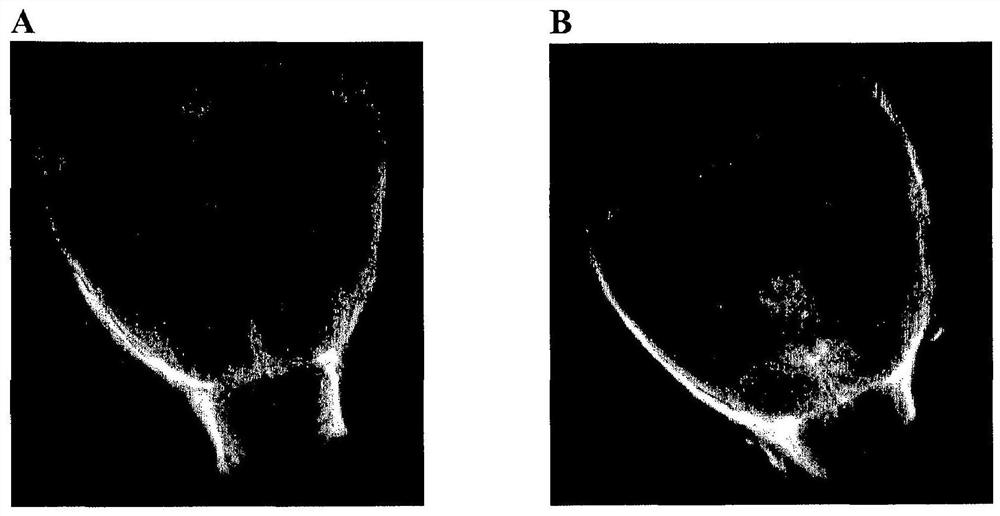
图1图解给颅盖截骨术的免疫活性小鼠模型的骨质缺损部位施用含有S/D血浆、IL-8和CaCl
图2提供了在图1B中显示的新形成的组织在20倍(A)和40倍放大率的显微分析。给颅盖截骨术的免疫活性小鼠模型的骨质缺损部位施用含有S/D血浆、IL-8和CaCl
具体实施方式
本文中使用的单数形式“一个”、“一种”和“所述”包括单数和复数指示物,除非上下文另外清楚地指明。
本文中使用的术语“包含”与“包括”或“含有”同义,并且是包括性的或开放性的,并且不排除另外的未引述的成员、要素或方法步骤。所述术语还包括“由……组成”和”基本上由……组成”。
通过端点限定的数字范围的列举包括被包含在各自范围内的所有数值和部分以及所列举的端点。
本文中使用的术语“约”当表示可测量的值诸如参数、量、持续时间等时,意欲包括指定值的变化和相对于指定值的变化,尤其是指定值的±10%或更小、优选±5%或更小、更优选±1%或更小和更优选±0.1%或更小的变化和相对于指定值的±10%或更小、优选±5%或更小、更优选±1%或更小和更优选±0.1%或更小的变化,只要这样的变化可适当执行公开的发明。应当理解,也明确地并优选地公开修饰词“约”所涉及的值本身。
尽管术语“一个/种或多个/种”(诸如一组成员中的一个或多个成员)本身是明确的,作为进一步例证,该术语特别地包括对所述成员中的任一个的提及,或对所述成员中的任意两个或更多个的提及,例如,对所述成员中的任意≥3、≥4、≥5、≥6或≥7个等且直至所有所述成员的提及。
在本说明书中引用的所有文件特此通过引用整体并入。
除非另外指出,否则用于公开本发明的所有术语(包括技术和科学术语)具有与本发明所属领域的普通技术人员通常理解的含义相同的含义。作为进一步指导,可以包括术语的定义以更好地理解本发明的教导。
在大规模哺乳动物细胞培养(Large Scale Mammalian Cell Culture)(Hu等人.1997.Curr Opin Biotechnol 8:148);无血清培养基(Serum-free Media)(K.Kitano.1991.Biotechnology 17:73);或大规模哺乳动物细胞培养(Large ScaleMammalian Cell Culture)(Curr Opin Biotechnol 2:375,1991)中,特别地概述了在细胞培养和培养基使用中的一般技术。
术语“药物制剂”、“药物组合物”或“药物制品”可以在本文中互换使用。同样地,术语“制剂”、“组合物”或“制品”可以在本文中互换使用。
术语“血浆”是如常规定义的。血浆通常得自全血的样品,所述样品被提供抗凝剂(例如,肝素、柠檬酸盐、草酸盐或EDTA)或与所述抗凝剂接触。随后,通过合适的技术,通常通过离心,将血液样品的细胞组分与液体组分(血浆)分离。因此,术语“血浆”表示不形成人或动物身体的部分的组合物。
术语“溶剂/去污剂处理过的血浆”、“S/D处理过的血浆”或“S/D血浆”通常表示可从包括下述步骤的方法或从包括下述步骤的方法得到的去细胞化的(decellularised)血浆:(a)用溶剂和去污剂处理血浆,和(b)过滤溶剂/去污剂处理过的血浆。
要在步骤(a)中处理的血浆可以是如常规地定义的任何血浆,诸如新鲜血浆、新鲜冷冻血浆、融化的冷冻血浆、或得自冷冻血浆的冷沉淀物、冷上清液或浓缩物及其稀释产品。血浆通常得自全血样品或通过单采血液成分术(apheresis)得到的样品。
在US 4,764,369中描述了溶剂诸如二-或三-烷基磷酸盐和去污剂。用于制备S/D血浆的溶剂优选地是二烷基磷酸盐或三烷基磷酸盐,二者都具有含有1-10个碳原子、特别是2-10个碳原子的烷基。溶剂的示例性例子可以包括三-(正丁基)磷酸盐、三-(叔丁基)磷酸盐、三-(正己基)磷酸盐、三-(2-乙基己基)磷酸盐或三-(正癸基)磷酸盐。一种优选的溶剂是三-(正丁基)磷酸盐。还可以采用不同三烷基磷酸盐的混合物以及具有不同烷基链(例如,乙基)的烷基的磷酸盐,二(正丁基)磷酸盐。类似地,可以采用各种二烷基磷酸盐,包括二烷基磷酸盐的不同烷基混合物的那些。此外,可以采用二-和三-烷基磷酸盐的混合物。
用在处理步骤(a)中的溶剂诸如二-或三-烷基磷酸盐优选地以在约0.01mg/ml至约100mg/ml、和优选约0.1mg/ml至约10mg/ml的范围内的量使用。换而言之,用在处理步骤(a)中的二-或三-烷基磷酸盐优选地以在约0.001%w/v至约10%w/v、和优选约0.01%w/v至约1%w/v的范围内的量使用。
用于制备S/D血浆的去污剂优选地是无毒的去污剂。预见到的非离子去污剂包括这样的去污剂:当向其中引入1克去污剂/100ml溶液时,其在优势温度将至少0.1重量%的脂肪分散在含有它们的水溶液中。去污剂的示例性例子可以包括脂肪酸的聚氧乙烯衍生物、山梨醇酸酐的偏酯(例如,商业上被称作“吐温80”、“吐温20”和“聚山梨酯80”的那些产品)和非离子的油可溶性的水去污剂,诸如商业上在商标“Triton X 100”(氧乙基化的烷基苯酚)下销售的去污剂。也预见到脱氧胆酸钠以及“Zwittergents”(其为被称作“磺基甜菜碱”的合成两性离子去污剂,诸如N-十二基-N,N-甲基-2-铵基-1-乙烷磺酸盐和它的同源物)或非离子去污剂诸如辛基-β-D-吡喃葡萄糖苷。
去污剂的量可以在约0.001%v/v至约10%v/v、优选约0.01%v/v至1.5%v/v的范围内。
优选地在-5℃至70℃之间(优选0℃至60℃之间)的温度实现用溶剂和去污剂的处理。这样的处理(接触)的时间是至少1分钟,优选至少1小时,通常是4-24小时。所述处理通常在常压下是有效的,尽管也可以采用低大气压力(subatmopheric pressure)和超大气压力(superatmospheric pressure)。
通常,在处理以后,除去溶剂(诸如三烷基磷酸盐)和去污剂。通过适合用于从血浆分离溶剂和去污剂的任何技术,可以除去溶剂和去污剂。当与溶剂(诸如三烷基磷酸盐)一起使用非离子去污剂时,它们可以如下除去:(1)使用截留血浆蛋白的多微孔膜(诸如TEFLON)渗滤;(2)将期望的血浆组分吸收在色谱或亲和色谱支持物上;(3)沉淀,例如,通过血浆蛋白的盐析;(4)低压冻干法等。
溶剂(诸如二烷基磷酸盐或三烷基磷酸盐)可以如下除去:(a)通过用2.2摩尔甘氨酸和2.0M氯化钠沉淀AHF,可以从抗血友病因子(AHF)除去;(b)通过使纤连蛋白结合在不溶明胶柱上并洗涤结合的纤连蛋白以除去试剂,可以从纤连蛋白除去。
过滤步骤(b)通常用1μm过滤器进行以除去细胞和碎片,随后使用0.2μm过滤器无菌过滤。
作为优选实施例,如Horowitz等人,1992(Blood,3,826-831)所述,可以如下制备S/D血浆:可以将FFP快速地融化,并可以在搅拌下用1%(v/v)三-(N-丁基)-磷酸(TNBP)和1%(v/v)聚氧乙烯-对-叔辛基苯酚(Triton X-100)在30℃处理4小时。处理以后,可以加入食用油诸如大豆油(5%v/v)或蓖麻油,轻轻混合30分钟,并可以在10,000g离心20分钟进行除去。可以将经澄清的血浆应用于Waters Prep C18树脂柱,使得血浆与柱体积的比率是6,且接触时间可以是3分钟。可以在0.2μm过滤器上过滤柱洗脱液。
例如,S/D血浆可作为
术语“S/D血浆”包括这样的血浆:其包含降低的纤溶酶抑制剂浓度或活性,诸如等于或小于0.60IU/ml或等于或小于0.50IU/ml的纤溶酶抑制剂水平,例如在0.20-0.30IU/ml之间、更具体地在0.22-0.25IU/ml之间的纤溶酶抑制剂水平。
与新鲜冷冻血浆(FFP)相比,S/D血浆可以包含降低的以下一种或多种的量和/或活性:纤溶酶抑制剂、蛋白S、因子XI、因子V、因子VIII、因子X、α2抗纤维蛋白溶酶、抗-胰蛋白酶、von Willebrand因子(vWF)和von Willebrand因子裂解蛋白酶(VWFCP)(也被称作解联蛋白和金属蛋白酶,其具有凝血酶敏感蛋白1型基序、成员13(ADAMTS-13))、肿瘤坏死因子-α(TNFα)、白介素-8(IL-8)、白介素-10(IL-10)(Benjamin和McLaughlin,2012,Svae等人,2007;Beeck和Hellstern,1998;Doyle等人,2003;Mast等人,1999,Theusinger等人,2011),和/或可以包含增加的因子VII的量和/或活性(Doyle等人,2003)。
S/D血浆可以直接用在本发明的药物制剂中。它们还可以适当地储存用于以后使用(例如,在高于血浆或血清各自的冰点、但是低于环境温度的温度储存较短的时间段,例如,至多约1-2周,该温度通常是约4℃至5℃;或通常在约-70℃至约-80℃之间通过冷冻贮存来储存较长的时间)。
如本领域已知的,可以将S/D血浆热灭活,特别是为了除去补体。在本发明的药物制剂采用要治疗的受试者自体的S/D血浆时,可能不必热灭活S/D血浆。在S/D血浆与要治疗的受试者至少部分地同种异体时,可能有利的是热灭活S/D血浆。
本发明的药物制剂可以包含要治疗的受试者自体的S/D血浆。关于S/D血浆的术语“自体”表示,所述S/D血浆得自与S/D血浆接触或用S/D血浆治疗过的相同受试者。本发明的药物制剂可以包含要治疗的受试者“同源的”或“同种异体的”S/D血浆,即,得自除了要与S/D血浆接触或用S/D血浆治疗过的受试者以外的一个或多个(合并的)受试者。本发明的药物制剂也可以包含如上定义的自体的和同源的(同种异体的)S/D血浆的混合物。优选地,所述药物制剂可以包含要治疗的受试者“同种异体的”S/D血浆。有利地,同种异体的S/D血浆是商购可得的,且因此是无限制的血浆来源。
术语“血清”是如常规定义的。血清通常可以如下从全血样品获得:首先使凝固在样品中发生,随后通过合适的技术(通常通过离心),将如此形成的凝块和血液样品的细胞组分与液体组分(血清)分离。凝固可以通过惰性催化剂(例如,玻璃珠或粉末)来促进。可替换地,可以通过除去抗凝剂和纤维蛋白来从血浆获得血清。因此,术语“血清”表示不形成人或动物身体的部分的组合物。
血清可以直接用在如本文教导的药物制剂中。它们还可以适当地储存用于以后使用(例如,在高于血浆或血清各自的冰点、但是低于环境温度的温度储存较短的时间段,例如,至多约1-2周,该温度通常是约4℃至5℃;或通常在约-70℃至约-80℃之间通过冷冻贮存来储存较长的时间)。
如本领域已知的,可以将血清热灭活,特别是为了除去补体。在本发明的药物制剂采用在有血清存在下培养的细胞的自体血清时,可能不必热灭活血清。在血清与培养的细胞至少部分地同种异体时,可能有利的是热灭活血清。
任选地,也可以在贮存或使用之前使用常规微生物过滤器,优选地具有0.2μm或更小的孔径,将血清灭菌。
在某些实施方案中,所述药物制剂可以采用要治疗的受试者自体的血清。关于血清的术语“自体”表示,所述血清得自要与所述血清接触的相同受试者。在某些实施方案中,所述药物制剂可以采用要治疗的受试者“同源的”或“同种异体的”血清,即,得自除了要与所述血清接触的受试者以外的一个或多个(合并的)受试者。在某些实施方案中,所述药物制剂可以采用如上定义的自体和同源的(同种异体的)血清的混合物。
术语“全血”是如常规定义的。优选地,所述样品可容易地通过微创伤方法得到,从而允许从受试者除去或分离全血。通常给全血提供抗凝剂(例如,肝素、柠檬酸盐、草酸盐或EDTA)或使全血与所述抗凝剂接触。
所述全血可以直接用在如本文教导的药物制剂中。所述全血还可以适当地储存用于以后使用(例如,在高于全血的冰点、但是低于环境温度的温度储存较短的时间段,例如,至多约1-4周,该温度通常是约4℃至5℃;或通常在约-70℃至约-160℃之间(诸如在约-70℃至约-80℃之间,诸如在约-160℃)通过冷冻贮存来储存较长的时间)。
在某些实施方案中,所述药物制剂可以采用要治疗的受试者自体的全血。关于全血的术语“自体”表示,所述全血得自要与所述全血接触的相同受试者。在某些实施方案中,所述药物制剂可以采用要治疗的受试者“同源的”或“同种异体的”全血,即,得自除了要与所述全血接触的受试者以外的一个或多个(合并的)受试者。在某些实施方案中,所述药物制剂可以采用如上定义的自体和同源的(同种异体的)全血的混合物。
在某些实施方案中,所述糖胺聚糖可以选自透明质酸及其衍生物、蛋白聚糖及其衍生物、硫酸软骨素、硫酸角质素、脱乙酰壳多糖及其衍生物、甲壳质及其衍生物。
术语“透明质酸”或“HA”可以与“透明质烷”或“透明质酸盐”互换使用。术语“透明质酸”表示由D-葡糖醛酸和N-乙酰基-D-葡糖胺(二者经由交替的β-1,4和β-1,3糖苷键连接)组成的二糖的阴离子的、未硫酸化的聚合物。透明质酸衍生物包括、但不限于:透明质酸盐(诸如透明质酸钠)或透明质酸与脂族、杂环或环脂族系列的醇的酯,或硫酸化形式的透明质酸或包含透明质酸的试剂的组合。
术语“蛋白聚糖”表示具有一个或多个共价地连接的糖胺聚糖(GAG)链的蛋白。所述糖胺聚糖可以是选自核心蛋白聚糖、二聚糖、睾丸蛋白聚糖、纤调蛋白聚糖、基膜聚糖、多功能蛋白聚糖、基底膜蛋白聚糖、神经蛋白聚糖或聚集蛋白聚糖的蛋白聚糖。
术语“硫酸软骨素”表示由N-乙酰基半乳糖胺和葡糖醛酸(其中的每一个可以在不同的位置和量被硫酸化)组成的二糖的聚合物。硫酸软骨素可以选自4-硫酸软骨素、6-硫酸软骨素、2,6-硫酸软骨素、4,6-硫酸软骨素。
术语“硫酸角质素”可以与“硫酸角质”互换使用,并表示重复二糖-3Galβ1-4GlcNAcβ1-的聚合物,其可以在Gal或GlcNAc单糖中的任一个或二者的6位碳(C6)处被硫酸化。
术语“脱乙酰壳多糖”表示由随机分布的β-(1-4)-连接的D-葡糖胺(脱乙酰化单元)和N-乙酰基-D-葡糖胺(乙酰化单元)组成的直链聚合物。
术语“甲壳质”表示由β-(1,4)-连接的N-乙酰基葡糖胺组成的聚合物。
在某些实施方案中,所述药物制剂进一步包含一种或多种药物活性成分。
这样的药物活性成分可以包括例如细胞组合物。
在某些实施方案中,所述细胞组合物可以包含间充质干细胞(MSC)、骨原细胞、成骨细胞、骨细胞、成软骨细胞和/或软骨细胞。
本文中使用的术语“间充质干细胞”或“MSC”表示成体、中胚层衍生的干细胞,其能够产生间充质谱系的细胞,通常是两个或更多个间充质谱系的细胞,例如,成骨细胞(骨)、软骨细胞(软骨)、肌细胞(肌)、腱细胞(腱)、成纤维细胞(结缔组织)、脂肪细胞(脂肪)和基质源性(骨髓基质)谱系的细胞。MSC可以从例如骨髓、小梁骨、血液、脐带、胎盘、胎儿卵黄囊、皮肤(真皮)、特别是胎儿和青少年皮肤、骨膜和脂肪组织分离。人MSC、它们的分离、体外繁殖和分化已描述于例如美国专利号5,486,359、美国专利号5,811,094、美国专利号5,736,396、美国专利号5,837,539或美国专利号5,827,740中。本领域中描述的和通过本领域描述的任何方法分离的任何MSC可以在本发明的药物制剂中是合适的。
术语MSC也包括MSC的后代,例如,通过体外或离体增殖(繁殖)从动物或人受试者的生物样品得到的MSC而得到的后代。
优选的MSC具有产生至少成骨细胞(骨)谱系的细胞(例如,骨原细胞和/或前成骨细胞和/或成骨细胞和/或骨细胞等)的潜力,或产生至少软骨形成细胞(软骨)谱系的细胞(例如,软骨形成细胞和/或成软骨细胞和/或软骨细胞等)的潜力。
术语“干细胞”通常表示未特化的或相对较少特化的并且具有增殖能力的细胞,其能够自我更新,即可增殖而不分化,并且其或其后代可产生至少一个相对更特化的细胞类型。该术语包括能够基本上无限地自我更新的干细胞,即,其中干细胞的后代或至少其部分基本上保留母干细胞的未特化或相对较少特化的表型、分化潜能和增殖能力,以及显示有限自我更新的干细胞,即,其中后代或其部分的进一步增殖和/或分化的能力与母细胞相比明确地下降。例如但不限于,干细胞可产生后代,所述后代可沿着一个或多个谱系分化以产生不断增进地相对更特化的细胞,其中此类后代和/或不断增进地相对更特化的细胞本身可以是本文中定义的干细胞,或甚至产生终末分化的细胞,即完全特化的细胞,其可以是有丝分裂后的。
本文中使用的术语“成体干细胞”表示存在于胎儿期的或出生后(例如在达到成年期后)的生物体中的或从所述生物体获得的(例如,从其分离的)干细胞。
本文中使用的“骨原细胞”可以特别地包括早期和晚期骨原细胞。“成骨细胞”可以特别地包括前成骨细胞、成骨细胞和骨细胞,且该术语可以更优选地表示前成骨细胞和成骨细胞。所有这些术语本身是众所周知的,并且如本文中使用的,通常可以表示具有成骨表型的细胞,并且其可以促成骨材料或骨基质形成,或能够发育成可促成骨材料或骨基质形成的细胞。
作为进一步指导且非限制性地,骨原细胞和成骨细胞以及包含骨原细胞和/或成骨细胞的细胞群可以展示下列特征:
a)所述细胞包含Runx2的表达,Runx2是一种调节成骨细胞分化和在成骨细胞分化过程中调节许多细胞外基质蛋白基因的表达的多功能转录因子;
b)所述细胞包含至少一种下列蛋白的表达:碱性磷酸酶(ALP),更具体地骨-肝-肾类型的ALP;和更优选还包含一种或多种另外的骨标志物例如骨钙素(OCN)、前胶原1型氨基末端前肽(P1NP)、骨结合素(ON)、骨桥蛋白(OP)和/或骨唾液蛋白(BSP)的表达,和/或一种或多种其它骨基质蛋白例如核心蛋白聚糖和/或骨保护素(OPG)的表达;
c)所述细胞大体上不表达CD45(例如少于约10%,优选少于约5%,更优选少于约2%的细胞可表达CD45);
d)所述细胞显示使外部环境矿化或合成含钙的细胞外基质的能力的证据(例如当暴露于成骨培养基时;参见Jaiswal等人.J Cell Biochem,1997,第64卷,295-312)。细胞内部的钙积累和基质蛋白中的钙沉积可以例如通过如下方法来常规地测量:在
e)所述细胞大体上不朝向脂肪细胞谱系(例如脂肪细胞)和软骨细胞谱系(例如软骨细胞)的细胞分化。可使用本领域建立的标准分化诱导条件(例如,参见Pittenger等人.Science,1999,第284卷,143-7)和测定法(例如当诱导时,脂肪细胞通常用显示脂质积累的油红O染色;软骨细胞通常用阿辛蓝或番红O染色)来测试朝向此类细胞谱系的分化的不存在。大体上缺乏朝向脂肪形成和/或软骨形成分化的倾向性可通常意指,当用于各自测试时,少于20%、或少于10%、或少于5%、或少于1%的测试细胞将显示脂肪形成或软骨形成分化的征兆。
所述细胞可以进一步包含一种或多种细胞募集因子(诸如IL6和/或VEGF)的表达。
本文中使用的“成软骨细胞”可以具体地包括成软骨细胞,即,在细胞外基质的分泌中有活性的早期的(不成熟的、未成熟的)软骨细胞。认为成软骨细胞通过从间充质干细胞分化而产生。术语“软骨细胞”更具体地表示软骨基质的维持所需的成熟软骨细胞。这些术语本身是众所周知的,并且如本文中使用的,通常可以表示具有软骨形成表型的细胞,并且其可以促成软骨或软骨基质形成,或能够发育成可促成软骨或软骨基质形成的细胞。
作为进一步指导且非限制性地,人关节软骨细胞可以展示如在Diaz-Romero等人.2005(J Cell Physiol,第202卷(3),731-42)中总结的细胞表达特征,例如,它们可以表达整联蛋白和其它粘附分子(CD49a、CD49b、CD49c、CD49e、CD49f、CD51/61、CD54、CD106、CD166、CD58、CD44)、四旋蛋白(tetraspanin)(CD9、CD63、CD81、CD82、CD151)、受体(CD105、CD119、CD130、CD140a、CD221、CD95、CD120a、CD71、CD14)、胞外酶(CD10、CD26)和其它表面分子(CD90、CD99)。在单层培养过程中,软骨细胞可以上调某些被视作间充质干细胞特征的标志物(CD10、CD90、CD105、CD166)。因此,这样的标志物也可以由不太成熟的成软骨细胞表达。
当细胞被描述为特定标志物阳性的(或表达所述标志物或包含所述标志物的表达)时,这意味着,当进行合适的测量时,技术人员将推断,与合适的对照相比,该标志物的独特信号(例如,抗体可检测的或通过反转录聚合酶链式反应来检测)的存在或证据。当该方法允许标志物的定量评估时,阳性细胞可以平均而言产生与对照显著不同的信号,例如但不限于,是对照细胞产生的此类信号的至少1.5倍,例如,至少2倍、至少4倍、至少10倍、至少20倍、至少30倍、至少40倍、至少50倍或甚至更高。
使用本领域已知的任何合适的免疫学技术(例如免疫细胞化学或亲和吸附、蛋白质印迹分析、FACS、ELISA等),或通过酶活性的任何合适的生物化学测定(例如对于ALP),或通过测量标志物mRNA的量的任何合适的技术(例如,RNA印迹、半定量或定量RT-PCR等),可以检测上述细胞特异性标志物的表达。本公开内容中所列的标志物的序列数据是已知的,并且可得自公共数据库诸如GenBank(http://www.ncbi.nlm.nih.gov/)。
本发明的药物制剂可以包含一种或多种具有成骨性能、骨诱导性能和/或骨传导性能的物质。在优选的实施方案中,这样的物质可以选自包含以下成员或由以下成员组成的集合:成纤维细胞生长因子(FGF)、优选地FGF-2、转化生长因子β(TGFB)、优选地TGFB-1、血小板衍生的生长因子(PDGF)、白介素-8(IL-8)、骨形态发生蛋白(BMP),例如BMP-2、BMP-4、BMP-6和BMP-7、甲状旁腺激素(PTH)、甲状旁腺激素相关的蛋白(PTHrp)和干细胞因子(SCF)中的任意一种或多种。当施用给受试者时,任何一种这样的物质可以以足以实现它的期望的成骨作用、骨诱导作用和/或骨传导作用的浓度包含在药物组合物中,尽管在可能避免不希望的副作用的范围内。
通常,但非限制性地,任何一种这样的物质可以以0.01ng/ml至1mg/ml(例如0.1ng/ml至100μg/ml,例如1ng/ml至50μg/ml)的浓度包含在药物制剂中。
术语“骨诱导”表示组分(例如肽生长因子)的招募未成熟细胞(诸如干细胞、MSC)并且刺激这些细胞分化为前成骨细胞和成熟成骨细胞从而形成骨组织的能力。本发明的药物组合物可以进一步包含具有骨诱导性能的组分,例如骨诱导蛋白或肽,例如骨形态发生蛋白,诸如BMP-2、BMP-7或BMP-4;水凝胶或生物聚合物诸如透明质酸或其衍生物、胶原、纤维蛋白原、骨结合素或骨钙素。优选地,所述药物组合物可以进一步包含透明质酸或其衍生物、胶原或纤维蛋白原。
术语“骨传导”表示组分的充当骨细胞可在其上附着、迁移、生长和产生新骨的支架的能力。所述药物组合物可以进一步包含具有骨传导性能的组分,例如,骨传导性支架或基质或表面,诸如但不限于磷酸三钙、羟磷灰石、羟磷灰石/磷酸三钙颗粒的组合(HA/TCP)、明胶、聚乳酸、聚乳酸乙醇酸、透明质酸、脱乙酰壳多糖、聚-L-赖氨酸或胶原。
如上所述,根据本发明的药物制剂可以包含在骨创伤和缺损的修复中有用的组分。所述药物制剂可以包含具有骨传导性能的支架或基质。所述药物制剂可以与去矿化的骨基质(DBM)或其它基质组合,以使复合物具有成骨性质以及骨传导性质和骨诱导性质。使用自体骨髓细胞和同种异体DBM的相似方法已产生良好的结果(Connolly等人.1995.ClinOrthop 313:8-18)。
根据本发明的药物制剂可以进一步包括补充性的生物活性因子或骨诱导蛋白(诸如骨形态发生蛋白,诸如BMP-2、BMP-7或BMP-4)或任意其它生长因子,或与它们共施用。其它潜在伴随组分包括适合于辅助骨再生的钙或磷酸盐的无机来源(WO 00/07639)。如果需要的话,可以在载体基质或材料上施用细胞制剂以提供改善的组织再生。例如,所述材料可以是水凝胶,或生物聚合物诸如明胶、胶原、透明质酸或其衍生物、骨结合素、纤维蛋白原或骨钙素。根据标准技术(例如,Mikos等人,Biomaterials 14:323,1993;Mikos等人,Polymer35:1068,1994;Cook等人,J.Biomed.Mater.Res.35:513,1997),可以合成生物材料。
应用本发明的原理的制剂有利地表现出特别好的凝胶形成性能,从而有利地产生粘稠制剂。在某些实施方案中,所述制剂是凝胶形成制剂。
术语“凝胶形成”、“一相”或“单相”可以在本文中互换使用。列举的“凝胶形成制剂”在本说明书中意图表示所述制剂的形成固体果冻样材料(凝胶)的能力,例如具有假塑性。例如,在将其组分组合时,或者当将其组分与有助于凝胶形成的材料和/或条件组合或向所述材料和/或条件暴露时,例如、但不限于当溶解或分散在滑液、血清或细胞组合物中时,本发明的药物制剂有利地形成凝胶。
术语“粘度”通常是用剪应力或拉应力变形的流体的抵抗力的量度。本发明的药物制剂可以具有至少10Pa.s的粘度,例如,在室温,当施加0,560s
体现本发明的原理的组合物可以获得它们的凝胶状稠度,特别是在有二价钙(Ca
结果,在某些实施方案中,不需要向本发明的药物组合物中加入Ca
在某些其它实施方案中,可以将Ca
在某些实施方案中,意图用于关节内或关节周施用的产品可以包括约20mM至约40mM之间(诸如约20mM至约30mM之间)的Ca
通过向其中加入合适量的药学上可接受的钙盐,优选可溶性的钙盐,可以在药物组合物中适当地包括Ca
在本文中预期的药物制剂可以包括约1mg/ml至约10mg/ml之间的CaCl
在某些实施方案中,所述药物制剂可以构造成用于胃肠外施用,诸如胃肠外注射,更优选地用于骨内、骨周、关节内或关节周施用,诸如骨内、骨周、关节内或关节周注射,或用于腱内、腱周、韧带内或韧带周施用,例如,腱内、腱周、韧带内或韧带周注射。
如本文中教导的药物制剂或多组分试剂盒可以构造成用于局部施用。本发明的药物制剂或多组分试剂盒可以构造成用于胃肠外施用,即,包括骨内、骨周、关节内、关节周、肌肉内、皮下、静脉内、胸骨内、腱内、腱周、韧带内或韧带周施用中的一种或多种,诸如包括骨内、骨周、关节内、关节周、肌肉内、皮下、静脉内和胸骨内施用中的一种或多种。
优选地,如本文中教导的药物制剂或多组分试剂盒被构造成用于骨内或骨周施用。骨内施用或递送通常表示这样的方法:其中将治疗直接地或间接地递送进骨(小梁或皮质)中。骨周施用或递送通常表示这样的方法:其中在骨的外围(特别是在骨折/损伤部位周围)中递送治疗。
特别优选的、如本文中教导的药物制剂或多组分试剂盒被构造成用于关节内或关节周施用。关节内施用或递送通常表示这样的方法:其中将治疗直接地或间接地递送进连接关节的滑液囊中。关节周施用或递送通常表示这样的方法:其中在连接关节的滑液囊和/或软骨下骨的外围中递送治疗。
并且,如本文中教导的药物制剂或多组分试剂盒可以构造成用于腱内或腱周施用。并且,如本文中教导的药物制剂或多组分试剂盒可以构造成用于韧带内或韧带周施用。
肌骨骼疾病一个有关的方面涉及用在肌骨骼疾病的治疗(贯穿本说明书,包括治疗性和/或预防性措施)中的如上所述的药物制剂。
本文中使用的术语“肌骨骼疾病”表示任何类型的骨疾病、肌肉疾病、关节疾病或软骨营养不良,所述疾病的治疗可以受益于本发明的药物制剂向患有所述疾病的受试者的施用。该术语也包括影响腱和/或韧带的疾病。具体地,这样的疾病可以特征在于例如减少的骨和/或软骨形成或过多的骨和/或软骨吸收,减少的存在于骨中的成骨细胞或骨细胞和/或存在于软骨中的成软骨细胞或软骨细胞的数目、生存力或功能,减少的受试者的骨量和/或软骨量,骨的变细,减弱的骨强度或弹性等。
肌骨骼疾病的非限制性例子可以包括局部或全身性障碍,例如,任何类型的骨质疏松症或骨质减少(例如原发性的、绝经后的、衰老的、肾上腺皮质激素诱发的、双磷酸盐诱发的和放射疗法诱发的);任何继发性骨坏死、单部位或多部位骨坏死;任何类型的骨折例如骨不连接、畸形愈合、延迟愈合骨折或挤压、需要骨融合(例如脊柱融合术和重建)的病况、颌面骨折、先天性骨质缺损、骨重建(例如在创伤或癌症手术后),以及颅面骨重建;创伤性关节炎、局灶性软骨和/或关节缺损、局灶性退行性关节炎;骨关节炎、退行性关节炎、膝关节病和髋关节变性病;成骨不全;溶骨性骨癌;佩吉特病、内分泌障碍、低磷血症、低钙血症、肾性骨营养障碍、骨软化、动力缺失性骨疾病、甲状旁腺功能亢进、原发性甲状旁腺功能亢进症、继发性甲状旁腺功能亢进症;牙周病;高-斯病和麦-奥二氏综合征;类风湿关节;脊椎关节病,包括强直性脊柱炎、牛皮癣关节炎、肠病性关节病和未分化脊椎关节炎和反应性关节炎;系统性红斑狼疮和相关综合征;硬皮病和相关障碍;舍格伦综合征;系统性脉管炎,包括巨细胞动脉炎(霍顿氏病)、高安动脉炎、风湿性多肌痛、ANCA相关脉管炎(例如韦格纳氏肉芽肿病、显微镜下多脉管炎和丘斯综合征)、贝赫切特综合征和其它多动脉炎和相关障碍(例如结节性多发性动脉炎、耳蜗前庭综合征和伯格氏病);伴随其它全身性炎性疾病的关节炎,包括淀粉样变性病和肉瘤样病;结晶性关节病,包括痛风、焦磷酸钙二水化物疾病、与磷酸钙或草酸钙结晶的关节沉着相关的障碍或综合征;软骨钙质沉着症和神经病性关节病;费尔蒂综合征和莱特尔综合症;莱姆病和风湿热。
术语“预防有效量”表示这样的活性化合物或药物活性成分的量:其在受试者中抑制或延迟障碍发作,如研究人员、兽医、医生或其它临床医师所寻求的。本文中使用的术语“治疗有效量”表示活性化合物或药物试剂在受试者中引发研究人员、兽医、医生或其它临床医师所寻求的生物或医学应答的量,所述生物或医学应答可以特别地包括待治疗的疾病或病症的征状的缓解。用于确定本发明的制剂或药物制剂的治疗上和预防上有效的剂量的方法是本领域已知的。
在本发明的上下文中,“治疗有效剂量”是指这样的药物活性成分或制剂的量:就具有肌骨骼疾病诸如骨疾病或关节疾病(可替换地或额外地,所述疾病可以影响腱和/或韧带)的患者的治疗而言,其在施用时会实现阳性的治疗应答。
根据药物活性化合物或药物活性成分的性质、疾病状况和严重程度、以及患者的年龄、大小和状况,有资格的医师可以确定本发明的制剂中的药物活性化合物或药物活性成分的适当治疗有效剂量。
非限制性地,例如要施用的糖胺聚糖的典型剂量的范围可以是每次注射约2mg至400mg糖胺聚糖。例如,要施用的剂量的范围可以是每次注射约4mg至300mg糖胺聚糖,例如,每次注射约8mg至200mg糖胺聚糖。优选地,要施用的剂量的范围是每次注射约8mg至160mg糖胺聚糖。
非限制性地,例如,要施用的剂量的范围可以是每次注射约0.05×10
应当认识到,本发明的治疗可以包括单个治疗有效剂量的施用或多个治疗有效剂量的施用制剂或药物制剂。
除非指出,“受试者”或“患者”互换使用,且表示动物,优选温血动物,更优选脊椎动物,甚至更优选哺乳动物,更优选灵长类动物,且具体地包括人患者和非人哺乳动物和灵长类动物。优选的患者是人受试者。
本文中使用的短语诸如“需要治疗的受试者”包括将受益于给定病症、特别是肌骨骼疾病诸如骨疾病或关节疾病(可替换地或额外地,所述疾病可以影响腱和/或韧带)的治疗的受试者。这样的受试者可以包括、但不限于,已经确诊所述病症的受试者,易于发展所述病症的受试者,和/或要在其中预防所述病症的受试者。
术语“治疗”包括已经发展的疾病或病症的治疗性处理,以及预防性的或防止性的措施,其中目的是防止或减小不期望的受累的发生机会,诸如防止疾病或病症的进展的机会。有益的或期望的临床结果可以包括、但不限于,一种或多种征状或一种或多种生物学标记的缓解,疾病的程度的减轻,稳定的(即,未恶化的)疾病状态,疾病进展的延迟或减慢,疾病状态的改善或减轻等。“治疗”还可以是指,与未接受治疗时预期的存活相比延长的存活。
除了在本文中特别指定的组分以外,本发明的药物制剂可以包含一种或多种药学上可接受的赋形剂。合适的药物赋形剂取决于剂型和活性成分的特性,并且可以由技术人员选择(例如通过参考药物赋形剂手册(Handbook of Pharmaceutical Excipients)2009年第6版,Rowe等人编)。本文中使用的“载体”或“赋形剂”包括任意的和所有的溶剂、稀释剂、缓冲剂(例如,中性缓冲盐水或磷酸盐缓冲盐水)、增溶剂、胶体、分散介质、媒介物、填充剂、螯合剂(例如,EDTA或谷胱甘肽)、氨基酸(例如,甘氨酸)、蛋白、崩解剂、粘合剂、润滑剂、润湿剂、乳化剂、甜味剂、着色剂、芳香剂、增香剂、增稠剂、用于实现储存作用的试剂、包衣剂、抗真菌剂、防腐剂、稳定剂、抗氧化剂、张度控制剂、吸收延迟剂等。这样的介质和试剂用于药物活性物质的用途是本领域众所周知的。这样的材料应当是无毒的,并且应当不会干扰药学活性成分的活性。
载体或其它材料的精确性质将取决于施用途径。例如,制剂可以呈胃肠外可接受的水溶液形式,其是无热原的,并且具有合适的pH、等渗性和稳定性。
所述制剂可以包含接近生理条件所需的药学上可接受的辅助物质,诸如pH调节剂和缓冲剂、防腐剂、络合剂、张度调节剂、润湿剂等,例如,醋酸钠、乳酸钠、磷酸钠、氢氧化钠、氯化氢、苯甲醇、对羟基苯甲酸酯、EDTA、油酸钠、氯化钠、氯化钾、氯化钙、脱水山梨糖醇单月桂酸酯、三乙醇胺油酸酯等。优选地,制剂的pH值是在生理pH范围内,诸如具体地,制剂的pH是在约5至约9.5之间,更优选约6至约8.5之间,甚至更优选约7至约7.5之间。这样的药物制剂的制备是在本领域技术人员的普通技能内。
另一个方面涉及前述制剂作为药物赋形剂的用途,更优选地作为持续释放或缓释药物赋形剂的用途。
本文中使用的术语“持续释放”、“缓释”或“延长释放”泛指,与所述化合物从参比制剂(诸如现有技术中已知的制剂)的释放相比,在扩大的、延长的或增加的时间点内化合物从制剂的释放。本文中使用的持续释放表示,制剂的一种或多种组分的延长释放,即S/D血浆(其可以包含有益的生物物质诸如内源性生长因子)的延长释放,和糖胺聚糖的延长释放,细胞组合物的延长释放,或一种或多种药物活性化合物的延长释放,和任选地一种或多种其它活性药物成分的延长释放。例如,从现有技术已知,高分子量透明质酸在关节中的半衰期是约6-8小时。因而本文中使用的持续释放表示糖胺聚糖(诸如透明质酸)从本发明的制剂的延长释放,例如在一天或多天中的释放,诸如在2天、3天、4天、5天、6天中,或在一周或多周中的释放,诸如在1.5周、2周、3周中,或在一个月或多个月中的释放。因而这些术语也可以具体地包括延长释放、延迟释放或控释。
具体实施方式
实施例1:人溶剂/去污剂处理过的血浆(S/D血浆)和人新鲜冷冻血浆(FFP)之间的对比
示例性制剂的组成特征
S/D血浆(即得自Octapharma AG(Lachen,瑞士)的
表1:基于
评论S/D血浆(具体地是
参考Svae等人在2007年的表1,其呈现了
表2:基于Svae等人在2007年的表1,S/D血浆(即
并且,Theusinger等人在2011年(Br.J.Anaesth.,106(4):505-11)研究了S/D血浆(即
此外,S/D处理可能导致不稳定因子V、因子VIII、α1-抗胰蛋白酶和α2-抗纤维蛋白溶酶的丝氨酸蛋白酶抑制剂(丝氨酸蛋白酶抑制蛋白)活性的损失,但是不会导致抗凝血酶的损失(Benjamin&McLaughtin 2012;Mast等人.1999)。因子VIII损失与高分子量vonWillebrand因子(vWF)的减少有关。在Sachs等人于2005年的研究中,就粒细胞特异性的抗体以及HLA I类和II类抗体而言,S/D血浆样品(n=5)被试验为阴性的。
表3提供了如在前述研究中检测到的,S/D血浆(即
表3:S/D血浆(即
综上所述,已经记载了人S/D血浆和新鲜冷冻血浆之间的众多组成差异。S/D血浆的特别显著的特征可以是与FFP相比降低的纤溶酶抑制剂水平,诸如等于或小于0.60IU/ml或等于或小于0.50IU/ml的纤溶酶抑制剂水平,例如在0.20-0.30IU/ml之间(更具体地在0.22-0.25IU/ml之间)的纤溶酶抑制剂水平。
凝固性能
接下来的实验采用下述人血浆类型:S/D血浆(即
对于2.5%和5%CaCl
表4:S/D血浆(即
对于未过滤的或经过滤的(去细胞化的)、肝素化的血浆,没有观察到凝块形成。S/D血浆的过滤没有显示凝固时间的显著差异(p=0.7780,配对t检验),而对于EDTA血浆(p=0.0053,配对t检验)和对于柠檬酸盐化的血浆(p=0.0143,配对t检验),观察到显著增加。但是,分别与柠檬酸盐化的血浆和EDTA血浆相比,S/D血浆的凝块形成快了约50%至超过100%。结果,用
因此,S/D血浆(具体地是去细胞化的S/D血浆)的一个显著特征可以是减小的凝固时间。例如,当在包含人去细胞化的S/D血浆、10或20%(v/v)的血清和2.5或5%w/v的CaCl
实施例2:人溶剂/去污剂(S/D)处理过的血浆
与得自关节炎患者(n=2)的滑液组合地试验了人S/D血浆(具体地是
与滑液一起温育包含4mg/ml CaCl
在有滑液存在下OctaplasLG
与得自骨关节炎患者(n=5)的滑液组合地试验了人S/D血浆(更具体地是OctaplasLG
与滑液接触后,该制剂在30分钟中形成凝块。
在另一个实验中,在上述制剂中试验了3种CaCl
综上所述,在该实验中,在有滑液存在下,凝块形成需要Ca
在有全血存在下OctaplasLG
研究了与得自健康供体(n=1)的全血组合的OctaplasLG
结果证实,以1:1(v/v)比例与柠檬酸盐化的血液接触以后,该制剂在37℃(保湿培养箱,5%CO
试验了几种制剂的稠度。所述制剂含有透明质酸(透明质酸钠,2-3.10
表5:制剂的组成
将以1:1(v/v)比例从外周血制备的人血清加入产物中,并在37℃在搅拌下温育。在30分钟、1h和24h以后,目测稠度。
表6提供了对于不同血浆类型而言胶凝作用的半定量评估。1小时以后,含有
表6:在有HA存在下
*
**搅拌以后得到的结果
在有或没有HA存在下
在含有或不含透明质酸(透明质酸钠,2-3.10
目检后,在两种制剂中形成凝块或胶凝相。但是,含有HA的制剂含有明显更少的液相,并且可以无变化地操作。相反,不含HA的凝块在凝块操作后破裂并释放液体。
基于S/D血浆和HA的细胞递送制剂
适合用于向人受试者骨内递送细胞的一种示例性的非限制性的制剂包含以下组分、基本上由其组成或由其组成:人S/D血浆(具体地是
实施例3:人S/D血浆(诸如
对于几种不含细胞、但是包含人S/D血浆(具体地是
可以得出结论:培养基中血清的存在以及钙的存在似乎是在没有细胞存在下的凝块形成所必需的。
将骨髓MSC在含有5%(v/v)、10%(v/v)或15%(v/v)S/D血浆(具体地是
以上数据表明了与在含有血清的、含有Ca
评估了含有不同类型的人血浆(
在37℃将从骨髓细胞培养的57000个细胞/cm2的骨原细胞接种在塑料T25烧瓶内的6ml补充了15%(v/v)的各种血浆的培养基(85%v/v)中。结果总结在表7中。培养基剩下含有肝素化的血浆的液体(表7)。在该初步实验中没有观察到
表7:在有细胞存在下不同试验血浆类型的胶凝/凝固时间
*Octaplas是经过过滤的血浆,即,不含细胞成分/组分的血浆。
**对于每种血浆类型,试验3种细胞培养物
基于S/D血浆的细胞递送制剂
适合用于向哺乳动物受试者骨内递送细胞的一种示例性的非限制性的制剂包含以下组分、基本上由其组成或由其组成:S/D血浆(具体地是
实施例4:人S/D血浆诸如
包含S/D血浆和药物活性成分的一种示例性的非限制性的药物制剂(其中所述制剂适合用于骨质缺损的治疗用途)基本上由以下组分组成或由其组成:S/D血浆(特别是
引文列表
非专利文献
Beeck H,Hellstern P.In vitro characterization of solvent/detergent-treated human plasma and of quarantine fresh frozen plasma.Vox Sang.1998;74Suppl 1:219-23.
Benjamin RJ,McLaughlin LS.Plasma components:properties,differences,and uses.Transfusion.2012May;52Suppl 1:9S-19S.
Burgess WH,Maciag T.The heparin-binding(fibroblast)growth factorfamily of proteins.Annu Rev Biochem.1989;58:575-606.
Cole,B.J.,Seroyer,S.T.,Filardo,G.,Bajaj,S.,Fortier,L.A.,2010.Platelet-Rich Plasma.Sports Health 2,203-210.
Doyle S,O'Brien P,Murphy K,Fleming C,O'Donnell J.Coagulation factorcontent of solvent/detergent plasma compared with fresh frozen plasma.BloodCoagul Fibrinolysis.2003 Apr;14(3):283-7.
Frescaline G,Bouderlique T,Huynh MB,Papy-Garcia D,Courty J,AlbaneseP.Glycosaminoglycans mimetics potentiate the clonogenicity,proliferation,migration and differentiation properties of rat mesenchymal stem cells.StemCell Res.2012Mar;8(2):180-92.
Gobbi,A.,Bathan,L.,2009.Biological approaches for cartilage repair.JKnee Surg 22,36-44.
Grimaud,E.,Heymann,D.,Rédini,F.,2002.Recent advances in TGF-betaeffects on chondrocyte metabolism.Potential therapeutic roles of TGF-beta incartilage disorders.Cytokine Growth Factor Rev.13,241-257.
Hausser HJ,Brenner RE.Low doses and high doses of heparin havedifferent effects on osteoblast-like Saos-2 cells in vitro.J CellBiochem.2004 Apr 1;91(5):1062-73.
Hellstern P,Solheim BG.The Use of Solvent/Detergent Treatment inPathogen Reduction of Plasma.Transfus Med Hemother.2011;38(1):65-70.
Horowitz B,Bonomo R,Prince AM,Chin SN,Brotman B,Shulman RW.Solvent/detergent-treated plasma:a virus-inactivated substitute for fresh frozenplasma.Blood.1992 Feb 1;79(3):826-31.
Lyon M,Rushton G,Gallagher JT.The interaction of the transforminggrowth factor-betas with heparin/heparan sulfate is isoform-specific.J BiolChem.1997 Jul 18;272(29):18000-6.
Mast AE,Stadanlick JE,Lockett JM,Dietzen DJ.Solvent/detergent-treatedplasma has decreased antitrypsin activity and absent antiplasminactivity.Blood.1999 Dec 1;94(11):3922-7.
McCaffrey TA,Falcone DJ,Brayton CF,Agarwal LA,Welt FG,WekslerBB.Transforming growth factor-beta activity is potentiated by heparin viadissociation of the transforming growth factor-beta/alpha 2-macroglobulininactive complex.J Cell Biol.1989 Jul;109(1):441-8.
Park SH,Cui JH,Park SR,Min BH.Potential of fortified fibrin/hyaluronic acid composite gel as a cell delivery vehicle forchondrocytes.Artif Organs.2009 Jun;33(6):439-47.
Sachs UJ,Kauschat D,Bein G.White blood cell-reactive antibodies areundetectable in solvent/detergent plasma.Transfusion.2005 Oct;45(10):1628-31.
Svae TE,Frenzel W,Heger A,
- 包含溶剂/去污剂处理过的血浆(S/D血浆)的制剂及其用途
- 包含溶剂/去污剂处理过的血浆(S/D血浆)的制剂及其用途
