硝基还原假单胞菌HS-18在防治AHLs介导致病的病原菌中的应用
文献发布时间:2023-06-19 11:54:11
技术领域
本发明涉及分子生物防治技术领域,更具体地,涉及硝基还原假单胞菌HS-18在防治 AHLs介导致病的病原菌中的应用。
背景技术
群体感应(quorum sensing,QS)是一种细胞间的交流机制,而群体感应信号是完成这种交流机制的“语言”。群体感应信号是由细菌胞内合成、分泌的一种小分子化合物,这种小分子化合物的产生贯穿整个细胞生长周期,并能自由扩散或主动运输到细胞外的环境中。当细胞数量增加时,细胞外群体感应信号的浓度也随之升高,细胞通过感知群体感应信号的浓度以感知环境中细胞的数量。当群体感应信号的浓度达到一定阈值后,信号分子与受体蛋白结合,并激活信号传导,以实现靶基因的表达。许多病原细菌利用群体感应信号调控毒力因子的表达及各种生理活动,如:运动性、生物膜的形成、胞外酶的产生、质粒转移、抗药性、生物发光等,从而对周围环境能有更好的适应性,对寄主植物有更强的致病性。
酰基高丝氨酸内酯类信号(N-acyl homoserine lactones,AHLs)首次发现于40多年前对海洋细菌费氏弧菌(Vibrio fischeri)和哈氏弧菌(Vibrio harveyi)的生物荧光研究,是目前革兰氏阴性菌中研究最早且最透彻的群体感应信号分子。AHLs广泛存在于多种革兰氏阴性细菌中,尤其存在于多种病原菌中,如:胡萝卜果胶杆菌(Pectobacteriumcarotovorum),铜绿假单胞菌(Pseudomonas aeruginosa),洋葱伯克霍尔德菌(Burkholderia cepacia),根癌农杆菌(Agrobacterium tumefaciens),青枯劳尔氏菌(Ralstonia solanacearum),水稻基腐病菌 (Dickeya zeae),欧文氏杆菌(Erwiniacarotovora),玉米细菌性枯萎病菌(Pantoea stewartii subsp.Stewartii)等。这些病原菌中大部分的AHLs由保守的N-酰基高丝氨酸内酯环和4~18 个不同碳原子数及不同侧链修饰的酰基链构成。
群体淬灭(quorum quenching,QQ)是指能干扰或破坏群体感应系统的策略。群体淬灭凭借对细菌不直接杀死、不产生选择压力的方式,已成为了一种有潜力、环保的生物防治途径。AHLs群体淬灭当下已得到广泛的研究,多种AHLs群体淬灭菌得到筛选与鉴定,前人研究结果表明细菌的AHLs群体淬灭能力与对依赖AHLs致病的病原菌的生物防治能力具有紧密联系。目前已有多种AHLs群体淬灭菌制剂和酶制剂等得到开发,并根据其底物特异性在水产养殖业、农业及水处理生物膜反应器等多领域得到应用。
目前对群体淬灭的研究主要集中于对专一类型的群体感应信号的淬灭研究,对淬灭菌多种群体淬灭能力的研究鲜有。因此对现有的群体淬灭菌进行更多类型群体淬灭能力的挖掘有助于进一步丰富群体淬灭现实意义与巨大应用价值。
发明内容
本发明为了克服现有技术中存在的上述问题,首先提供了硝基还原假单胞菌HS-18在降解AHLs信号分子中的应用。
本发明的第二个目的是提供硝基还原假单胞菌HS-18在防治AHLs介导致病的植物病害中的应用。
本发明的第三个目的是提供硝基还原假单胞菌HS-18在制备抗AHLs介导致病的植物病害的生物制剂中的应用。
本发明的目的通过以下技术方案实现:
本发明首先提供硝基还原假单胞菌HS-18在降解AHLs信号分子中的应用,所述AHLs 信号分子包括C4-HSL、C6-SHL、3-O-C6-HSL、C8-HSL、3-OH-C8-HSL、C10-HSL、 3-OH-C10-HSL、C12-HSL、3-O-C12-HSL、3-OH-C12-HSL、3-OH-C14-HSL。
尽管AHLs的结构差异主要不同于侧链的长度及取代基的种类,但是,能够降解短链 AHLs的菌株不一定能降解中长链AHLs,反之亦然;同时也存在能降解不同链长的广谱AHLs 淬灭菌。例如:前人研究发现的7株AHLs淬灭菌种,Stenotrophomonas属的RO1和RO5、Bacillus属的RO2和Pseudomonas属的RO7只能降解短链和中链的AHLs(C4~C10),不能降解长链的AHLs(C12~C14),而Bacillus属的RO3和RO4及Delftia属的RO6能够降解短链和中链的AHLs,也能够降解长链的C14-HSL,但无法降解12个碳链长的AHLs,由此可知,相同种属的菌株对不同类型的AHLs信号分子的降解情况可能是不同的,也存在不同的菌株可以同时降解同种类型的AHLs信号分子,这可能是基于AHLs淬灭菌中淬灭酶类型的不同,不同淬灭酶对降解底物的特异性也不同;对于具体的菌株降解AHLs信号分子的情况,需要做具体研究才能够获知;本发明通过研究发现硝基还原假单胞菌HS-18能够高效降解C4~C14酰基链长的AHLs信号分子,从而拓宽了AHLs信号分子的群体淬灭菌的种类。
本发明还提供硝基还原假单胞菌HS-18在防治AHLs介导致病的植物病害中的应用,所述AHLs信号分子包括C4-HSL、C6-SHL、3-O-C6-HSL、C8-HSL、3-OH-C8-HSL、C10-HSL、3-OH-C10-HSL、C12-HSL、3-O-C12-HSL、3-OH-C12-HSL、3-OH-C14-HSL。
优选的,上述应用是将硝基还原假单胞菌HS-18的菌液与依赖AHLs致病的病原菌共同接种植物。
更优选的,可以将上述硝基还原假单胞菌HS-18的菌液与依赖AHLs致病的病原菌混合后点涂到植物病害部位;其中,制备硝基还原假单胞菌HS-18的菌液采用PBS缓冲液,菌悬液的浓度不做严格限制,具体可根据实际植物病害的程度和应用效果做调整。
优选的,所述依赖AHLs致病的病原菌包括胡萝卜软腐果胶杆菌胡萝卜亚种(依赖3-O-C6-HSL致病)、洋葱伯克氏菌(依赖C8-HSL致病)、铜绿假单胞菌(依赖C4-HSL和 3-OH-C12-HSL致病)、青枯劳尔氏菌(依赖C6-HSL和C8-HSL致病)、根癌农杆菌(依赖 3-O-C8-HSL致病)、水稻基腐病菌(依赖3-O-C6-HSL致病)、欧文氏杆菌(依赖3-O-C6-HSL 致病)。
更优选的,上述硝基还原假单胞菌HS-18降解AHLs的pH值为6.8~7.2,温度为28~37℃。
更优选的,所述硝基还原假单胞菌HS-18的培养基为LB培养基,配方为:trypton10.0g/L, yeast extract 5.0g/L,NaCl 10.0g/L,pH 6.8~7.2。
本发明还提供硝基还原假单胞菌HS-18在制备抗AHLs介导致病的植物病害的生物制剂中的应用,所述AHLs信号分子包括C4-HSL、C6-SHL、3-O-C6-HSL、C8-HSL、3-OH-C8-HSL、C10-HSL、3-OH-C10-HSL、C12-HSL、3-O-C12-HSL、3-OH-C12-HSL、3-OH-C14-HSL。
或者,本发明还提供硝基还原假单胞菌HS-18在制备降解AHLs信号分子的生物制剂中的应用,所述AHLs信号分子包括C4-HSL、C6-SHL、3-O-C6-HSL、C8-HSL、3-OH-C8-HSL、C10-HSL、3-OH-C10-HSL、C12-HSL、3-O-C12-HSL、3-OH-C12-HSL、3-OH-C14-HSL。
与现有技术相比,本发明具有以下有益效果:
本发明研究发现,硝基还原假单胞菌株HS-18对用于检测的C4-C14链长的AHLs都具有较好的降解活性,且降解效果高效显著,为生物防治AHLs介导的病原菌提供了一种新的生防制剂。
附图说明
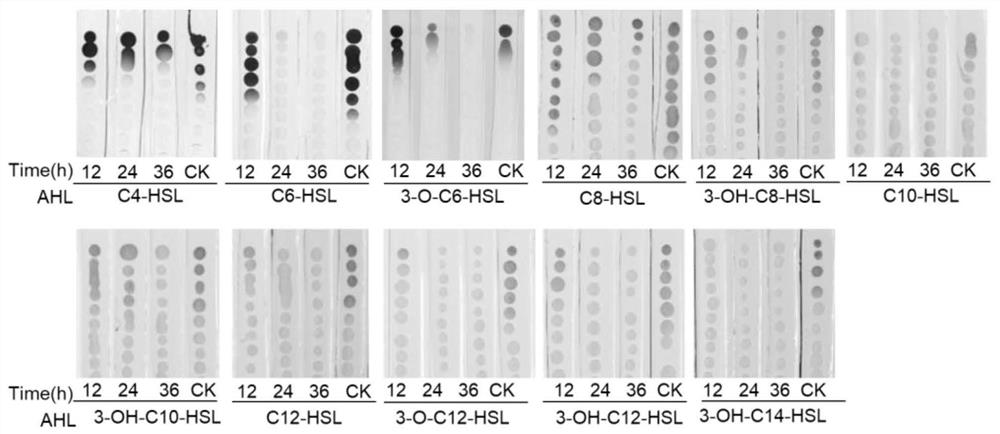
图1为硝基还原假单胞菌HS-18对不同酰基链长的AHLs(C4~C14)的降解活性检测图;
图2为硝基还原假单胞菌HS-18对依赖3-O-C6-HSL(OHHL)致病的胡萝卜软腐果胶杆菌胡萝卜亚种在寄主植物土豆上的生物防治效果图;
图3为硝基还原假单胞菌HS-18对依赖C8-HSL(OHL)致病的洋葱伯克氏菌在寄主植物洋葱上的生物防治效果图;
图4为硝基还原假单胞菌HS-18对依赖C4-HSL(BHL)和3-O-C12-HSL(OdDHL)致病的铜绿假单胞菌在寄主植物生菜上的生物防治效果图。
具体实施方式
下面对本发明的具体实施方式作进一步说明。在此需要说明的是,对于这些实施方式的说明用于帮助理解本发明,但并不构成对本发明的限定。此外,下面所描述的本发明各个实施方式中所涉及的技术特征只要彼此之间未构成冲突就可以相互组合。
下述实验例中所使用的试验方法如无特殊说明,均为常规方法;所使用的材料、试剂等,如无特殊说明,为可从商业途径得到的试剂和材料。
MM无机盐培养基:K
LB培养基:trypton 10.0g/L,yeast extract 5.0g/L,NaCl 10.0g/L,pH 6.8~7.2,121℃灭菌15~25min。
PBS磷酸盐缓冲液、X-gal以及培养基中需要的试剂均采购自广州齐湘、鼎国等生物试剂公司,本发明中用于检测降解活性的AHLs采购自上海有德化工科技有限公司和Sigma-Aldrich。
硝基还原假单胞菌HS-18分离于广州市华南农业大学附近长期被油污染的土样中,于 2017年5月12日保藏于中国典型培养物保藏中心,保藏号为CCTCC NO:M2017257。利用 LB培养基于30℃条件下培养HS-18。
实施例1硝基还原假单胞菌HS-18对AHLs的降解体系设定
首先,利用LB液体培养基于30℃,200rpm恒温摇床中过夜培养菌株HS-18以获取OD
表1列出了用于检测硝基还原假单胞菌HS-18淬灭效果的AHLs。
表1
实施例2利用报告菌株紫色杆菌(Chromobacterium violaceum)CV026对短链AHLs的定量检测
LB固体平板上活化紫色杆菌CV026,于LB液体培养基中过夜培养CV026。准备LB固体平板,切成0.8cm宽的相间琼脂条带。取10μl实施例1所述降解体系中乙酸乙酯萃取液点样于LB琼脂条顶端,于样品上样处下方连续点一列大小相近的报告菌株液滴。待样品和报告菌株液滴干后,将平板于28℃恒温培养箱中静置培养16h。AHLs扩散到的区域可诱导紫色杆菌CV026产生紫色杆菌素而使菌体呈现紫色。呈现紫色的报告菌株CV026的距离与待检测的AHLs含量呈正比。结果如图1表明,本发明中的菌株HS-18对本发明中用于检测的短链AHLs:C4-HSL、C6-HSL、3-O-C6-HSL都具有降解活性。
实施例3利用报告菌株根癌农杆菌(Agrobacterium tumefaciens)NT1(traR,tra::lacZ749) 对中长链AHLs的定量检测
LB固体平板上活化根癌农杆菌NT1,于含有终浓度为50μg/ml卡那霉素的LB液体培养基中过夜培养NT1。准备添加终浓度为40μg/ml的X-gal(5-溴-4-氯-3-吲哚-β-D-吡喃半乳糖苷)的MM固体平板,切成0.8cm宽的相间琼脂条。取10μl实施例1所述降解体系中乙酸乙酯萃取液点样于MM琼脂条顶端,于样品上样处下方连续点一列大小相近的报告菌株液滴。待样品和报告菌株液滴干后,将平板用锡纸包裹于28℃恒温培养箱中避光静置培养16h。AHLs扩散到的区域可诱导根癌农杆菌NT1产生β-半乳糖苷酶,β-半乳糖苷酶分解X-gal使菌体产生蓝色。根癌农杆菌NT1产生蓝色的距离与待检测的AHLs含量呈正比。结果如图1 表明,本发明中的菌株HS-18对本发明中用于检测的中长链AHLs:C8-HSL、3-OH-C8-HSL、 C10-HSL、3-OH-C10-HSL、C12-HSL、3-O-C12-HSL、3-OH-C12-HSL、3-OH-C14-HSL都具有降解活性。
实施例4硝基还原假单胞菌HS-18对依赖短链AHLs(3-O-C6-HSL)致病的病原菌的生防效果研究
本实施例以植物致病菌胡萝卜软腐果胶杆菌胡萝卜亚种(Pectobacteriumcarotovorum subsp.carotovora,Pcc)Z3-3为生物防治研究对象。Pcc依赖C6-HSL引起植物产生软腐病。
于30℃条件下于LB培养基中过夜培养菌株HS-18和病原菌Pcc Z3-3,将HS-18和Pcc Z3-3种子液分别用PBS重悬至OD
结果如图2表明,对寄主植物土豆切片用HS-18菌液进行预处理后,能够显著削弱病原菌Pcc Z3-3的致病力。
实施例5硝基还原假单胞菌HS-18对依赖中链AHLs(C8-HSL)致病的病原菌的生防效果研究
本实施例以致病菌洋葱伯克氏菌(Burkholderia cenocepacia,Bcc)H111为生物防治研究对象。H111依赖C8-HSL可对植物产生病害。
本发明利用LB培养基于30℃条件下过夜培养菌株HS-18和病原菌Bcc H111,将HS-18 和Bcc H111种子液分别用PBS重悬至OD
结果如图3表明,对寄主洋葱用HS-18菌液继续预处理后能够显著减少病原菌BccH111 引起的寄主植物洋葱的病害程度。
实施例6硝基还原假单胞菌HS-18对依赖长链AHLs(3-O-C12-HSL)致病的病原菌的生防效果研究
本实施例以致病菌铜绿假单胞菌(Pseudomonas aeruginosa)PAO1为生物防治研究对象。 PAO1依赖C4-HSL和3-O-C12-HSL引起植物发病。
本发明利用LB培养基于37℃条件下过夜培养菌株HS-18和病原菌PAO1,将HS-18和PAO1种子液分别用PBS重悬至OD
结果如图4表明,对寄主生菜用HS-18预处理后能够显著降低病原菌PAO1对寄主植物生菜的毒力。
- 硝基还原假单胞菌HS-18在防治AHLs介导致病的病原菌中的应用
- 硝基还原假单胞菌HS-18在防治AHLs介导致病的病原菌中的应用
