一种酿酒酵母表达长效重组纤连蛋白及其在化妆品中的应用
文献发布时间:2023-06-19 12:04:09
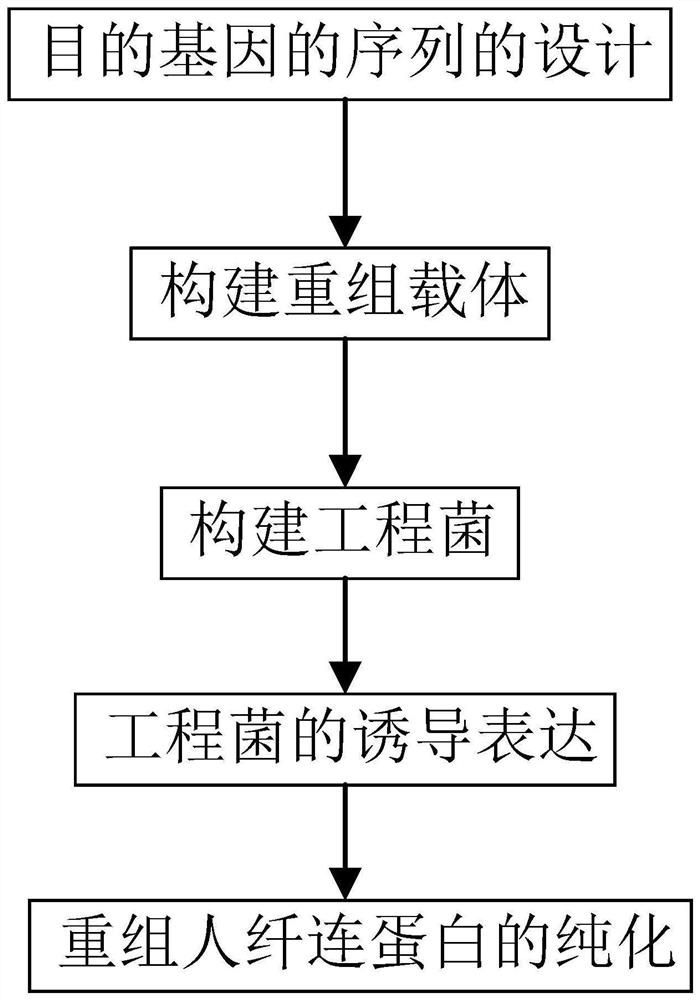
技术领域
本发明涉及新兴生物医学领域,尤其涉及一种酿酒酵母表达长效重组纤连蛋白,一种长效重组纤连蛋白促牛肾细胞贴壁活性检测的检测方法,以及一种酿酒酵母表达长效重组纤连蛋白在化妆品中的应用。
背景技术
天然纤连蛋白(fibronectin,FN)是一种高分子量的糖蛋白,是胞外基质中最为主要的组分之一,广泛存在于血液、体液及各种组织中。在脊椎动物中,FN高度保守且具有相同的组织结构。FN以二聚体形式存在,由两条分子量约为250kDa的多肽链通过C端的二硫键结合组成。每条链包含一连串的重复单元:12个I型、2个II型和7个III型重复单元。这些重复单元组成与纤维蛋白、胶原蛋白、明胶、细菌和细胞结合的功能域以发挥多种生物学功能,如调理作用、吞噬作用、血管生成、胚胎形成、组织结构和重新塑造等,还在许多病理过程起重要作用,如多发性关节炎和肿瘤。目前FN已经用于新兴生物医学领域,如肿瘤、创伤愈合、抑菌及组织工程材料等,也开始应用于美容护肤领域。
人血清白蛋白(Human serum albumin,HAS)是人体血液中的主要蛋白,由585个氨基酸构成,是人体循环系统内的含量最多的可溶性蛋白,在血液中的浓度为34-54g/L。HSA由肝脏合成,血清半衰期长,可达19天。HSA在调节血液渗透压、营养和促进伤口愈合等方面发挥重要作用,广泛用于肝硬化腹水、烧伤、休克等临床治疗。此外,HSA具有无免疫原性、人体相容性好、组织分布广和无酶活等特性,使其成为非常理想的重组蛋白融合载体。通过构建融合蛋白技术能够增加重组蛋白的分子量从而延长半衰期,有效的提高重组蛋白的稳定性。
目前FN的获得主要通过两条途径:一是从生物的组织细胞或体液中提取;二是运用基因工程技术构建表达载体,利用宿主表达重组FN。由于天然FN分子量大,全序列表达可行性低,主要是选取FN不同功能的结构域进行表达或组合表达,以获得具有不同功能的重组FN。天然提纯FN工艺复杂、成本高,且产品分子量大使其推广应用受到了限制。而利用基因工程技术表达外源基因已成为获取目的蛋白的高效途径之一,根据表达载体和宿主菌的不同,主要分为原核表达和真核表达。原核表达系统虽成本低廉,但该系统存在容易形成包涵体、获得的蛋白生物学活性较低等缺陷,而利用真核表达系统进行外源表达能够获得较高活性的目的蛋白。
酿酒酵母在医药和食品工业中是公认的安全微生物体,其生化和遗传研究已经非常详细。酿酒酵母分泌表达系统为真核表达系统,能够高水平表达蛋白质分泌到培养基中,产品生产工艺简单、成本低、产物均一、无免疫原性。
发明内容
为了克服天然提纯FN工艺复杂、成本高;天然FN分子量大,全序列表达可行性低,使其推广应用受到限制;现有原核表达系统存在容易形成包涵体、获得的FN蛋白生物学活性较低等缺陷的技术问题,本发明提供一种酿酒酵母表达长效重组纤连蛋白,一种长效重组纤连蛋白促牛肾细胞贴壁活性检测的检测方法,以及一种酿酒酵母表达长效重组纤连蛋白在化妆品中的应用。
本发明采用以下技术方案实现:一种酿酒酵母表达长效重组纤连蛋白,其包括:长效重组纤连蛋白的核苷酸序列如Seq ID NO.1所示,长效重组纤连蛋白包括FN的功能片段、HAS;FN的功能片段包括FNIII1C单元;FNIII1C单元为FN中第1个III型FN重复单元C端的一个功能片段。
作为上一步技术方案的改进,长效重组纤连蛋白的获得方法包括以下步骤:
步骤一、目的基因的序列的设计:目的基因为FNIII1C-HAS基因,FNIII1C-HAS基因包括:Not I酶切位点、Xba I酶切位点、起始密码子、终止密码子、标签序列以及连接FNIII1C单元和HSA序列的Linker所对应的碱基序列;
步骤二、构建重组载体:首先根据目的基因的序列设计扩增引物,其次PCR扩增目的基因,之后进行重组载体的构建;
步骤三、构建工程菌:将重组载体和酿酒酵母INVScl感受态细胞按照10μl:80μl的比例混合均匀,然后转移到预冷的电击杯中;冰浴5min,擦干电击杯外壁;
将Bio-Rad电转化仪调至真菌档,电击杯置于Bio-Rad电转化仪上电击;迅速向电击杯中加入500μl预冷的1M山梨醇溶液,混合均匀,涂SC-U固体平板;
30℃恒温倒置培养,直至长出单克隆;挑取转化子接种到SC-U液体培养基中,30℃、200rpm恒温培养;
以菌液为模板进行PCR反应,鉴定筛选阳性克隆;选取鉴定无误的转化子,获得工程菌INVSc1/pYES2/CT-MFα-rFNIII1C-HAS;
步骤四、工程菌的诱导表达:挑取工程菌单菌落接种于SC-U选择培养基,经30℃、220rpm震荡培养过夜。测定其OD
步骤五、长效重组纤连蛋白的纯化:离心收集培养液上清,用滤膜过滤用以上样;
使用镍离子螯合亲和层析填料自行装柱,获得镍离子螯合亲和层析柱,用纯化水清洗镍离子螯合亲和层析柱,再用PBS缓冲液平衡镍离子螯合亲和层析柱的pH值;
在线检测电导率值及280nm波长吸收值,待两者都稳定后开始上样,设置样品经过泵过层析柱的流速为5-6ml/min;再用PBS缓冲液过层析柱,洗去未与层析柱结合的杂蛋白,直到OD
再以含咪唑的PBS缓冲液过层析柱,洗脱并收集洗脱峰对应的蛋白,即得到长效重组纤连蛋白原液。
作为上一步技术方案的改进,扩增引物包括正向引物及反向引物,
正向引物的核苷酸序列如Seq ID NO.3所示;反向引物的核苷酸序列如Seq IDNO.4所示。
作为上一步技术方案的改进,PCR扩增目的基因的PCR条件包括:
第一步、95℃预变性5min;
第二步、95℃变性1min,60℃退火1min,72℃延伸2.5min,共29个循环;72℃最终延伸10min,获得PCR扩增产物;
第三步、分离PCR扩增产物,切下目的条带,目的条带为目的基因PCR扩增产物;
第四步、回收目的基因PCR扩增产物。
作为上一步技术方案的改进,重组载体的构建包括以下步骤:
步骤a、提取DH5α/pYES2/CT-MFα中的pYES2/CT-MFα质粒;
步骤b、将质粒pYES2/CT-MFα和目的基因PCR扩增产物分别用Not I和Xba I进行双酶切,获得双酶切的pYES2/CT-MFα片段和目的基因PCR扩增产物,回收双酶切的pYES2/CT-MFα片段和目的基因PCR扩增产物;
步骤c、将回收的pYES2/CT-MFα片段和目的基因PCR扩增产物用T4 DNA连接酶在37℃中连接约30min,获得连接产物;
步骤d、将连接产物转化到E.coliDH5α感受态细胞中,经Amp抗性筛选后挑取阳性转化子进行培养,获得重组载体,重组载体为pYES2/CT-MFα-rFNIII1C-HSA质粒。
进一步地,pYES2/CT-MFα质粒的酶切体系为50μl,pYES2/CT-MFα质粒的酶切体系以QuickCut Not I:QuickCut Xba I:10×QuickCut Green Buffer:pYES2/CT-MFα按照以下比例混合:5μl:5μl:5μl:35μl;
目的基因PCR扩增产物的酶切体系为50μl,目的基因PCR扩增产物的酶切体系以QuickCut Not I:QuickCut Xba I:10×QuickCut Green Buffer:目的基因PCR扩增产物按照以下比例混合:5μl:5μl:5μl:35μl;
pYES2/CT-MFα质粒与目的基因PCR扩增产物的酶切条件包括:在37℃金属浴中酶切3h。
进一步地,pYES2/CT-MFα片段与目的基因PCR扩增产物的连接体系为10μl,连接体系以回收的pYES2/CT-MFα片段:回收的目的基因PCR扩增产物:T4 DNA ligase:10×ligasebuffer按照以下比例混合:3μl:5μl:1μl:1μl。
本发明还提供一种酿酒酵母表达长效重组纤连蛋白促牛肾细胞贴壁活性检测的检测方法,该检测方法采用如上任意一项的酿酒酵母表达长效重组纤连蛋白;检测方法还包括试剂配制及促细胞生长活性测定。
作为上一步技术方案的改进,试剂包括:完全培养液、无血清培养液、消化液及PBS缓冲液;促细胞生长活性测定包括以下步骤:
牛肾细胞在完全细胞培养液中传代培养,加入用无血清培养基重悬,获得牛肾细胞细胞悬液;
将长效重组纤连蛋白用PBS缓冲液预稀释,预稀释完成后在96孔板中进行2倍梯度稀释,共做10个稀释度,获得每孔50μl不同稀释度的长效重组纤连蛋白样本,并设立阴性对照,4℃过夜孵育;阴性对照为50μl PBS;
孵育完成后弃去板中液体,每孔加入100μl 30g/L BSA封闭,置于37℃温箱孵育1h;弃去板中液体,加入牛肾细胞细胞悬液,细胞接种密度为1.0×10
将孵育完成的细胞板用PBS缓冲液洗涤,镜下观察细胞贴壁情况,选取200倍镜下除边缘处五个点计贴壁细胞数,获得计数结果拟合曲线,根据计数结果拟合曲线判断长效重组纤连蛋白促牛肾细胞贴壁活性。
本发明还提供一种酿酒酵母表达长效重组纤连蛋白在化妆品中的应用,其采用如上任意一项的酿酒酵母表达长效重组纤连蛋白。
本发明的有益效果:
1、本发明利用酿酒酵母分泌表达的长效重组纤连蛋白为天然人FN的一个功能片段(FNIII1C)与HSA融合而成的重组蛋白(FNIII1C-HAS)。FNIII1C为天然人FN中第1个III型FN重复单元C端的一个功能片段,具有抗肿瘤、抗转移和抑制血管增生的功能。该蛋白还能够使生物体中的FN发生超聚化,大大增强FN促细胞粘附、抗细胞迁移的能力。融合HAS有效的提高了重组蛋白的稳定性。
2、体外试验证明FNIII1C-HAS能促进牛肾细胞(MDBK)细胞的黏连和粘附,可提高细胞的贴壁率、汇合率,缩短细胞汇合时间,使细胞形态结构良好、代谢率增强及蛋白质合成速度显著提高。而细胞的黏连和粘附是细胞修复、细胞生长完成的必要条件,因此纤连蛋白具有促细胞修复的功效。此外,经小鼠模型试验证明FNIII1C-HAS能有效促进皮肤创伤修复,显著提高损伤的愈合率。
3、本发明利用酿酒酵母分泌表达长效重组纤连蛋白,获得的长效重组纤连蛋白产物均一、无免疫原性,使长效重组纤连蛋白生产工艺更加简单、且成本低。
附图说明
图1为长效重组纤连蛋白的获得方法的流程图。
图2为FN单体结构域的示意图。
图3为pYES2/CT-MFα质粒的图谱。
图4为PCR扩增FNIII1C-HAS基因的琼脂糖凝胶电泳结果图,图中M为DNA MarkerDL2000的琼脂糖凝胶电泳结果图,1-2为FNIII1C-HAS基因的琼脂糖凝胶电泳结果图,3为纯水的琼脂糖凝胶电泳结果图(阴性对照)。
图5为双酶切目的基因PCR扩增产物和pYES2/CT-MFα质粒的琼脂糖凝胶电泳结果图,图中M为DNA Marker DL2000的琼脂糖凝胶电泳结果图,1-2为双酶切的FNIII1C-HAS基因的琼脂糖凝胶电泳结果图,3为双酶切pYES2/CT-MFα片段的琼脂糖凝胶电泳结果图(阴性对照)。
图6为PCR鉴定目的基因的琼脂糖凝胶电泳结果图,图中M为DNA Marker DL2000;1-4为菌液PCR结果。
图7为INVSc1/pYES2/CT-MFα-rFNIII1C-HSA诱导表达的上清液的电泳结果图,图中1为诱导上清液的电泳结果图;M为Marker的电泳结果图;2为含有空载质粒酿酒酵母菌株的诱导上清液的电泳结果图。
图8为根据记录的伤口面积计算创面愈合率的示意图。
Seq ID NO.1所示为本发明实施例中长效重组纤连蛋白的核苷酸序列。
Seq ID NO.2所示为本发明实施例中长效重组纤连蛋白的氨基酸序列。
Seq ID NO.3所示为本发明实施例中正向引物的核苷酸序列。
Seq ID NO.4所示为本发明实施例中反向引物的核苷酸序列。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅用以解释本发明,并不用于限定本发明。
实施例1
本实施例公开一种酿酒酵母表达长效重组纤连蛋白。克服了天然提纯FN工艺复杂、成本高;天然FN分子量大,全序列表达可行性低,使其推广应用受到限制;现有原核表达系统存在容易形成包涵体、获得的FN蛋白生物学活性较低等缺陷。
该长效重组纤连蛋白为rFNIII1C-HAS。长效重组纤连蛋白的核苷酸序列如Seq IDNO.1所示,长效重组纤连蛋白的核苷酸序列所对应的氨基酸序列如Seq ID NO.2所示。长效重组纤连蛋白的核苷酸序列包括FN的功能片段、HAS;FN的功能片段包括FNIII1C单元;FNIII1C单元为FN中第1个III型FN重复单元C端的一个功能片段(结合图2所示)。
本实施例中的长效重组纤连蛋白为天然人FN的一个功能片段(FNIII1C)与HSA融合而成的重组蛋白(FNIII1C-HAS)。FNIII1C为天然人FN中第1个III型FN重复单元C端的一个功能片段,具有抗肿瘤、抗转移和抑制血管增生的功能。该蛋白还能够使生物体中的FN发生超聚化,大大增强FN促细胞粘附、抗细胞迁移的能力。融合HAS有效的提高了重组蛋白的稳定性。
获得长效重组纤连蛋白用到的培养基及试剂配制具体包括:
(1)YPD完全培养基:
121℃高压灭菌20min,冷却至60℃以下,超净台中加入无菌100ml10%葡萄糖。固体培养基另加琼脂粉2.0%。
(2)SC-U缺陷型培养基:
0.01%氨基酸混合物I为精氨酸、亮氨酸、苏氨酸、赖氨酸、色氨酸、半胱氨酸和腺嘌呤,0.005%氨基酸混合物II为天冬氨酸、丝氨酸、组氨酸、脯氨酸、异亮氨酸、苯丙氨酸、撷氨酸、酪氨酸和甲硫氨酸。121℃高压灭菌20min,冷却至60℃以下,超净台中加入无菌100ml20%葡萄糖。固体培养基另加琼脂粉2.0%。
(3)SC-U诱导培养基:
121℃高压灭菌20min,冷却至60℃以下,超净台中加入无菌100ml 20%半乳糖。固体培养基另加琼脂粉2.0%。
(4)PBS缓冲液:
称上述成分加纯化水溶解,调pH至8.0,定容至1L。
(5)含500mM咪唑PBS缓冲液:
称上述成分加纯化水溶解,调pH至8.0,定容至1L。
在其他实施例中,培养基及试剂配制的成分即定容量比例可根据本领域技术人员的需要进行调配。
该长效重组纤连蛋白的获得方法包括以下步骤:
步骤一、目的基因的序列的设计:目的基因为FNIII1C-HAS基因,FNIII1C-HAS基因包括:Not I酶切位点、Xba I酶切位点、起始密码子、终止密码子、标签序列以及连接FNIII1C单元和HSA序列的Linker所对应的碱基序列。
本实施例中根据pYES2/CT-MFα载体的性质(结合图3所示)和酿酒酵母宿主密码子偏爱性,设计FNIII1C-HSA基因序列为:
注:
融合蛋白FNIII1C-HSA的氨基酸序列为:
MNAPQPSHISKYILRWRPKNSVGRWKEATIPGHLNSYTIKGLKPGVVYEGQLISIQQYGHQEVTRFDFTTTSTSTPAEAAAKEAAAKAMKWVTFISLLFLFSSAYSRGVFRRDAHKSEVAHRFKDLGEENFKALVLIAFAQYLQQCPFEDHVKLVNEVTEFAKTCVADESAENCDKSLHTLFGDKLCTVATLRETYGEMADCCAKQEPERNECFLQHKDDNPNLPRLVRPEVDVMCTAFHDNEETFLKKYLYEIARRHPYFYAPELLFFAKRYKAAFTECCQAADKAACLLPKLDELRDEGKASSAKQRLKCASLQKFGERAFKAWAVARLSQRFPKAEFAEVSKLVTDLTKVHTECCHGDLLECADDRADLAKYICENQDSISSKLKECCEKPLLEKSHCIAEVENDEMPADLPSLAADFVESKDVCKNYAEAKDVFLGMFLYEYARRHPDYSVVLLLRLAKTYETTLEKCCAAADPHECYAKVFDEFKPLVEEPQNLIKQNCELFEQLGEYKFQNALLVRYTKKVPQVSTPTLVEVSRNLGKVGSKCCKHPEAKRMPCAEDYLSVVLNQLCVLHEKTPVSDRVTKCCTESLVNRRPCFSALEVDETYVPKEFNAETFTFHADICTLSEKERQIKKQTALVELVKHKPKATKEQLKAVMDDFAAFVEKCCKADDKETCFAEEGKKLVAASQAALGLHHHHHH。
步骤二、构建重组载体:首先,根据目的基因的序列设计扩增引物,本实施例中,根据FNIII1C-HSA核苷酸序列设计扩增引物。扩增引物包括正向引物与反向引物,正向引物的核苷酸序列如Seq ID NO.3所示,正向引物的核苷酸序列为:5'ATAAGAATGCGGCCGCATGAATGCGCCACAGCCATCCCATA 3'。反向引物的核苷酸序列如Seq ID NO.4所示,反向引物的核苷酸序列为5'CTAGTCTAGATTAGTGATGGTGATGGTGATGTAACCCTAAAG 3'。
其次,PCR扩增目的基因,PCR扩增目的基因的PCR条件包括:95℃预变性5min;95℃变性1min,60℃退火1min,72℃延伸2.5min,共29个循环;72℃最终延伸10min,获得PCR扩增产物;分离PCR扩增产物,切下目的条带,目的条带为目的基因PCR扩增产物;回收目的基因PCR扩增产物。
本实施例中通过琼脂糖凝胶电泳分离PCR扩增产物(结合图4所述),琼脂糖凝胶的浓度优选为1%,在紫外灯下快速切下目的条带,并用DNA凝胶回收试剂盒回收目的基因PCR扩增产物。在生物化学领域中,1%的琼脂糖凝胶指每100ml电泳缓冲液中加入1g琼脂糖形成的琼脂糖凝胶。
之后,进行重组载体的构建,其包括以下步骤:
步骤a、提取DH5α/pYES2/CT-MFα中的pYES2/CT-MFα质粒。
步骤b、将质粒pYES2/CT-MFα和目的基因PCR扩增产物分别用Not I和Xba I进行双酶切,获得双酶切的pYES2/CT-MFα片段和目的基因PCR扩增产物,回收双酶切的pYES2/CT-MFα片段和目的基因PCR扩增产物。
其中,pYES2/CT-MFα质粒的酶切体系为50μl,pYES2/CT-MFα质粒的酶切体系以QuickCut Not I:QuickCut Xba I:10×QuickCut Green Buffer:pYES2/CT-MFα按照以下比例混合:5μl:5μl:5μl:35μl。
目的基因PCR扩增产物的酶切体系为50μl,目的基因PCR扩增产物的酶切体系以QuickCut Not I:QuickCut Xba I:10×QuickCut Green Buffer:目的基因PCR扩增产物按照以下比例混合:5μl:5μl:5μl:35μl。
pYES2/CT-MFα质粒与目的基因PCR扩增产物的酶切条件为在37℃金属浴中酶切3h。在本实施例中,酶切后进行琼脂糖凝胶电泳(结合图5所示),琼脂糖凝胶的浓度优选为2%,并胶回收双酶切的目的基因PCR扩增产物和pYES2/CT-MFα片段。在生物化学领域中,2%的琼脂糖凝胶指每100ml电泳缓冲液中加入2g琼脂糖形成的琼脂糖凝胶。
步骤c、将回收的pYES2/CT-MFα片段和目的基因PCR扩增产物用T4 DNA连接酶在37℃中连接约30min,获得连接产物。pYES2/CT-MFα片段与目的基因PCR扩增产物的连接体系为10μl,连接体系以回收的pYES2/CT-MFα片段:回收的目的基因PCR扩增产物:T4 DNAligase:10×ligase buffer按照以下比例混合:3μl:5μl:1μl:1μl。
步骤d、将连接产物转化到E.coliDH5α感受态细胞中,经Amp抗性筛选后挑取阳性转化子进行培养,获得重组载体,重组载体为pYES2/CT-MFα-rFNIII1C-HSA质粒。本实施例中利用菌液PCR鉴定基因是否成功导入载体,其结果请参照图6,可知基因已成功导入载体。再将菌液送通用生物公司进行测序,测序结果无误,则pYES2/CT-MFα-rFNIII1C-HSA载体构建成功。
步骤三、构建工程菌,本实施例中pYES2/CT-MFα-rFNIII1C-HSA载体通过电转化至酿酒酵母INVSc1感受态细胞。
将重组载体:酿酒酵母INVScl感受态细胞按照10μl:80μl的比例混合均匀,然后转移到预冷的电击杯中;冰浴5min,擦干电击杯外壁;将Bio-Rad电转化仪调至真菌档,电击杯置于Bio-Rad电转化仪上电击;迅速向电击杯中加入500μl预冷的1M山梨醇溶液,混合均匀,涂SC-U固体平板;30℃恒温倒置培养,直至长出单克隆;挑取转化子接种到SC-U液体培养基中,30℃、200rpm恒温培养;以菌液为模板进行PCR反应,鉴定筛选阳性克隆;选取鉴定无误的转化子,获得工程菌INVSc1/pYES2/CT-MFα-rFNIII1C-HAS。
步骤四、工程菌的诱导表达:挑取工程菌单菌落接种于SC-U选择培养基,经30℃、220rpm震荡培养过夜。测定其OD
在本实施例中挑取INVSc1/pYES2/CT-MFα-rFNIII1C-HSA单菌落接种于20ml SC-U选择培养基,经30℃、220rpm震荡培养过夜。测定其OD
请结合图7所示,INVSc1/pYES2/CT-MFα-rFNIII1C-HSA诱导表达的上清液经SDS-PAGE电泳可观察到77kDa左右的特异性条带,而含有pYES2/CT-MFα空载质粒的酿酒酵母菌株的诱导表达上清液则无特异性条带。
步骤五、长效重组纤连蛋白的纯化:离心收集培养液上清,用滤膜过滤用以上样;使用镍离子螯合亲和层析填料自行装柱,获得镍离子螯合亲和层析柱,用纯化水清洗镍离子螯合亲和层析柱,再用PBS缓冲液平衡镍离子螯合亲和层析柱的pH值;在线检测电导率值及280nm波长吸收值,待两者都稳定后开始上样,设置样品经过泵过层析柱的流速为5-6ml/min;再用PBS缓冲液过层析柱,洗去未与层析柱结合的杂蛋白,直到OD
在本实施例中离心收集培养液上清,用0.22μm滤膜过滤用以上样。使用GEHealthcare公司Chelating Sepharose TM Fast Flow镍离子螯合亲和层析填料自行装柱,用3个柱体积的纯化水清洗Ni
酿酒酵母分泌表达系统为真核表达系统,能够高水平表达蛋白质分泌到培养基中,产品生产工艺简单、成本低、产物均一、无免疫原性。本发明利用酿酒酵母分泌表达的长效重组纤连蛋白能够使生物体中的FN发生超聚化,大大增强FN促细胞粘附、抗细胞迁移的能力,且重组蛋白的稳定性较高。
实施例2
本实施例公开一种酿酒酵母表达长效重组纤连蛋白促牛肾细胞贴壁活性检测的检测方法。用于验证如实施例1的长效重组纤连蛋白FNIII1C-HAS促牛肾细胞(MDBK)的贴壁活性。该检测方法包括试剂配制及促细胞生长活性测定。
试剂包括:完全培养液、无血清培养液、消化液及PBS缓冲液。
本实施例中各个培养及试剂的配制具体包括:
(1)完全培养液:量取胎牛血清10ml,双抗1ml,加入DMEM培养液90ml。
(2)无血清培养液:量取双抗1ml,加入1640培养液99ml。
(3)消化液:0.25%胰蛋白酶。
(4)PBS缓冲液:称取氯化钠8.0g、氯化钾0.20g、磷酸氢二钠1.44g、磷酸二氢钾0.24g,加水溶解并定容至1000ml,经121℃、15分钟高压灭菌。
促细胞生长活性测定包括以下步骤:
牛肾细胞在完全细胞培养液中传代培养,加入用无血清培养基重悬,获得牛肾细胞细胞悬液。其中,牛肾细胞在完全细胞培养液中呈单层、贴壁生长,每4-5d传代一次,1:2消化传代,于完全培养液中生长繁殖。待到快使用时,用无血清培养基进行重悬。
将长效重组纤连蛋白用PBS缓冲液预稀释,预稀释完成后在96孔板中进行2倍梯度稀释,共做10个稀释度,获得每孔50μl不同稀释度的长效重组纤连蛋白样本,并设立阴性对照,4℃过夜孵育;阴性对照为50μl PBS。
在本实施例中,将长效重组纤连蛋白rFNIII1C-HSA用PBS预稀释至0.5μg/ml,预稀释完成后在96孔板中进行2倍梯度稀释,共做10个稀释度,每孔50μl不同稀释度的rFNIII1C-HSA样本,并设立阴性对照(不加rFNIII1C-HSA,加入50μl PBS)作为对照,4℃过夜孵育。
孵育完成后弃去板中液体,每孔加入100μl 30g/L BSA封闭,置于37℃温箱孵育1h;弃去板中液体,加入牛肾细胞细胞悬液,细胞接种密度为1.0×10
将孵育完成的细胞板用PBS缓冲液洗涤,镜下观察细胞贴壁情况,选取200倍镜下除边缘处五个点计贴壁细胞数,获得计数结果拟合曲线,根据计数结果拟合曲线判断长效重组纤连蛋白促牛肾细胞贴壁活性。其中,孵育完成的细胞板用PBS缓冲液洗涤3次,在其他实施例中洗涤次数可根据本领域技术人员的经验设置。
rFNIII1C-HAS促MDBK细胞贴壁的黏附效果(半数有效浓度ED
实施例3
本实施例提供了rFNIII1C-HAS用于皮肤损伤修复的实验,用于验证实施例1中rFNIII1C-HAS用于皮肤损伤修复的效果。经小鼠模型试验证明FNIII1C-HAS能有效促进皮肤创伤修复,显著提高损伤的愈合率。该实施包括以下步骤:
(1)试验分组
4-5周龄实验大鼠分2组,每组10只,体重250g左右,打耳号标记。
(2)试验处理
采用打孔器于背部打孔(直径0.5cm),分别设置PBS涂抹对照组和rFNIII1C-HAS(1mg/ml)涂抹实验组,每天涂抹3次直至伤口愈合。将2组大鼠置于温暖干燥的环境中饲养,每天拍摄照片并观察纪录创面愈合情况。
(3)实验结果
请参阅图8,能够观察到验组小鼠背部创伤分别涂抹rFNIII1C-HAS的实验组和涂抹PBS的对照组的伤口变化:从第0d开始,实验组小鼠背部创伤发生的炎症反应程度弱与对照组,从第4d开始实验组小鼠的背部的创面愈合速率大于对照组,且这种现象一直持续到实验结束。观察拍照时测量伤口边缘周长,计算面积大小,根据记录的伤口面积计算创面愈合率,其中实验组愈合率为89.2%±4%,对照组愈合率为49.3%±6%,实验组高于对照组,且具有统计学意义(p<0.05)。
实施例4
本实施例提供一种酿酒酵母表达长效重组纤连蛋白在化妆品中的应用,其采用如实施例1中所述的酿酒酵母表达长效重组纤连蛋白。该长效重组纤连蛋白具有促细胞修复的功效。且如实施例2中所述,实施例1中的长效重组纤连蛋白具有促细胞修复的功效。另外,由此可知,如实施例3中所述,实施例1中的长效重组纤连蛋白能有效促进皮肤创伤修复,显著提高损伤的愈合率。由此可知,实施例1中所述的长效重组纤连蛋白在化妆品中具有广泛的应用前景。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
序列表
<110>芜湖英特菲尔生物制品产业研究院有限公司
<120>一种酿酒酵母表达长效重组纤连蛋白及其在化妆品中的应用
<141> 2021-04-01
<160> 4
<170> SIPOSequenceListing 1.0
<210> 1
<211> 2109
<212> DNA
<213>酿酒酵母(Saccharomyces cerevisiae)
<400> 1
atgaatgcgc cacagccatc ccatatctca aagtacattc taagatggag gcccaaaaac 60
tccgttgggc gttggaaaga agccaccatt cctggtcacc tgaattctta caccattaaa 120
ggccttaagc caggagtcgt ttatgagggt cagctaattt ccatccaaca gtatgggcat 180
caagaggtga ctagattcga cttcacaaca acgtctacat ccacacccgc agaggcggcg 240
gctaaggaag ctgcagccaa agccatgaag tgggttacgt ttatctccct attatttctg 300
ttctcatccg cctactccag aggtgttttc aggagagatg ctcacaaatc tgaggttgct 360
catagattca aggatttggg tgaagaaaac tttaaggcct tagtgttaat agctttcgca 420
caatacctgc aacagtgtcc ttttgaagac catgtcaaat tagttaatga agtcaccgaa 480
tttgctaaga cgtgcgttgc tgatgagtct gccgaaaatt gtgacaaatc actgcataca 540
ttgttcggtg ataagctatg taccgttgca actcttagag aaacgtacgg agagatggcg 600
gactgttgtg ctaaacaaga acctgaaaga aatgaatgtt ttttgcaaca caaagatgat 660
aatccaaact tgccaagatt ggtaagacca gaagttgacg ttatgtgtac cgcttttcat 720
gataatgaag aaacattttt gaaaaagtat ctttatgaaa tagcaaggag gcatccttac 780
ttctacgctc cagagttatt attttttgca aaaagatata aggcagcttt tactgaatgt 840
tgtcaggctg cggataaagc cgcatgtctg ttacccaaat tggatgaatt gagagacgag 900
ggcaaagcta gtagtgccaa acaaagatta aaatgcgctt cattacaaaa atttggagaa 960
agagcgttta aggcttgggc cgtagcaaga ttgtctcaga gattcccgaa agccgaattt 1020
gcagaagtga gtaaactggt cacagatttg acgaaagttc acacagaatg ttgtcacgga 1080
gatttattgg aatgcgctga cgatagggct gacttagcta aatacatatg cgagaatcaa 1140
gattccatat catcaaaatt gaaagaatgt tgtgagaaac cattattaga aaaatcccac 1200
tgtatagctg aagttgagaa cgatgaaatg cccgcggatt taccctccct tgcggctgac 1260
ttcgttgagt caaaggatgt ttgcaagaat tacgcggagg ccaaggatgt ttttcttggc 1320
atgtttttat atgagtatgc cagacgtcat ccggattatt ctgtagttct actgttaagg 1380
cttgccaaga catacgaaac taccttagaa aaatgttgtg cggctgccga tccacatgaa 1440
tgttacgcaa aagtttttga tgaattcaag ccgcttgtcg aggagccaca aaatttaatt 1500
aaacaaaact gtgaattatt tgaacaatta ggtgaatata aattccaaaa cgcattattg 1560
gtcagatata caaaaaaagt acctcaggtt tccacaccaa ctttagtgga agtgtcacgt 1620
aacctaggca aggttggtag taagtgctgt aaacacccag aagctaagag aatgccatgc 1680
gctgaagatt atctatcagt cgtacttaat caactgtgtg tcctacacga gaagactcct 1740
gtcagtgaca gagtgacaaa atgttgcacc gagagcttag ttaatagaag accgtgtttt 1800
tcagcgctgg aagttgatga aacctatgtt ccaaaggagt tcaatgcaga aacattcacc 1860
ttccatgctg atatatgtac tcttagtgaa aaagaaaggc agatcaaaaa acaaactgcc 1920
ctggtcgaat tagtcaaaca taaacctaaa gcaacgaagg aacagttgaa ggccgtaatg 1980
gatgatttcg cagctttcgt tgaaaaatgt tgcaaggctg atgacaaaga gacatgtttt 2040
gctgaagagg gaaaaaaatt ggtggcagct tctcaagccg ctttagggtt acatcaccat 2100
caccatcac 2109
<210> 4
<211> 703
<212> PRT
<213>融合蛋白(Saccharomyces cerevisiae)
<400> 4
Met Asn Ala Pro Gln Pro Ser His Ile Ser Lys Tyr Ile Leu Arg Trp
1 5 10 15
Arg Pro Lys Asn Ser Val Gly Arg Trp Lys Glu Ala Thr Ile Pro Gly
20 25 30
His Leu Asn Ser Tyr Thr Ile Lys Gly Leu Lys Pro Gly Val Val Tyr
35 40 45
Glu Gly Gln Leu Ile Ser Ile Gln Gln Tyr Gly His Gln Glu Val Thr
50 55 60
Arg Phe Asp Phe Thr Thr Thr Ser Thr Ser Thr Pro Ala Glu Ala Ala
65 70 75 80
Ala Lys Glu Ala Ala Ala Lys Ala Met Lys Trp Val Thr Phe Ile Ser
85 90 95
Leu Leu Phe Leu Phe Ser Ser Ala Tyr Ser Arg Gly Val Phe Arg Arg
100 105 110
Asp Ala His Lys Ser Glu Val Ala His Arg Phe Lys Asp Leu Gly Glu
115 120 125
Glu Asn Phe Lys Ala Leu Val Leu Ile Ala Phe Ala Gln Tyr Leu Gln
130 135 140
Gln Cys Pro Phe Glu Asp His Val Lys Leu Val Asn Glu Val Thr Glu
145 150 155 160
Phe Ala Lys Thr Cys Val Ala Asp Glu Ser Ala Glu Asn Cys Asp Lys
165 170 175
Ser Leu His Thr Leu Phe Gly Asp Lys Leu Cys Thr Val Ala Thr Leu
180 185 190
Arg Glu Thr Tyr Gly Glu Met Ala Asp Cys Cys Ala Lys Gln Glu Pro
195 200 205
Glu Arg Asn Glu Cys Phe Leu Gln His Lys Asp Asp Asn Pro Asn Leu
210 215 220
Pro Arg Leu Val Arg Pro Glu Val Asp Val Met Cys Thr Ala Phe His
225 230 235 240
Asp Asn Glu Glu Thr Phe Leu Lys Lys Tyr Leu Tyr Glu Ile Ala Arg
245 250 255
Arg His Pro Tyr Phe Tyr Ala Pro Glu Leu Leu Phe Phe Ala Lys Arg
260 265 270
Tyr Lys Ala Ala Phe Thr Glu Cys Cys Gln Ala Ala Asp Lys Ala Ala
275 280 285
Cys Leu Leu Pro Lys Leu Asp Glu Leu Arg Asp Glu Gly Lys Ala Ser
290 295 300
Ser Ala Lys Gln Arg Leu Lys Cys Ala Ser Leu Gln Lys Phe Gly Glu
305 310 315 320
Arg Ala Phe Lys Ala Trp Ala Val Ala Arg Leu Ser Gln Arg Phe Pro
325 330 335
Lys Ala Glu Phe Ala Glu Val Ser Lys Leu Val Thr Asp Leu Thr Lys
340 345 350
Val His Thr Glu Cys Cys His Gly Asp Leu Leu Glu Cys Ala Asp Asp
355 360 365
Arg Ala Asp Leu Ala Lys Tyr Ile Cys Glu Asn Gln Asp Ser Ile Ser
370 375 380
Ser Lys Leu Lys Glu Cys Cys Glu Lys Pro Leu Leu Glu Lys Ser His
385 390 395 400
Cys Ile Ala Glu Val Glu Asn Asp Glu Met Pro Ala Asp Leu Pro Ser
405 410 415
Leu Ala Ala Asp Phe Val Glu Ser Lys Asp Val Cys Lys Asn Tyr Ala
420 425 430
Glu Ala Lys Asp Val Phe Leu Gly Met Phe Leu Tyr Glu Tyr Ala Arg
435 440 445
Arg His Pro Asp Tyr Ser Val Val Leu Leu Leu Arg Leu Ala Lys Thr
450 455 460
Tyr Glu Thr Thr Leu Glu Lys Cys Cys Ala Ala Ala Asp Pro His Glu
465 470 475 480
Cys Tyr Ala Lys Val Phe Asp Glu Phe Lys Pro Leu Val Glu Glu Pro
485 490 495
Gln Asn Leu Ile Lys Gln Asn Cys Glu Leu Phe Glu Gln Leu Gly Glu
500 505 510
Tyr Lys Phe Gln Asn Ala Leu Leu Val Arg Tyr Thr Lys Lys Val Pro
515 520 525
Gln Val Ser Thr Pro Thr Leu Val Glu Val Ser Arg Asn Leu Gly Lys
530 535 540
Val Gly Ser Lys Cys Cys Lys His Pro Glu Ala Lys Arg Met Pro Cys
545 550 555 560
Ala Glu Asp Tyr Leu Ser Val Val Leu Asn Gln Leu Cys Val Leu His
565 570 575
Glu Lys Thr Pro Val Ser Asp Arg Val Thr Lys Cys Cys Thr Glu Ser
580 585 590
Leu Val Asn Arg Arg Pro Cys Phe Ser Ala Leu Glu Val Asp Glu Thr
595 600 605
Tyr Val Pro Lys Glu Phe Asn Ala Glu Thr Phe Thr Phe His Ala Asp
610 615 620
Ile Cys Thr Leu Ser Glu Lys Glu Arg Gln Ile Lys Lys Gln Thr Ala
625 630 635 640
Leu Val Glu Leu Val Lys His Lys Pro Lys Ala Thr Lys Glu Gln Leu
645 650 655
Lys Ala Val Met Asp Asp Phe Ala Ala Phe Val Glu Lys Cys Cys Lys
660 665 670
Ala Asp Asp Lys Glu Thr Cys Phe Ala Glu Glu Gly Lys Lys Leu Val
675 680 685
Ala Ala Ser Gln Ala Ala Leu Gly Leu His His His His His His
690 695 700
<210> 3
<211> 41
<212> DNA
<213> Saccharomyces cerevisiae
<400> 3
ataagaatgc ggccgcatga atgcgccaca gccatcccat a 41
<210> 4
<211> 42
<212> DNA
<213> Saccharomyces cerevisiae
<400> 4
ctagtctaga ttagtgatgg tgatggtgat gtaaccctaa ag 42
- 一种酿酒酵母表达长效重组纤连蛋白及其在化妆品中的应用
- 一种酿酒酵母表达长效重组金属硫蛋白及其在化妆品中的应用
