一种微流控分析芯片、样本检测方法
文献发布时间:2023-06-19 13:45:04
技术领域
本发明涉及生物样本检测技术领域,尤其涉及一种微流控分析芯片、样本检测方法。
背景技术
血细胞、血红蛋白(HGB)、糖化血红蛋白(HbA1C)、超敏C反应蛋白(hs-CRP)、C反应蛋白(CRP)、血清淀粉样蛋白A(SAA)、降钙素原(PCT)等生物标志物已成为临床炎症相关疾病诊断的常规检测项目。针对上述项目,现有检测技术不但实现了“分别加样分别检测”、“一次加样同时检测两个项目”,同时也朝着微流控方向发展。
现有技术一方面促进了临床炎症感染诊断生物标志检测操作的简便化,但仍然遗留有待解决的问题。例如对于血细胞检测而言,目前的检测设备尺寸大,占用空间大、且需要单独的废液罐,废液处理费时费力,试剂多人份,容易造成试剂过期浪费。同时,血细胞检测与炎症感染生物标志物的检测分别属于两种检测原理,所需样本形式各有不同。如血液细胞检测,需要抗凝全血;炎症感染生物标志物检测需要用到祛除血液细胞后的血浆或血清,实际检测中往往通过离心或过滤的方式实现血液细胞的祛除。现有技术为了实现一次加样、完成上述两类检测,则需要在设备上集成分血装置。分血装置的加入,不但增加了设备的复杂度,提高了设备的故障率,同时,样本消耗量也随检测项目的增加而增大。另一方面,现有技术中的小/微化主要集中于单方法学的运用,一台设备只能提供同一方法学不同项目的同时检测,导致血细胞、蛋白的检测需配置不同设备。
基于目前血细胞检测以及血细胞检测与炎症感染生物标志物无法同时检测存在的缺陷,有必要对此进行改进。
发明内容
有鉴于此,本发明提出了一种微流控分析芯片、样本检测方法,以解决或至少部分解决现有技术中存在的技术问题。
第一方面,本发明提供了一种微流控分析芯片,包括:
芯片本体,其内上下至少设有两个微流通道,所述芯片本体上还设有流道入口、所述流道入口与其中一个微流通道连通;
血细胞检测组件,包括:
第一微孔,其用于连通上下两个微流通道;
电阻抗信号电极对,其位于所述第一微孔两侧且分别位于两个微通道上,所述电阻抗信号电极对用于输出血细胞电阻抗脉冲信号;
信号采集开始电极对,位于微流通道内且位于电阻抗信号电极对下游,所述信号采集开始电极对用于确定血细胞电阻抗脉冲信号采集开始时刻;
信号采集结束电极对,位于微流通道内且信号采集开始电极对下游,所述信号采集结束电极对用于确定血细胞电阻抗脉冲信号采集结束时刻。
优选的是,所述的微流控分析芯片,还包括蛋白检测组件,所述蛋白检测组件包括位于微流通道内的检测试纸条,所述检测试纸条至少包括:
结合垫,其包被有待测蛋白抗体,该抗体带有标记探针;
反应垫,其位于结合垫下游,所述反应垫上设置有检测线和质控线,所述检测线包被有待测蛋白不同表位的抗体,所述质控线包被有多克隆抗体。
优选的是,所述的微流控分析芯片,所述芯片本体内设置有两个微流通道,所述检测试纸条位于上方的微流通道内,上方的微流通道内位于第一微孔和检测试纸条之间的区域不连通,所述芯片本体内设有连接组件,所述连接组件包括液流信号检测电极和第二微孔阵列,所述第二微孔阵列设置在两个微流通道之间并用于连通两个微流通道,所述结合垫的下端面与所述第二微孔阵列相贴合,所述液流信号检测电极位于下方的微流通道内且靠近所述第二微孔阵列,所述液流信号检测电极用于检测待测样本流入检测试纸条。
优选的是,所述的微流控分析芯片,所述液流信号检测电极呈圆环状,所述液流信号检测电极设置于所述第二微孔阵列外周。
优选的是,所述的微流控分析芯片,所述液流信号检测电极呈长条状且位于所述第二微孔阵列且靠近所述血细胞检测组件一侧。
优选的是,所述的微流控分析芯片,所述检测试纸条还包括样本垫,所述样本垫、所述结合垫、所述反应垫依次相互搭接,所述样本垫的端面贴合所述第二微孔阵列。
优选的是,所述的微流控分析芯片,所述检测试纸条还包括吸水垫,所述吸水垫位于所述反应垫远离所述结合垫一侧,所述吸水垫与所述反应垫相互搭接,所述检测试纸条所在的微流通道设有流道出口,所述吸水垫靠近所述流道出口。
优选的是,所述的微流控分析芯片,所述芯片本体上对应反应垫处设有观测窗。
优选的是,所述的微流控分析芯片,所述待测蛋白包括CRP、SAA、PCT、HGB、hs-CRP、HbA1c中的至少一种;所述标记探针包括胶体金、荧光微球、量子点、有机纳米粒子、纳米磁性材料、镧系元素中的一种。
第二方面,本发明还提供了一种样本检测方法,采用所述的微流控分析芯片进行检测,所述检测方法包括:
待测样本经流道入口进入微流通道;
当待测样本流到信号采集开始电极对时,外接系统开始通过电阻抗信号电极对采集血细胞的电阻抗脉冲信号,当待测样本流到信号采集结束电极对时,外接系统停止采集电阻抗脉冲信号,外接系统根据采集到的电阻抗脉冲信号对待测样本进行分析;
当所述微流控分析芯片包括蛋白检测组件时,所述检测方法还包括:
当待测样本流入至检测线和质控线时,待测样本发生反应,外接系统根据检测线、质控线所生成的信号对待测样本进行分析。
本发明的一种微流控分析芯片、样本检测方法,相对于现有技术具有以下有益效果:
(1)本发明的微流控分析芯片,通过向微流通道内加入待测样本,利用电阻抗信号电极对、信号采集开始电极、信号采集结束电极对,对一定时间内的待测样本的电阻抗脉冲信号进行采集,根据采集的电阻抗脉冲信号实现对待测样本中血细胞进行检测,微流控分析芯片尺寸小,检测所需的样本少,无需单独的废液罐;
(2)本发明的微流控分析芯片,还包括检测试纸条,其包括结合垫和反应垫,反应垫上设置有检测线和质控线,根据检测线和质控线的反应生成物对待测样本进行蛋白检测,通过该微流控分析芯片,实现了一次加样,同时获取血细胞、蛋白(如六种蛋白CRP、SAA、PCT、HGB、hs-CRP、HbA1c)的检测结果,极大简化了临床炎症感染诊断检测项目操作步骤、降低了样本需求量;同时本申请的微流控分析芯片实现蛋白质分析检测技术与电阻抗技术的结合,提高了操作便利性,对医护人员来说,无需准备不同类别样本(如抗凝血、促凝血),也无需配备多款设备,以达到检测目的,降低了设备购置成本。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单的介绍。显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
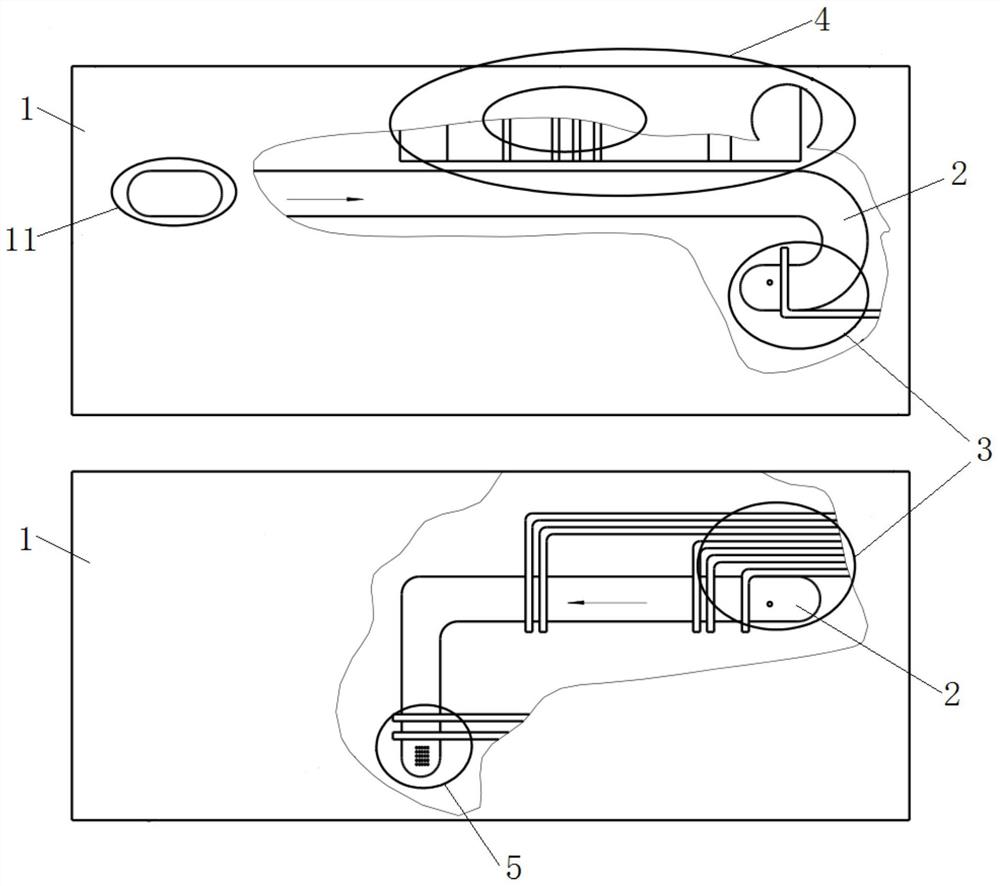
图1为本发明其中一个实施例中微流控分析芯片的结构示意图;
图2为本发明其中一个实施例中微流控分析芯片的结构示意图;
图3为本发明其中一个实施例中血细胞检测组件的结构示意图;
图4为本发明其中一个实施例中检测试纸条的结构示意图;
图5为本发明其中一个实施例中微流控分析芯片含有两个微流通道的截面示意图;
图6为本发明其中一个实施例中微流控分析芯片含有三个微流通道的截面示意图;
图7为本发明其中一个实施例中连接组件的结构示意图;
图8为本发明其中一个实施例中连接组件的结构示意图;
图9为本发明其中一个实施例中微流控分析芯片含有四个微流通道的截面示意图;
图10为本发明其中一个实施例中微流控分析芯片的结构示意图;
图11本发明其中一个实施例中微流控分析芯片进行检测时的工作时序图;
图12本发明其中一个实施例中微流控分析芯片进行检测时的工作时序图。
具体实施方式
下面将结合本发明实施方式,对本发明实施方式中的技术方案进行清楚、完整的描述,显然,所描述的实施方式仅仅是本发明一部分实施方式,而不是全部的实施方式。基于本发明中的实施方式,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施方式,都属于本发明保护的范围。
本申请实施例提供了一种微流控分析芯片,如图1~3所示,包括:
芯片本体1,其内上下至少设有两个微流通道2,芯片本体1上还设有流道入口11、流道入口11与其中一个微流通道2连通;
血细胞检测组件3,包括:
第一微孔31,其用于连通上下两个微流通道2;
电阻抗信号电极对32,其位于第一微孔31两侧且分别位于两个微通道2上,电阻抗信号电极对32用于输出血细胞电阻抗脉冲信号;
信号采集开始电极对33,位于微流通道2内且位于电阻抗信号电极对32下游,信号采集开始电极对33用于确定血细胞电阻抗脉冲信号采集开始时刻;
信号采集结束电极对34,位于微流通道2内且信号采集开始电极对33下游,信号采集结束电极对34用于确定血细胞电阻抗脉冲信号采集结束时刻。
需要说明的是,本申请实施例中微流控分析芯片既可工作于正压环境,也可工作于负压环境;芯片本体1内由上至下至少设置有两个微流通道2,具体的,微流通道2的数量可根据实际使用情况确定,比如可为2、3、4、5等;由于多个微流通道2之间相互连通,因此多个微流通道2实质上就组成一个完整的微流通道。例如可在芯片本体1内设置两个微流通道2,为了便于制备加工,芯片本体1可设置为三层结构,中间层的上下表面分别设置微流通道2,而上下两层分别贴合在中间层上,流道入口11开设在上层,即可形成芯片本体1;参考图1~2所示,图1~2显示了其中不同方案中中间层的上下表面设置的微流通道2、待测样本的流向(图中箭头方向)以及血细胞检测组件3的设置位置(图1中检测试纸条位于上表面所在的微流通道内,图2中检测试纸条位于下表面所在的微流通道内);芯片本体1上开设有流道入口11,通过流道入口11可向微流通道2内加入待测样本,同时流道入口11为外接动力源提供接口(工作于正压环境时);在微流通道2内设置血细胞检测组件3对样本中血细胞进行检测,具体的,参考图3所示,血细胞检测组件3包括第一微孔31、电阻抗信号电极对32、信号采集开始电极对33、信号采集结束电极对34,其中,第一微孔31用于连通上下两个微流通道2,具体的,第一微孔的孔径为30~60μm,电阻抗信号电极对32位于第一微孔31两侧且分别位于上下两个微流通道2上,即其中一个电阻抗信号电极对32位于上方的微流通道2上、另一个电阻抗信号电极对32位于下方的微流通道2上;信号采集开始电极对33位于电阻抗信号电极对32下游,信号采集结束电极对34位于信号采集开始电极对33下游,需要指出的是,本申请中的下游是以待测样本在微流通道中的流动方向(图1~2中箭头方向)来进行说明其上下游方位。当待测样本经上方的微流通道2流入至第一微孔31时,待测样本中的血细胞经过第一微孔31时,血细胞在第一微孔31中取代相同体积的液体,因体积置换效应及血细胞与周围包裹介质间的电导率差异,产生电阻抗脉冲信号,而电阻抗信号电极对32可以输出产生的电阻抗脉冲信号;信号采集开始电极对33确定血细胞电阻抗信号采集开始时刻;信号采集结束电极对34确定血细胞电阻抗信号采集结束时刻;信号采集开始电极对33、信号采集结束电极对34结合,确定被采集电阻抗脉冲信号的待测样本溶液的体积。待测样本流经电阻抗信号电极对32、信号采集开始电极对33、信号采集结束电极对34后进行血细胞检测。实际中,还包括外接系统,外接系统具体为上位机,电阻抗信号电极对32、信号采集开始电极对33、信号采集结束电极对34均与外接系统电连接,外接系统从电阻抗信号电极对32上采集开始时刻至结束时刻的电阻抗脉冲信号,外接系统根据被测血样处理方法可用于红细胞/血小板组合、白细胞中的一种血细胞进行分类并计数,实现对相应血细胞/血细胞亚群浓度参数的检测。本申请的微流控分析芯片,通过向微流通道内加入待测样本,利用电阻抗信号电极对、信号采集开始电极、信号采集结束电极对,对一定时间内的待测样本的电阻抗脉冲信号进行采集,根据采集的电阻抗脉冲信号实现对待测样本中血细胞进行检测,微流控分析芯片尺寸小,检测所需的样本少,无需单独的废液罐。
在一些实施例中,如图4所示,还包括蛋白检测组件,蛋白检测组件包括位于微流通道2内的检测试纸条4,检测试纸条4至少包括:
结合垫41,其包被有待测蛋白抗体,该抗体带有标记探针;
反应垫42,其位于结合垫41下游,反应垫42上设置有检测线43和质控线44,检测线43包被有待测蛋白不同表位的抗体,质控线44包被有多克隆抗体。
在上述实施例中,检测试纸条4位于微流通道2内且位于血细胞检测组件3下游,具体的,以两个微流通道2进行说明,两个微流通道2之间通过第一微孔31流通,且检测试纸条4位于下方的微流通道2内,流道入口11与上方的微流通道2连通,待测样本经过流道入口11进入上方的微流通道2后再经过第一微孔31此时完成样本中血细胞的检测;然后样本继续流动至下方的微流通道2中的检测试纸条4上进行蛋白检测。反应垫42上可以设置多条检测线43,且检测线43位于质控线44上游,当待测样本中含有一种或多种待检抗原时,抗原与标记探针的待测蛋白抗体结合形成“标记探针-抗体-抗原”复合物;当待测样本流经反应垫42时,结合了抗原的复合物在检测线43位置形成“标记探针-抗体-抗原-抗体”复合物,并固定于检测线位置,形成反应信号;未结合抗原的“标记探针-抗体”复合物在质控线44位置形成“标记探针-抗体-抗抗体复合物”,并固定于质控线位置,形成参比信号,根据反应信号和参比信号,可对待测样本中蛋白进行检测分析。在上述技术方案中,实现了一次加样,同时获取血细胞、蛋白(如六种蛋白CRP、SAA、PCT、HGB、HbA1C、hs-CRP)的检测结果,极大简化了临床炎症感染诊断检测项目操作步骤、降低了样本需求量;同时本申请的微流控分析芯片实现蛋白质分析检测技术与电阻抗技术的结合,提高了操作便利性,对医护人员来说,无需准备不同类别样本(如抗凝血、促凝血),也无需配备多款设备,以达到检测目的,降低了设备购置成本,还可明显降低与之配套的外接系统集成度,液体均被封装于芯片内部,即用即弃,两种技术的结合,同时为开发低故障率、多参数设备奠定了基础。
在一些实施例中,芯片本体1内设置有两个微流通道2,检测试纸条4位于上方的微流通道2内,上方的微流通道2内位于第一微孔31和检测试纸条4之间的区域不连通,芯片本体1内设有连接组件5,连接组件5包括液流信号检测电极51和第二微孔阵列52,第二微孔阵列52设置在两个微流通道2之间并用于连通两个微流通道2,结合垫41的下端面与第二微孔阵列52相贴合,液流信号检测电极51位于下方的微流通道2内且靠近第二微孔阵列52,液流信号检测电极51用于检测待测样本流入检测试纸条4。
上述实施例中,检测试纸条4位于上方的微流通道2内,参考图5所示,上方的微流通道2内设置隔断21用于使微流通道2内位于第一微孔31和检测试纸条4之间的区域不连通,待测样本经流道入口11流入上方的微流通道2经第一微孔31流入下方的微流通道2内再经过第二微孔阵列52流入检测试纸条4的结合垫41下端面,第二微孔阵列52中第二微孔的直径为60~100μm,进而进行待测样本中蛋白检测。同时还在下方的微流通道2内且靠近第二微孔阵列52处设置液流信号检测电极51,待测样本流经液流信号检测电极51后再经过第二微孔阵列52流出,通过液流信号检测电极51可检测待测样本流入检测试纸条4。
在一些实施例中,如图6所示,芯片本体1内设置有三个微流通道2,上方的两个微流通道2之间通过第一微孔31连通即最上方以及中间的两个微流通道2之间通过第一微孔31连通,显然待测样本通过第一微孔31可完成血细胞检测;芯片本体1内位于最下方以及中间的两个微流通道2之间开设有第二微孔阵列52,通过第二微孔阵列52可将最下方以及中间的两个微流通道2进行连通;检测试纸条4位于最下方的微流通道2内,且结合垫41的上端面与第二微孔阵列52相贴合,待测样本流入至中间的微流通道后再经过第二微孔阵列52流入至结合垫41表面,进而进行待测样本中蛋白检测;同时还在中间的微流通道2内且靠近第二微孔阵列52处设置液流信号检测电极51,待测样本流经液流信号检测电极51后再经过第二微孔阵列52流出,通过液流信号检测电极51可检测待测样本流入检测试纸条4。
在一些实施例中,如图7所示,液流信号检测电极51呈圆环状,液流信号检测电极51设置于第二微孔阵列52外周,即第二微孔阵列52设置在液流信号检测电极51的中心孔内。
在一些实施例中,如图8所示,液流信号检测电极51呈长条状,液流信号检测电极51位于第二微孔阵列第二微孔阵列52且靠近血细胞检测组件3一侧。
需要指出的是,本申请的液流信号检测电极51可采用任意形状,只要能实现检测待测样本流入检测试纸条4的功能即可,上述圆环状、长条状仅仅是其中2种优选的形状。
在一些实施例中,芯片本体1内设置有四个微流通道2,参考图9所示,为了便于描述,由上至下分别命名为第一微流通道、第二微流通道、第三微流通道、第四微流通道,其中第一微流通道、第二微流通道之间通过第一微孔31连通,第二微流通道和第四微流通道之间通过第一微孔31连通;而在第三微流通道和第四微流通过之间设置上述的第二微孔阵列52,且检测试纸条4位于第三微流通道内,且结合垫41的下端面与第二微孔阵列52相贴合,在本方案中,待测样本通过第一微孔31进入第二微流通道,然后经过再经过第一微孔31进入第四微流通道,然后经过第二微孔阵列52向上流入至第三微流通道的检测试纸条4上进而对待测样本进行蛋白检测;显然还可在第四微流通道内靠近第二微孔阵列52处同样设置液流信号检测电极51,待测样本流经液流信号检测电极51后再经过第二微孔阵列52流入至第三微流通道的检测试纸条4上,通过液流信号检测电极51可检测待测样本流入检测试纸条4。
在一些实施例中,检测试纸条4还包括样本垫45,样本垫45、结合垫41、反应垫42依次相互搭接,样本垫45的上端面贴合第二微孔阵列52。
在上述实施例中,待测样本流入至样本垫后继续向前流动至结合垫41、反应垫42进而发生反应。
在一些实施例中,请再次参考图4所示,检测试纸条4还包括吸水垫46,吸水垫46位于反应垫42远离结合垫41一侧,吸水垫46与反应垫42相互搭接或一体成型,检测试纸条4所在的微流通道2设有流道出口12,吸水垫46靠近流道出口12。
在上述实施例中,检测试纸条4包括相互搭接的样本垫45、结合垫41、反应垫42和吸水垫46,吸水垫46为吸水纸材质,待测样本依次流经样本垫45、结合垫41、反应垫42和吸水垫46;实际中,当微流控分析芯片工作于正压环境时,流道出口12直接与大气相连;当微流控分析芯片工作于负压环境时,流道出口12连接外部负压动力源。在工作时,待测样本经流道入口11加入至微流通道2内,在外接动力源或微流通道2毛细力的作用下流经血细胞检测组件3完成待测样本中血细胞检测、流经检测试纸条4完成蛋白检测。
在一些实施例中,如图10所示,芯片本体1上对应反应垫42处设有观测窗13。
在上述实施例中,图10显示了另一种方案中上下表面设置的微流通道2、待测样本的流向(图中箭头方向)以及血细胞检测组件3、检测试纸条4的设置位置。具体的,芯片本体1呈扁平层状立体结构,芯片本体1可采用透明材质制作而成,例如可采用聚甲基丙烯酸甲酯制作而成,透明材质的芯片本体1即可实现观测待测样本在检测线43位置形成的复合物以及质控线44位置形成的复合物。
在一些实施例中,待测蛋白包括CRP、SAA、PCT、HGB、hs-CRP、HbA1C中的至少一种;标记探针包括胶体金、荧光微球、量子点、有机纳米粒子、纳米磁性材料、镧系元素中的一种,优选的,标记探针为量子点。
基于同一发明构思,本申请还提供了一种样本检测方法,采用上述的微流控分析芯片进行检测,检测方法具体包括:
待测样本经流道入口进入微流通道;
当待测样本流到信号采集开始电极对,外接系统开始通过电阻抗信号电极对采集血细胞的电阻抗脉冲信号,当待测样本流到信号采集结束电极对时,外接系统停止采集电阻抗脉冲信号,外接系统根据采集到的电阻抗脉冲信号对待测样本进行分析;
当所述微流控分析芯片包括蛋白检测组件时,所述检测方法还包括:
当待测样本流入至检测线和质控线时,待测样本发生反应,外接系统根据检测线、质控线所生成的信号对待测样本进行分析。
在一些实施例中,若微流控分析芯片包括液流信号检测电极和第二微孔阵列,则检测方法包括:待测样本流经信号采集结束电极对后,经液流信号检测电极、第二微孔阵列流入至结合垫、反应垫,待测样本发生反应,根据检测线和质控线的反应生成物对待测样本进行分析。
具体的,如图11所示,本申请的微流控分析芯片进行检测时的工作时序图。t0时刻,待测样本加注到流道入口,外接动力源开始工作(高电平),或毛细力开始作用,或外接动力源与毛细力共同作用;t1时刻,待测样本流到达信号采集开始电极(低电平),与微流控分析芯片相连的外接系统开始电阻抗信号的采集;t2时刻,待测样本流到达信号采集结束电极(低电平),与微流控分析芯片相连的外接系统结束电阻抗信号的采集;t3时刻,待测样本全部流过信号采集结束电极,外接动力源停止工作(低电平)。随后,等待T分钟,待测样本流全部到达吸水垫,与微流控分析芯片相连的外接系统利用观测窗对检测线、质控线位置处生成的信号进行检测。需要指出的是,在上述工作时序过程中,由于微流控分析芯片不含有液流信号检测电极,此时,信号采集结束电极同时兼顾液流信号检测电极功能,即信号采集结束电极用于检测待测样本的流动。
本申请的微流控分析芯片进行检测时另一种工作时序图,如图12所示。t0时刻,待测样本加注到流道入口1,外接动力源开始工作(高电平),或毛细力开始作用,或外接动力源与毛细力共同作用;t1时刻,待测样本流到达信号采集开始电极(低电平),与微流控分析芯片相连的外接系统开始电阻抗信号的采集;t2时刻,待测样本流到达信号采集结束电极(低电平),与血细胞分析芯片相连的外接系统结束电阻抗信号的采集;t3时刻,待测样本流到达液流信号检测电极,液流信号检测电极转低电平;t4时刻,待测样本流全部流过液流信号检测电极,液流信号检测电极转高电平,外接动力源停止工作(低电平);随后,等待T分钟,待测样本流全部到达吸水垫,与微流控分析芯片相连的外接系统利用观测窗对检测线、质控线位置处生成的信号进行检测。检测结束后,与微流控分析芯片相连的外接系统根据采集到的电阻抗脉冲信号、检测线、质控线位置处的信号强弱,分别计算待测血细胞/血细胞亚群、待测蛋白的浓度参数,并输出检测报告,实现一次加样,同时报告待测血细胞、待测蛋白等临床炎症感染诊断所需的生物标志物检测结果,极大简化了临床炎症感染检测操作步骤。
以上所述仅为本发明的较佳实施方式而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 一种微流控分析芯片、样本检测方法
- 一种基于微流控芯片技术的样本分析试剂盒
