一种基于医学图像的器官分割建模方法及终端
文献发布时间:2024-04-18 19:58:53
技术领域
本发明涉及医学图像处理的技术领域,特别涉及一种基于医学图像的器官分割建模方法及终端。
背景技术
随着人工智能的飞速发展,目前应用于医学图像自动分割的软件不断涌现,当前应用广泛的软件包括3D slicer、ITK-SNAP等。这些软件背后所依赖的自动分割算法主要包括传统算法如基于阈值、区域生长、水平集方法、活动轮廓模型等,以及深度学习算法如U-Net、CNN等。
目前的现有技术公开了采用边缘感知算法针对腹部计算机断层扫描图像进行多器官的分割建模的方法。此方法中构建了腹部多器官分割网络,该网络主要包括体素分割模块、边缘感知模块和融合模块。通过训练集中的腹部CT图像对该网络进行训练,从而得到腹部多器官分割模型。但是,上述分割方法仅适用于CT图像的腹部脏器,对其他器官或病变的适用性较差。对于那些可以广泛适应各种器官组织的自动分割算法,大多数场景下的实际分割效果并不理想,导致其在实际应用中效益有限。
并且,传统自动分割算法对种子点、边界和阈值的选择非常敏感。为了得到较为准确的结果,可能需要人为设定多个边界点或在自动分割后进行大量的修正,这在操作上甚至可能超越直接手动分割的复杂度。至于深度学习算法,它们要求有大量标注的训练集数据,这不仅增加了工作量,而且需要较高的计算能力。
同时,现有的传统自动分割算法很难完全满足医学分割的需求。这些算法容易受到图像噪声的影响,且在目标与背景强度分布有重叠的情况下,其分割效果通常不尽如人意。由于医学图像的特性,脏器间的密度往往相似或有重叠,导致分割难以达到理想状态。尽管深度学习算法在特定场景中相较于传统算法表现更佳,但在处理生理变异或少见的病变和异常组织时,仍然面临较大的挑战。
发明内容
本发明所要解决的技术问题是:提供一种基于医学图像的器官分割建模方法及终端,能够对多种医学图像中的器官进行分割建模的同时,保证分割的准确度。
为了解决上述技术问题,本发明采用的技术方案为:
一种基于医学图像的器官分割建模方法,包括步骤:
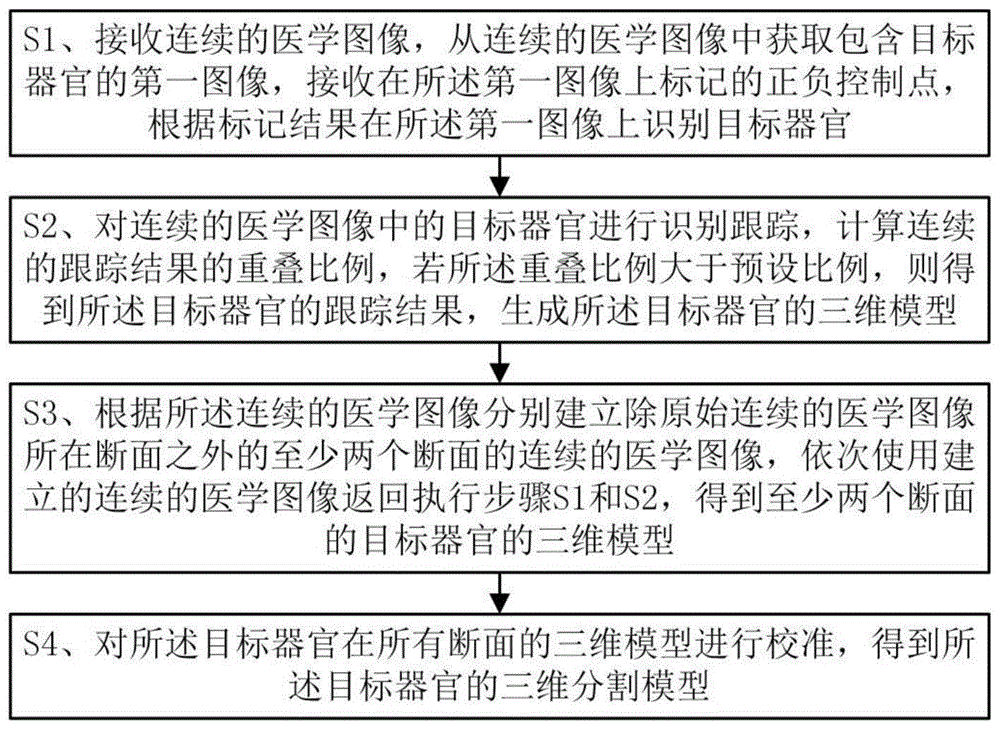
S1、接收连续的医学图像,从连续的医学图像中获取包含目标器官的第一图像,接收在所述第一图像上标记的正负控制点,根据标记结果在所述第一图像上识别目标器官;
S2、对连续的医学图像中的目标器官进行识别跟踪,计算连续的跟踪结果的重叠比例,若所述重叠比例大于预设比例,则得到所述目标器官的跟踪结果,生成所述目标器官的三维模型;
S3、根据所述连续的医学图像分别建立除原始连续的医学图像所在断面之外的至少两个断面的连续的医学图像,依次使用建立的连续的医学图像返回执行步骤S1和S2,得到至少两个断面的目标器官的三维模型;
S4、对所述目标器官在所有断面的三维模型进行校准,得到所述目标器官的三维分割模型。
为了解决上述技术问题,本发明采用的另一种技术方案为:
一种基于医学图像的器官分割建模终端,包括存储器、处理器以及存储在所述存储器上并可在处理器上运行的计算机程序,所述处理器执行所述计算机程序时实现以下步骤:
S1、接收连续的医学图像,从连续的医学图像中获取包含目标器官的第一图像,接收在所述第一图像上标记的正负控制点,根据标记结果在所述第一图像上识别目标器官;
S2、对连续的医学图像中的目标器官进行识别跟踪,计算连续的跟踪结果的重叠比例,若所述重叠比例大于预设比例,则得到所述目标器官的跟踪结果,生成所述目标器官的三维模型;
S3、根据所述连续的医学图像分别建立除原始连续的医学图像所在断面之外的至少两个断面的连续的医学图像,依次使用建立的连续的医学图像返回执行步骤S1和S2,得到至少两个断面的目标器官的三维模型;
S4、对所述目标器官在所有断面的三维模型进行校准,得到所述目标器官的三维分割模型。
本发明的有益效果在于:接收输入的连续的医学图像,从连续的医学图像中获取包含目标器官的第一图像,接收第一图像上标记的正负控制点,根据标记结果在所述第一图像上进行目标器官的自动识别,基于识别到的器官区域,对该连续的序列影像进行器官的连续追踪,进而完成整个器官的自动识别,生成器官基于原始断面连续图像上的三维模型,根据输入的连续的医学图像至少建立另外两个断面的连续的医学图像,再对其他断面的连续的医学图像进行器官的识别与建模。最后基于所有断面的模型进行校准得到所述目标器官的三维分割模型,确保得到精确的器官分割结果。因此,本发明可以适配多种医学图像,适用于多种扫描部位,同时目标器官的勾画只需在对应部位标注少量的控制点即可实现,结合连续的医学图像进行识别跟踪,进一步保证分割的准确度。
附图说明
图1为本发明实施例的一种基于医学图像的器官分割建模方法的流程图;
图2为本发明实施例的一种基于医学图像的器官分割建模终端的示意图;
图3为本发明实施例中医学图像目标器官三维模型构建流程图。
标号说明:
1、一种基于医学图像的器官分割建模终端;2、存储器;3、处理器。
具体实施方式
为详细说明本发明的技术内容、所实现目的及效果,以下结合实施方式并配合附图予以说明。
请参照图1,本发明实施例提供了一种基于医学图像的器官分割建模方法,包括步骤:
S1、接收连续的医学图像,从连续的医学图像中获取包含目标器官的第一图像,接收在所述第一图像上标记的正负控制点,根据标记结果在所述第一图像上识别目标器官;
S2、对连续的医学图像中的目标器官进行识别跟踪,计算连续的跟踪结果的重叠比例,若所述重叠比例大于预设比例,则得到所述目标器官的跟踪结果,生成所述目标器官的三维模型;
S3、根据所述连续的医学图像分别建立除原始连续的医学图像所在断面之外的至少两个断面的连续的医学图像,依次使用建立的连续的医学图像返回执行步骤S1和S2,得到至少两个断面的目标器官的三维模型;
S4、对所述目标器官在所有断面的三维模型进行校准,得到所述目标器官的三维分割模型。
从上述描述可知,本发明的有益效果在于:接收输入的连续的医学图像,从连续的医学图像中获取包含目标器官的第一图像,接收第一图像上标记的正负控制点,根据标记结果在所述第一图像上进行目标器官的自动识别,基于识别到的器官区域,对该断面中连续的序列影像进行器官的连续追踪,进而完成整个器官的自动识别,生成器官在基于原始断面连续图像上的三维模型,根据输入的连续的医学图像至少建立另外两个断面的连续的医学图像,再对其他断面的连续的医学图像进行器官的识别与建模。最后基于所有断面的模型进行校准得到所述目标器官的三维分割模型,确保得到精确的器官分割结果。因此,本发明可以适配多种医学图像,适用于多种扫描部位,同时目标器官的勾画只需在对应部位标注少量的控制点即可实现,结合连续的医学图像进行识别跟踪,进一步保证分割的准确度。
进一步地,所述接收在所述第一图像上标记的正负控制点,根据标记结果依次在所述第一图像上识别目标器官包括:
从所述第一图像中提取图像特征信息,基于所述图像特征信息构建所述第一图像的预测器;
接收对所述第一图像中的目标器官标记的正负控制点,将所述正负控制点输入所述预测器,识别得到所述第一图像中目标器官的图像分割结果。
由上述描述可知,对操作者而言,目标器官的勾画只需在对应部位标注少量的控制点;去除非目标组织也仅需将正向标记调整为反向标记,并进行相应的控制点操作。
进一步地,所述对连续的医学图像的目标器官进行识别跟踪包括:
构建包含所述第一图像及所述第一图像之后的图像的第一图像序列,以及包含所述第一图像及所述第一图像之前的图像的第二图像序列;
根据所述第一图像中目标器官的图像分割结果进行第一图像序列和第二图像序列中目标器官的识别跟踪,得到初始跟踪结果。
由上述描述可知,对目标器官区域上、下连续的序列影像进行器官的连续追踪,能够完成整个器官的自动识别。
进一步地,所述计算连续的跟踪结果的重叠比例,若所述重叠比例大于预设比例,则得到所述目标器官的跟踪结果包括:
在图像序列中从第一图像开始计算当前图像的跟踪结果与下一图像的初始跟踪结果的重叠比例,若所述重叠比例大于或者等于预设比例,则存储下一图像的初始跟踪结果,并将下一图像作为当前图像,进行重叠比例的计算,直至图像序列中的所有图像均完成重叠比例的计算;
若所述重叠比例小于预设比例,则认为下一图像中不存在目标器官,结束器官分割。
由上述描述可知,对连续的跟踪结果进行校核,其操作逻辑简单易理解,算力需求不高,且勾画效率显著,排除多个非连续区域出现的器官“漂移”的情况。
进一步地,对所述目标器官在所有断面的三维模型进行校准,得到所述目标器官的三维分割模型包括:
将所述目标器官在所有断面的三维模型转换到相同的坐标系,并计算所有断面的三维模型的交集,根据交集结果得到所述目标器官的三维分割模型。
由上述描述可知,结合横断面、矢状面、冠状面进行器官边界的识别,可以优势互补,提高器官分割的准确性。
请参照图2,本发明另一实施例提供了一种基于医学图像的器官分割建模终端,包括存储器、处理器以及存储在所述存储器上并可在处理器上运行的计算机程序,所述处理器执行所述计算机程序时实现上述的一种基于医学图像的器官分割建模方法的各个步骤。
本发明上述的一种基于医学图像的器官分割建模方法及终端,适配多种医学图像,适用于多种扫描部位,同时还能够保证分割的准确度。以下通过具体的实施方式进行说明:
实施例一
请参照图1和图3,一种基于医学图像的器官分割建模方法,其特征在于,包括步骤:
S1、接收连续的医学图像,从连续的医学图像中获取包含目标器官的第一图像,接收在所述第一图像上标记的正负控制点,根据标记结果在所述第一图像上识别目标器官。
S11、接收输入的DICOM格式的医学图像序列,该医学图像序列工包含n张医学图像,选取其中任意一张包含所需目标器官的图像,设为第i张图像,其图像表示为I
S12、从所述第一图像中提取图像特征信息,基于所述图像特征信息构建所述第一图像的预测器。
在本实施例中,为进行图像的自动分割勾画,采用SAM模型(Segment AnythingModel)进行图像解析。在识别过程中,首先应用SAM模型对图像I
在识别算法开始时,加载图像I
S13、接收对所述第一图像中的目标器官标记的正负控制点,将所述正负控制点输入所述预测器,识别得到所述第一图像中目标器官的图像分割结果。
具体的,基于图像I
在识别算法的预测阶段,将图像的控制点p
S2、对连续的医学图像中的目标器官进行识别跟踪,计算连续的跟踪结果的重叠比例,若所述重叠比例大于预设比例,则得到所述目标器官的跟踪结果,生成所述目标器官的三维模型。
本实施例中,依据单个断面图像的器官分割结果,对多层连续图像序列进行器官识别追踪,以获得连续图像中对同一器官的三维勾画分割。其具体思路是将连续滚动的医学图像视为一个连续的视频,以勾画的目标器官ROI作为视频中的某一物体,追踪上、下滚动图像时与其联动相关的组织,即将“视频追踪物体”的概念类推于此以达到自动勾画出整个序列图像中的目标组织三维结构的目的。
具体的,采用XMem模型(Long-Term Video Object Segmentation with anAtkinson-Shiffrin Memory Model)进行连续器官的识别追踪,在第一步自动分割出目标器官ROI的基础上,进行上、下连续图像的该器官区域追踪识别,从而获得目标器官的三维分割模型。具体分为以下步骤:
S21、构建包含所述第一图像及所述第一图像之后的图像的第一图像序列,以及包含所述第一图像及所述第一图像之前的图像的第二图像序列。
在图像I
S22、根据所述第一图像中目标器官的图像分割结果进行第一图像序列和第二图像序列中目标器官的识别跟踪,得到初始跟踪结果。
具体的,以图像序列S
S23、在图像序列中从第一图像开始计算当前图像的跟踪结果与下一图像的初始跟踪结果的重叠比例,若所述重叠比例大于或者等于预设比例,则存储下一图像的初始跟踪结果,并将下一图像作为当前图像,进行重叠比例的计算,直至图像序列中的所有图像均完成重叠比例的计算;若所述重叠比例小于预设比例,则认为下一图像中不存在目标器官,结束器官分割。
由于连续视频追踪主要思路是追踪物体的相似性,某一帧图像中的特定物体与其相连续帧中,物体可能有较大的位移、重叠部分较少。而医学图像连续层面中,每种器官上、下层面的器官具有较大重叠区域,如果单纯引用“物体相似性”可能会将并不相连续的其他相似性的器官勾画,就会造成较大的误差。
因此,在本实施例中,对结果M’
其中,Area(X)代表X的面积。
在校核过程中,首先需要排除多个非连续区域出现的“漂移”情况,即算法输出的M’
排除过程如下:假设M’
上述算法流程即实现了图像序列S
S3、根据所述连续的医学图像分别建立除原始连续的医学图像所在断面之外的至少两个断面的连续的医学图像,依次使用建立的连续的医学图像返回执行步骤S1和S2,得到至少两个断面的目标器官的三维模型。
具体的,医学图像的断面可以包括横断面、矢状面和冠状面,在本实施例中,原始连续的医学图像可以为从横断面获取的医学图像,之后基于原始连续的医学图像分别建立矢状面和上的连续的医学图像,都采用步骤S1和S2的过程进行三维勾画,继而得出同一个器官在三个断面下的三维模型。
S4、对所述目标器官在所有断面的三维模型进行校准,得到所述目标器官的三维分割模型。
其中,步骤S4包括:
将所述目标器官在所有断面的三维模型转换到相同的坐标系,并计算所有断面的三维模型的交集,根据交集结果得到所述目标器官的三维分割模型。
在本实施例中,医学图像所分析的影像为横断面、矢状面、冠状面中的任意一种,分别能够对应三维空间中的x,y,z三个平面。而基于单一维度的医学影像,可以构建出另外两个断面的图像用于校核。由于医学图像是灰度图像,器官与器官之间排列紧密,一些器官与器官之间的密度/信号相近,往往在某些断面上没有明显的界面,其边界难以准确识别。而本实施例中能够发现在不同方位观察器官与其他组织的界面存在差异,例如某些在横断面中难以区分的器官边界,在矢状面、冠状面中边界识别更为容易,即可达到各断面的识别优势互补的效果。
由此本实施例中将单一维度的图像重建出另外两个维度的图像,获得横断面、矢状面、冠状面的医学影像。在三个面中,分别根据步骤S1、S2进行目标器官的自动识别勾画器官,得到图像追踪结果。横断面、矢状面、冠状面的追踪结果分别表示为R
因此,本实施例中的器官分割建模方法,相对于过去那些泛化性能强但准确度不高或准确度高但泛化性能有限的算法,本实施例引入了SAM算法及视频连续追踪XMem算法,并结合医学图像框架,将视频追踪用于医学连续图像的自动分割。基于大数据的深度学习模型,它显著地增强了模型的泛化性能,使其同时具备出色的泛化性和准确度。
并且,采用本方法勾画目标器官所需输入条件简单,仅需要在解析图像后通过控制点标记的形式即可快速自动准确识别勾画目标区域,此方法避免了手动确定器官边界或设置阈值以防止区域外溢,且不需要依赖大量的训练集数据进行标注和学习。
同时,结合识别结果的重叠比例进一步提出了一个多维度矫正体系。这不仅保持了原有的高准确度,而且通过进一步的边界修正,显著提高了在存在边界重叠问题的器官自动分割的准确性。
实施例二
请参照图2,一种基于医学图像的器官分割建模终端1,包括存储器2、处理器3以及存储在所述存储器2上并可在处理器3上运行的计算机程序,所述处理器3执行所述计算机程序时实现实施例一的一种基于医学图像的器官分割建模方法的各个步骤。
综上所述,本发明提供的一种基于医学图像的器官分割建模方法及终端,接收输入的连续的医学图像,从连续的医学图像中获取包含目标器官的第一图像,接收第一图像上标记的正负控制点,根据标记结果在所述第一图像上进行目标器官的自动识别,基于识别到的器官区域,对该断面中连续的序列影像进行器官的连续追踪,进而完成整个器官的自动识别,生成器官在基于原始断面连续图像上的三维模型,根据输入的连续的医学图像至少建立另外两个断面的连续的医学图像,再对其他断面的连续的医学图像进行器官的识别与建模。最后基于所有断面的模型进行校准得到所述目标器官的三维分割模型,确保得到精确的器官分割结果。因此,本发明可以适配多种医学图像,适用于多种扫描部位,同时目标器官的勾画只需在对应部位标注少量的控制点即可实现,结合连续的医学图像进行识别跟踪,进一步保证分割的准确度。
以上所述仅为本发明的实施例,并非因此限制本发明的专利范围,凡是利用本发明说明书及附图内容所作的等同变换,或直接或间接运用在相关的技术领域,均同理包括在本发明的专利保护范围内。
- 用于在医学图像数据中分割检查对象的器官结构的方法
- 一种基于两步纳什均衡改进C-V模型的医学图像分割方法
- 一种基于人工智能的医学图像分割方法及系统
- 基于边缘感知的腹部多器官分割建模、分割方法及系统
- 基于医学组织器官自身特性的模糊聚类医学图像分割方法
