一种基于结构色水凝胶的心脏纤维化芯片及其制备方法和应用
文献发布时间:2024-04-18 20:01:30
技术领域
本发明涉及器官芯片领域,具体涉及一种基于结构色水凝胶的心脏纤维化芯片及其制备方法和应用。
背景技术
心脏纤维化是一个严重的世界性健康问题,因为它在多种形式的心脏病中普遍存在,并且与心力衰竭有着重要联系。为了探索心脏纤维化疗法,人们致力于开发准确的模型来研究潜在的治疗机制。然而,传统的体外模型是基于过于简单的细胞外微环境,无法再现纤维化心脏内的复杂生理和结构特征,静态生长条件可能会限制心脏结构和功能的维持,并进一步影响药物评估的准确性。而动物模型中参与纤维化激活的分子途径的数量较多且较复杂,严重限制了对心脏纤维化机制的了解。
器官芯片具有类似于器官的成分和细胞功能特征,已成为生物医学领域的一种有前途的工具。在纤维化发展过程中,心脏的收缩和舒张功能是评估纤维化进展的重要指标,然而传统的纤维化模型通常依赖于复杂的检测设备和昂贵的检测试剂,检测时间较长,缺乏直观性。
发明内容
为了解决传统体外模型缺乏对体内细胞环境的复刻、检测系统复杂繁琐的问题,本发明提供了一种基于结构色水凝胶的心脏纤维化芯片及其制备方法和应用,通过水凝胶发生形变后的结构色变化来评估纤维化进展。
本发明是通过以下技术方案实现的:
一种基于结构色水凝胶的心脏纤维化芯片的制备方法,制备微流控芯片和具有微纳拓扑形貌的结构色水凝胶,将结构色水凝胶嵌入微流控芯片中,然后注入心脏细胞、培养基和诱导因子,构建心脏纤维化芯片,具体包括以下步骤:
步骤(1):使二氧化硅胶体粒子分散液进行胶体自组装,得到光子晶体模板;制备表面具有沟槽结构的沟槽模板;
步骤(2):将水凝胶前聚液注入到光子晶体模板与沟槽模板之间,固化;剥离沟槽模板、去除光子晶体模板,获得具有微纳拓扑形貌的结构色水凝胶;所述的结构色水凝胶一面为沟槽结构、另一面为纳米孔洞;
步骤(3):将步骤(2)的结构色水凝胶嵌入微流控芯片中,搭建微流控系统;所述的微流控芯片具有微腔以及其两端的进液通道、出液通道,结构色水凝胶嵌入微腔中,沟槽结构面向上;
步骤(4):将心脏细胞培养基分散液注入含结构色水凝胶的微流控芯片内,获得心脏芯片;
步骤(5):在心脏芯片中注入诱导因子,刺激细胞纤维化,构建心脏纤维化芯片。
为优化上述技术方案,采取的具体措施/限定还包括:
步骤(1)中,采用具有沟槽结构的硅片模板制备沟槽模板,其中沟槽结构的加工间距为5-100nm。
进一步地,微流控芯片具有顶板、底板,所述的底板具有进液口、微腔、出液口,进液口连接若干分支通道后连至微腔,微腔连至出液口;所述的顶板具有进液孔、出液孔;顶板上的进液孔与底板上的进液口连通组成进液通道,顶板上的出液孔与底板上的出液口连通组成出液通道。
优选地,微流控芯片的顶板下表面设有一排用于固定结构色水凝胶的微柱。
优选地,结构色水凝胶靠近出液通道的侧边切割成锯齿状图案,再嵌入到微腔中。
优选地,一个微流控芯片具有两个微腔、两个进液通道和一个出液通道,两个微腔的一端分别各连接一个进液通道,另一端共同连至一个出液通道,两个微腔分别作为正常微腔和纤维化微腔的对比。
步骤(4)中,所述的心脏细胞培养基分散液为心肌细胞和成纤维细胞的培养基混合分散液,心肌细胞和成纤维细胞的数量比例为1:1-5:1,其中成纤维细胞提前用诱导因子刺激。
步骤(4)中,所述的培养基为含有10%胎牛血清、1%双抗的DMEM/F12培养基。
步骤(5)中,所述的诱导因子为TGF-β、Ang-II中的一种或两种的混合。
本发明还保护上述方法制备的基于结构色水凝胶的心脏纤维化芯片。
本发明还保护上述的心脏纤维化芯片在细胞纤维化传感分析或心脏纤维化药物筛选中的应用。
与现有技术相比,本发明的有益效果是:
本发明利用结构色材料操纵光子在其光子带隙中的传播导致结构色可调节的原理,将结构色水凝胶嵌入心脏芯片中以感知和响应心脏细胞的收缩和舒张,直观展示纤维化模型的发展进度,有效地再现纤维化的特征。
本发明中,微纳拓扑形貌的结构色水凝胶一面为沟槽结构、另一面为周期性的纳米孔洞,沟槽结构诱导细胞沿沟槽方向发生定向生长,可以仿生心脏内部结构;纳米孔洞是基于光子晶体结构的光学特性,具有周期性纳米孔洞结构的水凝胶具有特定的光学特征,当内部孔洞发生变形,会展现出肉眼可见的颜色变化,因此通过在水凝胶上种植细胞,当细胞发生收缩时带动水凝胶中的孔洞发生形状变化,通过观察颜色和检测光谱可以表征细胞微弱的收缩力。
本发明基于疾病模型评估抗纤维化药物的治疗效果,通过检测结构色水凝胶的结构色和光谱变化评估心脏细胞的搏动状况,实现纤维化发展进程的传感分析,能够用于纤维化药物的筛选和评估。
本发明的心脏纤维化芯片基于定制化微流体系统,取代传统体外模型,是具有连续提供营养和及时清除废物的理想解决方案。该芯片可应用于纤维化药物的筛选和评估,具有直观性、高效性。
附图说明
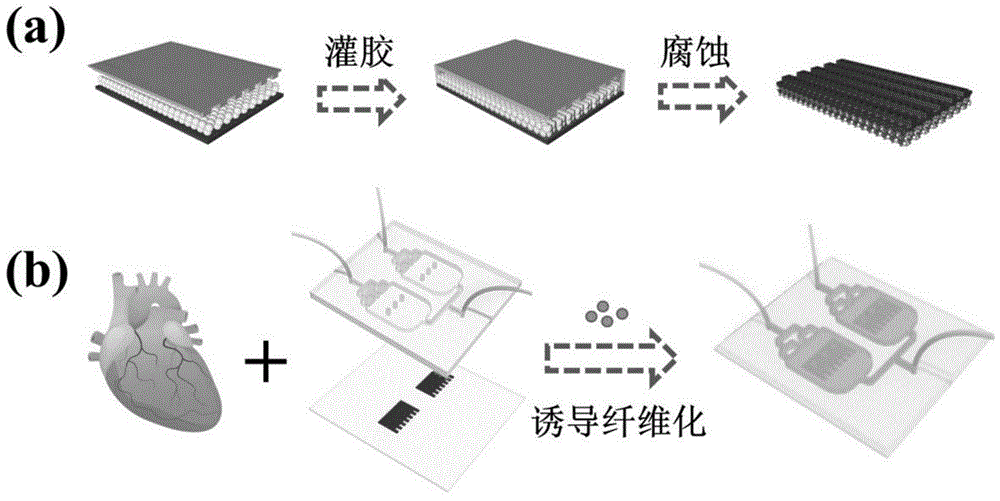
图1:本发明基于结构色水凝胶的心脏纤维化芯片的制备流程图,其中(a)为结构色水凝胶的制备流程,(b)为将结构色水凝胶整合到微流控芯片中,并引入心脏细胞和诱导因子,制备心脏纤维化芯片。
图2:本发明的结构色水凝胶的扫描电镜图,其中(a)为结构色水凝胶的截面整体结构,(b)为结构色水凝胶的顶部图,(c)为结构色水凝胶的底部图。
图3:本发明的心脏纤维化芯片的纤维化表征,其中(a)为正常样本和纤维化样本的α-辅肌动蛋白(α-actinin)和间隙连接蛋白43(CX-43)的表达,(b)、(c)分别为正常样本和纤维化样本的α-肌动蛋白(α-SMA)和I型胶原(Col I)的表达,(d)为正常样本和纤维化样本的I型胶原和III型胶原的比例。
图4:本发明的心脏纤维化芯片的自报告功能,其中(a)为正常样本和纤维化样本的结构色变化,(b)、(c)分别为正常样本和纤维化样本的光谱变化。
图5:本发明的心脏纤维化芯片的药物评估功能,其中(a)、(b)为对照组和治疗组中纤维化相关标志物的免疫荧光染色和荧光定量PCR检测,(c)分别为正常样本和纤维化样本的光谱变化,(d)分别为正常样本和纤维化样本的结构色变化。
具体实施方式
以下结合具体实施例对上述方案做进一步说明。应理解,这些实施例是用于说明本发明而不限于限制本发明的范围。凡根据本发明精神实质所做的等效变换或修饰,都应涵盖在本发明的保护范围之内。实施例中未注明的实施条件通常为常规实验中的条件。
本发明中微纳拓扑形貌的结构色水凝胶一面为沟槽结构、另一面为纳米孔洞,微纳拓扑形貌是沟槽结构和纳米孔洞的合称,具体地,沟槽结构为微米级、纳米孔洞为纳米级。
本发明中固化后去除模板的方式为:一面的沟槽模板为剥离除去,另一面的光子晶体模板采用腐蚀法去除,如利用氢氧化钠溶液或氢氟酸去除光子晶体模板的二氧化硅粒子。
本发明中采用的水凝胶前聚液为明胶、基底胶、壳聚糖、丙烯酰胺、甲基丙烯酰化透明质酸、甲基丙烯酰化明胶中的一种或多种的混合。
本发明中的固化方式为热固法、化学交联法或紫外光固化法。
本发明中的进液通道、出液通道用于注入细胞、药物、培养基等,流出培养基或细胞代谢废物等。
本发明中结构色水凝胶嵌入微腔中时采用沟槽结构朝上、纳米孔洞在下的方式,当通过微流控系统加入细胞时,细胞可以附着在沟槽结构表面,从而被定向诱导,因水凝胶透光率较高,纳米孔洞赋予的结构色即使在背面也可以被清晰的检测和观察到。
在一个优选的实施方式中,结构色水凝胶靠近出液通道的侧边切割成锯齿状图案,再嵌入到微腔中,通过将水凝胶切割成锯齿形状,可实现同微腔内的样品丰富性,增加了小尺寸微腔的样品数量,增强观测性,同时还能节约试剂和芯片。
在一个优选的实施方式中,一个微流控芯片具有两个微腔、两个进液通道和一个出液通道,两个微腔一端分别连接一个进液通道,另一端共同连至一个出液通道,两个微腔分别为正常微腔和纤维化微腔,各嵌入一块结构色水凝胶后,可以保证两组样品的温度、环境条件一致,可以实时在同一个芯片同时观察两组样本的纤维化进展。
本发明中的心脏细胞来自鼠源或人源。
在本发明的实施方式中,培养基采用含有10%胎牛血清、1%双抗的DMEM/F12培养基。
在本发明的实施方式中,在向芯片中添加细胞前首先在芯片中注入培养基浸润芯片,然后将分散有细胞的培养基注入芯片中。
以下结合具体实施例对本发明做进一步的详细说明:
实施例1一种结构色聚丙烯酰胺复合水凝胶的制备
(1)模板的制备
配置二氧化硅纳米粒子酒精分散液(1wt%)注入开口玻璃瓶中,瓶内插入干净玻璃片,经2天的胶体粒子自组装后在玻璃片上获得光子晶体模板;
聚二甲基硅氧烷单体和固化剂(9:1)混合后抽真空,然后将混合物浇在具有沟槽结构的定制硅片上,经60℃固化过夜后将聚二甲基硅氧烷沟槽模板从硅片上剥离获得。
(2)基于结构色水凝胶的制备
将丙烯酰胺(0.15g/mL)和基底胶(5mg/mL)的预聚液注入到聚二甲基硅氧烷沟槽模板和光子晶体模板之间,通过紫外固化,将固化水凝胶从聚二甲基硅氧烷沟槽模板上剥离后腐蚀二氧化硅粒子,最终获得具有表面沟槽形貌和底面周期性孔洞形貌的结构色水凝胶。
实施例2一种基于结构色甲基丙烯酰化明胶的心脏纤维化芯片的制备
(1)模板的制备
配置二氧化硅纳米粒子酒精分散液(1wt%)注入开口玻璃瓶中,瓶内插入干净玻璃片,经2天的胶体粒子自组装后在玻璃片上获得光子晶体模板;聚二甲基硅氧烷单体和固化剂(9:1)混合后抽真空,然后将混合物浇在具有沟槽结构的定制硅片上,经60℃固化过夜后将聚二甲基硅氧烷沟槽模板从硅片上剥离获得。
(2)基于结构色水凝胶的制备
将甲基丙烯酰化明胶的预聚液注入到聚二甲基硅氧烷沟槽模板和光子晶体模板之间,通过紫外固化,将固化水凝胶从聚二甲基硅氧烷沟槽模板上剥离后腐蚀二氧化硅粒子,最终获得具有表面沟槽形貌和底面周期性孔洞形貌的结构色水凝胶,电镜图如图2所示。
(3)心脏纤维化芯片的制备
首先将聚二甲基硅氧烷单体和固化剂(9:1)混合并抽真空,然后将混合物分别浇在具有微柱结构的定制聚甲基丙烯酸甲酯模板及具有交错通道和单独腔室的定制聚甲基丙烯酸甲酯模板上,继续抽真空并置于烘箱中固化脱模,分别得到芯片的顶板和底板。
将结构色水凝胶切割成锯齿状图案,嵌入到芯片底板的微腔中;将芯片顶板和底板做等离子体处理后贴紧使其发生键合,连接微流控系统;将多能干细胞来源的心肌细胞和人心脏成纤维细胞比例为4:1的培养基分散液经微流控系统注入芯片中,并补充10nMTGF-β1;其中纤维化组的人心脏成纤维细胞提前用10nM的TGF-β1刺激48小时,每次更换培养基时补充10nM TGF-β1。
如图2所示,芯片左侧有两个入口对应两个微腔,一侧微腔中注入心脏细胞分散液和培养基,为正常组;另一侧微腔中注入心脏细胞分散液、培养基以及诱导因子,形成诱导因子刺激后的纤维化细胞,为纤维化组。
(4)基于结构色甲基丙烯酰化明胶的心脏纤维化芯片对纤维化进展的报告
通过分子生物学手段检测两组(正常组、纤维化组)样本的纤维化程度,如图3所示;结构色水凝胶的周期性孔洞会随着心肌细胞的搏动和心脏成纤维细胞的收缩产生体积和形状的变化,根据布拉格衍射公式λ=2d sinθ(d为孔洞的直径,θ为布拉格掠射角),当结构色水凝胶的体积和角度发生变化时,d值和θ也会发生变化,因此,结构色水凝胶的特征反射峰也会发生变化;通过光纤光谱仪和光学显微镜检测心脏纤维化芯片中结构色水凝胶的特征反射峰和结构色,分析心脏的收缩和舒张功能,实现直观的纤维化进展,如图4所示。
实施例3一种基于结构色甲基丙烯酰化明胶的心脏纤维化芯片在药物筛选中的应用
将实施例2制得的结构色水凝胶切割成锯齿状图案,嵌入到芯片的微腔中;将结构色水凝胶将芯片顶板和底板做等离子体处理后贴紧使其发生键合,连接微流控系统;将提取的小鼠心脏成纤维细胞提前用10nM的TGF-β1刺激48小时,然后将小鼠心肌细胞和心脏成纤维细胞比例为3:1的培养基分散液经微流控系统注入芯片中,并补充10nM TGF-β1,置于培养箱中培养4天。
分别将常规培养基和提取的间充质干细胞来源的外泌体注入到心脏纤维化芯片的对照组微腔和治疗组微腔中,通过分子生物学手段检测纤维化的标志物表达情况,如图5所示,通过荧光定量PCR和免疫荧光染色对治疗组和对照组中纤维化相关标志物的表达情况进行评估,相关标志物的表达降低验证了外泌体的治疗效果;与此同时,利用光谱仪检测结构色水凝胶的结构色和光谱变化,由结果分析可知,治疗组的被动力减小、收缩幅度有一定的恢复,证明了此心脏纤维化芯片在抗纤维化药物筛选中的应用前景。
本发明使心脏细胞与微流控芯片结合,基于微流控芯片实现了体外心脏模型的微型化、集成化,以及培养基等试剂的低消耗,微流控芯片具有强大的液体操纵和区室化,可以实现心脏细胞生长环境的精确控制,包括ECM(细胞外基质)组成、药物浓度、氧气水平等,通过区室化可以实现多细胞共培养,有利于多组分心脏的体外复现,微流控系统还可以及时提供新鲜培养基并排掉代谢废物,有利于心脏细胞的生长。
以上所述,仅是本发明的较佳实施例,并非对本发明作任何形式上的限制,任何熟悉本专业的技术人员,在不脱离本发明技术方案范围内,依据本发明的技术实质,对以上实施例所作的任何简单的修改、等同替换与改进等,均仍属于本发明技术方案的保护范围之内。
