同时检测全长与截短的HBV pgRNA荧光定量PCR试剂盒及其应用
文献发布时间:2023-06-19 10:49:34
技术领域
本发明属于分析生物学技术领域,涉及乙型肝炎用药后治疗效果及复发风险评价方法,具体为同时检测全长与截短的HBV pgRNA荧光定量PCR试剂盒及其应用。
背景技术
乙肝病毒(HBV)感染呈世界性流行,但不同地区HBV感染的流行强度差异很大。据WHO报道,全球约有3.5亿慢性HBV感染者,非洲地区和西太平洋地区占68%。东南亚和西太平洋地区一般人群的乙型肝炎表面抗原(HBsAg)流行率分别为2%(3900万例)和6.2%(1.15亿例)。亚洲HBV地方性流行程度各不相同,多数亚洲地区为中至高流行区,少数为低流行区。据估计,目前我国一般人群HBsAg流行率为6%~8%,慢性HBV感染者约9000多万例,其中慢性乙型肝炎(CHB)患者约2 000万~3 000万例。
HBV属于嗜肝DNA病毒家族,其基因组DNA是双链松弛环状DNA(relaxed circular:rcDNA),全长约为3.2Kb,HBV侵入人的肝细胞,在细胞质中脱去核壳,形成rcDNA进入肝细胞核中解脱负链5’端连接的末端蛋白、正链5’端的RNA残段;依赖宿主细胞的DNA聚合酶和DNA连接酶补齐两条链上的缺口,并进一步折叠、扭曲形成超螺旋结构的共价闭合环状DNA(cccDNA),并以cccDNA为模板转录为不同大小的mRNA(3.5Kb、2.4Kb、2.1Kb、0.8Kb),从而翻译各种病毒蛋白。其中长度3.5Kb的前基因组RNA(pgRNA)包含HBV DNA上的所有遗传信息,以pgRNA作为逆转录模板,利用病毒的逆转录酶合成全长的基因组负链DNA,再以负链DNA作为模板,通过病毒DNA聚合酶的作用,合成正链DNA,与负链DNA一起组成新的HBV rcDNA。新合成的HBV rcDNA一方面进入细胞核内,转化为新的cccDNA,补充细胞内的cccDNA库;另一方面与病毒蛋白装配成新的完整HBV,释放至细胞外,再感染健康的肝细胞。
目前治疗乙型肝炎的抗病毒药主要分两类:一类是细胞因子,以干扰素为代表;另一类是核苷(酸)类似物,如阿德福韦、拉米夫定和恩替卡韦。干扰素是一种广谱的抗病毒药物,机理是与细胞膜特异性受体结合,诱导细胞Jak-STAT信号传导系统激活靶基因,编码合成抗病毒蛋白而建立细胞的抗病毒状态,同时干扰素还能增强机体的免疫功能。干扰素长期使用能够抑制HBV DNA的复制,抑制cccDNA的形成过程,但不能完全清除cccDNA,而且有较多不良反应,如抑制造血细胞,诱发自身免疫性疾病。阿德福韦、拉米夫定和恩替卡韦是安全有效治疗慢性乙型肝炎的药物。三种药物的作用机理是抑制病毒DNA聚合酶,但对HBV的抑制作用是可逆的,停药后短期内复发的可能性非常大,而且不能清除cccDNA,更不能清除已与细胞基因组DNA整合的HBV DNA。
cccDNA的水平与乙肝复发有极大的相关性,cccDNA定量是临床评价治疗效果和预测停药终点的重要指标,而cccDNA的检测需要对患者肝脏进行穿刺取样,侵入性检查会对患者造成一定伤害。血清HBV RNA作为cccDNA的转录产物,是反映cccDNA活性的理想血清学替代指标。近年来研究者进一步揭示,血清中的HBV RNA实质就是存在于核衣壳内未完成或部分完成逆转录的pgRNA。后续的研究发现,在核苷(酸)类药物(NAs)作用下产生的HBV RNA并非全部为全长pgRNA,还存在一些截短的pgRNA片段,这些RNA片段被证实为pgRNA的剪接变异体和长短不一的3'末端截短体。从机制上解释,3'末端截短体的产生是由于P蛋白在进行逆转录时,完成转录模板作用的pgRNA自3'端被P蛋白的RNase H活性所降解形成。中国《慢性乙型肝炎防治指南》(2019版)指出,血液中HBV RNA的量与肝细胞内cccDNA转录活性有关,在评估核苷(酸)类药物(NAs)治疗效果和预测停药后复发风险方面值得深入研究。2019年,美国FDA发布的《慢性乙型肝炎病毒感染药物研发指导意见(草案)》中,将血清HBVRNA作为评价新药的疗效终点指标之一。
发明内容
解决的技术问题:为了克服现有技术的不足,能够同时检测全长或截短的pgRNA,实现核苷(酸)类药物作用产物检测范围的全面性,为临床评价治疗效果和预测停药终点提供准确指导;鉴于此,本发明提供了同时检测全长与截短的HBV pgRNA荧光定量PCR试剂盒及其应用。
技术方案:同时检测全长与截短的HBV pgRNA荧光定量PCR试剂盒,所述试剂盒包括PCR反应液Ⅰ,PCR反应液Ⅰ包括SEQ ID NO:1、SEQ ID NO:2、SEQ ID NO:3、SEQ ID NO:4、SEQ ID NO:5和SEQ ID NO:6所示的特异性引物,以及SEQ ID NO:7、SEQ ID NO:8和SEQ IDNO:9所示的探针;其中,SEQ ID NO:1、SEQ ID NO:2、SEQ ID NO:3和SEQ ID NO:7为PreC/C区引物或探针,SEQ ID NO:4、SEQ ID NO:5、SEQ ID NO:6和SEQ ID NO:8为X区引物或探针,SEQ ID NO:9为与PreC/C区共用一对扩增引物的内标探针。
优选的,所述特异性引物和探针在扩增体系中的终浓度为:SEQ ID NO:1为0.3μM;SEQ ID NO:2为0.1μM;SEQ ID NO:3为0.3μM;SEQ ID NO:4为0.36μM;SEQ ID NO:5为0.36μM;SEQ ID NO:6为0.12μM;SEQ ID NO:7为0.15μM;SEQ ID NO:8为0.2μM;SEQ ID NO:9为0.1μM。引物及探针序列如表1所示:
表1.引物探针信息
优选的,所述的探针,其5’端标记有荧光基团,所述的荧光基团为FAM、VIC、CY5和TAMRA中的一种,且每组采用的荧光标记不同;其3’端标记有的淬灭基团,所述的淬灭基团为MGB或BHQ。
优选的,所述PCR反应液Ⅰ包括200mM pH为8.5的Tris-HCl、0.5M KCl、200mMMgCl
优选的,所述试剂盒包括PCR反应液Ⅱ,PCR反应液Ⅱ包括A-Taq酶、UNG酶、MMLV逆转录酶和RNase抑制剂。
优选的,所述试剂盒包括竞争性内标,内标与PreC/C区共用一对扩增引物,所述内标为假病毒。
优选的,所述试剂盒包括阳性血清对照、阴性血清对照和定量校准品,所述阳性血清对照为HBV阳性血清样本,所述阴性血清对照为HBV阴性血清样本,所述定量校准品为定值的HBV阳性血清样本。
优选的,所述试剂盒包括pgRNA提取试剂,所述pgRNA提取试剂包括裂解液、蛋白酶K、洗涤液Ⅰ、洗涤液Ⅱ、洗脱液和DNA消化反应液。
优选的,所述裂解液为盐酸胍、异硫氰酸胍和二硫苏糖醇,所述洗涤液Ⅰ由硫氰酸胍和无水乙醇组成,所述洗涤液Ⅱ由氯化钠和无水乙醇组成,所述洗脱液为无RNase水,所述DNA消化反应液为DNaseⅠ。
以上任一所述试剂盒在评价核苷类药物治疗乙型肝炎抗病毒效果中的应用。
以上任一所述试剂盒在预测核苷类药物停药后乙型肝炎复发风险中的应用。
有益效果:(1)本发明同时检测出血液中存在的全长与截短HBV pgRNA的含量,可以为临床医生评价核苷(酸)类药物(NAs)在CHB抗病毒治疗效果和预测停药后复发风险方面提供更多的参考数据。(2)本发明通过对HBV 8种基因型(A-H)PreC/C与X保守区域分别设计引物探针,并在体系中加入简并引物,特异性高,可有效降低检测脱靶概率;(3)本发明将人工改造的内对照DNA引入反应体系,该内标与PreC/C区共用一对扩增引物,但内标与靶序列有各自的探针,以指示每个PCR反应管的扩增情况,从而避免假阴性或部分抑制结果的出现;(4)本发明PCR检测体系中添加内参比荧光ROX,用于矫正加样误差与管间差异,定量结果更加准确。
附图说明
图1为通过DNAMAN软件分析HBV A-H基因型的PreC/C与X保守序列,A为PreC/C区分析的保守序列,B为X区分析的保守序列;
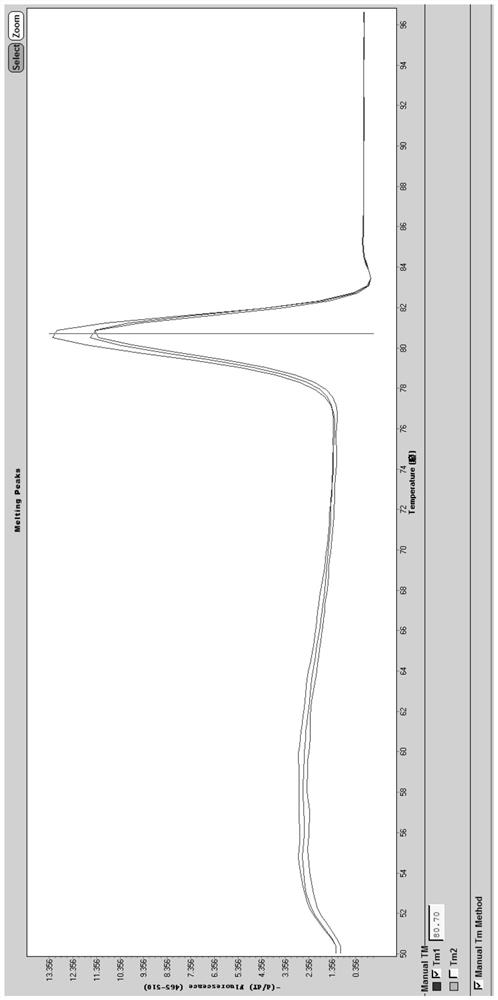
图2A为PreC/C区设计的引物扩增时的溶解曲线,图2B为X区设计的引物扩增时的溶解曲线;
图3为本发明具体实施方式的荧光定量PCR检测方法的PreC/C区灵敏度检测结果,其中A为不同浓度的乙型肝炎病毒RNA检测试剂国家标准品(批号340008-201901)经过检测后的Ct值,B为利用浓度和Ct值构建的标准曲线,C为荧光定量PCR最终得到的扩增曲线;
图4为本发明具体实施方式的荧光定量PCR检测方法的X区灵敏度检测结果,其中A为不同浓度的乙型肝炎病毒RNA检测试剂国家标准品(批号340008-201901)经过检测后的Ct值,B为利用浓度和Ct值构建的标准曲线,C为荧光定量PCR最终得到的扩增曲线。
具体实施方式
以下实施例进一步说明本发明的内容,但不应理解为对本发明的限制。在不背离本发明精神和实质的情况下,对本发明方法、步骤或条件所作的修改和替换,均属于本发明的范围。若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段。
实施例1
一种同时分别检测血液中全长与截短的乙型肝炎病毒前基因组RNA(pgRNA)荧光定量PCR检测试剂盒,包括表2所示组分,其中引物和探针的序列如SEQ ID NO:1-SEQ IDNO:9所示。
表2试剂盒组成信息
其中,PCR反应液Ⅰ中dATP、dUTP、dGTP、dCTP为0.1-1mM、Mg
所述内标中克隆质粒的基因序列为(SEQ ID NO:10):TGCCTACAGACCACCAAATCTTTAATCCCTTAGAAGTTCCCCTCCTCAACACTTCCGTACTATGCTCTGGCGCTCGCCTCGCAGACGAAGG。
所述定量校准品A、定量校准品B、定量校准品C、定量校准品D分别为3×10
所述阳性质控品为3×104-3×10
实施例2
利用实施例1的试剂盒,检测血液中HBV pgRNA,具体步骤如下:
1、病毒核酸提取
1)取1.5mL离心管N个并编号(N=HBV血清样本数+阳性质控品×1+阴性质控品×1+定量校准品×4),分别加入20μl蛋白酶K,200μL样本,再加入240μL裂解液+竞争性内标假病毒(裂解液:内标假病毒=240:1,现配现用),震荡20-30s,使之充分混匀;瞬时离心,放入预先加热至65℃水浴锅中,静置15min;
2)加入100μl异丙醇,20μl磁珠,震荡20-30s,使之充分混匀,室温放置5min;
3)将离心管放至磁架上,静置3min使磁珠完全被吸附,弃上清;
4)加入200μl洗涤液Ⅰ至1.5mL离心管中,震荡5-10s,使之充分混匀;
5)将离心管放至磁架上,静置2-3min使磁珠完全被吸附,弃上清;
6)加入200μl洗涤液Ⅱ至1.5mL离心管中,震荡5-10s,使之充分混匀;
7)将离心管放至磁架上,静置2-3min使磁珠完全被吸附,弃上清;
8)室温放置使管内残液挥发干净;
9)加入50μl洗脱液,震荡10-20s,使磁珠完全从管壁上洗下来,并充分与洗脱液混匀,65℃放置5min;
10)将1.5mL离心管放至磁架上,静置2-3min使磁珠完全被吸附,将上清液吸取至新的洁净的离心管中,获得HBV pgRNA与DNA混合物。
2、HBV pgRNA的纯化:使用DNaseⅠ纯化提取的HBV pgRNA
1)建立如下DNaseⅠ处理体系(20μL)
DNaseⅠ10×反应缓存液2μL;
DNaseⅠ1μL;
洗脱液17μL;
2)37℃孵育20min;
3)75℃孵育10min,使DNaseⅠ失活,得到HBV pgRNA的纯品;
3、PCR反应体系配制及加样
取PCR反应液Ⅰ和PCR反应液Ⅱ,根据样本例数按如下体系配制PCR反应体系:PCR反应液Ⅰ25μL×N;PCR反应液Ⅱ5μL×N;充分混匀后每管30μL分装至PCR管中,每管加入20μL消化后HBV pgRNA的纯品,最终体系为50μL/管,混匀,瞬时离心。
4、PCR扩增检测
将上述PCR反应管放入ABI 7500或QuantStudio DX荧光PCR仪中,程序设置如表3所示。
表3 qRT-PCR热循环参数
其中,荧光信号收集在阶段3:60℃30sec,收集的荧光信号为探针标记的荧光(FAM/VIC/TAMRA),参比荧光(Passive Reference)设置为ROX。
5、结果分析
根据仪器自动分析后的图像适当调节基线的Start值和Stop值以及阈值(使阴性对照的曲线平直或低于阈值线),软件自动定量。
6、质量控制
1)阴性对照:FAM与VIC通道无Ct值,TAMRA通道的Ct≤35;
2)阳性对照:检测浓度值介于3×10
3)四个定量校准品:均检测为阳性,且标准曲线相关性R
4)以上要求需在同一次实验中同时满足,否则,本次实验无效;
实施例3
对实施例1的试剂盒进行灵敏度的检测。
用阴性血清将HBV乙型肝炎病毒RNA检测试剂国家标准品梯度稀释至3E+7、3E+6、3E+5、3E+4、3E+3、3E+2、3E+1IU/mL,用上述确定的检测体系和循环参数对倍比稀释的标准品进行定量检测。结果显示,本发明的荧光定量检测方法具有较高的灵敏度,PreC/C与X区线性范围可低至3.00E+01IU/mL,其中PreC/C区标准曲线的线性回归方程为:y=-3.36x+42.234,相关系数的平方R2=0.997(图3A、B、C);X区标准曲线的线性回归方程为:y=-3.43x+45.945,相关系数的平方R2=0.999(图4A、B、C)。
实施例4
使用实施例1的试剂盒进行4例经核苷(酸)类药物(NAs)治疗3个月的阳性血液样本中全长与截短HBV pgRNA定量对比检测。同时,血液HBV DNA水平经商品化的HBV DNA定量检测试剂盒(雅培)检测,结果显示4例经核苷(酸)类药物(NAs)治疗3个月的血液样本HBVDNA检测均为阳性,有必要通过检测血清中HBV pgRNA的量来反映肝组织内HBV cccDNA的复制水平,为临床医生评价核苷(酸)类药物(NAs)在CHB抗病毒治疗效果提供更多的参考数据。
用本发明的荧光定量PCR方法对4例经核苷(酸)类药物(NAs)治疗3个月的慢乙肝患者血液HBV pgRNA进行了检测。结果显示,PreC/C区HBV pgRNA的量要明显高于X区HBVpgRNA的量,1-4号样本PreC/C区pgRNA的量分别是X区pgRNA量的7.04、2.78、7.04、13.96倍(表4)。说明经核苷(酸)类药物(NAs)治疗3个月,病毒的逆转录和DNA合成过程受到明显抑制,提前终止负链HBV DNA的合成,产生的HBV RNA并非全部为全长pgRNA,还存在一些截短pgRNA片段。本发明中X保守区域设计的引物可扩增全长的pgRNA(图1B),PreC/C保守区域设计的引物既可以扩增全长的pgRNA,又可以扩增pgRNA截短体(图1A),一些截短的pgRNA片段被PreC/C区引物探针体系检测到。
表4经核苷(酸)类药物(NAs)治疗3个月的慢乙肝患者血液HBV pgRNA(X区与PreC/C区)水平
综上所述,本发明提供的试剂盒可以用于同时检测血液中全长与截短的HBVpgRNA的含量,可以为临床医生评价核苷(酸)类药物(NAs)在CHB抗病毒治疗治疗效果和预测停药后复发风险方面提供更多的参考数据。本发明采用的竞争性PCR法内标参照,与待测模板使用同一反应条件、同一反应管、同一对引物同步扩增,从而可有效质控反应体系并反映其扩增效率,更加有效控制大量复杂的未知成分对PCR反应的抑制,更加准确的进行定量。本发明提供的HBV pgRNA检测试剂盒具有灵敏度高,特异性强,操作简单,检测准确等优点,适用于临床及科研中对HBV pgRNA的定量检测。
序列表
<110> 无锡中德美联生物技术有限公司
<120> 同时检测全长与截短的HBV pgRNA荧光定量PCR试剂盒及其应用
<160> 10
<170> SIPOSequenceListing 1.0
<210> 1
<211> 18
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 1
ctacagacca ccaaatgc 18
<210> 2
<211> 18
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 2
ctacagacca caaaatgc 18
<210> 3
<211> 19
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 3
ccttcgtctg cgaggcgag 19
<210> 4
<211> 17
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 4
cacctctctt tacgcgg 17
<210> 5
<211> 20
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 5
gatgggcgtt cacggtggtc 20
<210> 6
<211> 21
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 6
tgatgggcgt tcacggtggt t 21
<210> 7
<211> 28
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 7
acctgcctcg tcgtctaaca acagtagt 28
<210> 8
<211> 25
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 8
ccccgtctgt gccttctcat ctgcc 25
<210> 9
<211> 26
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 9
tcccttagaa gttcccctcc tcaaca 26
<210> 10
<211> 91
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 10
tgcctacaga ccaccaaatc tttaatccct tagaagttcc cctcctcaac acttccgtac 60
tatgctctgg cgctcgcctc gcagacgaag g 91
- 同时检测全长与截短的HBV pgRNA荧光定量PCR试剂盒及其应用
- 一种同时检测三种分枝杆菌的多重TaqMan荧光定量PCR试剂盒及其应用
