RNA提取试剂盒及RNA提取方法
文献发布时间:2023-06-19 13:49:36
技术领域
本发明涉及分子生物学领域,特别是涉及一种RNA提取试剂盒及RNA提取方法。
背景技术
RNA是生命体的遗传信息载体,包括编码RNA与非编码RNA,近些年来,科学家发现非编码RNA在生命体中也起着非常重要的作用,对非编码RNA的关注度越来越高。miRNA是一类内源性的具有调控功能的非编码RNA,研究发现其表达谱随着生命体状态的改变会发生特异性改变,能作为一类新兴的标志物,而提取出高质量的miRNA是研究miRNA的前提。
传统的RNA提取方法主要有基于柱分离技术的提取方法和Trizol-氯仿萃取法。但是,基于柱分离技术的提取方法提取miRNA的得率低,且GC含量低的miRNA部分丢失;Trizol-氯仿萃取法中所用到的Trizol中的苯酚和氯仿具有较高毒性,对操作人员的健康影响很大,而且提取过程中同样会导致miRNA部分降解,尤其是GC含量低的miRNA。
发明内容
基于此,有必要提供一种毒性较低、能提高RNA得率且减少GC含量低的RNA的丢失的RNA提取试剂盒。
此外,还提供一种RNA提取方法。
一种RNA提取试剂盒,包括变性裂解剂和蛋白分离剂,上述变性裂解剂包括异硫氰酸胍和β-巯基乙醇,异硫氰酸胍的摩尔量和β-巯基乙醇的体积之比为(1mol~6mol):(1mL~15mL);上述蛋白分离剂包括辛酸。
上述RNA提取试剂盒包括变性裂解剂和蛋白分离剂,变性裂解剂包括异硫氰酸胍和β-巯基乙醇,异硫氰酸胍能够迅速溶解蛋白质,破碎细胞结构,破坏核蛋白,有效萃取出RNA,同时它能抑制细胞释放出的核酸酶;β-巯基乙醇能够破坏核糖核酸酶的二硫键,使核糖核酸酶变性,防止核糖核酸酶对RNA的降解;蛋白分离剂包括辛酸,辛酸与蛋白或脂质具有很强的结合能力,能够有效地分离RNA-蛋白复合物;将异硫氰酸胍、β-巯基乙醇与辛酸结合使用,则能够在不含苯酚和氯仿的条件下,提高RNA得率,减少GC含量低的RNA的丢失。
在其中一个实施例中,异硫氰酸胍的摩尔量和β-巯基乙醇的体积之比为(2mol~5mol):(7mL~13mL)。
在其中一个实施例中,变性裂解剂还包括第一缓冲液,第一缓冲液选自柠檬酸钠缓冲液及Tris-EDTA缓冲液中的一种。
在其中一个实施例中,蛋白分离剂还包括第二缓冲液,第二缓冲液选自乙酸钠缓冲液、氯化钠溶液及氯化铵溶液中的一种。
在其中一个实施例中,第一缓冲液包含柠檬酸钠,柠檬酸钠与异硫氰酸胍的摩尔量之比为(5mmol~30mmol):(1mol~6mol)。
在其中一个实施例中,第二缓冲液包含乙酸钠,乙酸钠的摩尔量与辛酸的体积之比为(0.01mol~1mol):(2mL~25mL)。
在其中一个实施例中,RNA提取试剂盒还包括沉淀剂,沉淀剂包括异丙醇、无水乙醇和糖原中的至少一种。
在其中一个实施例中,沉淀剂包括异丙醇、无水乙醇和糖原,异丙醇的体积、无水乙醇的体积和糖原的质量之比为(20μL~30μL):(5μL~7.5μL):(1μg~5μg)。
在其中一个实施例中,变性裂解剂还包括第一缓冲液,第一缓冲液包括柠檬酸钠,在变性裂解剂中,柠檬酸钠的浓度为5mmol/L~30mmol/L,异硫氰酸胍的浓度为1mol/L~6mol/L,β-巯基乙醇的体积分数为0.1%~1.5%;蛋白分离剂还包括第二缓冲液,第二缓冲液包括乙酸钠,在蛋白分离剂中,乙酸钠的浓度为0.01mol/L~1mol/L,辛酸的体积分数为0.2%~2.5%;RNA提取试剂盒还包括沉淀剂,沉淀剂包括异丙醇、无水乙醇和糖原,异丙醇的体积、无水乙醇的体积和糖原的质量之比为(20μL~30μL):(5μL~7.5μL):(1μg~5μg),在上述沉淀剂中,糖原的浓度为40μg/mL~200μg/mL。
在其中一个实施例中,RNA提取试剂盒还包括乙醇胺溶液、蛋白酶K和丝氨酸蛋白酶抑制剂中的至少一种。
一种RNA提取方法,包括以下步骤:
将样本与变性裂解剂混合,得到第一混合液,变性裂解剂包括异硫氰酸胍和β-巯基乙醇,异硫氰酸胍的摩尔量和β-巯基乙醇的体积之比为(1mol~6mol):(1mL~15mL);
将第一混合液与蛋白分离剂混合,得到第二混合液,蛋白分离剂包括辛酸;及
将第二混合液放置至少5min后进行固液分离,取液体,制备RNA。
在其中一个实施例中,异硫氰酸胍的工作浓度为1mol/L~6mol/L,β-巯基乙醇的工作浓度为0.5%(v/v)~1.5%(v/v),辛酸的工作浓度为0.2%(v/v)~2.5%(v/v)。
在其中一个实施例中,将第二混合液进行固液分离,取液体之后,还包括以下步骤:
将上述液体与沉淀剂混合,于-20℃放置至少2h后于2℃~8℃以10000g~13000g离心10min~20min,留取沉淀,其中,沉淀剂包括异丙醇、无水乙醇和糖原;
将上述沉淀与体积分数为70%~80%的乙醇溶液混合,洗涤所述沉淀,得到纯化的RNA沉淀;及
将上述纯化的RNA沉淀干燥后与无核酸酶的水混合,溶解RNA。
在其中一个实施例中,样本为血浆;蛋白裂解剂的pH为4.0~6.0;糖原的工作浓度为5mg/mL~30mg/mL;样本、变性裂解剂、蛋白分离剂、异丙醇、无水乙醇和糖原的体积之比为200:(125~200):(125~200):(400~600):(100~150):(1~5)。
附图说明
图1为采用不同糖原用量提取出的miRNA总量测定结果;
图2为采用不同辛酸浓度提取出的miR-16的qPCR结果;
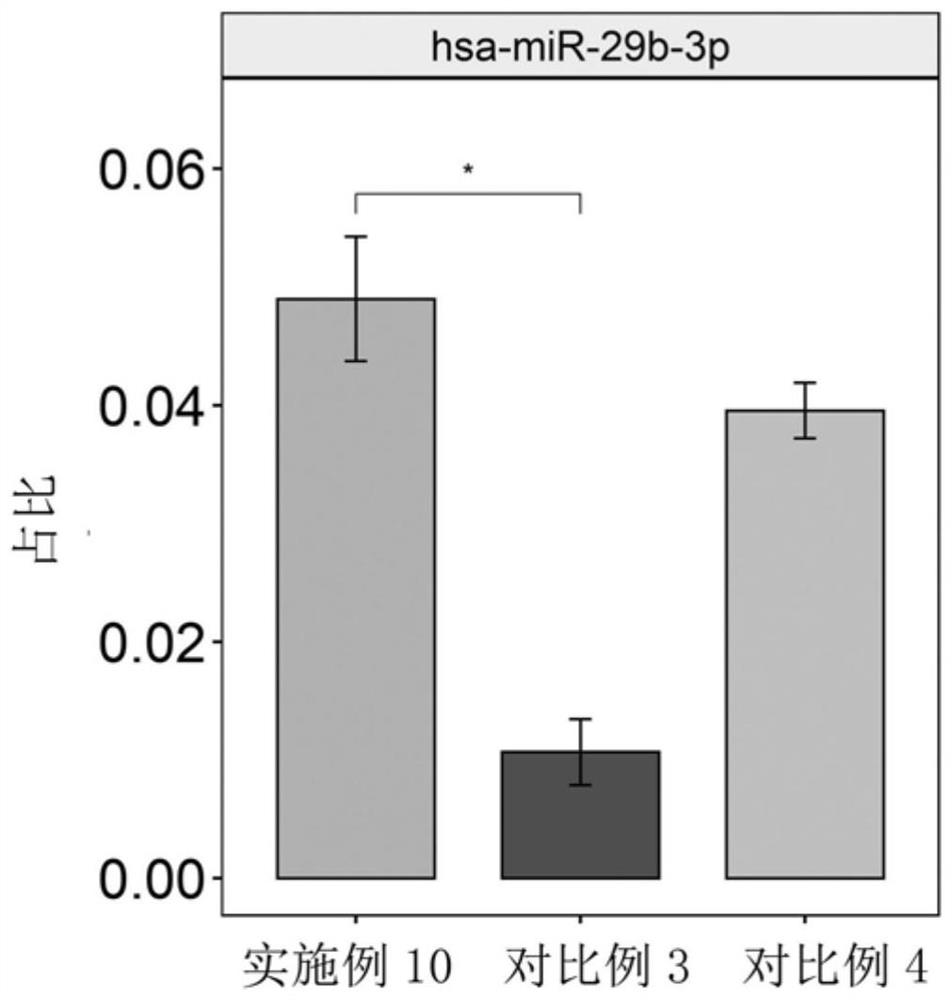
图3为hsa-miR-29b-3p的Reads占比结果图;
图4为hsa-miR-141-3p的Reads占比结果图;
图5为hsa-miR-106b-5p的Reads占比结果图;
图6~图11分别为按照本发明的RNA提取方法提取得到的样本的miRNA的质检结果;
图12~图17分别为采用试剂盒1提取得到的样本的miRNA的质检结果;
图18~图23分别为采用试剂盒2提取得到的样本的miRNA的质检结果。
具体实施方式
为使本发明的上述目的、特征和优点能够更加明显易懂,下面对本发明的具体实施方式做详细的说明。在下面的描述中阐述了很多具体细节以便于充分理解本发明。但是本发明能够以很多不同于在此描述的其它方式来实施,本领域技术人员可以在不违背本发明内涵的情况下做类似改进,因此本发明不受下面公开的具体实施例的限制。
除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。本文所使用的术语“和/或”包括一个或多个相关的所列项目的任意的和所有的组合。
本申请一实施方式提供了一种RNA提取试剂盒,该RNA提取试剂盒包括变性裂解剂和蛋白分离剂,变性裂解剂包括异硫氰酸胍和β-巯基乙醇,异硫氰酸胍的摩尔量和β-巯基乙醇的体积之比为(1mol~6mol):(1mL~15mL);蛋白分离剂包括辛酸。
上述RNA提取试剂盒包括变性裂解剂和蛋白分离剂,变性裂解剂包括异硫氰酸胍和β-巯基乙醇,异硫氰酸胍能够迅速溶解蛋白质,破碎细胞结构,破坏核蛋白,有效萃取出RNA,同时它能抑制细胞释放出的核酸酶;β-巯基乙醇能够破坏核糖核酸酶的二硫键,使核糖核酸酶变性,防止核糖核酸酶对RNA的降解;蛋白分离剂包括辛酸,辛酸与蛋白或脂质具有很强的结合能力,能够有效地分离RNA-蛋白复合物;将异硫氰酸胍、β-巯基乙醇与辛酸结合使用,则能够在不含苯酚和氯仿的条件下,提高RNA得率,减少GC含量低的RNA的丢失。
在其中一个实施例中,异硫氰酸胍的摩尔量和β-巯基乙醇的体积之比为(2mol~5mol):(7mL~13mL)。进一步地,异硫氰酸胍的摩尔量和β-巯基乙醇的体积之比为(2.5mol~4.5mol):(8mL~12mL)。
将异硫氰酸胍的摩尔量和β-巯基乙醇的体积之比设置为(2.5mol~4.5mol):(8mL~12mL),能够更有效地破坏核糖核酸酶,有利于游离RNA的保护。
在其中一个实施例中,变性裂解剂还包括第一缓冲液,第一缓冲液选自柠檬酸钠缓冲液和Tris-EDTA缓冲液中的一种。
在其中一个实施例中,第一缓冲液包含柠檬酸钠,柠檬酸钠与异硫氰酸胍的摩尔量之比为(20mmol~30mmol):(1mol~6mol)。进一步地,柠檬酸钠与异硫氰酸胍的摩尔量之比为(22mmol~28mmol):(2mol~5mol)。更进一步地,柠檬酸钠与异硫氰酸胍的摩尔量之比为(24mmol~26mmol):(2.5mol~4.5mol)。
在其中一个实施例中,第一缓冲液为柠檬酸钠缓冲液。在变性裂解剂中,柠檬酸钠的浓度为20mmol/L~30mmol/L,异硫氰酸胍的浓度为1mol/L~6mol/L,β-巯基乙醇的体积分数为0.1%~1.5%。
在其中一个实施例中,变性裂解剂由柠檬酸钠、异硫氰酸胍、β-巯基乙醇和水组成。在变性裂解剂中,柠檬酸钠的浓度为20mmol/L~30mmol/L,异硫氰酸胍的浓度为1mol/L~6mol/L,β-巯基乙醇的体积分数为0.1%~1.5%。
在其中一个实施例中,第一缓冲液为Tris-EDTA缓冲液。在变性裂解剂中,Tris-EDTA缓冲液包括0.5mmol/L~10mmol/L的EDTA和1mmol/L~50mmol/L的Tris,异硫氰酸胍的浓度为1mol/L~6mol/L,β-巯基乙醇的体积分数为0.1%~1.5%。
在其中一个实施例中,蛋白分离剂还包括第二缓冲液,第二缓冲液选自乙酸钠缓冲液、氯化钠溶液及氯化铵溶液中的一种。
在其中一个实施例中,第二缓冲液包含乙酸钠,乙酸钠的摩尔量与辛酸的体积之比为(0.01mol~1mol):(2mL~25mL);进一步地,乙酸钠的摩尔量与辛酸的体积之比为(0.05mol~0.5mol):(2mL~15mL);更进一步地,乙酸钠的摩尔量与辛酸的体积之比为(0.1mol~0.3mol):(5mL~13.5mL)。
在其中一个实施例中,第二缓冲液为乙酸钠缓冲液。在蛋白分离剂中,乙酸钠的浓度为0.01mol/L~1mol/L,辛酸的体积分数为0.2%~2.5%。
在其中一个实施例中,蛋白分离剂由乙酸钠、辛酸和水组成。在蛋白分离剂中,乙酸钠的浓度为0.01mol/L~1mol/L,辛酸的体积分数为0.2%~2.5%。
在其中一个实施例中,第二缓冲液为氯化钠溶液。在蛋白分离剂中,氯化钠的浓度为1mol/L~5mol/L,辛酸的体积分数为0.2%~2.5%。
在其中一个实施例中,第二缓冲液为氯化铵溶液。在蛋白分离剂中,氯化铵的浓度为1mol/L~5mol/L,辛酸的体积分数为0.2%~2.5%。上述第一缓冲液与第二缓冲液用以调节变性裂解剂和蛋白分离剂的pH,以保证在合适的pH条件下进行RNA提取,保证RNA提取的效率和质量。
在一些实施例中,RNA提取试剂盒还包括沉淀剂,沉淀剂包括异丙醇、无水乙醇和糖原中的至少一种。
上述沉淀剂包括异丙醇、无水乙醇和糖原中的至少一种。异丙醇或乙醇能够夺取RNA周围的水分,导致RNA聚集而发生沉淀。糖原作为助沉剂,在微量RNA不足以形成沉淀的情况下,能够与RNA共沉淀,形成可视化沉淀。
在其中一个实施例中,沉淀剂包括异丙醇、无水乙醇和糖原。
可选地,异丙醇的体积、无水乙醇的体积和糖原的质量之比为(20μL~30μL):(5μL~7.5μL):(1μg~5μg)。进一步地,异丙醇的体积、无水乙醇的体积和糖原的质量之比为(22μL~28μL):(5.5μL~7μL):(1.5μg~4.5μg)。更进一步地,异丙醇的体积、无水乙醇的体积和糖原的质量之比为(24μL~26μL):(6μL~6.5μL):(2μg~4μg)。
在其中一个实施例中,上述沉淀剂包括糖原,在沉淀剂中,糖原的浓度为40μg/mL~200μg/mL。进一步地,糖原的浓度为60μg/mL~180μg/mL。更进一步地,糖原的浓度为80μg/mL~160μg/mL。
在其中一个实施例中,变性裂解剂还包括第一缓冲液,第一缓冲液包括柠檬酸钠,在变性裂解剂中,柠檬酸钠的浓度为5mmol/L~30mmol/L,异硫氰酸胍的浓度为1mol/L~6mol/L,β-巯基乙醇的体积分数为0.1%~1.5%;蛋白分离剂还包括第二缓冲液,在蛋白分离剂中,乙酸钠的浓度为0.01mol/L~1mol/L,辛酸的体积分数为0.2%~2.5%;RNA提取试剂盒还包括沉淀剂,沉淀剂包括异丙醇、无水乙醇和糖原,异丙醇的体积、无水乙醇的体积和糖原的质量之比为(20μL~30μL):(5μL~7.5μL):(1μg~5μg),在上述沉淀剂中,糖原的浓度为40μg/mL~200μg/mL。
进一步地,在变性裂解剂中,柠檬酸钠的浓度为22mmol/L~28mmol/L,异硫氰酸胍的浓度为2mol/L~5mol/L,β-巯基乙醇的体积分数为0.7%~1.3%;在蛋白分离剂中,乙酸钠的浓度为0.05mol/L~0.5mol/L,辛酸的体积分数为0.2%~1.5%;异丙醇的体积、无水乙醇的体积和糖原的质量之比为(22μL~28μL):(5.5μL~7μL):(1.5μg~4.5μg),在上述沉淀剂中,糖原的浓度为60μg/mL~180μg/mL。
更进一步地,在变性裂解剂中,柠檬酸钠的浓度为24mmol/L~26mmol/L,异硫氰酸胍的浓度为2.5mol/L~4.5mol/L,β-巯基乙醇的体积分数为0.8%~1.2%;在蛋白分离剂中,乙酸钠的浓度为0.1mol/L~0.3mol/L,辛酸的体积分数为0.5%~1.35%;异丙醇的体积、无水乙醇的体积和糖原的质量之比为(24μL~26μL):(6μL~6.5μL):(2μg~4μg),在上述沉淀剂中,糖原的浓度为80μg/mL~160μg/mL。
在其中一个实施例中,RNA提取试剂盒还包括乙醇胺溶液、蛋白酶K和丝氨酸蛋白酶抑制剂中的至少一种。本申请一实施方式还提供了一种RNA提取方法,包括步骤a1、步骤a2和步骤a3:
步骤a1:将样本与变性裂解剂混合,得到第一混合液。
具体地,变性裂解剂的组成如上述RNA提取试剂盒中的描述,此处不再赘述。
可选地,异硫氰酸胍的工作浓度为1mol/L~6mol/L,β-巯基乙醇的工作浓度为0.1%(v/v)~1.5%(v/v),柠檬酸钠的工作浓度为5mmol/L~30mmol/L。需要说明的是,异硫氰酸胍的工作浓度是指在与样本混合之前,变性裂解剂中异硫氰酸胍的浓度;β-巯基乙醇的工作浓度是指在与样本混合之前,变性裂解剂中β-巯基乙醇的浓度;柠檬酸钠的工作浓度是指在与样本混合之前,变性裂解剂中柠檬酸钠的浓度。
在其中一个实施例中,样本具体为血浆,血浆与变性裂解剂的体积之比为200:(125~175)。进一步地,血浆与变性裂解剂的体积之比为200:(135~165)。更进一步地,血浆与变性裂解剂的体积之比为200:(145~155)。需要说明的是,此处的变性裂解剂是指异硫氰酸胍的工作浓度为1mol/L~6mol/L、β-巯基乙醇的工作浓度为0.1%(v/v)~1.5%(v/v)和柠檬酸钠的工作浓度为5mmol/L~30mmol/L的变性裂解剂。
步骤a2:将第一混合液与蛋白分离剂混合,得到第二混合液。
具体地,蛋白分离剂的组成如上述RNA提取试剂盒中的描述,此处不再赘述。
可选地,辛酸的工作浓度为0.2%(v/v)~2.5%(v/v),乙酸钠的工作浓度为0.01mol/L~1mol/L。需要说明的是,辛酸的工作浓度是指在与第一混合液混合之前,蛋白分离剂中辛酸的浓度;乙酸钠的工作浓度是指在与第一混合液混合之前,蛋白分离剂中乙酸钠的浓度。
蛋白裂解剂的pH为4.0~6.0。
步骤a3:将第二混合液放置至少5min后进行固液分离,取液体,制备RNA。
在其中一个实施例中,第二混合液在22℃~28℃中放置5min~10min后,于2℃~8℃在11000g~13000g条件下离心5min~10min,留取上清,制备RNA。
在22℃~28℃中放置5min~10min是为了使变性裂解剂、蛋白分离液与样本充分反应,释放RNA。
在其中一个实施例中,将第二混合液进行固液分离,取液体之后,还包括步骤b1、步骤b2和步骤b3:
步骤b1:将上述液体与沉淀剂混合,于-20℃放置至少2h后于2℃~8℃以10000g~13000g离心10min~20min,留取沉淀。
具体地,沉淀剂的组成如上述RNA提取试剂盒中的描述,此处不再赘述。
在RNA浓度较低的情况下,在-20℃条件下沉淀2h以上可以获得更高的RNA得率。
可选地,糖原的工作浓度为5mg/mL~30mg/mL。需要说明的是,糖原的的工作浓度是指在与样本、异丙醇和无水乙醇混合之前糖原的浓度。
在其中一个实施例中,样本、变性裂解剂、蛋白分离剂、异丙醇、无水乙醇和糖原的体积之比为200:(125~200):(125~200):(400~600):(100~150):(1~5)。进一步地,样本、变性裂解剂、蛋白分离剂、异丙醇、无水乙醇和糖原的体积之比为200:(135~190):(135~190):(450~550):(112.5~137.5):(2~4)。更进一步地,样本、变性裂解剂、蛋白分离剂、异丙醇、无水乙醇和糖原的体积之比为200:(145~180):(145~180):(475~525):(118~132):(2.5~3.5)。需要说明的是,此处的样本为血浆,变性裂解剂是指异硫氰酸胍的工作浓度为1mol/L~6mol/L、β-巯基乙醇的工作浓度为0.1%(v/v)~1.5%(v/v)和柠檬酸钠的工作浓度为5mmol/L~30mol/L的变性裂解剂,蛋白分离剂是指辛酸的工作浓度为0.2%(v/v)~2.5%(v/v)和乙酸钠的工作浓度为0.01mol/L~1mol/L的蛋白分离剂,糖原是指工作浓度为5mg/mL~30mg/mL的糖原。
步骤b2:将上述沉淀与体积分数为70%~80%的乙醇溶液混合,洗涤所述沉淀,得到纯化的RNA沉淀。
用体积分数为70%~80%的乙醇溶液洗涤RNA沉淀,可以去除盐离子、蛋白质、脂质和异丙醇,并且乙醇挥发快,RNA沉淀干燥速度较快,不会留下乙醇杂质。
步骤b3:将上述纯化的RNA沉淀干燥后与无核酸酶的水混合,溶解RNA。
上述RNA提取方法,采用上述RNA提取试剂盒,充分利用异硫氰酸胍、β-巯基乙醇与辛酸结合使用的优点,能够在不含苯酚和氯仿的条件下,提高RNA得率,减少GC含量低的RNA的丢失。
在其中一个实施例中,将第二混合液进行固液分离,取液体之后,还包括步骤c1和步骤c2:
步骤c1:将上述液体与乙醇胺溶液混合,并加入蛋白酶K,于55℃~70℃孵育20min~60min。
具体地,乙醇胺溶液的作用是调节pH,使得蛋白酶K能够在合适的pH条件下发挥作用,水解残留的蛋白质。
步骤c2:将步骤c1得到的液体与丝氨酸蛋白酶抑制剂(AEBSF)混合,于60℃~70℃孵育10min~20min。
具体地,丝氨酸蛋白酶抑制剂能够抑制蛋白酶K的活性,使蛋白酶K失活,停止继续发挥作用。
具体实施例
以下结合具体实施例进行详细说明。以下实施例如未特殊说明,则不包括除不可避免的杂质外的其他组分。实施例中采用试剂和仪器如非特别说明,均为本领域常规选择。实施例中未注明具体条件的实验方法,按照常规条件,例如文献、书本中所述的条件或者生产厂家推荐的方法实现。本文中“v/v”代表体积比。
实施例1
1.收集样本
收集12例健康成年志愿者的血液样本各2mL,于EDTA抗凝采血管中保存,并分离血浆,得到12个血浆样本,每个样本约900μL,分别命名为样本1~样本12。
2.变性并裂解样本
每个样本取200μL血浆放入1.5mL Nuclease-free离心管中,加入150μL变性裂解剂,其中,该变性裂解剂的组成为4mol/L异硫氰酸胍、25mmol/L柠檬酸钠(pH=7.0)和1%(v/v)β-巯基乙醇。
3.去除蛋白质
在步骤2中加入样本和变性裂解剂后的离心管中,加入150μL蛋白分离剂,其中,蛋白分离剂的组成为0.2mol/L乙酸钠和0.5%(v/v)辛酸,该蛋白分离剂pH为4.0。
将上述样本、变性裂解剂和蛋白分离剂混合液在涡旋振荡器上震荡30s混匀,于室温(25℃)放置5min后,于4℃在12000g条件下离心15min,吸取上清至新的1.5mL Nuclease-free离心管中。
向上清液中加入50μL乙醇胺溶液,再加入1μL蛋白酶K,涡旋混匀,65℃孵育30min。
加入1μL 10%丝氨酸蛋白酶抑制剂(AEBSF),涡旋混匀,65℃孵育10min。
4.沉淀RNA
在步骤3中新的Nuclease-free离心管中加入与上清等体积的异丙醇、异丙醇体积的25%的无水乙醇和3μL 20mg/mL的糖原,上下颠倒混匀,于-20℃沉淀2h。
沉淀完成后,于4℃在12000g条件下离心10min,弃去上清,得到RNA沉淀。
5.洗涤RNA沉淀
在步骤4得到的RNA沉淀中加入1mL75%(v/v)乙醇,上下颠倒15次洗涤沉淀,于4℃在12000g条件下离心5min,弃去上清,并重复此洗涤步骤一次,得到纯化的RNA沉淀。
6.溶解RNA
在室温(25℃)中干燥RNA沉淀后,加入6μL无核酸酶水溶解。
7.测定miRNA浓度
通过Qubit microRNA Assay kit对提取的miRNA浓度进行定量测定。miRNA浓度测定结果如表1所示。
8.进行small RNA文库构建
取5μL步骤6得到的RNA溶液,根据QIAseq miRNA Library Kit进行small RNA文库构建。
对比例1
本对比例采用实施例1步骤1中的样本,每个样本取200μL,采用商业化试剂盒1(QIAGEN miRNeasy Serum/Plasma Kit,货号:217184)进行RNA提取,提取步骤按照该试剂盒说明书进行。提取完成后miRNA的浓度测定根据实施例1步骤7进行,small RNA文库构建根据实施例1步骤8进行。miRNA浓度测定结果如表1所示。
对比例2
本对比例采用实施例1步骤1中的样本,每个样本取200μL,采用商业化试剂盒2(Norgen Biotek Plasma/Serum Circulating and Exosomal RNA Purification MiniKit(Slurry Format),货号:51000)进行RNA提取,提取步骤按照该试剂盒说明书进行。提取完成后miRNA的浓度测定根据实施例1步骤7进行,small RNA文库构建根据实施例1步骤8进行。miRNA浓度测定结果如表1所示。
表1 miRNA浓度测定结果
从表1中可知,实施例1得到的miRNA总量为13.16±1.51ng,对比例1得到的miRNA总量为5.69±0.62ng,对比例2得到的miRNA总量为1.70±0.20ng。实施例1提取得到的miRNA是对比例1的2.31倍,是对比例2的6.5倍。从结果对比可知,本发明的RNA得率明显高于采用商业化试剂盒的对比例1和对比例2。
此外,从表1中还可知,实施例1得到的miRNA浓度为2.18±0.25ng/μL,对比例1得到的miRNA浓度为0.47±0.05ng/μL,对比例2得到100μL miRNA洗脱液,浓度太低无法检测,样本经真空抽干浓缩至~10μL之后,浓度为0.17±0.02ng/μL。从实施例1、对比例1和对比例2中提取得到的样本1~样本12的RNA中各取5μL进行small RNA文库构建,因此,实施例1的miRNA总投入量为10.89±1.30ng,对比例1的miRNA总投入量为2.37±0.26ng,对比例2的miRNA总投入量≤1ng,即,构建small RNA文库时实施例1可用的起始miRNA投入量是对比例1的5倍,是对比例2的10倍。可见,实施例1可投入高通量文库构建的miRNA起始量明显高于对比例1和对比例2,投入量高可以显著提高微量血浆样本的miRNA高通量测序成功率。
实施例2
本实施例中所用试剂及试剂的浓度与实施例1相同,步骤与实施例1大致相同,其不同在于:
1)步骤7:通过Qubit microRNA Assay kit对提取的miRNA浓度进行定量测定。miRNA总量测定结果如图1所示;
2)无步骤8。
实施例3
本实施例的步骤与实施例2相同,试剂和试剂浓度与实施例2大致相同,其不同在于:步骤4中加入的糖原体积为2.5μL。miRNA总量测定结果如图1所示。
实施例4
本实施例的步骤与实施例2相同,试剂和试剂浓度与实施例2大致相同,其不同在于:步骤4中加入的糖原体积为2μL。miRNA总量测定结果如图1所示。
实施例5
本实施例的步骤与实施例2相同,试剂和试剂浓度与实施例2大致相同,其不同在于:步骤4中加入的糖原体积为1.5μL。miRNA总量测定结果如图1所示。
实施例6
本实施例的步骤与实施例2相同,试剂和试剂浓度与实施例2大致相同,其不同在于:步骤4中加入的糖原体积为1μL。miRNA总量测定结果如图1所示。
从图1中可知,随着糖原用量增加,本发明提取方法提取出的miRNA总量增加,在糖原用量为20μg~60μg时,miRNA总量高于4ng,此糖原用量为优选的用量范围。
实施例7
本实施例的试剂、试剂浓度及步骤与实施例1大致相同,其不同在于:
步骤7为:
测定miR-16表达水平
将步骤6中提取出的RNA,通过qPCR检测血浆中表达最丰富的miRNA之一miR-16的表达水平。RT-qPCR的步骤和程序按照TaqMan
miR-16的Ct值如图2所示。
实施例8
本实施例的步骤与实施例7相同,试剂和试剂浓度与实施例7大致相同,其不同在于:步骤3中辛酸的体积分数为1.5%。miR-16的Ct值如图2所示。
实施例9
本实施例的步骤与实施例7相同,试剂和试剂浓度与实施例7大致相同,其不同在于:步骤3中辛酸的体积分数为2.5%。miR-16的Ct值如图2所示。
从图2中可知,辛酸体积分数为0.5%的实施例7的miR-16的Ct值最低,即在此辛酸浓度下,采用本发明的RNA提取方法提取出的miR-16浓度最高,辛酸浓度提高会导致miR-16的Ct值升高。
实施例10
本实施例的步骤与实施例1大致相同,其不同在于:
1)步骤9:
进行高通量测序
将步骤8中构建好的文库经6%PAGE胶回收目的片段,长度为180bp;构建好的文库经Agilent 2100进行文库片段长度质检,文库质检合格后经qPCR定量,每个文库稀释到1.5nM,进行上机测序。miRNA高通量测序结果如表2所示。
2)步骤10:
低GC miRNA富集能力分析
将经过步骤9高通量测序的样本1中选取三个GC含量低的miRNA:hsa-miR-29b-3p、hsa-miR-141-3p和hsa-miR-106b-5p,分别分析这三种miRNA的Reads占比。hsa-miR-29b-3p、hsa-miR-141-3p和hsa-miR-106b-5p的Reads占比分别如图3、图4和图5所示。
对比例3
本对比例采用实施例1步骤1中的样本,每个样本取200μL,采用商业化试剂盒1(QIAGEN miRNeasy Serum/Plasma Kit,货号:217184)进行RNA提取,提取步骤按照该试剂盒说明书进行。提取完成后miRNA浓度测定、文库构建、高通量测序和低GC miRNA富集能力分析根据实施例2步骤7~步骤10进行。miRNA高通量测序结果如表2所示。hsa-miR-29b-3p、hsa-miR-141-3p和hsa-miR-106b-5p的Reads占比分别如图3、图4和图5所示。
对比例4
本对比例采用实施例1步骤1中的样本,每个样本取200μL,采用商业化试剂盒2(Norgen Biotek Plasma/Serum Circulating and Exosomal RNA Purification MiniKit(Slurry Format),货号:51000)进行RNA提取,提取步骤按照该试剂盒说明书进行。提取完成后miRNA浓度测定、高通量文库构建、高通量测序和低GC miRNA富集能力分析根据实施例2步骤7~步骤10进行。miRNA高通量测序结果如表2所示。hsa-miR-29b-3p、hsa-miR-141-3p和hsa-miR-106b-5p的Reads占比分别如图3、图4和图5所示。
表2 miRNA高通量测序结果
从表2中可知,从同一志愿者相同体积的血浆中提取miRNA,实施例10提取的miRNA均可以满足测序要求,高通量测序成功率为100%,并且获得的miRNA种类较多。而对比例3和对比例4提取的miRNA均存在高通量测序文库构建失败的可能性,对比例4中提取的样本3的miRNA构建文库浓度低于3nM,不满足上机要求,对比例3和对比例4中提取的样本4的miRNA构建文库浓度均低于3nM,不满足上机要求。本发明的miRNA提取方法提取得到的miRNA高通量测序成功率高于对比例3和对比例4的商业化试剂盒。
图3~图5分别为hsa-miR-29b-3p、hsa-miR-141-3p和hsa-miR-106b-5p的Reads占比结果图,其中左边的柱形表示实施例10的hsa-miR-29b-3p、hsa-miR-141-3p或hsa-miR-106b-5p的Reads占比结果,中间的柱形表示对比例3的hsa-miR-29b-3p、hsa-miR-141-3p或hsa-miR-106b-5p的Reads占比结果,右边的柱形表示对比例4的hsa-miR-29b-3p、hsa-miR-141-3p或hsa-miR-106b-5p的Reads占比结果。
从图3~图5中可知,实施例10中三种GC含量低的miRNA的Reads占比均高于对比例3和对比例4,尤其是GC含量35%的hsa-miR-29b-3p,实施例10中的占比与对比例3有显著性差异,说明本发明的miRNA提取方法对低GC含量的miRNA的富集能力优于对比例3和对比例4中的商业化试剂盒。
实施例11
本实施例的步骤与实施例1大致相同,其不同在于:
步骤7替换为:
对miRNA进行完整性检测
通过Agilent 2100生物分析仪对提取的miRNA完整性进行检测。miRNA质检结果如图6~图11所示。
对比例5
本对比例采用实施例1步骤1中的样本,每个样本取200μL,采用商业化试剂盒1(QIAGEN miRNeasy Serum/Plasma Kit,货号:217184)进行RNA提取,提取步骤按照该试剂盒说明书进行。提取完成后miRNA的完整性检测根据实施例4步骤7进行。miRNA完整性检测结果如图12~图17所示。
对比例6
本对比例采用实施例1步骤1中的样本,每个样本取200μL,采用商业化试剂盒2(Norgen Biotek Plasma/Serum Circulating and Exosomal RNA Purification MiniKit(Slurry Format),货号:51000)进行RNA提取,提取步骤按照该试剂盒说明书进行。提取完成后miRNA的完整性检测根据实施例4步骤7进行。miRNA完整性检测结果如图18~图23所示。
从图6~图23中可知,各样本RIN值没有差异,说明按照本发明的RNA提取方法提取得到的miRNA完整性与商业化的试剂盒无差异。
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。应当理解的是,在本领域技术人员在本发明提供的技术方案的基础上,通过合乎逻辑的分析、推理或有限的试验得到的技术方案,均在本发明所附权利要求的保护范围内。因此,本发明专利的保护范围应以所附权利要求为准,说明书及附图可以用于解释权利要求的内容。
- RNA提取试剂盒及RNA提取方法
- 无DNA残留的RNA提取试剂盒及RNA提取方法
