水稻新生多肽结合复合体NACA基因启动子及其应用
文献发布时间:2024-04-18 19:58:26
技术领域
本发明属于植物基因工程技术领域,具体涉及一种来自于水稻新生多肽结合复合体NACA基因的启动子及其在植物遗传改良中的应用。
背景技术
水稻(Oryza sativa L)产生的稻米是重要的粮食。在人类发展过程中,水稻为全世界1/2人口贡献了食物。近段时间来伴随着全球生态环境问题的突出,各种地理因素限制生物生长导致了产量降低。由于水稻不能移动,不能像动物一样主动选择环境,因此在植物生长发育过程中,抗逆境胁迫有着特别重要的意义。抗非生物胁迫是植物在高温、低温冻害、高盐等不利于作物生长的非正常情况下能正常生长的抗性机制。在抗逆胁迫过程中,作物能否及时识别并作出相应反应,依赖于抗逆基因的正确表达。不利环境因子的影响导致作物产量降低,以高盐、干旱、低温对作物产量的影响最为突出。传统的育种方法改良作物耐受性,过程繁琐,周期长,不能满足生产需要。随着分子生物学的不断进步和发展,通过转基因技术手段过表达或沉默一些胁迫相关基因的表达为改良作物品种提供了有效手段。
在水稻抗非生物胁迫研究过程中,水稻新生多肽结合复合体(Nascentpolypeptide-associated complex alpha chain,NAC)是由α(NACA)和β(NACB/BTF)这2个亚基组成的异二聚体复合物。酵母和动物细胞中的研究表明,NACA在转录调控中起作用,能与辅激活类蛋白相互作用、激活骨钙素基因、正向调控人红细胞分化、调节肌发生等(刘永昌等,2022);在发育过程和逆境应答中,能够保护新生多肽,并引导新生多肽正确定位(李晓白,2013)。目前研究发现了NACB在生长发育、逆境胁迫影响等功能(王晓静等,2016)。前人对水稻NACA基因进行表达模式进行分析,发现不同的基因具有明显的组织和诱导表达模式,调控拟南芥对干旱和渗透胁迫的抗性。
启动子(Promoters)位于结构基因上游,是RNA聚合酶及转录因子结合并起始基因转录的一段DNA序列,也是调控基因表达时空特异性的重要元件。启动子中含有许多顺式作用元件,如增强子、沉默子和特殊启动子成分。其主要结构是核心启动子区域和上游启动子各种元件,启动子的核心区域序列是转录起始所需要的最短序列,上游启动子元件包括一些真核生物中普遍存在的元件,如CAAT-box和GC-box等这些元件依据不同的基因其位置、方向和拷贝数也是不同(李广旭等,2012;荣晶,2014)。启动子是影响基因表达效率的重要因子,内外源基因高水平表达需要高效的启动子。植物基因的启动子按其基因的表达方式分为组成型启动子、诱导型启动子和组织特异性启动子。其中,其中组成型启动子在植物的整个发育阶段均能稳定启动基因表达,不受外界环境诱导而发生剧烈变化;组织特异型启动子能够在特定的时期、特定的组织中启动基因的表达;诱导型启动子则能够根据不同的环境胁迫或激素刺激等诱导基因的表达,进而增强植物对不利环境条件的防御能力,保护植株的正常生理代谢和生长发育。因此,挖掘寻找合适的启动子,对解决植物逆境胁迫具有重要意义。
发明内容
本发明目的之一在于提供一种具有启动子活性的DNA分子。
本发明提供的DNA分子来源于粳稻品种‘日本晴’(Oryza saliua subsp keng),其核苷酸序列具体如序列表中SEQ ID NO.1所示;或其核苷酸序列与SEQ ID NO.1所示序列具有至少80%的一致性且其功能与SEQ ID NO.1所示序列相同。
本发明的目的之二在于提供含有所述DNA分子的生物材料,可以为下述A1)至A7)中的任一种:
A1)含有权利要求1所述DNA分子的表达盒;
A2)含有权利要求1所述DNA分子的重组载体;
A3)含有A1)所述表达盒的重组载体;
A4)含有权利要求1所述DNA分子的重组微生物;
A5)含有A1)所述表达盒的的重组微生物;
A6)含有A2)所述重组载体的重组微生物;
A7)含有A3)所述重组载体的重组微生物。
在上述生物材料中,所述表达盒可由所述DNA分子、所述DNA分子启动表达的目的基因,以及转录终止序列组成;所述DNA分子以功能性方式与所述目的基因连接,且所述目的基因与所述转录终止序列连接。在本发明的一个实施例中,所述目的基因具体为GUS基因。
所述重组载体可通过本领域常规方法将所述DNA分子或所述表达盒连接至表达载体中得到,且所用的表达载体可以是本领域常规的各种表达载体,只要所得重组载体可以在相应的表达宿主中正常复制并表达目的基因即可。且所述目的基因由所述DNA分子启动表达。
所述重组微生物可通过本领域常规方法将DNA分子或表达盒或重组载体转染至微生物细胞中得到。在本发明的一个实施例中,微生物具体为农杆菌EHAl05。
本发明的目的之三在于提供一个用于上述DNA分子的引物对,该引物对的核苷酸序列如SEQ ID NO.2~3所示;以水稻基因组为模板,利用该引物对通过PCR扩增方式即可获得本发明提供的启动子序列。
本发明的目的之四在于提供所述DNA分子在作为启动子中的应用。
在上述应用中,所述启动子可以为诱导型启动子。更进一步地,所述诱导型启动子为低温诱导型启动子或干旱诱导型启动子或盐胁迫诱导型启动子。
在上述应用中,所述启动子可以为组织特异型启动子。更进一步地,所述组织为叶片和/或花萼和/或根。
本发明的目的之五在于提供所述DNA分子在启动目的基因在植物表达中的应用。
本发明的目的之六在于提供所述DNA分子在培育转基因植物中的应用。
本发明的目的之六在于提供所述DNA分子在植物遗传改良中的应用。
在上述应用中,所述植物可以为双子叶植物或单子叶植物。
本发明的有益效果为:
本发明通过对NACA2启动子表达模式预测、分析,构建载体转化拟南芥,设计组织化学染色实验等手段,确认本发明提供的启动子具有组织特异性,能够使目的基因在叶的叶脉和花的萼片中表达;而且该启动子还能作为诱导型启动子,其启动子活性可被低温、干旱、盐诱导。本发明提供的启动子可用于植物的遗传改良,对作物抗逆育种具有重要意义。
附图说明
图1为本发明提供的启动子中各顺式作用元件的相应位置。
图2为实施例2中NACA2启动子重组载体的酶切鉴定结果图。
图3为实施例3中转化阳性植株的筛选结果,其中a为无抗性,b为有抗性。
图4为实施例4中转基因拟南芥不同组织的染色结果图,图中,a为莲座叶叶染色结果,b为花染色结果,c为茎生叶染色结果。
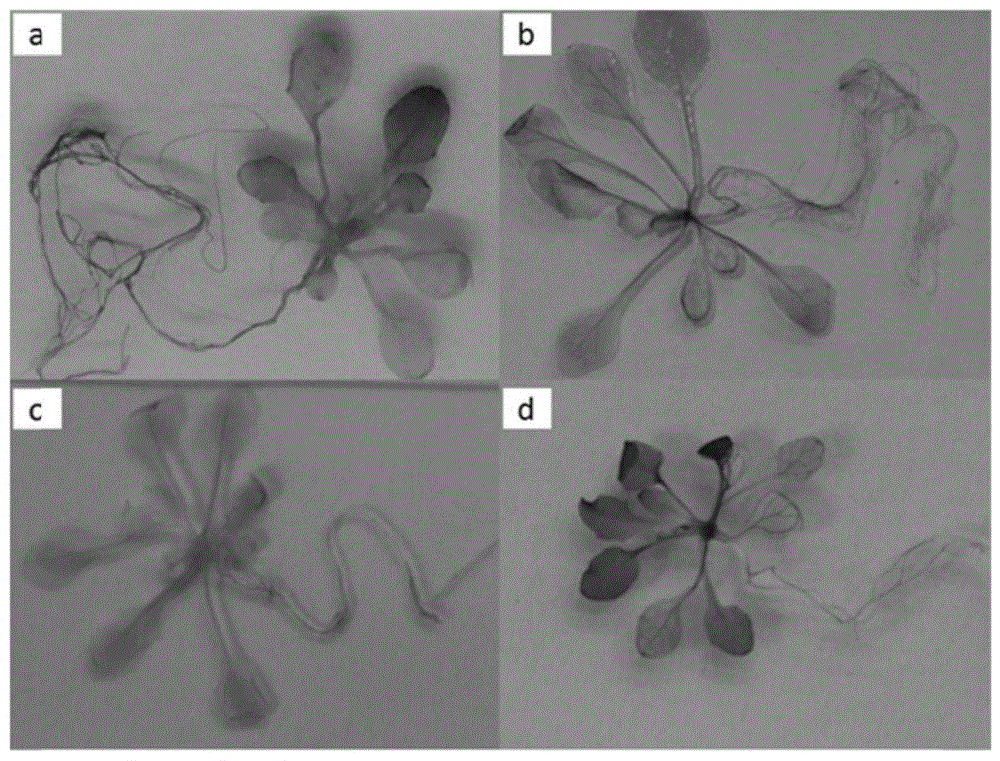
图5为实施例4中转基因拟南芥在不同胁迫处理下的染色结果图,图中,a为干旱处理,b为低温处理,c为高盐处理,d为未处理对照组。
具体实施方式
为了更好地理解本发明,下面结合具体实施例及其附图进一步阐明本发明的内容。应当理解的是,此处所描述的具体实施方式仅用于说明和解释本发明,并不用于限制本发明。
下述实施例中,若无特殊说明,均为常规方法;所述试剂和材料,若无特殊说明,均可从商业途径获得。
实施例1启动子的克隆和顺式作用元件分析
(1)水稻NACA2基因启动子序列克隆。
将粳稻品种‘日本晴’(Oryza saliua subsp keng)种子放置在30℃萌发4d,转移到25℃,光照12h/d条件下生长至4片叶子,取嫩叶提取基因组DNA,具体采用CTAB法提取且提取步骤如下:
①取0.1g“日本晴”水稻叶片,2mL的离心管中,加入600μL2%的CTAB,并加入钢珠进行研磨,然后置于65℃水浴30min;
②水浴后加入氯仿∶异戊醇(20∶1),剧烈振荡min后,12000rpm离心5-10min;
③离心后取上清液到1.5mL离心管中,加入400μL异丙醇,混匀,置于12000rpm离心10min;
④离心后倒掉上清液,加入500μL 75%的乙醇,12000rpm离心5min;
⑤离心后倒掉乙醇,在通风橱里晾干10-15min;
⑥加入ddH
在NCBI数据库(http://www.ncbi.nlm.nih.gov/)中获得NACA2(GenBank登录号Os03g02960.1)的基因组序列,根据其信息,查找NACA2基因起始密码子ATG上游1000bp的DNA序列设计引物,分别引入PstI(CTGCAG)和BamHI(GGATCC)酶切位点,所得引物的序列具体如下所示:
NACA2-F:5’-AA
NACA2-R:5’-CG
以水稻的基因组作为模板,利用上述引物对通过PCR反应体系得到NACA2启动子片段。其中,PCR反应程序具体为:
①预变性:95摄氏度,反应5分钟,促使DNA解旋为单链;
②变性:95摄氏度,反应30秒,促使模板DNA在高温条件下,DNA链的碱基之间的化学键断裂,形成单链的DNA;
③降温:55摄氏度,反应30秒,促使形成新的不完全的DNA链;
④合成:75摄氏度,反应30秒,在酶(耐热性的总减性硫酸酶)的作用下,以脱氧核糖核苷三磷酸为原料,最后形成新的完全的DNA链;步骤②、③循环30次。
⑤再合成:72℃,反应10分钟,让没有完全合成的DNA链继续合成;
⑥保温:16℃,反应30分钟,维持DNA的双链结构。
对PCR扩增产物回收后,连接至质粒并进行测序,其序列与预期一致,具体如SEQID NO.1所示。
(2)启动子顺式作用元件分析。
使用在线网站PlantCARE(http://bioinformatics.psb.plantcare/html/)预测得到的水稻NACA2基因启动子所含有的顺式作用元件。依据预测结果分析所含有的相关序列和顺式作用元件,并整理数据。
结果显示,顺式作用元件集中在NACA2基因起始位置约上游500bp,NACA2启动子序列中含有多个顺式作用元件且它们在序列中的相应位置如图1所示(背景色标识处为各顺式作用元件位点);而且,在NACA2基因上游200bp有较多的顺式作用元件有利于基因功能的正常表达。
分析结果还表明,在水稻叶片新生多肽结合复合体NACA2启动子序列中除了转录常见的TATA-box、CAAT-box、CGTCA-motif等保守序列区域外,同时存在一些感应环境胁迫有关的顺式作用元件:低温应答因子(LTR)、光(TCCC-motif、3-AF1 binding site、G-box等)、水分、激素应答相关序列等(如:脱落酸响应元件ABRE、赤霉素相应元件GARE-motif和茉莉酸相应元件CGTCA-motif)。在MYb响应元件核心序列CAACA相同又有微小差异最后一个碱基不同(C/G)、生长发育调节的元件、脱落酸应答因子ABRE也与MYb相似核心序列是ACGT剩下碱基有差异、植物激素应答因子GARE-motif、厌氧顺式作用元件ARE和参与防御和应激反应的顺式作用因素TC-rich repeats等。同时还有功能未知的As-1、Unnamed__4、Unnamed__1(见表1)。涉及光响应的顺式作用元件有5个核心序列:TCTCCCT、TAAGAGAGGAA、CACGAC/ACACGTGT/TACGTG/CACGTG/CACGTG;涉及脱落酸的响应元件有7个核心序列:GCCGCGTGGC/ACGTG/CACGTG、CACGTA、CACGTA以及厌氧、低温等响应元件。通过预测水稻NACA2启动子顺式作用元件推测启动子在非生物胁迫条件处理下可能启动相关基因表达。这些顺式作用元件的存在为水稻在逆境胁迫中能更好的适应环境并保证自身的生长发育提供物质条件。
表1水稻NACA2启动子的顺式作用元件序列及生物学功能
实施例2重组载体和重组微生物的构建
本例具体的构建过程如下:
以日本晴的基因组DNA为模板,通过PCR技术扩增NACA2启动子,然后连接到T载体pMD19-T。用PstI和BamH1酶切pMD19-T-PNACA2,利用琼脂糖凝胶电泳分离得到两条带:一条大小约为3250bp,和载体大小相同;第二条约为1000bp,和启动子相同(图2中A,M泳道所用Marker为D2000Plus,从上至下依次为5000、3000、2000、1000、750、500、250、100bp)。酶切正确的载体进行测序,得到NACA2启动子。用PstI和BamH1同时酶切pMD19-T-PNACA2和pCambia1300-221-GUS,琼脂糖凝胶电泳检测后回收NACA2启动子和pCambia1300-221片段,用T4 ligase,22℃连接过夜,即在pCambia1300中将35S启动子替换为NACA2启动子驱动GUS基因的表达。连接产物通过热激法转入大肠杆菌XL1-blue,扩繁目标载体pCambia1300-221-PNACA2,通过碱裂解法提取质粒。
为进一步保证实验准确性对双源载体pCambia1300-NACA2-GUS进行酶切验证,用PstI和BamH1酶切pCambia1300-221-PNACA2,37℃,1.5h,通过琼脂糖凝胶电泳检测酶切产物。通过琼脂糖凝胶电泳有三条带:1000和大于5000bp,最后一条为RNA杂带(图2中B,M泳道所用Marker为DL5000,从上至下依次为5000、3000、2000、1500、1000、750、500、250、100bp)。说明NACA2启动子载体构建成功。
将构建正确的pCambia1300-NACA2-GUS通过电激转化法转入农杆菌EHAl05,用于转化拟南芥。
实施例3转基因拟南芥的获得
将哥伦比亚野生型拟南芥(Arabidopsis thalianaA)种子用5%NaClO进行表面消毒10min,再用无菌水冲洗种子清洗4-5次。灭菌完成后,将拟南芥种子放入0.2%琼脂粉的培养基重悬,播种在1/2MS固体培养基(每500mL含有MS粉末2.2g、蔗糖20g和琼脂糖8g,121℃灭菌20min,倒平板,冷却后即得)。4℃低温冰箱诱导处理3d,放入合适光照和温度培养室进行培养以备后续实验。
通过实施例2得到的含有目的载体的农杆菌EHAl05转化野生型拟南芥,步骤如下:
采用沾花法,将拟南芥的花序放置在菌液中蘸取30-60s就可以满足(在开始转化实验前,需要把拟南芥的角果抹掉);
将拟南芥苗放到黑暗条件下、环境湿润中培养16h,然后光照培养。7天后,再进行一次重复操作;
在收集完种子以后,将T0代拟南芥种播种在含潮霉素的1/2MS培养基(MS盐4.74g˙L
实施例4转基因拟南芥的非生物胁迫处理
在获得的纯合植株后,将种子种植在1/2MS培养基上培养长出两片真叶,选取生长状态良好的转基因拟南芥进行不同因素处理:干旱、高盐,低温。
将幼苗取出,放入培养皿,加入液体1/2MS培养基预处理24h。一部分除去液体,进行干旱处理;一部分置于4℃,进行低温处理;一部分除去液体,加入150mM氯化钠的液体1/2MS培养基,进行高盐处理;一部分不进行处理,作为对照。处理4h后,进行组织化学染色。
为分析水稻NACA2的特异性表达模式,由NACA2驱动GUS基因表达的转基因拟南芥不同部位采用GUS组织化学染色。选取生长良好的拟南芥植株,取茎生叶、莲座叶和花进行组织化学染色。
其中,GUS组织化学染色方法的具体过程如下:
染色:利用无菌水把材料漂洗干净放置在1.5mL离心小管中加入1mL染色液(X-Gluc∶溶解液=1∶50),37℃染色10-15h。
洗脱:用70%乙醇进行洗脱,直至无色。
观察:用体式镜进行观察拍照。
由染色结果可知,在对正常生长的植株染色发现,GUS基因在莲座叶中叶脉表达量高,茎生叶中表达量也主要集中在叶脉中,在花当中表达量较低仅在萼片上有表达(图4)。在不同胁迫处理下的转基因拟南芥染色后显色程度不一样,说明在不同胁迫条件处理下,GUS表达量有所差异,主要在叶片中表达。在对转基因拟南芥进行干旱、高盐、低温处理后,染色发现,GUS基因在地上部分的表达量为未处理>干旱>低温>高盐,表现为降低目标基因的表达,但胁迫处理后GUS在根中出现了表达,在干旱处理后根中表达量最高(图5)。GUS基因在干旱诱导的表达量最高,其次低温诱导,高盐诱导GUS基因在根中的表达较低。
从本例的几组实验对比可知,成年植株的叶片中GUS基因主要在叶脉中表达,在花花冠中少量表达;胁迫处理后,幼苗的GUS基因在叶脉和叶肉中表达,但为下调表达;根中为上调表达,干旱条件处理后GUS基因表达量最高。实验结果表明,水稻NACA2启动子为干旱、低温诱导的特异启动子。
综上所述,本发明提供的水稻新生多肽结合复合体NACA2启动子序列全长有1000bp,其序列如SEQ ID NO.1所示;对NACA2启动子的顺式作用元件进行分析后,发现其包含:2类光响应元件TCCC-motif和3-AF1 binding site,相关植物激素表达的响应元件(与赤霉素响应有关元件GARE-motif、脱落酸相关元件ABRE),抗逆胁迫相关元件类(包括防御和应激反应TC-rich repeats、低温诱导的LTR作用元件、抗逆响应元件TC-rich repeats、厌氧感应反应相关元件ARE等)等,表明NACA2启动子在植物的生长发育和抗逆方面具有重要意义。
本发明进一步构建了植物表达载体pCambia1300-221-PNACA2,并采用农杆菌介导获得转PNACA2-GUS转基因拟南芥,对其进行非生物胁迫处理后,采用GUS化学组织染色分析NACA2启动子的表达模式。实验表明,水稻NACA2启动子为干旱、低温、高盐诱导的特异启动子,而且NACA2启动子在不同因素处理拟南芥中的表达活性存在差异,且该启动子可以驱动下游基因在叶脉中优势表达。
另外,NACA2启动子中存在与脱落酸、赤霉素和茉莉酸响应有关的顺式作用元件,推测该启动子在逆境调节过程中还涉及到各类生长激素的调控。
以上所述是本发明的优选实施方式,不能以此来限定本发明之权利范围,应当指出,对于本技术领域的普通技术人员来说,凡在本发明的精神和原则之内所做的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
- 一种水稻新生多肽结合复合体α亚基NACA基因在植物抗渗透胁迫中的应用
- 水稻几丁质激发子结合基因启动子及其应用
