作为激酶抑制剂的杂环酰胺
文献发布时间:2023-06-19 09:54:18
本申请是申请日为2016年5月19日,申请号为201680029135.8(PCT申请号为PCT/IB2016/052948),发明名称为:“作为激酶抑制剂的杂环酰胺”的中国发明专利申请的分案申请。
技术领域
本发明涉及抑制RIP1激酶的杂环酰胺及其制备和使用方法。
背景技术
受体相互作用蛋白1(RIP1)激酶,最初被称为RIP,其是一种涉及先天免疫信号传导的TKL家族丝氨酸/苏氨酸蛋白激酶。RIP1激酶是一种包含蛋白的RHIM结构域,其具有N端激酶结构域和C端死亡结构域((2005)Trends Biochem.Sci.30,151-159)。RIP1死亡结构域介导与其他包含死亡结构域的蛋白的相互作用,所述蛋白包括Fas和TNFR-1((1995)Cell81 513-523),TRAIL-R1和TRAIL-R2((1997)Immunity 7,821-830)和TRADD((1996)Immunity 4,387-396),而RHIM结构域对结合其他包含RHIM结构域的蛋白非常关键,所述蛋白如TRIF((2004)Nat Immunol.5,503-507),DAI((2009)EMBO Rep.10,916-922)和RIP3((1999)J.Biol.Chem.274,16871-16875),(1999)Curr.Biol.9,539-542),并通过这些相互作用实现其众多作用。RIP1是一种细胞信号传导的中心调节剂,其参与介导促存活和程序性细胞死亡通路二者,详细讨论如下。
RIP1在细胞信号传导中的作用已经在不同条件下进行了评估[包括TLR3((2004)Nat Immunol.5,503-507),TLR4((2005)J.Biol.Chem.280,36560-36566),TRAIL(CellSignal.2015 Feb;27(2):306-14),FAS((2004)J.Biol.Chem.279,7925-7933)],但是在死亡受体TNFR1下游介导信号中能够获得最佳理解((2003)Cell 114,181-190)。通过TNF实现TNFR衔接,导致低聚反应,将多种蛋白,包括线性K63连接的多泛素化RIP1((2006)Mol.Cell22,245-257),TRAF2/5((2010)J.Mol.Biol.396,528-539),TRADD((2008)Nat.Immunol.9,1037-1046)和cIAPs((2008)Proc.Natl.Acad.Sci.USA.105,11778-11783),募集至受体的胞质尾区。依赖于RIP1的这种复合物作为支架蛋白(即非激酶依赖性),称作复合物I,它通过激活NFκB和MAP激酶通路为促存活信号传导提供了一个平台((2010)Sci.Signal.115,re4)。另外,在促进RIP1脱泛素的条件下,TNF与其受体结合(通过例如A20和CYLD蛋白或cIAP抑制),将导致受体内化和复合物II或DISC(死亡诱导信号复合物)的形成((2011)CellDeath Dis.2,e230)。DISC(包括RIP1、TRADD、FADD和半胱天冬酶8)的形成,导致半胱天冬酶8的激活,还以非RIP1激酶依赖性方式开始程序性凋亡细胞死亡((2012)FEBS J 278,877-887)。细胞凋亡很大程度上是一种静止形式的细胞死亡,其参与例如发育和细胞体内稳态等常规过程。
在DISC形成和RIP3表达,但是细胞凋亡被抑制的条件下(如FADD/半胱天冬酶8缺失、半胱天冬酶抑制或病毒感染),就可能存在第三种RIP1激酶依赖性。现在,RIP3可以进入这种复合物,通过RIP1实现磷酸化,通过MLKL和PGAM5激活开始不依赖半胱天冬酶的程序性坏死细胞凋亡((2012)Cell 148,213-227);((2012)Cell 148,228-243);((2012)Proc.Natl.Acad.Sci.USA.109,5322-5327)。与细胞凋亡相反,程序性坏死(不要与非程序性被动坏死混淆)导致从细胞释放危险相关分子模式(DAMP)。这些DAMP能够向周围细胞和组织提供一种“危险信号”,诱发促炎反应,包括炎性体激活、细胞因子生成和细胞募集反应((2008 Nat.Rev.Immunol 8,279-289)。
通过使用RIP3基因敲除小鼠(其中RIP1介导的程序性坏死被完全阻断)和Necrostatin-1(一种具有较差的口服生物利用度的RIP1激酶活性的工具抑制剂)已经证明,RIP1激酶介导的程序性细胞死亡的调节异常与各种炎症有关。RIP3敲除小鼠已经显示对炎性肠病(包括溃疡性结肠炎和克罗恩氏病)((2011)Nature 477,330-334),银屑病((2011)Immunity 35,572-582),视网膜脱离诱导的感光细胞坏死((2010)PNAS 107,21695-21700),色素性视网膜炎((2012)Proc.Natl.Acad.Sci.,109:36,14598–14603),蛙皮素诱导的急性胰腺炎((2009)Cell 137,1100-1111)和败血症/全身炎症反应综合症(SIRS)((2011)Immunity 35,908-918)具有保护作用。已经显示Necrostatin-1能有效缓解缺血性脑损伤((2005)Nat.Chem.Biol.1,112-119),视网膜缺血/再灌注损伤((2010)J.Neurosci.Res.88,1569-1576),亨廷顿氏病((2011)Cell Death Dis.2e115),肾缺血再灌注损伤((2012)Kidney Int.81,751-761),顺铂诱导的肾损伤((2012)Ren.Fail.34,373-377)和创伤性脑损伤((2012)Neurochem.Res.37,1849-1858)。至少部分由RIP1依赖性细胞凋亡、坏死或细胞因子生成调节的其他疾病或病症包括,血液和实体器官恶性肿瘤((2013)Genes Dev.27:1640-1649),细菌感染和病毒感染((2014)Cell Host&Microbe 15,23–35)(包括但不限于结核病和流感((2013)Cell 153,1–14)))和溶酶体贮积症(尤其是戈谢病,Nature Medicine Advance Online Publication,2014年1月19日,doi:10.1038/nm.3449)。
一种有效的、选择性的、小分子的RIP1激酶活性抑制剂,能够阻断RIP1依赖性细胞坏死,从而能够为与DAMP、细胞死亡和/或炎症有关的疾病或事件提供治疗效果。
发明内容
本发明涉及根据式(I)的化合物或其盐,具体为药学上可接受的盐,
其中:
R
其中所述取代的(C
其中所述任选取代的(C
所述取代的(C
其中所述苯基、5-6元杂芳基或者9-元杂芳基任选被1个或者2个取代基取代,所述取代基独立地选自卤素、(C
R
其中所述取代的苯基、(C
R
条件是所述化合物不为环己基(5-苯基-4,5-二氢-1H-吡唑-1-基)甲酮。
根据式(I)的化合物或其盐(具体为药学上可接受的盐)抑制RIP1激酶的活性和/或功能。因此,这些化合物可具体地用于治疗RIP1激酶介导的疾病或者障碍。这种RIP1激酶介导的疾病或者障碍是由RIP1激酶的活化介导的疾病或者障碍,并因此是这样的疾病或者障碍:其中RIP1激酶的抑制会提供益处。
具体地,抑制RIP1激酶的活性和/或功能的式(I)化合物具有式(II)中所指定的立体化学:
其中R
在*手性碳中心处具有(R)立体化学的式(I)化合物(通常,如基于本文中提供的R
本发明还涉及根据式(III)的化合物或其盐,具体为药学上可接受的盐,
其中:
R
其中所述取代的(C
其中所述任选取代的(C
所述取代的(C
其中所述苯基、5-6元杂芳基或者9-元杂芳基任选被1个或者2个取代基取代,所述取代基独立地选自卤素、(C
R
其中所述取代的苯基、(C
R
其用于治疗。
附图说明
图1A显示了在口服预先给药实施例13化合物或者媒介物,然后同时静脉内给药小鼠TNF和zVAD之后小鼠随时间推移的温度损失。
图1B显示了在口服预先给药实施例13化合物或者媒介物,然后同时静脉内给药小鼠TNF和zVAD之后2.5小时小鼠的温度损失。
图2A显示了在口服预先给药实施例193化合物或者媒介物,然后同时静脉内给药小鼠TNF和zVAD之后小鼠随时间推移的温度损失。
图2B显示了在口服预先给药实施例193化合物或者媒介物,然后同时静脉内给药小鼠TNF和zVAD之后3小时小鼠的温度损失。
图3A显示了在口服预先给药实施例203化合物或者媒介物,然后同时静脉内给药小鼠TNF和zVAD之后小鼠随时间推移的温度损失。
图3B显示了在口服预先给药实施例203化合物或者媒介物,然后同时静脉内给药小鼠TNF和zVAD之后2.5小时小鼠的温度损失。
图4A显示了在口服预先给药实施例203化合物或者媒介物,然后静脉内给药小鼠TNF之后小鼠随时间推移的温度损失。
图4B显示了在口服预先给药实施例203化合物或者媒介物,然后静脉内给药小鼠TNF之后7.5小时小鼠的温度损失。
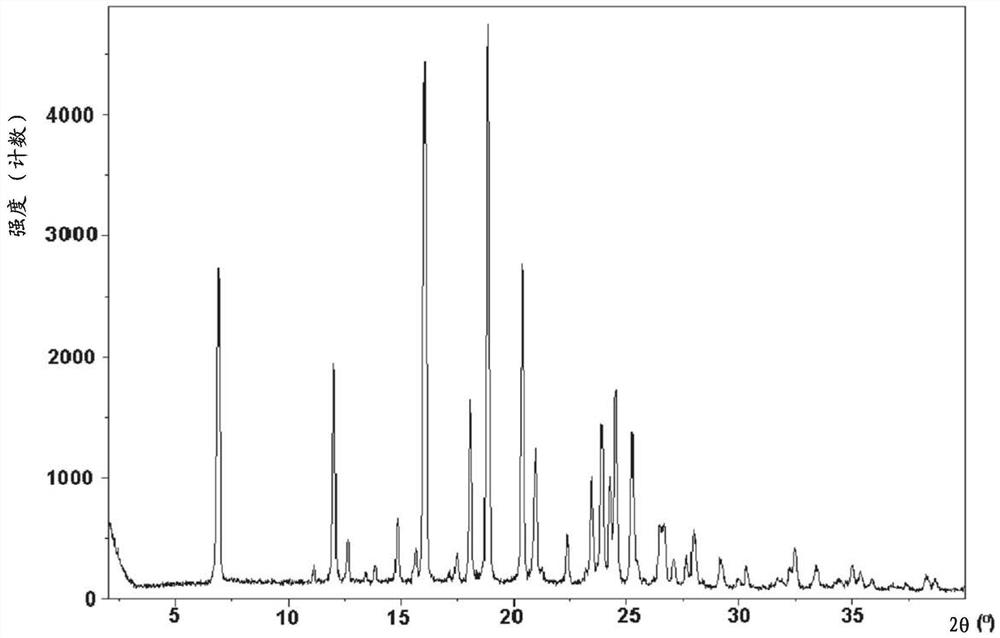
图5为(S)-1-(4-(5-(3,5-二氟苯基)-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)乙酮的结晶形式的粉末x-射线衍射(PXRD)图。
具体实施方式
在一个实施方案中,本发明还涉及根据式(I)的化合物或其盐,具体为药学上可接受的盐,其中:
R
其中所述取代的(C
所述取代的(C
R
其中所述取代的苯基、(C
R
条件是所述化合物不为环己基(5-苯基-4,5-二氢-1H-吡唑-1-基)甲酮。
在另一实施方案中,R
其中所述取代的(C
所述取代的(C
R
本发明还涉及根据式(III)的化合物或其盐,具体为药学上可接受的盐,其中:
R
其中所述取代的(C
所述取代的(C
R
其中所述取代的苯基、(C
R
本发明还涉及根据式(III)的化合物或其盐,具体为药学上可接受的盐,其中:
R
其中所述取代的(C
所述取代的(C
R
R
本发明还涉及根据式(III)的化合物或其盐,具体为药学上可接受的盐,其中:
R
其中所述取代的(C
所述取代的(C
R
其中所述取代的苯基、(C
R
在一个实施方案中,式(III)化合物不包括环己基(5-苯基-4,5-二氢-1H-吡唑-1-基)甲酮,或其盐。
在另一实施方案中,式(III)化合物不包括以下化合物:
(4,5-二氢-5-苯基-1H-吡唑-1-基)-3-吡啶基-甲酮,
[4,5-二氢-5-(2-甲氧基苯基)-1H-吡唑-1-基]-3-吡啶基-甲酮,
(4,5-二氢-5-苯基-1H-吡唑-1-基)-2-呋喃基-甲酮,
[5-(2-呋喃基)-4,5-二氢-1H-吡唑-1-基]-3-吡啶基-甲酮,
(4,5-二氢-5-苯基-1H-吡唑-1-基)-苯基-甲酮,
(4,5-二氢-5-苯基-1H-吡唑-1-基)-4-吡啶基-甲酮,
(4,5-二氢-5-苯基-1H-吡唑-1-基)-2-吡啶基-甲酮,
[4,5-二氢-5-(3-甲氧基苯基)-1H-吡唑-1-基]-3-吡啶基-甲酮,
[4,5-二氢-5-(4-甲氧基苯基)-1H-吡唑-1-基]-3-吡啶基-甲酮,
(4,5-二氢-5-苯基-1H-吡唑-1-基)-2-吡嗪基-甲酮,
[5-(2-氟苯基)-4,5-二氢-1H-吡唑-1-基]-3-吡啶基-甲酮,
[4,5-二氢-5-(2-甲基苯基)-1H-吡唑-1-基]-3-吡啶基-甲酮,
[5-(4-氯苯基)-4,5-二氢-1H-吡唑-1-基]-3-吡啶基-甲酮,
[4,5-二氢-5-(3-甲基苯基)-1H-吡唑-1-基]-3-吡啶基-甲酮,
[4,5-二氢-5-(4-甲基苯基)-1H-吡唑-1-基]-3-吡啶基-甲酮,
[5-(2-氯苯基)-4,5-二氢-1H-吡唑-1-基]-3-吡啶基-甲酮,
[4,5-二氢-5-(3-吡啶基)-1H-吡唑-1-基]-3-吡啶基-甲酮,
(4,5-二氢-5-苯基-1H-吡唑-1-基)[4-(三氟甲基)苯基]-甲酮,和
(4,5-二氢-5-苯基-1H-吡唑-1-基)-2-噻吩基-甲酮,
或其盐。
在另一实施方案中,式(III)化合物不包括以下化合物:
[5-(2-氯苯基)-4,5-二氢-3-甲基-1H-吡唑-1-基]-3-吡啶基-甲酮,
[5-(2-氯苯基)-4,5-二氢-3-甲基-1H-吡唑-1-基](2-氟苯基)-甲酮,
[5-(2-氯苯基)-4,5-二氢-3-甲基-1H-吡唑-1-基][4-(三氟甲基)苯基]-甲酮,
1-[5-(2-氯苯基)-4,5-二氢-3-甲基-1H-吡唑-1-基]-1-己酮,
1-[5-(2-氯苯基)-4,5-二氢-3-甲基-1H-吡唑-1-基]-1-丁酮,
1-[5-(2-氯苯基)-4,5-二氢-3-甲基-1H-吡唑-1-基]-1-丙酮,
[5-(2,4-二氯苯基)-4,5-二氢-3-甲基-1H-吡唑-1-基]-3-吡啶基-甲酮,
[5-(2,4-二氯苯基)-4,5-二氢-3-甲基-1H-吡唑-1-基](2-氟苯基)-甲酮,
[5-(2,4-二氯苯基)-4,5-二氢-3-甲基-1H-吡唑-1-基][4-(三氟甲基)苯基]-甲酮,
1-[5-(2,4-二氯苯基)-4,5-二氢-3-甲基-1H-吡唑-1-基]-1-戊酮,
1-[5-(2,4-二氯苯基)-4,5-二氢-3-甲基-1H-吡唑-1-基]-1-丁酮,
1-[5-(2,4-二氯苯基)-4,5-二氢-3-甲基-1H-吡唑-1-基]-1-丙酮,
[4,5-二氢-3-甲基-5-(4-甲基苯基)-1H-吡唑-1-基]苯基-甲酮,
(4,5-二氢-3-甲基-5-苯基-1H吡唑-1-基)-4-吡啶基-甲酮,和
[5-(2-呋喃基)-4,5-二氢-3-甲基-1H-吡唑-1-基]苯基-甲酮,
或其盐。
在另一实施方案中,式(III)化合物不包括以下化合物:
(4,5-二氢-3-甲基-5-苯基-1H吡唑-1-基)苯基-甲酮,
1-[(5S)-4,5-二氢-3-甲基-5-苯基-1H-吡唑-1-基]-3-苯基-1-丙酮,
[4,5-二氢-5-(2-羟基-3-甲基苯基)-3-甲基-1H-吡唑-1-基]苯基-甲酮,
(2-氯苯基)[4,5-二氢-5-(2-羟基苯基)-3-甲基-1H-吡唑-1-基]-甲酮,
[4,5-二氢-5-(2-羟基苯基)-3-甲基-1H-吡唑-1-基](2-甲基苯基)-甲酮,
[4,5-二氢-5-(2-羟基苯基)-3-甲基-1H-吡唑-1-基](4-甲基苯基)-甲酮,
[4,5-二氢-5-(2-羟基苯基)-3-甲基-1H-吡唑-1-基]苯基-甲酮,
[2,5-二氢-5-(1H-吲哚-3-基)-3-甲基-1H-吡唑-1-基]-4-吡啶基-甲酮,和
[2,5-二氢-5-(1H-吲哚-3-基)-3-甲基-1H-吡唑-1-基]-3-吡啶基-甲酮,
或其盐。
本文所用术语“烷基”表示具有指定数目碳原子的饱和的、直链或支链烃基。所述术语"(C
当取代基术语如"烷基"与另一取代基术语组合使用时,例如在“(C
术语“卤代(C
"烯基"指的是具有至少1个和最多3个碳-碳双键的直链或支链烃基。实例包括乙烯基和丙烯基。
"烷氧基”指的是"烷基-氧基-”基团,其含有通过氧连接原子结合的烷基部分。例如术语"(C
术语“卤代(C
碳环基是其中所有的环成员都是碳原子的环状基团,其可为饱和的、部分不饱和的(非芳香的)或完全不饱和的(芳香的)。术语"碳环的"包括环烷基和芳基。
“环烷基”表示含有指定数目碳原子的非芳香的、饱和的、环状的烃基。例如,术语“(C
术语“环烷基氧基”或“环烷氧基”指的是含有通过氧连接原子结合的如上所定义的环烷基部分的基团。“(C
“芳基”表示包含芳香的单环或双环烃原子团的基团或部分,其含有6到10个碳环原子且具有至少一个芳香环。“芳基”的实例为苯基、萘基、茚基和二氢茚基(茚满基)。通常,芳基为苯基。
所述术语"9-10元碳环-芳基"是指二环基团或者部分,具体地包含与5-6元饱和的或者部分饱和的碳环部分稠合的苯基部分。"9-10元碳环-芳基"基团的实例包括二氢茚基(茚满基)和四氢萘基。
杂环基为具有至少两种不同元素的原子作为环成员的环状基团,其中该环状基团可为饱和的、部分不饱和的(非芳香的)或完全不饱和的(芳香的)。
"杂环烷基"是指含有3-10个环原子的非芳族的单环或者二环基团,其为饱和的并且含有一个或者多个(通常一个或者两个)环杂原子,所述杂原子独立地选自氧、硫,和氮。“杂环烷基”基团的实例包括但不限于氮杂环丙烷基、硫杂环丙烷基、氧杂环丙烷基、氮杂环丁烷基、氧杂环丁烷基、硫杂环丁烷基、吡咯烷基、四氢呋喃基、四氢噻吩基、哌啶基、哌嗪基、四氢吡喃基、四氢噻喃基、1,4-二噁烷基、1,4-氧硫杂环戊烷基、1,4-氧硫杂环己烷基、1,4-二噻烷基、吗啉基,和硫吗啉基。
“4元杂环烷基”基团的实例包括氧杂环丁烷基、硫杂环丁烷基和氮杂环丁烷基。
术语"5-6-元杂环烷基"表示含有5或6个环原子的非芳香的单环基团,其为完全饱和的,且其含有一个或两个独立地选自氧、硫和氮的杂原子。5至6-元杂环烷基的示例性实例包括但不限于吡咯烷基、哌啶基、哌嗪基、四氢呋喃基、四氢噻吩基、四氢吡喃基、四氢噻喃基、吗啉基和硫吗啉基。
"杂芳基"表示包含芳香的单环或双环原子团(其含有5到10个环原子)的基团或部分,其包括1到4个独立地选自氮、氧和硫的杂原子。该术语还包括双环杂环芳基,其中含有与杂环烷基环部分稠合的芳基环部分,或者含有与环烷基环部分稠合的杂芳基环部分。
杂芳基的示例性实例包括但不限于呋喃基、噻吩基、吡咯基、咪唑基、吡唑基、三唑基、四唑基、噻唑基、噁唑基、异噁唑基、噁二唑基、噻二唑基、异噻唑基、吡啶基、氧代-吡啶基(吡啶基-N-氧化物)、哒嗪基、吡嗪基、嘧啶基、三嗪基、苯并呋喃基、异苯并呋喃基、2,3-二氢苯并呋喃基、1,3-苯并二氧杂环戊烯基、二氢苯并二氧杂环己烯基、苯并噻吩基、吲嗪基、吲哚基、异吲哚基、二氢吲哚基、苯并咪唑基、二氢苯并咪唑基、苯并噁唑基、二氢苯并噁唑基、苯并噻唑基、苯并异噻唑基、二氢苯并异噻唑基、吲唑基、咪唑并吡啶基、吡唑并吡啶基、苯并三唑基、三唑并吡啶基、嘌呤基、喹啉基、四氢喹啉基、异喹啉基、四氢异喹啉基、喹喔啉基、噌啉基、酞嗪基、喹唑啉基、1,5-二氮杂萘基、1,6-二氮杂萘基、1,7-二氮杂萘基、1,8-二氮杂萘基和蝶啶基。
所述术语"9-10元杂环-芳基"是指二环基团或者部分,其具体地包含与5-6元饱和的或者部分饱和的杂环状部分稠合的苯基部分。"9-10元杂环-芳基"基团的实例包括2,3-二氢苯并呋喃基(二氢苯并呋喃基)、2,3-二氢苯并噻吩基、1,3-苯并二氧杂环戊烯基、二氢苯并二氧杂环己烯基(二氢-1,4-苯并二氧杂环己烯基)、二氢吲哚基、四氢喹啉基,和四氢异喹啉基。
本文所用术语"5-6-元杂芳基"表示包含5或6个环原子的芳香的单环基团,其包括至少一个碳原子和1到4个独立地选自氮、氧和硫的杂原子。所选的5-元杂芳基含有一个氮、氧或硫环杂原子,并且其任选含有1、2或3个另外的氮环原子。所选的6-元杂芳基含有1、2或3个氮环杂原子。5-元杂芳基的实例包括呋喃基、噻吩基、吡咯基、咪唑基、吡唑基、三唑基、四唑基、噻唑基、异噻唑基、噻二唑基、噁唑基、异噁唑基、噁二唑基和氧代-噁二唑基。所选的6-元杂芳基包括吡啶基、氧代-吡啶基、吡嗪基、嘧啶基、哒嗪基和三嗪基。
二环杂芳基包括6,5-稠合的杂芳基(9-元杂芳基)和6,6-稠合的杂芳基(10-元杂芳基)。6,5-稠合的杂芳基(9-元杂芳基)的实例包括苯并噻吩基、苯并呋喃基、吲哚基、二氢吲哚基、异吲哚基、异二氢吲哚基、吲唑基、中氮茚基、异苯并呋喃基、2,3-二氢苯并呋喃基、苯并-1,3-二氧戊环基、苯并噁唑基、苯并噻唑基、苯并咪唑基、苯并噁二唑基、苯并噻二唑基、苯并三唑基、嘌呤基和咪唑并吡啶基。
除非另外说明,所有的双环体系可在任一环的合适位置相连。
术语“卤素”和“卤”表示氯、氟、溴或碘取代基。“氧代”表示双键的氧部分;例如,如果直接连接到碳原子上形成一个羰基部分(C=O)。“羟基”(Hydroxy或hydroxyl)旨在表示-OH原子团。本文所用术语“氰基”是指基团-CN。
本文所用术语“任选取代的”表示基团(例如烷基、环烷基、烷氧基、杂环烷基、芳基或杂芳基基团)或环或部分(例如碳环或杂环的环或部分)可不被取代,或所述基团、环或部分可被一个或多个所定义的取代基取代。在其中基团可选自许多替代性基团的情况下,该所选的基团可以相同或不同。
术语“独立地”是指当一个以上的取代基选自许多可能的取代基时,那些取代基可以相同或不同。
术语“药学上可接受的”是指那些化合物、物质、组合物和剂型,其在合理的医学判断范围内,适用于与人类和动物组织接触而没有过度的毒性、刺激,或其他的问题或并发症,与合理的利益/风险比相称。
本发明化合物含有一个或多个不对称中心(也称为手性中心),例如手性碳或手性–SO–部分。存在于本发明化合物中的手性碳的立体化学通常在本申请所述的化学名称和/或化学结构中表示。含有一个或多个手性中心的本发明化合物可以以外消旋混合物、非对映异构体混合物、对映异构体富集的混合物、非对映异构体富集的混合物、或对映异构体纯或非对映异构体纯的单独立体异构体存在。
在存在于本发明化合物中的手性碳中心的立体化学没有表示在化合物名称中或者在伴随的化学结构中的情况下,应理解的是,化合物作为对映异构体或者非对映异构体的混合物存在。应理解的是,本领域技术人员能够使用本文中所述的拆分技术或者使用其它常规拆分技术得到本文中所述的任何立体异构化合物混合物的(R)或者(S)异构体。
可使用本领域技术人员已知的方法拆分本文中所述的单独的异构体(或异构体富集的混合物)。例如,可如下进行所述拆分:(1)通过形成非对映异构体盐、复合物或其他衍生物;(2)通过与立体异构体特异性试剂的选择性反应,例如通过酶促氧化或还原;或(3)通过在手性环境中的气-液色谱或液相色谱,所述手性环境例如在手性载体上(例如结合有手性配体的硅胶)或在手性溶剂存在下。本领域技术人员将会理解,当将所需立体异构体通过上述分离方法之一转化成另一化学实体时,需要其他步骤来释放所需形式。或者,特异性立体异构体可通过使用光学活性试剂、底物、催化剂或溶剂的不对称合成法来合成,或通过不对称转化将一种对映异构体转化成另一种异构体。
在整个说明书中所提供的式(I)、(II)和/或(III)的各种基团和取代基的可选定义旨在个别地具体描述在本文中公开的各化合物物质,以及一种或多种化合物物质的组。本发明的范围包括这些基团和取代基定义的任一组合。本发明的化合物仅为那些本领域技术人员认为“化学稳定”的化合物。
本文所用术语“本发明化合物”或“该发明化合物”表示本申请所定义的式(I)、(II)和/或(III)化合物,其为任何形式,即,任何盐或非盐形式(例如游离酸或碱的形式,或其盐的形式,尤其是药学上可接受的盐)以及其任一物理形式(例如包括非固体形式(例如液体或半固体形式),以及固体形式(例如无定形或晶体形式,尤其是多晶型,溶剂化物形式,包括水合物形式(例如单水合物、二水合物和半水合物)),以及各种形式的混合物。
因此,本发明包括本申请所定义的式(I)、(II)和/或(III)化合物,其为任何盐或非盐形式以及其任一物理形式,以及各种形式的混合物。当本发明包括该化合物时,应当理解的是,本申请所定义的式(I)、(II)和/或(III)化合物(其为任何盐或非盐形式以及其任一物理形式)可根据制剂的目的,具有不同水平的活性、不同的生物利用度和不同的操作性能。
在式(I)、(II),和(III)化合物的实施方案中,R
其中所述取代的(C
其中所述任选取代的(C
所述取代的(C
在式(I)、(II),和(III)化合物的实施方案中,R
其中所述取代的(C
其中所述取代的5-6元杂环烷基被1、2或者3个取代基取代,所述取代基独立地选自羟基、(苄基氧基)羰基)氨基、氰基、卤素、(C
其中所述任选取代的(C
所述取代的(C
在另一实施方案中,R
其中所述取代的(C
所述取代的(C
在式(I)、(II),和(III)化合物的一个实施方案中,R
在式(I)、(II),和(III)化合物的一个实施方案中,R
在式(I)、(II),和(III)化合物的其它实施方案中,R
在式(I)、(II),和(III)化合物的其它实施方案中,R
在式(I)、(II),和(III)化合物的一个实施方案中,R
在其它实施方案中,R
在其它实施方案中,R
在其它实施方案中,R
在式(I)、(II),和(III)化合物的一个实施方案中,R
在另一实施方案中,R
在另一实施方案中,当R
在另一实施方案中,当R
在另一实施方案中,当R
在另一实施方案中,R
在另一实施方案中,R
在另一实施方案中,R
在具体实施方案中,R
在具体实施方案中,R
其中所述取代的哌啶-4-基进一步被以下基团取代:卤素或者(C
在具体实施方案中,R
在式(I)、(II),和(III)化合物的又一实施方案中,R
具体地,R
在式(I)、(II),和(III)化合物的又一实施方案中,R
在式(I)、(II),和(III)化合物的另一实施方案中,当R
在式(I)、(II),和(III)化合物的另一实施方案中,当R
在式(I)、(II),和(III)化合物的另一实施方案中,R
在式(I)、(II),和(III)化合物的另一实施方案中,R
在式(I)、(II),和(III)化合物的另一实施方案中,R
在式(I)、(II),和(III)化合物的另一实施方案中,R
在式(I)、(II),和(III)化合物的另一实施方案中,R
在式(I)、(II),和(III)化合物的另一实施方案中,R
在另一实施方案中,R
在另一实施方案中,R
在另一实施方案中,R
在式(I)、(II),和(III)化合物的一个实施方案中,R
在式(I)、(II),和(III)化合物的一个实施方案中,R
在更具体的实施方案中,R
在其它更具体的实施方案中,R
在式(III)化合物的一个实施方案中,R
在式(III)化合物的另一实施方案中,R
在式(III)化合物的其它实施方案中,R
在式(I)、(II),和(III)化合物的一个实施方案中,R
其中所述取代的苯基、(C
在另一实施方案中,R
其中所述取代的苯基、(C
在式(I)、(II),和(III)化合物的另一实施方案中,R
其中所述取代的苯基、(C
在另一实施方案中,R
在另一实施方案中,R
在另一实施方案中,R
在另一实施方案中,R
在具体实施方案中,当R
在式(I)、(II),和(III)化合物的一个实施方案中,R
在另一实施方案中,R
在另一实施方案中,R
在具体实施方案中,R
在具体实施方案中,R
在式(I)、(II),和(III)化合物的一个实施方案中,R
在式(I)、(II),和(III)化合物的一个实施方案中,R
在另一实施方案中,R
在式(I)、(II),和(III)化合物的另一实施方案中,R
在另一实施方案中,R
在另一实施方案中,R
在具体实施方案中,R
在选择的实施方案中,R
在式(I)、(II),和(III)化合物的另一实施方案中,R
在式(I)、(II),和(III)化合物的另一实施方案中,R
在式(I)、(II),和(III)化合物的另一实施方案中,R
在式(III)化合物的选择的实施方案中,R
在又一实施方案中,本发明涉及根据式(I)、(II),或者(III)的化合物,其中R
在又一实施方案中,本发明涉及根据式(I)、(II),或者(III)的化合物,其中R
在又一实施方案中,本发明涉及根据式(I)、(II),或者(III)的化合物,其中R
在又一实施方案中,本发明涉及根据式(I)、(II),或者(III)的化合物,其中R
在又一实施方案中,本发明涉及根据式(I)、(II),或者(III)的化合物,其中R
应理解的是,本发明涵盖式(I)、(II),或者(III)化合物,其作为游离碱和作为其盐,例如作为其药学上可接受的盐。在一个实施方案中,本发明涉及呈游离碱形式的式(I)、(II),或者(III)化合物。在另一实施方案中,本发明涉及呈盐,具体地,药学上可接受的盐的形式的式(I)、(II),或者(III)化合物。还应理解的是,在一个实施方案中,本发明涉及呈游离碱形式的实施例化合物。在另一实施方案中,本发明涉及实施例化合物,其为盐的形式,具体地,药学上可接受的盐。
本发明化合物包括本文中所述的以下化合物:
(5-(5-氟吡啶-3-基)-4,5-二氢-1H-吡唑-1-基)(1-(5-甲基嘧啶-2-基)哌啶-4-基)甲酮,
(1-(5-氟吡啶-2-基)哌啶-4-基)(5-苯基-4,5-二氢-1H-吡唑-1-基)甲酮,
(1-(5-甲基吡啶-2-基)哌啶-4-基)(5-苯基-4,5-二氢-1H-吡唑-1-基)甲酮,
(1-(5-甲基嘧啶-2-基)哌啶-4-基)(5-苯基-4,5-二氢-1H-吡唑-1-基)甲酮,
(1-(5-氟嘧啶-2-基)哌啶-4-基)(5-苯基-4,5-二氢-1H-吡唑-1-基)甲酮,
(5-(5-氟吡啶-3-基)-4,5-二氢-1H-吡唑-1-基)(1-(5-氟嘧啶-2-基)哌啶-4-基)甲酮,
(5-(5-氟吡啶-3-基)-4,5-二氢-1H-吡唑-1-基)(1-(嘧啶-2-基)哌啶-4-基)甲酮,
(S)-2,2-二甲基-1-(5-苯基-4,5-二氢-1H-吡唑-1-基)丙-1-酮,
1-(5-(5-氟吡啶-3-基)-4,5-二氢-1H-吡唑-1-基)-2,2-二甲基丙-1-酮,
(S)-1-(5-(5-氟吡啶-3-基)-4,5-二氢-1H-吡唑-1-基)-2,2-二甲基丙-1-酮,
(5-苯基-4,5-二氢-1H-吡唑-1-基)(1-苯基哌啶-4-基)甲酮,
(1-苯基哌啶-4-基)(5-(吡啶-3-基)-4,5-二氢-1H-吡唑-1-基)甲酮,
环己基(5-(吡啶-3-基)-4,5-二氢-1H-吡唑-1-基)甲酮,
环戊基(5-苯基-4,5-二氢-1H-吡唑-1-基)甲酮,
(5-苯基-4,5-二氢-1H-吡唑-1-基)(四氢-2H-吡喃-4-基)甲酮,
2-环戊基-1-(5-(5-氟吡啶-3-基)-4,5-二氢-1H-吡唑-1-基)乙酮,
1-(5-(5-氟吡啶-3-基)-4,5-二氢-1H-吡唑-1-基)-2-甲基丙-1-酮,
环己基(5-(5-氟吡啶-3-基)-4,5-二氢-1H-吡唑-1-基)甲酮,
1-(5-(5-氟吡啶-3-基)-4,5-二氢-1H-吡唑-1-基)-2,3-二甲基丁-1-酮,
(5-(吡啶-3-基)-4,5-二氢-1H-吡唑-1-基)(1-(嘧啶-2-基)哌啶-4-基)甲酮,
(S)-(5-(吡啶-3-基)-4,5-二氢-1H-吡唑-1-基)(1-(嘧啶-2-基)哌啶-4-基)甲酮,
2-甲基-1-(5-苯基-4,5-二氢-1H-吡唑-1-基)丙-1-酮,
环丁基(5-苯基-4,5-二氢-1H-吡唑-1-基)甲酮,
(5-苯基-4,5-二氢-1H-吡唑-1-基)(四氢-2H-吡喃-3-基)甲酮,
2-甲基-1-(5-苯基-4,5-二氢-1H-吡唑-1-基)丁-1-酮,
2-环戊基-1-(5-苯基-4,5-二氢-1H-吡唑-1-基)乙酮,
2,3-二甲基-1-(5-苯基-4,5-二氢-1H-吡唑-1-基)丁-1-酮,
1-(5-(3,4-二氯苯基)-4,5-二氢-1H-吡唑-1-基)-2,2-二甲基丙-1-酮,
(S)-1-(5-(3,4-二氯苯基)-4,5-二氢-1H-吡唑-1-基)-2,2-二甲基丙-1-酮,
2,2-二甲基-1-(5-(吡啶-3-基)-4,5-二氢-1H-吡唑-1-基)丙-1-酮,
(S)-2,2-二甲基-1-(5-(吡啶-3-基)-4,5-二氢-1H-吡唑-1-基)丙-1-酮,
1-(5-(3-氯苯基)-4,5-二氢-1H-吡唑-1-基)-2,2-二甲基丙-1-酮,
(S)-1-(5-(3-氯苯基)-4,5-二氢-1H-吡唑-1-基)-2,2-二甲基丙-1-酮,
1-(5-(6-甲氧基吡啶-3-基)-4,5-二氢-1H-吡唑-1-基)-2,2-二甲基丙-1-酮,
2,2-二甲基-1-(5-(5-甲基吡啶-2-基)-4,5-二氢-1H-吡唑-1-基)丙-1-酮,
2,2-二甲基-1-(5-(吡啶-2-基)-4,5-二氢-1H-吡唑-1-基)丙-1-酮,
(S)-2,2-二甲基-1-(5-(吡啶-2-基)-4,5-二氢-1H-吡唑-1-基)丙-1-酮,
2,2-二甲基-1-(5-(6-甲基吡啶-3-基)-4,5-二氢-1H-吡唑-1-基)丙-1-酮,
(S)-2,2-二甲基-1-(5-(6-甲基吡啶-3-基)-4,5-二氢-1H-吡唑-1-基)丙-1-酮,
1-(5-(2-氟-4-甲基苯基)-4,5-二氢-1H-吡唑-1-基)-2,2-二甲基丙-1-酮,
1-(5-(3-氟-4-甲基苯基)-4,5-二氢-1H-吡唑-1-基)-2,2-二甲基丙-1-酮,
1-(5-环己基-4,5-二氢-1H-吡唑-1-基)-2,2-二甲基丙-1-酮,
(S)-1-(5-环己基-4,5-二氢-1H-吡唑-1-基)-2,2-二甲基丙-1-酮,
1-(5-环戊基-4,5-二氢-1H-吡唑-1-基)-2,2-二甲基丙-1-酮,
2,2-二甲基-1-(5-(对甲苯基)-4,5-二氢-1H-吡唑-1-基)丙-1-酮,
2,2-二甲基-1-(5-(噁唑-4-基)-4,5-二氢-1H-吡唑-1-基)丙-1-酮,
2,2-二甲基-1-(5-(邻甲苯基)-4,5-二氢-1H-吡唑-1-基)丙-1-酮,
2,2-二甲基-1-(5-(4-(三氟甲基)苯基)-4,5-二氢-1H-吡唑-1-基)丙-1-酮,
(S)-2,2-二甲基-1-(5-(4-(三氟甲基)苯基)-4,5-二氢-1H-吡唑-1-基)丙-1-酮,
1-(5-(4-甲氧基苯基)-4,5-二氢-1H-吡唑-1-基)-2,2-二甲基丙-1-酮,
1-(5-(4-氯苯基)-4,5-二氢-1H-吡唑-1-基)-2,2-二甲基丙-1-酮,
(S)-1-(5-(4-氯苯基)-4,5-二氢-1H-吡唑-1-基)-2,2-二甲基丙-1-酮,
1-(5-(3-氟苯基)-4,5-二氢-1H-吡唑-1-基)-2,2-二甲基丙-1-酮,
(S)-1-(5-(3-氟苯基)-4,5-二氢-1H-吡唑-1-基)-2,2-二甲基丙-1-酮,
(1-(吡啶-2-基)哌啶-4-基)(5-(吡啶-3-基)-4,5-二氢-1H-吡唑-1-基)甲酮,
2,2-二甲基-1-(5-(5-甲基吡啶-3-基)-4,5-二氢-1H-吡唑-1-基)丙-1-酮,
2,2-二甲基-1-(5-(四氢-2H-吡喃-2-基)-4,5-二氢-1H-吡唑-1-基)丙-1-酮,
2,2-二甲基-1-(5-(5-甲基吡嗪-2-基)-4,5-二氢-1H-吡唑-1-基)丙-1-酮,
1-(5-(5-氟-6-甲基吡啶-2-基)-4,5-二氢-1H-吡唑-1-基)-2,2-二甲基丙-1-酮,
1-(5-(5-氯吡啶-3-基)-4,5-二氢-1H-吡唑-1-基)-2,2-二甲基丙-1-酮,
1-(5-(3-氟-5-甲基苯基)-4,5-二氢-1H-吡唑-1-基)-2,2-二甲基丙-1-酮,
1-(5-(2-氟-5-甲基苯基)-4,5-二氢-1H-吡唑-1-基)-2,2-二甲基丙-1-酮,
4-(1-特戊酰基-4,5-二氢-1H-吡唑-5-基)苯甲腈,
3-(1-特戊酰基-4,5-二氢-1H-吡唑-5-基)苯甲腈,
1-(5-(1H-吲哚-6-基)-4,5-二氢-1H-吡唑-1-基)-2,2-二甲基丙-1-酮,
1-(5-(1H-吲哚-5-基)-4,5-二氢-1H-吡唑-1-基)-2,2-二甲基丙-1-酮,
(S)-1-(5-(1H-吲哚-5-基)-4,5-二氢-1H-吡唑-1-基)-2,2-二甲基丙-1-酮,
1-(5-(1H-吲哚-4-基)-4,5-二氢-1H-吡唑-1-基)-2,2-二甲基丙-1-酮,
(S)-1-(5-(1H-吲哚-4-基)-4,5-二氢-1H-吡唑-1-基)-2,2-二甲基丙-1-酮,
(1-(苯并[d]噁唑-2-基)哌啶-4-基)(5-(吡啶-3-基)-4,5-二氢-1H-吡唑-1-基)甲酮,
((2R)-1-氧代-1-(5-苯基-4,5-二氢-1H-吡唑-1-基)丙-2-基)氨基甲酸苄基酯,
(5-苯基-4,5-二氢-1H-吡唑-1-基)(1-(嘧啶-2-基)哌啶-4-基)甲酮,
(S)-(5-苯基-4,5-二氢-1H-吡唑-1-基)(1-(嘧啶-2-基)哌啶-4-基)甲酮,
3-羟基-2,2-二甲基-1-(5-苯基-4,5-二氢-1H-吡唑-1-基)丙-1-酮,
(1-甲基-1H-吡咯-2-基)(4-(5-苯基-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)甲酮,
(5-苯基-4,5-二氢-1H-吡唑-1-基)(1-(吡啶-2-基)哌啶-4-基)甲酮,
2,2,2-三氟-1-(4-(5-苯基-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)乙酮,
(5-苯基-4,5-二氢-1H-吡唑-1-基)(1-(5-(三氟甲基)吡啶-2-基)哌啶-4-基)甲酮,
(1-(苯并[d]噁唑-2-基)哌啶-4-基)(5-苯基-4,5-二氢-1H-吡唑-1-基)甲酮,
1-(4-(5-苯基-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)乙酮,
其作为游离碱,或者作为其盐,具体为药学上可接受的盐。
本发明的代表性化合物还包括以下化合物:
(S)-(1-(5-氟吡啶-2-基)哌啶-4-基)(5-苯基-4,5-二氢-1H-吡唑-1-基)甲酮,
(1-(5-氟嘧啶-2-基)哌啶-4-基)(5-苯基-3-(三氟甲基)-4,5-二氢-1H-吡唑-1-基)甲酮,
(S)-(5-(5-氟吡啶-3-基)-4,5-二氢-1H-吡唑-1-基)(1-(5-氟嘧啶-2-基)哌啶-4-基)甲酮,
1-(4-(5-(苯并[d][1,3]二氧杂环戊烯-5-基)-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)乙酮,
(S)-(5-苯基-4,5-二氢-1H-吡唑-1-基)(1-苯基哌啶-4-基)甲酮,
(S)-(5-苯基-4,5-二氢-1H-吡唑-1-基)(四氢-2H-吡喃-4-基)甲酮,
(5-(6-甲基吡啶-3-基)-4,5-二氢-1H-吡唑-1-基)(1-(嘧啶-2-基)哌啶-4-基)甲酮,
(5-(6-甲基吡啶-3-基)-4,5-二氢-1H-吡唑-1-基)(1-(吡啶-2-基)哌啶-4-基)甲酮,
(S)-(1-(吡啶-2-基)哌啶-4-基)(5-(吡啶-3-基)-4,5-二氢-1H-吡唑-1-基)甲酮,
(S)-4-(1-特戊酰基-4,5-二氢-1H-吡唑-5-基)苯甲腈,
(5-苯基-4,5-二氢-1H-吡唑-1-基)(1-(三氟甲基)环丙基)甲酮,
2,2-二甲基-3-氧代-3-(5-苯基-4,5-二氢-1H-吡唑-1-基)丙腈,
2-甲氧基-2-甲基-1-(5-苯基-4,5-二氢-1H-吡唑-1-基)丙-1-酮,
1-(5-苯基-4,5-二氢-1H-吡唑-1-羰基)环戊烷甲腈,
(3-甲基-5-苯基-4,5-二氢-1H-吡唑-1-基)(1-(吡啶-2-基)哌啶-4-基)甲酮,
(1-(5-氟嘧啶-2-基)哌啶-4-基)(3-甲基-5-苯基-4,5-二氢-1H-吡唑-1-基)甲酮,
(5-(5-甲基吡嗪-2-基)-4,5-二氢-1H-吡唑-1-基)(1-(吡啶-2-基)哌啶-4-基)甲酮,
(4-甲基-1-(嘧啶-2-基)哌啶-4-基)(5-(5-甲基吡嗪-2-基)-4,5-二氢-1H-吡唑-1-基)甲酮,
(1-(环己烷羰基)哌啶-4-基)(5-苯基-4,5-二氢-1H-吡唑-1-基)甲酮,
(1-(环丁烷羰基)哌啶-4-基)(5-苯基-4,5-二氢-1H-吡唑-1-基)甲酮,
1-(4-(5-苯基-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)丙-1-酮,
2-甲基-1-(4-(5-苯基-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)丙-1-酮,
(5-苯基-4,5-二氢-1H-吡唑-1-基)(1-(吡啶-2-甲酰基)哌啶-4-基)甲酮,
(5-苯基-4,5-二氢-1H-吡唑-1-基)(1-(嘧啶-2-羰基)哌啶-4-基)甲酮,
(1-(4-吗啉代苯甲酰基)哌啶-4-基)(5-苯基-4,5-二氢-1H-吡唑-1-基)甲酮,
(1-(5-氯吡啶-2-甲酰基)哌啶-4-基)(5-苯基-4,5-二氢-1H-吡唑-1-基)甲酮,
(1-(吡啶-4-甲酰基)哌啶-4-基)(5-苯基-4,5-二氢-1H-吡唑-1-基)甲酮,
(1-(6-甲基吡啶-2-甲酰基)哌啶-4-基)(5-苯基-4,5-二氢-1H-吡唑-1-基)甲酮,
(1-(6-氯吡啶-2-甲酰基)哌啶-4-基)(5-苯基-4,5-二氢-1H-吡唑-1-基)甲酮,
(1-(6-氯吡啶-3-甲酰基)哌啶-4-基)(5-苯基-4,5-二氢-1H-吡唑-1-基)甲酮,
(1-(吡啶-3-甲酰基)哌啶-4-基)(5-苯基-4,5-二氢-1H-吡唑-1-基)甲酮,
(1-(5-氟吡啶-2-甲酰基)哌啶-4-基)(5-苯基-4,5-二氢-1H-吡唑-1-基)甲酮,
(1-(4-氯苯甲酰基)哌啶-4-基)(5-苯基-4,5-二氢-1H-吡唑-1-基)甲酮,
2-苯基-1-(4-(5-苯基-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)乙酮,
(1-(4-甲氧基苯甲酰基)哌啶-4-基)(5-苯基-4,5-二氢-1H-吡唑-1-基)甲酮,
(5-苯基-4,5-二氢-1H-吡唑-1-基)(1-(噻唑-2-羰基)哌啶-4-基)甲酮,
(5-环丙基异噁唑-3-基)(4-(5-苯基-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)甲酮,
噁唑-4-基(4-(5-苯基-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)甲酮,
(1-甲基-1H-咪唑-2-基)(4-(5-苯基-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)甲酮,
(1-甲基-1H-吡唑-5-基)(4-(5-苯基-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)甲酮,
(1-甲基-1H-吡唑-3-基)(4-(5-苯基-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)甲酮,
(2-甲基噁唑-4-基)(4-(5-苯基-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)甲酮,
(1-甲基-1H-咪唑-4-基)(4-(5-苯基-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)甲酮,
(2-甲基噻唑-4-基)(4-(5-苯基-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)甲酮,
(1-(4-甲基吡啶-2-甲酰基)哌啶-4-基)(5-苯基-4,5-二氢-1H-吡唑-1-基)甲酮,
(5-甲基噻吩-2-基)(4-(5-苯基-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)甲酮,
(1-(1H-吡唑-4-羰基)哌啶-4-基)(5-苯基-4,5-二氢-1H-吡唑-1-基)甲酮,
(2-甲基噻唑-5-基)(4-(5-苯基-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)甲酮,
异噻唑-5-基(4-(5-苯基-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)甲酮,
(2-甲基噁唑-5-基)(4-(5-苯基-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)甲酮,
(1-甲基-1H-吡唑-4-基)(4-(5-苯基-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)甲酮,
(5-甲基异噁唑-3-基)(4-(5-苯基-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)甲酮,
2-(苄基氧基)-1-(5-苯基-4,5-二氢-1H-吡唑-1-基)乙酮,
(1-(4-氟苯甲酰基)哌啶-4-基)(5-苯基-4,5-二氢-1H-吡唑-1-基)甲酮,
(1-(2,4-二氟苯甲酰基)哌啶-4-基)(5-苯基-4,5-二氢-1H-吡唑-1-基)甲酮,
4-(4-(5-苯基-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-羰基)苯甲腈,
(1-(1H-吡唑-3-羰基)哌啶-4-基)(5-苯基-4,5-二氢-1H-吡唑-1-基)甲酮,
3-氧代-3-(4-(5-苯基-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)丙腈,
(2,4-二甲基噻唑-5-基)(4-(5-苯基-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)甲酮,
(1-(3,5-二氟苯甲酰基)哌啶-4-基)(5-苯基-4,5-二氢-1H-吡唑-1-基)甲酮,
(1-(1H-1,2,3-三唑-4-羰基)哌啶-4-基)(5-苯基-4,5-二氢-1H-吡唑-1-基)甲酮,
(1-(1,2,3-噻二唑-5-羰基)哌啶-4-基)(5-苯基-4,5-二氢-1H-吡唑-1-基)甲酮,
苯并[d]噻唑-2-基(4-(5-苯基-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)甲酮,
(1-(1H-吲唑-3-羰基)哌啶-4-基)(5-苯基-4,5-二氢-1H-吡唑-1-基)甲酮,
(1-苯基-1H-咪唑-4-基)(4-(5-苯基-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)甲酮,
(1-(1H-苯并[d][1,2,3]三唑-6-羰基)哌啶-4-基)(5-苯基-4,5-二氢-1H-吡唑-1-基)甲酮,
(1-(1H-吲唑-6-羰基)哌啶-4-基)(5-苯基-4,5-二氢-1H-吡唑-1-基)甲酮,
咪唑并[1,2-b]哒嗪-2-基(4-(5-苯基-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)甲酮,
3-苯基-1-(4-(5-苯基-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)丙-2-炔-1-酮,
苯并[d]异噁唑-3-基(4-(5-苯基-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)甲酮,
噁唑-5-基(4-(5-苯基-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)甲酮,
噁唑-2-基(4-(5-苯基-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)甲酮,
(3-甲基-1H-吡唑-5-基)(4-(5-苯基-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)甲酮,
(5-甲基噻唑-2-基)(4-(5-苯基-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)甲酮,
异噁唑-5-基(4-(5-苯基-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)甲酮,
(5-苯基-4,5-二氢-1H-吡唑-1-基)(1-(噻唑-5-羰基)哌啶-4-基)甲酮,
异噁唑-3-基(4-(5-苯基-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)甲酮,
(5-苯基-4,5-二氢-1H-吡唑-1-基)(1-(噻唑-4-羰基)哌啶-4-基)甲酮,
(1-(1,2,5-噻二唑-3-羰基)哌啶-4-基)(5-苯基-4,5-二氢-1H-吡唑-1-基)甲酮,
异噻唑-4-基(4-(5-苯基-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)甲酮,
(4-甲基噻唑-2-基)(4-(5-苯基-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)甲酮,
(5-甲基噁唑-4-基)(4-(5-苯基-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)甲酮,
(1-(环丙烷羰基)哌啶-4-基)(5-苯基-4,5-二氢-1H-吡唑-1-基)甲酮,
(5-苯基-4,5-二氢-1H-吡唑-1-基)(1-(苯基磺酰基)哌啶-4-基)甲酮,
2-甲氧基-1-(4-(5-苯基-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)乙酮,
(1-(环戊烷羰基)哌啶-4-基)(5-苯基-4,5-二氢-1H-吡唑-1-基)甲酮,
1-(4-(5-苯基-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)丁-1-酮,
(1-苯甲酰基哌啶-4-基)(5-苯基-4,5-二氢-1H-吡唑-1-基)甲酮,
2-环己基-1-(4-(5-苯基-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)乙酮,
(1-苯甲酰基-4-甲基哌啶-4-基)(5-苯基-4,5-二氢-1H-吡唑-1-基)甲酮,
1-(4-甲基-4-(5-苯基-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)乙酮,
(1-(1H-吲哚-2-羰基)哌啶-4-基)(5-苯基-4,5-二氢-1H-吡唑-1-基)甲酮,
(1-(1H-吲哚-3-羰基)哌啶-4-基)(5-苯基-4,5-二氢-1H-吡唑-1-基)甲酮,
1-(4-(5-(2,3-二氢苯并呋喃-5-基)-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)乙酮,
1-(4-(5-(2,3-二氢-1H-茚-5-基)-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)乙酮,
(5-(2,3-二氢-1H-茚-5-基)-4,5-二氢-1H-吡唑-1-基)(1-(5-氟嘧啶-2-基)哌啶-4-基)甲酮,
(5-(4-(二氟甲氧基)苯基)-4,5-二氢-1H-吡唑-1-基)(1-(5-氟嘧啶-2-基)哌啶-4-基)甲酮,
(5-(6-甲基吡啶-3-基)-4,5-二氢-1H-吡唑-1-基)(1-(噁唑-5-羰基)哌啶-4-基)甲酮,
(1-(5-氟嘧啶-2-基)哌啶-4-基)(5-(6-甲基吡啶-3-基)-4,5-二氢-1H-吡唑-1-基)甲酮,
4-(1-(1-(5-氟嘧啶-2-基)哌啶-4-羰基)-4,5-二氢-1H-吡唑-5-基)苯甲腈,
(4-氟-1-(5-氟嘧啶-2-基)哌啶-4-基)(5-苯基-4,5-二氢-1H-吡唑-1-基)甲酮,
(1-(5-氟嘧啶-2-基)-4-甲基哌啶-4-基)(5-苯基-4,5-二氢-1H-吡唑-1-基)甲酮,
N-乙基-4-(5-苯基-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-甲酰胺,
1-(3-溴-5-苯基-4,5-二氢-1H-吡唑-1-基)-2,2-二甲基丙-1-酮,
1-(4-(5-苯基-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)乙酮,
1-(4-(5-(4-(二氟甲氧基)苯基)-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)乙酮,
1-(4-(5-(2,3-二氢苯并[b][1,4]二氧杂环己烯-6-基)-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)乙酮,
(S)-1-(4-(5-(3-氟苯基)-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)乙酮,
1-(4-(5-(3,5-二氟苯基)-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)乙酮,
(S)-1-(4-(5-(3,5-二氟苯基)-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)乙酮,
1-(4-(5-(2-氟苯基)-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)乙酮,
(S)-1-(4-(5-(2-氟苯基)-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)乙酮,
1-(4-(5-(4-氟苯基)-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)乙酮,
(S)-1-(4-(5-(4-氟苯基)-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)乙酮,
((1-甲基环丙基)(5-苯基-4,5-二氢-1H-吡唑-1-基)甲酮,
1-(4-(5-(4-氯苯基)-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)乙酮,
(1-(4-(5-(4-氯-3-氟苯基)-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)乙酮,
1-(5-苯基-4,5-二氢-1H-吡唑-1-羰基)环丙烷甲腈,
(5-苯基-4,5-二氢-1H-吡唑-1-基)(1-(噻唑-2-基)哌啶-4-基)甲酮,
其作为游离碱,或者作为其盐,具体为药学上可接受的盐。
在一个实施方案中,本发明涉及(S)-1-(4-(5-(3,5-二氟苯基)-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)乙酮,或其药学上可接受的盐。在另一实施方案中,本发明涉及(S)-1-(4-(5-(3,5-二氟苯基)-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)乙酮。在另一实施方案中,本发明化合物为(S)-1-(4-(5-(3,5-二氟苯基)-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)乙酮的结晶形式,其通过图5的PXRD图表征。
本发明还包括式(I)、(II)和/或(III)化合物的各种氘代形式。连接至碳原子的每一可利用的氢原子可独立地被氘原子替代。本领域普通技术人员将知道如何合成式(I)、(II)和/或(III)化合物的氘代形式。例如,可商购的氘代起始材料可用于制备式(I)、(II)和/或(III)化合物的氘代类似物,或者它们可通过常规技术,利用氘代试剂合成(例如,利用氘化锂铝或硼氘化钠的还原反应,或者利用金属卤素交换,然后再利用D
本领域的技术人员应当理解,式(I)、(II)或(III)化合物的溶剂化物(尤其是水合物)(包括式(I)、(II)或(III)化合物的盐的溶剂化物)可在结晶过程中当溶剂分子掺入晶格时形成。本发明范围包括所有可能的化学计量和非化学计量的盐和/或水合物形式。
当公开的化合物或其盐被命名或按结构描述时,应当理解该化合物或盐,包括其溶剂化物(尤其水合物),可以结晶形态、非结晶形态或其混合形态存在。该化合物或盐,或其溶剂化物(尤其水合物),也可表现出多晶型(即,体现为不同晶型的能力)。这些不同晶型通常被称为“多晶型物”。应当理解,通过结构命名或描述时,公开的化合物或其溶剂化物(尤其水合物)还包括它们的所有多晶型物。多晶型物具有相同化学组成,但是在固态晶体的堆积、几何排列和其他描述性特征方面存在差异。因此,多晶型物可能具备不同物理性质,如形状、密度、硬度、变形能力、稳定性和溶解性质。通常,多晶型物表现出不同熔点、红外光谱,和X射线粉末衍射图,其可用于多晶型物的鉴别。本领域的一般技术人员应当理解例如通过改变或调整化合物结晶/重结晶条件,可以生成不同多晶型物。
本领域的技术人员都知道且了解,使用的设备、湿度、温度、粉末晶体的取向,以及获取粉末X射线衍射(PXRD)图过程涉及的其他参数,可能引起衍射图的外形、强度和线位置的变化。本领域技术人员能够通过对比它们的PXRD图,确定该结晶化合物样品与已知晶型相同或不同。例如,本领域技术人员能够使结晶形式的试验样品的PXRD图与已知晶型的PXRD图重叠,并利用专业技能和知识,容易地确定样品的PXRD图与已知晶型的PXRD图是否基本一致。如果该PXRD图与已知晶型基本一致,那么样品晶型可以容易和准确地确定为与已知结晶形式相同。类似地,本领域技术人员能够确定由PXRD图获得的给定衍射角(以°2θ表示)与记载的值是否位置大致相同。
例如,PXRD图可与图5相同,或者更有可能存在一定差异。这种PXRD图可不必显示本申请衍射图案中的每一个线条,和/或外观、强度可存在轻微变化,或者获取数据的条件差异导致的所述线条位置发生移动。本领域技术人员能够使(S)-1-(4-(5-(3,5-二氟苯基)-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)乙酮的结晶形式的样品的PXRD图与图5的PXRD图重叠,并利用专业技能和知识,容易地确定样品的PXRD图与图5的PXRD图是否基本一致。如果该PXRD图与图5基本一致,那么样品晶型可以容易和准确地确定为与本文中所述的(S)-1-(4-(5-(3,5-二氟苯基)-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)乙酮的结晶形式相同。类似地,本领域技术人员能够确定由PXRD图获得的给定衍射角(以°2θ表示)与记载的值是否位置大致相同。
本发明的一个实施方案涉及(S)-1-(4-(5-(3,5-二氟苯基)-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)乙酮的结晶形式,其提供与图5基本一致的PXRD图。
因为它们在医学中的潜在用途,式(I)、(II),和(III)化合物的盐优选为药学上可接受的。适合的药学上可接受的盐可包括酸或者碱加成盐。
本文所用的术语“药学上可接受的”指适合制药用途的化合物。适合药用目的的式(I)、(II)和(III)化合物的盐和溶剂化物(如水合物和盐的水合物)是那些其中平衡离子或相关溶剂为药学上可接受的盐和溶剂化物。
具有非药学上可接受的平衡离子或相关溶剂的盐类和溶剂化物在本发明范围内,例如用作制备式(I)、(II)和(III)的其它化合物和它们的盐和溶剂化物过程中的中间体。
在式(I)、(II)和(III)化合物的最终分离和纯化期间,可原位制备盐。如果式(I)、(II)和(III)的碱性化合物被分离为盐,该化合物的相应游离碱形式可以通过任何合适的本领域已知的方法制备,包括利用无机碱或有机碱对盐进行处理,合适地,无机或有机碱具有比该化合物游离碱形式更高的pK
包含碱性胺或其他碱性官能团的式(I)、(II)和(III)化合物的盐,可以通过本领域已知的合适的方法制备,如利用酸处理游离碱。由此形成的药学上可接受的盐的实例包括乙酸盐、己二酸盐、抗坏血酸盐、天冬氨酸盐、苯磺酸盐、苯甲酸盐、樟脑酸盐、樟脑-磺酸盐(右旋樟脑磺酸)、癸酸盐(caprate或decanoate)、己酸盐(caproate或hexanoate)、辛酸盐(caprylate或octanoate)、碳酸盐、碳酸氢盐、肉桂酸盐、柠檬酸盐、环己烷氨基磺酸盐、十二烷基硫酸盐(dodecylsulfate或estolate)、乙烷-1,2-二磺酸盐(乙二磺酸盐)、乙烷磺酸盐(乙磺酸盐)、甲酸盐、富马酸盐、半乳糖酸盐(粘酸盐)、龙胆酸盐(2,5-二羟基苯甲酸盐)、葡庚糖酸盐(glucoheptonate或gluceptate)、葡萄糖酸盐、葡萄糖醛酸、谷氨酸盐、戊二酸盐、甘油磷酸盐、乙醇酸盐、马尿酸盐、氢溴酸盐、盐酸盐、氢碘酸盐、异丁酸盐、乳酸盐、乳糖醛酸盐、月桂酸盐、马来酸盐、苹果酸盐、丙二酸盐、扁桃酸盐、甲烷磺酸盐(甲磺酸盐)、萘-1,5-二磺酸盐(萘二磺酸盐)、萘-磺酸盐(萘磺酸盐)、烟酸盐、硝酸盐、油酸盐、草酸盐、棕榈酸盐、扑酸盐、磷酸盐、丙酸盐、焦谷氨酸盐、水杨酸盐、癸二酸盐、硬脂酸盐、琥珀酸盐、硫酸盐、酒石酸盐、硫氰酸盐、对甲苯磺酸盐(甲苯磺酸盐)、十一烯酸盐、1-羟基-2-萘甲酸盐、2-羟基乙磺酸盐(羟乙基磺酸盐)、2-氧代戊二酸盐、4-乙酰氨基苯甲酸盐和4-氨基水杨酸盐。
包含羧酸或其他酸性官能团的公开的化合物的盐可以通过与合适的碱反应制备。该药学上可接受的盐可以通过具有药学上可接受的阳离子的碱来制备,其包括碱金属盐(特别是钠盐和钾盐),碱土金属盐(特别是钙盐和镁盐),铝盐和铵盐,以及由生理学可接受的有机碱制备的盐,该碱例如三甲胺,三乙胺,吗啉,吡啶,哌啶,甲基吡啶,二环己胺,N,N'-二苄基乙二胺,2-羟基乙胺,双-(2-羟乙基)胺,三-(2-羟乙基)胺,普鲁卡因,二苄基哌啶、去氢枞胺、N,N’-双去氢枞胺,葡糖胺、N-甲基葡糖胺、三甲吡啶、胆碱、奎宁、喹啉和碱性氨基酸,如赖氨酸和精氨酸。
应理解的是,如果式(I)、(II),或者(III)化合物含有两个或更多个碱性部分,那么盐形成的化学计量学可包括1、2或者更多当量的酸。这种盐会含有1、2或者更多酸抗衡离子,例如,二乙酸盐或者二盐酸盐。
由于式(I)、(II),和(III)化合物或其药学上可接受的盐旨在用于药物组合物,所以本领域技术人员很容易理解它们各自优选以基本上纯的形式提供,如至少达到60%纯度,更合适地为至少达到75%纯度,且优选至少达到85%纯度,特别是至少达到98%纯度(百分比按重量计算)。不纯的本发明化合物的制品可以用来制备在药物组合物中使用的更纯的形式。
本发明化合物对RIP1激酶介导的疾病或障碍的治疗特别有效。这种RIP1激酶介导的疾病或障碍是通过激活RIP1激酶介导的疾病或障碍;因此,RIP1激酶的抑制对这些疾病或障碍的治疗有益。
在本发明中,RIP1激酶介导的疾病或障碍为通过激活RIP1激酶介导的疾病或障碍,因此,RIP1激酶的抑制对这些疾病或障碍的治疗有益。该RIP1激酶介导的疾病或障碍为可能至少部分地通过程序性坏死、凋亡或炎症细胞因子的产生调节的疾病/障碍,尤其炎性肠病(包括克罗恩氏病和溃疡性结肠炎)、银屑病、视网膜脱离(和变性)、色素性视网膜炎、黄斑变性、胰腺炎、特应性皮炎、关节炎(包括类风湿性关节炎、脊椎关节炎、痛风、幼年特发性关节炎(全身型幼年特发性关节炎(SoJIA))、银屑病关节炎)、系统性红斑狼疮(SLE)、干燥综合征、全身性硬皮病、抗磷脂综合征(APS)、血管炎、骨关节炎、肝损伤/疾病(非酒精性脂肪性肝炎、酒精性脂肪性肝炎、自身免疫性肝炎、自身免疫性肝胆疾病、原发性硬化性胆管炎(PSC)、对乙酰胺基酚中毒、肝毒性)、肾损伤/受伤(肾炎、肾移植、手术、给药肾毒性药物例如顺铂、急性肾损伤(AKI))、乳糜泻、自身免疫特发性血小板减少性紫癜(自身免疫性ITP)、移植排斥(移植器官、组织和细胞的排斥)、实体器官的缺血再灌注损伤、败血症、全身性炎症反应综合征(SIRS)、脑血管意外(CVA、中风)、心肌梗塞(MI)、动脉粥样硬化、亨廷顿氏病、阿尔茨海默氏病、帕金森氏病、肌萎缩侧索硬化(ALS)、新生儿缺氧性脑损伤、缺血性脑损伤、创伤性脑损伤变应性疾病(包括哮喘和特应性皮炎)、烧伤、多发性硬化、I型糖尿病、韦格纳肉芽肿、肺结节病、白塞氏病、白细胞介素-1转换酶(ICE,也已知为半胱天冬酶-1)相关的发热综合征、慢性阻塞性肺病(COPD)、吸烟诱导的损伤、囊性纤维化病、肿瘤坏死因子受体相关的周期性综合征(TRAPS)、新形成的肿瘤、牙周炎、NEMO-突变(NF-κ-B关键调节基因(也已知为IKKγ或IKKG))的突变,尤其,NEMO-缺乏综合征、HOIL-1缺乏((也已知为RBCK1)heme-氧化的IRP2泛素连接酶-1缺乏)、链状泛素链组装复合物(LUBAC)缺乏综合征、血液和实体器官恶性肿瘤、细菌感染和病毒感染(例如流感、葡萄球菌和分枝杆菌(肺结核)),和溶酶体贮积病(尤其,戈谢病,并包括GM2神经节苷脂贮积病、α-甘露糖苷贮积症、天冬氨酰葡糖胺尿症、胆固醇酯贮积症、慢性己糖胺酶A缺乏、胱氨酸贮积症、达农病、法布里病、法伯病、岩藻糖苷沉积症、半乳糖唾液酸苷贮积症、GM1神经节苷脂贮积病、粘脂质累积、小儿游离唾液酸贮积病、幼年己糖胺酶A缺乏、克拉伯病、溶酶体酸脂酶缺乏、异染性脑白质营养不良、粘多糖累积病、多种硫酸酯酶缺乏症、尼曼匹克氏病、神经元蜡样脂褐质沉积症、庞皮病、致密性成骨不全症、桑德霍夫病、辛德勒病、唾液酸贮积病、泰-萨克斯病,和沃尔曼病)、斯-约二氏综合征(Stevens-Johnson syndrome)、中毒性表皮坏死松解症、青光眼、脊髓损伤、胰腺导管腺癌、肝细胞癌、间皮瘤、黑色素瘤、急性肝功能衰竭和辐射保护/缓解、听觉障碍如噪声性听力减退和与耳毒性相关联的药物如顺铂诱发的听觉障碍,或者用于体外处理细胞以维持活力和功能。
本发明化合物,具体为式(I)、(II)或者(III)化合物,或其药学上可接受的盐,可具体用于治疗以下RIP1激酶介导的疾病或者障碍:炎性肠病(包括克罗恩氏病和溃疡性结肠炎)、银屑病、视网膜脱离(和变性)、色素性视网膜炎、黄斑变性、胰腺炎、特应性皮炎、关节炎(包括类风湿性关节炎、脊椎关节炎、痛风、全身型幼年特发性关节炎(SoJIA)、银屑病关节炎)、系统性红斑狼疮(SLE)、干燥综合征、全身性硬皮病、抗磷脂综合征(APS)、血管炎、骨关节炎、肝损伤/疾病(非酒精性脂肪性肝炎、酒精性脂肪性肝炎、自身免疫性肝炎、自身免疫性肝胆疾病、原发性硬化性胆管炎(PSC)、对乙酰胺基酚中毒、肝毒性)、肾损伤/受伤(肾炎、肾移植、手术、给药肾毒性药物例如顺铂、急性肾损伤(AKI))、乳糜泻、自身免疫特发性血小板减少性紫癜(自身免疫性ITP)、移植排斥(移植器官、组织和细胞的排斥)、实体器官的缺血再灌注损伤、败血症、全身性炎症反应综合征(SIRS)、脑血管意外(CVA、中风)、心肌梗塞(MI)、动脉粥样硬化、亨廷顿氏病、阿尔茨海默氏病、帕金森氏病、肌萎缩侧索硬化(ALS)、新生儿缺氧性脑损伤、变应性疾病(包括哮喘和特应性皮炎)、烧伤、多发性硬化、I型糖尿病、韦格纳肉芽肿、肺结节病、白塞氏病、白细胞介素-1转换酶(ICE,也已知为半胱天冬酶-1)相关的发热综合征、慢性阻塞性肺病(COPD)、吸烟诱导的损伤、囊性纤维化病、肿瘤坏死因子受体相关的周期性综合征(TRAPS)、新形成的肿瘤、牙周炎、NEMO-突变(NF-κ-B关键调节基因(也已知为IKKγ或IKKG))的突变,尤其,NEMO-缺乏综合征、HOIL-1缺乏((也已知为RBCK1)heme-氧化的IRP2泛素连接酶-1缺乏)、链状泛素链组装复合物(LUBAC)缺乏综合征、血液和实体器官恶性肿瘤、细菌感染和病毒感染(例如流感、葡萄球菌和分枝杆菌(肺结核)),和溶酶体贮积病(尤其,戈谢病,并包括GM2神经节苷脂贮积病、α-甘露糖苷贮积症、天冬氨酰葡糖胺尿症、胆固醇酯贮积症、慢性己糖胺酶A缺乏、胱氨酸贮积症、达农病、法布里病、法伯病、岩藻糖苷沉积症、半乳糖唾液酸苷贮积症、GM1神经节苷脂贮积病、粘脂质累积、小儿游离唾液酸贮积病、幼年己糖胺酶A缺乏、克拉伯病、溶酶体酸脂酶缺乏、异染性脑白质营养不良、粘多糖累积病、多种硫酸酯酶缺乏症、尼曼匹克氏病、神经元蜡样脂褐质沉积症、庞皮病、致密性成骨不全症、桑德霍夫病、辛德勒病、唾液酸贮积病、泰-萨克斯病,和沃尔曼病)、斯-约二氏综合征(Stevens-Johnson syndrome)、中毒性表皮坏死松解症,和/或用于体外处理细胞以维持活力和功能。
本发明化合物(尤其式(I)、(II)或(III)化合物或其药学上可接受的盐)尤其可以用于治疗RIP1激酶介导的疾病或障碍,即,以下疾病/障碍,其可能至少部分地通过RIP1激酶活性调节,尤其是炎性肠病(包括克罗恩氏病和溃疡性结肠炎)、类风湿性关节炎、慢性阻塞性肺病(COPD)、哮喘、吸烟诱导的损伤、囊性纤维化病、银屑病、视网膜脱离和变性、色素性视网膜炎、黄斑变性、特应性皮炎、烧伤、牙周炎、细菌或病毒感染(病原体感染,包括但不局限于流感、葡萄球菌和/或分枝杆菌(肺结核))、全身性硬皮病(尤其,局部治疗变硬和/或变紧的皮肤区域),和/或实体器官的缺血再灌注损伤/移植排斥(尤其,局部治疗供体器官(尤其肾、肝和心脏和/或肺移植),器官接受者的输注),和局部治疗肠。
本发明化合物,具体为式(I)、(II)或者(III)化合物,或其药学上可接受的盐,可用于治疗青光眼。
本发明化合物,具体为式(I)、(II)或者(III)化合物,或其药学上可接受的盐,具体可用于治疗胰腺导管腺癌、肝细胞癌、间皮瘤,或者黑色素瘤。
本发明化合物,具体为式(I)、(II)或者(III)化合物,或其药学上可接受的盐,具体可用于治疗以下RIP1激酶介导的疾病或者障碍:类风湿性关节炎、炎性肠病(包括克罗恩氏病和溃疡性结肠炎),和银屑病。
上述疾病/障碍的治疗可能涉及,更具体地,改善由于所述疾病/障碍导致的持续性器官受伤或损伤。例如,本发明化合物尤其可以用于改善在局部缺血脑损伤或外伤性脑损伤后的脑组织受伤或损伤,或用于改善在心肌梗塞后的心脏组织受伤或损伤,或用于改善与亨廷顿氏病、阿尔茨海默氏病或帕金森氏病有关的脑组织受伤或损伤,或用于改善与非酒精性脂肪性肝炎、酒精性脂肪性肝炎、自身免疫性肝炎、自身免疫性肝胆疾病、原发性硬化性胆管炎或对乙酰胺基酚过量相关的肝组织受伤或损伤。
本发明化合物可具体用于改善作为放射疗法的结果经受的器官受伤或损伤,或者改善在脊髓受伤后的脊柱组织受伤或损伤,或者改善急性肝功能衰竭相关的肝组织受伤或损伤。本发明化合物可具体用于改善听觉障碍,例如噪声性听力减退,或者在给药耳毒性药物或者物质如顺铂后的听觉障碍。
本发明化合物可具体用于改善在移植或者给药肾毒性药物或者物质如顺铂后的实质器官组织(具体为肾、肝,和心脏和/或肺)受伤或损伤。应理解的是,在可能的情况下,这种组织损伤的改善可通过以下方法实现:用式(I)、(II)或者(III)化合物,或其药学上可接受的盐预先处理;例如,在给药顺铂之前预先处理患者或者在移植外科手术之前预先处理器官或者器官接受者。这种组织损伤的改善可通过以下方法实现:在移植外科手术期间用式(I)、(II)或者(III)化合物,或其药学上可接受的盐处理。这种组织损伤的改善也可通过以下方法实现:在移植外科手术之后用式(I)、(II)或者(III)化合物,或其药学上可接受的盐短期治疗患者。
在一个实施方案中,所述本发明化合物,具体为式(I)、(II)或者(III)化合物,或其药学上可接受的盐,可用于处理视网膜脱离、黄斑变性,和色素性视网膜炎。
在另一实施方案中,所述本发明化合物,具体为式(I)、(II)或者(III)化合物,或其药学上可接受的盐,可用于治疗多发性硬化。
在一个实施方案中,所述本发明化合物,具体为式(I)、(II)或者(III)化合物,或其药学上可接受的盐,可用于治疗创伤性脑损伤。
在另一实施方案中,所述本发明化合物,具体为式(I)、(II)或者(III)化合物,或其药学上可接受的盐,可用于治疗亨廷顿氏病、阿尔茨海默氏病、肌萎缩侧索硬化,和尼曼匹克氏病。
视网膜脱离、黄斑变性、色素性视网膜炎、多发性硬化、创伤性脑损伤、亨廷顿氏病、阿尔茨海默氏病、肌萎缩侧索硬化,和尼曼匹克氏病的治疗可涉及,更具体地,改善作为这些疾病/障碍的结果经受的器官受伤或损伤。例如,本发明化合物可具体用于改善在创伤性脑损伤后的脑组织受伤或者损伤,或者用于改善亨廷顿氏病、阿尔茨海默氏病、肌萎缩侧索硬化,和尼曼匹克氏病相关的脑组织受伤或者损伤。
在另一实施方案中,所述本发明化合物,具体为式(I)、(II)或者(III)化合物,或其药学上可接受的盐,可用于治疗视网膜脱离、黄斑变性,和色素性视网膜炎,和改善作为多发性硬化、创伤性脑损伤、亨廷顿氏病、阿尔茨海默氏病、肌萎缩侧索硬化,和尼曼匹克氏病的结果的脑组织受伤或者损伤。
RIP1介导的疾病病症的治疗可通过以下方法实现:使用本发明化合物(具体为式(I)或者式(II)化合物或其药学上可接受的盐)作为单一疗法,或者作为双重或者多重组合疗法,具体地用于治疗顽固性病例,例如与其它抗炎和/或抗-TNF药物组合,所述其它抗炎和/或抗-TNF药物可按本领域已知的治疗有效量给药。
本发明化合物,具体为式(I)、(II)或者(III)化合物,或其药学上可接受的盐,可单独使用或者与一种或者多种其它治疗剂如药物活性化合物或者生物产物(例如,单克隆抗体)组合使用。根据本发明的组合疗法由此包括给药至少一种本发明化合物,具体为式(I)、(II)或者(III)化合物,或其药学上可接受的盐,和至少一种其它治疗活性剂。优选地,根据本发明的组合疗法包括给药至少一种本发明化合物,具体为式(I)、(II)或者(III)化合物,或其药学上可接受的盐,和至少一种其它治疗活性剂,尤其是一种或者两种其它治疗活性剂,更尤其是一种其它治疗活性剂。
例如,组织损伤的改善可通过以下方法实现:在移植外科手术期间用式(I)、(II)或者(III)化合物,或其药学上可接受的盐,和至少一种其它治疗活性剂治疗。组织损伤的改善也可通过以下方法实现:在移植外科手术之后用式(I)、(II)或者(III)化合物,或其药学上可接受的盐,和至少一种其它治疗活性剂短期治疗患者。体外组织损伤的改善(即,组织、器官和细胞的体外保存)也可通过以下方法实现:在移植外科手术之前或者期间用式(I)、(II)或者(III)化合物,或其药学上可接受的盐,和至少一种其它治疗活性剂短期处理组织、器官和细胞。
本发明化合物,具体为式(I)、(II)或者(III)化合物,或其药学上可接受的盐,和其它一种或多种治疗剂可在单一药物组合物中一起给药或者分开给药,并且当分开给药时,这可同时发生或者以任何次序顺序发生。本发明化合物,具体为式(I)、(II)或者(III)化合物,或其药学上可接受的盐,和其它一种或多种治疗剂的量和相对给药时机将被选择以实现期望的组合疗效。由此,在另一方面,提供一种组合,其包含本发明化合物,具体为式(I)、(II)或者(III)化合物,或其药学上可接受的盐,以及一种或者多种其它治疗剂,尤其是一种或者两种其它治疗活性剂,更尤其为一种其它治疗活性剂。在一个方面,提供一种组合,其包含(S)-1-(4-(5-(3,5-二氟苯基)-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)乙酮,或其药学上可接受的盐,以及一种或者多种其它治疗剂,尤其为一种或者两种其它治疗活性剂,更尤其为一种其它治疗活性剂。
因此,在本发明的一个方面,本发明化合物,具体为式(I)、(II)或者(III)化合物,或其药学上可接受的盐,或者包含本发明化合物,具体为式(I)、(II)或者(III)化合物,或其药学上可接受的盐的药物组合物可与一种或者多种其它治疗剂组合使用,或者包括一种或者多种其它治疗剂,例如抗炎剂和/或抗-TNF剂。
本发明的药物组合物通常包含一种本发明化合物。然而,在一些实施方案中,本发明药物组合物含有超过一种本发明化合物。在其它实施方案中,本发明药物组合物可包括一种或者多种另外的治疗剂,尤其为一种或者两种其它治疗活性剂,更尤其为一种其它治疗活性剂。
抑制RIP1激酶的化合物(尤其式(I)化合物或其药学上可接受的盐)可以与其它抗炎药组合给药用于任一上述适应症,包括口服或局部皮质类固醇,抗-TNF药,5-氨基水杨酸和美沙拉秦制剂,羟基氯喹,硫代嘌呤,甲氨蝶呤,环磷酰胺,环孢菌素,钙神经素抑制剂,霉酚酸,mTOR抑制剂,JAK抑制剂,Syk抑制剂,抗炎生物剂,包括抗IL6生物制剂,抗IL1剂,抗IL17生物制剂,抗CD22,抗整联蛋白剂,抗-IFNα,抗-CD20或CD4生物制剂和对T细胞或B细胞受体的其它细胞因子抑制剂或生物制剂或白介素。
在CVA的治疗中,抑制RIP1激酶的化合物(尤其式(I)化合物或其药学上可接受的盐)可以与以下组合给药:血栓溶解剂(例如组织纤溶酶原激活剂
在SIRS的治疗中,抑制RIP1激酶的化合物(尤其式(I)化合物或其药学上可接受的盐)可以与以下组合给药:广谱抗生素(例如万古霉素)或其它抗-MRSA治疗(头孢吡肟
在炎性肠病(尤其,克罗恩氏病和/或溃疡性结肠炎)的治疗中,抑制RIP1激酶的化合物(尤其式(I)化合物或其药学上可接受的盐)可以与维多珠单抗
在银屑病的治疗中,抑制RIP1激酶的化合物(尤其式(I)化合物或其药学上可接受的盐)可以与以下组合给药:ixekizumab、tildrakizumab(MK-3222)或secukinumab(AIN457)组合给药。
在牙周炎的治疗中,抑制RIP1激酶的化合物(尤其式(I)化合物或其药学上可接受的盐)可以与以下组合给药:抗微生物剂(例如氯己定(
在哮喘的治疗中,抑制RIP1激酶的化合物(尤其式(I)化合物或其药学上可接受的盐)可以与以下组合给药:吸入性皮质类固醇(ICS)例如丙酸氟替卡松
在哮喘的治疗中适合用于组合治疗的其它药物包括蛋白酪氨酸激酶抑制剂(马赛替尼)、CRTH2/D-类前列腺素受体拮抗剂(AMG 853)、肾上腺素吸入气雾剂(E004)、瑞利珠单抗、Vectura的VR506、lebrikizumab(RG3637)、磷酸二酯酶(PDE)-3和(PDE)-4抑制剂(RPL554)的组合。
在COPD的治疗中,抑制RIP1激酶的化合物(尤其式(I)化合物或其药学上可接受的盐)可以与以下组合给药:LABA(例如昔萘酸沙美特罗(Serevent)、酒石酸福莫特罗
在COPD的治疗中适合用于组合治疗的其它药物包括SCH527123(CXCR2拮抗剂)、格隆溴铵((NVA237)
在分枝杆菌感染(肺结核)的治疗中,抑制RIP1激酶的化合物(尤其式(I)化合物或其药学上可接受的盐)可以与以下组合给药:抗分支杆菌药(例如异烟肼(INH)、ehambutol
在全身性硬皮病的治疗中,抑制RIP1激酶的化合物(尤其式(I)化合物或其药学上可接受的盐)可以与以下组合给药:口服皮质类固醇(例如泼尼松龙(
在囊性纤维化病的治疗中,抑制RIP1激酶的化合物(尤其式(I)化合物或其药学上可接受的盐)可以与以下组合给药:囊性纤维化跨膜通道调节因子(CFTR)增强剂(依伐卡托
在色素性视网膜炎的治疗中,抑制RIP1激酶的化合物(尤其式(I)化合物或其药学上可接受的盐)可以与以下组合给药:睫状神经营养生长因子(NT-501-CNTF)或基因转移因子
在黄斑变性的治疗中,抑制RIP1激酶的化合物(尤其式(I)化合物或其药学上可接受的盐)可以与以下组合给药:眼科玻璃体内注射液(阿柏西普
在流感的治疗中,抑制RIP1激酶的化合物(尤其式(I)化合物或其药学上可接受的盐)可以与以下组合给药:三价(IIV3)灭活的流感疫苗(例如
在葡萄球菌感染的治疗中,抑制RIP1激酶的化合物(尤其式(I)化合物或其药学上可接受的盐)可以与以下组合给药:抗生素(例如β-内酰胺头孢菌素(
在移植排斥的治疗中,抑制RIP1激酶的化合物(尤其式(I)化合物或其药学上可接受的盐)可以与以下组合给药:高剂量皮质类固醇(例如泼尼松
在特应性皮炎的治疗中,抑制RIP1激酶的化合物(尤其式(I)化合物或其药学上可接受的盐)可以与以下组合给药:局部免疫调节剂或钙神经素抑制剂(例如吡美莫司
在本发明的一个实施方案中,所述至少一种其它治疗活性剂选自血栓溶解剂、组织型纤溶酶原激活物、抗凝剂和血小板聚集抑制剂。在其它实施方案中,所述至少一种其它治疗活性剂选自肝素、香豆素、氯吡格雷、双嘧达莫、盐酸噻氯匹定、依替巴肽,和阿司匹林。在一个实施方案中,用这些药物治疗的所述RIP1激酶介导的疾病或障碍是脑血管意外。
在本发明的一个实施方案中,所述至少一种其它治疗活性剂选自广谱抗生素、抗-MRSA治疗和低剂量类固醇。在其它实施方案中,所述至少一种其它治疗活性剂选自万古霉素、头孢吡肟、哌拉西林和他唑巴坦的组合、亚胺培南、美罗培南、多利培南、环丙沙星、左氧氟沙星、氧氟沙星、莫西沙星和氢化可的松。在一个实施方案中,用这些药物治疗的所述RIP1激酶介导的疾病或障碍是全身性炎症反应综合征。
在本发明的一个实施方案中,所述至少一种其它治疗活性剂是alicaforse或remestemcel-L。在一个实施方案中,用这些药物治疗的所述RIP1激酶介导的疾病或障碍是克罗恩氏病或溃疡性结肠炎。
在本发明的一个实施方案中,所述至少一种其它治疗活性剂是ixekizumab或tildrakizumab。在一个实施方案中,用这些药物治疗的所述RIP1激酶介导的疾病或障碍是银屑病。
在本发明的一个实施方案中,所述至少一种其它治疗活性剂是抗微生物剂或抗生素。在其它实施方案中,所述至少一种其它治疗活性剂选自氯己定、多西环素和米诺环素。在一个实施方案中,用这些药物治疗的所述RIP1激酶介导的疾病或障碍是牙周炎。
在本发明的一个实施方案中,所述至少一种其它治疗活性剂选自吸入性皮质类固醇、长效β激动剂、吸入性皮质类固醇和长效β激动剂的组合、短效β激动剂、白三烯调节剂、抗-IgE、甲基黄嘌呤支气管扩张药、肥大细胞抑制剂,和长效毒蕈碱拮抗剂。在其它实施方案中,所述至少一种其它治疗活性剂选自丙酸氟替卡松、丙酸倍氯米松、布地奈德、曲安奈德、氟尼缩松、糠酸莫米松或环索奈德、富马酸福莫特罗、昔萘酸沙美特罗、糠酸氟替卡松和维兰特罗的组合、福莫特罗和布地奈德吸入剂的组合、丙酸倍氯米松和福莫特罗的组合、丙酸氟替卡松和沙美特罗的组合、硫酸沙丁胺醇、酒石酸左沙丁胺醇、异丙托溴铵和沙丁胺醇的组合、异丙托溴铵、孟鲁司特钠、扎鲁司特、齐留通、奥马珠单抗、茶碱、色甘酸钠、奈多罗米钠、以及糠酸莫米松和富马酸福莫特罗二水合物的组合。在其它实施方案中,所述至少一种其它治疗活性剂选自蛋白酪氨酸激酶抑制剂、CRTH2/D-类前列腺素受体拮抗剂、肾上腺素吸入气雾剂、以及磷酸二酯酶-3抑制剂和磷酸二酯酶-4抑制剂的组合。在其它实施方案中,所述至少一种其它治疗活性剂选自马赛替尼、AMG 853、茚达特罗、E004、糠酸氟替卡松和丙酸氟替卡松的组合、维兰特罗糠酸氟替卡松的组合、丙酸氟替卡松和富马酸福莫特罗无水物的组合、瑞利珠单抗、沙丁胺醇、噻托溴铵、福莫特罗和布地奈德的组合、糠酸氟替卡松、VR506、lebrikizumab和RPL554。在一个实施方案中,用这些药物治疗的所述RIP1激酶介导的疾病或障碍是哮喘。
在本发明的一个实施方案中,所述至少一种其它治疗活性剂选自长效β激动剂、长效吸入性抗胆碱能药或毒蕈碱拮抗剂、磷酸二酯酶抑制剂、吸入性皮质类固醇和长效β激动剂的组合、短效β激动剂和吸入性皮质类固醇。在其它实施方案中,所述至少一种其它治疗活性剂选自昔萘酸沙美特罗、芜地溴铵和维兰特罗的组合、芜地溴铵、酒石酸福莫特罗、富马酸福莫特罗、马来酸茚达特罗、丙酸氟替卡松和富马酸福莫特罗无水物的组合、噻托溴铵、阿地溴铵、罗氟司特、糠酸氟替卡松和维兰特罗的组合、丙酸氟替卡松和沙美特罗的组合、布地奈德和福莫特罗的组合、莫米松和福莫特罗的组合、异丙托溴铵和硫酸沙丁胺醇的组合、沙丁胺醇和异丙托铵的组合、异丙托溴铵、硫酸沙丁胺醇、布地奈德、丙酸氟替卡松和二丙酸倍氯米松。在其它实施方案中,所述至少一种其它治疗活性剂选自SCH527123、格隆溴铵、格隆溴铵和马来酸茚达特罗的组合、格隆溴铵和富马酸福莫特罗的组合、马来酸茚达特罗、奥达特罗、噻托溴铵、奥达特罗、以及阿地铵和福莫特罗的组合。在一个实施方案中,用这些药物治疗的所述RIP1激酶介导的疾病或障碍是COPD。
在本发明的一个实施方案中,所述至少一种其它治疗活性剂是抗分支杆菌药或杀菌性抗生素。在其它实施方案中,所述至少一种其它治疗活性剂选自异烟肼、ehambutol、利福平、吡嗪酰胺、利福布汀、利福喷汀、卷曲霉素、左氧氟沙星、莫西沙星、氧氟沙星、乙硫异烟胺、环丝氨酸、卡那霉素、链霉素、紫霉素、富马酸贝达喹啉、PNU-100480和地依麦迪。在一个实施方案中,用这些药物治疗的所述RIP1激酶介导的疾病或障碍是分枝杆菌感染。
在本发明的一个实施方案中,所述至少一种其它治疗活性剂选自口服皮质类固醇、抗胸腺细胞球蛋白、沙利度胺、苯丁酸氮芥、钙通道阻滞剂、局部润肤剂、ACE抑制剂、5-羟色胺再摄取抑制剂、内皮素-1受体抑制剂、抗纤维化剂、质子泵抑制剂或伊马替尼、ARG201和托珠单抗。在其它实施方案中,所述至少一种其它治疗活性剂选自泼尼松龙、抗胸腺细胞球蛋白、FK506(他克莫司)、沙利度胺、苯丁酸氮芥、硝苯地平、尼卡地平、硝酸甘油软膏剂、赖诺普利、地尔硫卓、氟西汀、波生坦、依前列醇、秋水仙碱、对氨基苯甲酸、二甲基亚砜、D-青霉胺、干扰素α、干扰素γ(INF-g))、奥美拉唑、甲氧氯普胺、兰索拉唑、艾美拉唑、泮托拉唑、雷贝拉唑、伊马替尼、ARG201和托珠单抗。在一个实施方案中,用这些药物治疗的所述RIP1激酶介导的疾病或障碍是全身性硬皮病。
在本发明的一个实施方案中,所述至少一种其它治疗活性剂选自囊性纤维化跨膜传导调节增强剂、粘液溶解剂、胰腺酶、支气管扩张剂、抗生素或依伐卡托/lumacaftor、ataluren和噻托溴铵。在其它实施方案中,所述至少一种其它治疗活性剂选自依伐卡托、脱氧核糖核酸酶α、胰脂肪酶、沙丁胺醇、妥布霉素、氨曲南、多粘菌素E甲磺酸钠、头孢羟氨苄一水合物、头孢唑林、头孢氨苄、头孢唑林、莫西沙星、左氧氟沙星、吉米沙星、阿奇霉素、庆大霉素、哌拉西林/他唑巴坦、头孢他啶、环丙沙星、甲氧苄啶/磺胺甲基异噁唑、氯霉素或依伐卡托/lumacaftor、ataluren和噻托溴铵。在一个实施方案中,用这些药物治疗的所述RIP1激酶介导的疾病或障碍是囊性纤维化病。
在本发明的一个实施方案中,所述至少一种其它治疗活性剂是睫状神经营养生长因子或基因转移因子。在其它实施方案中,所述至少一种其它治疗活性剂是NT-501-CNTF或编码肌球蛋白VIIA的基因转移因子(MY07A)。在一个实施方案中,用这些药物治疗的所述RIP1激酶介导的疾病或障碍是色素性视网膜炎。
在本发明的一个实施方案中,所述至少一种其它治疗活性剂选自眼科玻璃体内注射液、抗血管内皮生长因子抑制剂和睫状神经营养生长因子。在其它实施方案中,所述至少一种其它治疗活性剂选自阿柏西普、雷尼珠单抗、哌加他尼钠、NT501、人源化sphingomab和贝伐单抗。在一个实施方案中,用这些药物治疗的所述RIP1激酶介导的疾病或障碍是黄斑变性。
在本发明的一个实施方案中,所述至少一种其它治疗活性剂选自三价(IIV3)灭活的流感疫苗、四价(IIV4)灭活的流感疫苗、三价重组流感疫苗、四价活的减毒流感疫苗、抗病毒剂或灭活的流感疫苗。在其它实施方案中,所述至少一种其它治疗活性剂选自奥司他韦、扎那米韦、金刚乙胺或金刚烷胺。在一个实施方案中,用这些药物治疗的所述RIP1激酶介导的疾病或障碍是流感。
在本发明的一个实施方案中,所述至少一种其它治疗活性剂选自β-内酰胺、萘夫西林、磺胺甲噁唑、甲氧苄啶、柳氮磺吡啶、乙酰磺胺异噁唑和万古霉素。在一个实施方案中,用这些药物治疗的所述RIP1激酶介导的疾病或障碍是葡萄球菌感染。
在本发明的一个实施方案中,所述至少一种其它治疗活性剂选自单克隆抗体、多克隆抗T细胞抗体、抗胸腺细胞γ球蛋白马抗体、抗胸腺细胞球蛋白兔抗体、抗CD40拮抗剂、JAK抑制剂和抗TCR鼠mAb。在其它实施方案中,所述至少一种其它治疗活性剂选自莫罗单抗-CD3、ASKP-1240、ASP015K和TOL101。在一个实施方案中,用这些药物治疗的所述RIP1激酶介导的疾病或障碍是移植排斥。
在本发明的一个实施方案中,所述至少一种其它治疗活性剂选自局部免疫调节剂或钙神经素抑制剂、局部皮质类固醇、口服皮质类固醇、干扰素γ、抗组胺药或抗生素。在其它实施方案中,所述至少一种其它治疗活性剂选自吡美莫司、他克莫司、氢化可的松、倍他米松、丙酮缩氟氢羟龙、氟替卡松、曲安西龙、醋酸氟轻松、氯倍他索、氢化可的松、甲泼尼龙、泼尼松龙、干扰素α蛋白质、重组合成I型干扰素、干扰素α-2a、干扰素α-2b、羟嗪、苯海拉明、氟氯西林、双氯西林和红霉素。在一个实施方案中,用这些药物治疗的所述RIP1激酶介导的疾病或障碍是特应性皮炎。
因此,本发明的一个实施方案涉及抑制RIP1激酶的方法,其包括使细胞与本发明化合物接触。本发明的另一实施方案是抑制RIP1激酶的方法,其包括使细胞与式(II)或者式(III)化合物或其盐,具体为药学上可接受的盐接触。本发明的一个具体实施方案是抑制RIP1激酶的方法,其包括使细胞与式(II)或者(III)化合物,或者其盐,具体为药学上可接受的盐接触。
在另一实施方案中,本发明涉及治疗RIP1激酶介导的疾病或者障碍(例如,本文中记载的疾病或者障碍)的方法,其包括向需要的人给予治疗有效量的式(I)、(II),或者(III)化合物,或其盐,具体为药学上可接受的盐。在一个具体实施方案中,本发明涉及治疗RIP1激酶介导的疾病或者障碍(例如,本文中记载的疾病或者障碍)的方法,其包括向需要的人给予治疗有效量的本文中公开的化合物,或其盐,具体为药学上可接受的盐。在一个具体实施方案中,本发明涉及治疗RIP1激酶介导的疾病或者障碍(尤其是,本文中记载的疾病或者障碍)的方法,其包括向需要的人给予治疗有效量的(S)-1-(4-(5-(3,5-二氟苯基)-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)乙酮,或其药用盐。在另一具体实施方案中,本发明涉及治疗RIP1激酶介导的疾病或者障碍(尤其是,本文中记载的疾病或者障碍)的方法,其包括向需要的人给予治疗有效量的(S)-1-(4-(5-(3,5-二氟苯基)-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)乙酮。
本发明还提供式(I)、(II)或者(III)化合物,或其药学上可接受的盐,其用于治疗。本发明提供了式(I)、(II)或者(III)化合物,或其药学上可接受的盐,其用于治疗RIP1激酶介导的疾病或者障碍(例如,本文中记载的疾病或者障碍)。尤其是,本发明提供了本文中描述的化合物,或其药学上可接受的盐,其用于治疗。更尤其是,本发明提供了(S)-1-(4-(5-(3,5-二氟苯基)-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)乙酮,或其药用盐,其用于治疗。更尤其是,本发明提供了(S)-1-(4-(5-(3,5-二氟苯基)-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)乙酮,其用于治疗。
在另一实施方案中,本发明提供了本发明化合物,其用于治疗RIP1激酶介导的疾病或者障碍,尤其是本文中记载的疾病或者障碍。本发明提供本文中所述的化合物,或其药学上可接受的盐,其用于治疗RIP1激酶介导的疾病或者障碍,尤其是本文中记载的疾病或者障碍。在另一具体实施方案中,本发明提供了(S)-1-(4-(5-(3,5-二氟苯基)-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)乙酮,或其药学上可接受的盐,其用于治疗RIP1激酶介导的疾病或者障碍,尤其是本文中记载的疾病或者障碍。在另一具体实施方案中,本发明提供了(S)-1-(4-(5-(3,5-二氟苯基)-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)乙酮,其用于治疗RIP1激酶介导的疾病或者障碍,尤其是本文中记载的疾病或者障碍。
本发明尤其提供了式(I)、(II)或者(III)化合物,或其药学上可接受的盐作为活性治疗物质的用途。更尤其是,本发明提供了本文中所述的化合物用于治疗RIP1激酶介导的疾病或者障碍,尤其是本文中记载的疾病或者障碍的用途。因此,本发明提供了式(I)、(II)或者(III)化合物作为活性治疗物质在患有RIP1激酶介导的疾病或者障碍,尤其是本文中记载的疾病或者障碍的需要的人的治疗中的用途。在一个实施方案中,本发明提供了(S)-1-(4-(5-(3,5-二氟苯基)-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)乙酮,或其药学上可接受的盐作为活性治疗物质用于治疗RIP1激酶介导的疾病或者障碍,尤其是本文中记载的疾病或者障碍的用途。在更具体的实施方案中,本发明提供了(S)-1-(4-(5-(3,5-二氟苯基)-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)乙酮作为活性治疗物质用于治疗RIP1激酶介导的疾病或者障碍,尤其是本文中记载的疾病或者障碍的用途。
本发明还提供了式(I)、(II)或者(III)化合物,或其盐,具体为其药学上可接受的盐在制备药物中的用途,所述药物用于治疗RIP1激酶介导的疾病或者障碍,例如本文中记载的疾病和障碍。尤其是,本发明还提供了本文中所述的化合物,或其药学上可接受的盐在制备药物中的用途,所述药物用于治疗RIP1激酶介导的疾病或者障碍,例如本文中所述的疾病和障碍。在一个实施方案中,本发明提供了(S)-1-(4-(5-(3,5-二氟苯基)-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)乙酮,或其药学上可接受的盐在制备药物中的用途,所述药物用于治疗RIP1激酶介导的疾病或者障碍,例如,本文中所述的疾病和障碍。在另一实施方案中,本发明提供了(S)-1-(4-(5-(3,5-二氟苯基)-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)乙酮在制备药物中的用途,所述药物用于治疗RIP1激酶介导的疾病或者障碍,例如,本文中所述的疾病和障碍。
如本文所定义,治疗“有效量”旨在表示,当给予有此需要的患者所述治疗时,足够达到治疗效果的化合物的量。因此,例如,式(I)、(II)或(III)化合物或其药学上可接受的盐的治疗有效量是指:当给予有此需要的人时,足以调节或抑制RIP1激酶活性,使所述活性介导的疾病症状降低、减缓或阻止的本发明药物的量。对应于所述量的给定化合物的量依据多种因素而改变,例如具体化合物(例如,具体化合物的效力(pIC
“治疗”或“疗法”是指患者的疾病或障碍至少有所减轻。减轻疾病或障碍的治疗方法包括本发明化合物在任一常规可接受方法中的使用,例如用于阻止、阻滞、预防、治疗或治愈本发明描述的RIP1激酶介导的的疾病或障碍。
本发明化合物可以以任一合适的给药途径给药,包括全身给药和局部给药。全身给药包括口服给药、肠胃外给药、透皮给药、直肠给药和吸入给药。肠胃外给药表示除肠内、透皮或吸入以外的给药途径,通常为注射或输注。肠胃外给药包括静脉、肌内和皮下注射或输注。吸入表示给药至患者肺部,无论是通过嘴或是鼻道吸入。局部给药包括施用至皮肤。
在一定时间内,本发明化合物可给药一次或根据给药方案给药,其中在给定时间段以不同的时间间隔给药一定次数。例如,剂量可以每天给药一次、二次、三次或四次。剂量可以给药直到实现所需治疗效果,或无限期给药以维持所需治疗效果。本发明化合物的合适给药方案取决于化合物的药代动力学性质,例如吸收、分布和半衰期,其可由本领域技术人员确定。此外,本发明化合物的合适的给药方案(包括该给药方案的持续时间)取决于待治疗的疾病或障碍、待治疗的疾病或障碍的严重程度、待治疗的患者的年龄和身体状况、待治疗的患者的病史、并行治疗的性质、所需治疗效果和本领域技术人员知识和专业内的类似因素。该技术人员还将理解,合适的给药方案可根据个体患者对于给药方案的反应或由于个体患者需要随时间变化来进行调整。总的日剂量为1mg至2000mg。
对于在治疗中的用途,本发明化合物将通常,但不是必须,在给药于患者之前配制成药物组合物。因此,本发明还涉及药物组合物,其包含本发明化合物和一种或者多种药学上可接受的赋形剂。本发明涉及药物组合物,其包含式(I)、(II)或者(III)化合物,或其药学上可接受的盐,和一种或者多种药学上可接受的赋形剂。在一个实施方案中,提供了药物组合物,其包含(S)-1-(4-(5-(3,5-二氟苯基)-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)乙酮,或其药学上可接受的盐,和一种或者多种药学上可接受的赋形剂。在另一实施方案中,提供了药物组合物,其包含(S)-1-(4-(5-(3,5-二氟苯基)-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)乙酮,和一种或者多种药学上可接受的赋形剂。在另一实施方案中,提供了药物组合物,其包含具有图5的PXRD谱图的结晶(S)-1-(4-(5-(3,5-二氟苯基)-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)乙酮和一种或者多种药学上可接受的赋形剂。
本发明还涉及药物组合物,其包含式(I)、(II),或者(III)化合物,或其药学上可接受的盐,和一种或者多种药学上可接受的赋形剂和至少一种其它治疗活性剂,尤其是一种或者两种其它治疗活性剂,更尤其是一种其它治疗活性剂。在一个实施方案中,提供了药物组合物,其包含(S)-1-(4-(5-(3,5-二氟苯基)-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)乙酮,或其药用盐、一种或者多种药学上可接受的赋形剂,和至少一种其它治疗活性剂,尤其是一种或者两种其它治疗活性剂,更尤其是一种其它治疗活性剂。在另一实施方案中,提供了药物组合物,其包含(S)-1-(4-(5-(3,5-二氟苯基)-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)乙酮、一种或者多种药学上可接受的赋形剂,和至少一种其它治疗活性剂,尤其是一种或者两种其它治疗活性剂,更尤其是一种其它治疗活性剂。在又一实施方案中,提供了药物组合物,其包含具有图5的PXRD图的结晶(S)-1-(4-(5-(3,5-二氟苯基)-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)乙酮、一种或者多种药学上可接受的赋形剂,和至少一种其它治疗活性剂,尤其是一种或者两种其它治疗活性剂,更尤其是一种其它治疗活性剂。
本发明的药物组合物可以以散装形式制备和包装,其中有效量的本发明化合物可以被取出然后给予患者,例如粉剂、糖浆和注射溶液。替代地,本发明的药物组合物可以以单位剂型制备和包装。药物组合物的剂量含有至少治疗有效量的本发明化合物(即,式(I)、(II),或者(III)化合物,或其药学上可接受的盐)。当以单位剂型制备时,所述药物组合物可含有1mg至1000mg本发明化合物。
如本文所提供,包含1mg至1000mg本发明化合物或其药学上可接受的盐的单位剂型(药物组合物)可以每天给药一次、两次、三次或四次,优选每天一次、两次或三次,更优选地,每天一次或两次,来实现治疗RIP1激酶介导的疾病或障碍。
本文所用“药学上可接受的赋形剂”表示在给定形式中涉及的或与组合物相容的物质、组合物或载体。当混合时,各赋形剂必须与药物组合物的其他成分相容,从而避免对患者给药时将实质性地降低本发明化合物的疗效的相互作用和将导致药物组合物成为药学上不可接受的相互作用。此外,各赋形剂的纯度当然必须足够高,使其成为药学上可接受。
本发明化合物和一种或多种药学上可接受的赋形剂通常被配制成通过所需给药途径适于给药至患者的剂型。适于与本发明化合物一起使用的常规的剂型包括(1)适于口服给药的剂型,例如片剂、胶囊剂、小胶囊剂、丸剂、锭剂、粉末、糖浆、酏剂、悬浮液、溶液、乳剂、囊袋剂和扁囊剂;(2)适于肠胃外给药的剂型,例如无菌溶液、悬浮液和用于重构(reconstitution)的粉末;(3)适于透皮给药的剂型,例如透皮贴剂;(4)适于直肠给药的剂型,例如栓剂;(5)适于吸入的那些,例如气雾剂和溶液;和(6)适于局部给药的剂型,例如乳剂、软膏、洗剂、溶液、糊剂、喷雾剂、泡沫剂和凝胶剂。
合适的药学上可接受的赋形剂将根据具体的所选剂型而变化。此外,可根据在组合物中发挥的具体功能来选择合适的药学上可接受的赋形剂。例如,可根据促进制备均一剂型的能力来选择某些药学上可接受的赋形剂。可根据促进制备稳定的剂型的能力来选择某些药学上可接受的赋形剂。可根据在给药至患者后促进本发明化合物从一个器官或身体部分运载或运输至另一器官或身体部分的能力来选择某些药学上可接受的赋形剂。可根据提高患者顺应性的能力来选择某些药学上可接受的赋形剂。
合适的药学上可接受的赋形剂包括下列赋形剂类型:稀释剂、填充剂、粘合剂、崩解剂、润滑剂、助流剂、粒化剂、包衣剂、润湿剂、溶剂、共溶剂、助悬剂、乳化剂、增甜剂、调味剂、掩味剂、着色剂、防结块剂、保湿剂、螯合剂、增塑剂、增粘剂、抗氧化剂、防腐剂、稳定剂、表面活性剂和缓冲剂。本领域技术人员将理解,某些药学上可接受的赋形剂可以发挥多于一种功能以及可发挥替代性功能,取决于所述赋形剂在制剂中存在多少和在制剂中存在何种其他成分。
具有本领域的知识和技术的技术人员能够选择出以适当量用于本发明的合适的药学上可接受的赋形剂。此外,有若干本领域技术人员可用的资源,这些资源描述了药学上可接受的赋形剂且其可用于选择合适的药学上可接受的赋形剂。实例包括
本发明的药物组合物是使用本技术领域人员已知的技术和方法制备的。通常用于本领域的一些方法描述在
在一个方面,本发明涉及包含有效量的本发明化合物和一种或者多种药学上可接受的赋形剂的局部剂型如乳膏剂、软膏剂、洗剂、糊剂,或者凝胶剂。亲脂制剂如无水乳膏剂和软膏剂通常将具有衍生自脂肪醇和聚乙二醇的基质。另外的添加剂包括醇类、无毒表面活性剂,和抗氧化剂。对于软膏剂,所述基质通常将为油,或者油和蜡如矿脂的混合物。此外,通常会包含少量的抗氧化剂。由于组合物局部应用,并且可以通过施用的总组合物来控制有效剂量,所以组合物中活性成分的百分比可以广泛地变化。常规浓度范围为0.5%至20%。
局部施加的凝胶剂还可以是可发泡的悬浮凝胶,其包含作为活性剂的本发明化合物、一种或多种增稠剂和任选的分散剂/润湿剂,pH调节剂、表面活性剂、推进剂、抗氧化剂、另外的发泡剂、络合剂/螯合剂、溶剂、香料、着色剂、防腐剂,其中所述凝胶剂是含水的并形成均质泡沫。
在一个方面,本发明涉及可以通过吸入,即通过鼻内和口腔吸入施用来施用的局部剂型。可以通过常规技术制备用于这种给药的合适剂型,例如气雾剂或定量吸入器。鼻内喷雾剂可以与水性或非水性载体一起配制,加入诸如增稠剂、缓冲盐或酸或碱以调节pH的试剂、等渗性调节剂或抗氧化剂。用雾化吸入的溶液可以用加入诸如酸或碱之类的试剂的水性载体、缓冲盐、等渗性调节剂或抗微生物剂来配制。
通过吸入给药的制剂或可发泡凝胶剂通常需要使用合适的推进剂。用于吸入器或吹入器的胶囊和药筒(例如明胶)可以使用合适的粉末基质如乳糖或淀粉来配制。
另一方面,本发明涉及包含有效量的本发明化合物和稀释剂或填充剂的固体口服剂型,例如片剂或胶囊剂。合适的稀释剂和填充剂包括乳糖、蔗糖、右旋糖、甘露糖醇、山梨糖醇、淀粉(例如玉米淀粉、马铃薯淀粉和预胶化淀粉)、纤维素及其衍生物(例如微晶纤维素)、硫酸钙和二碱式磷酸钙。口服固体剂型可以进一步包含粘合剂。合适的粘合剂包括淀粉(例如玉米淀粉、马铃薯淀粉和预胶化淀粉)、明胶、阿拉伯胶、海藻酸钠、海藻酸、西黄蓍胶、瓜尔胶、聚维酮和纤维素及其衍生物(例如微晶纤维素)。所述口服固体剂型还可包括崩解剂。合适的崩解剂包括交聚维酮、羟基乙酸淀粉钠、交联羧甲基纤维素、海藻酸和羧甲基纤维素钠。所述口服固体剂型还可包括润滑剂。适合的润滑剂包括硬脂酸、硬脂酸镁、硬脂酸钙,和滑石。
实施例
用下列实施例来示例说明本发明。这些实施例不是为了限制本发明的范围,而是为本领域技术人员提供关于制备和使用本发明的化合物、组合物和方法的指导。虽然本发明描述了具体的实施方案,本领域技术人员将理解,在不脱离本发明精神和范围的情况下,可作出各种变化和修改。
本申请所述的反应可用于制备具有本申请所定义的不同取代基(如R
本申请描述的中间体和最终化合物的命名是通过使用软件命名程序ACD/NamePro V6.02(来自Advanced Chemistry Development,Inc.,110Yonge Street,14
本领域技术人员将理解在某些情况下,对于一个用结构描述的化合物,这些程序可以该化合物的互变异构体来命名。应理解,提及任何给定命名的化合物或用结构描述的化合物时,均意在包括该类化合物所有互变异构体及其互变异构体的任何混合物。
在Waters ZQ质谱仪上使用交替扫描正和负模式电喷雾电离记录质谱。锥电压:20或5V。
LC/MS方法1:HPLC在X-Select CSH C18 XP柱(2.5μm 30x 4.6mm id)上进行,用0.1%甲酸/水(溶剂A)和0.1%甲酸/乙腈(溶剂B)洗脱,使用以下洗脱梯度:0-3min.:5%至100%B,3-4min.100%B,流速为1.8ml/min.,在40℃。
LC/MS方法2:UPLC分析在Acquity UPLC CSH C18柱(50mm x 2.1mm,i.d.1.7μm填充直径)上在40℃进行,用0.1%甲酸/水(溶剂A)和0.1%甲酸/乙腈(溶剂B)洗脱,使用以下洗脱梯度:0min:97%/3%(A/B),1.5min.5%/95%(A/B),1.9min.5%/95%(A/B),2min.97%/3%(A/B),流速为1mL/min.,用UV检测波长210nm至350nm的总的信号。
LC/MS方法3:UPLC在Acquity UPLC BEH C
LC/MS方法4:HPLC在X-Bridge C-18(150X4.6mm,3.5μm)上进行,用以下流动相洗脱:A:10mM乙酸铵,和B:100%乙腈,使用以下洗脱梯度-时间/%B:0/5,1.5/5,3/15,7/55,10/95,15/95,17/5,20/5,流速为1.0mL/分钟,在40℃,稀释剂为70:30(乙腈:H
LC/MS方法5:分析型HPLC在X-Select CSH C18 XP柱(2.5μm 30x 4.6mm id)上进行,用0.1%甲酸/水(溶剂A)和0.1%甲酸/乙腈(溶剂B)洗脱,使用以下洗脱梯度:0-4分钟:0%至50%B,流速为1.8ml/分钟,在40℃。
分析型手性SFC在Chiralpak IC(4.6X 250mm)5μCO
分析型手性HPLC方法1:在AD-H上使用4.6x150 mm柱,50:50EtOH:庚烷+0.1%异丙胺(在254nm),流速为1mL/min。分析型手性HPLC方法2:CHIRALPAK IE 250x4.6 5μm,C7/EtOH 70/30+0.1%TFA+0.3%TEA,1.5mL/min,40℃。
在以下实验描述中,可使用以下缩写:
制备1
5-甲基吡啶-3-甲醛
步骤1:将NaBH
步骤2:将MnO
制备2
四氢-2H-吡喃-2-甲醛
在惰性气氛下将DMSO(690μL,9.71mmol)添加至草酰氯(410μL,4.85mmol)在无水CH
制备3
(E)-3-(5-甲基吡嗪-2-基)丙-2-烯-1-醇
步骤1:向在MeCN/H
步骤2:在0℃将1.0M TBAF的THF溶液(12mL,12mmol)添加至2-[(1E)-3-[(叔丁基二甲基甲硅烷基)氧基]丙-1-烯-1-基]-5-甲基吡嗪(2.57g,9.72mmol)在无水THF(24mL)中的溶液。在0℃在1小时搅拌之后,将反应通过添加2.63g固体NaHCO
步骤3:将MnO
用于制备标题实施例化合物的以下中间体通过类似于上述方法的方法合成。
制备4
5-氯吡啶-3-甲醛
向(5-氯吡啶-3-基)甲醇(292mg,2.03mmol)在无水DCM(10ml)中的溶液添加MnO
制备5
(E)-3-(吡啶-3-基)丙烯醛
向3-碘吡啶(5g,24.39mmol)在DMF(25mL)和DMSO(25mL)中的搅拌的溶液添加烯丙醇(1.91mL,29.3mmol)、PdOAc
制备6
(E)-3-(5-氟吡啶-3-基)丙烯醛
向3-溴-5-氟吡啶(5.0g,28.4mmol)、Herrmann催化剂(0.533g,0.568mmol)和乙酸钠(2.56g,31.3mmol)在NMP(60mL)中的溶液(其在用氮气脱气10分钟之后在氮气下在室温在密封管中搅拌)添加丙烯醛(1.752g,31.3mmol)。将反应混合物在140℃搅拌2小时。TLC显示SM完成,然后冷却至室温,添加水(200mL),用DCM(100mL)萃取,并将有机层浓缩以得到粗产物。粗制化合物通过硅胶柱使用10-30%EtOAc/己烷纯化,得到作为浅黄色固体的(E)-3-(5-氟吡啶-3-基)丙烯醛(2.0g,12.67mmol,44.6%收率),其通过光谱分析确认。MS(m/z)152(M+H
制备7
1-(5-氟吡啶-2-基)哌啶-4-甲酸甲基酯
向哌啶-4-甲酸甲基酯(4.6ml,34.22mmol)和2-氯-5-氟吡啶(1.5g,11.4mmol)在无水甲苯(25ml)中的溶液添加叔丁醇钠(1.37g,14.25mmol)、BINAP(212mg,0.34mmol),和三(二亚苄基丙酮)二钯(0)(104mg,0.114mmol)。将混合物加热至120℃并在该温度搅拌2小时,然后冷却至室温,并添加水(30ml)和EtOAc(20ml)。分离各相,并用EtOAc(2x)萃取水层。合并的有机相经Na
用于制备标题实施例化合物的以下中间体用与上述方法类似的方法合成。
制备8
1-(噁唑-5-羰基)哌啶-4-甲酸甲基酯
在室温向哌啶-4-甲酸乙基酯(15.3g,97mmol)在2-MeTHF(300mL)中的溶液添加噁唑-5-甲酸(11.00g,97mmol)、HATU(38.9g,102mmol)和Et
制备9
1-(5-氟吡啶-2-基)哌啶-4-甲酸
将2M NaOH水溶液(9.5ml,19mmol)添加至1-(5-氟吡啶-2-基)哌啶-4-甲酸甲基酯(1.8g,7.6mmol)在THF(19ml)中的溶液。将反应混合物在室温搅拌2小时,然后通过添加HCl在1,4-二噁烷中的4M溶液(4.75ml,19mmol)淬灭。蒸发溶剂,将得到的粗物质溶解在DCM/MeOH(9/1,15ml)中并搅拌1小时。过滤固体,将滤液蒸发至干,得到作为白色-黄色粉末的标题化合物(1.1g,4.78mmol,通过UV测定的纯度:100%a/a,回收率:64%)。MS(m/z)225(M+H
用于制备标题实施例化合物的以下中间体用与上述方法类似的方法合成。
制备10
1-(嘧啶-2-基)哌啶-4-甲酸甲基酯
向哌啶-4-甲酸甲基酯(0.8g,5.59mmol)在无水MeOH(20ml)中的溶液添加2-氯嘧啶(0.7g,6.14mmol)和DIPEA(2ml,11.18mmol)。将混合物加热至回流并在该温度搅拌过夜。蒸发溶剂,并将粗混合物通过快速色谱法纯化(硅胶,Cy/EtOAC从1/0至0/1),得到标题化合物(0.25g,1.13mmol,通过UV测定的纯度>97%a/a,回收率:20%)。MS(m/z)222(M+H
制备11
1-苯基哌啶-4-甲酰氯
在0℃向1-苯基哌啶-4-甲酸(500mg,2.436mmol)在DCM(10mL)中的在氮气下搅拌的溶液滴加SOCl
用于制备标题实施例化合物的以下中间体用与上述方法类似的方法合成。亚硫酰氯可代替草酰氯或者Ghosez试剂。
制备12
(E)-3-(6-甲氧基吡啶-3-基)丙烯醛
步骤1:向6-甲氧基吡啶-3-甲醛(2g,14.6mmol)在无水CH
步骤2:在-78℃向(E)-3-(6-甲氧基吡啶-3-基)丙烯酸乙基酯(3.01g,14.5mmol)在无水甲苯(30ml)中的溶液滴加在甲苯(31.9ml)中的1M DIBAL溶液,并将反应在该温度搅拌3小时。在-78℃分批添加Na
步骤3:向(E)-3-(6-甲氧基吡啶-3-基)丙-2-烯-1-醇(2.09g,12.7mmol)在无水DCM(25ml)中的溶液添加MnO
用于制备标题实施例化合物的以下中间体用与上述方法类似的方法合成。
制备13
(E)-4-(3-氧代丙-1-烯-1-基)苯甲腈
步骤1:向在无水CH
步骤2:将(2E)-3-(4-氰基苯基)丙-2-烯酸乙基酯(1.6g,7.95mmol)溶解在15ml无水甲苯中,并将溶液冷却至-78℃。历时40分钟滴加DIBAL溶液(1M甲苯溶液,22.3ml,22.26mmol),并将反应在该温度搅拌1.5小时。将反应温热至-30/20℃并用EtOAc(5ml)和饱和酒石酸钠钾(罗谢尔盐)水溶液(30ml)淬灭,然后剧烈搅拌30分钟。将水溶液用EtOAc萃取,将合并的有机物层用盐水洗涤,干燥并在真空下浓缩,得到612mg,其为醇和相应的醛的混合物。将混合物通过快速色谱法纯化(硅胶,Cy/EtOAc从9/1至0/1),得到产物,其为混合物(419mg,2.63mmol,33%)。MS(m/z)163(醛)和160(腈)(M+H
步骤3:向上述混合物(419mg,2.6mmol)在NMP(6ml)中的溶液添加羟胺盐酸盐(269mg,3.9mmol)。将混合物在100℃搅拌1小时,然后在110℃搅拌5小时。将混合物用EtOAc稀释并用水和盐水洗涤。将有机层干燥(Na
步骤4:向醇(238mg,1.5mmol)在无水DCM(10mL)中的溶液添加MnO
用于制备标题实施例化合物的以下中间体用与上述方法类似的方法合成。
制备14
(E)-3-(4-氯苯基)丙烯醛
将甲酰甲撑基三苯基磷(Triphenylphosphornylidene acetaldehyde)(1.08g,3.55mmol)溶解在2.5ml无水DMF中并添加4-氯苯甲醛(0.5g,3.55mmol),并将反应在室温搅拌过夜。UPLC显示不完全反应,将反应混合物在40℃加热8小时,然后在室温放置过夜。尽管UPLC显示仍然不完全反应,但是仍然将反应用EtOAc稀释并洗涤至5%NaHCO
用于制备标题实施例化合物的以下中间体用与上述方法类似的方法合成。可使用THF、2-MeTHF和甲苯替代DMF。可提高温度,直到80℃。
制备15
(E)-3-(1-对甲苯磺酰基-1H-吲哚-5-基)丙烯酸乙基酯
步骤1:向1H-吲哚-5-甲醛(1.5g,8.96mmol)在无水CH
步骤2:在0℃向NaH(481mg,12.04mmol)在THF(30ml)中的悬浮液添加酯(2.16g,10.03mmol)。在0℃搅拌30min之后,向所述混合物分批添加4-甲基苯-1-磺酰氯(2.87g,15.05mmol),并在室温搅拌5小时。UPLC显示产物和起始材料的存在。将反应混合物冷却至0℃并进一步添加NaH(80mg)。将反应混合物搅拌30min,然后添加4-甲基苯-1-磺酰氯(382mg)。将反应混合物在室温搅拌过夜。第二天,UPLC检查仍然显示起始材料的存在。将反应冷却至0℃并添加NaH(80mg),然后在室温搅拌2小时。将NH
用于制备标题实施例化合物的以下中间体用与上述方法类似的方法合成。
制备16
(E)-3-(1-对甲苯磺酰基-1H-吲哚-6-基)丙烯酸乙基酯
步骤1:在室温向NaH(620mg,15.5mmol)在THF(25ml)中的悬浮液添加1H-吲哚-6-甲醛(1.5g,10.33mmol)。在室温搅拌20min之后,将4-甲基苯-1-磺酰氯(2.95g,15.5mmol)添加至混合物并在室温搅拌过夜。UPLC显示产物和起始材料的存在。将NH
步骤2:向在无水CH
制备17
(E)-3-(3-氟苯基)丙烯醛
步骤1:向(E)-3-(3-氟苯基)丙烯酸(2.88g,17.33mmol)在DCM(1mL)中的溶液添加EDC(3.49g,18.20mmol)和DMAP(0.212g,1.733mmol)。将反应搅拌15分钟,然后添加乙醇(10.12mL,173mmol),并将反应搅拌过夜。然后将反应浓缩,并吸收在DCM中,并先后用1NHCl、水、饱和碳酸氢钠和盐水洗涤。有机层经Na
步骤2:通过在-78℃滴加在DCM中的DIBAL-H(33.1mL,33.1mmol),缓慢处理(E)-3-(3-氟苯基)丙烯酸乙基酯(3.06g,15.76mmol)在DCM(2mL DCM/mmol酯)中的溶液。将所得混合物在-78℃搅拌2小时,然后用10%NaOH淬灭,并随着时间推移温热至环境温度。将反应搅拌过夜以允许NaOH破坏残留的DIBAL。将有机层用水、1N HCl,和盐水洗涤。然后有机层经MgSO
步骤3:向(E)-3-(3-氟苯基)丙-2-烯-1-醇(1.81g,11.89mmol)在DCM(24mL)中的溶液添加8克硅藻土,然后添加PCC(3.85g,17.84mmol)。通过LC/Ms监测反应。在反应完成之后,将混合物过滤并浓缩。棕色油状物通过正相纯化(10%EtOAc和至60%的己烷)进行纯化。将纯的级份收集并浓缩,提供1.12g标题化合物(63%)。NMR与结构一致。1H NMR(400MHz,DMSO-d
制备18
5-苯基-4,5-二氢-1H-吡唑
将肼(6.84mL,190mmol)加热至回流。滴加肉桂醛(10g,76mmol)在叔丁醇(20mL)中的溶液,并将混合物回流过夜。将反应混合物在减压下浓缩。然后将粗物质用DCM稀释并用水洗涤。将合并的有机层用水洗涤,然后经Na
制备19
5-苯基-4,5-二氢-1H-吡唑
将肼(6.84mL,190mmol)加热至回流。滴加肉桂醛(10g,76mmol)在叔丁醇(20mL)中的溶液,并将混合物回流过夜。将反应混合物在减压下浓缩。然后将粗物质用DCM稀释并用水洗涤。将合并的有机层用水洗涤,然后经Na
用于制备标题实施例化合物的以下中间体用与上述方法类似的方法合成。
制备20
3-(4,5-二氢-1H-吡唑-5-基)-5-氟吡啶
将肼一水合物(65%w/w水溶液,2.46mL,33.1mmol)添加至3-(5-氟吡啶-3-基)丙-2-烯醛(1g,6.62mmol)在叔丁醇(25ml)中的溶液。将反应溶液在80°加热过夜,然后在真空下除去溶剂。粗物质通过快速色谱法纯化(硅胶;AcOEt 100%至AcOEt/MeOH 97/3)作为洗脱剂),得到作为橙色油状物的3-(4,5-二氢-1H-吡唑-5-基)-5-氟吡啶(0.800g,73.2%回收)。MS(m/z)156(M+H
用于制备标题实施例化合物的以下中间体使用与上述类似的方法在80-95℃的反应温度合成。在一些情况下,用乙醇代替叔丁醇。在一些情况下,粗反应混合物在有机溶剂如DCM和水之间分配;将有机相干燥并浓缩,并将分离的粗产物不经任何进一步纯化就用于后续步骤。
制备21
3-甲基-5-苯基-4,5-二氢-1H-吡唑
将水合肼(2.6mL,82.2mmol)溶解在Et
用于制备标题实施例化合物的以下中间体用与上述方法类似的方法合成。
实施例1
(5-(5-氟吡啶-3-基)-4,5-二氢-1H-吡唑-1-基)(1-(5-甲基嘧啶-2-基)哌啶-4-基)甲酮
在0℃向草酰氯在无水DCE(1ml)中的溶液添加一滴DMF。将混合物搅拌10分钟,并在0℃添加1-(5-甲基嘧啶-2-基)哌啶-4-甲酸(135mg,0.52mmol)在无水DCE(2ml)中的溶液。将混合物搅拌45分钟,然后在0℃滴加3-(4,5-二氢-1H-吡唑-5-基)-5-氟吡啶(86mg,0.52mmol)和DIPEA(0.27ml,1.56mmol)在无水DCE(2ml)中的溶液。使混合物达到室温并在此温度搅拌30分钟。将溶液浓缩并进行反相纯化(2x),得到标题化合物(21mg,0.057mmol,通过UV测定的纯度:99%a/a,回收率:11%)。
以下中间体以类似的方式合成:
以下化合物以类似的方式合成。化合物被分离为外消旋物。如结构所示,在选择的实施例上进行手性HPLC分离以分离单一活性对映异构体。基于如实施例13中所述的作为活性对映异构体的(S)-2,2-二甲基-1-(5-苯基-4,5-二氢-1H-吡唑-1-基)丙-1-酮的指定,将活性对映异构体的绝对构型在每一情况中指定为(S)。制备方法:Chiralcel OD-H柱30mm x25cm;30%EtOH/庚烷,流速=30mL/min,波长215nm。
实施例13
(S)-2,2-二甲基-1-(5-苯基-4,5-二氢-1H-吡唑-1-基)丙-1-酮
步骤1:将肼(6.84mL,190mmol)加热至回流。滴加肉桂醛(10g,76mmol)在叔丁醇(20mL)中的溶液,并将混合物回流过夜。将反应混合物在减压下浓缩。然后将粗物质用DCM稀释并用水洗涤。将合并的有机层用水洗涤,然后经Na
步骤2:向5-苯基-4,5-二氢-1H-吡唑(150mg,1.026mmol)在DCM(3mL)中的溶液添加DIPEA(0.376mL,2.155mmol),然后添加特戊酰氯(0.153mL,1.129mmol)。反应剧烈放热。在15分钟之后,实施LC/MS并显示反应完全。将反应混合物浓缩,然后吸收在DMSO中并通过制备型HPLC纯化,提供纯的外消旋物。
对映异构体经由手性色谱法在反相HPLC(IC柱,10:90EtOH:庚烷)上分离,提供75mg(30%)(S)-2,2-二甲基-1-(5-苯基-4,5-二氢-1H-吡唑-1-基)丙-1-酮。(R)和(S)对映异构体的绝对构型通过从头VCD分析(ab initio VCD analysis)测定。MS(m/z)231(M+H
在步骤1中使用叔丁醇或EtOH作为溶剂并且在步骤2中使用DCM或DMSO作为溶剂以及DIPEA或TEA作为胺碱,以类似的方式合成以下化合物。化合物作为外消旋物分离。如上述实施例中所述,通过选择的实施例进行手性HPLC分离以分离单一活性对映异构体,如结构所示。基于如上所述的作为活性对映异构体的(S)-2,2-二甲基-1-(5-苯基-4,5-二氢-1H-吡唑-1-基)丙-1-酮的指定,将活性对映异构体的绝对构型在每一情况中指定为(S)。在实施例68中使用聚合物结合的DIPEA(见表)。
实施例90
1-(5-(1H-吲哚-6-基)-4,5-二氢-1H-吡唑-1-基)-2,2-二甲基丙-1-酮
步骤1:将(2E)-3-{1-[(4-甲基苯)磺酰基]-1H-吲哚-6-基}丙-2-烯酸乙基酯(3.08g,8.34mmol)溶解在20ml无水甲苯中并冷却至-78℃。历时40分钟向所述溶液滴加DIBAL在甲苯中的1M溶液(23.4ml,23.35mmol),并将反应在该温度搅拌1小时。将反应温热至-30/20℃并用EtOAc(6ml)和酒石酸钠钾(罗谢尔盐)饱和水溶液(50ml)淬灭,然后剧烈搅拌30分钟。将水溶液用EtOAc萃取,将合并的有机物层用盐水洗涤,干燥并在真空下浓缩,得到2.6g(95%)期望的醇。MS(m/z)310(M-OH)
步骤2:向(2E)-3-{1-[(4-甲基苯)磺酰基]-1H-吲哚-6-基}丙-2-烯-1-醇(2.6g,7.94mmol)在25ml无水DCM中的溶液添加MnO
步骤3:向(2E)-3-{1-[(4-甲基苯)磺酰基]-1H-吲哚-6-基}丙-2-烯醛(2.36g,7.25mmol)在叔丁醇(20mL)中的搅拌的溶液添加肼(65%水溶液,2.7mL,36.26mmol)。将反应在80℃搅拌4小时。真空除去溶剂,并将粗产物用DCM稀释和用NaHCO
步骤4:在0℃向在无水DCM(5mL)中的6-(4,5-二氢-1H-吡唑-5-基)-1-[(4-甲基苯)磺酰基]-1H-吲哚(0.67g,1.86mmol)添加DIPEA(0.454mL,2.6mmol),然后滴加2,2-二甲基丙酰氯(0.251mL,2.04mmol)。将反应在室温搅拌4小时,然后用1N HCl水溶液、饱和NaHCO
步骤5:向在无水EtOH(4mL)和水(2mL)中的2,2-二甲基-1-(5-{1-[(4-甲基苯)磺酰基]-1H-吲哚-6-基}-4,5-二氢-1H-吡唑-1-基)丙-1-酮(0.303g,0.72mmol)添加KOH(0.803mL,14.31mmol)。将反应在60℃搅拌过夜。在冷却之后,将冰-水和1N HCl添加至反应混合物,然后用DCM萃取。浓缩有机层,得到309mg 1-(5-(1H-吲哚-6-基)-4,5-二氢-1H-吡唑-1-基)-2,2-二甲基丙-1-酮,使其进行制备型LC/MS,得到58.4mg(30%)标题化合物。MS(m/z)270(M+H
以下化合物以类似的方式合成。在实施例92中用LiOH代替KOH。
实施例94
(1-(苯并[d]噁唑-2-基)哌啶-4-基)(5-(吡啶-3-基)-4,5-二氢-1H-吡唑-1-基)甲酮
步骤1:将肼在圆底烧瓶中在氮气气氛下加热至回流。向回流溶液滴加在叔丁醇(20mL)中的(E)-3-(吡啶-3-基)丙烯醛(2g,15.02mmol)。将混合物加热过夜。第二天,将反应浓缩并通过正相HPLC纯化。条件使用在DCM/DCM中的10%MeOH,梯度为20%至80%,历时10分钟。将纯的级份浓缩,提供1.08g(49%)期望的产物。MS(m/z)148(M+H
步骤2:向3-(4,5-二氢-1H-吡唑-5-基)吡啶(0.3g,2.038mmol)在DMSO(20mL)中的溶液添加DIPEA(0.712mL,4.08mmol),然后添加1-(叔丁氧羰基)哌啶-4-甲酸(0.467g,2.04mmol)。搅拌混合物,然后添加HATU(1.163g,3.06mmol)。反应混合物变成黄色,然后在25℃搅拌过夜。第二天,LCMS显示了产物。将该反应混合物立刻注射至制备型HPLC系统上并在酸性条件下纯化。纯的级份在轻微加热和氮气流下浓缩。使Boc基团在这些条件下断裂并用于后续反应。MS(m/z)259(M+H
步骤3:向哌啶-4-基(5-(吡啶-3-基)-4,5-二氢-1H-吡唑-1-基)甲酮(500mg,1.936mmol)在DMSO(1mL)中的溶液添加2-氯苯并[d]噁唑(297mg,1.94mmol)。将反应在100℃加热20分钟。LCMS指示产物。粗物质在酸性条件下纯化,其中将纯的级份收集并浓缩,提供75mg(8%)标题化合物。MS(m/z)376(M+H
实施例95
(1-(环丁烷羰基)哌啶-4-基)(5-苯基-4,5-二氢-1H-吡唑-1-基)甲酮
步骤1:向Boc-Inp-OH(5.18g,22.57mmol)在2-MeTHF(50mL)中的溶液先后添加DIPEA(7.17mL,41.0mmol)、HATU(10.92g,28.7mmol)和5-苯基-4,5-二氢-1H-吡唑(3g,20.52mmol)。将反应混合物在室温搅拌过夜。将反应混合物吸收在EtOAc中并用H
步骤2:向4-(5-苯基-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-甲酸叔丁基酯(16.7g,46.7mmol)在二氯甲烷(200mL)中的溶液添加3M HCl的CPME溶液(62.3mL,187mmol)。将反应混合物在室温搅拌72小时。将析出物过滤并用二异丙基醚洗涤。将固体在45℃在高真空下干燥,得到作为奶油色粉末的(5-苯基-4,5-二氢-1H-吡唑-1-基)(哌啶-4-基)甲酮盐酸盐(13g,44.2mmol,通过LCMS测定的纯度:>95%,回收率:95%)。LCMS(m/z)258(M+H
步骤3:向环丁烷甲酸(0.096mL,1.021mmol)在2-MeTHF(5mL)中的溶液先后添加DIPEA(0.357mL,2.042mmol)、HATU(388mg,1.021mmol)和(5-苯基-4,5-二氢-1H-吡唑-1-基)(哌啶-4-基)甲酮盐酸盐(200mg,0.681mmol)。将反应混合物在室温搅拌过夜。将反应混合物吸收在EtOAc中并用H
以下中间体以类似的方式合成:
第二步应用于该中间体的合成:
以下化合物以类似的方式合成。2-MeTHF可用DCM、THF和DMF替代。HATU可用T3P替代。
实施例159
(1-(环丙烷羰基)哌啶-4-基)(5-苯基-4,5-二氢-1H-吡唑-1-基)甲酮
在室温向(5-苯基-4,5-二氢-1H-吡唑-1-基)(哌啶-4-基)甲酮盐酸盐(200mg,0.681mmol)在2-MeTHF(8mL)中的在氮气下搅拌的溶液添加纯DIPEA(0.357mL,2.042mmol),然后添加纯环丙烷甲酰氯(0.093mL,1.021mmol)。将反应混合物在室温搅拌1小时。添加EtOAc(25mL),并用0.5M HCl(25mL)、NaHCO
以下化合物以类似的方式合成。对于(5-苯基-4,5-二氢-1H-吡唑-1-基)(1-(苯基磺酰基)哌啶-4-基)甲酮,酰氯用磺酰氯替代,对于用于1-(4-甲基-4-(5-苯基-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)乙酮,酰氯用乙酸酐替代。
实施例170
((2R)-1-氧代-1-(5-苯基-4,5-二氢-1H-吡唑-1-基)丙-2-基)氨基甲酸苄基酯
在室温向5-苯基-4,5-二氢-1H-吡唑(500mg,3.42mmol)在DMF(10mL)中的溶液添加(R)-2-(((苄基氧基)羰基)氨基)丙酸(763mg,3.42mmol)、EDC(983mg,5.13mmol),和HOBt(786mg,5.13mmol),然后添加TEA(1.073mL,7.70mmol)。将反应在室温搅拌过夜。一旦通过TLC(使用5%MeOH/DCM)测定反应完成,将反应混合物用冷水(20mL)稀释并用DCM(2x20mL)萃取。将合并的有机物先后用水(10mL)和盐水洗涤并经无水Na
实施例171
(5-苯基-4,5-二氢-1H-吡唑-1-基)(1-(嘧啶-2-基)哌啶-4-基)甲酮
在小瓶中,向1-(嘧啶-2-基)哌啶-4-甲酸(312mg,1.51mmol)在DMSO(1mL)中的溶液添加DIPEA(0.478mL,2.74mmol),然后添加5-苯基-4,5-二氢-1H-吡唑(200mg,1.37mmol),然后添加HATU(780mg,2.052mmol)。将反应搅拌过夜。反应用EtOAc稀释并用水和盐水洗涤。然后将有机层经MgSO
以下化合物以类似的方式合成。在一些情况中LiOH可替代KOH。一些化合物经历通过反相HPLC实施的手性分离,以分离单一对映异构体。HATU被PyBROP替代用于实施例(5-(4-(二氟甲氧基)苯基)-4,5-二氢-1H-吡唑-1-基)(1-(5-氟嘧啶-2-基)哌啶-4-基)甲酮。DMSO可被DCM、2-MeTHF或者DMF替代。
实施例189
(4-氟-1-(5-氟嘧啶-2-基)哌啶-4-基)(5-苯基-4,5-二氢-1H-吡唑-1-基)甲酮
在室温向(4-氟哌啶-4-基)(5-苯基-4,5-二氢-1H-吡唑-1-基)甲酮盐酸盐(250mg,0.802mmol)、2-氯-5-氟嘧啶(0.198mL,1.604mmol)在乙腈(8mL)中的在氮气下搅拌的悬浮液添加纯的Et
以下化合物以类似的方式合成。TEA用DIPEA替代。
实施例191
N-乙基-4-(5-苯基-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-甲酰胺
在室温向(5-苯基-4,5-二氢-1H-吡唑-1-基)(哌啶-4-基)甲酮盐酸盐(200mg,0.681mmol)和DIPEA(0.178mL,1.021mmol)在2-MeTHF(8mL)中的在氮气下搅拌的悬浮液添加纯的异氰酸乙酯(0.108mL,1.362mmol)。将反应混合物在室温搅拌过夜。添加0.5M HCl(25mL)和EtOAc(30mL)。在分离之后,将水层用EtOAc(2x 30mL)萃取。将合并的有机层用饱和盐水洗涤,经硫酸钠干燥并真空蒸发,得到无色油状物。该残留物通过柱色谱法纯化[硅胶,(EtOH/EtOAc 1:4)/CyH 0/100至100/0],得到作为泡沫状物的标题化合物,其在乙醚/二异丙基醚中析出,得到白色固体(185mg,0.563mmol,通过LCMS测定的纯度:>95%,回收率:83%)。LCMS(m/z)329(M+H
实施例192
1-(3-溴-5-苯基-4,5-二氢-1H-吡唑-1-基)-2,2-二甲基丙-1-酮
将5-苯基吡唑烷-3-酮(434mg,2.68mmol)溶解在DMF(5mL)中,并将反应混合物在冰浴中冷却至0℃。向其添加DIPEA(0.935mL,5.35mmol),然后滴加特戊酰氯(0.329mL,2.68mmol)。然后将反应混合物搅拌18小时,在此期间反应混合物温热至室温。然后将反应混合物真空浓缩,并在DCM(100mL)和水(100mL)之间分配。分离水相,并用另外的DCM(100mL)洗涤。然后将合并的有机级份真空浓缩,得到橙色/棕色油状物。其通过硅胶色谱法用EtOAc:环己烷(0-60%EtOAc)洗脱纯化,将适当的级份合并,并真空浓缩,得到5-苯基-1-特戊酰基吡唑烷-3-酮(84mg,13%),MS(m/z)247(M+H
将三溴氧化磷(54mg,0.188mmol)添加至5-苯基-1-特戊酰基吡唑烷-3-酮(72mg,0.292mmol)在乙腈(2mL)中的溶液,并将反应混合物在氮气气氛下在回流下(85℃)加热1小时50分钟。LCMS显示产物的主峰以及无起始材料剩余。将反应混合物冷却至室温并在减压下蒸发。将残留物在EtOAc(10mL)和碳酸氢钠饱和溶液(10mL)之间分配。将有机萃取液干燥(疏水的釉料)并在减压下浓缩。然后将残留物通过质量控制的自动制备型HPLC(SunfireC18柱)纯化,得到作为白色固体的标题化合物(12mg,0.039mmol,13%收率)。MS(m/z)310/312(M+H
实施例193
1-(4-(5-苯基-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)乙酮
将纯的肼一水合物(17.07mL,352mmol)加热至回流。滴加肉桂醛(19.05mL,141mmol)在叔丁醇(40mL)中的溶液,并将混合物回流过夜。将反应混合物真空蒸发,得到黄色油状物。该残留物通过柱色谱法纯化(AcOEt/CyH 0-50%),得到作为黄色油状物的5-苯基-4,5-二氢-1H-吡唑(11.645g,80mmol,56.6%收率)。MS(m/z)147(M+H
将哌啶-4-甲酸(5g,38.7mmol)在乙酸酐(36.5ml,387mmol)中的悬浮液在130℃加热3小时(反应混合物变得均匀)。在3小时之后,将反应混合物真空蒸发,得到棕色油状物,其在夜晚结晶。将固体在iPr
在室温向5-苯基-4,5-二氢-1H-吡唑(1g,6.84mmol)、1-乙酰基哌啶-4-甲酸(1.757g,10.26mmol)和DIPEA(2.389mL,13.68mmol)在DCM(30mL)中的在氮气下搅拌的溶液添加固体HATU(3.90g,10.26mmol)。将反应混合物在室温搅拌过夜。向反应混合物添加0.5MHCl(100mL)和EtOAc(100mL)。在分离之后,用EtOAc(2x 100mL)萃取水层。将合并的有机相用饱和盐水洗涤,经硫酸钠干燥并真空蒸发,得到深橙色油状物。柱色谱法[(EtOAc/EtOH4:1)/CyH 0-100%)未能得到纯的预期的产物。柱色谱法的第二次尝试(EtOH/DCM 0-5%)得到作为浅黄色油状物的纯的1-(4-(5-苯基-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)乙酮(926mg,3.09mmol,45%收率)。MS(m/z)300(M+H
将对映异构体经由手性色谱法在反相HPLC(Chiralpak AD-H,5μm,1mL/min;C7/EtOH 50/50)上分离,提供125mg(25%)(S)-2,2-二甲基-1-(5-苯基-4,5-二氢-1H-吡唑-1-基)丙-1-酮(Rt=10.1min)和125mg(25%)(R)-2,2-二甲基-1-(5-苯基-4,5-二氢-1H-吡唑-1-基)丙-1-酮(Rt=16.3min),其为白色固体。基于如上所述的作为活性对映异构体的(S)-2,2-二甲基-1-(5-苯基-4,5-二氢-1H-吡唑-1-基)丙-1-酮的指定,将活性对映异构体的绝对构型指定为(S)。MS(m/z)300(M+H
以下化合物以类似的方式,使用2-(3H-[1,2,3]三唑并[4,5-b]吡啶-3-基)-1,1,3,3-四甲基异脲鎓六氟磷酸盐(V)(HATU)或者溴化三吡咯烷基鏻六氟磷酸盐(PyBroP)作为偶联剂和使用DCM或者DMF作为溶剂合成。
实施例196
(S)-1-(4-(5-(3-氟苯基)-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)乙酮
在0℃向1-甲基咪唑(3.88mL,48.7mmol)在DCM(15mL)中的搅拌的溶液添加甲烷磺酰氯(0.95mL,12.2mmol),并将反应混合物在0℃搅拌15min,然后在0℃添加1-乙酰基哌啶-4-甲酸(2.1g,12.2mmol),将所得反应混合物在室温搅拌1小时。然后添加5-(3-氟苯基)-4,5-二氢-1H-吡唑(2g,12.18mmol)在DCM(15.00mL)中的溶液,然后将内容物在室温搅拌16小时。然后添加碳酸氢钠溶液(30mL),并用DCM(2X 30mL)萃取,将合并的有机物经无水Na
将粗产物通过硅胶(100-200目)柱,使用0.5-1%MeOH/DCM纯化,得到1.1g期望的化合物,其通过制备型HPLC进一步纯化,得到作为白色固体的1-(4-(5-(3-氟苯基)-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)乙酮(800mg,2.5mmol,20%收率)。MS(m/z)318(M+H
以下化合物以类似的方式合成。
实施例203
(S)-1-(4-(5-(3,5-二氟苯基)-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)乙酮
步骤1:在10℃向3,5-二氟苯甲醛(200g,1.407mol)在H
步骤2:在0℃向肼一水合物(118mL,2427mmol)在EtOH(2.2L)中的搅拌的溶液添加纯的乙酸(150mL,2.629mol)。在添加结束之后,分批添加固体3-(3,5-二氟苯基)丙烯醛(340g,2.022mol)。将反应混合物在100℃搅拌21小时。将反应混合物真空蒸发,得到作为橙色油状物的5-(3,5-二氟苯基)-4,5-二氢-1H-吡唑(365g,2.004mol,纯度:51%,回收率:99%)。该油状物不经进一步纯化就用于后续反应。LCMS(m/z)183(M+H
步骤3A:4-(1H-咪唑-1-羰基)哌啶-1-甲酸叔丁基酯的合成:
在0℃将1-(叔丁氧羰基)哌啶-4-甲酸(512g,2233mmol)溶解在DCM(2L)中。分批添加1,1′-羰基二咪唑(380g,2345mmol),并将反应混合物在室温搅拌2小时。添加H
步骤3B:在室温向5-(3,5-二氟苯基)-4,5-二氢-1H-吡唑(365g,2.004mol)在THF(1.5L)中的搅拌的溶液分批添加固体4-(1H-咪唑-1-羰基)哌啶-1-甲酸叔丁基酯(560g,2.004mol)。将反应混合物在室温搅拌1小时并在80℃加热4小时。将反应混合物真空蒸发。添加DCM(1.5L)并用H
步骤4:在室温向4-(5-(3,5-二氟苯基)-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-甲酸叔丁基酯(858g,2.181mol)在DCM(1.5L)中的搅拌的溶液分批添加HCl在CPME中的3M溶液(1.454L,4.362mol)。将反应混合物在室温搅拌30小时。将固体过滤,先后用iPr
步骤5:向(5-(3,5-二氟苯基)-4,5-二氢-1H-吡唑-1-基)(哌啶-4-基)甲酮盐酸盐(460g,1.395mol)在H
步骤6:在0℃向(S)-(5-(3,5-二氟苯基)-4,5-二氢-1H-吡唑-1-基)(哌啶-4-基)甲酮,1R-(-)-樟脑-10-磺酸盐(182g,346mmol)在DCM(1.3L)中的悬浮液滴加TEA(121mL,866mmol)。滴加纯的Ac
图5的PXRD图从(S)-1-(4-(5-(3,5-二氟苯基)-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)乙酮的样品(所述样品通过以下方法制备:在热乙醚中研磨,然后冷却至室温并过滤),使用Rigaku Miniflex II Desktop X-射线衍射仪如下得到。将材料装载在零背景载玻片样品架上并根据以下参数进行扫描:
开始角度=2停止角度=40
步宽=0.02
计数时间=1.0
kV=30mA=15
扫描轴=2θ/θ。
实施例204
1-(4-(5-(4-氯苯基)-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)乙酮
在0℃向1-乙酰基哌啶-4-甲酰氯(1.05g,5.54mmol)在DCM(20mL)中的在氮气下搅拌的溶液添加DIPEA(2.4mL,13.8mmol),然后在1min内分批添加5-(4-氯苯基)-4,5-二氢-1H-吡唑(0.5g,2.77mmol)。将反应混合物在室温搅拌约16小时。通过TLC监测反应。TLC流动相:40%EtOAc/己烷,Rf值:0.2。将反应混合物用水(10mL)稀释并用DCM(3x30 mL)萃取,将分离的有机层用饱和碳酸氢盐溶液(25ml)和盐水溶液(25mL)洗涤并经无水Na
以下化合物使用DIPEA或者TEA作为碱以类似的方式合成。
实施例207
(5-苯基-4,5-二氢-1H-吡唑-1-基)(1-(噻唑-2-基)哌啶-4-基)甲酮
在0℃向4-(氯化羰基)哌啶-1-甲酸叔丁基酯(10.2g,41mmol)在DCM(100mL)中的溶液添加5-苯基-4,5-二氢-1H-吡唑(15g,103mmol)和DIPEA(54mL,308mmol),并将反应在室温搅拌3小时。添加水(100mL)并用DCM(2x 100mL)萃取,将有机层分离并经无水Na
在0℃向4-(5-苯基-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-甲酸叔丁基酯(2.7g,7.55mmol)在DCM(40mL)中的溶液添加TFA(2.9mL,37.8mmol),并将反应在室温搅拌4小时。在反应完成之后,在减压下除去溶剂,得到粗产物。将得到的粗产物溶解在MeOH(50mL)中并添加amberlyst A-21离子交换树脂至PH~8,将树脂过滤,将滤液浓缩并在高真空下干燥,得到作为白色固体的(5-苯基-4,5-二氢-1H-吡唑-1-基)(哌啶-4-基)甲酮(1.5g,5.78mmol,76%收率)。MS(m/z)258(M+H
向(5-苯基-4,5-二氢-1H-吡唑-1-基)(哌啶-4-基)甲酮(1g,3.89mmol)和2-溴噻唑(0.765g,4.66mmol)在无水DMF(10mL)中的溶液添加Cs
通过实施例90的方法还制备了以下化合物:
通过实施例171的方法还制备了以下化合物:
药物组合物
实施例A-软膏剂通过以下方法制备:组合20%(w/w)实施例8化合物和80%(w/w)矿脂。使混合物通过轧制机,直到得到一致的均匀性。
实施例B-喷雾剂:溶液从以下组分制备:[成分(量(w/w))]:化合物8(1.00)、丙二醇(5.00)、聚山梨醇酯80(1.00)、乙醇(78.00)、纯净水(15.00)。将溶液置于常规气溶胶容器中,连接阀机构,并将容器充氮气至100psig。
实施例C-片剂使用常规方法制备并如下配制:[成分(量/片剂)]:化合物(5mg)、微晶纤维素(100mg)、乳糖(100mg)、淀粉羟乙酸钠(30mg)、硬脂酸镁(2mg)。
实施例D–胶囊剂使用常规方法制备并如下配制:[成分(量/片剂)]:化合物(15mg)、干淀粉(178mg)、硬脂酸镁(2mg)。
生物学试验:
体外生物学试验
使用基于荧光偏振的结合试验来评估本发明化合物的活性,其细节公开于国际专利申请PCT/IB2014/059004,现在的国际专利申请公开号WO2014/125444。
将pIC
如使用上述方法所测定,实施例1-209的化合物呈现出在约5.0和9.0之间的pIC
例如,实施例1、2、4-6、9、11、13、14、15、18、20-22、25、27-50、53-63、65-69、71-77、80、81、90-94、170-173、175、176、178-181和208的化合物呈现在约6.0和9.0之间的pIC
实施例2、3、5-7、9、10、13-16、18、19、21、22、26、29、32、33、36-38、40、43、44、53、54、56、58、62、65-68、70、75、76、79、80、83、85、87、93、95、102、105、109、112-114、116、122-125、130、131、133、136-140、143、145-149、151-159、164、168、169、171、172、175-180、183-185、187-190、193、196-199、203、205和207的化合物呈现在约7.0和9.0之间的pIC
例如,实施例2、13、15、32、40、42、44、48、50、56、62、66、68、91、93和172的化合物在上述方法中各自以约7.4、7.7、7.1、7.5、7.3、6.7、7.8、6.4、6.2、7.2、7.1、7.5、8.1、6.6、7.0和7.8的平均pIC
体内生物学试验
利用TNF驱动的全身炎症反应综合症模型(Duprez,L.等人,2011.Immunity 35(6):908-918),使用TNF加上半胱天冬酶抑制剂zVAD,可以在小鼠体内测试RIP1抑制剂的效力。该模型在大约3小时结束(按照IACUC指导,分析温度损失)。TNF(或TNF/zVAD)诱导表现包括温度损失,外周大量细胞因子的生成(包括IL-6,IL-1b,MIP1β和MIP2),肝脏炎症和肠炎症,以及血清中细胞标记物(LDH和CK)和肝脏损伤标记物(AST和ALT)的增加。对这些TNF/zVAD诱导的现象的抑制可以通过用所选化合物IP预先给药来显示。例如,在同时静脉内给药小鼠TNF(30μg/小鼠)和zVAD(0.4mg/小鼠)之前15分钟,将小鼠(每组8个小鼠)预先IP给药媒介物或者化合物。在小鼠中的温度损失通过直肠探针测得。根据我们的IACUC协议,当对照组损失7度时,研究终止。所有数据显示为平均值±平均值的标准误差。在图1A-3B中分别提供了实施例13、193和203的化合物的代表性数据,其随时间推移表示以及在2.5、3和2.5小时的时间点表示。在该模型中测试的实施例13、48、66、155、158、193和203的化合物的数据提供在表1中。
表1.
该模型可以长期形式(仅使用TNF,静脉注射)进行,其在~8小时内导致研究结束(按照IACUC指导,分析温度损失)。对于模型的TNF(单独)形式,在静脉内给药小鼠TNF(30μg/小鼠)之前15分钟,将小鼠(每组8个小鼠)以100mg/kg预先口服给药媒介物或者测试化合物。所有数据显示为平均值±平均值的标准误差。表2中提供了在该模型中测试的化合物的数据。在图4A和4B中分别提供了随时间推移表示的和在7.5小时的时间点表示的实施例203的代表性数据。
表2.
生物体外细胞试验
RIP1抑制剂的效力可以利用人类单核细胞性白血病U937或小鼠L929纤维肉瘤细胞,通过小鼠体外坏死性凋亡测定实验来测试。如使用在He,S.et al.2009.Cell 137(6):1100-1111和国际专利申请PCT/IB2014/059004(现在的国际专利申请公开号WO2014/125444)中所述的方法测定,实施例1-209的化合物呈现在约5.0和9.0之间的pIC
例如,实施例2、3、6、7、9、10、13-16、18、19、22、40、43、44、53、54、56、58、62、65-68、76、79、80、87、105、108、112、114、122、124、125、130、131、139、140、146-148、151、153-155、158、164、171、172、175-177、179、180、184、185、187-190的化合物在上述方法中以约7.0和9.0之间的平均pIC
例如,实施例3、7、13、15、40、44、50、53、56、60、65、66、68、76、79、93,和190的化合物在上述方法中以约7.0和9.0之间的平均pIC
例如,实施例2、13、15、32、40、42、44、48、50、56、62、66、68、91、93和172的化合物在上述方法中分别以约7.8、8.3、7.2、6.8、7.5、6.6、7.8、6.4、6.8、7.5、7.2、8.0、8.6、7.0、7.0和8.0的平均pIC
此外,实施例16、17、23、64、81、174和209的化合物在上述方法中分别以约7.9、6.2、6.3、6.5、6.2、6.3和5.7的平均pIC
例如,实施例2、13、15、40、44、48、50、56、66、68、91、93和172的化合物在上述方法中分别以约6.7、8.3、7.7、7.8、7.4、6.7、7.7、7.3、11.8、8.3、6.6、7.1和6.2的平均pIC
参考文献:WO2010075561A;EP295695(US4,839,376;US4,990,529);EP322691(US4,895,947);WO2009086303(US20090163545);Postovskii,I.Y.;Vereshchagina,N.N.,Doklady Akademii Nauk SSSR,110,802-804(1956);Liu,X.-H.,Hecheng Huaxue,15(2),212-215(2007);Santos,J.M.;Lopez,Y.;Aparicio,D.;Palacios,F.,J.Org.Chem.,73(2),550-557(2008);Liu,X.-H.;Zhu,J.;Pan,C.–X.;Song,B.-A.,Yingyong Huaxue,24(10),1162-1166(2007)。
综上,本申请涉及以下方面:
1.根据式(I)的化合物或其盐,
其中:
R
其中所述取代的(C
其中所述任选取代的(C
所述取代的(C
其中所述苯基、5-6元杂芳基或者9-元杂芳基任选被1个或者2个取代基取代,所述取代基独立地选自卤素、(C
R
其中所述取代的苯基、(C
R
条件是所述化合物不为环己基(5-苯基-4,5-二氢-1H-吡唑-1-基)甲酮。
2.根据项1的化合物或其盐,其中:
R
其中所述取代的(C
所述取代的(C
R
其中所述取代的苯基、(C
R
3.根据项1的化合物或其盐,其中:
R
其中所述取代的(C
所述取代的(C
R
4.根据项1-3中的任一项的化合物或其盐,所述化合物具有式(II):
5.根据项1-4中的任一项的化合物或其盐,其中R
6.根据项1-4中的任一项的化合物或其盐,其中R
7.根据项1-4中的任一项的化合物或其盐,其中R
8.根据项1-4中的任一项的化合物或其盐,其中R
9.根据项1-4中的任一项的化合物或其盐,其中R
10.根据项1-4中的任一项的化合物或其盐,其中R
11.根据项1-10中的任一项的化合物或其盐,其中R
其中所述取代的苯基、(C
12.根据项1-10中的任一项的化合物或其盐,其中R
13.根据项1-10中的任一项的化合物或其盐,其中R
14.根据项1-10中的任一项的化合物或其盐,其中R
15.根据项1-14中的任一项的化合物或其盐,其中R
16.根据项1-15中的任一项的化合物或其盐,其中所述盐为药学上可接受的盐。
17.化合物,其为(S)-1-(4-(5-(3,5-二氟苯基)-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)乙酮,或其药学上可接受的盐。
18.化合物,其为(S)-1-(4-(5-(3,5-二氟苯基)-4,5-二氢-1H-吡唑-1-羰基)哌啶-1-基)乙酮。
19.根据项18的化合物,其提供基本上与图5一致的PXRD图。
20.药物组合物,其包含根据项16-19中的任一项的化合物或其药学上可接受的盐,和一种或者多种药学上可接受的赋形剂。
21.根据项20的药物组合物,其还包含至少一种其它治疗活性剂。
22.根据项16-19中的任一项的化合物或其药学上可接受的盐,其用于治疗。
23.治疗RIP1激酶介导的疾病或者障碍的方法,其包括将治疗有效量的根据项16-19中的任一项的化合物或其药学上可接受的盐给药于需要的人。
24.根据项16-19中的任一项的化合物或其药学上可接受的盐在制备用于治疗RIP1激酶介导的疾病或者障碍的药物中的用途。
25.根据项16-19中的任一项的化合物或其药学上可接受的盐,其用于治疗RIP1激酶介导的疾病或者障碍。
26.根据式(III)的化合物或其药学上可接受的盐,其用于治疗,
其中:
R
其中所述取代的(C
其中所述任选取代的(C
所述取代的(C
其中所述苯基、5-6元杂芳基或者9-元杂芳基任选被1个或者2个取代基取代,所述取代基独立地选自卤素、(C
R
其中所述取代的苯基、(C
R
- 作为激酶抑制剂的杂环酰胺
- 作为激酶抑制剂的杂环酰胺
