通过递送抗OSMRβ抗体治疗皮肤疾病或病症
文献发布时间:2023-06-19 10:18:07
相关申请的交叉引用
本申请要求于2018年4月25日提交的美国临时专利申请序列号62/662,607、于2018年8月13日提交的美国临时专利申请序列号62/718,324、于2018年9月14日提交的美国临时专利申请序列号62/731,618、于2018年11月7日提交的美国临时专利申请序列号62/757,047、于2018年8月16日提交的美国临时专利申请序列号62/765,033、于2018年12月4日提交的美国临时专利申请序列号62/775,350、于2019年1月7日提交的美国临时专利申请序列号62/789,434和于2019年1月18日提交的美国临时专利申请序列号62/794,356的权益和优先权,其各自的内容并入本文中。
以引用方式并入序列表
于2019年4月25日创建的、大小为17.2KB的名为“KPL-003WO_ST25.txt”的文本文件的内容据此整体以引用方式并入。
背景技术
特应性皮炎是一种慢性炎症性皮肤病症,其主要特征在于极度瘙痒,导致抓挠和擦伤,继而导致典型的湿疹病变。多种疾病和病症均伴有瘙痒症(瘙痒)。例如,患有肾衰竭(通常是终末期肾病(ESRD))的患者通常受到严重的瘙痒症(尿毒症瘙痒)的困扰。结节性痒疹(PN),也称为结节性瘙痒症,是一种皮肤病,其特征在于通常在手臂和腿部出现发痒的结节。患者经常出现由抓挠引起的多发性表皮脱落病变。严重瘙痒症是一种严重使人虚弱的病状。与特应性皮炎和尿毒症瘙痒相关的不适且通常疼痛的症状包括瘙痒、肿胀、发红、起水泡、结痂、溃疡、疼痛、鳞化、开裂、脱发、结疤或皮肤、眼睛或黏膜有渗出液。伴有瘙痒症的其他使人虚弱的皮肤病状包括慢性特发性瘙痒症、慢性特发性荨麻疹、慢性自发性荨麻疹、皮肤淀粉样变、慢性单纯性苔藓、斑块状银屑病、扁平苔藓、炎症性鱼鳞癣、肥大细胞增生病和大疱性类天疱疮。
控制瘙痒症的需要导致寻找既安全又有效的治疗剂。当全身施用时,皮质类固醇在这方面是有效的,但伴随有明显且可能危险的副作用。局部施用的皮质类固醇在治疗这些病状方面有某些疗效,但在许多情况下仅部分有效,并有其自身明显的副作用。其他药剂对治疗某些皮炎和尿毒症瘙痒具有部分效用。
发明内容
本发明尤其提供了使用抗OSMRβ抗体治疗瘙痒性或炎性皮肤疾病或病症或者与某疾病或病症相关的瘙痒症的方法。特别地,本发明提供了用于治疗结节性痒疹、特应性皮炎、尿毒症瘙痒以及与慢性特发性瘙痒症、慢性特发性荨麻疹、慢性自发性荨麻疹、皮肤淀粉样变、慢性单纯性苔藓、斑块状银屑病、扁平苔癣、炎症性鱼鳞癣、肥大细胞增生病和大疱性类天疱疮等有关的瘙痒症的方法。
一方面,本发明提供了用于治疗结节性痒疹的方法,该方法包括以下步骤:相对于对照而言,以治疗有效剂量和施用间隔向需要治疗的受试者施用抗OSMRβ抗体一段足以改善、稳定或减轻结节性痒疹的一种或多种症状的治疗周期。在一些实施方案中,该受试者表现为瘙痒性过角化结节。
在一些实施方案中,结节性痒疹是特发性的。在一些实施方案中,结节性痒疹不与任何其他潜在的合并症相关。
在一些实施方案中,结节性痒疹与一种或多种潜在的合并症相关。
在一些实施方案中,相对于对照而言,受试者中的IL-31表达水平升高。在一些实施方案中,相对于对照而言,受试者中的IL-31表达水平没有升高。在一些实施方案中,受瘙痒性疾病或病状影响的受试者的一部分皮肤中的IL-31表达水平与以下中的IL-31表达水平大致相同:(i)未受瘙痒性疾病或病状影响的受试者的一部分皮肤,或(ii)未诊断为瘙痒性疾病或病症的健康受试者的一部分正常皮肤。在一些实施方案中,相对于对照而言,受试者中的IL-31Rα表达水平升高。在一些实施方案中,相对于对照而言,受试者中的OSM表达水平升高。在一些实施方案中,相对于对照而言,受试者中的OSMRβ表达水平升高。在一些实施方案中,相对于对照而言,受试者中的OSMRβ表达水平没有升高。在一些实施方案中,受瘙痒性疾病或病症影响的受试者的一部分皮肤中的OSMRβ表达水平与以下中的OSMRβ表达水平大致相同:(i)未受瘙痒性疾病或病症影响的受试者的一部分皮肤,或(ii)未诊断为瘙痒性疾病或病症的健康受试者的一部分正常皮肤。
在一些实施方案中,受试者中的IL-31、IL-31Rα、OSM和OSMRβ中的任一种的水平通过来自过角化结节的皮肤活检来测定。在一些实施方案中,对照是未被诊断为瘙痒性疾病的健康受试者。
在一些实施方案中,需要治疗的受试者的瘙痒NRS得分大于或等于5。
在一些实施方案中,需要治疗的受试者的瘙痒NRS得分大于或等于7。
在一些实施方案中,与对照受试者相比,需要治疗的受试者的MCP-1/CCL2水平升高。
在一些实施方案中,治疗导致受试者中MCP-1/CCL2水平的降低。
在一些实施方案中,治疗导致受试者中MCP-1/CCL2水平的降低等同于健康受试者中的水平。在一些实施方案中,治疗导致受试者中MCP-1/CCL2水平的降低等同于未患有疾病的对照受试者中的水平。
在另一方面,本发明提供了治疗特应性皮炎的方法,该方法包括以下步骤:相对于对照而言,以治疗有效剂量和施用间隔向需要治疗的受试者施用抗OSMRβ抗体一段足以改善、稳定或减轻特应性皮炎的一种或多种症状的治疗周期。在一些实施方案中,施用步骤包括皮下施用。在一些实施方案中,施用步骤包括静脉内施用。在一些实施方案中,施用步骤包括静脉内施用,然后是皮下施用。在一些实施方案中,皮下施用通过皮下注射进行。在一些实施方案中,皮下施用通过皮下泵进行。在一些实施方案中,治疗有效剂量包括初始冲击剂量(bolus dose)或负荷剂量(loading dose)。在一些实施方案中,治疗有效剂量包括维持剂量。在一些实施方案中,治疗有效剂量包括初始冲击剂量或负荷剂量,然后是至少一个维持剂量。在一些实施方案中,治疗有效剂量是初始冲击剂量或负荷剂量,并且其中该方法还包括施用至少一个维持剂量。在一些实施方案中,施用步骤包括初始冲击剂量或负荷剂量,然后是至少一个维持剂量。在一些实施方案中,初始冲击剂量或负荷剂量大于至少一个维持剂量。在一些实施方案中,初始冲击剂量或负荷剂量的剂量是至少一个维持剂量的剂量的至少一倍、二倍、三倍、四倍或五倍。在一些实施方案中,初始冲击剂量或负荷剂量的剂量是至少一个维持剂量的剂量的两倍。
在一些实施方案中,施用间隔是每天。在一些实施方案中,施用间隔是每隔一天。在一些实施方案中,施用间隔是一周多次。在一些实施方案中,施用间隔是每周一次。在一些实施方案中,施用间隔是每两周一次。在一些实施方案中,施用间隔是每三周一次。在一些实施方案中,施用间隔是每四周一次。在一些实施方案中,施用间隔是每五周一次。
在一些实施方案中,特应性皮炎的一种或多种症状由特应性皮炎的研究者总体评估(IGA)来评估。在一些实施方案中,特应性皮炎的一种或多种症状由湿疹面积与严重性指数(EASI)来评估。在一些实施方案中,特应性皮炎的一种或多种症状由特应性皮炎评分来评估。在一些实施方案中,特应性皮炎的一种或多种症状由特应性皮炎区域照片来评估。在一些实施方案中,特应性皮炎的一种或多种症状由特应性皮炎的体表面积受累(BSA)来评估。在一些实施方案中,特应性皮炎的一种或多种症状皮肤由病生活质量指数(DLQI)来评估。在一些实施方案中,特应性皮炎的一种或多种症状由医院焦虑抑郁量表(HADS)来评估。在一些实施方案中,特应性皮炎的一种或多种症状(例如睡眠质量和睡眠量)由体动记录仪来评估。在一些实施方案中,特应性皮炎的一种或多种症状由定量数值瘙痒量表(例如瘙痒数值评定量表(NRS)、视觉模拟量表(VAS)或语言评定量表(VRS))来评估。瘙痒VAS是SCORAD的组成部分,并反映前3天经历的平均瘙痒症,其中0=无瘙痒,10=可以想象的最严重瘙痒。在一些实施方案中,抗OSMRβ抗体的施用导致定量数值瘙痒量表在统计学上显著下降。在一些实施方案中,抗OSMRβ抗体的施用导致受试者生活质量、睡眠质量和睡眠量的改善中的至少一种。在一些实施方案中,在指定的研究访视时,睡眠不足由睡眠不足VAS(SCORAD的组成部分)来评估。睡眠不足VAS反映前3个晚上经历的平均失眠水平。0=没有失眠,10=可以想象的最严重的失眠。
通常,对照指示未经治疗的特应性皮炎的一个或多个疾病参数。在一些实施方案中,对照是患有类似疾病状态但未治疗的受试者的疾病参数的相应值。在一些实施方案中,对照是具有类似疾病状态但使用安慰剂治疗的受试者的疾病参数的相应值。在一些实施方案中,对照是受试者在治疗前的疾病参数(也称为基线)的相应值。在一些实施方案中,对照是基于集体知识或历史数据指示未经治疗的疾病参数的参考值。
在一些实施方案中,治疗前受试者中的特应性皮炎的一种或多种症状包括瘙痒NRS得分大于或等于4或使用定量数值瘙痒量表的等效评估。在一些实施方案中,治疗前受试者中的特应性皮炎的一种或多种症状包括瘙痒NRS得分大于或等于7或使用定量数值瘙痒量表的等效评估。在一些实施方案中,需要治疗的受试者已被诊断为中度至重度特应性皮炎,其中中度至重度特应性皮炎包括3或4的IGA和大约10%或更多的BSA受累。在一些实施方案中,对照指示具有相同疾病状态而未经治疗的对照受试者的特应性皮炎的一种或多种症状。在一些实施方案中,对照指示具有相同疾病状态并施用安慰剂的对照受试者的特应性皮炎的一种或多种症状。
在一些实施方案中,施用不在受试者中导致严重的不良反应。在一些实施方案中,施用不会导致外周性水肿、特应性皮炎恶化、鼻咽炎、上呼吸道感染、肌酸磷酸激酶增加、结膜炎、睑缘炎、口腔疱疹、角膜炎、眼睛瘙痒、其他单纯疱疹病毒感染和干眼症中的一种或多种。
在另一方面,本发明提供了治疗尿毒症瘙痒的方法,该方法包括以下步骤:相对于对照而言,以治疗有效剂量和施用间隔向需要治疗的受试者施用抗OSMRβ抗体一段足以改善、稳定或减轻尿毒症瘙痒的一种或多种症状的治疗周期。在一些实施方案中,施用步骤包括皮下施用。在一些实施方案中,施用步骤包括静脉内施用。在一些实施方案中,施用步骤包括静脉内施用,然后是皮下施用。在一些实施方案中,皮下施用通过皮下注射进行。在一些实施方案中,皮下施用通过皮下泵进行。在一些实施方案中,施用步骤包括初始冲击剂量或负荷剂量,然后是至少一个维持剂量。在一些实施方案中,初始冲击剂量或负荷剂量大于至少一个维持剂量。在一些实施方案中,初始冲击剂量或负荷剂量的剂量是至少一个维持剂量的剂量的至少一倍、二倍、三倍、四倍或五倍。在一些实施方案中,初始冲击剂量或负荷剂量的剂量是至少一个维持剂量的剂量的两倍。如本文所用,初始冲击剂量或负荷剂量以及初始负荷剂量和初始剂量是可互换使用的术语。
在一些实施方案中,尿毒症瘙痒的一种或多种症状由皮肤病生活质量指数(DLQI)来评估。在一些实施方案中,尿毒症瘙痒的一种或多种症状由医院焦虑抑郁量表(HADS)来评估。在一些实施方案中,特异性皮炎的一种或多种症状,例如睡眠质量和睡眠量,由体动记录仪来评估。在一些实施方案中,抗OSMRβ抗体的施用导致受试者生活质量、睡眠质量和睡眠量的改善中的至少一种。
在一些实施方案中,对照指示治疗前受试者的尿毒症瘙痒的一种或多种症状。在一些实施方案中,治疗前受试者的尿毒症瘙痒的一种或多种症状包括瘙痒NRS得分大于或等于5或使用定量数值瘙痒量表的等效评估。在一些实施方案中,治疗前受试者的尿毒症瘙痒的一种或多种症状包括瘙痒NRS得分大于或等于7或使用定量数值瘙痒量表的等效评估。在一些实施方案中,需要治疗的受试者患有终末期肾脏疾病。在一些实施方案中,需要治疗的受试者接受每周至少一次的血液透析方案。在一些实施方案中,需要治疗的受试者每周接受三次血液透析方案。在一些实施方案中,每周三次血液透析方案已经稳定至少三个月。在一些实施方案中,对照指示具有相同疾病状态而未经治疗的对照受试者的尿毒症瘙痒的一种或多种症状。在一些实施方案中,对照指示具有相同疾病状态并施用安慰剂的对照受试者的尿毒症瘙痒的一种或多种症状。
在另一方面,本发明提供了用于治疗患有肾脏疾病的受试者的瘙痒症的方法和组合物。在一些实施方案中,受试者患有慢性肾脏疾病。在一些实施方案中,患有慢性肾脏疾病的受试者未经历透析。在一些实施方案中,本发明提供了用于治疗透析前受试者中的与慢性肾脏疾病相关的瘙痒症的方法和组合物。
在一些实施方案中,该方法包括以下步骤:相对于对照而言,以治疗有效剂量和施用间隔向需要治疗的受试者施用抗OSMRβ抗体一段足以改善、稳定或减轻慢性肾脏疾病的一种或多种症状的治疗周期。在一些实施方案中,施用步骤包括皮下施用。在一些实施方案中,施用步骤包括静脉内施用。在一些实施方案中,施用步骤包括静脉内施用,然后是皮下施用。在一些实施方案中,皮下施用通过皮下注射进行。在一些实施方案中,皮下施用通过皮下泵进行。在一些实施方案中,施用步骤包括初始冲击剂量或负荷剂量,然后是至少一个维持剂量。
在一些实施方案中,施用间隔是每天。在一些实施方案中,施用间隔是每隔一天。在一些实施方案中,施用间隔是一周多次。在一些实施方案中,施用间隔是每周一次。在一些实施方案中,施用间隔是每两周一次。在一些实施方案中,施用间隔是每三周一次。在一些实施方案中,施用间隔是每四周一次。在一些实施方案中,施用间隔是每五周一次。
在一些实施方案中,治疗周期与受试者进行血液透析的时间一样长。在一些实施方案中,施用步骤发生在受试者进行血液透析前的一天。在其他实施方案中,施用步骤发生在血液透析期间。在其他实施方案中,施用步骤发生在血液透析完成后的血液透析当天。在其他实施方案中,施用步骤发生在血液透析后的一天之内。
在一些实施方案中,尿毒症瘙痒的一种或多种症状由定量数值瘙痒量表,例如,瘙痒数值评定量表(NRS)、视觉模拟量表(VAS)或语言评定量表(VRS),来评估。在一些实施方案中,抗OSMRβ抗体的施用导致定量数值瘙痒量表在统计学上的显著下降。
在另一方面,本发明提供了一种用于治疗患有选自以下疾病或病状的受试者的瘙痒症的方法:慢性特发性瘙痒症(CIP)、慢性特发性荨麻疹(CIU)、慢性自发性荨麻疹(CSU)、皮肤淀粉样变(CA)、慢性单纯性苔藓(LSC)、斑块状银屑病(PP)、扁平苔藓(LP)、炎症性鱼鳞癣(II)、肥大细胞增生病(MA)和大疱性类天疱疮(BP)。在一些实施方案中,该方法包括步骤:相对于对照而言,以治疗有效剂量和施用间隔向需要治疗的受试者施用抗OSMRβ抗体一段足以改善、稳定或减轻瘙痒症的治疗周期。
在一些实施方案中,受试者患有CIP。在一些实施方案中,受试者患有CSU。在一些实施方案中,受试者患有CIU。在一些实施方案中,受试者患有CA。在一些实施方案中,受试者患有LSC。在一些实施方案中,受试者患有PP。在一些实施方案中,受试者患有LP。在一些实施方案中,受试者患有II。在一些实施方案中,受试者患有MA。在一些实施方案中,受试者患有BP。
在一些实施方案中,本发明提供了一种治疗CIU的方法,该方法包括步骤:相对于对照而言,以治疗有效剂量和施用间隔向需要治疗的受试者施用抗OSMRβ抗体一段足以改善、稳定或减轻荨麻疹的一种或多种症状的治疗周期。
在一些实施方案中,施用不在受试者中导致严重的不良反应。在一些实施方案中,施用不会导致外周性水肿、鼻咽炎、上呼吸道感染、肌酸磷酸激酶增加、结膜炎、睑缘炎、口腔疱疹、角膜炎、眼睛瘙痒、其他单纯疱疹病毒感染和干眼症中的一种或多种。
在本文所述的各个方面和实施方案中,抗OSMRβ抗体包含由SEQ ID NO:8定义的轻链互补决定区1(LCDR1)、由SEQ ID NO:9定义的轻链互补决定区2(LCDR2)和由SEQ ID NO:10定义的轻链互补决定区3(LCDR3)以及由SEQ ID NO:5定义的重链互补决定区1(HCDR1)、由SEQ ID NO:6定义的重链互补决定区2(HCDR2)和由SEQ ID NO:7定义的重链互补决定区3(HCDR3)。
在本文所述的各个方面和实施方案中,抗OSMRβ抗体包含轻链可变结构域和重链可变结构域,该轻链可变结构域具有与SEQ ID NO:4至少90%相同的氨基酸序列,该重链可变结构域具有与SEQ ID NO:3至少90%相同的氨基酸序列。在本文所述的一些实施方案中,轻链可变结构域具有SEQ ID NO:4所示的氨基酸序列;并且重链可变结构域具有SEQ IDNO:3所示的氨基酸序列。
在本文所述的各个方面和实施方案中,抗OSMRβ抗体包含衍生自IgG4抗体的CH1结构域、铰链结构域和CH2结构域,这些结构域融合到衍生自IgG1抗体的CH3结构域。
在本文所述的各个方面和实施方案中,抗OSMRβ抗体包含具有与SEQ ID NO:2至少90%相同的氨基酸序列的轻链和具有与SEQ ID NO:1至少90%相同的氨基酸序列的重链。在本文所述的一些实施方案中,轻链具有SEQ ID NO:2所示的氨基酸序列;并且重链具有SEQ ID NO:1所示的氨基酸序列:
在本文所述的各个方面和实施方案中,本文提供的本发明允许通过使用治疗有效剂量的抗OSMRβ抗体来治疗瘙痒性或炎性皮肤疾病或病症。在一些实施方案中,治疗有效剂量等于或大于约0.1mg/kg、0.2mg/kg、0.3mg/kg、0.4mg/kg、0.5mg/kg、0.6mg/kg、0.8mg/kg、0.9mg/kg、1mg/kg、1.2mg/kg、1.5mg/kg、2mg/kg、2.5mg/kg、3mg/kg、3.5mg/kg、4mg/kg、4.5mg/kg、5mg/kg、5.5mg/kg、6mg/kg、6.5mg/kg、7mg/kg、7.5mg/kg、8mg/kg、8.5mg/kg、9mg/kg、9.5mg/kg、10mg/kg、10.5mg/kg、11mg/kg、11.5mg/kg、12mg/kg、12.5mg/kg、13mg/kg、13.5mg/kg、14mg/kg、14.5mg/kg、15mg/kg、15.5mg/kg、16mg/kg、17mg/kg、18mg/kg、19mg/kg或20mg/kg。在一些实施方案中,治疗有效剂量约介于约20mg/kg与约50mg/kg之间。在一些实施方案中,治疗有效剂量约介于约50mg/kg与约75mg/kg之间。在一些实施方案中,治疗有效剂量约介于约75mg/kg与100mg/kg之间。在一些实施方案中,治疗有效剂量约介于约100mg/kg与125mg/kg之间。在一些实施方案中,治疗有效剂量约介于约125mg/kg与约150mg/kg之间。在一些实施方案中,治疗有效剂量约介于约175mg/kg与200mg/kg之间。
在一些实施方案中,治疗有效剂量为大约3-20mg/kg、大约4-20mg/kg、大约5-20mg/kg、大约6-20mg/kg、大约7-20mg/kg、大约8-20mg/kg、大约9-20mg/kg、大约10-20mg/kg、大约11-20mg/kg、大约12-20mg/kg、大约13-20mg/kg、大约14-20mg/kg、大约15-20mg/kg、大约16-20mg/kg、大约17-20mg/kg、大约18-20mg/kg、大约19-20mg/kg、大约3-19mg/kg、大约3-18mg/kg、大约3-17mg/kg、大约3-16mg/kg、大约3-15mg/kg、大约3-14mg/kg、大约3-13mg/kg、大约3-12mg/kg、大约3-11mg/kg、大约3-10mg/kg、大约3-9mg/kg、大约3-8mg/kg、大约3-7mg/kg、大约3-6mg/kg、大约3-5mg/kg、大约3-4mg/kg或大约5-10mg/kg。在一些实施方案中,治疗有效剂量为约5mg/kg。在一些实施方案中,治疗有效剂量为约10mg/kg。
在一些实施方案中,治疗有效剂量等于或大于20mg/kg、25mg/kg、30mg/kg、35mg/kg、40mg/kg、45mg/kg或50mg/kg。
在一些实施方案中,治疗有效剂量等于或大于50mg/kg、100mg/kg、150mg/kg、200mg/kg、250mg/kg、300mg/kg、350mg/kg、400mg/kg、450mg/kg、500mg/kg、550mg/kg、600mg/kg、650mg/kg、700mg/kg、750mg/kg、800mg/kg、850mg/kg、900mg/kg、950mg/kg或1000mg/kg。
在一些实施方案中,治疗有效剂量是大约50-1,000mg/kg、大约100-1,000mg/kg、大约150-1,000mg/kg、大约200-1,000mg/kg、大约250-1,000mg/kg、大约300-1,000mg/kg、大约350-1,000mg/kg、大约400-1,000mg/kg、大约450-1,000mg/kg、大约500-1,000mg/kg、大约550-1,000mg/kg、大约600-1,000mg/kg、大约650-1,000mg/kg、大约700-1,000mg/kg、大约750-1,000mg/kg、大约800-1,000mg/kg、大约850-1,000mg/kg、大约900-1,000mg/kg、大约950-1,000mg/kg、大约50-950mg/kg、大约50-900mg/kg、大约50-850mg/kg、大约50-800mg/kg、大约50-750mg/kg大约50-700mg/kg、大约50-650mg/kg、大约50-600mg/kg、大约50-550mg/kg、大约50-500mg/kg、大约50-450mg/kg、大约50-400mg/kg、大约50-350mg/kg、大约50-300mg/kg、大约50-250mg/kg、大约50-200mg/kg、大约50-150mg/kg或大约50-100mg/kg。
在一些实施方案中,治疗有效剂量(例如,初始剂量和/或维持剂量)是平稳剂量(flat dose)。如本文所用,术语“平稳剂量”和“固定剂量”可互换使用。在一些实施方案中,合适的平稳剂量介于约10mg与800mg之间。因此,在一些实施方案中,合适的平稳剂量等于或大于约10mg、20mg、30mg、40mg、50mg、55mg、60mg、65mg、70mg、75mg、80mg、85mg、90mg、95mg、100mg、105mg、110mg、115mg、120mg、125mg、130mg、135mg、140mg、140mg、150mg、155mg、160mg、165mg、170mg、175mg、180mg、185mg、190mg、195mg、200mg、205mg、210mg、215mg、220mg、225mg、230mg、235mg、240mg、245mg、250mg、255mg、260mg、265mg、270mg、275mg、280mg、285mg、290mg、295mg、300mg、305mg、310mg、315mg、320mg、325mg、330mg、335mg、340mg、345mg、350mg、355mg、360mg、365mg、370mg、375mg、380mg、385、390mg、395mg、400mg、405mg、410mg、415、420mg、425mg、430mg、435mg、440mg、445mg、450mg、455mg、460mg、465mg、470mg、475mg、480mg、485mg、490mg、495mg、500mg、505mg、510mg、515mg、520mg、525mg、530mg、535mg、540mg、545mg、550mg、555mg、560mg、565mg、570mg、575mg、580mg、585mg、590mg、595mg、600mg、605mg、610mg、615mg、620mg、625mg、630mg、635mg、640mg、645mg、650mg、655mg、660mg、665mg、670mg、675mg、680mg、685mg、690mg、695、700mg、705mg、710mg、715mg、720mg、725mg、730mg、735mg、740mg、745mg、750mg、755mg、760mg、765mg、770mg、775mg、780mg、785mg、790mg、795或800mg。在一些实施方案中,合适的平稳剂量的范围是50-800mg、50-700mg、50-600mg、50-500mg、100-800mg、100-700mg、100-600mg、100-500mg、100-500mg、100-400mg、150-400mg、200-400mg、250-400mg、300-350mg、320-400mg或350-400mg。在一些实施方案中,合适的初始冲击或负荷平稳剂量为约720mg。在一些实施方案中,合适的维持平稳剂量为约360mg。在一些实施方案中,平稳剂量为约720mg的初始冲击剂量或负荷剂量,并且为约360mg的维持剂量。
在一些实施方案中,负荷剂量为约4mg/kg、5mg/kg、6mg/kg、7mg/kg、8mg/kg、9mg/kg、10mg/kg、11mg/kg、12mg/kg、13mg/kg、14mg/kg、15mg/kg、16mg/kg、17mg/kg、18mg/kg、19mg/kg、20mg/kg、21mg/kg、22mg/kg、23mg/kg、24mg/kg或25mg/kg。在一些实施方案中,在施用负荷剂量后施用维持剂量。在一些实施方案中,负荷剂量介于约5mg/kg与25mg/kg之间,维持剂量介于约2.5mg/kg与7.5mg/kg之间。在一些实施方案中,维持剂量为约2.0mg/kg、2.5mg/kg、3.0mg/kg、3.5mg/kg、4.0mg/kg、4.5mg/kg、5.0mg/kg、5.5mg/kg、6.0mg/kg、6.0mg/kg、6.5mg/kg、7.0mg/kg或7.5mg/kg。在一些实施方案中,负荷剂量为约10mg/kg,而维持剂量为约5mg/kg。
在本文所述的各个方面和实施方案中,与对照相比,向患有瘙痒性或炎性皮肤疾病或病症的受试者施用抗OSMRβ抗体导致数值评定得分(NRS)降低。
在本文所述的各个方面和实施方案中,对照是NRS,该NRS指示具有类似疾病状态而未经治疗的受试者。在一些实施方案中,对照是治疗前受试者的NRS。在一些实施方案中,对照是患有类似疾病状态但使用安慰剂治疗的受试者的疾病参数的相应值。
在本文所述的各个方面和实施方案中,NRS降低至少2分、或至少3分、或至少4分、或至少5分、或至少6分、或至少7分或至少8分。在一些实施方案中,NRS降低大于4分。在一些实施方案中,NRS降低至少8分。在一些实施方案中,NRS降低大约10%或更多、大约20%或更多、大约30%或更多、大约40%或更多、大约50%或更多、大约60%或更多、大约70%或更大、大约75%或更多、或大约80%或更多。在一些实施方案中,NRS的降低在大约30%或更多、大约40%或更多、大约50%或更多、或大约60%或更多、大约70%或更多、或80%或更多的施用抗OSMRβ抗体的受试者中为大约4分或更多分。在一些实施方案中,NRS的降低在大约30%或更多、大约40%或更多、大约50%或更多、或大约60%或更多、大约70%或更多、或大约80%或更多的施用抗OSMRβ抗体的受试者中为大约5分。在一些实施方案中,NRS的降低在大约30%或更多、大约40%或更多、大约50%或更多、或大约60%或更多、大约70%或更多、或大约80%或更多的施用抗OSMRβ抗体的受试者中为6分或更多分。在一些实施方案中,NRS的降低在大约30%或更多、大约40%或更多、大约50%或更多、或大约60%或更多、大约70%或更多、或大约80%或更多的施用抗OSMRβ抗体的受试者中为大约7分或更多分。在一些实施方案中,NRS的降低在大约30%或更多、大约40%或更多、大约50%或更多、或大约60%或更多、大约70%或更多、或大约80%或更多的施用抗OSMRβ抗体的受试者中为大约8分或更多分。在一些实施方案中,NRS的降低在大约30%或更多、大约40%或更多、大约50%或更多、或大约60%或更多、大约70%或更多、或大约80%或更多的施用抗OSMRβ抗体的受试者中为大约9分或更多分。在一些实施方案中,NRS的降低在大约30%或更多、大约40%或更多、大约50%或更多、或大约60%或更多、大约70%或更多、或大约80%或更多的施用抗OSMRβ抗体的受试者中为大约10分或更多分。在一些实施方案中,NRS的降低发生于受试者的抗OSMRβ抗体初始剂量后少于5周、或少于4周、或少于3周、或少于2周、或少于1周时。在一些实施方案中,NRS的降低在受试者的抗OSMRβ抗体初始剂量后约4周时是大约30%或更多、大约40%或更多、大约50%或更多、或大约60%或更多、大约70%或更多、或大约80%或更多。
在本文描述的各个方面和实施方案中,其中NRS是最严重瘙痒NRS(WI-NRS)。
在本文所述的各个方面和实施方案中,NRS值被计算为每周平均值。
在本文所述的各个方面和实施方案中,施用抗OSMRβ抗体导致受试者的睡眠改善,如与对照相比,由睡眠不足VAS的降低所证明的。
在本文所述的各个方面和实施方案中,对照是睡眠不足VAS,所述睡眠不足VAS指示受试者具有类似疾病状态而未经治疗。在一些实施方案中,对照是治疗前受试者的睡眠不足VAS。在一些实施方案中,基线是治疗前受试者的睡眠不足VAS。
在本文所述的各个方面和实施方案中,睡眠不足VAS相对于基线降低至少10%、或至少20%、或至少30%、或至少40%、或至少50%、或至少60%、或至少70%、或至少80%、或至少90%。在一些实施方案中,睡眠不足VAS的降低在受试者的抗OSMRβ抗体初始剂量后少于5周、或少于4周、或少于3周、或少于2周、或少于1周时发生。
在本文所述的各个方面和实施方案中,睡眠不足VAS值被计算为每周平均值。
在本文所述的各个方面和实施方案中,与对照相比,施用抗OSMRβ抗体导致EASI的降低。在一些实施方案中,对照是指示受试者具有类似疾病状态而未经治疗的EASI。在一些实施方案中,对照是治疗前受试者的EASI。在一些实施方案中,对照是治疗前受试者的EASI。在一些实施方案中,EASI相对于基线降低至少10%、或至少20%、或至少30%、或至少40%、或至少50%、或至少60%、或至少70%、或至少80%、或至少90%。在一些实施方案中,EASI的降低在受试者的抗OSMRβ抗体初始剂量后少于5周、或少于4周或少于3周时发生。
在本文所述的各个方面和实施方案中,EASI值被计算为每周平均值。
在本文所述的各个方面和实施方案中,施用抗OSMRβ抗体导致以下两种或更多种:与对照NRS相比,瘙痒数值评定得分(NRS)降低至少4分;与对照EASI相比,EASI降低了至少20%;与对照VAS相比,睡眠不足VAS降低至少20%;与对照SCORAD相比,活动性皮炎评分(SCORAD)得到改善;与对照DLQI相比,皮肤病生活质量指数(DLQI)得到改善;与对照HADS相比,医院焦虑抑郁量表(HADS)有所改善。在一些实施方案中,施用抗OSMRβ抗体导致三个或更多、四个或更多、五个或更多、或六个或更多上述标识的减少或改善。
在本文所述的各个方面和实施方案中,与对照NRS相比,施用抗OSMRβ抗体导致瘙痒数值评定得分(NRS)降低至少4分,并且与对照EASI相比,EASI降低至少20%。
在本文所述的各个方面和实施方案中,与对照NRS相比,施用抗OSMRβ抗体导致瘙痒数值评定得分(NRS)降低至少4分,并且与对照VAS相比,睡眠不足VAS至少降低了20%。
在本文所述的各个方面和实施方案中,与对照VAS相比,施用抗OSMRβ抗体导致睡眠不足VAS降低至少20%,并且与对照EASI相比,EASI降低至少20%。
在本文所述的各个方面和实施方案中,与对照NRS相比,施用抗OSMRβ抗体导致瘙痒数值评定得分(NRS)降低至少4分、5分、6分、7分、8分或9分。
在本文所述的各个方面和实施方案中,与对照EASI相比,施用抗OSMRβ抗体导致EASI降低至少30%、或至少40%、或至少50%、或至少60%、或至少70%、或至少75%、或至少80%或至少90%。在一些实施方案中,向受试者施用抗OSMRβ抗体导致大约30%或更多的受试者、大约35%或更多的受试者、大约40%或更多的受试者、大约45%或更多的受试者、大约50%或更多的受试者、大约55%或更多的受试者、大约60%或更多的受试者、大约65%或更多的受试者、大约70%或更多的受试者、大约75%或更多的受试者、大约80%或更多的受试者、或约大85%或更多的受试者的EASI得分降低50%(即,EASI-50)。在本文所述的各个方面和实施方案中,向受试者施用抗OSMRβ抗体导致大约30%或更多的受试者、大约35%或更多的受试者、大约40%或以上的受试者、大约45%或以上的受试者、大约50%或以上的受试者、大约55%或以上的受试者、大约60%或以上、大约65%或以上的受试者、大约70%或以上的受试者、大约75%或以上的受试者、大约80%或以上的受试者、或大约85%或以上的受试者的EASI得分降低75%(即,EASI-75)。
在本文所述的各个方面和实施方案中,与对照VAS相比,施用抗OSMRβ抗体导致睡眠不足VAS降低至少30%、或至少40%、或至少50%、至少60%、或至少70%、或至少80%、或至少90%。
在本文所述的各个方面和实施方案中,对照是指示具有类似疾病状态而未经治疗的受试者的相应参数(例如,NRS、EASI、VAS、SCORAD、DLQI或HADS)的值。在本文所述的各个方面和实施方案中,对照是指示治疗前受试者的相应参数(例如,NRS、EASI、VAS、SCORAD、DLQI或HADS)的值。在本文所述的各个方面和实施方案中,对照是指示可比患有类似疾病状态但用安慰剂治疗的受试者的相应参数(例如,NRS、EASI、VAS、SCORAD、DLQI或HADS)的值。
在本文所述的各个方面和实施方案中,本发明提供了一种治疗炎症的方法,该方法包括:以治疗有效剂量和在施用间隔向需要治疗的受试者施用抗OSMRβ抗体一段使与炎症相关的一种或多种症状的强度、严重性或频率降低或使其发病延迟的治疗周期。在一些实施方案中,炎症是T
在本文所述的各个方面和实施方案中,受试者患有炎性疾病、病症或病状。在一些实施方案中,受试者患有慢性炎性疾病。在一些实施方案中,慢性炎性疾病是慢性特发性荨麻疹(CIU),并且与炎症相关的在强度、严重性或频率方面降低或发病延迟的症状是荨麻疹。
在本文所述的各个方面和实施方案中,本文所述的抗OSMRβ抗体与另外的治疗剂联合施用。在一些实施方案中,另外的治疗剂是局部皮质类固醇(例如,TCS)。在一些实施方案中,另外的治疗剂是局部钙调神经蛋白抑制剂。在一些实施方案中,另外的治疗剂是局部抗菌剂和/或杀菌剂。在一些实施方案中,另外的治疗剂是局部抗组胺剂。
应当理解,如上所述的所有实施方案均适用于本发明的所有方面。
附图说明
附图仅用于说明的目的,而非限制。
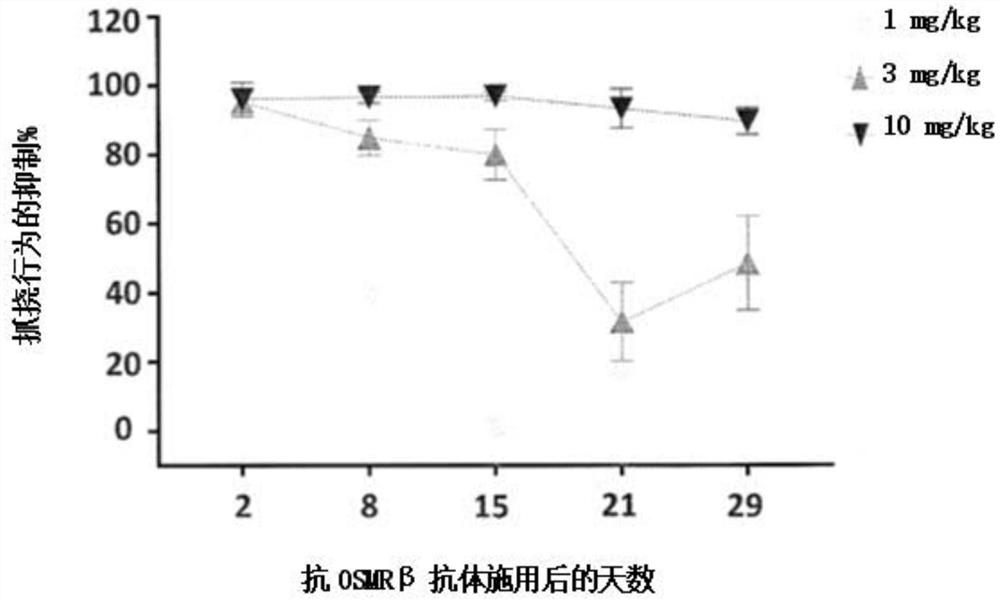
图1A描绘在用抗OSMRβ抗体给药后第2天、第8天、第15天、第21天和第29天在IL-31挑战后1小时猴子抓挠行为的抑制百分比的示例性图。
图1B描绘在抗OSMRβ抗体给药后第2天、第8天、第15天、第21天和第29天在IL-31挑战后1小时猴子的抓挠行为和抗OSMRβ抗体的血清浓度图。
图2描绘用于在健康志愿者和特应性皮炎患者的单剂量剂量递增研究中确定抗OSMRβ抗体安全性和有效性的研究设计。
图3A-3D描绘抗OSMRβ抗体治疗的瘙痒症的变化。患者接受7.5mg/kg抗OSMRβ抗体(抗OSMRβAb)或安慰剂(PBO)的单次静脉内剂量。图3A指示在指定期间内平均VAS瘙痒得分(+/-SEM)相对于基线的变化。图3B表示在指定期间内平均百分比VAS瘙痒得分(+/-SEM)相对于基线的变化。图3C指示指定期间内的平均每周平均最严重瘙痒NRS(WI-NRS)。图3D指示每周平均WI-NRS相对于基线(+/-SEM)的平均百分比变化。数据指示,与PBO相比,在施用后的最初4周内接受抗体的患者减少幅度更大,这种情况持续8周。
图4描绘在接受7.5mg/kg抗OSMRβ抗体(抗OSMRβAb)或安慰剂(PBO)的单次静脉内剂量后每周平均NRS有临床意义的降低(≥4分)的受试者百分比。
图5A-5D描绘在7.5mg/kg抗OSMRβ抗体(抗OSMRβAb)或安慰剂的单次静脉内剂量后9周内对相对于基线的NRS降低具有特定幅度的反应(≥4)的受试者人数。图5A和图5C显示来自抗OSMRβ抗体接受者组的结果,图5B和图5D显示来自安慰剂组的结果。
图6A-6B显示接受7.5mg/kg抗OSMRβ抗体(抗OSMRβAb)或安慰剂的单次静脉内剂量的受试者在指定观察期内的失眠情况得到改善。图6A显示平均(±SEM)睡眠不足VAS得分变化,图6B显示相对于基线的平均(±SEM)百分比睡眠不足VAS得分变化。
图7A-7B描绘衡量疾病的严重性的EASI得分的变化。受试者接受7.5mg/kg抗OSMRβ抗体(抗OSMRβAb)或安慰剂的单次静脉内剂量。图7A显示平均得分(±SEM);图7B显示相对于基线的平均百分比(±SEM)EASI变化。
图8A-8B描绘受试者的显示通过EASI得分测量的疾病严重性降低的临床上有意义的反应的百分比。受试者接受7.5mg/kg抗OSMRβ抗体(抗OSMRβAb)或安慰剂的单次静脉内剂量。图8A显示与基线相比(EASI-50得分)EASI降低了50%或更多的响应者的结果;图8B显示以上所指示的7.5mg/kg的抗OSMRβ抗体(抗OSMRβAb)或安慰剂的单次静脉内剂量后的研究周期内,与基线(EASI-75)相比,EASI分别降低75%或更多的响应者的结果,每个数据点指示该组人群中受试者的百分比后。在图8A和图8B中,空心柱表示安慰剂受试者,实心柱表示抗OSMRβAb接受者受试者。
图9A-9B显示在受试者接受7.5mg/kg的抗OSMRβ抗体(抗OSMRβAb)或安慰剂的单次静脉内剂量后,作为特应性皮炎的程度和严重性变化的临床评价的SCORAD值。图9A显示在指定时间段内平均SCORAD值(+/-SEM)相对于基线的变化。图9B显示在指定时间段内相对于基线的平均百分比SCORAD(+/-SEM)变化。
图10A-10C描绘用于皮下施用的建模的PK参数。图10A描绘插图中所示的各种给药方案中血浆的抗OSMR Ab浓度的模拟中值。图10B描绘在皮下施用给特应性皮炎患者之后的指定时间段内血浆的抗OSMRβAb的浓度曲线。HV,健康的志愿者;AD,特应性皮炎患者;IV,静脉内施用;SC,皮下施用。图10C描绘各种SC给药方案的一系列模拟。
图11是描绘IL-31Rα、OSMRβ和LIFR信号传导途径的示意图。
图12是描绘使用OSM(50ng/mL)治疗6小时和24小时后人表皮角化细胞(HEK)和人皮肤成纤维细胞(HDF)上清液中MCP-1蛋白的水平的一系列图表(插图A)。图12B插图B显示相对于管家基因18S mRNA的MCP-1mRNA水平。数据显示添加OSM后MCP-1水平强烈上调。
图13是描绘在添加50ng/mL OSM、50ng/mL LIF或100ng/mL IL-31后与浓度增加的IL-4(插图A)或IL-13(插图B)联合时培养的HEK细胞和HDF细胞的上清液中MCP-1蛋白的水平的一系列图表。
图14是显示使用OSM治疗6小时和24小时的培养的HEK细胞中IL-13Rα1或IL-4Rα的mRNA表达水平的一系列图表。
图15是显示将增加浓度的抗OSMRβ抗体(插图A)、抗IL-31Rα抗体(插图B)或同种型对照(插图C)添加到用50ng/mL的OSM治疗过的培养的HEK细胞中的反应的一系列图表。
图16是显示了将增加浓度的抗OSMRβ抗体(插图A)、抗IL-31Rα抗体(插图B)或同种型对照(插图C)添加到用50ng/mL的OSM和IL-4(5或20ng/mL的浓度)刺激的培养的HEK细胞中的反应的一系列图表。
图17是描绘从患有结节性痒疹(PN)或特应性皮炎(AD)的受试者的非病变性(NL)和病变性(LS)皮肤活检中获得的IL-31mRNA表达测量值的结果的一系列图表。
图18是描绘从PN、AD或健康对照对象(HC)的皮肤活检获得的IL-31mRNA表达测量(插图A)或OSM表达测量值(插图B)的结果的一系列图表。
图19是显示从患有WI-NRS<7或患有WI-NRS≥7的PN受试者获得的OSM(插图A)和IL-31(插图B)mRNA表达测量值的结果的一系列图表。
图20是显示从PN受试者获得的皮肤样本中免疫组织化学观察的定量的一系列图表。图20插图A-D显示了真皮中发现的与健康对照相比针对从PN受试者获得的样本中的OSMRβ(插图A)、OSM(插图B)、IL-31(插图C)或IL-31Rα(插图D)是阳性的细胞(细胞/μm2)的定量。图20插图E-H是显示从PN受试者的NL或LS皮肤活检获得的皮肤样本中IL-31(插图E)、OSM(插图F)、IL-31α(插图G)或OSMRβ(插图H)的阳性百分比的图表。
图21是显示从来自患有WI-NRS<7或WI-NRS≥7的受试者的NL皮肤活检和LS皮肤活检获得的免疫组化观察的定量(IL-31,插图A;OSM,插图B;IL-31Rα,插图C;OSMRβ,插图D)的一系列图表。
图22是显示从慢性特发性荨麻疹患者获得的对照皮肤样本或皮肤样本获得的OSMRβmRNA(插图A和插图B)或蛋白(插图C)的表达水平的一系列图表。插图A和插图B分别显示使用
图23是显示患有慢性单纯性苔藓(LSC)的受试者的OSMRβmRNA水平的一系列图表。从LSC患者获得的样本中的OSMRβmRNA水平由NanoString(插图A)和RNAscope(插图B)技术评估。
图24是显示患有扁平苔藓(LP)的受试者的OSMRβmRNA水平的图表。使用NanoString技术评估从LP患者获得的样本中的OSMRβmRNA水平。
图25是显示患有慢性特发性瘙痒症(CIP)的受试者的OSMRβmRNA水平的图表。使用NanoString技术评估从CIP患者获得的样本中的OSMRβmRNA水平。
定义
为了使本发明更容易理解,首先在下文定义了某些术语。下述术语和其他术语的另外定义阐述在整个本说明书中。本文所引用的用于描述本发明的背景技术并提供关于其实施的附加细节的出版物和其他参考材料以引用方式并入本文。
氨基酸如本文所用,术语“氨基酸”在其最广泛的意义上是指可以掺入多肽链中的任何化合物和/或物质。在一些实施方案中,氨基酸具有一般结构H
转佳:如本文所用,术语“转佳”意指受试者的状态的预防、减轻或缓和或状态的改善。转佳包括但不要求疾病病状的完全恢复或完全预防。在一些实施方案中,转佳包括增加相关疾病组织中缺乏的相关蛋白质或其活性的水平。
大约或约:如本文所用,当应用于一个或多个目的值时,术语“大约”或“约”指与所述参考值相似的值。在某些实施方案中,术语“大约”或“约”指落入所述值任一方向(大于或小于)中的25%、20%、19%、18%、17%、16%、15%、14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4%、3%、2%、1%或更少的一系列值,除非另有说明或从上下文中另外显而易见的(除非该数字超过可能值的100%)。
对照如本文所用,术语“对照”是改变所确定的参考。在一些实施方案中,对照是患有类似疾病状态但未治疗的受试者的疾病参数的相应值。在一些实施方案中,对照是具有类似疾病状态但使用安慰剂治疗的受试者的疾病参数的相应值。在一些实施方案中,对照是受试者在治疗前的疾病参数(也称为基线)的相应值。在一些实施方案中,对照是基于集体知识或历史数据指示未经治疗的疾病参数的参考值。
递送:如本文所用,术语“递送”涵盖局部递送和全身递送。
半衰期:如本文所用,术语“半衰期”是诸如氨基酸或蛋白质的浓度或活性的量下降到在一个时间段开始时测量的其值的一半所需的时间。
改进、增加或减少:如本文所用,术语“改善”、“增加”或“减少”或语法上的等同物表示相对于基线测量的值,例如患有类似疾病状态但未经本文所述治疗的受试者的疾病参数的相应值,或在没有接受本文所述治疗的受试者(例如,施用安慰剂的受试者)(或多个对照受试者)的测量值。在一些实施方案中,对照是基于集体知识或历史数据指示未经治疗的疾病参数的参考值。
基本同一性:本文中使用短语“基本同一性”指氨基酸序列或核酸序列之间的比较。如本领域普通技术人员将理解的,如果两个序列在相应位置含有相同残基,则通常认为它们是“基本相同的”。如本领域中众所周知的,可以使用多种算法中的任何一种来比较氨基酸或核酸序列,这些算法包括商业计算机程序中可用的那些算法,诸如用于核苷酸序列的BLASTN和用于氨基酸序列的BLASTP、空位BLAST和PSI-BLAST。此类示例性程序在Altschul等人,Basic local alignment search tool,J Mal.Biol.,215(3):403-410,1990;Altschul等人,Methods in Enzymology;Altschul等人,Nucleic Acids Res.25:3389-3402,1997;Baxevanis等人,Bioinformatics:A Practical Guide to the Analysisof Genes and Proteins,Wiley,1998;以及Misener等人(编辑)Bioinformatics Methodsand Protocols(Methods in Molecular Biology,第132卷),Humana Press,1999中进行了描述。除了标识相同序列外,以上提到的程序通常还提供对同一性程度的指示。在一些实施方案中,如果在有关残基段上两个序列至少50%、55%、60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更多的相应残基相同,则认为这两个序列基本上相同。在一些实施方案中,有关段是完整序列。在一些实施方案中,有关段是至少10个残基、15个残基、20个残基、25个残基、30个残基、35个残基、40个残基、45个残基、50个残基、55个残基、60个残基、65个残基、70个残基、75个残基、80个残基、85个残基、90个残基、95个残基、100个残基、125个残基、150个残基、175个残基、200个残基、225个残基、250个残基、275个残基、300个残基、325个残基、350个残基、375个残基、400个残基、425个残基、450个残基、475个残基、500个残基或更多个残基。
适合皮下递送:如本文所用,涉及本发明的药物组合物的短语“适合皮下递送”或“用于皮下递送的制剂”通常是指此类组合物的稳定性、粘度、耐受性和溶解性以及此类组合物将其中所含的有效量的抗体递送到递送靶点的能力。
患者:如本文所用,术语“患者”是指可以例如出于实验目的、诊断目的、预防目的、美容目的和/或治疗目的向其施用所提供的组合物的任何生物体。典型的患者包括动物(例如,哺乳动物,诸如小鼠、大鼠、兔子、非人类灵长类和/或人类)。在一些实施方案中,患者是人。人包括产前和产后。“患者”与“受试者”可互换使用,其中该受试者患有疾病并施用抗体或安慰剂。
药学上可接受的:如本文所用,术语“药学上可接受的”是指与合理的受益/风险比相称在合理的医学判断范围内适用于与人和动物的组织接触而没有过度毒性、刺激性、过敏反应或其他问题或并发症的物质。
受试者:如本文所用,术语“受试者”是指人或任何非人动物(例如,小鼠、大鼠、兔、狗、猫、牛、猪、绵羊、马或灵长类动物)。人包括产前和产后。在许多实施方案中,受试者是人。受试者可以是患者,该患者是指向医疗提供者提出进行疾病诊断或治疗的人。术语“受试者”在本文中可与“个体”或“患者”互换使用。受试者可以患有疾病或病症或对疾病或病症敏感,但是可以或可以不显示出该疾病或病症的症状。
基本上:如本文所用,术语“基本上”是指表现出全部或接近全部范围或程度的目标特征或性质的定性条件。生物学领域的普通技术人员将理解,生物学和化学现象很少(如果曾经有)完成和/或继续完成或达到或避免绝对结果。因此,在本文中使用术语“基本上”来捕获许多生物学和化学现象中固有的潜在完整性缺失。
全身分布或递送:如本文所用,术语“全身分布”、“全身递送”或语法上的等效物是指影响整个身体或整个生物体的递送或分布机制或方法。通常,全身分布或递送经由身体的循环系统(例如血液)完成。与“局部分布或递送”的定义形成对比。
靶组织:如本文所用,术语“靶组织”是指受待治疗的疾病或病症影响的任何组织。在一些实施方案中,靶组织包括展示疾病相关病理学、症状或特征的那些组织。
治疗有效量:如本文所用,术语治疗剂的“治疗有效量”是指当施用于患有疾病、病症和/或病状或对疾病、病症和/或病状敏感的受试者时,足以治疗、诊断、预防和/或延迟该疾病、病症和/或病状的症状发作的量。本领域的普通技术人员将认识到,通常通过包含至少一个单位剂量的给药方案来施用治疗有效量。
治疗:如本文所用,术语“治疗”是指用于使特定疾病、病症和/或病状的一种或多种症状或特征部分或完全缓解、转佳、减轻,抑制、预防、延迟其发作,降低其严重性和/或降低其发病率的任何方法。为了降低发展与疾病关联的病理的风险,可以向未表现出疾病体征和/或仅表现出疾病早期体征的受试者施用治疗。
具体实施方式
本发明尤其提供了治疗特应性皮炎的方法,该方法包括以下步骤:相对于对照而言,以治疗有效剂量和施用间隔向需要治疗的受试者施用抗OSMRβ抗体一段足以改善、稳定或减轻特应性皮炎的一种或多种症状的治疗周期。还提供了治疗尿毒症瘙痒的方法,该方法包括以下步骤:相对于对照而言,以治疗有效剂量和施用间隔向需要治疗的受试者施用抗OSMRβ抗体一段足以改善、稳定或减轻特应性皮炎的一种或多种症状的治疗周期。
在以下部分中详细描述了本发明的各个方面。部分的使用并不意在限制本发明。每个部分可以适用于本发明的任何方面。在本申请中,除非另有说明,否则“或”的使用意指“和/或”。
特应性皮炎
特应性皮炎(AD)是一种慢性炎症性皮肤病,其特征在于Th2细胞介导的免疫反应、受损的皮肤屏障功能和细菌定殖。儿童的AD患病率约为20%,成人为1%至10%。大约20%的AD患者患有涉及大面积体表面积的中度至重度疾病,并患有慢性强烈瘙痒症,导致睡眠剥夺和生活质量差(Boguniewicz等人,2011;Brandt等人,2011;Gittler等人,2012;Silverberg等人,2013)。局部皮质类固醇和钙调神经蛋白抑制剂用于治疗中度至重度疾病,但是这些疗法的疗效有限,且长期使用会带来副作用。类似地,全身性皮质类固醇或环孢霉素虽然有效,但仍具有明显的毒性(Ring等人,2012;Sidbury等人,2014)。
在瘙痒性病状中,一直显示IL-31轴被上调。血清IL-31水平升高,并与儿童(Ezzat等人,2011)和成人(Raap等人,2008)中的AD疾病严重性相关。与健康皮肤相比,AD和PN患者的皮肤活检中观察到IL-31mRNA的增加(Sonkoly等人,2006);AD皮肤中的IL-31、OSMRβ和IL-31受体α(IL-31Rα)染色增强(Nobbe等人,2012)。IL-31由活化的Th2细胞产生(Dillon等人,2004),其表达由IL-4诱导(Stott等人,2013)。因此,与来自非特应性供体的外周血单核细胞(PBMC)相比,来自特应性供体的PBMC在激活时产生更多的IL-31(Stott等人,2013)。一旦释放,IL-31就会参与反馈循环,该反馈循环使AD中的炎症反应永久存在。IL-31增加了来自特应性供体的PBMC中和鼻上皮细胞中IL-4、IL-5和IL-13的产生(Liu等人,2015)。此外,IL-31与IL-4协同产生CCL2和VEGF,并且非常重要的是,诱导更多的IL-4、IL-5和IL-13(Ip等人,2007;Stott等人,2013;Liu等人,2015)。
另一个加剧因素来自定殖细菌的作用,例如葡萄球菌,它有时会感染患有AD的皮肤。葡萄球菌肠毒素B(SEB)和葡萄球菌α毒素是葡萄球菌产生的超抗原,可增加AD患者PBMC和皮肤中IL-31的产生(Sonkoly等人,2006;Niebuhr等人,2011),进一步加剧炎症的恶性循环。炎症反应在细胞因子受体侧也得到增强。AD中的角化细胞和皮肤浸润性巨噬细胞表达IL-31Rα;SEB激动剂和TLR2激动剂(葡萄球菌的细胞成分)、IFN-γ、OSM、IL-4和IL-13上调巨噬细胞和角化细胞上IL-31Rα的表达(Bilsborough等人,2006;Heise等人,2009;Kasraie等人,2011;Edukulla等人,2015)。IL-31在AD症状和疾病进展中的重要性的临床数据由CIM331的第一项临床试验提供,CIM331是一种人源化的抗IL31Rα抗体,也被称为奈莫利珠单抗(nemolizumab),其中AD患者显示瘙痒视觉模拟量表(VAS)的得分降低(Nemoto等人,2016;Ruzicka等人,2017)。
OSM在AD病理学中也起着重要作用,并呼应了IL-31的许多功能。OSM是由患有AD的皮肤浸润性T细胞产生的,而AD患者皮肤中的OSMRβ水平升高(Boniface等人,2007)。除皮肤浸润性T细胞外,巨噬细胞和中性粒细胞在炎性病状下还产生OSM(Richards,2013)。一旦产生,OSM就会诱导多种细胞因子的产生:IL-4、IL-5、IL-13、IL-6、IL-12、肿瘤坏死因子(TNF)和IL-10和趋化因子(CXCL1、CXCL2、CXCL8、CCL11和CCL24)(Fritz等人,2011年;Botelho等人,2013年)。此外,它通过与转化生长因子-β、IL-4/IL-13、淋巴细胞和肥大细胞无关的机制促进胶原蛋白的沉积(Mozaffarian等人,2008)。在炎性环境中,OSM与IL-4协同作用产生嗜酸细胞活化趋化因子和嗜酸性粒细胞化学引诱物(Fritz等人,2006;Fritz等人,2009)。此外,OSM与IL-1、TNF、IL-17和IL-22协同作用,以下调与角化细胞分化和皮肤屏障完整性有关的基因(桥粒芯蛋白和丝聚合蛋白),并上调人β-防御素(HBD)2和HBD3(Boniface等人,2007;Rabeony等人,2014)。HBD2和HBD3进而通过诱导更多OSM、IL-22、IL-4、IL-13和IL-31的产生而进入炎症的恶性循环(Kanda等人,2012)。OSM上调IL-4Rα进一步推动了该循环(Mozaffarian等人,2008;Fritz等人,2009;Fritz等人,2011)。总体而言,IL-31和OSM通过多种重叠途径增强炎症反应并损害AD中的皮肤屏障功能。因此,拮抗IL-31和OSM两者的抗体(例如本文所述的抗OSMRβ抗体)通过抑制由IL-31和OSM(两种驱动瘙痒和炎症的细胞因子)刺激的下游信号传导事件,在AD中提供了治疗机会。
有几种不同的方法来评估特应性皮炎的症状。在一些实施方案中,特应性皮炎的一种或多种症状由特应性皮炎的研究者总体评估(IGA)来评估。在一些实施方案中,特应性皮炎的一种或多种症状由湿疹面积与严重性指数(EASI)来评估。在一些实施方案中,特应性皮炎的一种或多种症状由对特应性皮炎评分(SCORAD)来评估。在一些实施方案中,特应性皮炎的一种或多种症状由特应性皮炎区域照片来评估。在一些实施方案中,特应性皮炎的一种或多种症状由特应性皮炎的体表面积受累(BSA)来评估。在一些实施方案中,特应性皮炎的一种或多种症状由皮肤病生活质量指数(DLQI)来评估。在一些实施方案中,特应性皮炎的一种或多种症状由医院焦虑抑郁量表(HADS)来评估。在一些实施方案中,特应性皮炎的一种或多种症状,例如睡眠质量和睡眠量,由体动记录仪来评估。在一些实施方案中,特应性皮炎的一种或多种症状由定量数值瘙痒量表,例如瘙痒数值评定量表(NRS)、视觉模拟量表(VAS)或语言评定量表(VRS)来评估。
治疗
在本发明的一些实施方案中,通过相对于对照而言,以治疗有效剂量和施用间隔向需要治疗的受试者施用抗OSMRβ抗体一段足以改善、稳定或减轻特应性皮炎的一种或多种症状的治疗周期来治疗特应性皮炎。在本文的特应性皮炎的上下文中使用的术语“治疗”是指改善与特应性皮炎有关的一种或多种症状,预防或延迟特应性皮炎的一种或多种症状的发作,和/或减轻特应性皮炎的一种或多种症状的严重性或频率。在一些实施方案中,在本文的特应性皮炎的上下文中使用的术语“治疗”是指部分或完全缓解、改善、减轻、抑制、预防特应性皮炎的特征的一种或多种症状,延迟其发作、降低其严重性和/或降低其发生率。在一些实施方案中,抗OSMRβ抗体的施用导致定量数值瘙痒量表在统计学上显著下降。在一些实施方案中,施用步骤包括皮下施用。在一些实施方案中,皮下施用通过皮下注射进行。在一些实施方案中,皮下施用通过皮下泵进行。
在一些实施方案中,可以在上臂、大腿的前表面、腹部的下部、臀部的上背部或上部区域中进行抗OSMRβ抗体的皮下注射。在一些实施方案中,旋转注射部位。在一些实施方案中,施用步骤包括静脉内施用。在一些实施方案中,施用步骤包括静脉内施用,然后是皮下施用。
在一些实施方案中,相对于对照而言,测量抗OSMRβ抗体对特应性皮炎的影响。在一些实施方案中,对照指示治疗前受试者的特应性皮炎的一种或多种症状。在一些实施方案中,治疗前受试者的特应性皮炎的一种或多种症状包括瘙痒NRS得分大于或等于5。在一些实施方案中,治疗前受试者的特应性皮炎的一种或多种症状包括瘙痒NRS得分大于或等于7。在一些实施方案中,需要治疗的受试者被诊断出患有特应性皮炎至少一年。在一些实施方案中,需要治疗的受试者已被诊断患有中度至重度特应性皮炎。在一些实施方案中,中度至重度特应性皮炎的IGA得分为3或4。在一些实施方案中,中度至重度特应性皮炎包括大约10%或更多的BSA受累。在一些实施方案中,中度至重度特应性皮炎包括3或4的IGA得分和大约10%或更高的BSA受累。在一些实施方案中,对照指示具有相同疾病状态而未经治疗的对照受试者的特应性皮炎的一种或多种症状。在一些实施方案中,对照指示具有相同疾病状态并施用安慰剂的对照受试者的特应性皮炎的一种或多种症状。
在一些实施方案中,与健康受试者相比,需要治疗的受试者的与OSMRβ信号传导途径相关的一种或多种细胞因子的水平升高。因此,在一些实施方案中,与健康受试者相比,需要治疗的受试者的IL-31、OSM、IL-31Rα和OSMRβ中的一种或多种的水平升高。在一些实施方案中,与健康受试者相比,需要治疗的受试者的一种或多种IL-31的水平升高。在一些实施方案中,与健康受试者相比,需要治疗的受试者的一种或多种OSM的水平升高。在一些实施方案中,与健康受试者相比,需要治疗的受试者一种或多种IL-31Rα的水平升高。在一些实施方案中,与健康受试者相比,需要治疗的受试者一种或多种OSMRβ的水平升高。
在一些实施方案中,治疗需要其的受试者导致受试者中的MCP-1/CCL2水平的降低或稳定。因此,在一些实施方案中,与患病状态相比,治疗需要其的受试者导致MCP-1水平的降低。在一些实施方案中,治疗需要其的受试者导致MCP-1水平的稳定。“稳定”是指MCP-1的水平保持大致相同,并且不增加或减少。在一些实施方案中,治疗受试者导致淋巴细胞和/或内皮细胞中MCP-1水平的降低。
在一些实施方案中,需要治疗的受试者的WI-NRS得分为约4、约5、约6、约7、约8或以上。因此,在一些实施方案中,需要治疗的受试者的WI-NRS得分为约4。在一些实施方案中,需要治疗的受试者的WI-NRS得分为约5。在一些实施方案中,需要治疗的受试者的WI-NRS得分为约6。在一些实施方案中,需要治疗的受试者的WI-NRS得分为约7。在一些实施方案中,需要治疗的受试者的WI-NRS得分为约8。在一些实施方案中,需要治疗的受试者的WI-NRS得分大于8。
在一些实施方案中,选择MCP-1/CCL2水平大于健康个体中发现的水平的受试者进行治疗。在一些实施方案中,与健康个体相比,选择用于治疗的受试者的MCP-1/CCL2水平不升高。在一些实施方案中,相对于对照而言,受试者中的IL-31表达水平升高。在一些实施方案中,相对于对照而言,受试者中的IL-31表达水平没有升高。在一些实施方案中,受瘙痒性疾病或病状影响的受试者的一部分皮肤中的IL-31表达水平与以下中的IL-31表达水平大致相同:(i)未受瘙痒性疾病或病状影响的受试者的一部分皮肤,或(ii)未诊断为瘙痒性疾病或病症的健康受试者的一部分正常皮肤。在一些实施方案中,相对于对照而言,受试者中的IL-31Rα表达水平升高。在一些实施方案中,相对于对照而言,受试者中的OSM表达水平升高。在一些实施方案中,相对于对照而言,受试者中的OSMRβ表达水平升高。在一些实施方案中,相对于对照而言,受试者中的OSMRβ表达水平没有升高。在一些实施方案中,受瘙痒性疾病或病症影响的受试者的一部分皮肤中的OSMRβ表达水平与以下中的OSMRβ表达水平大致相同:(i)未受瘙痒性疾病或病症影响的受试者的一部分皮肤,或(ii)未诊断为瘙痒性疾病或病症的健康受试者的一部分正常皮肤。
剂量
用于治疗特应性皮炎的抗OSMRβ抗体的治疗有效剂量可以各种剂量出现。在本发明的一些实施方案中,治疗有效剂量等于或大于约0.1mg/kg、0.2mg/kg、0.3mg/kg、0.4mg/kg、0.5mg/kg、0.6mg/kg、0.8mg/kg、0.9mg/kg、1mg/kg、1.2mg/kg、1.5mg/kg、2mg/kg、2.5mg/kg、3mg/kg、3.5mg/kg、4mg/kg、4.5mg/kg、5mg/kg、5.5mg/kg、6mg/kg、6.5mg/kg、7mg/kg、7.5mg/kg、8mg/kg、8.5mg/kg、9mg/kg、9.5mg/kg、10mg/kg、10.5mg/kg、11mg/kg、11.5mg/kg、12mg/kg、12.5mg/kg、13mg/kg、13.5mg/kg、14mg/kg、14.5mg/kg、15mg/kg、15.5mg/kg、16mg/kg、17mg/kg、18mg/kg、19mg/kg或20mg/kg、或30mg/kg。在一些实施方案中,治疗有效剂量等于或大于3mg/kg、4mg/kg、5mg/kg、6mg/kg、7mg/kg、7.5mg/kg、8mg/kg、9mg/kg、10mg/kg、11mg/kg、12mg/kg、13mg/kg、14mg/kg、15mg/kg、16mg/kg、17mg/kg、18mg/kg、19mg/kg或20mg/kg。
在一些实施方案中,治疗有效剂量是大约0.1-20mg/kg、大约0.3-20mg/kg、大约0.5-20mg/kg、大约0.75-20mg/kg、大约1-20mg/kg、大约1.5、-20mg/kg、大约2-20mg/kg、大约2.5-20mg/kg、大约3-20mg/kg、大约3.5-20mg/kg、大约4-20mg/kg、大约4.5-20mg/kg、大约5-20mg/kg、大约5.5-20mg/kg、大约6-20mg/kg、大约6.5-20mg/kg、大约7-20mg/kg、大约7.5-20mg/kg、大约8-20mg/kg、大约8.5-20mg/kg、大约9-20mg/kg、大约9.5-20mg/kg、大约10-20mg/kg或大约10.5-20mg/kg。
在一些实施方案中,治疗有效剂量是大约3-20mg/kg、大约4-20mg/kg、大约5-20mg/kg、大约6-20mg/kg、大约7-20mg/kg、大约8-20mg/kg、大约9-20mg/kg、大约10-20mg/kg、大约11-20mg/kg、大约12-20mg/kg、大约13-20mg/kg、大约14-20mg/kg、大约15-20mg/kg、大约16-20mg/kg、大约17-20mg/kg、大约18-20mg/kg、大约19-20mg/kg、大约3-19mg/kg、大约3-18mg/kg、大约3-17mg/kg、大约3-16mg/kg、大约3-15mg/kg、大约3-14mg/kg、大约3-13mg/kg大约3-12mg/kg、大约3-11mg/kg、大约3-10mg/kg、大约3-9mg/kg、大约3-8mg/kg、大约3-7mg/kg、大约3-6mg/kg、大约3-5mg/kg、大约3-4mg/kg或大约5-10mg/kg。在一些实施方案中,治疗有效剂量为约5mg/kg。在一些实施方案中,治疗有效剂量为约10mg/kg。
在一些实施方案中,治疗有效剂量等于或大于50mg/kg、100mg/kg、150mg/kg、200mg/kg、或250mg/kg、300mg/kg、310mg/kg、320mg/kg、330mg/kg、340mg/kg、350mg/kg、360mg/kg、370mg/kg、380mg/kg、390mg/kg、400mg/kg、450mg/kg、500mg/kg、550mg/kg、600mg/kg、650mg/kg、700mg/kg、710mg/kg、720mg/kg、730mg/kg、740mg/kg、750mg/kg、800mg/kg、850mg/kg、900mg/kg、950mg/kg、或1000mg/kg。
在一些实施方案中,治疗有效剂量是大约50-1,000mg/kg、大约100-1,000mg/kg、大约150-1,000mg/kg、大约200-1,000mg/kg、大约250-1,000mg/kg、大约300-1,000mg/kg、大约350-1,000mg/kg、大约400-1,000mg/kg、大约450-1,000mg/kg、大约500-1,000mg/kg、大约550-1,000mg/kg、大约600-1,000mg/kg、大约650-1,000mg/kg、大约700-1,000mg/kg、大约750-1,000mg/kg、大约800-1,000mg/kg、大约850-1,000mg/kg、大约900-1,000mg/kg、大约950-1,000mg/kg、大约50-950mg/kg、大约50-900mg/kg、大约50-850mg/kg、大约50-800mg/kg、大约50-750mg/kg、大约50-700mg/kg、大约50-650mg/kg、大约50-600mg/kg、大约50-550mg/kg、大约50-500mg/kg、大约50-450mg/kg、大约50-400mg/kg、大约50-350mg/kg、大约50-300mg/kg、大约50-250mg/kg、大约50-200mg/kg、大约50-150mg/kg或大约50-100mg/kg。
在一些实施方案中,施用包括初始冲击剂量或负荷剂量,然后是至少一个维持剂量。在一些实施方案中,初始冲击剂量或负荷剂量大于至少一个维持剂量。在一些实施方案中,初始冲击剂量或负荷剂量的剂量是至少一个维持剂量的剂量的至少一倍、二倍、三倍、四倍或五倍。在一些实施方案中,初始冲击剂量或负荷剂量的剂量是至少一个维持剂量的剂量的两倍。例如,在一些实施方案中,初始冲击剂量或负荷剂量是720mg,并且维持剂量是360mg。
在一些实施方案中,在施用负荷剂量后施用维持剂量。在一些实施方案中,平稳剂量用作初始冲击剂量或负荷剂量和/或维持剂量。在一些实施方案中,在单个注射器中提供合适的平稳剂量。合适的平稳剂量可以单次注射或多次注射(例如皮下或静脉内)施用。在一些实施方案中,合适的平稳剂量介于约10mg与800mg之间。因此,在一些实施方案中,合适的平稳剂量等于或大于约10mg、20mg、30mg、40mg、50mg、55mg、60mg、65mg、70mg、75mg、80mg、85mg、90mg、95mg、100mg、105mg、110mg、115mg、120mg、125mg、130mg、135mg、140mg、140mg、150mg、155mg、160mg、165mg、170mg、175mg、180mg、185mg、190mg、195mg、200mg、205mg、210mg、215mg、220mg、225mg、230mg、235mg、240mg、245mg、250mg、255mg、260mg、265mg、270mg、275mg、280mg、285mg、290mg、295mg、300mg、305mg、310mg、315mg、320mg、325mg、330mg、335mg、340mg、345mg、350mg、355mg、360mg、365mg、370mg、375mg、380mg、385、390mg、395mg、400mg、405mg、410mg、415、420mg、425mg、430mg、435mg、440mg、445mg、450mg、455mg、460mg、465mg、470mg、475mg、480mg、485mg、490mg、495mg、500mg、505mg、510mg、515mg、520mg、525mg、530mg、535mg、540mg、545mg、550mg、555mg、560mg、565mg、570mg、575mg、580mg、585mg、590mg、595mg、600mg、605mg、610mg、615mg、620mg、625mg、630mg、635mg、640mg、645mg、650mg、655mg、660mg、665mg、670mg、675mg、680mg、685mg、690mg、695、700mg、705mg、710mg、715mg、720mg、725mg、730mg、735mg、740mg、745mg、750mg、755mg、760mg、765mg、770mg、775mg、780mg、785mg、790mg、795或800mg。在一些实施方案中,合适的平稳剂量的范围是50-800mg、50-700mg、50-600mg、50-500mg、100-800mg、100-700mg、100-600mg、100-500mg、100-500mg、100-400mg、150-400mg、200-400mg、250-400mg、300-350mg、320-400mg或350-400mg。在一些实施方案中,负荷剂量为约700mg、705mg、710mg、715mg、720mg、725mg、730mg、735mg、740mg、745mg、750mg、755mg、760mg、765mg、770mg、775mg、780mg、785mg、790mg、795mg或800。在一些实施方案中,合适的初始冲击平稳剂量是720mg。在一些实施方案中,维持剂量为约300mg、305mg、310mg、315mg、320mg、325mg、330mg、335mg、340mg、345mg、350mg、355mg、360mg、365mg、370mg、375mg、380mg、380mg、390mg、395mg或400mg。在一些实施方案中,合适的维持剂量是360mg。在一些实施方案中,平稳剂量是720mg初始冲击剂量,并且是360mg维持剂量。在一些实施方案中,施用约720mg的初始负荷剂量或冲击剂量。在一些实施方案中,治疗有效剂量包括约720mg的初始冲击剂量或负荷剂量,然后是约360mg的至少一个维持剂量。
在一些实施方案中,基于体重的剂量用作初始冲击剂量或负荷剂量和/或维持剂量。在一些实施方案中,剂量在单个注射器中提供。该剂量可以单次注射或多次注射(例如皮下或静脉内)施用。在一些实施方案中,负荷剂量为约4mg/kg、5mg/kg、6mg/kg、7mg/kg、8mg/kg、9mg/kg、10mg/kg、11mg/kg、12mg/kg、13mg/kg、14mg/kg、15mg/kg、16mg/kg、17mg/kg、18mg/kg、19mg/kg、20mg/kg、21mg/kg、22mg/kg、23mg/kg、24mg/kg或25mg/kg。在一些实施方案中,负荷剂量约介于约5mg/kg与25mg/kg之间,维持剂量约介于约2.5mg/kg与7.5mg/kg之间。在一些实施方案中,维持剂量为约2.0mg/kg、2.5mg/kg、3.0mg/kg、3.5mg/kg、4.0mg/kg、4.5mg/kg、5.0mg/kg、5.5mg/kg、6.0mg/kg、6.0mg/kg、6.5mg/kg、7.0mg/kg或7.5mg/kg。在一些实施方案中,施用约10mg/kg的初始负荷剂量或冲击剂量。在一些实施方案中,治疗有效剂量包括约10mg/kg的初始冲击剂量,然后是约5mg/kg的至少一个维持剂量。
施用间隔
抗OSMRβ抗体在特应性皮炎的治疗中的施用间隔可以以不同的持续时间发生。在本发明的一些实施方案中,施用间隔是每天。在一些实施方案中,施用间隔是每隔一天。在一些实施方案中,施用间隔是一周多次。在一些实施方案中,施用间隔是每周一次。在一些实施方案中,施用间隔是每两周一次。在一些实施方案中,施用间隔是每三周一次。在一些实施方案中,施用间隔是每四周一次。在一些实施方案中,施用间隔是每五周一次。
治疗周期
使用抗OSMRβ抗体治疗特应性皮炎的治疗周期在持续时间上可能会有所不同。在一些实施方案中,治疗周期是至少一个月。在一些实施方案中,治疗周期是至少4周、或至少5周、或至少6周、或至少7周、或至少8周、或至少9周、或至少10周、或至少11周、或至少12周、或至少13周、或至少15周、或至少18周、或至少20周、或至少22周、或至少24周。在一些实施方案中,治疗周期是至少两个月。在一些实施方案中,治疗周期是至少三个月。在一些实施方案中,治疗周期是至少六个月。在一些实施方案中,治疗周期是至少九个月。在一些实施方案中,治疗周期是至少一年。在一些实施方案中,治疗周期是至少两年。在一些实施方案中,治疗周期在受试者的整个生命中持续。
药代动力学和药效动力学
患有特应性皮炎的患者的血清中抗OSMRβ抗体浓度-时间曲线的评估可以通过测量全身性血清抗OSMRβ抗体浓度-时间曲线直接进行评估。通常,通过定期对治疗的受试者的血液进行采样来评估抗OSMRβ抗体的药代动力学和药效动力学曲线。以下标准缩写用于表示相关的药代动力学参数。
C
t
AUC
AUC
其中C
λ
t
t
CL 清除率
Vd 分布体积(仅IV剂量)
Vd/F 表观分布体积(仅SC剂量)
通常,在PK分析中使用相对于开始抗OSMRβ抗体施用的实际血液样本采集时间。例如,通常在施用抗OSMRβ抗体前(注射前基线或时间0)的15或30分钟内并在施用后的第1个小时、第4个小时、第8个小时或第12个小时或第1天(24小时)、第2天、第3天、第4天、第5天、第6天、第7天、第10天、第14天、第17天、第21天、第24天、第28天、第31天、第38天、第45天、第52天、第60天、第70天或第90天收集血液样本。
可以使用多种方法来测量血清中的抗OSMRβ抗体的浓度。作为非限制性实例,使用酶联免疫吸附测定(ELISA)方法。
可以在治疗期间的任何阶段评估药代动力学参数,例如,在第1天、第2天、第3天、第4天、第5天、第6天、第1周、第2周、第3周、第4周、第5周、第6周、第7周、第8周、第9周、第10周、第11周、第12周、第13周、第14周、第15周、第16周、第17周、第18周、第19周、第20周、第21周、第22周、第23周、第24周或以后。在一些实施方案中,可以在治疗期间的第1个月、第2个月、第3个月、第4个月、第5个月、第6个月、第7个月、第8个月、第9个月、第10个月、第11个月、第12个月、第13个月、第14个月、第15个月、第16个月、第17个月、第18个月、第19个月、第20个月、第21个月、第22个月、第23个月、第24个月或以后评价药代动力学参数。
不良反应
与特应性皮炎的治疗有关的不良反应可包括外周性水肿、特应性皮炎恶化、鼻咽炎、上呼吸道感染、肌酸磷酸激酶增加、结膜炎、睑缘炎、口腔疱疹、角膜炎、眼睛瘙痒、其他单纯疱疹病毒感染和干眼症。
在一些实施方案中,抗OSMRβ抗体的施用不在受试者中导致严重的不良反应。在一些实施方案中,抗OSMRβ抗体的施用不会导致外周性水肿、特应性皮炎恶化、鼻咽炎、上呼吸道感染、肌酸磷酸激酶增加、结膜炎、睑缘炎、口腔疱疹、角膜炎、眼睛瘙痒、其他单纯疱疹病毒感染和干眼症中的一种或多种。
组合疗法
在一些实施方案中,本文所述的抗OSMRβ抗体可以与一种或多种其他治疗剂联合使用以治疗特应性皮炎(AD)。例如,抗OSMRβ抗体可以与其他全身施用(例如口服)或局部施用的伴随的皮质类固醇(例如,TCS)、局部钙调神经蛋白抑制剂、抗菌剂和/或杀菌剂、抗组胺药和其他药物(例如,煤膏、磷酸二酯酶抑制剂)中的一种或多种联合施用。在一些实施方案中,抗OSMRβ抗体和一种或多种其他治疗剂可以同时施用。在一些实施方案中,抗OSMRβ抗体和一种或多种其他治疗剂可以按顺序施用。在一些实施方案中,可以根据需要施用一种或多种其他治疗剂。
尿毒症瘙痒
尿毒症瘙痒(UP)是一种使人衰弱的疾病,对患者的生活质量产生严重负面影响。接受透析的患有终末期肾脏疾病(ESRD)的患者中大约有一半以上患有瘙痒症(Makhlough,2010)。根据国际透析结局和实践研究的结果,估计中度至重度疾病的患病率为42%(Pisoni等人,2006)。UP的潜在病因尚不清楚,但已牵涉到IL-31。实际上,在UP中,标识用于循环IL-31的最低阈值浓度,高于此浓度瘙痒显著增加,表明血清IL-31可能是瘙痒强度的定量生物标志物,至少在该指征中如此(Ko等人,2014)。患者通常接受保湿剂、局部类固醇药膏、抗组胺药、光疗(紫外线B灯)、消胆胺、促红细胞生成素和昂丹司琼治疗,但这些疗法疗效差,因此迫切需要新的治疗方法(Makhlough等人,2010)。因此,拮抗IL-31和OSM两者的抗体(如本文所述的抗OSMRβ抗体)可通过抑制IL-31和OSM(驱动慢性瘙痒性疾病中的瘙痒、炎症和纤维化的两种细胞因子)刺激的下游信号传导事件,为UP提供治疗机会。
尿毒症瘙痒的临床特性是多变的。瘙痒症可能是恒定的或间歇的。背部是最常见的患处,但手臂、头部和腹部也常受到影响。没有原发病灶的表皮脱落以及背部蝶形区域稀疏是典型的。ESRD患者(尤其是可归因于糖尿病时)经常会出现角化结节,活检时显示穿孔性病症。这些结节代表痒疹结节,是严重和长期瘙痒症的标志。
有几种不同的评估尿毒症瘙痒的方法。在一些实施方案中,尿毒症瘙痒的一种或多种症状由瘙痒数值评定量表(NRS)来评估。在一些实施方案中,尿毒症瘙痒的一种或多种症状由皮肤病生活质量指数(DLQI)来评估。在一些实施方案中,尿毒症瘙痒的一种或多种症状由医院焦虑抑郁量表(HADS)来评估。在一些实施方案中,尿素性瘙痒症的一种或多种症状,例如睡眠质量和睡眠量,由体动记录仪来评估。
在一些实施方案中,本发明的方法用于治疗患有肾脏疾病的受试者的瘙痒症。在一些实施方案中,本发明的方法用于治疗患有慢性肾脏疾病的受试者的瘙痒症。在一些实施方案中,本发明的方法用于患有慢性肾脏疾病的透析前受试者。本发明的组合物和方法可用于治疗患有慢性肾脏疾病且未接受透析的受试者亚组中的瘙痒症。在一些实施方案中,在透析前、透析期间或紧接透析之后施用抗OSMRβ抗体。
治疗
在本发明的一些实施方案中,通过相对于对照而言,以治疗有效剂量和施用间隔向需要治疗的受试者施用抗OSMRβ抗体一段足以改善、稳定或减轻尿毒症瘙痒的一种或多种症状的治疗周期来治疗尿毒症瘙痒。在本文的尿毒症瘙痒的上下文中使用的术语“治疗”是指改善与尿毒症瘙痒有关的一种或多种症状,预防或延迟尿毒症瘙痒的一种或多种症状的发作,和/或降低尿毒症瘙痒的一种或多种症状的严重性或频率。在一些实施方案中,如本文在尿毒症瘙痒的上下文中使用的术语“治疗”是指部分或完全缓解、改善、减轻、抑制、预防尿毒症瘙痒的一种或多种症状或特征,延迟其发作,降低其严重性和/或降低其发生率。在一些实施方案中,抗OSMRβ抗体的施用导致定量数值瘙痒量表在统计学上显著下降。在一些实施方案中,施用步骤包括皮下施用。在一些实施方案中,皮下施用通过皮下注射进行。在一些实施方案中,皮下施用通过皮下泵进行。
在一些实施方案中,可以在上臂、大腿的前表面、腹部的下部、臀部的上背部或上部区域中进行抗OSMRβ抗体的皮下注射。在一些实施方案中,旋转注射部位。
在一些实施方案中,施用步骤包括静脉内施用。在一些实施方案中,施用步骤包括静脉内施用,然后是皮下施用。在一些实施方案中,施用步骤发生在受试者进行血液透析的一天前。在其他实施方案中,施用步骤发生在血液透析期间。在其他实施方案中,施用步骤发生在血液透析后的一天之内。
在一些实施方案中,需要治疗的受试者患有终末期肾脏疾病。在一些实施方案中,需要治疗的受试者接受每周至少一次的血液透析方案。在一些实施方案中,需要治疗的受试者接受每周三次的血液透析方案。在一些实施方案中,每周三次血液透析方案已经稳定至少三个月。
在一些实施方案中,相对于对照而言,测量抗OSMRβ抗体对尿毒症瘙痒的作用。在一些实施方案中,对照指示治疗前受试者中尿毒症瘙痒的一种或多种症状。在一些实施方案中,治疗前受试者中尿毒症瘙痒的一种或多种症状包括瘙痒NRS得分大于或等于5。在一些实施方案中,治疗前受试者中尿毒症瘙痒的一种或多种症状包括瘙痒NRS得分大于或等于7。在一些实施方案中,对照指示具有相同疾病状态而未经治疗的对照受试者的尿毒症瘙痒的一种或多种症状。在一些实施方案中,对照指示具有相同疾病状态并施用安慰剂的对照受试者的尿毒症瘙痒的一种或多种症状。
在一些实施方案中,与健康受试者相比,根据本发明的需要治疗的患有炎性或瘙痒性皮肤疾病或病症的受试者的与OSMRβ信号传导途径相关的一种或多种细胞因子的水平升高。因此,在一些实施方案中,与健康受试者相比,需要治疗的受试者的IL-31、OSM、IL-31Rα和OSMRβ中的一种或多种的水平升高。在一些实施方案中,与健康受试者相比,需要治疗的受试者的一种或多种IL-31的水平升高。在一些实施方案中,与健康受试者相比,需要治疗的受试者的一种或多种OSM的水平升高。在一些实施方案中,与健康受试者相比,需要治疗的受试者一种或多种IL-31Rα的水平升高。在一些实施方案中,与健康受试者相比,需要治疗的受试者一种或多种OSMRβ的水平升高。
在一些实施方案中,治疗需要其的受试者导致受试者中的MCP-1/CCL2水平的降低或稳定。因此,在一些实施方案中,与患病状态相比,治疗需要其的受试者导致MCP-1水平的降低。在一些实施方案中,治疗需要其的受试者导致MCP-1水平的稳定。“稳定”是指MCP-1的水平保持大致相同,并且不增加或减少。在一些实施方案中,治疗受试者导致淋巴细胞和/或内皮细胞中MCP-1水平的降低。
在一些实施方案中,需要治疗的受试者的WI-NRS得分为约4、约5、约6、约7、约8或以上。因此,在一些实施方案中,需要治疗的受试者的WI-NRS得分为约4。在一些实施方案中,需要治疗的受试者的WI-NRS得分为约5。在一些实施方案中,需要治疗的受试者的WI-NRS得分为约6。在一些实施方案中,需要治疗的受试者的WI-NRS得分为约7。在一些实施方案中,需要治疗的受试者的WI-NRS得分为约8。在一些实施方案中,需要治疗的受试者的WI-NRS得分大于8。
在一些实施方案中,选择MCP-1/CCL2水平大于健康个体中发现的水平的受试者进行治疗。在一些实施方案中,与健康个体相比,选择用于治疗的受试者的MCP-1/CCL2水平不升高。在一些实施方案中,相对于对照而言,受试者中的IL-31表达水平升高。在一些实施方案中,相对于对照而言,受试者中的IL-31表达水平没有升高。在一些实施方案中,受瘙痒性疾病或病状影响的受试者的一部分皮肤中的IL-31表达水平与以下中的IL-31表达水平大致相同:(i)未受瘙痒疾病或病状影响的受试者的一部分皮肤,或(ii)未诊断为瘙痒性疾病或病症的健康受试者的一部分正常皮肤。在一些实施方案中,相对于对照而言,受试者中的IL-31Rα表达水平升高。在一些实施方案中,相对于对照而言,受试者中的OSM表达水平升高。在一些实施方案中,相对于对照而言,受试者中的OSMRβ表达水平升高。在一些实施方案中,相对于对照而言,受试者中的OSMRβ表达水平没有升高。在一些实施方案中,受瘙痒性疾病或病症影响的受试者的一部分皮肤中的OSMRβ表达水平与以下中的OSMRβ表达水平大致相同:(i)未受瘙痒性疾病或病症影响的受试者的一部分皮肤,或(ii)未诊断为瘙痒性疾病或病症的健康受试者的一部分正常皮肤。
剂量
用于治疗尿毒症瘙痒或用于治疗患有肾脏疾病的透析前受试者中的瘙痒症的抗OSMRβ抗体的治疗有效剂量可以各种剂量出现。在本发明的一些实施方案中,治疗有效剂量等于或大于约0.1mg/kg、0.2mg/kg、0.3mg/kg、0.4mg/kg、0.5mg/kg、0.6mg/kg、0.8mg/kg、0.9mg/kg、1mg/kg、1.2mg/kg、1.5mg/kg、2mg/kg、2.5mg/kg、3mg/kg、3.5mg/kg、4mg/kg、4.5mg/kg、5mg/kg、5.5mg/kg、6mg/kg、6.5mg/kg、7mg/kg、7.5mg/kg、8mg/kg、8.5mg/kg、9mg/kg、9.5mg/kg、10mg/kg、10.5mg/kg、11mg/kg、11.5mg/kg、12mg/kg、12.5mg/kg、13mg/kg、13.5mg/kg、14mg/kg、14.5mg/kg、15mg/kg、15.5mg/kg、16mg/kg、17mg/kg、18mg/kg、19mg/kg或20mg/kg或30mg/kg。在一些实施方案中,治疗有效剂量等于或大于3mg/kg、4mg/kg、5mg/kg、6mg/kg、7mg/kg、7.5mg/kg、8mg/kg、9mg/kg、10mg/kg、11mg/kg、12mg/kg、13mg/kg、14mg/kg、15mg/kg、16mg/kg、17mg/kg、18mg/kg、19mg/kg或20mg/kg。
在一些实施方案中,治疗有效剂量是大约0.1-20mg/kg、大约0.3-20mg/kg、大约0.5-20mg/kg、大约0.75-20mg/kg、大约1-20mg/kg、大约1.5、-20mg/kg、大约2-20mg/kg、大约2.5-20mg/kg、大约3-20mg/kg、大约3.5-20mg/kg、大约4-20mg/kg、大约4.5-20mg/kg、大约5-20mg/kg、大约5.5-20mg/kg、大约6-20mg/kg、大约6.5-20mg/kg、大约7-20mg/kg、大约7.5-20mg/kg、大约8-20mg/kg、大约8.5-20mg/kg、大约9-20mg/kg、大约9.5-20mg/kg、大约10-20mg/kg或大约10.5-20mg/kg。
在一些实施方案中,治疗有效剂量是大约3-20mg/kg、大约4-20mg/kg、大约5-20mg/kg、大约6-20mg/kg、大约7-20mg/kg、大约8-20mg/kg、大约9-20mg/kg、大约10-20mg/kg、大约11-20mg/kg、大约12-20mg/kg、大约13-20mg/kg、大约14-20mg/kg、大约15-20mg/kg、大约16-20mg/kg、大约17-20mg/kg、大约18-20mg/kg、大约19-20mg/kg、大约3-19mg/kg、大约3-18mg/kg、大约3-17mg/kg、大约3-16mg/kg、大约3-15mg/kg、大约3-14mg/kg、大约3-13mg/kg大约3-12mg/kg、大约3-11mg/kg、大约3-10mg/kg、大约3-9mg/kg、大约3-8mg/kg、大约3-7mg/kg、大约3-6mg/kg、大约3-5mg/kg、大约3-4mg/kg或大约5-10mg/kg。在一些实施方案中,治疗有效剂量为约5mg/kg。在一些实施方案中,治疗有效剂量为约10mg/kg。
在一些实施方案中,治疗有效剂量等于或大于50mg/kg、100mg/kg、150mg/kg、200mg/kg或250mg/kg、300mg/kg、310mg/kg、320mg/kg、330mg/kg、340mg/kg、350mg/kg、360mg/kg、370mg/kg、380mg/kg、390mg/kg、400mg/kg、450mg/kg、500mg/kg、550mg/kg、600mg/kg、650mg/kg、700mg/kg、710mg/kg、720mg/kg、730mg/kg、740mg/kg、750mg/kg、800mg/kg、850mg/kg、900mg/kg、950mg/kg或1000mg/kg。
在一些实施方案中,治疗有效剂量是大约50-1,000mg/kg、大约100-1,000mg/kg、大约150-1,000mg/kg、大约200-1,000mg/kg、大约250-1,000mg/kg、大约300-1,000mg/kg、大约350-1,000mg/kg、大约400-1,000mg/kg、大约450-1,000mg/kg、大约500-1,000mg/kg、大约550-1,000mg/kg、大约600-1,000mg/kg、大约650-1,000mg/kg、大约700-1,000mg/kg、大约750-1,000mg/kg、大约800-1,000mg/kg、大约850-1,000mg/kg、大约900-1,000mg/kg、大约950-1,000mg/kg、大约50-950mg/kg、大约50-900mg/kg、大约50-850mg/kg、大约50-800mg/kg、大约50-750mg/kg、大约50-700mg/kg、大约50-650mg/kg、大约50-600mg/kg、大约50-550mg/kg、大约50-500mg/kg、大约50-450mg/kg、大约50-400mg/kg、大约50-350mg/kg、大约50-300mg/kg、大约50-250mg/kg、大约50-200mg/kg、大约50-150mg/kg或大约50-100mg/kg。
在一些实施方案中,施用包括初始冲击剂量或负荷剂量,然后是至少一个维持剂量。在一些实施方案中,初始冲击剂量或负荷剂量大于至少一个维持剂量。在一些实施方案中,初始冲击剂量或负荷剂量的剂量是至少一个维持剂量的剂量的至少一倍、二倍、三倍、四倍或五倍。在一些实施方案中,初始冲击剂量或负荷剂量的剂量是至少一个维持剂量的剂量的两倍。例如,在一些实施方案中,初始冲击剂量或负荷剂量是720mg,并且维持剂量是360mg。
在一些实施方案中,在施用负荷剂量后施用维持剂量。在一些实施方案中,将平稳剂量用作初始冲击剂量或负荷剂量和/或维持剂量。在一些实施方案中,在单个注射器中提供合适的平稳剂量。可以单次注射或通过多次注射来施用(例如,皮下或静脉内)合适的平稳剂量。在一些实施方案中,合适的平稳剂量介于约10mg与800mg之间。因此,在一些实施方案中,合适的平稳剂量等于或大于约10mg、20mg、30mg、40mg、50mg、55mg、60mg、65mg、70mg、75mg、80mg、85mg、90mg、95mg、100mg、105mg、110mg、115mg、120mg、125mg、130mg、135mg、140mg、140mg、150mg、155mg、160mg、165mg、170mg、175mg、180mg、185mg、190mg、195mg、200mg、205mg、210mg、215mg、220mg、225mg、230mg、235mg、240mg、245mg、250mg、255mg、260mg、265mg、270mg、275mg、280mg、285mg、290mg、295mg、300mg、305mg、310mg、315mg、320mg、325mg、330mg、335mg、340mg、345mg、350mg、355mg、360mg、365mg、370mg、375mg、380mg、385、390mg、395mg、400mg、405mg、410mg、415、420mg、425mg、430mg、435mg、440mg、445mg、450mg、455mg、460mg、465mg、470mg、475mg、480mg、485mg、490mg、495mg、500mg、505mg、510mg、515mg、520mg、525mg、530mg、535mg、540mg、545mg、550mg、555mg、560mg、565mg、570mg、575mg、580mg、585mg、590mg、595mg、600mg、605mg、610mg、615mg、620mg、625mg、630mg、635mg、640mg、645mg、650mg、655mg、660mg、665mg、670mg、675mg、680mg、685mg、690mg、695、700mg、705mg、710mg、715mg、720mg、725mg、730mg、735mg、740mg、745mg、750mg、755mg、760mg、765mg、770mg、775mg、780mg、785mg、790mg、795或800mg。在一些实施方案中,合适的平稳剂量的范围是50-800mg、50-700mg、50-600mg、50-500mg、100-800mg、100-700mg、100-600mg、100-500mg、100-500mg、100-400mg、150-400mg、200-400mg、250-400mg、300-350mg、320-400mg或350-400mg。在一些实施方案中,负荷剂量为约700mg、705mg、710mg、715mg、720mg、725mg、730mg、735mg、740mg、745mg、750mg、755mg、760mg、765mg、770mg、775mg、780mg、785mg、790mg、795mg或800。在一些实施方案中,合适的初始冲击平稳剂量是720mg。在一些实施方案中,维持剂量为约300mg、305mg、310mg、315mg、320mg、325mg、330mg、335mg、340mg、345mg、350mg、355mg、360mg、365mg、370mg、375mg、380mg、380mg、390mg、395mg或400mg。在一些实施方案中,合适的维持剂量是360mg。在一些实施方案中,平稳剂量是720mg初始冲击剂量,并且是360mg维持剂量。在一些实施方案中,施用约720mg的初始负荷剂量或冲击剂量。在一些实施方案中,治疗有效剂量包括约720mg的初始冲击剂量或负荷剂量,然后是约360mg的至少一个维持剂量。
在一些实施方案中,基于体重的剂量用作初始冲击剂量或负荷剂量和/或维持剂量。在一些实施方案中,在单个注射器中提供剂量。该剂量可以单次注射或多次注射(例如皮下或静脉内)施用。在一些实施方案中,负荷剂量为约4mg/kg、5mg/kg、6mg/kg、7mg/kg、8mg/kg、9mg/kg、10mg/kg、11mg/kg、12mg/kg、13mg/kg、14mg/kg、15mg/kg、16mg/kg、17mg/kg、18mg/kg、19mg/kg、20mg/kg、21mg/kg、22mg/kg、23mg/kg、24mg/kg或25mg/kg。在一些实施方案中,负荷剂量约介于约5mg/kg与25mg/kg之间,维持剂量约介于约2.5mg/kg与7.5mg/kg之间。在一些实施方案中,维持剂量为约2.0mg/kg、2.5mg/kg、3.0mg/kg、3.5mg/kg、4.0mg/kg、4.5mg/kg、5.0mg/kg、5.5mg/kg、6.0mg/kg、6.0mg/kg、6.5mg/kg、7.0mg/kg或7.5mg/kg。在一些实施方案中,施用约10mg/kg的初始负荷剂量或冲击剂量。在一些实施方案中,治疗有效剂量包括约10mg/kg的初始冲击剂量,然后是约5mg/kg的至少一个维持剂量。
施用间隔
抗OSMRβ抗体在治疗尿毒症瘙痒或治疗慢性肾脏疾病受试者的瘙痒症的施用间隔可以在不同的持续时间发生。在本发明的一些实施方案中,施用间隔是每天。在一些实施方案中,施用间隔是每隔一天。在一些实施方案中,施用间隔是一周多次。在一些实施方案中,施用间隔是每周一次。在一些实施方案中,施用间隔是每两周一次。在一些实施方案中,施用间隔是每三周一次。在一些实施方案中,施用间隔是每四周一次。在一些实施方案中,施用间隔是每五周一次。
治疗周期
用抗OSMRβ抗体治疗尿毒症瘙痒的治疗周期可能会有所不同。在一些实施方案中,治疗周期是至少一个月。在一些实施方案中,治疗周期为至少4周、或至少5周、或至少6周、或至少7周、或至少8周、或至少9周、或至少10周、或至少11周或至少12周、或至少13周、或至少15周、或至少18周、或至少20周、或至少22周、或至少24周。在一些实施方案中,治疗周期是至少两个月。在一些实施方案中,治疗周期是至少三个月。在一些实施方案中,治疗周期是至少六个月。在一些实施方案中,治疗周期是至少九个月。在一些实施方案中,治疗周期是至少一年。在一些实施方案中,治疗周期是至少两年。在一些实施方案中,治疗周期与受试者进行血液透析的时间一样长。
药代动力学和药效动力学
患有尿毒症瘙痒的受试者血清的抗OSMRβ抗体浓度-时间曲线的评估可以通过测量全身性血清抗OSMRβ抗体浓度-时间曲线来直接评估。通常,通过定期对治疗受试者的血液进行采样来评估抗OSMRβ抗体的药代动力学和药效动力学曲线。以下标准缩写用于表示相关的药代动力学参数。
C
t
AUC
AUC
其中C
λ
t
t
CL 清除率
Vd 分布体积(仅IV剂量)
Vd/F 表观分布体积(仅SC剂量)
通常,在PK分析中使用相对于开始抗OSMRβ抗体施用的实际血液样本采集时间。例如,通常在抗OSMRβ抗体施用(注射前基线或时间0)前的15分钟或30分钟内并在第1个小时、第4个小时、第8个小时或第12个小时或第1天(24和28小时)、第2天、第3天、第4天、第5天、第6天、第7天、第10天、第13天、第17天、第20天、第24天、第27天、第31天、第34天、第41天、第48天、第55天、第62天、第69天、第76天、第90天收集血液样本。
可以使用多种方法来测量血清中的抗OSMRβ抗体的浓度。作为非限制性实例,使用酶联免疫吸附测定(ELISA)方法。
可以在治疗期间的任何阶段评估药代动力学参数,例如,在第1天、第2天、第3天、第4天、第5天、第6天、第1周、第2周、第3周、第4周、第5周、第6周、第7周、第8周、第9周、第10周、第11周、第12周、第13周、第14周、第15周、第16周、第17周、第18周、第19周、第20周、第21周、第22周、第23周、第24周或以后。在一些实施方案中,可以在治疗期间的第1个月、第2个月、第3个月、第4个月、第5个月、第6个月、第7个月、第8个月、第9个月、第10个月、第11个月、第12个月、第13个月、第14个月、第15个月、第16个月、第17个月、第18个月、第19个月、第20个月、第21个月、第22个月、第23个月、第24个月或以后评价药代动力学参数。
不良反应
与尿毒症瘙痒治疗相关的不良反应包括外周性水肿、鼻咽炎、上呼吸道感染、肌酸磷酸激酶增加、结膜炎、睑缘炎、口腔疱疹、角膜炎、眼睛瘙痒、其他单纯疱疹病毒感染和干眼症。
在一些实施方案中,抗OSMRβ抗体的施用不在受试者中导致严重的不良反应。在一些实施方案中,抗OSMRβ抗体的施用不会导致外周性水肿、鼻咽炎、上呼吸道感染和肌酸磷酸激酶增加中的一种或多种。
组合疗法
在一些实施方案中,本文所述的抗OSMRβ抗体可以与一种或多种其他治疗剂联合使用以治疗尿毒症瘙痒(UP)。例如,抗OSMRβ抗体可以与其他全身施用(例如口服)或局部施用的伴随的皮质类固醇(例如,TCS)、钙调神经蛋白抑制剂、抗菌剂和/或杀菌剂、抗组胺药和其他药物(例如,煤膏、磷酸二酯酶抑制剂)中的一种或多种联合施用。在一些实施方案中,抗OSMRβ抗体和一种或多种其他治疗剂可以同时施用。在一些实施方案中,抗OSMRβ抗体和一种或多种其他治疗剂可以按顺序施用。在一些实施方案中,可以根据需要施用一种或多种其他治疗剂。
结节性痒疹
在一方面,本文所述的抗OSMRβ抗体用于治疗结节性痒疹(PN)。在一些实施方案中,本发明的方法用于治疗患有PN的受试者的瘙痒症。PN,也称为结节性瘙痒症,是一种以瘙痒结节为特征的皮肤疾病。结节通常出现在手臂和腿部。患者经常出现由抓挠引起的多发性表皮脱落病变。在一些实施方案中,该受试者表现为瘙痒性过角化结节。
在一些实施方案中,结节性痒疹是特发性的。在一些实施方案中,结节性痒疹不与任何其他潜在的合并症相关。在一些实施方案中,结节性痒疹与一种或多种潜在的合并症相关。
在一些实施方案中,PN可以是不由其共存病状定义的独特的高度瘙痒性慢性皮肤病。IL-31可能与PN的发病机理有关。在一些实施方案中,IL-31途径可能是PN药物干预的有吸引力的靶标。在一些实施方案中,相对于对照而言,受试者中的IL-31表达水平升高。在一些实施方案中,相对于对照而言,受试者中的IL-31Rα表达水平升高。在一些实施方案中,相对于对照而言,受试者中的OSM表达水平升高。在一些实施方案中,相对于对照而言,受试者中的OSMR表达水平升高。在一些实施方案中,受试者中IL-31、IL-31Rα、OSM和OSMR中任一种的水平通过来自过角化结节的皮肤活检来测定。在一些实施方案中,对照是未被诊断为瘙痒疾病的健康受试者。
治疗结节性痒疹的方法包括:相对于对照而言,以治疗有效剂量和施用间隔向需要治疗的受试者施用抗OSMRβ抗体一段足以改善、稳定或减轻瘙痒症的一种或多种症状的治疗周期。
在一些实施方案中,施用步骤包括皮下施用。在一些实施方案中,施用步骤包括静脉内施用。在一些实施方案中,施用步骤包括静脉内施用,然后是皮下施用。在一些实施方案中,皮下施用通过皮下注射进行。有几种不同的方法评估结节性痒疹。在一些实施方案中,结节性痒疹的一种或多种症状根据瘙痒数值评定量表(NRS)通过相对于基线的变化或百分比变化来评估。在一些实施方案中,结节性痒疹的一种或多种症状通过最严重瘙痒-数字评定量表(WI-NRS)的每周平均值相对于基线的变化或百分比变化来评估。在一些实施方案中,通过在每周平均WI-NRS相对于基线降实现至少4分的降低的受试者的比例来评估结节性痒疹的一种或多种症状。在一些实施方案中,结节性痒疹的一种或多种症状由瘙痒视觉模拟量表(VAS)相对于基线的变化或百分比变化来评估。在一些实施方案中,结节性痒疹的一种或多种症状由5-D瘙痒症总得分相对于基线的变化来评估。在一些实施方案中,结节性痒疹的一种或多种症状由失眠VAS相对于基线的变化来评估。在一些实施方案中,结节性痒疹的一种或多种症状由入睡困难NRS每周平均值相对于基线的变化来评估。在一些实施方案中,结节性痒疹的一种或多种症状由睡眠质量NRS每周平均值相对于基线的变化来评估。在一些实施方案中,结节性痒疹的一种或多种症状由生活质量量度随时间相对于基线随的变化来评估。在一些实施方案中,结节性痒疹的一种或多种症状由结节性痒疹研究者总体评估(PN-IGA)相对于基线的变化来评估。在一些实施方案中,结节性痒疹的一种或多种症状由结节性痒疹结节评估工具估(PN-NAT)相对于基线的变化来评估。在一些实施方案中,结节性痒疹的一种或多种症状由皮肤病生活质量指数(DLQI)来评估。在一些实施方案中,结节性痒疹的一种或多种症状由医院焦虑抑郁量表(HADS)来评估。在一些实施方案中,结节性痒疹的一种或多种症状(如睡眠质量和睡眠量)由体动记录仪来评估。
治疗
在本发明的一些实施方案中,通过相对于对照而言,以治疗有效剂量和施用间隔向需要治疗的受试者施用抗OSMRβ抗体一段足以改善、稳定或减轻结节性痒疹的一种或多种症状的治疗周期来治疗结节性痒疹。本文在结节性瘙痒症的上下文中使用的术语“治疗”是指改善与结节性痒疹有关的一种或多种症状,预防或延缓结节性痒疹的一种或多种症状的发作,和/或减轻结节性痒疹的一种或多种症状的严重性或频率。在一些实施方案中,本文在结节性痒疹的上下文中使用的术语“治疗”是指部分或完全缓解、改善、减轻、抑制、预防结节性痒疹的一种或多种症状,延迟其发作,降低其严重性和/或降低其发生率在一些实施方案中,抗OSMRβ抗体的施用导致瘙痒数值评定量表在统计学上显著下降。在一些实施方案中,抗OSMRβ抗体的施用导致最严重瘙痒数值评定量表(WI-NRS)在统计学上显著下降。在一些实施方案中,每周平均WI-NRS得分比基线降低至少4分。在一些实施方案中,抗OSMRβ抗体的施用导致瘙痒视觉模拟量表(VAS)相对于基线在统计学上显著下降或百分比变化。在一些实施方案中,抗OSMRβ抗体的施用导致5-D瘙痒症总得分相对于基线在统计学上显著下降或百分比变化。在一些实施方案中,抗OSMRβ抗体的施用导致睡眠不足VAS中相对于基线在统计学上显著下降或百分比变化。在一些实施方案中,抗OSMRβ抗体的施用导致入睡困难NRS的每周平均值在统计学上显著下降或百分比变化。在某些实施方案中,抗OSMRβ抗体的施用导致每周平均睡眠质量NRS在统计学上下降或百分比变化。在一些实施方案中,抗OSMRβ抗体的施用导致结节性痒疹研究者总体评估(PN-IGA)相对于基线统计学上显著下降或百分比变化。在一些实施方案中,抗OSMRβ抗体的施用导致在结节性痒疹结节评估工具(PN-NAT)比较于基线统计学上显著下降或百分比变化。在一些实施方案中,抗OSMRβ抗体的施用导致皮肤病生活质量指数(DLQI)相对于基线的统计学上显著降低或百分比变化。在一些实施方案中,抗OSMRβ抗体的施用导致医院焦虑症抑郁量表(HADS)相对于基线在统计学上显著降低或百分比变化。在一些实施方案中,抗OSMRβ抗体的施用导致体动记录仪得分相对于基线在统计学上改善或百分比变化。在一些实施方案中,抗OSMRβ抗体的施用导致生活质量量度随时间在统计学上显著增加或百分比变化。在一些实施方案中,抗OSMRβ抗体的施用导致UAS7得分在统计学上显著下降或百分比变化。在一些实施方案中,施用步骤包括皮下施用。在一些实施方案中,皮下施用通过皮下注射进行。在一些实施方案中,皮下施用通过皮下泵进行。
在一些实施方案中,可以在上臂、大腿的前表面、腹部的下部、臀部的上背部或上部区域中进行抗OSMRβ抗体的皮下注射。在一些实施方案中,旋转注射部位。
在一些实施方案中,施用步骤包括静脉内施用。在一些实施方案中,施用步骤包括静脉内施用,然后是皮下施用。在一些实施方案中,施用步骤发生在受试者进行血液透析的一天前。在其他实施方案中,施用步骤发生在血液透析期间。在其他实施方案中,施用步骤发生在血液透析后的一天之内。
在一些实施方案中,需要治疗的受试者患有终末期肾脏疾病。在一些实施方案中,需要治疗的受试者接受每周至少一次的血液透析方案。在一些实施方案中,需要治疗的受试者接受每周三次的血液透析方案。在一些实施方案中,每周三次血液透析方案已经稳定至少三个月。
在一些实施方案中,相对于对照而言,测量抗OSMRβ抗体对结节性痒疹的作用。在一些实施方案中,对照指示治疗前受试者的结节性痒疹的一种或多种症状。在一些实施方案中,治疗前受试者的结节性痒疹的一种或多种症状包括瘙痒NRS得分大于或等于5。在一些实施方案中,治疗前受试者的结节性痒疹的一种或多种症状包括瘙痒NRS得分大于或等于7。在一些实施方案中,对照指示具有相同疾病状态而未经治疗的对照受试者的结节性痒疹的一种或多种症状。在一些实施方案中,对照指示具有相同疾病状态并施用安慰剂的对照受试者的结节性痒疹的一种或多种症状。
在一些实施方案中,与健康受试者相比,需要治疗的受试者的与OSMRβ信号传导途径相关的一种或多种细胞因子的水平升高。因此,在一些实施方案中,与健康受试者相比,需要治疗的受试者的IL-31、OSM、IL-31Rα和OSMRβ中的一种或多种的水平升高。在一些实施方案中,与健康受试者相比,需要治疗的受试者的一种或多种IL-31的水平升高。在一些实施方案中,与健康受试者相比,需要治疗的受试者的一种或多种OSM的水平升高。在一些实施方案中,与健康受试者相比,需要治疗的受试者一种或多种IL-31Rα的水平升高。在一些实施方案中,与健康受试者相比,需要治疗的受试者一种或多种OSMRβ的水平升高。
在一些实施方案中,治疗需要其的受试者导致受试者中的MCP-1/CCL2水平的降低或稳定。因此,在一些实施方案中,与患病状态相比,治疗需要其的受试者导致MCP-1水平的降低。在一些实施方案中,治疗需要其的受试者导致MCP-1水平的稳定。“稳定”是指MCP-1的水平保持大致相同,并且不增加或减少。在一些实施方案中,治疗受试者导致淋巴细胞和/或内皮细胞中MCP-1水平的降低。
在一些实施方案中,需要治疗的受试者的WI-NRS得分为约4、约5、约6、约7、约8或以上。因此,在一些实施方案中,需要治疗的受试者的WI-NRS得分为约4。在一些实施方案中,需要治疗的受试者的WI-NRS得分为约5。在一些实施方案中,需要治疗的受试者的WI-NRS得分为约6。在一些实施方案中,需要治疗的受试者的WI-NRS得分为约7。在一些实施方案中,需要治疗的受试者的WI-NRS得分为约8。在一些实施方案中,需要治疗的受试者的WI-NRS得分大于8。
在一些实施方案中,选择MCP-1/CCL2水平大于健康个体中发现的水平的受试者进行治疗。在一些实施方案中,与健康个体相比,选择用于治疗的受试者的MCP-1/CCL2水平不升高。在一些实施方案中,相对于对照而言,受试者中的IL-31表达水平升高。在一些实施方案中,相对于对照而言,受试者中的IL-31表达水平没有升高。在一些实施方案中,受瘙痒性疾病或病状影响的受试者的一部分皮肤中的IL-31表达水平与以下中的IL-31表达水平大致相同:(i)未受瘙痒疾病或病状影响的受试者的一部分皮肤,或(ii)未诊断为瘙痒性疾病或病症的健康受试者的一部分正常皮肤。在一些实施方案中,相对于对照而言,受试者中的IL-31Rα表达水平升高。在一些实施方案中,相对于对照而言,受试者中的OSM表达水平升高。在一些实施方案中,相对于对照而言,受试者中的OSMRβ表达水平升高。在一些实施方案中,相对于对照而言,受试者中的OSMRβ表达水平没有升高。在一些实施方案中,受瘙痒性疾病或病症影响的受试者的一部分皮肤中的OSMRβ表达水平与以下中的OSMRβ表达水平大致相同:(i)未受瘙痒性疾病或病症影响的受试者的一部分皮肤,或(ii)未诊断为瘙痒性疾病或病症的健康受试者的一部分正常皮肤。
剂量
用于治疗结节性痒疹的抗OSMRβ抗体的治疗有效剂量可以多种剂量出现。在本发明的一些实施方案中,治疗有效剂量等于或大于约0.1mg/kg、0.2mg/kg、0.3mg/kg、0.4mg/kg、0.5mg/kg、0.6mg/kg、0.8mg/kg、0.9mg/kg、1mg/kg、1.2mg/kg、1.5mg/kg、2mg/kg、2.5mg/kg、3mg/kg、3.5mg/kg、4mg/kg、4.5mg/kg、5mg/kg、5.5mg/kg、6mg/kg、6.5mg/kg、7mg/kg、7.5mg/kg、8mg/kg、8.5mg/kg、9mg/kg、9.5mg/kg、10mg/kg、10.5mg/kg、11mg/kg、11.5mg/kg、12mg/kg、12.5mg/kg、13mg/kg、13.5mg/kg、14mg/kg、14.5mg/kg、15mg/kg、15.5mg/kg、16mg/kg、17mg/kg、18mg/kg、19mg/kg或20mg/kg或30mg/kg。在一些实施方案中,治疗有效剂量等于或大于3mg/kg、4mg/kg、5mg/kg、6mg/kg、7mg/kg、7.5mg/kg、8mg/kg、9mg/kg、10mg/kg、11mg/kg、12mg/kg、13mg/kg、14mg/kg、15mg/kg、16mg/kg、17mg/kg、18mg/kg、19mg/kg或20mg/kg。
在一些实施方案中,治疗有效剂量是大约0.1-20mg/kg、大约0.3-20mg/kg、大约0.5-20mg/kg、大约0.75-20mg/kg、大约1-20mg/kg、大约1.5、-20mg/kg、大约2-20mg/kg、大约2.5-20mg/kg、大约3-20mg/kg、大约3.5-20mg/kg、大约4-20mg/kg、大约4.5-20mg/kg、大约5-20mg/kg、大约5.5-20mg/kg、大约6-20mg/kg、大约6.5-20mg/kg、大约7-20mg/kg、大约7.5-20mg/kg、大约8-20mg/kg、大约8.5-20mg/kg、大约9-20mg/kg、大约9.5-20mg/kg、大约10-20mg/kg或大约10.5-20mg/kg。
在一些实施方案中,治疗有效剂量是大约3-20mg/kg、大约4-20mg/kg、大约5-20mg/kg、大约6-20mg/kg、大约7-20mg/kg、大约8-20mg/kg、大约9-20mg/kg、大约10-20mg/kg、大约11-20mg/kg、大约12-20mg/kg、大约13-20mg/kg、大约14-20mg/kg、大约15-20mg/kg、大约16-20mg/kg、大约17-20mg/kg、大约18-20mg/kg、大约19-20mg/kg、大约3-19mg/kg、大约3-18mg/kg、大约3-17mg/kg、大约3-16mg/kg、大约3-15mg/kg、大约3-14mg/kg、大约3-13mg/kg大约3-12mg/kg、大约3-11mg/kg、大约3-10mg/kg、大约3-9mg/kg、大约3-8mg/kg、大约3-7mg/kg、大约3-6mg/kg、大约3-5mg/kg、大约3-4mg/kg或大约5-10mg/kg。在一些实施方案中,治疗有效剂量为约5mg/kg。在一些实施方案中,治疗有效剂量为约10mg/kg。
在一些实施方案中,治疗有效剂量等于或大于50mg/kg、100mg/kg、150mg/kg、200mg/kg或250mg/kg、300mg/kg、310mg/kg、320mg/kg、330mg/kg、340mg/kg、350mg/kg、360mg/kg、370mg/kg、380mg/kg、390mg/kg、400mg/kg、450mg/kg、500mg/kg、550mg/kg、600mg/kg、650mg/kg、700mg/kg、710mg/kg、720mg/kg、730mg/kg、740mg/kg、750mg/kg、800mg/kg、850mg/kg、900mg/kg、950mg/kg或1000mg/kg。
在一些实施方案中,治疗有效剂量是大约50-1,000mg/kg、大约100-1,000mg/kg、大约150-1,000mg/kg、大约200-1,000mg/kg、大约250-1,000mg/kg、大约300-1,000mg/kg、大约350-1,000mg/kg、大约400-1,000mg/kg、大约450-1,000mg/kg、大约500-1,000mg/kg、大约550-1,000mg/kg、大约600-1,000mg/kg、大约650-1,000mg/kg、大约700-1,000mg/kg、大约750-1,000mg/kg、大约800-1,000mg/kg、大约850-1,000mg/kg、大约900-1,000mg/kg、大约950-1,000mg/kg、大约50-950mg/kg、大约50-900mg/kg、大约50-850mg/kg、大约50-800mg/kg、大约50-750mg/kg、大约50-700mg/kg、大约50-650mg/kg、大约50-600mg/kg、大约50-550mg/kg、大约50-500mg/kg、大约50-450mg/kg、大约50-400mg/kg、大约50-350mg/kg、大约50-300mg/kg、大约50-250mg/kg、大约50-200mg/kg、大约50-150mg/kg或大约50-100mg/kg。
在一些实施方案中,施用包括初始冲击剂量或负荷剂量,然后是至少一个维持剂量。在一些实施方案中,初始冲击剂量或负荷剂量大于至少一个维持剂量。在一些实施方案中,初始冲击剂量或负荷剂量的剂量是至少一个维持剂量的剂量的至少一倍、二倍、三倍、四倍或五倍。在一些实施方案中,初始冲击剂量或负荷剂量的剂量是至少一个维持剂量的剂量的两倍。例如,在一些实施方案中,初始冲击剂量或负荷剂量是720mg,并且维持剂量是360mg。
在一些实施方案中,在施用负荷剂量后施用维持剂量。在一些实施方案中,将平稳剂量用作初始冲击剂量或负荷剂量和/或维持剂量。在一些实施方案中,在单个注射器中提供合适的平稳剂量。可以单次注射或通过多次注射来施用(例如,皮下或静脉内)合适的平稳剂量。在一些实施方案中,合适的平稳剂量介于约10mg与800mg之间。因此,在一些实施方案中,合适的平稳剂量等于或大于约10mg、20mg、30mg、40mg、50mg、55mg、60mg、65mg、70mg、75mg、80mg、85mg、90mg、95mg、100mg、105mg、110mg、115mg、120mg、125mg、130mg、135mg、140mg、140mg、150mg、155mg、160mg、165mg、170mg、175mg、180mg、185mg、190mg、195mg、200mg、205mg、210mg、215mg、220mg、225mg、230mg、235mg、240mg、245mg、250mg、255mg、260mg、265mg、270mg、275mg、280mg、285mg、290mg、295mg、300mg、305mg、310mg、315mg、320mg、325mg、330mg、335mg、340mg、345mg、350mg、355mg、360mg、365mg、370mg、375mg、380mg、385、390mg、395mg、400mg、405mg、410mg、415、420mg、425mg、430mg、435mg、440mg、445mg、450mg、455mg、460mg、465mg、470mg、475mg、480mg、485mg、490mg、495mg、500mg、505mg、510mg、515mg、520mg、525mg、530mg、535mg、540mg、545mg、550mg、555mg、560mg、565mg、570mg、575mg、580mg、585mg、590mg、595mg、600mg、605mg、610mg、615mg、620mg、625mg、630mg、635mg、640mg、645mg、650mg、655mg、660mg、665mg、670mg、675mg、680mg、685mg、690mg、695、700mg、705mg、710mg、715mg、720mg、725mg、730mg、735mg、740mg、745mg、750mg、755mg、760mg、765mg、770mg、775mg、780mg、785mg、790mg、795或800mg。在一些实施方案中,合适的平稳剂量的范围是50-800mg、50-700mg、50-600mg、50-500mg、100-800mg、100-700mg、100-600mg、100-500mg、100-500mg、100-400mg、150-400mg、200-400mg、250-400mg、300-350mg、320-400mg或350-400mg。在一些实施方案中,负荷剂量为约700mg、705mg、710mg、715mg、720mg、725mg、730mg、735mg、740mg、745mg、750mg、755mg、760mg、765mg、770mg、775mg、780mg、785mg、790mg、795mg或800。在一些实施方案中,合适的初始冲击平稳剂量是720mg。在一些实施方案中,维持剂量为约300mg、305mg、310mg、315mg、320mg、325mg、330mg、335mg、340mg、345mg、350mg、355mg、360mg、365mg、370mg、375mg、380mg、380mg、390mg、395mg或400mg。在一些实施方案中,合适的维持剂量是360mg。在一些实施方案中,平稳剂量是720mg初始冲击剂量,并且是360mg维持剂量。在一些实施方案中,施用约720mg的初始负荷剂量或冲击剂量。在一些实施方案中,治疗有效剂量包括约720mg的初始冲击剂量或负荷剂量,然后是约360mg的至少一个维持剂量。
在一些实施方案中,基于体重的剂量用作初始冲击剂量或负荷剂量和/或维持剂量。在一些实施方案中,在单个注射器中提供剂量。该剂量可以单次注射或多次注射(例如皮下或静脉内)施用。在一些实施方案中,负荷剂量为约4mg/kg、5mg/kg、6mg/kg、7mg/kg、8mg/kg、9mg/kg、10mg/kg、11mg/kg、12mg/kg、13mg/kg、14mg/kg、15mg/kg、16mg/kg、17mg/kg、18mg/kg、19mg/kg、20mg/kg、21mg/kg、22mg/kg、23mg/kg、24mg/kg或25mg/kg。在一些实施方案中,负荷剂量约介于约5mg/kg与25mg/kg之间,维持剂量约介于约2.5mg/kg与7.5mg/kg之间。在一些实施方案中,维持剂量为约2.0mg/kg、2.5mg/kg、3.0mg/kg、3.5mg/kg、4.0mg/kg、4.5mg/kg、5.0mg/kg、5.5mg/kg、6.0mg/kg、6.0mg/kg、6.5mg/kg、7.0mg/kg或7.5mg/kg。在一些实施方案中,施用约10mg/kg的初始负荷剂量或冲击剂量。在一些实施方案中,治疗有效剂量包括约10mg/kg的初始冲击剂量,然后是约5mg/kg的至少一个维持剂量。
施用间隔
抗OSMRβ抗体在治疗受试者的结节性痒疹的施用间隔可以不同的持续时间发生。在本发明的一些实施方案中,施用间隔是每天。在一些实施方案中,施用间隔是每隔一天。在一些实施方案中,施用间隔是一周多次。在一些实施方案中,施用间隔是每周一次。在一些实施方案中,施用间隔是每两周一次。在一些实施方案中,施用间隔是每三周一次。在一些实施方案中,施用间隔是每四周一次。在一些实施方案中,施用间隔是每五周一次。
治疗周期
用抗OSMRβ抗体治疗结节性瘙痒的持续时间可能会有所不同。在一些实施方案中,治疗周期是至少一个月。在一些实施方案中,治疗周期为至少4周、或至少5周、或至少6周、或至少7周、或至少8周、或至少9周、或至少10周、或至少11周或至少12周、或至少13周、或至少15周、或至少18周、或至少20周、或至少22周、或至少24周。在一些实施方案中,治疗周期是至少两个月。在一些实施方案中,治疗周期是至少三个月。在一些实施方案中,治疗周期是至少六个月。在一些实施方案中,治疗周期是至少九个月。在一些实施方案中,治疗周期是至少一年。在一些实施方案中,治疗周期是至少两年。在一些实施方案中,治疗周期与受试者进行血液透析的时间一样长。
药代动力学和药效动力学
结节性瘙痒症患者血清中抗OSMRβ抗体浓度-时间曲线的评估可以通过测量全身性血清抗OSMRβ抗体浓度-时间曲线来直接评估。通常,通过定期对治疗受试者的血液进行采样来评估抗OSMRβ抗体的药代动力学和药效动力学曲线。以下标准缩写用于表示相关的药代动力学参数。
C
t
AUC
AUC
其中C
λ
t
t
CL 清除率
Vd 分布体积(仅IV剂量)
Vd/F 表观分布体积(仅SC剂量)
通常,在PK分析中使用相对于开始抗OSMRβ抗体施用的实际血液样本采集时间。例如,通常在抗OSMRβ抗体施用(注射前基线或时间0)前的15分钟或30分钟内并在第1个小时、第4个小时、第8个小时或第12个小时或第1天(24和28小时)、第2天、第3天、第4天、第5天、第6天、第7天、第10天、第13天、第17天、第20天、第24天、第27天、第31天、第34天、第41天、第48天、第55天、第62天、第69天、第76天、第90天收集血液样本。
可以使用多种方法来测量血清中的抗OSMRβ抗体的浓度。作为非限制性实例,使用酶联免疫吸附测定(ELISA)方法。
可以在治疗期间的任何阶段评估药代动力学参数,例如,在第1天、第2天、第3天、第4天、第5天、第6天、第1周、第2周、第3周、第4周、第5周、第6周、第7周、第8周、第9周、第10周、第11周、第12周、第13周、第14周、第15周、第16周、第17周、第18周、第19周、第20周、第21周、第22周、第23周、第24周或以后。在一些实施方案中,可以在治疗期间的第1个月、第2个月、第3个月、第4个月、第5个月、第6个月、第7个月、第8个月、第9个月、第10个月、第11个月、第12个月、第13个月、第14个月、第15个月、第16个月、第17个月、第18个月、第19个月、第20个月、第21个月、第22个月、第23个月、第24个月或以后评价药代动力学参数。
不良反应
与结节性瘙痒症治疗相关的不良反应包括外周性水肿、鼻咽炎、上呼吸道感染、肌酸磷酸激酶增加、结膜炎、睑缘炎、口腔疱疹、角膜炎、眼睛瘙痒、其他单纯疱疹病毒感染和干眼症
在一些实施方案中,抗OSMRβ抗体的施用不在受试者中导致严重的不良反应。在一些实施方案中,抗OSMRβ抗体的施用不会导致外周性水肿、鼻咽炎、上呼吸道感染和肌酸磷酸激酶增加中的一种或多种。
组合疗法
在一些实施方案中,本文所述的抗OSMRβ抗体可以与一种或多种其他治疗剂联合使用以治疗结节性瘙痒症(PN)。例如,抗OSMRβ抗体可以与全身施用(例如口服)或局部施用的伴随的皮质类固醇(例如TCS)、钙调神经蛋白抑制剂、抗菌剂和/或杀菌剂、抗组胺药和其他药物(例如煤膏、磷酸二酯酶抑制剂)中的一种或多种联合施用。在一些实施方案中,抗OSMRβ抗体和一种或多种其他治疗剂可以同时施用。在一些实施方案中,抗OSMRβ抗体和一种或多种其他治疗剂可以按顺序施用。在一些实施方案中,可以根据需要施用一种或多种其他治疗剂。
其他治疗指征
在一些实施方案中,本发明提供了用于治疗与慢性特发性瘙痒症(CIP)相关的瘙痒症的方法和组合物。在一些实施方案中,预期本发明的方法和组合物用于治疗与慢性特发性荨麻疹(CIU)有关的瘙痒症。在一些实施方案中,预期本发明的方法和组合物用于治疗与慢性自发性荨麻疹(CSU)有关的瘙痒症。在一些实施方案中,预期本发明的方法和组合物用于治疗与皮肤淀粉样变(CA)有关的瘙痒症。在一些实施方案中,预期本发明的方法和组合物用于治疗与斑块状银屑病(PP)相关的瘙痒症。在一些实施方案中,预期本发明的方法和组合物用于治疗与慢性单纯性苔藓(LSC)有关的瘙痒症。在一些实施方案中,预期本发明的方法和组合物用于治疗与扁平苔藓(LP)相关的瘙痒症。在一些实施方案中,预期本发明的方法和组合物用于治疗与炎症性鱼鳞癣(II)相关的瘙痒症。在一些实施方案中,预期本发明的方法和组合物用于治疗与肥大细胞增生病(MA)相关的瘙痒症。在一些实施方案中,预期本发明的方法和组合物用于治疗与大疱性类天疱疮(BP)相关的瘙痒症。
治疗CIP、CIU、CSU、CA、PP、LSC、LP、MA或BP的方法包括:相对于对照而言,以治疗有效剂量和施用间隔向需要治疗的受试者施用抗OSMRβ抗体一段足以改善、稳定或减轻瘙痒症的一种或多种症状的治疗周期。有几种不同的方法来评估CIP、CIU、CSU、CA、PP、LSC、LP、MA或BP的症状在一些实施方案中,任何这些瘙痒病状的一种或多种症状由最严重瘙痒数值评定量表(WI-NRS)的每周平均值相对于基线的变化或百分比变化来评估。在一些实施方案中,任何这些瘙痒病状的一种或多种症状由在每周平均WI-NRS相对于基线实现至少4分的降低的受试者的比例来评估。在一些实施方案中,任何这些瘙痒病的一个或多个症状由瘙痒视觉模拟量表(VAS)相对于基线的变化或百分比变化来评估。在一些实施方案中,任何这些瘙痒症的一种或多种症状由5-D瘙痒症总得分相对于基线的变化来评估。在一些实施方案中,任何这些瘙痒病的一个或多个症状由睡眠不足VAS相对于基线的变化来评估。在一些实施方案中,任何这些瘙痒病状的一种或多种症状由从入睡困难NRS的每周平均值相对于的基线的变化来评估。在一些实施方案中,这些瘙痒病状中的任一种或多种症状由睡眠质量NRS每周平均值相对于基线的变化来评估。在一些实施方案中,任何这些瘙痒病的一个或多个症状随时由生活质量量度随时间相对于基线的变化来评估。在一些实施方案中,CIU或CSU的一种或多种症状由每周瘙痒严重性得分(荨麻疹活动得分7(UAS7)的组成部分)相对于基线的变化来评估。在一些实施方案中,通过每周荨麻疹严重性得分(UAS7的组成部分)相对于基线的变化来评估CIU或CSU的一种或多种症状。在某些实施方案中,CIU或CSU的一种或多种症状由从UAS7相对于基线的变化来评估。
在一些实施方案中,相对于对照而言,测量抗OSMRβ抗体对CIP、CIU、CSU、CA、PP、LSC、LP、MA或BP的作用。在一些实施方案中,对照指示治疗前受试者的这些瘙痒病的一种或多种症状,包括例如,瘙痒NRS得分大于或等于5。在一些实施方案中,治疗前受试者的这些瘙痒病的一种或多种症状包括瘙痒NRS得分大于或等于7。在一些实施方案中,对照指示具有相同疾病状态而未经治疗的对照受试者的这些瘙痒病的一种或多种症状。在一些实施方案中,对照指示具有相同疾病状态并施用安慰剂的对照受试者的这些瘙痒病的一种或多种症状。
在一些实施方案中,通过相对于对照而言,以治疗有效剂量和施用间隔向需要治疗的受试者施用抗OSMRβ抗体一段足以改善、稳定或减轻CIP、CIU、CSU、CA、PP、LSC、LP、MA或BP的一种或多种症状的治疗周期来治疗CIP、CIU、CSU、CA、PP、LSC、LP、MA或BP。在本文中CIP、CIU、CSU、CA、PP、LSC、LP、MA或BP的上下文中使用的术语“治疗”是指改善与CIP、CIU、CSU、CA、PP、LSC、LP、MA或BP有关的一种或多种症状,预防或延迟CIP、CIU、CSU、CA、PP、LSC、LP、MA或BP的一种或多种症状的发作,和/或减轻CIP、CIU、CSU、CA、PP、LSC、LP、MA或BP的一种或多种症状的严重性或频率。在一些实施方案中,本文在CIP、CIU、CSU、CA、PP、LSC、LP、MA或BP的上下文中使用的术语“治疗”是指部分或完全缓解、改善、减轻、抑制、预防CIP、CIU、CSU、CA、PP、LSC、LP、MA或BP中一种或多种症状或特征,延迟其发作,降低其严重性和/或降低其发生率。在一些实施方案中,抗OSMRβ抗体的施用导致定量数值瘙痒量表在统计学上显著下降。在一些实施方案中,OSMRβ抗体的施用导致每周平均最严重瘙痒数值评定量表(WI-NRS)在统计学上显著下降。在一些实施方案中,每周平均WI-NRS得分比基线降低至少4分。在一些实施方案中,抗OSMRβ抗体的施用导致瘙痒视觉模拟量表(VAS)相对于基线在统计学上显著下降或百分比变化。在一些实施方案中,抗OSMRβ抗体的施用导致5-D瘙痒症总得分相对于基线在统计学上显著下降或百分比变化。在一些实施方案中,抗OSMRβ抗体的施用导致睡眠不足VAS相对于基线在统计学上显著下降或百分比变化。在一些实施方案中,抗OSMRβ抗体的施用导致入睡困难NRS的每周平均值在统计学上显著下降或百分比变化。在一些实施方案中,抗OSMRβ抗体的施用导致生活质量量度随时间在统计学上显著增加火百分比变化。在一些实施方案中,抗OSMRβ抗体的施用导致UAS7得分在统计学上显著下降或百分比变化。
在一些实施方案中,施用步骤包括皮下施用。在一些实施方案中,皮下施用通过皮下注射进行。在一些实施方案中,皮下施用通过皮下泵进行。
用于治疗CIP、CIU、CSU、CA、PP、LSC、LP、MA或BP的抗OSMRβ抗体的治疗有效剂量可以多种剂量出现。在本发明的一些实施方案中,治疗有效剂量等于或大于约0.1mg/kg、0.2mg/kg、0.3mg/kg、0.4mg/kg、0.5mg/kg、0.6mg/kg、0.8mg/kg、0.9mg/kg、1mg/kg、1.2mg/kg、1.5mg/kg、2mg/kg、2.5mg/kg、3mg/kg、3.5mg/kg、4mg/kg、4.5mg/kg、5mg/kg、5.5mg/kg、6mg/kg、6.5mg/kg、7mg/kg、7.5mg/kg、8mg/kg、8.5mg/kg、9mg/kg、9.5mg/kg、10mg/kg、10.5mg/kg、11mg/kg、11.5mg/kg、12mg/kg、12.5mg/kg、13mg/kg、13.5mg/kg、14mg/kg、14.5mg/kg、15mg/kg、15.5mg/kg、16mg/kg、17mg/kg、18mg/kg、19mg/kg或20mg/kg或30mg/kg。在一些实施方案中,治疗有效剂量等于或大于3mg/kg、4mg/kg、5mg/kg、6mg/kg、7mg/kg、7.5mg/kg、8mg/kg、9mg/kg、10mg/kg、11mg/kg、12mg/kg、13mg/kg、14mg/kg、15mg/kg、16mg/kg、17mg/kg、18mg/kg、19mg/kg或20mg/kg。
在一些实施方案中,治疗有效剂量是大约0.1-20mg/kg、大约0.3-20mg/kg、大约0.5-20mg/kg、大约0.75-20mg/kg、大约1-20mg/kg、大约1.5、-20mg/kg、大约2-20mg/kg、大约2.5-20mg/kg、大约3-20mg/kg、大约3.5-20mg/kg、大约4-20mg/kg、大约4.5-20mg/kg、大约5-20mg/kg、大约5.5-20mg/kg、大约6-20mg/kg、大约6.5-20mg/kg、大约7-20mg/kg、大约7.5-20mg/kg、大约8-20mg/kg、大约8.5-20mg/kg、大约9-20mg/kg、大约9.5-20mg/kg、大约10-20mg/kg或大约10.5-20mg/kg。
在一些实施方案中,治疗有效剂量是大约3-20mg/kg、大约4-20mg/kg、大约5-20mg/kg、大约6-20mg/kg、大约7-20mg/kg、大约8-20mg/kg、大约9-20mg/kg、大约10-20mg/kg、大约11-20mg/kg、大约12-20mg/kg、大约13-20mg/kg、大约14-20mg/kg、大约15-20mg/kg、大约16-20mg/kg、大约17-20mg/kg、大约18-20mg/kg、大约19-20mg/kg、大约3-19mg/kg、大约3-18mg/kg、大约3-17mg/kg、大约3-16mg/kg、大约3-15mg/kg、大约3-14mg/kg、大约3-13mg/kg大约3-12mg/kg、大约3-11mg/kg、大约3-10mg/kg、大约3-9mg/kg、大约3-8mg/kg、大约3-7mg/kg、大约3-6mg/kg、大约3-5mg/kg、大约3-4mg/kg或大约5-10mg/kg。在一些实施方案中,治疗有效剂量为约5mg/kg。在一些实施方案中,治疗有效剂量为约10mg/kg。
在一些实施方案中,治疗有效剂量等于或大于50mg/kg、100mg/kg、150mg/kg、200mg/kg或250mg/kg、300mg/kg、310mg/kg、320mg/kg、330mg/kg、340mg/kg、350mg/kg、360mg/kg、370mg/kg、380mg/kg、390mg/kg、400mg/kg、450mg/kg、500mg/kg、550mg/kg、600mg/kg、650mg/kg、700mg/kg、710mg/kg、720mg/kg、730mg/kg、740mg/kg、750mg/kg、800mg/kg、850mg/kg、900mg/kg、950mg/kg或1000mg/kg。
在一些实施方案中,治疗有效剂量是大约50-1,000mg/kg、大约100-1,000mg/kg、大约150-1,000mg/kg、大约200-1,000mg/kg、大约250-1,000mg/kg、大约300-1,000mg/kg、大约350-1,000mg/kg、大约400-1,000mg/kg、大约450-1,000mg/kg、大约500-1,000mg/kg、大约550-1,000mg/kg、大约600-1,000mg/kg、大约650-1,000mg/kg、大约700-1,000mg/kg、大约750-1,000mg/kg、大约800-1,000mg/kg、大约850-1,000mg/kg、大约900-1,000mg/kg、大约950-1,000mg/kg、大约50-950mg/kg、大约50-900mg/kg、大约50-850mg/kg、大约50-800mg/kg、大约50-750mg/kg、大约50-700mg/kg、大约50-650mg/kg、大约50-600mg/kg、大约50-550mg/kg、大约50-500mg/kg、大约50-450mg/kg、大约50-400mg/kg、大约50-350mg/kg、大约50-300mg/kg、大约50-250mg/kg、大约50-200mg/kg、大约50-150mg/kg或大约50-100mg/kg。
在一些实施方案中,施用包括初始冲击剂量或负荷剂量,然后是至少一个维持剂量。在一些实施方案中,初始冲击剂量或负荷剂量大于至少一个维持剂量。在一些实施方案中,初始冲击剂量或负荷剂量的剂量是至少一个维持剂量的剂量的至少一倍、二倍、三倍、四倍或五倍。在一些实施方案中,初始冲击剂量或负荷剂量的剂量是至少一个维持剂量的剂量的两倍。例如,在一些实施方案中,初始冲击剂量或负荷剂量是720mg,并且维持剂量是360mg。
在一些实施方案中,在施用负荷剂量后施用维持剂量。在一些实施方案中,将平稳剂量用作初始冲击剂量或负荷剂量和/或维持剂量。在一些实施方案中,在单个注射器中提供合适的平稳剂量。可以单次注射或通过多次注射来施用(例如,皮下或静脉内)合适的平稳剂量。在一些实施方案中,合适的平稳剂量介于约10mg与800mg之间。因此,在一些实施方案中,合适的平稳剂量等于或大于约10mg、20mg、30mg、40mg、50mg、55mg、60mg、65mg、70mg、75mg、80mg、85mg、90mg、95mg、100mg、105mg、110mg、115mg、120mg、125mg、130mg、135mg、140mg、140mg、150mg、155mg、160mg、165mg、170mg、175mg、180mg、185mg、190mg、195mg、200mg、205mg、210mg、215mg、220mg、225mg、230mg、235mg、240mg、245mg、250mg、255mg、260mg、265mg、270mg、275mg、280mg、285mg、290mg、295mg、300mg、305mg、310mg、315mg、320mg、325mg、330mg、335mg、340mg、345mg、350mg、355mg、360mg、365mg、370mg、375mg、380mg、385、390mg、395mg、400mg、405mg、410mg、415、420mg、425mg、430mg、435mg、440mg、445mg、450mg、455mg、460mg、465mg、470mg、475mg、480mg、485mg、490mg、495mg、500mg、505mg、510mg、515mg、520mg、525mg、530mg、535mg、540mg、545mg、550mg、555mg、560mg、565mg、570mg、575mg、580mg、585mg、590mg、595mg、600mg、605mg、610mg、615mg、620mg、625mg、630mg、635mg、640mg、645mg、650mg、655mg、660mg、665mg、670mg、675mg、680mg、685mg、690mg、695、700mg、705mg、710mg、715mg、720mg、725mg、730mg、735mg、740mg、745mg、750mg、755mg、760mg、765mg、770mg、775mg、780mg、785mg、790mg、795或800mg。在一些实施方案中,合适的平稳剂量的范围是50-800mg、50-700mg、50-600mg、50-500mg、100-800mg、100-700mg、100-600mg、100-500mg、100-500mg、100-400mg、150-400mg、200-400mg、250-400mg、300-350mg、320-400mg或350-400mg。在一些实施方案中,负荷剂量为约700mg、705mg、710mg、715mg、720mg、725mg、730mg、735mg、740mg、745mg、750mg、755mg、760mg、765mg、770mg、775mg、780mg、785mg、790mg、795mg或800。在一些实施方案中,合适的初始冲击平稳剂量是720mg。在一些实施方案中,维持剂量为约300mg、305mg、310mg、315mg、320mg、325mg、330mg、335mg、340mg、345mg、350mg、355mg、360mg、365mg、370mg、375mg、380mg、380mg、390mg、395mg或400mg。在一些实施方案中,合适的维持剂量是360mg。在一些实施方案中,平稳剂量是720mg初始冲击剂量,并且是360mg维持剂量。在一些实施方案中,施用约720mg的初始负荷剂量或冲击剂量。在一些实施方案中,治疗有效剂量包括约720mg的初始冲击剂量或负荷剂量,然后是约360mg的至少一个维持剂量。
在一些实施方案中,基于体重的剂量用作初始冲击剂量或负荷剂量和/或维持剂量。在一些实施方案中,在单个注射器中提供剂量。该剂量可以单次注射或多次注射(例如皮下或静脉内)施用。在一些实施方案中,负荷剂量为约4mg/kg、5mg/kg、6mg/kg、7mg/kg、8mg/kg、9mg/kg、10mg/kg、11mg/kg、12mg/kg、13mg/kg、14mg/kg、15mg/kg、16mg/kg、17mg/kg、18mg/kg、19mg/kg、20mg/kg、21mg/kg、22mg/kg、23mg/kg、24mg/kg或25mg/kg。在一些实施方案中,负荷剂量约介于约5mg/kg与25mg/kg之间,维持剂量约介于约2.5mg/kg与7.5mg/kg之间。在一些实施方案中,维持剂量为约2.0mg/kg、2.5mg/kg、3.0mg/kg、3.5mg/kg、4.0mg/kg、4.5mg/kg、5.0mg/kg、5.5mg/kg、6.0mg/kg、6.0mg/kg、6.5mg/kg、7.0mg/kg或7.5mg/kg。在一些实施方案中,施用约10mg/kg的初始负荷剂量或冲击剂量。在一些实施方案中,治疗有效剂量包括约10mg/kg的初始冲击剂量,然后是约5mg/kg的至少一个维持剂量。抗OSMRβ抗体在治疗受试者中的CIP、CIU、CSU、CA、PP、LSC、LP、MA或BP中的施用间隔可以以各种持续时间进行。在本发明的一些实施方案中,施用间隔是每天。在一些实施方案中,施用间隔是每隔一天。在一些实施方案中,施用间隔是一周多次。在一些实施方案中,施用间隔是每周一次。在一些实施方案中,施用间隔是每两周一次。在一些实施方案中,施用间隔是每三周一次。在一些实施方案中,施用间隔是每四周一次。在一些实施方案中,施用间隔是每五周一次。
用抗OSMRβ抗体治疗CIP、CIU、CSU、CA、PP、LSC、LP、MA或BP的治疗周期可能在持续时间上变化。在一些实施方案中,治疗周期是至少一个月。在一些实施方案中,治疗周期为至少4周、或至少5周、或至少6周、或至少7周、或至少8周、或至少9周、或至少10周、或至少11周或至少12周、或至少13周、或至少15周、或至少18周、或至少20周、或至少22周、或至少24周。在一些实施方案中,治疗周期是至少两个月。在一些实施方案中,治疗周期是至少三个月。在一些实施方案中,治疗周期是至少六个月。在一些实施方案中,治疗周期是至少九个月。在一些实施方案中,治疗周期是至少一年。在一些实施方案中,治疗周期是至少两年。在一些实施方案中,治疗周期与受试者进行血液透析的时间一样长。
与CIP、CIU、CSU、CA、PP、LSC、LP、MA或BP治疗相关的不良反应可以包括外周性水肿、鼻咽炎、上呼吸道感染、肌酸磷酸激酶增加、结膜炎、睑缘炎、口腔疱疹、角膜炎、眼睛瘙痒、其他单纯疱疹病毒感染、干眼症、疼痛、疲劳、关节痛、骨折、腿痛、手臂痛、头晕、瘙痒性皮炎、耳痛和表现为支气管痉挛的过敏性反应、低血压、晕厥、荨麻疹和/或喉咙或舌头血管性水肿。
在一些实施方案中,抗OSMRβ抗体的施用不在受试者中导致严重的不良反应。在一些实施方案中,抗OSMRβ抗体的施用不会导致外周性水肿、鼻咽炎、上呼吸道感染、肌酸磷酸激酶增加、结膜炎、睑缘炎、口腔疱疹、角膜炎、眼睛瘙痒、其他单纯疱疹病毒感染、干眼症、疼痛、疲劳、关节痛、骨折、腿痛、手臂痛、头晕、瘙痒性皮炎、耳痛和表现为支气管痉挛的过敏性反应、低血压、晕厥,荨麻疹和/或喉咙或舌头血管性水肿。
在一些实施方案中,本文所述的抗OSMRβ抗体用于治疗与慢性特发性瘙痒症(CIP)相关的瘙痒症。在一些实施方案中,本发明的方法用于治疗患有CIP的受试者的瘙痒症。本文介绍的研究显示,与未患有CIP的受试者相比,患有CIP的受试者的OSMRβmRNA水平升高。治疗CIP的方法包括:相对于对照而言,以治疗有效剂量和施用间隔向需要治疗的受试者施用抗OSMRβ抗体一段足以改善、稳定或减轻瘙痒症的一种或多种症状的治疗周期。在一些实施方案中,施用步骤包括皮下施用。在一些实施方案中,施用步骤包括静脉内施用。在一些实施方案中,施用步骤包括静脉内施用,然后是皮下施用。在一些实施方案中,皮下施用通过皮下注射进行。
在一些实施方案中,本文所述的抗OSMRβ抗体用于治疗与慢性自发性荨麻疹(CSU),也称为慢性特发性荨麻疹(CIU)有关的瘙痒症。在一些实施方案中,本发明的方法用于治疗患有CSU的受试者的瘙痒症。本文介绍的研究显示,与未患有CSU的受试者相比,患有CSU的受试者OSMRβmRNA和蛋白质表达水平升高。治疗CSU的方法包括:相对于对照而言,以治疗有效剂量和施用间隔向需要治疗的受试者施用抗OSMRβ抗体一段足以改善、稳定或减轻瘙痒症的一种或多种症状的治疗周期。治疗CSU的方法包括:相对于对照而言,以治疗有效剂量和施用间隔向需要治疗的受试者施用抗OSMRβ抗体一段足以改善、稳定或减轻荨麻疹的治疗周期。在一些实施方案中,CSU的一种或多种症状由UAS7(包括例如瘙痒或荨麻疹严重性得分)相对于基线相比的变化来评估。在一些实施方案中,施用步骤包括皮下施用。在一些实施方案中,施用步骤包括静脉内施用。在一些实施方案中,施用步骤包括静脉内施用,然后是皮下施用。在一些实施方案中,皮下施用通过皮下注射进行。
在一些实施方案中,本文所述的抗OSMRβ抗体用于治疗与慢性特发性荨麻疹(CIU)有关的瘙痒症。在一些实施方案中,本发明的方法用于治疗患有CIU的受试者的瘙痒症。本文介绍的研究显示,与未患有CIU的受试者相比,患有CIU的受试者OSMRβmRNA和蛋白质表达水平升高。治疗CIU的方法包括:相对于对照而言,以治疗有效剂量和施用间隔向需要治疗的受试者施用抗OSMRβ抗体一段足以改善、稳定或减轻瘙痒症的一种或多种症状的治疗周期。治疗CIU的方法包括:相对于对照而言,以治疗有效剂量和施用间隔向需要治疗的受试者施用抗OSMRβ抗体一段足以改善、稳定或减轻荨麻疹的治疗周期。在一些实施方案中,CIU的一种或多种症状由UAS7(包括例如瘙痒或荨麻疹严重性得分)相对于基线的变化来评估。在一些实施方案中,施用步骤包括皮下施用。在一些实施方案中,施用步骤包括静脉内施用。在一些实施方案中,施用步骤包括静脉内施用,然后是皮下施用。在一些实施方案中,皮下施用通过皮下注射进行。
在一些实施方案中,本文所述的抗OSMRβ抗体用于治疗与皮肤淀粉样变(CA)有关的瘙痒症。在一些实施方案中,本发明的方法用于治疗患有CA的受试者的瘙痒症。CA的方法包括:相对于对照而言,以治疗有效剂量和施用间隔向需要治疗的受试者施用抗OSMRβ抗体一段足以改善、稳定或减轻瘙痒症的一种或多种症状的治疗周期。在一些实施方案中,施用步骤包括皮下施用。在一些实施方案中,施用步骤包括静脉内施用。在一些实施方案中,施用步骤包括静脉内施用,然后是皮下施用。在一些实施方案中,皮下施用通过皮下注射进行。
在一些实施方案中,本文所述的抗OSMRβ抗体用于治疗与慢性单纯性苔藓(LSC)有关的瘙痒症。在一些实施方案中,本发明的方法用于治疗患有LSC的受试者的瘙痒症。本文提出的研究显示,与未患有LSC的受试者相比,患有LSC的受试者的OSMRβmRNA表达水平升高。治疗LSC的方法包括:相对于对照而言,以治疗有效剂量和施用间隔向需要治疗的受试者施用抗OSMRβ抗体一段足以改善、稳定或减轻瘙痒症的一种或多种症状的治疗周期。在一些实施方案中,施用步骤包括皮下施用。在一些实施方案中,施用步骤包括静脉内施用。在一些实施方案中,施用步骤包括静脉内施用,然后是皮下施用。在一些实施方案中,皮下施用通过皮下注射进行。
在一些实施方案中,本文所述的抗OSMRβ抗体用于治疗与斑块状银屑病(PP)相关的瘙痒症。在一些实施方案中,本发明的方法用于治疗患有PP的受试者的瘙痒症。PP的方法包括:相对于对照而言,以治疗有效剂量和施用间隔向需要治疗的受试者施用抗OSMRβ抗体一段足以改善、稳定或减轻瘙痒症的一种或多种症状的治疗周期。在一些实施方案中,施用步骤包括皮下施用。在一些实施方案中,施用步骤包括静脉内施用。在一些实施方案中,施用步骤包括静脉内施用,然后是皮下施用。在一些实施方案中,皮下施用通过皮下注射进行
在一些实施方案中,本文所述的抗OSMRβ抗体用于治疗与扁平苔藓(LP)有关的瘙痒症。在一些实施方案中,本发明的方法用于治疗患有LP的受试者的瘙痒症。本文提出的研究显示,与未患有LP的受试者相比,患有LP的受试者的OSMRβmRNA表达水平升高。治疗LP的方法包括:相对于对照而言,以治疗有效剂量和施用间隔向需要治疗的受试者施用抗OSMRβ抗体一段足以改善、稳定或减轻瘙痒症的一种或多种症状的治疗周期。在一些实施方案中,施用步骤包括皮下施用。在一些实施方案中,施用步骤包括静脉内施用。在一些实施方案中,施用步骤包括静脉内施用,然后是皮下施用。在一些实施方案中,皮下施用通过皮下注射进行。
在一些实施方案中,本文所述的抗OSMRβ抗体用于治疗与炎症性鱼鳞癣(II)有关的瘙痒症。在一些实施方案中,本发明的方法用于治疗患有II的受试者的瘙痒症。治疗II的方法包括:相对于对照而言,以治疗有效剂量和施用间隔向需要治疗的受试者施用抗OSMRβ抗体一段足以改善、稳定或减轻瘙痒症的一种或多种症状的治疗周期。在一些实施方案中,施用步骤包括皮下施用。在一些实施方案中,施用步骤包括静脉内施用。在一些实施方案中,施用步骤包括静脉内施用,然后是皮下施用。在一些实施方案中,皮下施用通过皮下注射进行。
在一些实施方案中,本文所述的抗OSMRβ抗体用于治疗与肥大细胞增生病(MA)有关的瘙痒症。在一些实施方案中,本发明的方法用于治疗患有MA的受试者的瘙痒症。治疗MA的方法包括以治疗有效剂量和相对于对照而言足以改善、稳定或减轻瘙痒症的一种或多种症状的治疗周期的施用间隔,向需要治疗的受试者施用抗OSMRβ抗体。在一些实施方案中,施用步骤包括皮下施用。在一些实施方案中,施用步骤包括静脉内施用。在一些实施方案中,施用步骤包括静脉内施用,然后是皮下施用。在一些实施方案中,皮下施用通过皮下注射进行。
在一些实施方案中,本文所述的抗OSMRβ抗体用于治疗与大疱性类天疱疮(BP)有关的瘙痒症。在一些实施方案中,本发明的方法用于治疗患有BP的受试者的瘙痒症。用于治疗BP的方法包括:相对于对照而言,以治疗有效剂量和施用间隔向需要治疗的受试者施用抗OSMRβ抗体一段足以改善、稳定或减轻瘙痒症的一种或多种症状的治疗周期。在一些实施方案中,施用步骤包括皮下施用。在一些实施方案中,施用步骤包括静脉内施用。在一些实施方案中,施用步骤包括静脉内施用,然后是皮下施用。在一些实施方案中,皮下施用通过皮下注射进行。
在一些实施方案中,本文所述的抗OSMRβ抗体用于治疗T
上述实施方案的有效剂量、施用间隔或治疗周期如本申请其他地方所公开。
在一些实施方案中,与健康受试者相比,患有CIP、CIU、CSU、CA、PP、LSC、LP、MA或BP的受试者的与OSMRβ信号传导途径相关的一种或多种细胞因子的水平升高。因此,在一些实施方案中,与健康受试者相比,受试者的IL-31、OSM、IL-31Rα和OSMRβ中的一种或多种的水平升高。在一些实施方案中,与健康受试者相比,受试者的一种或多种IL-31水平升高。在一些实施方案中,与健康受试者相比,受试者的一种或多种OSM的水平升高。在一些实施方案中,与健康受试者相比,受试者的一种或多种IL-31Rα的水平升高。在一些实施方案中,与健康受试者相比,受试者的一种或多种OSMRβ的水平升高。
在一些实施方案中,治疗患有CIP、CIU、CSU、CA、PP、LSC、LP、MA或BP的受试者导致受试者的MCP-1/CCL2水平的降低或稳定。因此,在一些实施方案中,与患病状态相比,治疗受试者导致MCP-1水平降低。在一些实施方案中,治疗受试者导致MCP-1水平的稳定。“稳定”是指MCP-1的水平保持大致相同,并且不增加或减少。在一些实施方案中,治疗受试者导致淋巴细胞和/或内皮细胞中MCP-1水平降低。
在一些实施方案中,患有CIP、CIU、CSU、CA、PP、LSC、LP、MA或BP的受试者的WI-NRS得分为约4、约5、约6、约7、约8或以上。因此,在一些实施方案中,需要治疗的受试者的WI-NRS得分为约4。在一些实施方案中,需要治疗的受试者的WI-NRS得分为约5。在一些实施方案中,需要治疗的受试者的WI-NRS得分为约6。在一些实施方案中,需要治疗的受试者的WI-NRS得分为约7。在一些实施方案中,需要治疗的受试者的WI-NRS得分为约8。在一些实施方案中,需要治疗的受试者的WI-NRS得分大于8。
在一些实施方案中,选择患有CIP、CIU、CSU、CA、PP、LSC、LP、MA或BP并且MCP-1/CCL2水平高于健康个体中发现的水平的受试者进行治疗。在一些实施方案中,与健康个体相比,选择用于治疗的受试者的MCP-1/CCL2水平不升高。在一些实施方案中,相对于对照而言,受试者中的IL-31表达水平升高。在一些实施方案中,相对于对照而言,受试者中的IL-31表达水平没有升高。在一些实施方案中,受瘙痒性疾病或病状影响的受试者的一部分皮肤中的IL-31表达水平与以下中的IL-31表达水平大致相同:(i)未受瘙痒疾病或病状影响的受试者的一部分皮肤,或(ii)未诊断为瘙痒性疾病或病症的健康受试者的一部分正常皮肤。在一些实施方案中,相对于对照而言,受试者中的IL-31Rα表达水平升高。在一些实施方案中,相对于对照而言,受试者中的OSM表达水平升高。在一些实施方案中,相对于对照而言,受试者中的OSMRβ表达水平升高。在一些实施方案中,相对于对照而言,受试者中的OSMRβ表达水平没有升高。在一些实施方案中,受瘙痒性疾病或病症影响的受试者的一部分皮肤中的OSMRβ表达水平与以下中的OSMRβ表达水平大致相同:(i)未受瘙痒性疾病或病症影响的受试者的一部分皮肤,或(ii)未诊断为瘙痒性疾病或病症的健康受试者的一部分正常皮肤。
抗抑瘤素M受体(OSMR)抗体
在一些实施方案中,本发明提供的发明性组合物和方法用于将抗OSMRβ抗体递送到需要的受试者。在本发明的某些实施方案中,抗OSMRβ抗体是完全人单克隆抗体,该完全人单克隆抗体通过结合OSMRβ(两种受体共有的亚基)分别特异性抑制IL-31受体和II型OSM受体的IL-31和抑瘤素M(OSM)诱导的激活。在某些实施方案中,抗体由两条轻链和两条重链组成。在一些实施方案中,轻链包含λ恒定区。重链的恒定区包含与人IgG1抗体的CH3结构域融合的人免疫球蛋白IgG4抗体的CH1结构域、铰链结构域和CH2结构域。在其他实施方案中,抗OSMRβ抗体的重链包含改善稳定性的S228P修饰和除去N-连接的糖基化位点的N297Q修饰。
抗OSMRβ重链氨基酸序列
QVQLVQSGAEVKKPGASVKVSCKASGYTFTSYEINWVRQATGQGLEWMGWMNPNSGYTGYAQKFQGRVTMTRDTSISTAYMEMSSLRSEDTAVYYCARDIVAANTDYYFYYGMDVWGQGTTVTVSSASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTKTYTCNVDHKPSNTKVDKRVESKYGPPCPPCPAPEFLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFQSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPG(SEQ ID NO:1)
抗OSMRβ轻链氨基酸序列
QSVLTQPPSASGTPGQRVTISCSGSNSNIGSNTVNWYHQLPGTAPKLLIYNINKRPSGVPDRFSGSKSGSSASLAISGLQSEDEADYYCSTWDDSLDGVVFGGGTKLTVLGQPKAAPSVTLFPPSSEELQANKATLVCLISDFYPGAVTVAWKADSSPVKAGVETTTPSKQSNNKYAASSYLSLTPEQWKSHRSYSCQVTHEGSTVEKTVAPTECS(SEQID NO:2)
抗OSMRβ重链可变结构域氨基酸序列
QVQLVQSGAEVKKPGASVKVSCKASGYTFTSYEINWVRQATGQGLEWMGWMNPNSGYTGYAQKFQGRVTMTRDTSISTAYMEMSSLRSEDTAVYYCARDIVAANTDYYFYYGMDVWGQGTTVTVSS(SEQ ID NO:3)
抗OSMRβ轻链可变结构域氨基酸序列
QSVLTQPPSASGTPGQRVTISCSGSNSNIGSNTVNWYHQLPGTAPKLLIYNINKRPSGVPDRFSGSKSGSSASLAISGLQSEDEADYYCSTWDDSLDGVVFGGGTKLTVLG(SEQ ID NO:4)
抗OSMRβ重链可变结构域CDR 1(HCDR1)氨基酸序列
SYEIN(SEQ ID NO:5)
抗OSMRβ重链可变结构域CDR 2(HCDR2)氨基酸序列
WMGWMNPNSGYTGYAQKFQGR(SEQ ID NO:6)
抗OSMRβ重链可变结构域CDR 3(HCDR3)氨基酸序列
DIVAANTDYYFYYGMDV(SEQ ID NO:7)
抗OSMRβ轻链可变结构域CDR1(LCDR1)氨基酸序列
SGSNSNIGSNTVN(SEQ ID NO:8)
抗OSMRβ轻链可变结构域CDR2(LCDR2)氨基酸序列
NINKRPS(SEQ ID NO:9)
抗OSMRβ轻链可变结构域CDR3(LCDR3)氨基酸序列
STWDDSLDGVV(SEQ ID NO:10)
抗OSMRβ重链信号肽氨基酸序列
MDFGLSLVFLVLILKGVQC(SEQ ID NO:11)
抗OSMRβ轻链信号肽氨基酸序列
MATGSRTSLLLAFGLLCLSWLQEGSA(SEQ ID NO:12)
抗OSMRβ重链氨基酸序列-IgG4 CH1、铰链和CH2结构域
ASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTKTYTCNVDHKPSNTKVDKRVESKYGPPCPPCPAPEFLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFQSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAK(SEQ ID NO:13)
抗OSMRβ重链氨基酸序列–IgG1 CH3结构域
GQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPG(SEQ ID NO:14)
抗OSMRβ重链氨基酸序列–恒定结构域
ASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTKTYTCNVDHKPSNTKVDKRVESKYGPPCPPCPAPEFLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFQSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPG(SEQ ID NO:15)
抗OSMRβ轻链氨基酸序列-IgGλ恒定结构域
QPKAAPSVTLFPPSSEELQANKATLVCLISDFYPGAVTVAWKADSSPVKAGVETTTPSKQSNNKYAASSYLSLTPEQWKSHRSYSCQVTHEGSTVEKTVAPTECS(SEQ ID NO:16)
在本发明的一些实施方案中,抗OSMRβ抗体包含由SEQ ID NO:8定义的轻链互补决定区1(LCDR1)、由SEQ ID NO:9定义的轻链互补决定区2(LCDR2)和由SEQ ID NO:10定义的轻链互补决定区3(LCDR3)以及由SEQ ID NO:5定义的重链互补决定区1(HCDR1)、由SEQ IDNO:6定义的重链互补决定区2(HCDR2)和由SEQ ID NO:7定义的重链互补决定区3(HCDR3)。
在本发明的一些实施方案中,抗OSMRβ抗体包含具有与SEQ ID NO:8、SEQ ID NO:9、SEQ ID NO:10、SEQ ID NO:5、SEQ ID NO:6和SEQ ID NO:7至少75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%的同一性或更高的同一性的CDR氨基酸序列。
在本发明的一些实施方案中,抗OSMRβ抗体包含具有与SEQ ID NO:4至少90%相同的氨基酸序列的轻链可变结构域和具有与SEQ ID NO:3至少90%相同的氨基酸序列的重链可变结构域。在本发明的一些实施方案中,抗OSMRβ抗体具有与SEQ ID NO:4至少50%、55%、60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%的同一性或更高的同一性的轻链可变结构域氨基酸序列和与SEQ ID NO:3至少50%、55%、60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%的同一性或更高同一性的重链可变结构域氨基酸序列。在本发明的一些实施方案中,抗OSMRβ抗体包含具有SEQ ID NO:4所示的氨基酸序列的轻链可变结构域和具有SEQ ID NO:3所示的氨基酸序列的重链可变结构域。
在本发明的一些实施方案中,抗OSMRβ抗体包含具有与SEQ ID NO:2至少90%相同的氨基酸序列的轻链和具有与SEQ ID NO:1至少90%相同的氨基酸序列的重链。在本发明的一些实施方案中,抗OSMRβ抗体具有与SEQ ID NO:2至少50%、55%、60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%的同一性或更高的同一性的轻链氨基酸序列以及与SEQ ID NO:1至少50%、55%、60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%的同一性或更高的同一性的重链氨基酸序列。在本发明的一些实施方案中,抗OSMRβ抗体包含具有SEQ ID NO:2所示的氨基酸序列的轻链和具有SEQ ID NO:1所示的氨基酸序列的重链。
在本发明的一些实施方案中,抗OSMRβ抗体的重链恒定区包含衍生自IgG4抗体的CH1结构域、铰链结构域和CH2结构域,这些结构域融合到衍生自IgG1抗体的CH3结构域。在一些实施方案中,衍生自IgG4抗体的CH1结构域、铰链结构域和CH2结构域包含SEQ ID NO:13。在一些实施方案中,衍生自IgG1抗体的CH3结构域包含SEQ ID NO:14。在一些实施方案中,根据本发明的抗OSMRβ抗体的重链恒定区包含具有与SEQ ID NO:13至少50%、55%、60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%的同一性或更高的同一性的氨基酸序列。在一些实施方案中,根据本发明的抗OSMRβ抗体的重链恒定区包含具有与SEQ ID NO:14至少50%、55%、60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%的同一性或更高的同一性的氨基酸序列。在一些实施方案中,根据本发明的抗OSMRβ抗体的重链恒定区包含具有与SEQ ID NO:15至少50%、55%、60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%的同一性或更高的同一性的氨基酸序列。在一些实施方案中,根据本发明的抗OSMRβ抗体包含衍生自IgG抗体的λ恒定结构域。在一些实施方案中,衍生自IgG的λ恒定结构域包含SEQ ID NO:16。在一些实施方案中,根据本发明的抗OSMRβ抗体包含具有与SEQ ID NO:16至少50%、55%、60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%的同一性或更高的同一性的氨基酸序列。
参考文献
Bilsborough J,Leung DY,Maurer M,Howell M,Boguniewicz M,Yao L,StoreyH,LeCiel C,Harder B,Gross JA.IL-31is associated with cutaneous lymphocyteantigen-positive skin homing T cells in patients with atopic dermatitis.JAllergy Clin Immunol.2006Feb;117(2):418-25.
Boguniewicz M,Leung DY.Atopic dermatitis:a disease of altered skinbarrier and immune dysregulation.Immunol Rev.2011;242:233-46.
Boniface K,Diveu C,Morel F,Pedretti N,Froger J,Ravon E,etal.Oncostatin M secreted by skin infiltrating T lymphocytes is a potentkeratinocyte activator involved in skin inflammation.J Immunol.2007;178(7):4615-22.
Botelho FM,Rangel-Moreno J,Fritz D,Randall TD,Xing Z,and RichardsCD.Pulmonary expression of oncostatin M(OSM)promotes inducible BALT formationindependently of IL-6,despite a role for IL-6in OSM-driven pulmonaryinflammation.J Immunol.2013;191(3):1453-64.
Brandt EB,Sivaprasad U.Th2 cytokines and atopic dermatitis.J ClinCell Immunol 2011;2:110.
Dillon SR,Sprecher C,Hammond A,Bilsborough J,Rosenfeld-Franklin M,Presnell SR,et al.Interleukin 31,a cytokine produced by activated T cells,induces dermatitis in mice.Nat Immunol.2004;5(7):752-60.
Edukulla R,Singh B,Jegga AG,Sontake V,Dillon SR,and MadalaSK.Th2Cytokines Augment IL-31/IL-31RA Interactions via STAT6-dependent IL-31RA Expression.J Biol Chem.2015;290(21):13510-20.
Ezzat MH,Hasan ZE,Shaheen KY.Serum measurement of interleukin-31(IL-31)in paediatric atopic dermatitis:elevated levels correlate with severityscoring.J Eur Acad Dermatol Venereol.2011 Mar;25(3):334-9.
Fritz DK,Kerr C,Botelho F,Stampfli M,and Richards CD.Oncostatin M(OSM)primes IL-13-and IL-4-induced eotaxin responses in fibroblasts:regulation of the type-II IL-4 receptor chains IL-4Ralpha and IL-13Ralpha1.Exp Cell Res.2009;315(20):3486-99.
Fritz DK,Kerr C,Fattouh R,Llop-Guevara A,Khan WI,Jordana M,et al.Amouse model of airway disease:oncostatin M-induced pulmonary eosinophilia,goblet cell hyperplasia,and airway hyperresponsiveness are STAT6 dependent,and interstitial pulmonary fibrosis is STAT6 independent.J Immunol.2011;186(2):1107-18.
Fritz DK,Kerr C,Tong L,Smyth D,and Richards CD.Oncostatin-M up-regulates VCAM-1 and synergizes with IL-4 in eotaxin expression:involvementof STAT6.J Immunol.2006;176(7):4352-60.
Gittler JK,Shemer A,
Heise R,Neis MM,Marquardt Y,Joussen S,Heinrich PC,Merk HF,et al.IL-31receptor alpha expression in epidermal keratinocytes is modulated by celldifferentiation and interferon gamma.J Invest Dermatol.2009;129(1):240-3.
Ip WK,Wong CK,Li ML,Li PW,Cheung PF,Lam CW.Interleukin-31inducescytokine and chemokine production from human bronchial epithelial cellsthrough activation of mitogen-activated protein kinase signaling pathways:implications for the allergic response.Immunology.2007 Dec;122(4):532-41.
Kanda N,Watanabe S.Increased serum humanβ-defensin-2 levels in atopicdermatitis:relationship to IL-22 and oncostatin M.Immunobiology.2012Apr;217(4):436-45.Epub 2011 Oct 23.
Kasraie S,Niebuhr M,Baumert K,Werfel T.Functional effects ofinterleukin 31 in human primary keratinocytes.Allergy.2011 Jul;66(7):845-52.
Ko MJ,Peng YS,Chen HY,Hsu SP,Pai MF,Yang JY,et al.Interleukin-31 isassociated with uremic pruritus in patients receiving hemodialysis.J Am AcadDermatol.2014 Dec;71(6):1151-1159.
Liu W,Luo R,Chen Y,Sun C,Wang J,Zhou L,et al.Interleukin-31promoteshelper T cell type-2 inflammation in children with allergic rhinitis.PediatrRes.2015 Jan;77(1-1):20-8.
Makhlough A.Topical capsaicin therapy for uremic pruritus in patientson hemodialysis.Iran J Kidney Dis.2010 Apr;4(2):137-40.
Mozaffarian A,Brewer AW,Trueblood ES,Luzina IG,Todd NW,Atamas SP,etal.Mechanisms of oncostatin M-induced pulmonary inflammation and fibrosis.JImmunol.2008 Nov 15;181(10):7243-53.
Nemoto O,Furue M,Nakagawa H,Shiramoto M,Hanada R,Matsuki S,et al.Thefirst trial of CIM331,a humanized antihuman interleukin-31 receptor Aantibody,in healthy volunteers and patients with atopic dermatitis toevaluate safety,tolerability and pharmacokinetics of a single dose in arandomized,double-blind,placebo-controlled study.Br J Dermatol.2016 Feb;174(2):296-304.Epub 2015 Dec 19.
Niebuhr M,Mamerow D,Heratizadeh A,Satzger I,and WerfelT.Staphylococcal alpha-toxin induces a higher T cell proliferation andinterleukin-31 in atopic dermatitis.Int Arch Allergy Immunol.2011;156(4):412-5.
Nobbe S,Dziunycz P,Muhleisen B,Bilsborough J,Dillon SR,French LE,etal.IL-31 expression by inflammatory cells is preferentially elevated inatopic dermatitis.Acta Derm Venereol.2012;92(1):24-8.
Pisoni RL,
Raap U,Wichmann K,Bruder M,
Rabeony H,Petit-Paris I,Garnier J,Barrault C,Pedretti N,Guilloteau K,et al.Inhibition of keratinocyte differentiation by the synergistic effect ofIL-17A,IL-22,IL-1alpha,TNFalpha and oncostatin M.PLoS One.2014;9(7):e101937.
Richards CD.The enigmatic cytokine oncostatin m and roles indisease.ISRN Inflamm.2013;2013:512103.
Ring J,Alomar A,Bieber T,Deleuran M,Fink-Wagner A,Gelmetti C,etal.Guidelines for treatment of atopic eczema(atopic dermatitis)part I.J EurAcad Dermatol Venereol.2012;26:1045-60.
Ruzicka T,Hanifin J,Furue M,Pulka G,Mlynarczyk I,Wollenberg A,GalusR,Etoh T,Mihara R,Yoshida H,Stewart J,Kabashima K.Anti-Interleukin-31ReceptorA Antibody for Atopic Dermatitis.N Engl J Med 2017;376(9):826-835.
Sidbury R,Davis DM,Cohen DE,Cordoro KM,Berger TG,Bergman JN,etal.Guidelines of care for the management of atopic dermatitis:section3.Management and treatment with phototherapy and systemic agents.J Am AcadDermatol.2014;71:327-49.
Silverberg JI,Hanifin JM.Adult eczema prevalence and associationswith asthma and other health and demographic factors:a US population-basedstudy.J Allergy Clin Immunol 2013;132:1132–38.
Sonkoly E,Muller A,Lauerma AI,Pivarcsi A,Soto H,Kemeny L,et al.IL-31:a new link between T cells and pruritus in atopic skin inflammation.J AllergyClin Immunol.2006Feb;117(2):411-7.
Stott B,Lavender P,Lehmann S,Pennino D,Durham S,and Schmidt-WeberCB.Human IL-31is induced by IL-4and promotes TH2-driven inflammation.JAllergy Clin Immunol.2013;132(2):446-54e5.
实施例
尽管已经根据某些实施方案具体描述了本发明的某些方法,但是以下实施例仅用于说明本发明的方法,而无意于限制本发明。
实施例1:抗OSMRβ抗体对食蟹猴的影响
本实施例中的研究旨在评估在雄性食蟹猴中静脉内(IV)施用后抗OSMRβ抗体的单剂量药代动力学和功效。进行了一项先前的研究,以确定在皮内施用后在雄性食蟹猴中产生最一致和最强的抓挠反应的人IL-31的剂量水平。所选剂量水平为3μg/kg人IL-31,这是超生理水平的IL-31细胞因子。
实验设计
动物的选择
从SNBL USA畜类选择雄性食蟹猴。选定的动物由兽医检查身体。此外,在研究开始前进行行为评估,以排除可能是过度理毛的动物或具有预先存在的皮肤病状或脱毛的动物。只有符合基本健康标准并且被认为是健康的动物才被兽医批准用于研究。
适应期
在开始给药前,使先前检疫的动物适应研究室环境至少14天。收集所有动物(包括备用动物)适应环境阶段的数据。在适应环境过程中,使用Noldus视频监控系统对每只动物进行至少30分钟的监控,并记录抓挠事件或理毛事件的次数。在预筛的30分钟内发生40次以上抓挠事件/理毛事件的动物用可用备用动物替换,并从研究中排除。
随机化
从满足上述指定标准的动物中,包括了体重的分层随机方案被使用,并在适应环境过程中执行,以将动物分配给研究组。
研究设计
比较了四个治疗组(0mg/kg、1mg/kg、3mg/kg和10mg/kg的抗OSMRβ抗体)。将六只动物分配到每个治疗组。总体积剂量(mL)根据最近的体重计算得出。
通过在大腿外侧/外侧使用直针和注射器,通过皮内(ID)推注或负荷注射向所有动物施用重组人(rh)IL-31挑战。给药前至少1天剃光注射部位。在第-1天、第2天(抗OSMRβ抗体给药后24小时)、第8天、第15天、第22天和第29天向动物进行rhIL-31挑战,并在第1天一次给予动物抗OSMRβ抗体。
观察和体检
从适应环境的第二天(第-13天)开始,每只动物每天进行两次临床观察。首次观察发生在早晨,即打扫房间前。第二次观察不早于早晨观察后四个小时(且不是在视频监视期间)。必要时进行其他临床观察。如果对动物的临床观察表明动物状况下降,则进行兽医评估。
对动物进行详细的临床观察/评估,同时在它们的程序笼中,在适应环境过程中进行一次详细的临床观察/评估,在每次rhIL-31挑战施用后5.5小时(±10分钟)进行一次详细的临床观察/评估。检查包括观察ID注射部位以及由抓挠或理毛行为引起的任何明显的刺激或痕迹。记录所有异常。
在rhIL-31挑战施用的每一天,在给药前使用Noldus Media Recorder监视动物至少1小时,并在给药后30分钟开始监视动物至少1小时。在此期间,记录抓挠和/或自我理毛(也可能包括拉扯毛/皮肤或用牙齿拉动皮肤)的观察结果。还记录了每个事件的位置和持续时间。
如果观察到动物显示出动物状况下降,则进行兽医评估。
在给药第一天前以及在给药阶段每周一次对每只动物称重。如有必要,采集额外的体重。
采血程序
从受限制的有意识动物的外周静脉采集血液。只要有可能,就通过一次抽血来采集血液,然后适当分配。如果可能,在麻醉和尸检前从有意识的计划外动物中采集静脉血样本。
在第-1天、第2天、第8天、第15天、第22天和第29天的每次IL-31挑战剂量后3小时采集PK血样。每个样本大约抽取1mL血液。离心后(在2-8℃下)获得血清的单一等分试样,转移到适当大小的冷冻管中,并在-60至-86℃下保存。在储存前,将标本保存在干冰上。
结果
如图1A和图1B所示,单次IV施用抗OSMRβ抗体在减少食蟹猴的IL-31诱导的抓挠行为方面产生了剂量依赖性作用,这种作用至少持续了29天。
药物施用后24小时,所测试的1mg/kg的最低剂量的抗OSMRβ抗体对抓挠计数产生86%的抑制作用。到第8天,这种止痒作用变成40%,表明该作用在给药后持续介于1天与7天之间的某个时间段。
药物施用后24小时,所测试的中等剂量的抗OSMRβ抗体(3mg/kg)对抓挠计数产生了95%的抑制。到第21天,这种止痒作用变成32%,表明该作用在给药后持续15-21天。
药物施用后24小时,所测试的最高剂量的抗OSMRβ抗体(10mg/kg的)对抓挠计数产生了96%μ的抑制。这种止痒作用到第29天一直保持在90%,表明这种作用至少持续至给药后29天。
图1B显示了沿着在右纵轴上显示的抗OSMRβ抗体的血清浓度标绘的在左纵轴上的原始抓挠行为。显示了以1mg/kg(左插图)、3mg/kg(中插图)和10mg/kg(右插图)单次IV施用抗OSMRβ抗体的数据。此PK/PD相关性的结果定义了5μg/ml至8.5μg/ml的浓度范围,在该浓度范围或更高浓度范围下,抗OSMRβ抗体可提供保护,使其免受超生理浓度的人IL-31诱发的瘙痒症。
实施例2:抗OSMRβ抗体治疗特应性皮炎
该实施例中的研究旨在评估抗OSMRβ抗体在特应性皮炎患者中的安全性、耐受性、PK和免疫原性。该研究还包括药物遗传学的探索性研究以及抗OSMRβ抗体对临床疗效评估、基因表达和PD量度的影响。
研究设计
将抗OSMRβ抗体静脉内(IV)施用到经历中度至重度瘙痒症的患有中度至重度特应性皮炎的受试者。此外,将抗OSMRβ抗体皮下(SC)施用到经历中度至重度瘙痒症的患有度至重度特应性皮炎的一组受试者。
如下所述,受试者进入七个组中的一组。确认资格后,使受试者随机接受抗OSMRβ抗体或安慰剂。在六个组中,IV施用抗OSMRβ抗体或安慰剂。在第七组中,受试者接受抗OSMRβ抗体或安慰剂作为单次SC注射。
第一组通过静脉内接受0.3mg/kg抗OSMRβ抗体或安慰剂。第二组通过静脉内接受1.5mg/kg抗OSMRβ抗体或安慰剂。第三组通过静脉内接受5mg/kg抗OSMRβ抗体或安慰剂。第四组通过静脉内接受10mg/kg抗OSMRβ抗体或安慰剂。第五组通过静脉内接受20mg/kg抗OSMRβ抗体或安慰剂。第六组通过静脉内接受7.5mg/kg抗OSMRβ抗体或安慰剂。第七组通过皮下接受1.5mg/kg抗OSMRβ抗体或安慰剂。给药后,受试者必须受限在临床研究单位内进行至少2天的安全性监测和密集的PK采样。在预先指定的时间点收集PK样本。
研究治疗
抗OSMRβ抗体药物产品是无菌液体制剂,以单次使用小瓶形式提供,用于IV或SC注射。将3mL的Schott小瓶灌装2.3mL,以使递送的体积为2mL,可抽取的剂量为200mg/小瓶。将抗OSMRβ抗体药物产品稀释至100mL的体积,以进行IV输注。
将IV施用的剂量在盐水中稀释到总体积为100mL,并在1小时内输注。密切观察受试者的任何输注反应。如果出现提示输注反应的体征和症状,则停止输注。在解决与输注反应有关的体征和症状后重新开始输注。在研究过程中,输注时间可延长至1小时以上。
受试者纳入标准
受试者在筛选访视1时必须具有≥7的瘙痒NRS得分,并且在第-1天入住时必须具有≥5的瘙痒NRS得分。受试者还必须有医生记录的至少1年的特应性皮炎诊断和中度至重度疾病的诊断,中度至重度疾病定义为筛选访视1前至少3个月,IGA是3或4,且体表面积(BSA)受累是10%或更高。
研究评估
通过静脉穿刺或套管插入术收集血样,并使用经过验证的分析程序测定抗OSMRβ抗体的血清浓度。尽可能根据抗OSMRβ抗体的血清浓度为每个受试者计算以下PK参数:
C
t
AUC
AUC
其中C
λ
t
t
CL 清除率
Vd 分布体积(仅IV剂量)
Vd/F 表观分布体积(仅SC剂量)
列出描述性统计数据(算术平均值、标准偏差、最小值、中位数、最大值、几何平均值和几何变异系数(视情况而定)),并汇总抗OSMRβ抗体的血清浓度和PK参数。
如果有可用数据,则在剂量组之间检查抗OSMRβ抗体的剂量比例。使用功率模型方法或适当地使用方差分析(ANOVA)模型,对AUC
在有数据的情况下,将通过SC注射施用的抗OSMRβ抗体的暴露量与接受相同剂量的IV施用的组进行比较。使用具有作为固定效应的组的ANOVA模型分析对数转换后的AUC
在研究过程中还进行了以下临床反应评估。
使用瘙痒数值评定量表,要求受试者使用从0到10的量表为他们的瘙痒症症状的强度分配一个数字得分,其中0表示无瘙痒症,而10表示可想象的最严重的瘙痒症。NRS工具用于在筛选访视1和第-1天评估受试者的瘙痒程度,以确定该研究的合格性。在向受试者提供电子日记后,会在筛选访视2中指导他们每日报告NRS得分,并在每次门诊访视时跟踪依从性。从筛选访问第2天到第60天后,受试者每天完成评定量表。
研究者总体评估(IGA)是针对每个受试者进行的总体评估。IGA使用从0(轻的)到5(非常严重的疾病)的6分量表。基于形态学分配IGA得分,而无需返回参考基线状态。IGA得分记录在电子病例报告表(e-CRF)中。合格的皮肤科医生对本研究进行IGA评估。
湿疹面积与严重性指数(EASI)得分用于衡量特应性皮炎的严重性和程度。分别评估4个身体部位(头颈部、躯干、上肢和下肢)的红斑、浸润/丘疹形成、表皮脱落和苔藓样硬化斑。根据疾病的严重性,将4个身体区域中每个区域的每个体征的平均临床严重性分配为0到3分,并将该得分记录在e-CRF中。确定每个身体区域所受累的皮肤区域,并根据受累程度将其分配为0到6,并将该得分记录在e-CRF中。在研究结束时计算每次访视的EASI总得分。合格的皮肤科医生对该研究进行EASI评估。
特应性皮炎评分(SCORAD)用于评估特应性皮炎的严重性。SCORAD是临床研究和实践中使用的工具,旨在标准化特应性皮炎的程度和严重性的评估。SCORAD结合了客观的医师对疾病程度和严重性的估计以及主观的受试者对瘙痒和睡眠不足的评估。确定受特应性皮炎影响的每个身体区域的百分比,并报告所有区域的总和。此外,AD的6种症状的严重性被评定为无(0)、轻度(1)、中度(2)或重度(3)。包括瘙痒和失眠的量度。SCORAD基于预定义公式计算。
在筛查访视1、筛查访视2以及入住(第-1天)、第7天、第14天、第28天和第60天时,获取了特应性皮炎受累最严重的区域的标准医学照片。该照片包括受特应性皮炎和病变两侧关节影响的区域。删除受试者可识别信息。
确定身体各部位(头部、躯干、手臂和腿)受特应性皮炎影响的体表面积(BSA)。所有受影响的主要身体区域的百分比相加。
皮肤病生活质量指数(DLQI)是一个包含10个问题的问卷,其中考虑了症状和感觉、日常活动、休闲、学校、人际关系和治疗。每个问题的回答量表为0到3(完全不为0,一点不为1,很多为2,非常多为3),并考虑了上周的情况。将得分相加,最小为0(指的是对生活质量没有影响),和30(指的是极大影响)。
医院焦虑抑郁量表(HADS)是用于检测焦虑和抑郁状态的通用李克特量表。问卷中的14个项目包括与焦虑相关的7个和与抑郁相关的7个。问卷中的每个项目的评分量表为0到3,每个参数的可能总得分在0到21之间。
体动记录仪使用记录延长时间的运动的便携式装置(体动记录仪手表)。受试者晚上在非主要腕上佩戴腕部体动记录仪手表,以监控睡眠质量和数量。
受试者的特应性皮炎的体征和症状相对于基线的任何临床显著恶化均被视为不良事件(AE)(例如,特应性皮炎恶化/发作),并触发与研究现场皮肤科医生的磋商,确定IGA(包括在e-CRF中),准备详细的临床总结并在24小时内报告。对受试者伴随的用药的任何更改或添加均会以适当的开始日期和停止日期输入到e-CRF中。在研究过程中,所有不良事件和严重不良事件均会得到跟踪,直至解决。
实施例3:使用抗OSMRβ抗体治疗尿毒症瘙痒
本实施例中的研究旨在评估抗OSMRβ抗体在患有尿毒症瘙痒的血液透析的受试者中的安全性、耐受性、PK和免疫原性。该研究还包括药物遗传学的探索性研究以及抗OSMRβ抗体对临床效果评估、基因表达和PD量度的影响。
研究设计
向患有尿毒症瘙痒的血液透析受试者静脉内(IV)施用抗OSMRβ抗体。
受试者进入一个治疗组。确认资格后,使受试者在第0天(常规计划血液透析疗程的前一天)随机接受5mg/kg或10mg/kg的抗OSMRβ抗体或安慰剂。
给药后,受试者必须受限在临床研究单位内进行至少2天的安全性监测和密集的PK采样。在预先指定的时间点收集PK样本。在某些血液透析疗程时进行强化PK采样。在指定的时间点收集透析前后的血液样本以及透析前后的样本和透析液样本,以进行抗OSMRβ浓度分析。在研究中以定期的间隔针对额外的安全监控、AE报告、电子日记合规性验证和PK采样对受试者进行评估。每次研究访视时,均会对伴随的用药(续用或新用)进行审核并记录在e-CRF中。
研究治疗
将IV施用的剂量在盐水中稀释到总体积为100mL,并在1小时内输注。密切观察受试者的任何输注反应。如果出现提示输注反应的体征和症状,则停止输注。在解决与输注反应有关的体征和症状后重新开始输注。在研究过程中,输注时间可延长至1小时以上。
受试者纳入标准
受试者在筛选访视1时必须具有≥7的瘙痒NRS得分,并且在第-1天入住时必须具有≥5的瘙痒NRS得分。患有终末期肾病(ESRD)受试者还必须在筛选访视1时接受每周三次的血液透析方案,在筛选访视1前至少要稳定3个月。
研究评估
通过静脉穿刺或套管插入术收集血样,并使用经过验证的分析程序测定抗OSMRβ抗体的血清浓度。尽可能根据抗OSMRβ抗体的血清浓度为每个受试者计算以下PK参数:
C
t
AUC
AUC
其中C
λ
t
t
CL 清除率
Vd 分布体积(仅IV剂量)
Vd/F 表观分布体积(仅SC剂量)
在指定进行强化PK采样的血液透析日,为受限在临床研究单位内的每个受试者收集以下样本:紧邻血液透析前后的血液;透析液样本;以及来自透析器上游和下游的样本,血液透析前后的尿液样本(对于能够产生尿液的受试者)以及介于第0天与第2天之间的某个时间的24小时尿液样本(对于能够产生尿液的受试者)。还记录血液透析前后的体重、站立血压和仰卧血压。此外,血液透析流速、透析液体积和其他血液透析参数也被收集并记录在e-CRF中。血液透析期间给予的药物也记录在e-CRF中。在可能的情况下,还会根据抗OSMRβ抗体的血清和透析液浓度为每个受试者计算以下其他参数:透析液清除率和透析液提取率,所述透析液清除率和透析液提取率以血液透析期间提取的施用剂量的百分比计算。记录血液透析流速和透析液体积。
列出描述性统计数据(算术平均值、标准偏差、最小值、中位数、最大值、几何平均值和几何变异系数,视情况而定),并汇总抗OSMRβ抗体的血清浓度和PK参数。
当对患有尿毒症瘙痒的血液透析患者施用抗OSMRβ抗体PK时的探索性分析被包括在内。列出并总结了抗OSMRβ抗体的血清和透析液浓度以及相关的PK参数的描述性统计数据。
在研究过程中还进行了以下临床反应评估。
使用瘙痒数值评定量表(NRS),要求受试者使用从0到10的量表为他们的瘙痒症症状的强度分配数字得分,其中0表示无瘙痒症,10表示可想象的最严重的瘙痒症。NRS工具用于在筛选访视1和第-1天评估受试者的瘙痒程度,以确定该研究的合格性。在为受试者提供电子日记时,会在筛选访视2中指导受试者每日报告NRS得分,并在每次门诊访视时跟踪依从性。从筛选访问第2天到第60天后,受试者每天完成评定量表。
皮肤病生活质量指数(DLQI)是一个包含10个问题的问卷,其中考虑了症状和感觉、日常活动、休闲、学校、人际关系和治疗。每个问题的回答量表为0到3(完全不为0,一点不为1,很多为2,非常多为3),并考虑了上周的情况。将得分相加,最小为0(指的是对生活质量没有影响),和30(指的是极大影响)。
医院焦虑抑郁量表(HADS)是用于检测焦虑和抑郁状态的通用李克特量表。问卷中的14个项目包括与焦虑相关的7个和与抑郁相关的7个。问卷中的每个项目的评分量表为0到3,每个参数的可能总得分在0到21之间。
体动记录仪使用记录延长时间的运动的便携式装置(体动记录仪手表)。受试者晚上在非主要腕上佩戴腕部体动记录仪手表,以监控睡眠质量和数量。
实施例4:抗抑瘤素M受体β单克隆抗体在人首次研究中的安全性和有效性
本实施例中的研究旨在通过抗OSMRβ抗体的随机、双盲、安慰剂(PBO)受控制的单次上升剂量研究来评估抗OSMRβ抗体在健康受试者和患有特应性皮炎(AD)的成年受试者中的安全性、耐受性、PK和免疫原性。AD被用作IL-31驱动的瘙痒性疾病的代用药物,以评估目标参与度和早期疗效信号。
健康受试者和患有特应性皮炎的受试者的研究设计
将抗OSMRβ抗体静脉内(IV)施用到四组成年健康志愿者(HV)受试者。此外,将抗OSMRβ抗体皮下施用(SC)到两组HV受试者。向三组患有中度至重度特应性皮炎经历中度至重度瘙痒症的AD受试者静脉内施用抗OSMRβ抗体。此外,向一组患有中度至重度特应性皮炎经历中度至重度瘙痒症的AD受试者皮下施用抗OSMRβ抗体。在图2中概述研究设计。
健康志愿者的剂量组
如下所述,HV受试者进入六个组中的一组。确认资格后,使HV受试者随机接受抗OSMRβ抗体或安慰剂。在四组中,IV施用抗OSMRβ抗体或安慰剂。在第五组和第六组中,HV受试者接受抗OSMRβ抗体或安慰剂作为单次SC注射。
第一组通过静脉内接受1.5mg/kg抗OSMRβ抗体或安慰剂;六名HV受试者接受抗OSMRβ抗体,两名HV受试者接受安慰剂。第二组通过静脉内接受5mg/kg抗OSMRβ抗体或安慰剂;六名HV受试者接受抗OSMRβ抗体,两名HV受试者接受了安慰剂。第三组通过静脉内接受10mg/kg抗OSMRβ抗体或安慰剂;六名HV受试者接受抗OSMRβ抗体,两名HV受试者接受了安慰剂。第四组通过静脉内接受20mg/kg抗OSMRβ抗体或安慰剂;六名HV受试者接受抗OSMRβ抗体,两名HV受试者接受安慰剂。第五组通过皮下注射接受1.5mg/kg抗OSMRβ抗体或安慰剂;六名HV受试者接受抗OSMRβ抗体,两名HV受试者接受安慰剂。第六组通过皮下注射接受360mg/kg抗OSMRβ抗体或安慰剂;六名HV受试者接受抗OSMRβ抗体,两名HV受试者接受安慰剂。研究设计在图2左插图中以图形方式表示。
患有特应性皮炎的受试者的剂量组
如下所述AD受试者进入四个组中一组。确认资格后,使AD受试者随机接受抗OSMRβ抗体或安慰剂。在三个组中,IV施用抗OSMRβ抗体或安慰剂。在第四组中,AD受试者接受抗OSMRβ抗体或安慰剂作为单次SC注射。
第一组通过静脉内接受0.3mg/kg抗OSMRβ抗体或安慰剂;三名AD受试者接受抗OSMRβ抗体,两名AD受试者接受安慰剂。第二组通过静脉内接受1.5mg/kg抗OSMRβ抗体或安慰剂;三名AD受试者接受抗OSMRβ抗体,两名AD受试者接受安慰剂。第三组通过静脉内接受7.5mg/kg抗OSMRβ抗体或安慰剂;十名AD受试者接受了抗OSMRβ抗体,六名AD受试者接受了安慰剂。第四组通过皮下给药接受1.5mg/kg抗OSMRβ抗体或安慰剂;四名AD受试者接受了抗OSMRβ抗体,两名AD受试者接受了安慰剂。研究设计在图2右下方插图中以图形方式表示。
受试者纳入标准
包括患有中度至重度AD经历中度至重度瘙痒症的成人受试者;(研究者总体评估[IGA]得分是3或4,身体表面积[BSA]>为10%);经历中度至重度瘙痒症;(筛选时最严重瘙痒数值评定量表[WI-NRS]≥7)。以如下剂量递增队列施用静脉内(IV)或皮下(SC)抗OSMRβ抗体:HV IV:1.5、5、10和20mg/kg;HV SC:1.5mg/kg和360mg;AD IV:0.3、1.5和7.5mg/kg;ADSC:1.5mg/kg(图2)。
在剂量递增前评估安全性和耐受性。从第-7天到第28天,禁止使用的药物包括局部皮质类固醇(TCS);提供了用于AD发作的救援药物。第28天后,所有受试者均根据需要接受了TCS的使用。
安全性数据和耐受性数据包括生命体征、体格检查、ECG、实验室量度和不良事件(AE)。抗OSMRβ抗体靶标参与度和临床药效动力学(PD)数据包括每日电子日记WI-NRS和定期的睡眠不足的视觉模拟量表(VAS),直到第60天为止。计算每日WI-NRS的每周平均值。
结果
总共有50名健康志愿者(IV-24活性物:8PBO;SC-12活性物:4PBO)和32名患有中度至重度过特应性皮炎(AD)经历中度至重度瘙痒症的受试者(IV-16活性物:10PBO;SC-4活性物:2PBO)在1a/1b期临床试验中接受了单剂量抗OSMRβ抗体或安慰剂,健康志愿者的最高剂量是20mg/kg,在患有特应性皮炎的受试者中最高剂量为7.5mg/kg。在治疗前,所有患有特应性皮炎的受试者的先前疗法都有七天的冲洗期,在第28天前禁止使用局部皮质类固醇(TCS)。提供特应性皮炎发作的救援药物,并在第28天后根据需要所有受试者均接受了TCS的使用。所有受试者均耐受抗OSMRβ抗体,未观察到剂量限制性毒性,也没有严重的不良事件。
使基线人口统计学在各个剂量组之间平衡,但前提是,过去一年中抗OSMRβ抗体接受者的AD发作平均值高于安慰剂接受者:28.1(SD=41.6)活性物对比3.7(SD=3.5)PBO。没有发生死亡、SAE或因AE招致停药的情况。药物相关的治疗突发AE很少见,并且没有剂量反应相关性,都得到全部解决,没有后遗症:在HV中,出现1例轻度头痛(5mg/kg,IV),1例轻度潮红(1.5mg/kg,SC)和1例轻度贫血(360mg,SC);在AD受试者中:出现1例轻度头痛/轻度食欲下降(1.5mg/kg,IV),1例轻度头晕(7.5mg/kg,IV),1例轻度头晕(1.5mg/kg,SC)和1例轻度嗜睡(PBO,IV)。在接受抗OSMRβ抗体治疗的任何患者中均未观察到以下情况:死亡,严重不良事件;因不良事件而终止;输注反应;注射部位反应;血小板减少症;外周性水肿;结膜炎。
为了评估单剂量后AD受试者的靶标参与度和抗OSMRβ抗体的临床PD效果,在7.5mg/kg IV(n=10)的抗OSMRβ抗体接受者与合并的PBO IV接收者(n=10)之间比较了第28天每周平均瘙痒WI-NRS。基线平均每周平均瘙痒NRS达到平衡:8.0(抗OSMRβ抗体)与8.2(PBO);在第0天到第60天之间,有3位抗OSMRβ抗体接受者和3位PBO接受者发生了AD发作。一名0.3mg/kg IV抗OSMRβ抗体的接受者在第7天出现发作;7.5mg/kg IV的抗OSMRβ抗体的两名接受者分别在第14天和第20天出现发作;三名PBO接受者分别在第1天、第5天和第45天出现发作。在发作时,为这些患者提供了局部皮质类固醇(TCS)作为救援疗法。在图3A-8B中,末次观察推进法(LOCF)或无响应者(NR)方法应用于第1-4周的数据值。但是,在第4周后到第9周的较长时间内,当所有患者均可以使用TCS时,对数据采用“观察到的”(AO)统计方法。附图中的虚线表示两个阶段。在图3A显示每周平均瘙痒数值评定量表(VAS)相对于基线的平均变化。图3B显示VAS瘙痒症得分相对于基线的平均百分比变化。最严重瘙痒数值评定量表(WI-NRS)显示在图3C中。图3D显示每周平均WI-NRS相对于基线的平均变化。每周平均瘙痒症VAS(SCORAD的组成部分)的平均百分比变化在抗OSMRβ抗体接受者中比PBO更大:在第28天,-55.4%活性物对比-10.4%PBO(图3B)。每周平均WI-NRS的平均百分比变化在抗OSMRβ抗体接受者中比PBO更大:在第28天,-40.7%活性物对比-17.6%PBO(图3D)。图4和图5A-5D显示了平均每周WI-NRS相对于基线降低了≥4分的受试者百分比。相对于基线,NRS降低≥4分通常被认为是临床上有意义的改变。与PBO相比,较高百分比的抗OSMRβ抗体接受者显示,每周平均WI-NRS降低≥4分,在整个研究期间一致,如图4所示。在第4周,活性物组中有50%的人显示每周WI-NRS平均降低了≥4分,而PBO组中为10%。图5A-5D显示以相对于基线的NRS降低的特定幅度做出反应的受试者百分比(≥4分)。图5A和图5C显示了抗OSMRβ抗体接受者的各自百分比,图5B和图5D显示了安慰剂接受者的各自百分比。在图4、图5A和图5B中,使用包含非缺失值的受试者的分母计算出反应者比率。在图5C和图5D中,使用包括所有受试者的分母来计算反应者比率。在此评估中,被救援受试者被视为无反应者。抗OSMRβ抗体接受者显示每周平均WI-NRS相比PBO更高的降低幅度,在整个研究过程中一致。在第28天时WI-NRS的最大下降量在抗OSMRβ抗体接受者中比PBO更大:≥8分活性物对比4分PBO。此外,在第3周,在30%的抗OSMRβ抗体接受者中观察到≥7分的降低,而在安慰剂组中为0%。相比,在最初28天后(即使用伴随的TCS)在研究期间观察到的WI-NRS总体最大下降幅度在抗OSMRβ抗体接受者中比PBO更大:≥9分活性物对比5-5.9分PBO。在第5周,在13%的抗OSMRβ抗体接受者(图5A)中观察到≥9分的下降,而安慰剂组中为0%(图5B)。抗OSMRβ抗体接受者在辅助治疗期间联合使用伴随的TCS直至第56天对每周平均WI-NRS表现出持续的影响(图3C-D、图4和图5A-D)。与对瘙痒症的影响一致,抗OSMRβ抗体接受者相比PBO报告了改善的睡眠(图6A-B),如睡眠不足VAS(SCORAD的组成部分)更大幅下降所证明:在第28天,-59.5%活性物对比-2.3%PBO(图6B)。图7A-B显示了抗体接受者和安慰剂接受者的湿疹面积与严重性指数(EASI)相对于基线的变化。图7B显示湿疹面积与严重性指数(EASI)相对于基线的平均百分比变化。EASI降低在抗OSMRβ抗体接受者中相比PBO更大:在第4周,-42.59%对比-25.07%,如图7B所示。抗OSMRβ抗体受试者显示疾病严重性降低,如由受试者实现降低50%或更多的EASI得分(EASI-50)降低所确定的,如图8A所示。在第28天,相对于安慰剂组的20%,44%的抗OSMRβ抗体接受者实现EASI-50,。此外,如图8B所示,与第28天的安慰剂组的10%的受试者相比,27%的抗OSMRβ抗体接受者实现EASI-75,表明EASI降低了75%。图9A和图9B分别描绘直到第60天为止所显示的相对于基线的平均SCORAD值和平均百分比SCORAD变化。这些数据显示OSMRβ抑制对AD患者的安全性和耐受性曲线、药效动力学作用及其对生活质量的影响。7.5mg/kg的单剂量OSMRβ抗体在给药后第44天至第47天在80%的接受者中导致血清水平高于5g/mL(5.8-28.2g/mL)。此外,使用观察到的数据集,在介于第29天与第60天之间,在10例抗OSMRβ抗体(7.5mg/kg,IV)接受者和10例PBO IV接受者之间比较WI-NRS、瘙痒VAS和睡眠不足VAS。抗OSMRβ抗体的接受者经历了更大的WI-NRS改善,并持续到辅助治疗期,在此期间他们接受了伴随的TCS并在6周时达到最高水平:-51%对比-26.3%。与PBO相比,较高百分比的抗OSMRβ抗体接受者显示WI-NRS降低≥4分,在他们接受伴随的TCS的辅助治疗期间在5周时达到最大差异:63%对比0%。抗OSMRβ抗体接受者与PBO接受者之间在瘙痒或睡眠不足VAS改善方面的差异也延伸到辅助治疗期。
皮下施用与静脉内施用
建模PK参数以评估皮下施用的可行性。图10A中的模拟图来自非人灵长类、HV患者和AD患者的抗OSMRβ抗体的血浆浓度。图10A显示了对健康志愿者(HV)或特应性皮炎(AD)患者皮下(SC)施用或静脉内(IV)后数周内指定时间内血浆的抗体浓度的模拟中值图。在提供针对非人灵长类动物的超生理人IL-31挑战诱导的瘙痒症的保护方面,上方的虚线指示抗OSMRβ抗体的EC
在成年健康志愿者(HV)和患有AD的受试者中进行IV施用和SC施用后,进行了单独的建模模拟,以表征抗OSMRβ抗体的PK,并研究了各种SC给药方案,以优化目标人群中的实际慢性给药。分析了来自57HV受试者和患有AD的受试者的1b期临床研究的单剂量数据。大多数HV受试者和AD受试者均接受了基于体重的IV施用(分别为n=24,n=16;范围:0.3-20mg/kg),随后接受了基于体重的SC(n=6,n=4;1.5mg/kg)和固定剂量SC(HV,n=7,360mg)施用。使用靶标介导的药物处置(TMDD)模型描述了单剂量IV施用或SC施用后HV受试者和AD受试者中抗OSMRβ抗体的PK,以说明其非线性清除率。联合速度常数和解离速度常数分别通过实验确定为0.734nM hr
实施例5.结节性痒疹的发病机理和IL-31的作用
在该实施例中的研究表征了结节性痒疹的发病机理,并评估了IL-31在疾病机理中的作用。结节性痒疹(PN)是一种病因不明的慢性皮肤疾病,其特征是对称分布的高度瘙痒性过角化结节。通过引发导致结节形成的瘙痒-抓痒周期,以慢性瘙痒为特征的合并症与PN发病机理有关。尚不知道OSMRβ(瘙痒症、炎症和纤维化中涉及到的IL-31和抑瘤素M(OSM)信号传导的共享受体亚基)在PN发病机理中的作用。本文阐明了IL-31在PN疾病机理中的作用。
研究设计与方法
在美国和欧洲进行了一项前瞻性的纵向/观察性研究,以研究PN的病理生理。长达12个月时在基线处收集病史、瘙痒症(电子日记)、睡眠、生活质量、疾病严重性、血液和皮肤活检。皮肤生物标志物基因表达(RT-PCR;RNA)和免疫组织化学(IHC;蛋白质)的结果与最严重瘙痒数值评定量表(WI-NRS)相关。基因表达结果以特应性皮炎(AD)和正常皮肤为基准。
结果
入选54例患者。大多数(n=35,65%)患有PN,没有识别出潜在的合并症:4例未患有其他疾病;31例患有其他疾病,但没有一个被认为是因与症状相关。19例(35%)人患有被认为因与症状相关的其他疾病。
不管是否存在潜在的合并症,瘙痒强度(电子日记的最严重瘙痒NRS)、睡眠障碍和疾病严重性(病变的数量以及表皮脱落和/结壳的百分比)均相似。此外,无论是否识别出潜在病状,在89%的病变性活检(免疫组织化学)中均存在表达IL-31的单核细胞。在病变性活检对比非病变性活检中,单核细胞中的IL-31、IL-31Rα、OSM和OSMRβ表达上调(p≤0.001)。IL-31mRNA在44%的病变性PN、16%的非病变性PN、12.5%的健康志愿者和100%的AD活检中表达(病变性[LS]和非病变性[NL])。WI-NRS≥7的PN患者的LS活检中有64%表达IL-31mRNA。在大部分LS PN活检(89%)对比44%的NL PN活检中,IL-31蛋白(IHC)在单核细胞中表达。多形核细胞(PMN)(当存在时)和内皮细胞是LS PN皮肤中IL-31的其他常见来源。OSM、IL-31Rα和OSMRβmRNA的表达在LS或NL PN、AD或健康的志愿者活检中普遍存在(74-100%)。但是,与NL PN活检相比,更高比例的LS PN活检包含表达IL-31Rα1.7倍、OSM(3.6倍)和OSMRβ(1.8倍)蛋白的单核细胞。表皮细胞以及PMN、皮肤神经和附件结构(当存在时)是LS PN皮肤中的IL-31Rα和OSMRβ的其他常见来源。有关此研究的更多详细信息,参见实施例7。
数据表明,PN是一种独特的、高度瘙痒的慢性皮肤病,其未被合并症定义。鉴于其在PN结节中普遍表达,IL-31与PN的发病机理有关。因此,IL-31在PN的发病机理中的作用由此得到阐明。
实施例6.抗OSMRβ抗体对角化细胞的Th2信号传导途径的影响
该实施例中的研究进一步显示,本发明的抗OSMRβ抗体可以有效治疗炎症。这些研究的目的是通过使用在炎症反应中起作用的趋化因子单核细胞趋化蛋白1(MCP-1/CCL-2),与LIF和IL-31相比,来表征人表皮角化细胞(HEK)和人皮肤成纤维细胞(HDF)对OSM的体外反应。该实施例中提出的研究的另一个目的是评估本发明的抗OSMRβ抗体在HEK细胞和HDF细胞中实现MCP-1/CCL2应答的能力。
图11显示IL-31信号传导和OSM信号传导的受体结构。OSM与人中的两种受体(一种I型受体和一种II型受体)相互作用。I型受体复合物包含LIFRα和gp130的受体异质二聚体。II型受体复合物包含OSMRβ和gp130的受体异质二聚体。特别地,该实施例中提供的数据显示,施用抗OSMRβ抗体可靶向并减弱人表皮角化细胞(HEK)和人皮肤成纤维细胞(HDF)中的OSM介导的T
抑瘤素M(OSM)(gp130细胞因子家族的成员)参与T
在HEK和HDF细胞中均观察到IL-4或IL-13与OSM(p<0.01)联合使用时MCP-1产量呈剂量依赖性增加(图13)。这些结果显示,OSM与IL-4或IL-13在HEK和HDF的MCP1/CCL-2的诱导中协同作用。值得注意的是,对于IL-4或IL-13与LIF或IL-31的联合,未观察到MCP-1产量的剂量依赖性增加。此外,在任何评估浓度下,单独的IL-4或IL-13均不会诱导MCP-1/CCL-2的水平。
在HEK细胞和HDF细胞中,OSM显著诱导II型IL-4受体(IL-4Rα/IL13Rα)和II型OSM受体OSMRβ/gp130(HEK,p<0.05;HDF,p<0.01)的受体链的mRNA,但不诱导LIF受体或IL-31Rα的链的mRNA。图14中的数据是从HEK细胞获得的,并显示用OSM治疗后第6个小时和第24个小时IL13Rα和IL-4RαmRNA的增加。这些数据表明,OSM刺激HDF细胞中II型IL-4受体和II型OSM受体复合物的受体链的mRNA。
还进行了研究以测试将本发明的抗OSMRβ抗体添加到已经用OSM在HEK细胞中诱导的细胞培养物中的效果。对于这些研究,将HEK在96孔板中以15,000个细胞/孔进行培养,并在抗OSMRβ、抗IL31Rα或对照同种型抗体的浓度不断增加的情况下,用OSM(50ng/mL)对其刺激24小时(n=4/治疗)。除去培养上清液,并将其保存在-80℃下,然后通过ELISA分析MCP-1。这些研究的结果指示,抗OSMRβ抗体抑制了HEK细胞中OSM诱导的MCP-1/CCL-2(图15插图A)。具体而言,在浓度为0.001μg/mL或更高浓度的抗OSMRβ下,MCP-1/CCL-2水平显著降低。
进行了进一步的研究,以评估抗OSMRβ是否降低了与对OSM和IL-4的协同应答相关的MCP-1/CCL-2水平。对于这些研究,将HEK在96孔板中以15,000个细胞/孔进行培养,并在(A)抗OSMRβ或(B)抗IL31Rα的浓度不断增加(如所示)的情况下,用浓度为5或20ng/mL的OSM(50ng/mL)和IL-4对HEK刺激24小时(n =4/治疗)。除去培养上清液,并将其保存在-80℃下,然后通过ELISA分析MCP-1。数据显示,在两种测试浓度下,抗OSMRβ均降低了与对OSM和IL-4的协同应答相关的MCP-1/CCL-2水平(图16插图A)。
抗IL-31Rα或同种型对照抗体对OSM和OSM+IL-4诱导的应答没有显著影响(图15插图B和插图C,和图16插图B)。总体而言,此实施例中提供的数据显示OSM调节HEK和HDF细胞中促炎性趋化因子MCP-1/CCL-2的表达。这些数据还显示OSM与T
可以扩展类似的研究以评估本发明的抗OSMRβ抗体对炎症途径的IL-6、IL-8和其他介质的作用。
实施例7:结节性痒疹生物标志物分析和临床终点
本实施例显示了与健康皮肤活检样本相比,结节性痒疹(PN)患者皮肤活检中IL-31、IL-31Rα、OSM和OSMRβRNA和蛋白质表达水平的调查结果。从本文所述研究获得的数据显示,PN皮肤样本和特应性皮炎(AD)皮肤样本中均存在OSMRβ轴分子IL-31、OSM、IL-31Rα和OSMRβ。在PN患者中,在病变性(LS)活检中比在非病变性(NL)活检中更频繁地检测到IL-31。此外,PN患者的瘙痒严重性会增加IL-31表达的强度或上调。
与健康对照受试者相比,进行了NL和LS皮肤活检的基因表达测量,以评估IL-31mRNA的表达水平。这些研究的数据表明,与健康对照相比,PN活检和AD活检中发现的mRNA水平显著增加。在44%的LS PN、16%的NL PN、12.5%的健康志愿者和100%的AD(LS和NL)活检中检测到IL-31mRNA表达(图17)。
使用PN皮肤活检和AD皮肤活检进行了另外的研究,以确定与健康皮肤相比IL-31表达和OSM表达的水平(图18插图A和插图B)。数据显示,与NL或健康活检相比,来自LS PN活检的细胞表达更高水平的IL-31和OSM。
从具有不同等级的WI-NRS瘙痒得分的患者获得的皮肤活检显示,IL-31水平和OSM水平与瘙痒得分相关。对于这些研究,根据基线WI-NRS得分对患者进行分组。图19插图A显示OSM表达水平在患有WI-NRS≥7的患者的NL活检和LS活检中增加。在患有WI-NRS≥7的患者中IL-31表达也增加(图19插图B)。
对切片活检样本进行了另外的免疫组织化学研究。对于这些研究,将从患有结节性痒疹(PN)的受试者获得的皮肤样本切片,并用对OSMRβ、OSM、IL-31或IL-31Rα特异性的抗体进行免疫组织化学分析。使用ImagJ软件在表皮连接处测量阳性细胞计数。这些研究的结果显示,与健康对照受试者相比,患有PN的受试者的真皮中OSMRβ、OSM、IL-31和IL-31Rα阳性的细胞数量增加(图20插图A-D)。对从PN受试者获得的活检进行了进一步的免疫组织化学分析,结果表明,淋巴单核细胞和内皮细胞是NL组织和LS组织中IL-31和OSM的常见来源。此外,与NL活检相比,来自LS活检的淋巴单核细胞显示所有靶标蛋白的表达明显更高(图20插图E-插图H)。这些研究进一步显示,淋巴单核细胞中的IL-31Rα蛋白水平和OSMRβ蛋白水平与瘙痒严重性相关(图21插图A-插图D)。
总体而言,本实施例中呈现的数据显示了PN病变性皮肤和AD病变性皮肤中OSMRβ轴(IL-31、OSM、IL31Rα和OSMRβ)的普遍表达。这些数据表明这些因子的表达在皮肤炎性病状的发病机理中起作用。这些数据指示使用如本文所述的抗体靶向OSMRβ可用于PN的治疗。
实施例8:荨麻疹皮肤活检中OSMRβmRNA和蛋白水平升高
从患有慢性特发性荨麻疹(CIU)的受试者和未患有炎性或瘙痒性皮肤疾病或病症的对照受试者中获得皮肤活检样本,以便评估样本中的OSMRβmRNA和蛋白表达水平。对于这些研究,使用
这些研究显示,与从未患有发炎或瘙痒性皮肤疾病或病症的受试者获得的皮肤相比,CIU皮肤的OSMRβmRNA和蛋白质表达水平显著提高(图22插图A-插图C)。由
总体而言,从这些研究中获得的数据显示,与未患有发炎或瘙痒性皮肤疾病或病症的受试者相比,患有CIU的受试者的皮肤中OSMRβmRNA和蛋白质水平增加。这些数据指示,使用如本文所述的抗体靶向OSMRβ可用于CIU的治疗。
实施例9:OSMRβmRNA在慢性单纯性苔藓(LSC)、扁平苔藓(LP)皮肤活检和慢性特发性瘙痒症(CIP)中增加
皮肤活检样本从患有慢性单纯性苔藓(LSC)和扁平苔藓(LP)的受试者中获得。使用标准
从这些研究中获得的数据显示,患有LSC的受试者的OSMRβmRNA水平升高(图23插图A和插图B)。数据是使用NanoString(插图A)或RNAScope(插图B)方法获得的。
与对照样本相比,还从患有LP的受试者中分离出的皮肤样本中获得数据(图24)。使用
此外,与对照样本相比,还从患有慢性特发性瘙痒症(CIP)的受试者中分离出的皮肤样本中获得数据。使用
总体而言,这些数据指示,使用本文所述的抗体靶向OSMRβ也可用于LSC、LP和/或CIP的治疗。
等效物
本领域的技术人员将认识到,或仅仅使用常规实验就能够确定本文描述的本发明的具体实施方案的许多等同形式。本发明的范围并非旨在限于以上说明书,而是如以下权利要求书中所述。
序列表
<110> 基尼克萨制药有限公司
<120> 通过递送抗OSMRβ抗体治疗皮肤疾病或病症
<130> KPL-003WO
<150> 62/662,607
<151> 2018-04-25
<150> 62/718,324
<151> 2018-08-13
<150> 62/731,618
<151> 2018-09-14
<150> 62/757,047
<151> 2018-11-07
<150> 62/765,033
<151> 2018-08-16
<150> 62/775,350
<151> 2018-12-04
<150> 62/789,434
<151> 2019-01-07
<150> 62/794,356
<151> 2019-01-18
<160> 16
<170> PatentIn 3.5版
<210> 1
<211> 452
<212> PRT
<213> 人工序列
<220>
<223> 合成多肽
<400> 1
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Glu Ile Asn Trp Val Arg Gln Ala Thr Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Met Asn Pro Asn Ser Gly Tyr Thr Gly Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Met Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Ile Val Ala Ala Asn Thr Asp Tyr Tyr Phe Tyr Tyr Gly
100 105 110
Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser Ala Ser
115 120 125
Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr
130 135 140
Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro
145 150 155 160
Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val
165 170 175
His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser
180 185 190
Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr
195 200 205
Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val
210 215 220
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe
225 230 235 240
Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
245 250 255
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
260 265 270
Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val
275 280 285
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Gln Ser
290 295 300
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
305 310 315 320
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser
325 330 335
Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
340 345 350
Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln
355 360 365
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
370 375 380
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
385 390 395 400
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu
405 410 415
Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser
420 425 430
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
435 440 445
Leu Ser Pro Gly
450
<210> 2
<211> 216
<212> PRT
<213> 人工序列
<220>
<223> 合成多肽
<400> 2
Gln Ser Val Leu Thr Gln Pro Pro Ser Ala Ser Gly Thr Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Ser Asn Ser Asn Ile Gly Ser Asn
20 25 30
Thr Val Asn Trp Tyr His Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Asn Ile Asn Lys Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Ser Ser Ala Ser Leu Ala Ile Ser Gly Leu Gln
65 70 75 80
Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Thr Trp Asp Asp Ser Leu
85 90 95
Asp Gly Val Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gln
100 105 110
Pro Lys Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Glu Glu
115 120 125
Leu Gln Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe Tyr
130 135 140
Pro Gly Ala Val Thr Val Ala Trp Lys Ala Asp Ser Ser Pro Val Lys
145 150 155 160
Ala Gly Val Glu Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn Lys Tyr
165 170 175
Ala Ala Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser His
180 185 190
Arg Ser Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu Lys
195 200 205
Thr Val Ala Pro Thr Glu Cys Ser
210 215
<210> 3
<211> 126
<212> PRT
<213> 人工序列
<220>
<223> 合成多肽
<400> 3
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Glu Ile Asn Trp Val Arg Gln Ala Thr Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Met Asn Pro Asn Ser Gly Tyr Thr Gly Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Met Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Ile Val Ala Ala Asn Thr Asp Tyr Tyr Phe Tyr Tyr Gly
100 105 110
Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 4
<211> 111
<212> PRT
<213> 人工序列
<220>
<223> 合成多肽
<400> 4
Gln Ser Val Leu Thr Gln Pro Pro Ser Ala Ser Gly Thr Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Ser Asn Ser Asn Ile Gly Ser Asn
20 25 30
Thr Val Asn Trp Tyr His Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Asn Ile Asn Lys Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Ser Ser Ala Ser Leu Ala Ile Ser Gly Leu Gln
65 70 75 80
Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Thr Trp Asp Asp Ser Leu
85 90 95
Asp Gly Val Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly
100 105 110
<210> 5
<211> 5
<212> PRT
<213> 人工序列
<220>
<223> 合成寡肽
<400> 5
Ser Tyr Glu Ile Asn
1 5
<210> 6
<211> 21
<212> PRT
<213> 人工序列
<220>
<223> 合成寡肽
<400> 6
Trp Met Gly Trp Met Asn Pro Asn Ser Gly Tyr Thr Gly Tyr Ala Gln
1 5 10 15
Lys Phe Gln Gly Arg
20
<210> 7
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> 合成寡肽
<400> 7
Asp Ile Val Ala Ala Asn Thr Asp Tyr Tyr Phe Tyr Tyr Gly Met Asp
1 5 10 15
Val
<210> 8
<211> 13
<212> PRT
<213> 人工序列
<220>
<223> 合成寡肽
<400> 8
Ser Gly Ser Asn Ser Asn Ile Gly Ser Asn Thr Val Asn
1 5 10
<210> 9
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 合成寡肽
<400> 9
Asn Ile Asn Lys Arg Pro Ser
1 5
<210> 10
<211> 11
<212> PRT
<213> 人工序列
<220>
<223> 合成寡肽
<400> 10
Ser Thr Trp Asp Asp Ser Leu Asp Gly Val Val
1 5 10
<210> 11
<211> 19
<212> PRT
<213> 人工序列
<220>
<223> 合成寡肽
<400> 11
Met Asp Phe Gly Leu Ser Leu Val Phe Leu Val Leu Ile Leu Lys Gly
1 5 10 15
Val Gln Cys
<210> 12
<211> 26
<212> PRT
<213> 人工序列
<220>
<223> 合成寡肽
<400> 12
Met Ala Thr Gly Ser Arg Thr Ser Leu Leu Leu Ala Phe Gly Leu Leu
1 5 10 15
Cys Leu Ser Trp Leu Gln Glu Gly Ser Ala
20 25
<210> 13
<211> 220
<212> PRT
<213> 人工序列
<220>
<223> 合成多肽
<400> 13
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro
100 105 110
Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
115 120 125
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
130 135 140
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
145 150 155 160
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
165 170 175
Gln Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
180 185 190
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
195 200 205
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys
210 215 220
<210> 14
<211> 106
<212> PRT
<213> 人工序列
<220>
<223> 合成多肽
<400> 14
Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp
1 5 10 15
Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe
20 25 30
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu
35 40 45
Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe
50 55 60
Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly
65 70 75 80
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr
85 90 95
Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
100 105
<210> 15
<211> 326
<212> PRT
<213> 人工序列
<220>
<223> 合成多肽
<400> 15
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro
100 105 110
Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
115 120 125
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
130 135 140
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
145 150 155 160
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
165 170 175
Gln Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
180 185 190
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
195 200 205
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
210 215 220
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys
225 230 235 240
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
245 250 255
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
260 265 270
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
275 280 285
Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser
290 295 300
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
305 310 315 320
Leu Ser Leu Ser Pro Gly
325
<210> 16
<211> 105
<212> PRT
<213> 人工序列
<220>
<223> 合成多肽
<400> 16
Gln Pro Lys Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Glu
1 5 10 15
Glu Leu Gln Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe
20 25 30
Tyr Pro Gly Ala Val Thr Val Ala Trp Lys Ala Asp Ser Ser Pro Val
35 40 45
Lys Ala Gly Val Glu Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn Lys
50 55 60
Tyr Ala Ala Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser
65 70 75 80
His Arg Ser Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu
85 90 95
Lys Thr Val Ala Pro Thr Glu Cys Ser
100 105
- 通过递送抗OSMRβ抗体治疗皮肤疾病或病症
- 抗CD40L抗体和用于治疗CD40L相关疾病或病症的方法
