遗传性耳聋检测系统、标志物或探针、药物及应用
文献发布时间:2023-06-19 18:37:28
技术领域
本公开属于听力障碍领域,具体涉及遗传性耳聋检测系统、标志物或探针、药物及应用。
背景技术
听力障碍是世界上发生率最高的感官缺陷性疾病。在哺乳动物中,听觉毛细胞和支持细胞仅在胚胎发育中产生,而毛细胞一旦受到损伤将不会自发再生,并将会导致永久耳聋,毛细胞的不可逆损伤是造成感音神经性聋的关键原因。关于耳聋的治疗,在临床上主要通过助听器和人工耳蜗移植治疗,这两种方法虽然能部分恢复患者听力,但是都是借助残存的毛细胞,存在一定的局限性,不能从根本上解决问题。因此最理想的治疗感音神经性聋的方法是通过基因治疗使毛细胞再生达到耳蜗结构和功能的修复,从而在根本上恢复听力。目前通过腺相关病毒(AAV)介导的基因治疗是目前最有希望治疗感音神经性耳聋的方法。
许多基因突变会导致听力损失,其中Taperin(Tprn)是表达在内耳毛细胞静纤毛根部的一种听觉相关蛋白质,目前已发现该基因突变可导致常染色体隐性遗传性聋(DFNB79)。
目前的研究表明,taperin的突变会导致小鼠和人类耳聋,目前临床上针对于耳聋这种情况,主要是借助于助听器和人工耳蜗的植入,但是这2种方式都需要借助残存的毛细胞和螺旋神经元的质量和数量。
发明内容
针对现有技术的不足,本公开的目的在于提供遗传性耳聋检测系统、标志物或探针、药物及应用,探究Taperin、Taperin-Clic5-Ptprq在遗传性耳聋的研究,以及应用。
本公开的目的可以通过以下技术方案实现:
一种遗传性耳聋诊断、治疗或检测系统,所述系统包括:
识别模块,识别模块进行识别毛细胞静纤毛根部的Taperin-Clic5-Ptprq的环状蛋白复合物结构;
检测模块,检测模块进行检测识别模块识别的Taperin-Clic5-Ptprq的环状蛋白复合物结构的完整性;
输出模块,输出模型将检测模块检测Taperin-Clic5-Ptprq的环状蛋白复合物结构的完整性信息进行输出。
在一些公开中,所述检测模块,还包括对Taperin的表达量的检测;
所述检测模块与输出模块之间包括判别模块,判别模块用于判别Taperin的是否过表达;
输出模块,将判别模块判别的信息进行输出。
在一些公开中,识别模块进行识别毛细胞静纤毛根部的Taperin-Clic5-Ptprq的环状蛋白复合物结构,包括:
标志物为HA,所述标志物的标志对象为毛细胞静纤毛根部的Taperin-Clic5-Ptprq的环状蛋白复合物,CRISPR/Cas9基因组编辑在终止密码子之前的TAPERINC-末端插入了血凝素(HA)标记编码序列;通过AAV载体Anc80L65将内含肽介导的分裂Cas9系统与重组供体一起递送到HCs中;
或,STED成像来表征TAPERIN的分布。
第二方面,一种遗传性耳聋诊断、治疗或检测的标志物或探针,包括HA,所述HA进行标志Taperin-clic5-ptprq的环状蛋白复合物。
第三方面,一种遗传性耳聋诊断、治疗或检测的药剂,包括以下任一项:
如第二方面所述的标志物或探针;
外源性TAPERIN;
锤头状核酶N107V1。
第四方面,一种遗传性耳聋诊断、治疗或检测的试剂盒,其特征在于,所述试剂盒内装载有以下任一项:
如第二方面所述的标志物或探针;
外源性TAPERIN;
锤头状核酶N107V1。
在一些公开中,Taperin-clic5-ptprq的环状蛋白复合物在遗传性耳聋诊断、治疗或检测的药剂中的应用。
在一些公开中,蛋白载体在遗传性耳聋诊断、治疗或检测的药剂中的应用,所述蛋白载体包括AAV载体AAV载体包载有TAPERIN。
在一些公开中,锤头状核酶在遗传性耳聋的诊断、治疗或检测的药剂中的应用,所述遗传性耳聋由于外源性taperin的过表达导致。
针对现有技术的不足,本发明提供了一种可以对taperin导致耳聋的基因治疗从而恢复小鼠听力的方法。
本公开的有益效果:
明确了Taperin在毛细胞静纤毛根部锥形区域形成环状结构;
确定了在静纤毛根部Taperin-Clic5-Ptprq形成环状复合物结构;
Taperin-Clic5-Ptprq形成环状复合物结构对于维持听力至关重要,受到破坏会造成严重的听力损失;
Taperin的表达量对环状结构的维持与稳定至关重要;
因环状结构的破坏引起的听力损失可以通过基因递送的方式进行治疗。
附图说明
为了更清楚地说明本公开实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
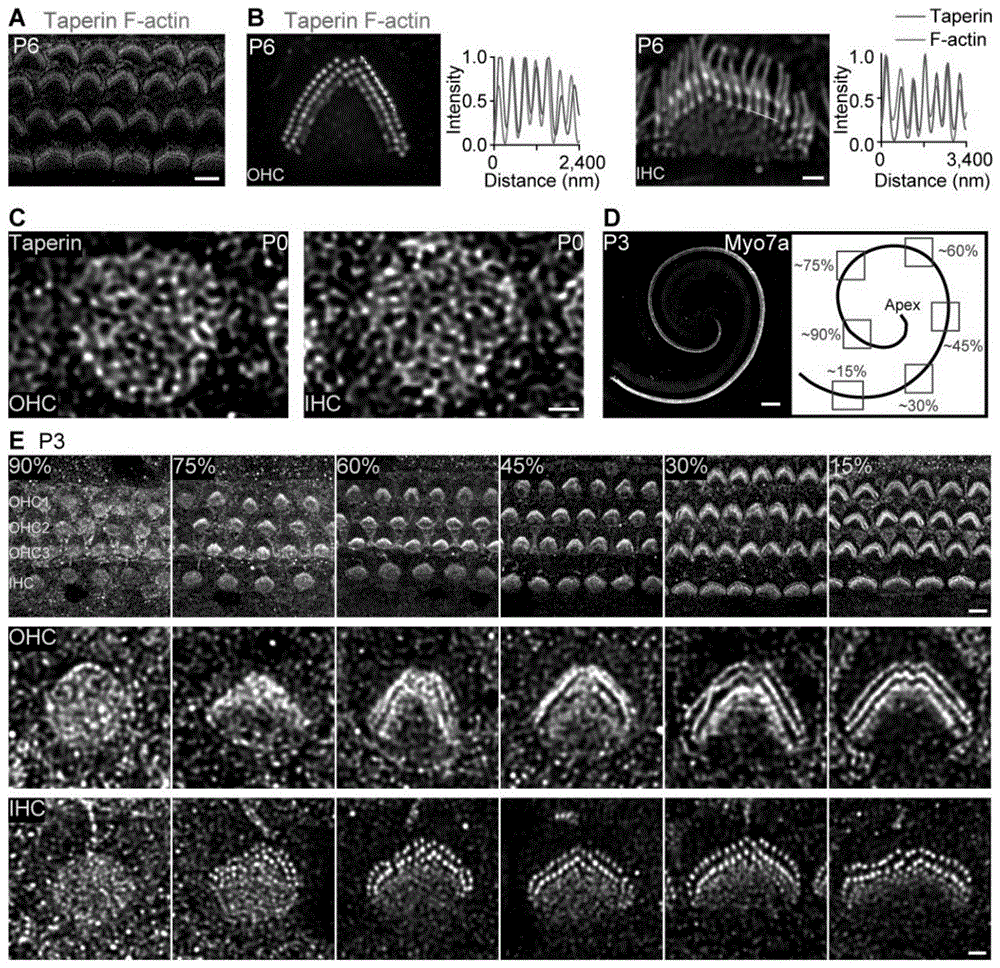
图1:Taperin定位于静纤毛的根部的示意图;(A)P6小鼠HCs中TAPERIN(洋红色)和F-肌动蛋白(绿色)的代表性共聚焦图像;比例尺:5μm;(B)OHCs和IHCs中TAPERIN(洋红色)和F-肌动蛋白(绿色)的双色共焦图像;如图显示了对应于虚线的强度分布;比例尺:1μm;(C)P6小鼠OHCs和IHCs中TAPERIN的代表性共聚焦图像;比例尺:1μm;(D)左图,Myo7a的共聚焦图像,表明耳蜗螺旋;右图,说明了整个耳蜗螺旋中的相对位置;我们认为0%是耳蜗螺旋的底部,而100%是耳蜗螺旋的顶部;比例尺:1mm;(E)在(D)中所示耳蜗螺旋的不同弯曲处,TAPERIN在OHCs和IHCs中的常规共聚焦图像;比例尺:5μm(39)和1μm(底部);
图2:TAPERIN在静纤毛的锥形区域形成环状结构;(A)TAPERIN在小鼠OHC和IHC中的常规STED图像,分别放大了黄色框区域,如图所示;插入的图像是同一成像场下的共焦图像;对应于虚线(1-8)的荧光强度显示在底部;OHC中比例尺分别为:1μm和500nm,IHC中分别为:1μm和400nm;(B)OHC和IHC中TAPERIN环的直径;误差线是平均值的标准误差;(C)HEK-293T细胞用FLAG、Tprn-FLAG或Tprn-HA结构转染;使用FLAG抗体进行免疫沉淀,然后使用FLAG或HA抗体进行蛋白质免疫印迹检测共表达的蛋白质;代表性图像来自于两个独立的实验;(D)在HCs中通过AAV和Crispr/Cas9介导的同源定向修复(HDR)在Tprn编码序列末端插入HA的策略;(E)用Anc80L65描述小鼠耳蜗中Tprn-HA敲入(KI)的实验模型;在P13收集耳蜗用于进一步的PCR、基因组测序和STED成像;(F)AAV感染的IHC中TAPERIN-HA的常规STED图像;HA序列通过AAV和Crispr/Cas9介导的HDR在IHC中插入Tprn编码序列的末端,左耳中的剂量为9×10
图3:TAPERIN-CLIC5-PTPRQ在静纤毛的锥形区域形成环状复合物;P14小鼠OHC中TAPERIN(洋红色)和F-肌动蛋白(绿色)的常规共聚焦和STED图像;对应于虚线(1-6)的强度分布如下所示;比例尺:500nm;(B)TAPERIN和肌动蛋白之间的Co-IP;用FLAG、Tprn-FLAG、Tprn-HA或Actb-FLAG质粒转染小鼠N2A细胞;使用FLAG抗体进行免疫沉淀,然后使用β-肌动蛋白或HA抗体进行蛋白质印迹以检测共表达的蛋白质;该图像代表三个独立实验;(C)在HEK-293T细胞中将FLAG、Tprn-FLAG或Clic5-HA质粒共转染;使用FLAG抗体进行免疫沉淀,然后使用HA抗体进行蛋白质印迹以检测共表达的蛋白质;来自三个独立实验的代表性数据;(D)Anc80L65-Clic5-HA感染的耳蜗P17IHC中CLIC5-HA的代表性STED图像;比例尺:1μm;(E)在P3手术后第17天,Anc80L65-Clic5-HA感染的耳蜗IHC中CLIC5-HA(洋红色)和TAPERIN(绿色)的代表性双STED图像,剂量为4.5×10
图4:TAPERIN和CLIC5之间相互作用的体内破坏导致听力受损和感觉上皮细胞受损;(A)用于识别与CLIC5绑定域的TAPERIN片段结构图,结合区用“+”表示;(B)HEK293T细胞与TAPERIN片段结构以及Clic5-FLAG结构共转染;使用FLAG抗体进行免疫沉淀,然后使用HA抗体进行蛋白质印迹检测共表达的蛋白质;这些图像代表三个独立的实验;(C)TAPERIN#5和#6片段竞争性地削弱了TAPERIN和CLIC5之间的相互作用;HEK 293T细胞与TAPERIN片段(#5或#6)和Clic5-FLAG结构共转染;使用FLAG抗体进行免疫沉淀,然后使用HA抗体进行蛋白质印迹检测共表达的蛋白质;这些图像代表两个独立的实验;(D)描述Anc80L65竞争性抑制实验的示意图;在P2时,所有小鼠的左耳都注射了相应的病毒;感染至少4周后进行ABR测试并收集耳蜗用于进一步的形态分析;(E)P2手术后第35天注射Anc80L65-Tprn#5-HA的代表性耳蜗共聚焦图像;绿色:Myo7a,洋红色:Tprn#5-HA;比例尺:10μm;(F)P2手术后第35天注射Anc80L65-Tprn#5-HA的代表性静纤毛共聚焦图像;绿色:鬼笔环肽,洋红色:TAPERIN;比例尺:400nm;(G)P2手术后第56天注射Anc80L65-Tprn#6-HA的代表性耳蜗共聚焦图像;绿色:Myo7a,洋红色:Tprn#6-HA;比例尺:10μm;(H)32天后,从对照组、Anc80L65-Tprn#5-HA注射组和Anc80L65-Tprn#6-HA-组小鼠记录的代表性ABR波形图,在20dB和90dB之间显示出16kHz声音;(I)记录小鼠在P34时的ABR检测结果,对照组(n=4)、Anc80L65-Tprn#5-HA注射组(n=6)以及Anc80L65-Tprn#5-HA注射组(n=6);(J)P2手术后第35天,对照组和注射Anc80L65-Tprn#5-HA的小鼠耳蜗上皮细胞SEM图像;黄色三角形表示缺失的HCs;比例尺:10μm;(K)P2手术后第35天,对照组和Anc80L65-Tprn#5-HA感染组的HCs静纤毛SEM图像;黄色箭头表示缺失的静纤毛;比例尺:1μm;(L)对照组和Anc80L65-Tprn#5-HA感染组OHC中的总静纤毛数,与(K)图对应;以5.25×10
图5:TAPERIN缺乏会导致严重的听力损失和静纤毛破坏;(A)使用Crispr/Cas9系统生成Tprn
图6:外源性TAPERIN在Tprn
图7:HHR介导的适量外源性TAPERIN表达部分恢复了Tprn
具体实施方式
下面将结合本公开实施例中的附图,对本公开实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本公开一部分实施例,而不是全部的实施例。基于本公开中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其它实施例,都属于本公开保护的范围。
实施例一:确认tperin在耳蜗静纤毛根部的表达
首先通过免疫荧光染色检查了TAPERIN在Corti器官中的位置,APERIN分布在毛细胞和支持细胞中,并在小鼠出生后第6天于HC中静纤毛的锥形区域发出强烈信号(图1、A和B)。为了确定TAPERIN是否存在于HCs发育的早期阶段,我们测量了出生不同发育阶段静纤毛中的TAPERIN表达。TAPERIN早在P0时就集中在HCs的表皮板中,但在P0的静纤毛锥形区域未检测到TAPERIN信号(图1、C)。TAPERIN开始在P3周围的锥形区域从耳蜗螺旋的底部(0%)积累到顶点(100%)(图1、D和E)。双色荧光图像结果证实了每个TAPERIN簇在空间上与外毛细胞(OHCs)和内毛细胞(IHCs)中的单个静纤毛相对应(图1、B)。总而言之,我们的研究结果证实,TAPERIN是一种在发达HCs的静纤毛锥形区域具有特定的定位的蛋白质。
实施例二:Taperin在静纤毛根部的锥形区域形成环状结构
超分辨率荧光显微镜的最新研究使得分子可视化具有精确的精度,并且已经开发出STED技术,STED已成功用于获得细胞区室中高空间分辨率的蛋白质分布。为了获得静纤毛中TAPERIN分布的更高空间分辨率,尤其是在锥形区域,我们使用STED成像来表征TAPERIN的分布。通过共聚焦显微镜100倍放大,我们在OHC和IHC的静纤毛中观察到TAPERIN的点状聚集(图2A)。而STED显示TAPERIN形成了有组织的环状结构,直径范围在150nm至200nm之间,并且勾勒出了OHC和IHC的边缘(图2、A和B)。此外,免疫共沉淀(Co-IP)实验表明TAPERIN分子具有同源结合亲和力(图2、C)。之前有研究表明,用随机光学重建显微镜(STORM)发现TAPERIN表现为延伸到静纤毛核心的致密点,这与我们的结果不一致。为了排除非特异性抗体结合的影响,我们使用CRISPR/Cas9基因组编辑在终止密码子之前的小鼠TAPERINC-末端插入了血凝素(HA)标记编码序列(图2、D)。通过AAV载体Anc80L65将内含肽介导的分裂Cas9系统与重组供体一起递送到HCs中(图2、E)。在注射病毒11天后的基因组PCR中确认HA标签已插入基因组(图2、E)。与上述结果一致,HA抗体显示的HA信号在三个维度上显示出相似的环状结构(图2、F),这也验证了使用商业TAPERIN抗体获得的实验结果。总之,这些结果表明,TAPERIN在静纤毛的锥形区域形成环形结构,并且可能在纤毛稳定性中起关键作用。
实施例三:Taperin-clic5-ptprq环状蛋白复合物将肌动蛋白丝锚定在细胞膜下方
锥形区域位于静纤毛的底端,在这里平行的肌动蛋白丝开始变窄并以有序的方式终止。静纤毛中的肌动蛋白由β-肌动蛋白和γ-肌动蛋白组成。我们通过双STED成像原位观察了TAPERIN和肌动蛋白之间的相关性,其中肌动蛋白用鬼笔环肽缀合的有机染料标记。STED图像显示每个TAPERIN环都围绕一个肌动蛋白点(图3、A),佐证了TAPERIN形成了一个勾勒出单个静纤毛横截面边缘圆环的结果。因为HCs需要TAPERIN来调节静纤毛形态,我们试图确定锥形区域中TAPERIN和肌动蛋白末端之间的关系。通过构建用于在体外进行Co-IP的Tprn过表达质粒来验证其与β-肌动蛋白的相互作用。结果揭示了TAPERIN与内源性β-肌动蛋白之间的关联,反之亦然(图3、B)。考虑到TAPERIN的同源结合亲和力(图1、C),TAPERIN可能形成连接体并与肌动蛋白的尖端相互作用,从而稳定肌动蛋白和静纤毛。然而,作为一种细胞质蛋白,TAPERIN环如何形成并固定在锥形区域尚不清楚。之前的一项研究表明,细胞内氯化物通道5蛋白(chloride intracellular channel 5 protein,CLIC5)可稳定静纤毛锥形区域的膜-肌动蛋白丝连接,直接与TAPERIN相互作用。我们在Co-IP实验中证实了这一观察结果(图3、C)。为了可视化它们的原位相关性,我们将Clic5-HA表达盒包装到AAV载体中,并在P3时通过圆窗膜(RWM)注射将其递送到耳蜗中。在P17收获耳蜗,并用HA和TAPERIN抗体一起进行免疫染色。共聚焦成像中的CLIC5-HA泪滴状点在STED图像中也呈现出类似的环状结构(图3、D)。此外,CLIC5呈现出同心环状,内部有明显较小的TAPERIN环(图3、E)。三维STED成像证实了这一观察结果(图3、E)。作为细胞质蛋白,TAPERIN-CLIC5复合物可能需要锚定在细胞膜上从而将肌动蛋白丝固定到位。PTPRQ是锥形区域的膜蛋白,我们发现TAPERIN与PTPRQ的C-末端相互作用(图3、F)。为了可视化PTPRQ的结构,我们使用Cas9介导的同源重组将HA标签插入到Ptprq基因编码区的末端,并通过STED显微镜对PTPRQ-HA进行成像。PTPRQ在耳蜗HCs中显示出相似的环状结构(图3、G),因此这些结果表明TAPERIN、CLIC5和PTPRQ在锥形区域形成环状簇复合物。为了证实这一复合物,我们将Tprn、Clic5和mem-Ptprq(其中Ptprq的细胞内区域用膜信号肽标记)表达质粒转染到HeLa细胞中。我们发现TAPERIN与CLIC5共存于细胞质中,并且通过添加mem-Ptprq将TAPERIN-CLIC5复合物募集到细胞膜附近(图3、H),这表明TAPERIN-CLIC5复合物由膜蛋白PTPRQ锚定。综上所述,这些结果表明TAPERIN与膜下肌动蛋白末端相互作用,并可能通过CLIC5和PTPRQ将肌动蛋白丝锚定到静纤毛的基部,这种蛋白质复合物的完整性可能是静纤毛结构稳定和听力正常的原因。
实施例四:Taperin-Clic5相互作用的破坏导致严重的静纤毛障碍和耳聋
接下来,我们试图确定TAPERIN-CLIC5-PTPRQ环状簇复合体在正常听力中的潜在作用。我们首先生成了几个与HA标签融合的TAPERIN截断(图4、A)来绘制对TAPERIN-CLIC5相互作用至关重要的蛋白质结构域。TAPERIN中含有氨基酸106-506的片段(TAPERIN
实施例五:Taperin的过表达无法挽救tpaerin-/-小鼠的听力功能
我们的Co-IP实验表明,TAPERIN可以与肌动蛋白、CLIC5和PTPRQ的细胞内结构域结合,这表明TAPERIN在锥形区域中发挥着核心作用。为了确定TAPERIN在听觉系统中的功能,我们通过使用CRISPR/Cas9系统删除所有Tprn外显子来生成Tprn
基因疗法最近已成为治疗遗传性疾病的一种可能而且比较有希望的策略。为了研究Tprn
我们想知道为什么Tprn过度表达不仅不能挽救听力损失,而且事实上加剧了Tprn
实施例六:用锤头状核酶降低taperin的表达可以部分恢复taperin-/-小鼠的听力功能
上述结果表明,适当的TAPERIN定位对听力功能至关重要(图4),而低剂量的Anc80L65-CAG-Tprn-HA不足以将TAPERIN限制在合适的水平(图6、F和G)。考虑到内源性TAPERIN的低表达水平,我们试图通过使用HHR大幅减少外源性TAPERIN的水平。HHR是一种小的自分裂核酶,广泛用于转录RNA的可逆分裂从而调节基因表达。根据之前的一项研究,I型HHRN107v1导致HEK293T细胞中高斯荧光素酶报告基因的34倍抑制作用。在外源Tprn基因的3'UTR引入N107v1(图7、A)可能降低耳蜗中的基因表达,从而恢复听力。
针对于N107v1说明:该序列参加文献PMID:31873216;N107V1序列(5’—3’)为:
CUGAGGUGCAGGUACAUCCAGCUGACGAGUCCCAAAUAGGACGAAACGCGCUUCGGUGCGUCCUGGAUUCCACUGCUAUCCAC。
我们通过Anc80L65注射在3'UTR处将外源性Tprn与N107v1一起递送到P1-P2Tprn
因此,我们在转录和翻译水平方面评估了Tprn在Tprn-N107v1注射小鼠中的表达。与注射Anc80-Tprn的小鼠相比,注射Anc80-Tprn-N107v1的小鼠耳蜗和对侧耳蜗显示较少的Tprn mRNA转录物,分别具有约100倍和3倍的抑制作用(图7、G)。通过蛋白质印迹和TAPERIN-HA在翻译水平的免疫染色也验证了类似的趋向(图7、H和I)。更重要的是,Tprn
通过上述研究:
1、解析Taperin在静纤毛根部的精密结构,之前的研究仅表明taperin在静纤毛的根部表达,并没有表征其结构,而我们的研究发现,Taperin在静纤毛的根部形成环状结构,这是之前未有过报道的。
2、静纤毛的根部有很多蛋白,对听力的维持有很重要的作用,且发挥着不同的作用,根据之前的研究,我们仅仅知道Taperin,Clic5,Ptprq在静纤毛的根部有表达,对于他们之间的关系不是很清楚,我们的结果表明这3个蛋白之间形成了环状复合物结构,这是之前未报道过的。
3、因为Taperin,Clic5,Ptprq在静纤毛的根部有表达,且其突变均会导致听力的下降,我们的结果表明,Taperin-Clic5-Ptprq形成的环状结构被破坏后,会导致小鼠的听力严重受损,这表明,Taperin-Clic5-Ptprq形成的环状结构对于听力的维持具有重要作用。
4、因为基因治疗已经成为目前遗传性耳聋治疗有前景的方法,所有我们尝试利用AAV介导外源taperin来恢复taperin-/-小鼠的听力,但是我们发现过量表达的taperin没办法恢复小鼠的听力,且会造成更为严重的听力损失,所以当对taperin-/-小鼠进行基因治疗的时候,适当的taperin表达量对其听力恢复至关重要。
5、锤头状核酶(HHR)是一种小的自分裂核酶,广泛用于转录RNA的可逆分裂从而调节基因表达。因此我们借助其作为我们新的基因治疗的工具,来降低外源过表达的taperin基因。关键的是,我们发现当使用HHR进行基因治疗后,taperin-/-小鼠的听力得到部分恢复,并且这个恢复时间可以延长到2个月。
在本说明书的描述中,参考术语“一个实施例”、“示例”、“具体示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本公开的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不一定指的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任何的一个或多个实施例或示例中以合适的方式结合。
以上显示和描述了本公开的基本原理、主要特征和本公开的优点。本行业的技术人员应该了解,本公开不受上述实施例的限制,上述实施例和说明书中描述的只是说明本公开的原理,在不脱离本公开精神和范围的前提下,本公开还会有各种变化和改进,这些变化和改进都落入要求保护的本公开范围内容。
