一种综合利用虾加工副产物的方法
文献发布时间:2023-06-19 09:27:35
技术领域
本发明涉及水产品废弃物综合利用技术领域,尤其是涉及一种综合利用虾加工副产物的方法。
背景技术
虾是人类蛋白质的重要来源,是我国大宗水产品之一。目前,我国年加工虾产品100万吨以上,在虾加工过程中会产生大量的虾头和虾壳等副产物,这些副产物占虾质量的30%~40%。当前企业对虾头虾壳等副产物的处理方法主要是低价销售或进行鱼粉饲料加工,产品附加值低。而在虾加工旺季时,虾头虾壳等甚至作为废弃物处理,给生态环境带来严重影响。
现有技术中大多数采用加入酶进行酶解的方式提取蛋白肽,如CN1844406A公开了一种对原料虾用沸水进行蛋白质变性后,按2-3%(酶/底物)的比例加入蛋白酶制备蛋白肽的方法。该类方法需要加入大量价格不菲的蛋白酶,成本高昂,而且还会对蛋白肽的口感和稳定性造成不良影响。
CN109280096A公开了一种虾蟹壳的综合利用方法,该专利采用先用乙酸乙酯提取脂肪,再提取蛋白质,最后提取甲壳素和柠檬酸钙。但发明人发现,该专利的技术方案中虾蟹壳由于没有经过充分酶解,脂肪及不饱和脂肪酸在细胞内难以被提取出来;使用乙酸乙酯提取的大部分为脂肪,而其中价值更高的不饱和脂肪酸没有被充分提取出来。
CN108976113A公开了一种利用虾蟹壳生产醋酸钙、蛋白肽和甲壳素的方法,包括预处理,酶解,蛋白肽回收,甲酸处理,醋酸钙回收,加碱处理,甲壳素回收。其缺点为加碱处理需要浸泡24-48h,效率低,且由于处理时间太长容易造成微生物污染。
因此,需要一种高效、低成本、利用充分的虾加工副产物综合利用方法。
发明内容
发明概述
为解决上述问题,一方面,本发明提供了一种高效、低成本、利用充分的虾加工副产物综合利用方法,所述方法包括预处理,虾蛋白肽提取,虾油提取,甲壳素提取和有机酸钙的制备等步骤。
通过采用合适的虾蛋白肽提取条件,可以不外加蛋白酶,降低了成本,同时还能保持虾蛋白肽原有的良好口感和稳定性。
通过采用合适的提取步骤,在酶解蛋白质并提取虾蛋白肽后,充分破坏细胞膜后,用合适的溶剂提取高价值的不饱和脂肪酸,同时使水不溶性蛋白质变性,分子结构变松散,使得甲壳素和有机酸钙的回收更高效,实现了虾加工副产物高效和充分利用。
另一方面,本发明公开了一种通过本发明所制备的虾蛋白肽和虾油的用途。
发明详述
第一方面,本发明提供一种综合利用虾加工副产物的方法。
一种综合利用虾加工副产物的方法,包括以下步骤:预处理,虾蛋白肽提取,虾油提取,甲壳素提取和有机酸钙的制备。
所述预处理包括清洗、粉碎。
所述虾蛋白肽提取包括:将预处理后的虾加工副产物与水混合,调节pH,任选地加酶,于30-60℃反应4-8小时后灭活酶,更优选地在40-50℃反应4-8小时后灭活酶,降温至室温,离心,得第一上清液和第一沉淀物,第一上清液经过滤,得第一滤液,第一滤液经浓缩和/或干燥,得所述虾蛋白肽。在一些实施例中,所述第一上清液经过滤可以为第一上清液经陶瓷膜或卷式膜过滤。在一些实施例中,所述第一上清液经过滤可以为第一上清液经陶瓷膜和卷式膜联合过滤。
所述虾加工副产物与水的重量比可以为1∶1-1∶8。在一些优选的实施例中,所述虾加工副产物与水的重量比为1∶2-1∶4。
所述酶灭活的温度可以为90-100℃。
所述酶灭活的时间可以为5-30分钟。
所述干燥可以包括喷雾干燥或冻干。
所述酶可以包括选自碱性蛋白酶、风味蛋白酶、木瓜蛋白酶、中性蛋白酶、菠萝蛋白酶、胰蛋白酶、酸性蛋白酶和胃蛋白酶中的至少一种。在一些实施例中,所述酶包括选自碱性蛋白酶、风味蛋白酶、木瓜蛋白酶、中性蛋白酶、菠萝蛋白酶、胰蛋白酶、酸性蛋白酶和胃蛋白酶中的两种。
所述酶的加入量可以为虾加工副产物重量的0-1.0%。
所述pH可以为2-9。在一些优选的实施例中,所述pH为6-9。在一些更优选的实施例中,所述pH为7-8。
所述调节pH可以采用10%(W/W)NaOH溶液或10%(V/V)HCl溶液调节pH。
所述虾油提取可以包括:取第一沉淀物,加溶剂提取,离心,得第二上清液和第二沉淀物,除去第二上清液中溶剂,得所述虾油。
所述溶剂可以包括甲醇、乙醇或其水溶液。在一些实施例中,所述溶剂为95%(V/V)的乙醇溶液。
所述虾油提取的提取温度可以为40-65℃。
所述虾油提取的提取时间可以为2h-4h。
所述甲壳素提取可以包括:取第二沉淀物,加有机酸进行提取,过滤,得第二滤液和第二滤渣,第二滤渣洗涤后,得所述甲壳素。
所述洗涤可以包括用酸和碱洗涤。在一些实施方式中,所述酸为1%-5%(V/V)盐酸溶液。在一些实施方式中,所述碱为1%-10%(W/W)氢氧化钠溶液。
所述加有机酸进行提取的提取温度可以为25-70℃。
所述加有机酸进行提取的提取时间可以为1h-5h。
所述有机酸可以包括柠檬酸、丙酸等有机酸或其水溶液。
所述有机酸为体积百分比可以为5%-30%的有机酸水溶液。
在一些实施例中,所述有机酸钙的制备包括:将第二滤液用氢氧化钙调节pH至7-10,离心或过滤,得第三滤液或第三上清液,将第三滤液或第三上清液浓缩和/或干燥,得所述有机酸钙。在一些实施例中,所述有机酸包括丙酸。
在一些实施例中,所述有机酸钙的制备包括:将第二滤液用氢氧化钙调节pH至7-10,离心或过滤,得第三滤渣或第三沉淀物,将第三滤渣或第三沉淀物干燥,得所述有机酸钙。在一些实施例中,所述有机酸包括柠檬酸。
在本发明的一些实施方式中,一种综合利用虾加工副产物的方法,包括以下步骤:预处理,虾蛋白肽提取,虾油提取,甲壳素提取和有机酸钙的制备,所述预处理包括清洗、粉碎,所述虾蛋白肽提取包括:将预处理后的虾加工副产物与水混合,调节pH为6-9,在40-50℃反应4-8小时后灭活酶,降温至室温,离心,得第一上清液和第一沉淀物,第一上清液经过滤,得第一滤液,第一滤液经浓缩和/或干燥,得所述虾蛋白肽,采用此方式综合利用虾加工副产物,不需另外加酶,降低了成本,同时还能保持虾蛋白肽原有的良好口感和稳定性。
在本发明的一些实施方式中,一种综合利用虾加工副产物的方法,包括以下步骤:预处理,虾蛋白肽提取,虾油提取,甲壳素提取和有机酸钙的制备;所述虾蛋白肽提取包括:将预处理后的虾加工副产物与水混合,调节pH,任选地加酶,于30-60℃或40-50℃反应4-8小时后灭活酶,降温至室温,离心,得第一上清液和第一沉淀物,第一上清液经过滤,得第一滤液,第一滤液经浓缩和/或干燥,得所述虾蛋白肽;所述虾油提取包括:取第一沉淀物,加溶剂提取,离心,得第二上清液和第二沉淀物,除去第二上清液中溶剂,得所述虾油,所述溶剂为95%(V/V)的乙醇溶液,本方式采用95%(V/V)的乙醇溶液对酶解提取虾蛋白肽后的滤渣进行虾油提取,能充分提取出不饱和脂肪酸;同时还能使水不溶性蛋白质变性,分子结构变松散,在对甲壳素和有机酸钙进行回收时能更高效;实现了虾加工副产物高效和充分的利用。
在本发明的一些实施方式中,一种综合利用虾加工副产物的方法,包括以下步骤:预处理,虾蛋白肽提取,虾油提取,甲壳素提取和有机酸钙的制备;所述虾蛋白肽提取包括:将预处理后的虾加工副产物与水混合,调节pH为6-9,在40-50℃反应4-8小时后灭活酶,降温至室温,离心,得第一上清液和第一沉淀物,第一上清液经过滤,得第一滤液,第一滤液经浓缩和/或干燥,得所述虾蛋白肽;所述虾油提取包括:取第一沉淀物,加溶剂提取,离心,得第二上清液和第二沉淀物,除去第二上清液中溶剂,得所述虾油,所述溶剂为95%(V/V)的乙醇溶液,采用此方式综合利用虾加工副产物,不需另外加酶,降低了成本,同时还能保持虾蛋白肽原有的良好口感和稳定性,另外,本方式采用95%(V/V)的乙醇溶液对酶解提取,第一上清液经过滤,得第一滤液,第一滤液经浓缩和/或干燥,得所述虾蛋白肽后的滤渣进行虾油提取,能充分提取出不饱和脂肪酸;同时还能使水不溶性蛋白质变性,分子结构变松散,在对甲壳素和有机酸钙进行回收时能更高效;实现了虾加工副产物高效和充分的利用。
在本发明的一些实施方式中,一种综合利用虾加工副产物的方法,包括以下步骤:预处理,虾蛋白肽提取,虾油提取,甲壳素提取和有机酸钙的制备;所述虾蛋白肽提取包括:将预处理后的虾加工副产物与水混合,调节pH为6-9,在40-50℃反应4-8小时后灭活酶,降温至室温,离心,得第一上清液和第一沉淀物,第一上清液经过滤,得第一滤液,第一滤液经浓缩和/或干燥,得所述虾蛋白肽;所述虾油提取包括:取第一沉淀物,加溶剂提取,离心,得第二上清液和第二沉淀物,除去第二上清液中溶剂,得所述虾油,所述溶剂为95%(V/V)的乙醇溶液;所述有机酸钙的制备包括:将第二滤液用氢氧化钙调节pH至7-10,离心或过滤,得第三滤液或第三上清液,将第三滤液或第三上清液浓缩和/或干燥,得所述有机酸钙,所述有机酸包括丙酸。
在本发明的一些实施方式中,一种综合利用虾加工副产物的方法,包括以下步骤:预处理,虾蛋白肽提取,虾油提取,甲壳素提取和有机酸钙的制备;所述虾蛋白肽提取包括:将预处理后的虾加工副产物与水混合,调节pH为6-9,在40-50℃反应4-8小时后灭活酶,降温至室温,离心,得第一上清液和第一沉淀物,第一上清液经过滤,得第一滤液,第一滤液经浓缩和/或干燥,得所述虾蛋白肽;所述虾油提取包括:取第一沉淀物,加溶剂提取,离心,得第二上清液和第二沉淀物,除去第二上清液中溶剂,得所述虾油,所述溶剂为95%(V/V)的乙醇溶液;所述有机酸钙的制备包括:将第二滤液用氢氧化钙调节pH至7-10,离心或过滤,得第三滤渣或第三沉淀物,将第三滤渣或第三沉淀物干燥,得所述有机酸钙,所述有机酸包括柠檬酸。
第二方面,本发明提供一种上述任一方法所制备的虾蛋白肽和虾油的用途。
一种虾蛋白肽在制备用于提高虾免疫力及促进虾生长作用的饲用添加剂中的应用,所述虾蛋白肽包括上述任一方法中所述虾蛋白肽,所述虾蛋白肽分子量小,易于吸收,且能有效提高虾免疫力、促进虾生长。
一种虾油在制备具有抗炎功能、抗氧化功能和/或胃粘膜损伤辅助保护功能的保健食品中的应用,所述虾油包括上述任一方法中所述虾油,所述虾油富含花生四烯酸、DHA、EPA等不饱和脂肪酸,能有效起到消炎、抗氧化、保护胃粘膜的损伤等作用。
有益效果
(1)在本发明的虾蛋白肽提取中,通过采用合适的pH和温度,充分利用虾头组织的内源酶对蛋白质进行酶解,降低了成本,同时还能保持虾蛋白肽原有的良好口感和稳定性。
(2)本发明通过采用合适的提取步骤,在酶解蛋白质并提取虾蛋白肽后,充分破坏细胞膜后,用合适的溶剂提取高价值的不饱和脂肪酸,实现了虾加工副产物的充分和合理利用。
(3)本发明在虾油提取步骤中,通过采用合适的溶剂,尤其是采用95%(V/V)的乙醇溶液,使水不溶性蛋白质变性,分子结构变松散,使得后续的甲壳素和有机酸钙的回收更高效,实现了虾加工副产物高效和充分利用。
(4)采用本发明所制备的虾蛋白肽分子量小,易于吸收,且能有效提高虾免疫力、促进虾生长作用。
(5)采用本发明所制备的虾油富含花生四烯酸、DHA、EPA等不饱和脂肪酸,能有效起到抗炎、抗氧化和/或保护胃粘膜的损伤的作用。
(6)采用本发明对虾加工副产物进行综合利用,实现了虾头虾壳低值副产物的全值化及高价值化利用,大幅度降低了有机物的排放,减轻了环保处理压力。
附图说明
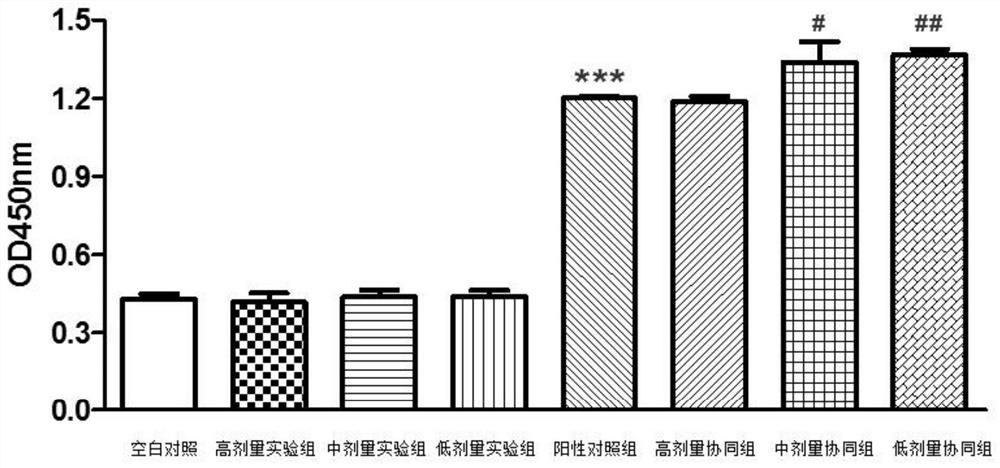
图1示实施例3中虾蛋白肽对脾淋巴细胞增殖的影响结果;其中,***表示阳性对照组和空白组比较,p<0.001;#表示中剂量协同组和阳性对照组比较,p<0.05;##表示低剂量协同组和阳性对照组比较,p<0.01。
图2示实施例4中虾蛋白肽对虾体重的影响结果。
图3示实施例4中虾蛋白肽对虾长度的影响结果。
图4示实施例5中虾油对RAW264.7细胞释放NO的影响结果;其中,####表示模型组与正常组相比,p<0.0001;**表示实验组4与模型组相比,p<0.01;****表示阳性组、实验组1、实验组2或实验组3与模型相比,p<0.0001。
图5示实施例5中RAW264.7细胞在虾油中的存活率结果;####表示模型组与正常组相比,p<0.0001;****表示阳性组与模型组相比,p<0.0001。
图6示实施例6中虾油浓度对DPPH自由基清除率的影响结果。
术语说明
“BAY11-7085”为(E)-3-((4-(叔丁基)苯基)磺酰基)丙烯腈,其CAS号为196309-76-9。
“%(W/W)”表示该物质质量占溶液总质量的百分比。“%(V/V)”表示该物质体积占溶液总体积的百分比。DHA表示二十二碳六烯酸。EPA表示二十碳五烯酸。附图说明中的p表示比较的两者的差别是由机遇所致的可能性大小。“NO”表示一氧化氮。RAW264.7细胞表示小鼠单核巨噬细胞。DPPH表示1,1-二苯基-2-三硝基苯肼。NaOH表示氢氧化钠。HCl表示盐酸。Da表示分子量单位,道尔顿。cells/mL表示细胞/毫升。LPS表示脂多糖。OD表示吸光度。μ℃g/mL表示微克/毫升。mmol/L表示毫摩尔/毫升。μmol/L表示微摩尔/毫升。mg/mL表示毫克/毫升。min表示分钟。μL表示微升。h表示小时。nm表示纳米。μM表示微摩尔/毫升。pH表示酸碱度。Griess试剂表示格里斯试剂。PBS表示磷酸缓冲盐溶液。
本发明中,室温表示环境温度,在0℃-45℃,或者10℃-30℃,或者20℃-28℃。
在本发明的描述中,需要理解的是,术语“第一”、“第二”仅用于描述目的,而不能理解为指示或暗示相对重要性或者隐含指明所指示的技术特征的数量。由此,限定有“第一”、“第二”的特征可以明示或者隐含地包括一个或者更多个该特征。在本发明的描述中,“多个”的含义是两个或两个以上,除非另有明确具体的限定。
术语“任选”或“任选地”是指随后描述的事件或情形可以但不一定出现。例如,“任选地加酶”是指“加酶”可以存在或可以不存在。
在本说明书的描述中,参考术语“一个实施例”、“一些实施例”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不必须针对的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任一个或多个实施例或示例中以合适的方式结合。此外,在不相互矛盾的情况下,本领域的技术人员可以将本说明书中描述的不同实施例或示例以及不同实施例或示例的特征进行结合和组合。
具体实施方式
为了使本领域的技术人员更好地理解本发明的技术方案,下面进一步披露一些非限制实施例,对本发明作进一步的详细说明。
本发明所使用的试剂均可以从市场上购得或者可以通过本发明所描述的方法制备而得。
实施例1:虾蛋白肽、虾油、丙酸钙及甲壳素的连续化制备
1)虾蛋白肽的制备:取粉碎后的虾头虾壳120kg,加480kg水,搅拌后于50℃反应6小时,反应结束后升温至90℃10分钟,灭活酶,降温至室温,再离心,得第一沉淀物30kg与第一上清液;所得第一上清液经陶瓷膜和卷式膜联合过滤,得第一滤液,第一滤液经单效浓缩至约60kg,再经喷雾干燥,得虾蛋白肽5kg。取适量虾蛋白肽进行检测,得虾蛋白肽中低聚肽含量为58.5%,其中肽分子量≤1000Da的肽占低聚肽的84.8%。
2)虾油的制备:取30kg第一沉淀物,加入95%(V/V)乙醇120kg,于65℃提取4h,再离心,得第二上清液和第二沉淀物,第二沉淀物干燥后为13kg;第二上清液经减压浓缩去除酒精和水,得到虾油3.5kg。取适量虾油进行检测,得虾油中主要不饱和脂肪酸含量:花生四烯酸为4.6%,EPA为9.0%,DHA为7.7%,游离虾青素0.054%。
3)甲壳素的提取和丙酸钙的制备:取13kg干燥后的第二沉淀物,加入丙酸13kg,于70℃提取时间2h,再过滤,得第二滤液和第二滤渣,第二滤渣经1%(V/V)HCl溶液及10%(W/W)NaOH溶液洗涤,得甲壳素4.2kg。第二滤液用氢氧化钙调节pH至7-8,过滤,得第三滤液,将第三滤液减压浓缩至干,得丙酸钙16kg。取适量丙酸钙进行检测,得丙酸钙含量为98.6%。
实施例2:虾蛋白肽、虾油、柠檬酸钙及甲壳素的连续化制备
1)虾蛋白肽的制备:取粉碎后的虾头虾壳120kg,加入120kg水,再加入中性蛋白酶300g和胰蛋白酶300g,调节PH至7-8,搅拌,于50℃反应4小时,反应结束后升温至90℃10分钟,灭活酶,降温至室温,再离心,得第一沉淀物30kg和第一上清液;第一上清液经陶瓷膜和卷式膜联合过滤,得第一滤液,第一滤液经单效浓缩至浓缩液约60kg,再冻干,得虾蛋白肽5.5kg。取适量虾蛋白肽进行检测,得虾蛋白肽中低聚肽含量为63.3%,其中肽分子量≤1000Da的肽占低聚肽的86.0%。
2)虾油的制备:取30kg第一沉淀物,加入95%(V/V)乙醇90kg,于65℃提取4h,再离心,得第二上清液和第二沉淀物,第二沉淀物经干燥为15kg。取第二上清液经减压浓缩去除酒精和水,得到虾油3.2kg。取适量虾油进行检测,得虾油中主要不饱和脂肪酸含量:花生四烯酸为4.5%,EPA为9.5%,DHA为7.8%,游离虾青素0.052%。
3)甲壳素的提取和柠檬酸钙的制备:取干燥的第二沉淀物15kg,加入30%(W/W)柠檬酸溶液150kg,于30℃提取1h,再过滤,得第二滤液和第二滤渣,第二滤渣经5%(V/V)HCl溶液及1%(W/W)NaOH溶液洗涤,得甲壳素5.1kg。第二滤液用氢氧化钙调节pH至至8-10,过滤,得第三滤渣,第三滤渣经干燥,得柠檬酸钙42kg,取适量柠檬酸钙进行检测,测得柠檬酸钙含量为99.2%。
实施例3:实施例1所得虾蛋白肽对Balb/c鼠脾淋巴细胞增殖活性的影响
取Balb/c鼠脾淋巴细胞,加入含10%FBS的1640RPMI培养基制备细胞悬液,用96孔板,每孔接种200μL,接种密度约5×10
表1.虾蛋白肽对Balb/c鼠脾淋巴细胞增殖活性影响实验的分组和处理
结果表明:
1.虾蛋白肽单独给药对淋巴细胞的增殖无影响,但和作为丝裂原的LPS有协同作用,能协同刺激小鼠淋巴细胞增殖,在合适的浓度比例下,虾蛋白肽与LPS同时使用能比单独使用LPS更能刺激小鼠淋巴细胞增殖。
2.在本实验中,在存在10μg/mL的LPS的情况下,在促进细胞增殖的活性方面,1μg/mL的虾蛋白肽的效果优于10μg/mL的虾蛋白肽的效果,10μg/mL的虾蛋白肽的效果优于100μg/mL虾蛋白肽的效果。
实施例4:实施例1所得虾蛋白肽的促生长试验
将试验虾苗(长度约6mm)养于虾池(1m×1m×1m)中,每个虾池放养虾苗1000尾,共设计4个虾池试验组。每天往虾池中分别投放等量添加有0%、1%、5%和10%实施例1所得虾蛋白肽的幼虾复合饲料,分别记为空白组,低剂量组,中剂量组和高剂量组,观察虾生长状态。养殖30天后,分别随机捞取20尾虾,用电子天平称量每只虾体重,并用游标卡尺量每只虾的长度,记录并分析数据。
结果:养殖期间,低剂量组、中剂量组和高剂量组的虾生长状态良好,未见死虾。虾体重与长度实验结果见图2和图3。
结论:虾平均长度和虾平均体重随着虾蛋白肽添加比例的增加而增加,说明在虾养殖的饲料中添加一定比例的虾蛋白肽对草虾的生长速度有明显的促进作用。
实施例5:实施例1制备得到的虾油的体外抗炎活性评价
(1)RAW264.7细胞培养
取对数生长期的RAW264.7细胞,以1×10
表2:虾油的体外抗炎活性评价分组和处理
(2)一氧化氮抑制实验
取Griess试剂盒(Thermo Fisher Scientific,货号G7921)1mmol/L的亚硝酸盐(NaNO
根据实验用量,以等体积的试剂A和试剂B混合配制Griess试剂。试剂A:1mg/mL N-1-萘乙二胺盐酸盐溶液。试剂B:10mg/mL的磺胺酸溶液。
取75μL亚硝酸盐标准溶液和步骤(1)中所得上清液分别加入96孔板中,每孔加入10μL的Griess试剂以及65μL的去离子水,振荡96孔板令孔内溶液充分混匀,室温条件反应30min后,测试反应液于548nm处的吸光度。以OD548值对标准样品的系列浓度进行回归,得到标准曲线,待测样品的浓度通过标准曲线法计算。
(3)对RAW264.7细胞的毒性作用试验
取步骤(1)中96孔板中培养24h的细胞用PBS洗涤后,每孔加入100μL含体积分数10%CCK-8试剂的完全培养基,在细胞培养箱孵育1h后,于458nm处测定各孔的吸光度,计算细胞存活率。
按以下公式计算样品对RAW264.7细胞的存活率。
细胞存活率(%)=(Ai-A0)/(Aj-A0)×100%
式中,
Ai——待测样品组的吸光度;
A0——空白对照的吸光度(含培养基和CCK-8试剂,不含LPS、BAY11-7085和虾油);
Aj——正常组的吸光度。
(4)实验结果
一氧化氮抑制实验结果如图4所示,LPS刺激RAW264.7细胞大量释放NO,而10μM的阳性药BAY11-7085极显著抑制NO释放,不同浓度的所述虾油均显著抑制NO释放,且呈浓度依赖性。
对RAW264.7细胞的毒性作用试验结果如图5所示,LPS刺激RAW264.7细胞增殖,而10μM的阳性药BAY11-7085显著抑制RAW264.7细胞增殖,体现了较强的细胞毒性;不同浓度的所述虾油对RAW264.7细胞增殖均没有影响。
(5)实验结论
一氧化氮在体内能促进炎症,通过抑制一氧化氮的释放,可起到抗炎的作用。阳性药BAY11-7085有显著的抑制一氧化氮的释放的作用,进而可以起到显著的抗炎作用,但同时也对RAW264.7细胞产生显著的毒性。所述虾油在不对RAW264.7细胞产生毒性的情况下,显示出显著的抑制一氧化氮的释放的作用,进而可以起到显著的抗炎作用,这一特性优于阳性药BAY11-7085,具有显著的进步。
实施例6:实施例1所得虾油的体外抗氧化活性评价
(1)DPPH溶液的配制
称取适量DPPH粉末,用少量乙醇溶解,转移至容量瓶后用乙醇定容至100mL,得浓度为0.5mmol/L的DPPH溶液,避光保存。
(2)测试方法
用乙醇将实施例1所得虾油样品配制成浓度为10mg/mL的样品母液,再将样品母液稀释成浓度分别为1.00mg/mL、0.75mg/mL、0.50mg/mL、0.35mg/mL和0.10mg/mL的样品溶液,检测不同浓度样品溶液在517nm处的吸光度。取10mL各浓度的样品溶液,分别加入0.5mmol/L的DPPH溶液2mL,于室温、避光的条件下静置反应30min,反应结束后,于517nm处检测样品溶液的吸光度。
(3)结果处理
按以下公式计算样品的抗氧化能力:
清除率(%)=[1-(Ai-Aj)/A0]×100%
式中,
Ai——添加DPPH溶液反应后样品溶液的吸光度;
Aj——未添加DPPH溶液时样品溶液的吸光度;
A0——DPPH溶液的吸光度。
(4)实验结果
图6实验结果显示,所述虾油在浓度为1.00mg/mL时对DPPH自由基的清除率为83.24%,表明所述虾油具有抗氧化能力,能有效清除DPPH自由基,具有进一步开发成为抗氧化、抵抗自由基引起的损害的药物、食品或化妆品的添加剂的潜力。
本发明的方法已经通过较佳实施例进行了描述,相关人员明显能在本发明内容、精神和范围内对本文所述的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明内。
