响应神经电活动调节葡萄糖氧化的纳米材料及其制备方法
文献发布时间:2024-04-18 19:48:15
技术领域
本发明属于医疗技术领域,具体涉及可响应神经电活动调节葡萄糖氧化的纳米材料及其制备方法。
背景技术
大脑作为最高级且复杂的组织器官,其电信号及化学信号均由神经元产生并进行传导。研究表明,若兴奋性神经递质谷氨酸释放与重摄取出现障碍,将使兴奋性神经递质的水平迅速升高,随后谷氨酸受体过度激活而引起细胞内钙稳态失衡,神经元表现为异常剧烈的电活动,并由此引发神经兴奋性死亡及由此支配的神经功能丧失,进而导致神经系统性疾病的发生。例如,癫痫、亨廷顿病等,病灶区神经元通过消耗大量葡萄糖维持神经元异常超同步化的电活动,最终造成神经兴奋性中毒并诱导细胞死亡。
过去几十年中,以兴奋性中毒机制为靶点的药物研发不断增多。鉴于谷氨酸受体(NMDAR)对于神经兴奋性的重要作用,NMDAR拮抗剂,如美金刚、Gavestinel等,已被临床用于抑制神经兴奋性中毒,其作用机理是通过阻断离子通道、谷氨酸结合位点等,抑制受体的异常激活。但该类药物通常具有较为严重的副作用,如恶心、呕吐、心血管和精神方面的影响等。除干预受体本身,研究人员进一步发展了干预NMDAR下游信号通路的治疗策略,如抑制NO介导的氧化和硝化应激发挥神经保护作用。干预谷氨酸释放和重摄取也是近期研究颇多的神经保护性治疗策略。虽然相关药物及治疗策略均在快速推进和研发中,但目前临床上推荐的可用于神经性疾病的药物却屈指可数。一方面是研发药物大都没能最终走向临床转化,另一方面是药物严重的副作用无法普及推广。因此,亟需研发安全可靠、可普适化推广应用的兴奋性中毒治疗药物。
近年来,随着纳米技术的快速发展,具有丰富功能设计性的纳米材料在纳米生物医学领域发挥着其独特优势。依据神经元的电活动发生及传递的条件和形式,结合具有与之特性相关的材料,利用材料特殊的物理化学特性影响神经元特性,将有望避免目前治疗手段解决兴奋性中毒面临的瓶颈问题,实现持久且高效的兴奋性中毒相关神经性疾病的治疗,具有重要的研究价值和意义。
众所周知,为了维持正常的神经功能,大脑需要大量能量用于供应离子通道和神经递质的正常活动,从而精细调节神经元的兴奋性。中枢神经系统兴奋与抑制的失衡可导致癫痫发作,其中大量神经元异常同步放电导致大脑消耗大量的葡萄糖,异常的能量代谢会引起中枢神经系统功能紊乱,引起神经元离子转运障碍、神经递质摄取和释放障碍等,最终促使癫痫发生。由于神经元兴奋性中毒引发的癫痫也伴随着能量代谢异常,生酮饮食可改变神经元能量代谢途径,已在癫痫治疗中取得一定效果,即从高脂肪食物中获取脂肪,将脂肪酸产生的酮体作为大脑的替代能量来源,酮体可抑制谷氨酸能突触传递,减少谷氨酸释放,抑制癫痫发作。然而,由于生酮饮食起效慢、治疗时间长、患者的坚持度和依从性方面等问题阻碍了其进一步应用。
贵金属纳米材料因同时具备贵金属特殊的物理和化学性能,在能源、催化和生物等领域备受关注。近年来,利用贵金属纳米材料解决神经科学研究领域的问题,取得了显著进展。贵金属纳米材料的独特物理化学特性犹如为神经科学提供了丰富的工具包,例如利用材料的物理特性(导电特性、光学特性等)和化学特性(催化特性、表面修饰特性等)调控神经元的异常放电等。因此,利用贵金属纳米材料响应神经系统的物理化学信号,可调节兴奋性中毒的相关因素,发展基于贵金属基纳米材料的神经兴奋性中毒治疗新技术,有望解决神经性疾病现有治疗手段所面临的诸多问题,为神经性疾病治疗提供新思路和新策略。
发明内容
本发明的目的在于提供一种可响应神经电活动调节葡萄糖氧化的贵金属纳米材料及其制备方法。
本发明提供的可响应神经电活动调节葡萄糖氧化的纳米材料,是Au/Pt纳米合金材料,材料粒径为10-20 nm;Au与Pt摩尔比为3:1—1:3;其中,Au具备催化葡萄糖转化为葡萄糖酸的能力,Pt具备催化过氧化氢分解的能力。
本发明提供的Au/Pt纳米合金材料的制备方法,是以HAuCl
(1)将HAuCl
(2)快速向上述溶液中加入5-15 mL浓度为15-25 mg/mL柠檬酸钠溶液,加热并搅拌5-15min后,停止加热,继续搅拌25-35 min后静置冷却至室温;离心收集,获得尺寸均一,分散性良好的Au/Pt合金纳米材料。
葡萄糖作为脑内最主要的供能物质,可为高强度的神经活动供给能量。但对于某些神经性疾病,如癫痫、亨廷顿病等,病变区神经发生异常同步化放电,可导致神经元异常兴奋而中毒死亡,此时的葡萄糖充当起加速疾病恶化的帮凶。因此,本发明提供具有电场响应催化葡萄糖氧化分解的贵金属基纳米材料,可根据神经电活动的剧烈程度,调节葡萄糖催化分解速率,进而干扰能量供给以避免神经元异常放电行为的发生和发展,实现对由神经异常兴奋而引发的神经性疾病的高效治疗。基于能量代谢在调节神经活动及神经性疾病发生、发展中的重要作用。
本发明提供的Au/Pt纳米合金材料,Au具备催化葡萄糖转化为葡萄糖酸的能力,Pt具备催化过氧化氢分解的能力。因此,具有可响应神经电活动调节葡萄糖氧化的优异功能,据此,可用于制备高效治疗癫痫的制剂,实现可控、长期的抑制癫痫发作,而对正常区神经活动无显著影响。其原理如下:癫痫放电产生的内源性电场引起纳米材料内部电子的集体振荡行为,进而增强纳米材料级联催化分解葡萄糖效率,减少癫痫病灶区神经元的能量供应,降低癫痫病灶区神经元的过度放电,达到高效治疗癫痫的目的。
具体地,神经元放电形成的局域电场,可激活纳米材料内部电子运动,调控Au/Pt合金催化氧化葡萄糖效率,且放电活动越剧烈,纳米材料内部电子振荡越强烈,其表现出的电催化葡萄糖分解效率越高。
Au/Pt合金纳米材料,在无外加电场条件下的催化氧化葡萄糖效率较低,不会干扰神经正常行为;而处于癫痫发作时的高频强电场下,Au/Pt合金级联催化葡萄糖氧化效率显著提升,限制神经元过度放电时所需的能量补给,抑制了神经电活动的产生,降低了神经元兴奋性,避免了癫痫发作导致的神经兴奋性中毒死亡。
附图说明
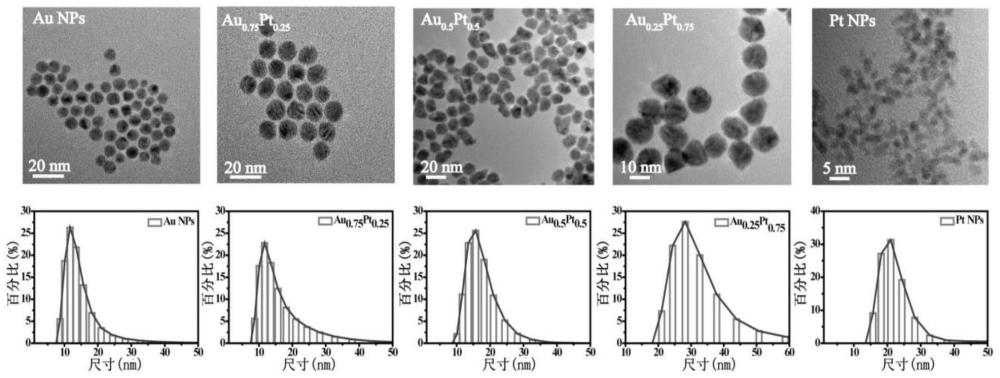
图1为不同比例的Au/Pt合金纳米颗粒的透射电镜(TEM)照片和动态光散射(DLS)图。
图2为不同比例的Au/Pt合金纳米颗粒的X射线衍射(XRD)图谱。
图3为不同比例的Au/Pt合金纳米颗粒的紫外可见吸收光谱。
图4为不同比例的Au/Pt合金催化葡萄糖生成的葡萄糖酸。
图5为不同比例的Au/Pt合金催化 H
图6为Au/Pt合金在电场下对于葡萄糖的催化氧化情况。
图7为在不同电场强度下,对于葡萄糖的催化氧化情况。
图8为不同浓度Au/Pt纳米颗粒的细胞毒性实验结果图。
图9为Au/Pt合金纳米材料在细胞水平的治疗效果评价图。
图10为Au/Pt合金纳米颗粒处理癫痫模型的离体脑片的变化情况结果图。
图11为Au/Pt 合金纳米颗粒处理癫痫小鼠模型的在体多通道电生理结果图。
实施方式
下面通过实施例结合附图进一步介绍本发明。
实施例:Au/Pt合金纳米材料干扰能量代谢用于高效治疗癫痫。
本发明提出“内源电场增强Au/Pt合金级联催化葡萄糖分解用于癫痫高效治疗”创新策略。采用Au/Pt纳米合金材料,利用癫痫放电产生的内源性电场引起材料内部电子的集体振荡行为,进而增强材料级联催化分解葡萄糖效率,减少癫痫病灶区神经元的能量供应,降低癫痫病灶区神经元的过度放电,从而实现高效治疗癫痫的目的。
实施例1、Au/Pt纳米合金纳米材料的制备与表征。
为了验证不同比例的Au/Pt合金纳米材料的葡萄糖催化性能,按不同比例向水中加入HAuCl
关于不同比例Au/Pt合金纳米材料的相关表征结果如下所示:如图1所示, 透射电子显微镜(TEM)图像显示这些不同比例的Au/Pt合金粒径均一,分散性良好;动态光散射(DLS)结果表明不同Au/Pt比例合成的Au/Pt合金的水合动力学粒径约为10-20 nm,分散性良好。通过X射线衍射(XRD)进一步定性确认Au/Pt合金的形成(图2),不同Au/Pt比例的Au、Pt和Au/Pt合金的XRD衍射峰的结果表明,所制备的材料均具有面心立方(fcc)晶体结构。紫外-可见吸收光谱表明随着Pt组分的逐渐加入,在520 nm处由表面等离子体基元共振(Local Surface Plasmon Resonance, LSPR)效应引起的典型吸收峰逐渐消失,表明随着原料中Au、Pt组分比例的改变,Au元素的表面逐步被Pt元素占据,逐渐形成Au/Pt合金(图3)。
实施例2、Au/Pt纳米合金纳米材料催化性能表征。
葡萄糖氧化:检测葡萄糖酸的生成表征Au/Pt合金的催化葡萄糖氧化的性能。将不同比例的Au/Pt合金和C
H
电化学表征:测试时工作电极为Pt电极,对电极为石墨电极,参比电极为Ag/AgCl电极,结合工作电极构建三电极体系,磷酸缓冲液为电解液,电解液中C
电化学催化:借助于盐桥搭建产生离子电流,以pH=7.4的磷酸缓冲液为电解液,其中含有一定浓度的C
实施例3、Au/Pt 合金纳米材料对于PC12细胞毒性评价实验。
选用类神经细胞-大鼠肾上腺嗜铬细胞瘤细胞(PC12细胞),评价Au/Pt合金的生物相容性。采用PC12细胞评估材料的细胞毒性。将PC12细胞以每孔10
实施例4、Au/Pt 合金纳米材料在细胞水平的治疗效果评价。
将Au/Pt合金与培养成熟的皮层神经元共孵育,进行全细胞膜片钳的记录。采用Calcein AM/PI 细胞活性与细胞毒性检测试剂盒检测Au/Pt 合金对于使用KA诱导的神经兴奋性中毒的抑制效果。选用原代大鼠脑皮层神经元,待培养14天至神经元成熟后,将神级元细胞分为(1)对照组:继续培养皮层神经元;(2)Au/Pt组:加入含有100 ppm的Au/Pt的培养基;(3)KA组:加入含有KA的培养基;(4)KA+ Au/Pt组:加入含有KA及Au/Pt培养基。各组神经元共孵育24 h,利用KA诱导皮层神经元细胞持续去极化,使其处于癫痫样放电,之后去除各组细胞的培养基,并用PBS洗涤两遍。接下来,根据Calcein AM/PI检测试剂盒操作要求处理细胞,使用荧光共聚焦显微镜检测Calcein AM/PI荧光强度,从而进一步检测Au/Pt合金对于使用KA诱导皮层神经元细胞兴奋性中毒后细胞存活状态的影响。 如图9所示,空白组的大多数神经元基本呈正常状态(绿色);Au/Pt合金对照组表明材料对神经元的状态基本没有影响;神经元与KA共孵育24 h后,大多数神经元出现死亡(红色),表明KA引起持续性的癫痫活动将导致神经元兴奋性中毒,进而死亡。
实施例5、Au/Pt合金纳米颗粒处理癫痫模型的离体脑片实验。
将小鼠用异氟烷麻醉后断头处理,迅速将小鼠大脑完整取出,避免损伤脑组织。取出后放置于预冷的且用95% O
实施例6、Au/Pt 合金纳米颗粒处理癫痫小鼠模型的在体多通道电生理实验。
完成电极植入手术后,小鼠恢复一周,利用Plexon OmniPlex16信号采集系统对小鼠进行信号采集,主要采集小鼠在癫痫前后、以及Au/Pt干预前后海马区域的单细胞放电率(Spike)和局部场电位(LFP)的变化。设置系统参数:Spike的采样率设置为40 kHz,采样频率为300-8000 Hz,Spike的信噪比的比值大于2:1。LFP的采样率设置为1 kHz,采样频率为0.5-200 Hz。首先,提前半小时记录小鼠海马区域的电生理信号;然后通过给药电极,将KA(500 nL,0.3 mg/mL)溶液注射至小鼠的海马区域,诱发癫痫模型。通过实时检测电生理信号并观察小鼠的行为,当电生理信号出现较为明显的癫痫波信号并伴随着爆发放电,且小鼠有明显的癫痫发作时的抽搐行为,可判定癫痫模型诱发成功;最后,通过给药导管给癫痫状态下的小鼠注射Au/Pt合金纳米材料,采集在其干预状态下小鼠的脑电信号,观察Au/Pt合金对小鼠的癫痫发作是否具有改善作用。如图11所示,癫痫诱发后,通过在体多通道技术,记录在癫痫状态下的海马区域的局部场电位比正常情况下提升5倍,通过脑内核团给药将Au/Pt合金注射至小鼠的海马区域,当注射10 min后对小鼠进行行为观察并进行电生理检测,发现当Au/Pt合金注射20-30 min时,小鼠的抽搐行为明显减少且放电模式逐渐平稳,小鼠的局部场电位能量逐渐降低。综上所述,Au/Pt合金可以在异常放电情况下影响小鼠的电生理信号,显著抑制KA诱导的小鼠癫痫的发生发展。
