一种装载有铪键合血红素的纳米增敏剂及其制备和应用
文献发布时间:2024-04-18 20:01:55
技术领域
本发明属于肿瘤治疗技术领域,具体涉及一种装载有铪键合血红素的纳米增敏剂及其制备和应用。
背景技术
缺氧和肿瘤微环境(TME)的高度免疫抑制性质是肿瘤放射抗拒性的重要驱动因素。
在放疗过程中,放疗射线会诱导肿瘤细胞DNA双链断裂,导致肿瘤细胞的死亡。但由于肿瘤内血管迅速扩张,导致肿瘤内高度缺氧,加上其中存在的致密结缔组织和高水平间质压力,可使肿瘤对放疗产生抗拒。缺氧还可触发缺氧诱导因子(HIF)信号的激活,导致无节制的肿瘤增殖有利于增强侵袭性和转移进展,同时保护免疫介导的清除。肿瘤内高浓度的谷胱甘肽(GSH)和其他还原性物质能够修复辐射损伤,进一步限制了其疗效。
肿瘤微环境(TME)由基质、非恶性细胞、血管和肿瘤衍生因子组成,聚集在肿瘤发生部位。随着肿瘤的进展,TME发生一系列复杂的变化,包括缺氧、酸度水平升高和氧化还原稳态改变,这些通常导致抗肿瘤免疫受损。
气体疗法是一种肿瘤治疗方法,需要积累特定的气体信号分子,从而达到稳健的治疗效果。几种气体在一系列生理过程中发挥重要的内源性作用,包括一氧化氮、二氧化硫、一氧化碳和硫化氢。氢气可调节肿瘤细胞中的代谢活性,降低ATP水平并促进凋亡,而对正常细胞中的ATP水平无任何相应影响。由于氢气的超低分子量,可以穿过生物膜和致密的肿瘤微环境结构穿透到靶组织深处。因此开发能够在靶肿瘤内响应外部能量场释放氢气的纳米平台作为肿瘤治疗的方法带来了巨大的希望。氧气在治疗策略(包括放疗、化疗、光动力疗法和超声动力疗法)中也很重要,因为其能够调节肿瘤微环境的特征。在较高浓度的氧气作用下,HIF-1α在细胞内发生泛素化和蛋白酶介导的降解。因此,将提高这些气体水平的治疗方法与其他抗癌治疗策略相结合,为受影响患者的未来管理带来了巨大的希望。
发明内容
本发明的目的在于克服肿瘤微环境中的缺氧和免疫抑制、提高肿瘤对放疗的敏感性、提升治疗效果,提供一种纳米增敏剂及其制备方法和应用。
超声催化法指某些纳米材料能够介导超声波能量分裂水生成氢气和氧气,这两种气体可用于抗肿瘤治疗。本发明的纳米增敏剂适用于超声介导的氢气/氧气气体治疗,可激活抗肿瘤免疫。
本发明的目的通过下述技术方案实现:
一种纳米增敏剂,其为装载有铪键合血红素的纳米颗粒,所述的纳米颗粒优选为脂质体,所述的脂质体优选为聚乙二醇化脂质体。
所述的纳米增敏剂的制备方法,包括如下步骤:将铪盐溶液加到DSPE-PEG-NH
所述的纳米增敏剂的制备方法中,所述的铪盐包括氯化铪、硫酸铪、乙醇铪等;所述的血红素优选为氯化血红素;所述的铪盐溶液、DSPE-PEG-NH
所述的纳米增敏剂的制备方法,还包括离心、清洗沉淀的步骤。
进一步地,所述的纳米增敏剂的制备方法包括如下步骤:将10-40mg/mL的铪盐溶液滴加到10-20mg/mL的DSPE-PEG-NH
本发明的纳米增敏剂为装载有铪键合血红素的纳米颗粒,铪为高原子序数元素,能够在X射线照射下表现出特别高的光电吸收系数和二次电离,使其可以为周围细胞提供更大的辐射剂量,从而增强肿瘤内X射线沉积,增强对肿瘤细胞的杀伤。该纳米增敏剂还能够响应超声能力,将氢离子转化为氢气分子,快速生成大量氢气。该纳米增敏剂还能够分解肿瘤微环境内过高水平的H
所述的纳米增敏剂在制备肿瘤治疗药物中的应用。该纳米增敏剂能够与X射线照射和/或超声联合治疗肿瘤。
一种肿瘤治疗药物,包含所述的纳米增敏剂,还可包含药学上可接受的载体或赋形剂。
本发明相对于现有技术具有如下的优点及效果:相比于其他纳米增敏剂,装载有铪键合血红素的纳米增敏剂不仅能够增强射线在肿瘤靶区的沉积,还能够在超声介导下产生氢气和氧气,其中氢气能够降低肿瘤细胞内ATP水平,促进肿瘤细胞凋亡,而氧气能够改善肿瘤内乏氧的微环境,降低乏氧导致的肿瘤的放疗抗拒,这种策略能够有效改善肿瘤免疫抑制环境,起到高效消除肿瘤的效果。
附图说明
图1是装载有铪键合血红素的纳米增敏剂HAHf NPs的表征图。A:透射电子显微镜图,显示了HAHf NPs的形貌。B、C:X射线光电子能谱全谱以及铪精细谱,确认了材料中的主要元素的存在,确定了铪元素的结合能。D:(αhν)
图2是4T1细胞与不同浓度的HAHf NPs共孵育后的细胞存活率。
图3是装载有铪键合血红素的纳米增敏剂HAHf NPs用于体外乳腺肿瘤细胞4T1的治疗效果。A:4T1细胞在乏氧条件下经不同处理后的HIF-1α荧光染色图,显示HAHf NPs在超声介导下对乳腺肿瘤细胞乏氧缓解。B:CCK-8方法检测不同处理组的细胞存活率,证实HAHfNPs在超声介导下增强放疗效果对于乳腺肿瘤细胞的杀伤效果。C:γ-H2AX染色检测不同处理组细胞的DNA双链断裂情况。D:不同处理组的细胞克隆形成试验,显示了HAHf NPs在超声介导下增强放疗对于乳腺肿瘤细胞的增殖能力抑制效果。*P<0.05,**P<0.01,***P<0.005;Student t检验。
图4是装载有铪键合血红素的纳米增敏剂HAHf NPs促进体内超声催化介导的H
图5是不同处理组的荷瘤小鼠的肿瘤生长曲线(A)、体重变化曲线(B)。
图6是不同处理组的荷瘤小鼠的瘤内ATP含量。
图7是4T1肿瘤荷瘤小鼠经HAHf NPs治疗的肿瘤内免疫活性变化。A、B:流式细胞术分析(A)和M1和M2标记蛋白(分别为CD86和CD206)表达的定量(B)。C:Western免疫印迹评估肿瘤中M1标记物(TNF-α、iNOS)和M2标记物(精氨酸酶1、IL-10)的蛋白水平。D:IFN-γ的分泌。E、F:免疫组织化学染色(E)和肿瘤内CD8
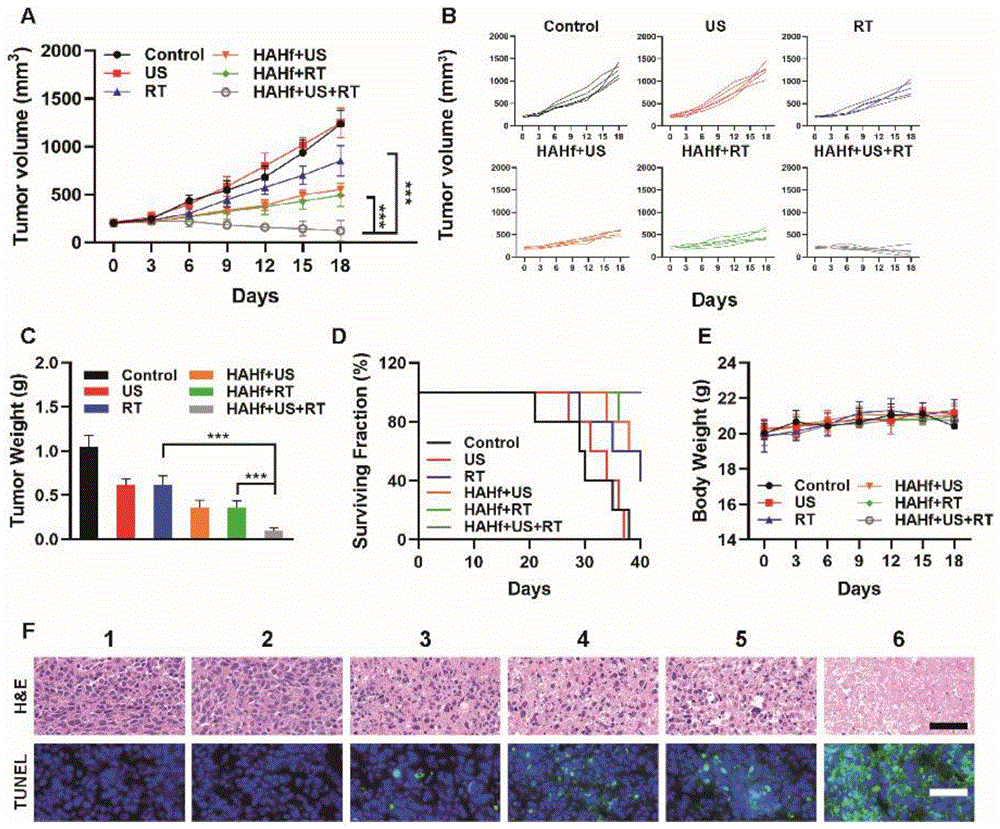
图8是装载有铪键合血红素的纳米增敏剂HAHf NPs用于体内肿瘤的治疗效果。A-C:各处理组的肿瘤体积(A、B)和重量(C)变化。D、E:小鼠存活率(D)和体重(E)的经时变化。F:各处理组小鼠的代表性肿瘤组织切片的TUNEL和H&E染色图,1-6分别是对照、US、RT、HAHf+US、HAHf+RT、HAHf+US+RT。*P<0.05,**P<0.01,***P<0.005;Student t检验。
具体实施方式
下面结合实施例对本发明作进一步详细的描述,但本发明的实施方式不限于此。
本发明提供的装载有铪键合血红素的纳米增敏剂的制备方法,其具体可包括如下步骤:将1mL氯化铪甲醇溶液(10-30mg/mL)或硫酸铪甲醇溶液(10-40mg/mL)或乙醇铪乙醇溶液(10-30mg/mL)滴加到5mL DSPE-PEG-NH
实施例1装载有铪键合血红素的纳米增敏剂(HAHf NPs)的制备和表征
将1mL氯化铪甲醇溶液(20mg/mL)滴加到5mL DSPE-PEG-NH
透射电子显微镜图显示HAHf NPs为球形形状、平均粒径400nm(图1A)。XPS光谱分析证实了HAHf NPs中存在C1s、O 1s和Hf 4f峰(图1B),而XPS精细光谱扫描显示结合能为17.38eV和18.97eV的峰分别归因于Hf 4f7/2和Hf 4f5/2(图1C)。(αhν)
实施例2装载有铪键合血红素的纳米增敏剂(HAHf NPs)的细胞毒性
为了评估HAHf NPs的生物相容性,通过CCK-8法对其细胞毒性进行了分析。浓度高达100μg/mL的HAH fNPs与4T1细胞共同孵育24小时后,4T1细胞仍保持90%以上的存活率(图2)。
实施例3装载有铪键合血红素的纳米增敏剂(HAHf NPs)用于体外乳腺肿瘤细胞4T1的治疗
检测HAHf NPs消除缺氧和杀死肿瘤细胞的能力。
首先测试了乏氧条件下HAHf介导的超声产氧的能力,4T1细胞经过不同处理(对照组、HAHf组、HAHf+US组。以HAHf+US组为例,4T1细胞加入浓度50μg/mL HAHf NPs共培育4小时后,进行超声,US强度1W/cm
将4T1细胞分为6组处理(1:对照组;2:US组;3:RT组;4:HAHf+RT组;5:HAHf+US组;6:HAHf+US+RT组)使用CCK-8方法检测细胞存活情况。以HAHf+US+RT组为例,4T1细胞加入浓度50μg/mL HAHf NPs共培育4小时后,进行超声,US强度1W/cm
实施例4超声介导下装载有铪键合血红素的纳米增敏剂(HAHf NPs)促进体内的H
使用光声(PA)成像监测体内氧合血红蛋白相关的PA信号随时间的变化。使用4T1细胞在BALB/c小鼠右后臀构建皮下瘤模型,待肿瘤体积增长至400mm
进一步评估该治疗缓解肿瘤内的缺氧的能力。使用4T1细胞构建BALB/c小鼠皮下瘤模型,待肿瘤体积达到约400mm
实施例5装载有铪键合血红素的纳米增敏剂(HAHf NPs)有利于M2样肿瘤相关巨噬细胞的促炎性M1重编程
首先,将10
接下来,评估HAHf+US这种治疗方式促进皮下4T1肿瘤荷瘤小鼠肿瘤相关巨噬细胞(TAMs)体内复极化的能力。肿瘤体积以及小鼠体重观察结束后,在观察的第18天,取小鼠肿瘤或者脾脏或者血液进行流式细胞仪分析。结果发现,在对照组、US组或HAHf组的肿瘤中M2TAMs的高频率明显,与US或HAHf单独不能促进巨噬细胞复极化一致(图7A,B)。相反,HAHf+US组M2 CD206+信号水平下降,CD86+M1样TAMs频率相应增加,与M2-M1复极化一致。这些数据表明,US照射后HAHf介导的H
上述结果表明,HAHf治疗可通过诱导M2-M1巨噬细胞复极化和瘤内CD8
实施例6装载有铪键合血红素的纳米增敏剂(HAHf NPs)用于体内肿瘤的治疗
将10
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
