用于测量药物产品效力的基于细胞的测定
文献发布时间:2023-06-19 10:27:30
本申请要求2018年6月8日提交的美国临时专利申请号62/682,263的优先权,将该文献的内容通过援引以其全文并入本文。
本申请含有序列表,该序列表已以ASCII格式通过EFS-Web提交并且特此通过援引以其全文并入。2019年6月4日创建的所述ASCII拷贝名为AVEX-004001WO_ST25.txt且大小为25千字节。
背景技术
腺相关病毒(AAV)是细小病毒科(parvoviridae)的成员。AAV基因组由线性单链DNA分子构成,该分子含有大约4.7千碱基(kb)并且由编码非结构性Rep(复制)和结构性Cap(衣壳)蛋白的两个主要开放阅读框组成。侧接AAV编码区的是两个顺式作用的核苷酸反向末端重复(ITR)序列,长度为大约145个核苷酸,具有中断的回文序列,这些回文序列可以折叠成在DNA复制起始期间作为引物发挥功能的发夹结构。除了它们在DNA复制中的作用外,已显示ITR序列对于病毒整合、从宿主基因组中拯救以及将病毒核酸衣壳化为成熟病毒体也是必需的。
源自AAV的载体对于递送遗传物质特别有吸引力,因为(i)它们能够感染(转导)多种多样的非分裂和分裂细胞类型,包括肌肉纤维和神经元;(ii)它们缺乏病毒结构基因,从而消除了天然宿主细胞对病毒感染的应答,例如干扰素介导的应答;(iii)野生型病毒从未发现与人类的任何病理相关;(iv)与能够整合到宿主细胞基因组中的野生型AAV相比,复制缺陷型AAV载体通常作为附加体存留,因此限制了插入诱变或激活致癌基因的风险;以及(v)与其他载体系统相比,AAV载体不会触发显著的免疫应答(参见ii),因此允许治疗性转基因的长期表达(前提条件是其基因产物不被排斥)。
自身互补型腺相关病毒(scAAV)是由天然存在的腺相关病毒(AAV)工程化以用于在基因疗法中使用的病毒载体。scAAV被称为“自身互补型”,因为编码区已被设计为形成分子内双链DNA模板。标准单链AAV基因组的基因表达中的限速步骤涉及第二链合成,因为典型的AAV基因组是单链DNA模板。然而,对于scAAV基因组并非如此。感染后,scAAV的两个互补半部分将缔合而不是等待第二链的由细胞介导的合成,以形成一个准备立即复制和转录的双链DNA(dsDNA)单元。
脊髓性肌萎缩(SMA)是一种严重的神经肌肉疾病,该疾病是由SMN1基因的遗传缺陷引起的,引起运动神经元的丧失并导致进行性肌无力和瘫痪。基于疾病发作和严重程度,将SMA分为子类-SMA 1、2、3和4型,它们通常与运动神经元存活(SMN)蛋白水平相关联。
由于SMA的单基因性质(这意味着它是由单一基因的缺失或突变引起的),经由使用病毒载体(作为传递载体)进行基因疗法是一种非常适合治疗该疾病的方法。先前已确定AAV9是适用于SMA基因疗法的病毒载体,其中已将它用于SMA 1型和SMA 2型。该病毒载体已显示出将全功能性人SMN基因递送至靶运动神经元细胞中,产生足以改善运动神经元功能所需的水平的SMN蛋白,并且除了持续SMN蛋白表达外,还提供了快速起效的作用。
然而,仍需要开发旨在用于AAV9药物产品的批次处置的用于测定相对效力的基于细胞的稳健定量体外测定。迄今为止,没有一种所测试的转化或原代细胞(人类或鼠类)(包括在使用基于AAV9的病毒载体进行感染滴度测试中通常使用的HeLa RC32细胞系)显示出容许AAV9载体的事实阻碍了基于细胞的稳健定量体外效力测定的开发。
在本披露内容中,首次提供了源自SMN1-/-遗传背景下的神经祖细胞的终末分化非分裂细胞(源自NPC的终末分化细胞,在下文中称为mTD-NPC-Δ7),这些终末分化非分裂细胞能够被非复制型AAV9载体有效地转导。更重要的是,将这些细胞用于体外细胞模型系统,以开发基于细胞的定量测定来使用对目的蛋白具有特异性的单克隆抗体通过高内涵成像系统测量在渐增的感染复数(MOI)下转导AAV9载体后目的蛋白表达的剂量依赖性增加。
发明内容
在一方面,本披露内容提供了用于测量转基因表达的方法,该方法包括以下步骤:(a)培养多个细胞,其中这些细胞包含病毒载体,其中该病毒载体包含转基因,其中该培养是在足以从该转基因表达目的蛋白的条件下;(b)孵育该多个细胞以允许该目的蛋白的转基因表达跟着发生;(c)使该多个细胞与对该目的蛋白具有特异性的分子接触;(d)对细胞进行成像,以获得积分荧光强度/细胞(IFI-C)测定读出;并且,(e)基于该IFI-C读出测定该转基因的表达。
在相关方面,本披露内容提供了测量或定量多个细胞中的病毒感染滴度的方法,该方法包括以下步骤:(a)培养多个细胞,其中这些细胞包含病毒载体,其中该病毒载体包含转基因,其中该培养是在足以从该转基因表达目的蛋白的条件下;(b)孵育该多个细胞以允许该目的蛋白的转基因表达跟着发生;(c)使该多个细胞与对该目的蛋白具有特异性的分子接触;(d)对细胞进行成像,以获得积分荧光强度/细胞(IFI-C)测定读出;并且,(e)基于该IFI-C读出测定该转基因的表达。
在另一个方面,本披露内容提供了用于测量转基因表达的方法,该方法包括:(a)提供第一多个终末分化神经祖细胞(NPC);(b)用包含病毒载体的测试样品转导该第一多个终末分化NPC,该病毒载体包含编码目的蛋白的序列;(c)在足以表达该目的蛋白的条件下孵育所转导的第一多个终末分化NPC;(d)使来自(c)的该第一多个终末分化NPC与对该目的蛋白具有特异性的分子接触;(e)对该第一多个终末分化NPC进行成像,以获得积分荧光强度/细胞(IFI-C)测定读出;并且(f)基于该IFI-C读出测定该目的蛋白的表达。
在本披露内容的方法的一些方面,该第一多个终末分化NPC对于运动神经元存活基因(SMN1)-/-突变是纯合的。在一些方面,该SMN1-/-突变包括SMN1外显子7的缺失(Δ7)。在一些方面,孵育步骤c)之后是固定和透化该第一多个终末分化NPC。
在另一个方面,本披露内容提供了包括以下项的方法:(g)提供第二多个终末分化NPC;(h)用包含该病毒载体的参考标准品转导该第二多个终末分化NPC;(i)在足以表达该目的蛋白的条件下孵育所转导的第二多个终末分化NPC;(j)使来自(i)的该第二多个终末分化NPC与对该目的蛋白具有特异性的分子接触;(k)对该第二多个终末分化NPC进行成像,以获得积分荧光强度/细胞(IFI-C)测定读出;并且(l)比较该第一多个终末分化NPC的IFI-C与该第二多个终末分化NPC的IFI-C;从而测定该测试样品的该病毒载体相对于该参考标准品的相对效力。
在本披露内容的方法的一些方面,该第二多个终末分化NPC对于SMN1-/-突变是纯合的。在一些方面,该SMN1-/-突变包括SMN1外显子7的缺失(Δ7)。
在一些方面,孵育步骤(i)之后是固定和透化该第二多个终末分化NPC。
在一些方面,所述第一多个终末分化NPC和所述第二多个终末分化NPC是通过使从SMN1-/-小鼠胚胎的皮层分离的神经祖细胞终末分化而产生的。在一些方面,这些神经祖细胞(NPC)是通过以下方式终末分化的:(a)将这些NPC在含有表皮生长因子(EGF)和碱性成纤维细胞生长因子(bFGF)的无血清培养基中培养以形成神经球;(b)解离所述神经球以产生经解离的NPC;并且(c)将这些经解离的NPC在不具有生长因子的富血清培养基中培养,从而产生终末分化NPC。
在本披露内容的方法的一些方面,所述第一多个细胞和所述第二多个细胞被该测试样品和该参考标准品在该病毒载体的至少两种不同的感染复数(MOI)下转导。在一些方面,所述第一多个细胞和所述第二多个细胞在该测试样品和该参考标准品中的该病毒载体的5种不同的MOI下被转导。在一些方面,该5种MOI包括300,000、150,000、75,000、37,500、18,750个病毒颗粒/细胞。
在本披露内容的方法的一些方面,比较步骤(l)包括针对该测试样品和该参考标准品中的每一种绘制MOI相对于IFI-C的标准曲线。在一些方面,该比较步骤(l)包括针对该测试样品和该参考标准品中的每一种计算log MOI相对于IFI-C的线性回归,从而得出测试样品斜率和参考标准品斜率。
在本披露内容的方法的一些方面,测定该病毒载体的相对效力是通过平行线分析(PLA)来进行,并且其中该PLA包括测量该测试样品斜率相对于该参考标准品斜率的斜率比。在一些方面,该参考标准品斜率大于或等于1.02E+05。在一些方面,该斜率比在0.69-1.45之间。在一些方面,该斜率比在0.75与1.33之间。
在本披露内容的方法的一些方面,这些方法包括计算该样品的线性回归的变异系数。在一些方面,该变异系数在15.6%与29.5%之间。在一些方面,该变异系数小于或等于40%、小于或等于30%或小于或等于20%。
在本披露内容的方法的一些方面,这些方法包括计算该测试样品和该参考标准品的线性回归的R
在本披露内容的方法的一些方面,这些方法包括计算该参考标准品的测定动态窗。在一些方面,该测定动态窗大于或等于2.69。
在本披露内容的方法的一些方面,该目的蛋白是运动神经元存活(SMN1)蛋白。在一些方面,该SMN1蛋白包含SEQ ID NO:3的氨基酸序列。
在本披露内容的方法的一些方面,该病毒载体是腺相关病毒血清型9(AAV9)。在一些方面,该病毒载体包含与编码该SMN1蛋白的序列可操作地连接的编码巨细胞病毒(CMV)增强子/鸡-β-肌动蛋白杂合启动子(CB)的序列。在一些方面,该病毒载体包含来自AAV血清型2(AAV2)DNA的AAV反向末端重复序列(ITR)。在一些方面,该病毒载体包含SEQ ID NO:1的序列。
在本披露内容的方法的一些方面,将这些细胞在用该病毒载体转导之前传代8至15次。
在本披露内容的方法的一些方面,在转导后孵育这些终末分化NPC的步骤进行约69-75小时(h)。
在本披露内容的方法的一些方面,对该目的蛋白具有特异性的该分子包括抗体、抗体片段或适体。在一些方面,该抗体包括对该目的蛋白具有特异性的抗体。在一些方面,以约4μg/mL的浓度提供该抗目的蛋白抗体。在一些方面,以约2μg/mL的浓度提供该抗目的蛋白抗体。在一些方面,该分子包括可检测标记。
在本披露内容的方法的一些方面,这些方法进一步包括使这些终末分化NPC与特异性识别对该目的蛋白具有特异性的该分子的第二分子接触。在一些方面,该第二分子包括可检测标记。在一些方面,该第二分子包括抗体、抗体片段或适体。
在本披露内容的方法的一些方面,在该固定和透化步骤之后,使这些终末分化NPC与抗细胞核可检测标记接触。
在本披露内容的方法的一些方面,这些终末分化NPC在固体表面上。在一些方面,该固体表面包被有聚D-赖氨酸。在一些方面,以20,000个细胞/孔的密度接种这些终末分化NPC。
在另一个方面,测量或定量多个细胞中的病毒感染滴度的方法进一步包括优化该多个细胞的感染复数(MOI)。
在另一个相关方面,在步骤a)之前用该病毒载体转导该多个细胞。在另一个方面,孵育步骤b)之后是固定和透化该多个细胞。
在另一个相关方面,测定病毒载体测试样品的相对效力的步骤是在线性回归数据拟合之后通过相对于参考标准品的标准曲线进行平行线分析(PLA)来进行。
在另一个方面,该病毒载体是腺相关病毒血清型9(AAV9),该腺相关病毒血清型9包含在巨细胞病毒(CMV)增强子/鸡-β-肌动蛋白杂合启动子(CB)的控制下表达SMN1蛋白的cDNA、和来自AAV血清型2(AAV2)DNA的AAV反向末端重复序列(ITR)。
在另一个相关方面,用病毒载体转导的细胞是终末分化非分裂细胞。
在另一个方面,该细胞源自SMN1-/-遗传背景下的神经祖细胞(mTD-NPC-Δ7)。
在另一个方面,该IFI-C读出反映了蛋白质表达的量度。
在另一个方面,对该目的蛋白具有特异性的该分子包括抗体、抗体片段或适体。在另一个方面,该抗体包括对该目的蛋白具有特异性的抗体。
在另一个方面,该分子包括可检测标记。
在另一个方面,该方法进一步包括洗涤这些细胞以去除对该目的蛋白具有特异性的该分子。
在另一个方面,该方法进一步包括使这些细胞与特异性识别对该目的蛋白具有特异性的该分子的第二分子接触。在另一个方面,该第二分子包括可检测标记。在另一个方面,该第二分子包括抗体、抗体片段或适体。在另一个方面,在该固定和透化步骤之后,使该细胞与抗细胞核可检测标记接触。
在另一个方面,该方法允许定量测量该目的蛋白的水平的剂量依赖性增加。
在另一个方面,该目的蛋白是运动神经元存活(SMN1)蛋白。
本披露内容提供了试剂盒,这些试剂盒包括:(a)能够用病毒载体转导的多个细胞;(b)编码目的蛋白的病毒载体;(c)能够结合该目的蛋白的第一分子;(d)能够结合该第一分子的第二分子,其中该第二分子包括可检测标记;以及,(e)在成像测定中的使用说明书。
本披露内容提供了产生包含含有转基因的病毒载体的药物组合物的方法,该方法包括:(a)产生该含有该转基因的病毒载体;(b)根据本披露内容的用于测量该转基因的方法测定所述病毒载体;并且(c)将该含有该转基因的病毒载体配制在药物组合物中。
本披露内容提供了用包含含有转基因的病毒载体的疗法治疗有需要的患者的方法,该方法包括:(a)根据本披露内容的测量转基因表达的方法测定所述含有转基因的病毒载体;并且(b)将该含有转基因的病毒载体施用至所述患者。
在本披露内容的方法的一些方面,该病毒载体的相对效力是相对于参考标准品的至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、至少99.5%、至少99.9%、至少100%、至少110%、至少120%、至少130%或至少140%。在一些方面,该病毒载体的相对效力是相对于该参考标准品的至少90%。
在本披露内容的方法的一些方面,该药物配制品中该病毒载体的效力在该参考标准品的效力的5%内、该参考标准品的效力的10%内或该参考标准品的效力的20%内。
上述方面中的任一个都可以与任何其他方面组合。
除非另外定义,否则本文中使用的所有技术术语和科学术语具有与本披露内容所属领域的普通技术人员通常所理解的含义相同的含义。
如本文所使用,除非上下文另外明确指出;否则,单词的单数形式也包括单词的复数形式;作为实例,术语“一个/种(a、an)”和“该(the)”被理解为单数或复数,并且术语“或”被理解为是包括性的。举例来说,“一个/种要素”是指一个/种或多个/种要素。
在本说明书通篇中,单词“包含(comprising)”或变型诸如“包含(comprises)”应理解为暗示包括所述要素、整体或步骤,或要素、整体或步骤的组,但不排除任何其他要素、整体或步骤,或要素、整体或步骤的组。在本说明书通篇中,单词“由……组成(consistingof)”或变型诸如“由……组成(consists of)”应理解为暗示包括所述要素、整体或步骤,或要素、整体或步骤的组,并且排除任何其他要素、整体或步骤,或要素、整体或步骤的组。在本说明书通篇中,单词“基本上由……组成(consisting essentially of)”或变型诸如“基本上由……组成(consists essentially of)”应理解为暗示包括所述要素、整体或步骤,或要素、整体或步骤的组,以及不会实质上影响所要求保护的发明的基本和新型特征的任何其他要素、整体或步骤,或要素、整体或步骤的组。
约可理解为在所述值的10%、9%、8%、7%、6%、5%、4%、3%、2%、1%、0.5%、0.1%、0.05%或0.01%内。除非上下文中另外清楚地指出,否则本文提供的所有数值均由术语“约”修饰。
尽管可以在本披露内容的实践或测试中使用类似于或等效于本文所述的方法和材料的方法和材料,但适合的方法和材料描述如下。本文提及的所有出版物、专利申请、专利以及其他参考文献通过援引以其全文并入。本文引用的参考文献不被视为是针对所要求保护的披露内容的现有技术。当发生冲突时,以包括定义在内的本说明书为准。此外,材料、方法和实例仅是说明性的而非旨在具有限制性。根据以下具体实施方式和权利要求,本披露内容的其他特征和优点将是清楚的。
附图说明
本专利或申请文件含有至少一幅以彩色绘制的附图。在提出请求并支付必要费用后,专利局将提供具有彩色附图的本专利或专利申请公布案的副本。
可以将以上方面和实施例中的任一个与本文在发明内容和/或具体实施方式部分中披露的任何其他方面或实施例组合。
通过结合附图参考以下具体实施方式和所附权利要求,本发明的各种目的和优点以及对本发明的更完全理解是清楚的并且更容易理解,在附图中:
图1展示了主/工作库系统。
图2展示了分层的主/工作库系统。
图3A至3C展示了源自SMNΔ7小鼠的胚皮层的NPC的终末分化。(图3A)NPC源自在约e14.5处的小鼠SMN-/-胚皮层(中间图像)并且(图3B)在有丝分裂原(生长因子EGF和FGF)的存在下生长为增殖性神经球。(图3C)当从生长因子中移出并置于基于血清的培养基中时,可以将神经球解离并最终分化成包括GFAP+星形胶质细胞的CNS细胞。
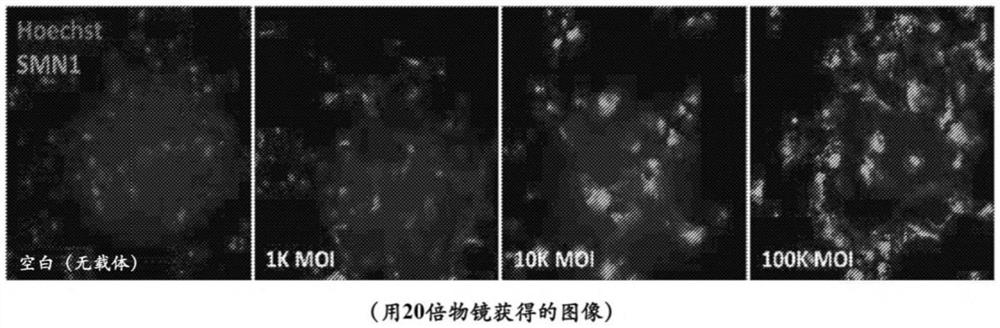
图4展示了在所指示的MOI下用AAV9-eGFP转导的mTD-NPC-Δ7的图像。
图5A至5B展示了以20,000个细胞/孔的细胞密度(细胞核染色)(图5A)和以10,000个细胞/孔的细胞密度(细胞核染色)(图5B)覆盖约40%的孔的图像的剪辑图。
图6展示了在用AAV9载体(批次号NCHAAV9SMN0613)转导后72小时处,SMN1(2B1)和细胞核(Hoechst33342)染色的图像。
图7展示了用AAAV9载体批次NCHAAV9SMN0613转导的mTD-NPC-Δ7的GFP和SMN1染色的图像(顶部)(底部图片是对照组)。
图8A至8B展示了接种在未包被板上的mTD-NPC-Δ7的细胞核染色(覆盖孔的40%的图像的剪辑图)(图8A)、和接种在聚D-赖氨酸包被板上的mTD-NPC-Δ7的细胞核染色(覆盖孔的40%的图像的剪辑图)(图8B)。
图9A至9B展示了在转导后72小时处AAV9-eGFP转导的mTD-NPC-Δ7的图像(图9A)和在转导后48小时处AAV9-eGFP转导的mTD-NPC-Δ7的图像(图9B)。
图10展示了对于SMN1编码AAV9载体转导的mTD-NPC-Δ7的SMN1(绿色)和细胞核(蓝色)染色的图像(转导后72小时)。
图11展示了对于在各种感染复数(MOI)下用NCH0613转导的mTD-NPC-Δ7的SMN1(绿色)和细胞核(蓝色)染色的图像(转导后72小时)。
图12展示了积分荧光强度/细胞(IFI-C)的12点剂量数据的曲线拟合(左:未变换的,右:在x轴上对数变换的)。
图13展示了log MOI相对于IFI-C的拟合线图。
图14展示了IFI-C相对于log MOI的散点图,显示对于所有五个平行测定的线非常接近。所有五个平行测定均通过成对并行性检验(所有p值>0.25)。
图15A至15C展示了AAV9载体的体外相对效力测定在使用基于mNPC的测定平台的定量感染性测定中的应用。
图16A至16B展示了概念验证研究,以确立针对感染滴度EC
图17是展示使用三种不同的抗SMN抗体浓度,SMN的等效剂量依赖性增加的图。
图18是使用CellInsight高内涵筛选系统获取的细胞核的示例图像。
图19是展现测量相对效力与预期相对效力之间的线性的图。正方形指示几何均值,圆圈指示单独值。x轴显示预期相对效力(%),y轴显示测量相对效力(%)。
图20A至20B是示出了通过使用SMN1抗体对用SMN1编码AAV9载体或MECP2编码AAV9载体转导的细胞进行染色而展现的特异性的一对图。图20A示出了用抗SMN1抗体染色的细胞。空心圆圈指示用SMN1编码AAV9载体转导的对照细胞,实心圆圈指示用MECP2编码AAV9载体转导的细胞。x轴显示log2 MOI(感染复数),并且y轴显示积分荧光强度/细胞(IFI-C)。图20B示出了用MECP2编码AAV9载体转导并用抗MECP2抗体染色的细胞。x轴显示log2 MOI,并且y轴显示IFI-C。通过以下展现出特异性:尽管AAV9-MECP2当通过抗MECP2抗体染色时显示出成功地转导了细胞,但是当通过抗SMN1抗体染色AAV9-SMN1载体转导的,而不是AAV9-MECP2载体转导的细胞时,指示外源性SMN1蛋白表达的IFI-C信号随渐增的MOI剂量展现剂量依赖性增加,如通过IFI-C的剂量依赖性增加所指示的。
图21展示了均匀性研究中使用的板布局。
图22是展示IFI-C的剂量依赖性增加的图。将mTD-NPC-Δ7细胞用AAV9-SMN1或者AAV9-MECP2载体转导,用抗SMN1或抗MeCP2染色,并且测量IFI-C。
图23是体外相对效力测定板的图像剪辑图。第1-7列通过抗SMN1抗体染色。第8-11列用抗MeCP2抗体染色。
图24是展示针对AAV9-MECP2转导的IFI-C的剂量依赖性增加的图。
图25是展示样品与参考标准品的斜率比估计值的汇总的图。
图26A示出了pSMN的质粒图谱。pSMN是编码重组自身互补型AAV DNA基因组的信息的质粒,该基因组在具有即刻/早期巨细胞病毒(CMV)增强子元件的鸡-β-肌动蛋白杂合启动子的控制下表达人运动神经元存活(SMN)cDNA。SMN cDNA编码全长的功能蛋白。表达盒含有源自猿猴病毒40(SV40)的修饰内含子序列和牛生长激素(BGH)聚腺苷酸化信号。表达盒(CMV-CB-SV40-SMN-BGHpA)侧接有AAV2来源的反向末端重复序列(ITR)。左ITR被修饰以优先包装自身互补型AAV基因组。在ITR之间且包括ITR的区域在制造最终药物产品期间被一起包装至重组AAV9衣壳中。不意图包装到重组AAV基因组中的关键pSMN组分包括编码对卡那霉素(KanR)的抗性的开放阅读框和源自pUC的复制起点(ori)。ori和KanR区域可用于质粒制造。
图26B示出了pHELP质粒的质粒图谱。pHELP质粒含有重组腺相关病毒生产所必需的反式作用腺病毒组分。pHELP质粒含有腺病毒基因组中的提供对AAV复制重要的因子的区域,即E2A、E4和VA RNA。涉及rAAV复制的腺病毒E1功能是通过转染宿主293细胞提供。然而,pHELP质粒不含有其他腺病毒复制或结构基因。此质粒中存在的腺病毒序列仅代表腺病毒基因组的约28%(9,280/35,938),并且不含有对复制至关重要的顺式元件,诸如反向末端重复序列。因此,预期不会从这种产生系统中产生感染性腺病毒。
图26C示出了AAV质粒的质粒图谱。野生型AAV基因组含有侧接rep和cap开放阅读框的两个非编码结构元件(称为反向末端重复序列)。Rep和cap分别编码病毒复制和衣壳蛋白。在重组腺相关病毒载体的产生中,病毒ITR是以顺式使用的唯一元件,而病毒开放阅读框是以反式提供的。使用瞬时转染粘附型HEK293细胞的方法制备AAV通过将不同遗传元件分至分开的质粒解决了这些遗传元件的顺式/反式作用。pAAV2/9质粒含有AAV2 rep基因和AAV9 cap基因的开放阅读框。
图27示出了用于选择HEK293细胞以进行异常粘附性和预主细胞库(MCB)建库的工艺流程图。
图28示出了用于选择HEK293细胞以进行异常粘附性和预主细胞库(MCB)建库的细胞处理细节的汇总。
图29描述了药物物质上游工艺流程图。
图30描述了药物物质下游工艺流程图。
图31示出了XMuLV被最长至120min时添加的吐温20的灭活。
图32示出了PRV被最长至120min时添加的吐温20的灭活。
图33描述了在细胞接种密度实验期间的HEK 293细胞扩增工艺流程。
图34A至34E示出了生长和代谢产物概况。将HEK 293细胞以12,000和8,000个细胞/cm
图35示出了病毒基因组产生随细胞接种密度(8000或12000个细胞/cm
图36示出了来自在整个制造工艺期间在不同的过滤步骤取样的中间物的病毒滴度。
图37A和37B示出了在TFF1步骤的病毒载体回收率和宿主细胞蛋白(HCP)清除率。
图38描述了在细胞接种密度实验期间的HEK 293细胞扩增工艺流程。
图39A至39E显示,将HEK 293细胞以8,000个细胞/cm
图40A至40B示出了在生物反应器中从四个起始接种密度的药物物质产生。示出了每单位表面积收获的病毒滴度和载体基因组的比较。
图41示出了1期(工艺A)和3期试验(工艺B)制造过程。
图42A至42B提供了展示可比性和制造一致性结果的表-工艺A(1期)和工艺B(3期)产品。与工艺A相比,工艺B产品显示出具有额外的益处。
图43示出了使用工艺A(1期批次NCHAAV9SMN0613)和工艺B(3期批次600156)的成对比较在工艺A与工艺B之间的可比性。与工艺A相比,工艺B产品显示出具有额外益处。
图44示出了通过成对比较工艺B(3期)批次600156和600307进行的制造一致性评估。
图45示出了在≤-60℃的实时存储条件下经12个月存储的NCH批次NCHAAV9SMN0613的稳定性概况。
图46示出了1期物料(NCHAAV9SMN0613)的沉降系数(s x10
图47示出了3期物料(600156)的沉降系数(s x10
图48示出了3期物料(600307)的沉降系数(s x10
具体实施方式
本发明披露内容提供了一种基于细胞的定量体外效力测定,其使用容许AAV9载体转导的细胞来评估效力,旨在用于批次处置表达目的蛋白的AAV9药物产品。在另一个实施例中,病毒载体药物产品是表达SMN1蛋白的AAV9载体。该测定利用源自SMN1-/-遗传背景下的神经祖细胞的终末分化非分裂细胞(源自NPC的终末分化细胞,在下文中称为mTD-NPC-Δ7),该终末分化非分裂细胞具有被非复制型AAV9载体有效转导的能力。使用mTD-NPC-Δ7作为体外细胞模型系统,开发了基于细胞的5天定量测定以使用对SMN蛋白具有特异性的可商购单克隆抗体通过高内涵成像系统测量在渐增的感染复数(MOI)下转导SMN1编码AAV9载体后SMN1蛋白水平的剂量依赖性增加。在一些实施例中,基于细胞的体外测定可以测量载体样品相对于参考标准品的效力。
本披露内容提供了用于测量编码目的蛋白的AAV载体的效力的基于细胞的体外测定。在一些实施例中,目的蛋白是SMN1,并且使用本文所述的方法测量了在缺乏SMN1的终末分化非分裂细胞中来自载体的SMN1表达。
在一个实施例中,本披露内容提供了用于测量转基因表达的方法,这些方法包括以下步骤:(a)培养多个细胞,其中这些细胞包含病毒载体,其中该病毒载体包含转基因,其中该培养是在足以从该转基因表达目的蛋白的条件下;(b)孵育该多个细胞以允许该目的蛋白的转基因表达跟着发生;(c)使该多个细胞与对该目的蛋白具有特异性的分子接触;(d)对细胞进行成像,以获得积分荧光强度/细胞(IFI-C)测定读出;并且,(e)基于该IFI-C读出测定该转基因的表达。
在另一个实施例中,提供了测量或定量多个细胞中病毒感染滴度的方法,该方法包括以下步骤:(a)培养多个细胞,其中这些细胞包含病毒载体,其中该病毒载体包含转基因,其中该培养是在足以从该转基因表达目的蛋白的条件下;(b)孵育该多个细胞以允许该目的蛋白的转基因表达跟着发生;(c)使该多个细胞与对该目的蛋白具有特异性的分子接触;(d)对细胞进行成像,以获得积分荧光强度/细胞(IFI-C)测定读出;并且,(e)基于该IFI-C读出测定该转基因的表达。
在另一个实施例中,这些测量或定量多个细胞中的病毒感染滴度的方法进一步包括优化该多个细胞的感染复数(MOI)。在另一个实施例中,提供了用于测量或定量多个细胞中病毒感染滴度的感染性测定。
在另一个实施例中,在步骤(a)之前用该病毒载体转导该多个细胞。在另一个实施例中,孵育步骤(b)之后是固定和透化该多个细胞。
在另一个实施例中,测定病毒载体的相对效力的步骤是在线性回归数据拟合之后通过相对于参考标准品的标准曲线进行平行线分析(PLA)来进行。平行线测定是一种计算相对效力的方法。在一些实施例中,对于稀释测定计算相对效力。
在一些实施例中,这些方法包括(a)提供第一多个终末分化神经祖细胞(NPC);(b)用包含病毒载体的测试样品转导该第一多个终末分化NPC,该病毒载体包含编码目的蛋白的序列;(c)在足以表达该目的蛋白的条件下孵育所转导的第一多个终末分化NPC;(d)使来自(c)的该第一多个终末分化NPC与对该目的蛋白具有特异性的分子接触;(e)对该第一多个终末分化NPC进行成像,以获得积分荧光强度/细胞(IFI-C)测定读出;并且(f)基于该IFI-C读出测定该目的蛋白的表达。
如本文所用,“测试样品”是指包含其滴度和/或效力未知并将使用本文所述的方法来测定的AAV病毒载体的样品,该AAV病毒载体包含编码目的蛋白的序列。
在一些实施例中,这些方法包括(g)提供第二多个终末分化NPC;(h)用包含该病毒载体的参考标准品转导该第二多个终末分化NPC;(i)在足以表达该目的蛋白的条件下孵育所转导的第二多个终末分化NPC;(j)使来自(i)的该第二多个终末分化NPC与对该目的蛋白具有特异性的分子接触;(k)对该第二多个终末分化NPC进行成像,以获得积分荧光强度/细胞(IFI-C)测定读出;并且(l)比较该第一多个终末分化NPC的IFI-C与该第二多个终末分化NPC的IFI-C;从而测定该测试样品的该病毒载体相对于该参考标准品的相对效力。
在一些实施例中,这些方法包括提供第三多个终末分化NPC、用包含该病毒载体的测定对照转导该第三多个终末分化NPC、在足以表达该目的蛋白的条件下孵育所转导的第三多个终末分化NPC;使该第三多个终末分化NPC与对该目的蛋白具有特异性的分子接触;对该第三多个终末分化NPC进行成像,以获得积分荧光强度/细胞(IFI-C)测定读出;并且比较该第三多个终末分化NPC的IFI-C与该第一多个终末分化NPC和/或该第二多个终末分化NPC的IFI-C;从而测定该体外效力测定的有效性。在一些实施例中,该测定对照是阳性对照。
在一些实施例中,平行地将多个终末分化NPC培养,用测试样品、参考样品和任选的测定对照转导,孵育、染色并成像。例如,可以将多个终末分化NPC在同一96孔板中培养,用测试样品、参考样品和任选的测定对照转导并进行进一步下游处理。
在一些实施例中,所述第一多个细胞和所述第二多个细胞被来自该测试样品和该参考标准品的病毒载体在至少两种不同的感染复数(MOI)下转导。在一些实施例中,该至少两种不同的MOI包括至少2种、至少3种、至少4种、至少5种、至少6种、至少7种、至少8种、至少9种、至少10种、至少11个或至少12种MOI。在一些实施例中,该至少两种不同的MOI包括5种不同的MOI。在一些实施例中,该5种MOI包括300,000、150,000、75,000、37,500、18,750个病毒颗粒/细胞。
在一些实施例中,这些方法进一步包括转导第三多个
在另一个实施例中,该病毒载体或包含该病毒载体的药物组合物保留了参考标准品的±20%之间、±15%之间、±10%之间、优选±5%的效力。在一个实施例中,该效力是如使用本文披露的方法相对于参考标准品评估的。可以使用任何合适的参考标准品。
如本文所用,“参考标准品”是指包含其浓度和/或效力是已知的AAV载体的组合物,该AAV载体编码目的蛋白。示例性参考标准品包括AAV-SMN1载体,该载体在小于或等于-60℃下储存直至使用、解冻一次,并在2℃-8℃下储存少于一周。
在一些实施例中,病毒载体的相对效力是相对于参考标准品的至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、至少99.5%、至少99.9%、至少100%、至少110%、至少120%、至少130%或至少140%。在一些实施例中,病毒载体的相对效力是相对于参考标准品的至少90%。
本发明的方法测定了由本文披露的病毒载体中存在的转基因表达的蛋白质的效力,其中转基因旨在用于递送至脑。设想用于递送的脑区域包括但不限于运动皮层和脑干。在一些实施例中,转基因递送至脊髓。在一些实施例中,转基因递送至下运动神经元。本发明的实施例采用rAAV9以将转基因递送至神经和神经胶质细胞。在一些实施例中,神经胶质细胞是小神经胶质细胞、少突胶质细胞或星形胶质细胞。在一些实施例中,rAAV9用于将转基因递送至施万细胞(Schwann cell)。
指示了本文披露的病毒载体的用途,例如用于治疗下运动神经元疾病,诸如SMA和ALS以及庞贝病、溶酶体贮积症、多形性胶质母细胞瘤和帕金森病。溶酶体贮积症包括但不限于激活因子缺乏症/GM2神经节苷脂贮积症、α-甘露糖苷贮积症、天冬氨酰葡糖胺尿症、胆固醇酯贮积病、慢性己糖胺酶A缺乏症、胱氨酸病、达农病(Danon disease)、法布里病(Fabry disease)、法贝尔病(Farber disease)、岩藻糖苷贮积症、半乳糖唾液酸贮积症、戈谢病(Gaucher Disease)(I型、II型、III型)、GMl神经节苷脂贮积症(婴儿型、晚期婴儿型/青少年型、成人型/慢性)、I-细胞病/黏脂贮积症II型、婴儿型游离唾液酸贮积病/IS SD、青少年型己糖胺酶A缺乏症、克拉伯病(Krabbe disease)(婴儿发病、晚期发病)、异染性脑白质营养不良、粘多糖贮积症(假性哈伦多发性营养不良(Pseudo-Hurler polydystrophy)/黏脂贮积症IIIA型、MPSI哈伦综合征、MPSI沙伊(Scheie)综合征、MPS I哈伦-沙伊综合征、MPS II亨特(Hunter)综合征、A型圣菲利柏(Sanfilippo)综合征/MPS III A、B型圣菲利柏综合征/MPS III B、C型圣菲利柏综合征/MPS III C、D型圣菲利柏综合征/MPS III D、莫奎欧氏症(Morquio)A型/MPS WA、莫奎欧氏症B型/MPS IVB、MPS IX透明质酸酶缺乏症、MPS VI马洛托-拉米症氏(Maroteaux-Lamy)、MPS VII史莱氏(Sly)综合征、黏脂贮积症1型/唾液酸贮积症、粘脂质贮积症IIIC型、黏脂贮积症IV型)、多发性硫酸酯酶缺乏症、尼曼-匹克病(Niemann-Pick Disease)(A型、B型、C型)、神经元蜡样质脂褐质沉积症(CLN6病(非典型晚期婴儿型、晚期发病变型、早期青少年型)、巴-斯-沃(Batten-Spielmeyer-Vogt)三氏/青少年型NCL/CLN3病、芬兰变异晚期婴儿型CLN5、詹-比(Jansky-Bielschowsky)二氏病/晚期婴儿型CLN2/TPP1病、库夫斯(Kufs)/成人发病型NCL/CLN4病、北方癫痫型/变异晚期婴儿型CLN8、圣-霍(SantavuoriHaltia)二氏/婴儿型CLNl/PPT病、β-甘露糖苷贮积症、庞贝病/糖原贮积症II型、致密性成骨不全症、桑德霍夫病(Sandhoff Disease)/成人发病型/GM2神经节苷脂贮积症、桑德霍夫病/GM2神经节苷脂贮积症-婴儿型、桑德霍夫病/GM2神经节苷脂贮积症-青少年型、辛德勒(Schindler)病、莎拉(Salla)病/唾液酸贮积病、戴萨克斯症(Tay-Sachs)/GM2神经节苷脂贮积症、沃尔曼(Wolman)病。
指示了本文披露的病毒载体例如用于治疗SMA的用途。
在进一步的实施例中,指示了这些方法和材料用于治疗神经系统疾病,诸如雷特综合征、阿尔茨海默病、帕金森病、亨廷顿病,或用于治疗神经系统损伤,包括脊髓和脑创伤/损伤、中风和脑癌的用途。
“治疗”包括将有效剂量或有效多个剂量的包含本发明的rAAV的组合物静脉内或经由鞘内途径施用至有需要的动物(包括人类)的步骤。如果剂量在障碍/疾病发展之前施用,则该施用是预防性的。如果剂量在疾病发展之后施用,则该施用是治疗性的。在本发明的实施例中,有效剂量是缓解(消除或者减少)与所治疗的障碍/疾病状态相关的至少一种症状、减慢或防止进展成障碍/疾病状态、减慢或防止障碍/疾病状态进展、减弱疾病的程度、导致疾病(部分或全部)缓解和/或延长存活期的剂量。上文列出了设想本发明的方法治疗的疾病状态的实例。
本文提供了用于产生终末分化NPC,并在基于细胞的体外效力测定中使用终末分化NPC以测定编码目的蛋白的AAV载体的相对效力的方案。在一些实施例中,AAV载体的效力是相对于参考标准品测定的。本文提供的方案可用于测定在药物组合物(例如药物物质和药物产品组合物)中AAV-SMN1载体的效力,以及评估载体稳定性。
用于进行方案的材料对于本领域普通技术人员而言将是已知的。示例性材料包括组织培养处理烧瓶(T75、T150和T175)、带盖的聚丙烯离心管15和50mL、移液管(单通道P1000、P200和P20以及8或12通道P1000和P300)、康宁BioCoat聚D-赖氨酸96孔板(康宁354640)、光学透明板密封件(飞世尔品牌8408240)、试剂存储容器、PIPET-AID、Cellometer载玻片(耐细隆公司(Nexcelom),CHT4-SD100-002),96孔DeepWell
如本文实例中所提供的,NPC是在胚胎期约14.5(e14.5)处从SMAΔ7(SMN1-/-)小鼠品系的胚胎的皮层中收集的。然后可以将这些细胞解离成单一细胞。在培养期间,细胞形成为未分化细胞的3维集落的神经球。大约3-5天后,然后可以将神经球通过解离成单一细胞进行传代,并使其形成次级球。为了终末分化NPC,然后可以将神经球解离并以1E+06个细胞/孔接种在0.5mL(24孔板,福尔肯公司(Falcon)),或以2E+05个细胞/孔接种在100μL(96孔板,康宁公司)不具有生长因子的富血清培养基中。在分化后约24小时,细胞变得主要终末分化为神经胶质谱系。
如本文所用,术语“细胞系”是指能够在体外连续或延长生长和分裂的细胞群。在本领域中进一步已知在此类克隆群体的储存或转移期间,核型可能发生自发性或诱导性变化。因此,源自所提及细胞系的细胞可能与祖先细胞或培养物不完全相同,并且所提及的细胞系包括此类变体。
在一个实施例中,本文披露的用于在披露的基于细胞的测定中使用的终末分化非分裂细胞源自SMN1-/-遗传背景下的神经祖细胞(源自NPC的终末分化细胞,在本文中称为“mTD-NPC-Δ7”)。这些细胞具有被非复制型AAV9载体有效转导的能力。
在一些实施例中,将从小鼠胚皮层分离并如本文所述培养的NPC-Δ7细胞冷冻(例如,在小于或等于-60℃下),然后用于基于细胞的体外效力测定中。
在一些实施例中,使用以下方案解冻NPC-Δ7细胞。在使用前,将完全生长培养基在37℃水浴或等效物中预热至少30分钟。从液氮储存器中移出mNPC细胞的经冷冻的冷冻小瓶。将小瓶保持在干冰上,直至它准备解冻,然后在37℃水浴中快速解冻,偶尔涡旋以确保解冻。用70%(v/v)异丙醇(IPA)擦拭小瓶表面,然后使用BSC中的无菌移液器将内容物转移至50mL离心管。解冻细胞后,将冷冻保护剂缓慢稀释以防止渗透性休克。约10-20mL通常足以克服毒性作用。以逐滴方式添加10-20mL的温热完全生长培养基,同时通过涡旋轻轻混合,之后在20℃下以300xg离心5分钟。吸出上清液,然后轻轻搅动管以破碎细胞沉淀物。将适当体积(例如1.0-2.0mL)的温热完全生长培养基添加至细胞并混合。
在一些实施例中,获得活细胞计数和活力。在一些实施例中,活细胞计数是≥60.0%活的以便继续进行。
在一些实施例中,将细胞转移至组织培养瓶,添加10.0mL的完全生长培养基,并且轻轻摇动烧瓶以确保均匀分布。然后将烧瓶在37℃和5%CO
在一些实施例中,NPC细胞对于SMN1(SMN1-/-)中的突变是纯合的。在一些实施例中,SMN1-/-中的突变是无效突变。在一些实施例中,SMN1-/-是外显子7的缺失(Δ7),并且细胞称为NPC-Δ7细胞。在一些实施例中,NPC分离自或源自小鼠胚皮层。
在一些实施例中,在用于本文所述的基于细胞的体外效力测定中之前,通过一轮或多轮传代培养NPC-Δ7细胞。
在一些实施例中,从解冻后的第二代开始,将NPC-Δ7细胞用于测定中。
在一些实施例中,将NPC-Δ7细胞在第8-15代用于在本文所述的基于细胞的体外效力测定中。解冻不被视为是一次传代。在一些实施例中,将细胞使用至第15代。例如,如果将工作细胞库在第6代(P6)或之后冷冻,则当解冻细胞时,它们保留的传代数为P6。在适当的细胞增殖天数后,将细胞通过用Accumax解离来进行传代,并成为P7。在P7,细胞不能用于测定。
在一些实施例中,将NPC-Δ7细胞通过用Accumax解离来进行传代(P8),然后可以用于体外效力测定。
随着细胞在悬浮液中增殖,它们形成称为神经球的3维集落。在一些实施例中,例如为了防止神经球生长太大并在中心变得坏死,每4±1天对细胞进行传代。
示例性细胞传代方案描述如下。在使用前,将基础培养基和完全生长培养基在37℃水浴或等效物中预热30分钟。示例性基础培养基包含DMEM/F12、GlutaMAX补充剂、2%B27补充剂(50x)和1%抗生素-抗真菌药。示例性完全生长培养基包括基础培养基、0.1%肝素(5mg/mL)、0.02%bFGF(碱性成纤维细胞生长因子)重组人蛋白(100g/mL)和0.005%EGF(表皮生长因子)重组人蛋白溶液(1mg/mL)。
在一些实施例中,为了对细胞进行传代,将含有细胞的烧瓶从培养箱中移出,并使用含有细胞的培养基冲洗烧瓶的表面。将细胞从烧瓶转移至50mL锥形管中,并以300xg离心5分钟。吸出上清液而不扰动细胞沉淀物,并添加200.0μL Accumax。轻轻研磨细胞沉淀物,然后在室温下孵育30±10分钟。
在Accumax孵育结束时,通过预热的基础培养基中和Accumax。在一些实施例中,添加400.0μL预热的基础培养基,并且将细胞轻轻研磨以完全解离成单一细胞。
在一些实施例中,再添加400.0μL预热的基础培养基以使总体积为1.0mL。
在一些实施例中,将细胞稀释至可接受的细胞密度范围。示例性细胞密度范围包括用于细胞计数的5.00E+05个细胞/mL至1.00E+07的范围。然而,普通技术人员将能够将细胞密度范围调整至适当的细胞计数方法。
在一些实施例中,将在相同传代数下、来自具有相同细胞参考品/批次的多个烧瓶的出售物汇集,之后进行细胞计数。
在一些实施例中,将细胞混合,然后移取出细胞的样品以测定活细胞计数和活力。
在一些实施例中,当每一次细胞计数的活力≥60.0%、≥70.0%、≥80.0%或≥90.0%时,制备mTD NPC-Δ7(终末分化NPCΔ7)板。在一些实施例中,当每一次细胞计数的活力≥80.0%时,制备mTD NPC-Δ7(终末分化NPCΔ7)板。
在一些实施例中,只有每一次细胞计数的活力是≥70.0%活的时才继续进行体外效力测定。
本披露内容提供了终末分化NPC以产生用于在本文所述的基于细胞的体外效力测定中使用的终末分化NPC的方法。在一些实施例中,终末分化NPC包含SMN1的外显子7的纯合缺失(mTD NPC-Δ7细胞)。
在一些实施例中,将板培养基用于终末分化NPC。示例性板培养基包含DMEM/F12、GlutaMAX补充剂、2%B27补充剂(50x)、1%抗生素-抗真菌剂和10%FBS。
在一些实施例中,将细胞在板培养基中稀释至20,000个细胞/孔/100μL(或2.00x10
在一些实施例中,将100μL细胞轻轻混合并添加至96孔聚D-赖氨酸包被板的孔。
在一些实施例中,将一个或多个板在环境温度下静置25±5分钟,之后将铺板的细胞放置于37℃、5%CO
在一些实施例中,将铺板的细胞在37℃、5%CO
在一个实施例中,术语“转染”在本文中与术语“转导”可互换使用,并且术语或者其语法等同物用于指细胞摄取外来DNA,并且细胞已被“转染”或“转导”是指外源DNA已被引入细胞膜内部的情况。多种转染技术通常是本领域已知的。参见例如Graham等人(1973)Virology[病毒学],52:456;Sambrook等人(1989)Molecular Cloning,a laboratorymanual[分子克隆实验指南],Cold Spring Harbor Laboratories[冷泉港实验室],NewYork[纽约];Davis等人(1986)Basic Methods in Molecular Biology[分子生物学基本方法],Elsevier[爱思唯尔];以及Chu等人(1981)Gene[基因]13:197。此类技术可用于将一个或多个外源DNA部分引入合适的宿主细胞中。
用于转导细胞的合适方法是本领域已知的。在一个实施例中,通过将病毒载体与细胞组合来体外转导细胞。在一个实施例中,通过将AAV9载体与细胞组合来体外转导细胞。在一个实施例中,通过将SMN1编码AAV9载体与细胞组合来体外转导细胞。在一个实施例中,将AAV9在分化后约24小时与细胞组合。在另一个实施例中,将其在分化后约12-24小时与细胞组合。在另一个实施例中,将其在分化后约24-32小时与细胞组合。
在一个实施例中,可以使用任何合适的转染培养基。在一个实施例中,将用于细胞扩增的DMEM无血清生长培养基替换为经改良的DMEM转染培养基。在一个实施例中,转染培养基是没有FBS、没有钙、没有L-谷氨酰胺但具有4.5g/l葡萄糖的DMEM。
在一个特定的实施例中,将在转导后孵育细胞的步骤进行约69-75小时。在一些实施例中,将转导后孵育细胞的步骤进行约24-48小时、48-69小时或约75-90小时。
在一个实施例中,用本发明的rAAV转导患者的细胞导致由rAAV编码的多肽或RNA的持续表达。
在另一个实施例中,用病毒载体转导的细胞是终末分化非分裂细胞。在另一个实施例中,用病毒载体转导的细胞是终末分化非分裂原代细胞,诸如mTD NPC-Δ7细胞。
在一些实施例中,用包含含有编码SMN1蛋白的转基因的AAV载体的测试样品和参考标准品转导mTD NPC-Δ7细胞。在一些实施例中,用包含含有编码SMN1蛋白的转基因的AAV载体的测试样品、参考标准品和测定对照(例如,阳性对照,有时称为对照)转导mTDNPC-Δ7细胞。
在一些实施例中,如下制备AAV9-SMN1载体参考标准品(RS)、对照(Crtl)和测试样品。将参考标准品(RS)、对照和测试样品的等分试样在环境温度下解冻。在使用前,将配制缓冲液和板培养基在37℃水浴或等效物中预热至少30分钟。使用适当的预热配制缓冲液在1.5mL微量离心管中将样品预稀释至1.00E+12vg/mL(方案可针对其他浓度修改)。
在一些实施例中,进行系列稀释以制备不同的MOI,从而产生MOI相对于IFI-C的曲线图。例如,可以对300K MOI的起始浓度进行系列稀释以产生150K MOI、75K MOI、37.5KMOI和18.75K MOI下的RS、测试和测定/阳性对照样品。
在一些实施例中,将在所制备MOI下制备的样品轻轻混合,并立即以与96孔板的相应孔的壁成一定角度分配。将板转移至培养箱(37℃±1℃、5±1%CO2)。将板孵育72±2小时。
本文提供了针对目的蛋白对细胞进行染色的方法,所述目的蛋白例如SMN蛋白,诸如SMN1或SMN2,例如SMN1。这些对细胞进行染色的方法可用于本文所述的基于细胞的体外效力测定中。
在一个实施例中,对目的蛋白具有特异性的分子包括抗体、抗体片段或适体。在另一个实施例中,抗体包括对目的蛋白具有特异性的抗体。
抗体作为完整的免疫球蛋白或作为许多由各种肽酶消化产生的良好表征的片段存在。因此,例如,胃蛋白酶在铰链区中二硫键下方消化抗体以产生F(ab′)2,即Fab二聚体,所述Fab二聚体本身是通过二硫键连接至VH-CH1的轻链。可在温和条件下还原F(ab′)2以使铰链区中的二硫键断裂,从而将F(ab′)2二聚体转化成Fab′单体。Fab′单体基本上是具有铰链区的一部分的Fab(对于其他抗体片段的更详细描述,参见Fundamental Immunology[基础免疫学],W.E.Paul编辑,Raven Press[雷文出版社],New York[纽约](1999))。虽然各种抗体片段根据完整抗体的消化加以定义,但是本领域技术人员应认识到此类Fab′片段等可通过化学方法或利用重组DNA方法来从头合成。因此,如本文所使用的术语抗体还包括通过修饰整个抗体而产生的或使用重组DNA方法从头合成的抗体片段。抗体包括单链抗体,包括单链Fv(sFv或scFv)抗体,其中可变重链和可变轻链接合在一起(直接或通过肽接头)以形成连续多肽。
如上文所解释(参见在前的定义),本文使用的抗体任选地包含F(ab)2、F(ab′)2、Fab、Fab′、scFv等,这取决于实施例的具体要求。一些实施例利用替代性免疫球蛋白,诸如IgM、IgA、IgD和IgE。此外,各种免疫球蛋白的所有可能同种型也涵盖在当前的实施例内。因此,IgG1、IgG2、IgG3等都是所有可能用于在本发明使用的分子。
在一个实施例中,以约4μg/mL的浓度提供抗目的蛋白抗体。在另一个实施例中,以约1-4μg/mL、4-8μg/mL、8-12μg/mL、或12-16μg/mL的浓度提供抗目的蛋白抗体。在一个实施例中,以约2μg/mL的浓度提供抗目的蛋白抗体。
在另一个实施例中,分子包括可检测标记以实现检测。标记包括例如螯合的镧系金属(如铕)、铂族金属(如钌)、荧光染料(尤其包括黄嘌呤衍生物,如荧光素和若丹明或两者的任何衍生物)、荧光蛋白(如绿色荧光蛋白(GFP)及其衍生物黄色荧光蛋白(YFP)和红色荧光蛋白(RFP))、放射性标记(如碘125和锕-225)以及本领域已知的其他类似可检测标记。在一些实施例中,使用了无需进行洗涤步骤的可检测标记。
荧光标记基团通常基于其激发光谱、发射光谱或荧光寿命中的一种或多种而彼此区分。通过将不同波长的激发光分别引导在细胞处,然后可以测定由任何一种或多种不同的可检测标记产生的荧光水平。可替代地,选择可检测标记以具有可区别的荧光发射最大值,例如,它们以显著不同的波长发射光或发荧光。在操作中,将单一光源引导在细胞处。然后,使来自细胞的荧光发射通过滤光片,这些滤光片将不同的荧光发射物分开,然后分别对这些不同的荧光发射物进行定量。在选择可区分的激发或发射最大值时,通常优选的是一种标记例如参考标记的激发或发射光谱与另一标记的激发或发射光谱不明显重叠。具体地,虽然通常对于不同的标记具有最大的激发或发射波长,但是典型地存在具有一些激发或发射的较宽波长范围。典型地,选择标记以使得两个标记的激发或发射光谱之间基本上不存在重叠,例如,在检测一种标记时,少于10%的荧光是由于与另一标记的重叠所致。
在一个实施例中,荧光强度的测量提供了已经发生在细胞内部的目的蛋白表达的量度。在另一个实施例中,针对本文披露的基于细胞的测定中提供的病毒载体的每个剂量计算积分荧光强度/细胞(IFI-C)值并重复。在另一个实施例中,IFI-C读出反映了目的蛋白表达的量度。
在一个实施例中,本文提供的方法进一步包括洗涤细胞以去除对目的蛋白具有特异性的分子。在另一个实施例中,洗涤后,该方法进一步包括使细胞与特异性识别对目的蛋白具有特异性的分子的第二分子接触。在另一个实施例中,第二分子包括可检测标记。在另一个实施例中,第二分子包括抗体、抗体片段或适体。
在本文提供的方法的另一个实施例中,在固定和透化步骤之后,使细胞与抗细胞核可检测标记接触。用于检测细胞核的可检测标记可以包括但不限于DAPI、碘化丙啶(PI)、Hoechst、
在一个实施例中,在用本文披露的至少一种可检测标记染色后,该方法进一步包括采集一个或多个细胞图像的步骤,其中图像显示如经由检测在用光激发时由至少一种可检测标记提供的可检测信号测定的细胞内目的蛋白的表达。此外,获得图像的步骤之后是进行图像分析。
在一个实施例中,在分离后和/或在进行本文披露的基于细胞的测定之前,评估本文披露的细胞的活力。用于评估细胞活力的方法是本领域熟知的,并且包括例如台盼蓝染色(或根据使用的细胞计数器的等效细胞活力试剂)、显微镜观察等。
在一个实施例中,将多个细胞接种在固体表面上。在另一个实施例中,固体表面包括本领域已知的任何类型的板,包括24或96孔板。在另一个实施例中,在测定中使用的板适于对细胞进行成像。在另一个实施例中,固体表面包被有聚D-赖氨酸。
在另一个实施例中,以20,000个细胞的密度将细胞接种在固体表面上。在另一个实施例中,以10,000个细胞的密度将细胞接种在固体表面上。在另一个实施例中,以10,000-20,000个细胞的密度将细胞接种在固体表面上。在另一个实施例中,以20,000个细胞/孔的密度接种细胞。在另一个实施例中,以10,000个细胞/孔的密度接种细胞。在另一个实施例中,以10,000-20,000个细胞/孔的密度接种细胞。
在一个实施例中,转基因包含编码运动神经元存活(SMN1)蛋白的多核苷酸。在另一个实施例中,由用本文披露的病毒载体转导的细胞表达的目的蛋白是运动神经元存活(SMN1)蛋白。
在一些实施例中,在72小时±2小时处从培养箱中移出包含本文所述的终末分化且转导的细胞的转导板以进行细胞染色。
在一些实施例中,根据下文所述的方案来固定细胞。将50.0μL 4%多聚甲醛或适当的体积和浓度轻轻添加至孔。然后将板在环境室温下孵育例如5至7分钟。孵育后,从每个孔中吸出4%多聚甲醛,并用250.0μL DPBS(杜氏磷酸盐缓冲盐水)洗涤孔。
在一些实施例中,可以将板储存在2℃-4℃下。在一些实施例中,可以将板储存多达3天。储存板时,在储存板之前除去DPBS并添加250.0μL新鲜DPBS。
在一些实施例中,将细胞用曲通X-100透化。在一些实施例中,从每个孔中轻轻吸出DPBS,并轻轻添加50.0μL 0.1%曲通X-100。然后可以将板在环境室温下孵育例如5至7分钟,从每个孔中吸出0.1%曲通X-100,并用DPBS洗涤孔。
一抗孵育
示例性一抗包括小鼠单克隆抗SMN抗体(克隆2B1),1:500稀释度下的圣克鲁斯sc-32313XS批次号C2818、1:1000稀释度下的圣克鲁斯sc-32313XS批次号F2118和1:500稀释度下的EMD密理博(Millipore)批次号3054700。例如,为了制备1:500稀释度抗体的4.0mL染色溶液,将8.0μL抗SMN抗体添加至在DPBS中的4.0mL 1%BSA中。
在一些实施例中,在环境室温下与一抗一起孵育120至150分钟。
在一些实施例中,一抗孵育后,用DPBS洗涤细胞。
二抗孵育
示例性二抗包括在DPBS中的1%BSA中的最终2μg/mL山羊抗小鼠IgG(H+L)AlexaFluor Plus 488(在1:1000稀释度下)和2μg/mL细胞核染料Hoechst 33342(1:5000稀释度)。可以通过将10.0μL Hoechst 33342细胞核染料添加至40.0μL蒸馏水中来预稀释Hoechst 33342细胞核染料。
在一些实施例中,将细胞在环境室温下、避光(例如:用箔覆盖)的二抗中孵育60至80分钟。
从每个孔中吸出二抗溶液,并用DPBS洗涤细胞。
在一些实施例中,然后用透明的光学板密封件密封板,并成像。
计算相对效力
本披露内容提供了测定测试样品中载体的效力的方法。在一些实施例中,测试样品中载体的效力是相对于参考标准品(RS)测定的。在一些实施例中,参考标准品包含与测试样品相同的载体,但是参考标准品的特征(载体浓度、效力等)是已知的。
在一些实施例中,使用平行线分析(PLA)进行测试样品中的载体相比于参考标准品中的载体的相对效力计算。PLA是一种用于比较剂量响应曲线的方法,例如,作为MOI或log MOI结果的IFI-C。
在一些实施例中,PLA包括针对测试样品和参考标准品中的每一种将单独的线性模型拟合至Log
在一些实施例中,对测试样品、参考标准品和测定对照使用最小二乘法计算线性回归的R平方值(R
在一些实施例中,使用测试样品斜率估计值相对于参考标准品之比
y=α+βlog
其中y是来自给定MOI水平的积分荧光强度/细胞;α和β分别是线性回归线的截距和斜率,并且e是残差。
在一些实施例中,在PLA中使用共同斜率模型。在一些实施例中,对于每个测试样品和参考标准品和任选的测定对照,将具有单独截距和共同斜率的线性回归模型(M2.2)拟合至:板上的积分荧光强度/细胞(IFI-C)的测定读出相对log
y=α+βlog
并且其中y
在一些实施例中,针对测试样品和参考样品以及任选的测定对照中的每一个的IFI-C是从每种MOI下的多个测定读出(例如2、3或更多个平行测定)取平均值。
在一些实施例中,相对效力如下计算:根据来自模型(M2.2)的截距或斜率估计值将测试样品的相对效力计算为
在一些实施例中,如果测试样品的IFI-C的变异系数百分比(CV%)、线性回归拟合的R
在一些实施例中,测试样品的IFI-C的CV%小于或等于40%、小于或等于30%、小于或等于20%、小于或等于10%或小于或等于10%。在一些实施例中,测试样品的IFI-C的CV%小于或等于20%。
在一些实施例中,线性回归拟合时的R
在一些实施例中,线性回归拟合时的R
在一些实施例中,参考标准品(RS)具有≥2.0、≥2.1、≥2.2、≥2.3、≥2.4、≥2.5、≥2.6、≥2.69、≥2.8、≥2.9或≥3.0的测定动态窗(仅最大信号/背景信号细胞)。在一些实施例中,参考标准品(RS)具有≥2.69的测定动态窗(仅最大信号/背景信号细胞)。
在一些实施例中,参考标准品(RS)具有≥1.02E+05的斜率。
在一些实施例中,测定对照(例如阳性对照)相对于参考标准品的斜率比在0.60-1.5之内。在一些实施例中,测定对照(例如阳性对照)相对于参考标准品的斜率比在0.70-1.4之内。在一些实施例中,测定对照(例如阳性对照)相对于参考标准品的斜率比在0.75-1.33之内。
在一些实施例中,对于每种测试样品,对于自然对数变换相对效力结果估计均值
在某些实施例中,在测试样品之间计算log(y
在一些实施例中,在测试样品之间计算总体中间精密度
在一些实施例中,在测试样品之间计算总体可重复性。在一些实施例中,使用log(y
在一些实施例中,评估斜率比的平行性。体外相对效力测定的平行性可以通过测试样品和参考标准品的斜率之比,即斜率
在一些实施例中,对斜率比进行对数变换以便分析。在一些实施例中,针对每个测试样品和测定对照(例如阳性对照)样品的自然对数变换的斜率比,估计均值
执行本文所述的统计分析的方法对于本领域普通技术人员而言是已知的。例如,可以使用统计软件JMP Pro 13.2.1、R、Matlab等进行统计分析。
本文提供了使用本文所述的基于细胞的体外效力测定评估载体的稳定性的方法。
在一些实施例中,这些方法包括将载体稳定性样品在特定温度(例如20℃-25℃)下保持一定时间长度,然后将载体稳定性样品的相对效力与未经在特定温度下保持的参考标准品进行比较。例如,可以将载体稳定性样品在20℃-25℃下保持1周、2周、3周、1个月、2个月、3个月或4个月,并且使用本文提供的方法将载体稳定性样品的效力与在-60℃或低于-60℃保持相同时间长度的参考标准品进行比较。
本披露内容提供了病毒载体作为基因疗法生物产品,旨在开发用于治疗诊断为患有疾病的儿科患者。可以使用本文所述的基于细胞的体外效力测定来测定本文提供的载体、和包含这些载体的药物组合物的效力。在一个实施例中,疾病是SMA,例如SMA 1型、SMA2型、SMA 3型、SMA 4型或其组合。在一个实施例中,疾病是SMA 1型,这是一种严重的神经肌肉疾病,其特征在于由于对运动神经元的存活重要的SMN1基因的遗传缺陷而导致的运动神经元的丧失。在一些实施例中,病毒载体由非复制型非整合型重组自身互补型腺相关病毒血清型9(AAV9)构成,该腺相关病毒血清型9包含在巨细胞病毒(CMV)增强子/鸡-β-肌动蛋白杂合启动子(CB)的控制下表达SMN1蛋白的cDNA、和来自AAV血清型2(AAV2)DNA的两个AAV反向末端重复序列(ITR)。
在一个实施例中,术语“载体”是指当与适当的控制元件缔合时能够复制并且可以在细胞之间转移基因序列的任何遗传元件,诸如质粒、噬菌体、转座子、粘粒、染色体、病毒、病毒体等。因此,该术语包括克隆和表达媒介物,以及病毒载体。
在一个实施例中,术语“AAV载体”是指源自腺相关病毒血清型的载体,包括而不限于AAV-1、AAV-2、AAV-3、AAV-4、AAV-5、AAV-6、AAV-7、AAV-8和AAV-9,优选AAV-9。AAV载体中,AAV野生型基因(优选rep和/或cap基因)中的一个或多个可以全部或部分缺失,但保留功能性侧接ITR序列。功能性ITR序列对于AAV病毒体的拯救、复制和包装是必需的。因此,本文将AAV载体定义为至少包括对于病毒复制和包装而言顺式所需的那些序列(例如功能性ITR)。ITR不必是野生型核苷酸序列,并且可以例如通过核苷酸的插入、缺失或取代而改变,只要序列提供功能性拯救、复制和包装即可。在优选的实施例中,载体是具有AAV-2来源的ITR的AAV-9载体。“AAV载体”也意指蛋白外壳或衣壳,其提供用于将载体核酸递送至靶细胞的细胞核的高效媒介物。
在一个实施例中,术语“scAAV”是指自身互补型腺相关病毒(scAAV),该自身互补型腺相关病毒是由天然存在的腺相关病毒(AAV)工程化以用于在基因疗法中使用的病毒载体。scAAV称为“自身互补型”,因为编码区已被设计为形成分子内双链DNA模板。
在一个实施例中,本文提供了rAAV基因组。rAAV基因组包含一个或多个AAV ITR,该一个或多个AAV ITR侧接编码多肽(包括但不限于SMN多肽)或编码针对突变蛋白或其基因的控制序列的siRNA、shRNA、反义和/或miRNA的多核苷酸。该多核苷酸可操作地连接至在靶细胞中起作用以形成基因盒的转录控制DNA,特别是启动子DNA和聚腺苷酸化信号序列DNA。基因盒还可以包括内含子序列以当在哺乳动物细胞中表达时促进对RNA转录物的加工。
在一些实施例中,rAAV9基因组编码siRNA、shRNA、反义和/或miRNA,用于在降低突变体亨廷顿蛋白(htt)表达以治疗神经退行性障碍(诸如亨廷顿病)方法中使用。
在各种实施例中,rAAV9基因组编码siRNA、shRNA、反义和/或miRNA,用于在神经退行性障碍(诸如ALS)的治疗中使用。治疗导致疾病的分子标记物(诸如TNFα、一氧化氮、过氧亚硝酸盐和/或一氧化氮合酶(NOS))的表达降低。
在一些实施例中,载体编码针对ALS的突变蛋白(诸如超氧化物歧化酶)或者ALS或帕金森病的神经营养因子(诸如GDNF或IGFl)的短发夹RNA。
在一些实施例中,指示了本发明的病毒载体用于治疗神经发育障碍例(诸如雷特综合征)的用途。对于与雷特综合征相关的实施例,rAAV9基因组可以编码例如甲基胞嘧啶结合蛋白2(MeCP2)。
本文披露的rAAV基因组可以缺少AAV rep和cap DNA。rAAV基因组中的AAV DNA(例如ITR)可以来自可衍生重组病毒的任何AAV血清型,包括但不限于AAV血清型AAV-1、AAV-2、AAV-3、AAV-4、AAV-5、AAV-6、AAV-7、AAV-8、AAV-9、AAV-10和AAV-11。AAV血清型的基因组的核苷酸序列是本领域已知的。例如,AAV-1的完整基因组在GenBank登录号NC_002077中提供;AAV-2的完整基因组在GenBank登录号NC 001401和Srivastava等人Virol.[病毒学],45:555-564(1983)中提供;AAV-3的完整基因组在GenBank登录号NC_1829中提供;AAV-4的完整基因组在GenBank登录号NC_001829中提供;AAV-5基因组在GenBank登录号AF085716中提供;AAV-6的完整基因组在GenBank登录号NC_00 1862中提供;AAV-7和AAV-8基因组的至少一部分别在GenBank登录号AX753246和AX753249中提供;AAV-9基因组在Gao等人,J.Virol.[病毒学杂志],78:6381-6388(2004)中提供;AA V-10基因组在Mol.Ther.[分子疗法],13(1):67-76(2006)中提供;并且AAV-11基因组在Virology[病毒学],330(2):375-383(2004)中提供。
在另一个实施例中,提供了包含本发明的rAAV基因组的DNA质粒。DNA质粒被转移至可允许用AAV的辅助病毒(例如,腺病毒、EI缺失的腺病毒或疱疹病毒)感染以便将rAAV基因组组装到具有AAV9衣壳蛋白的感染性病毒颗粒中的细胞。用于产生rAAV颗粒的技术(其中向细胞提供待包装的AAV基因组、rep和cap基因以及辅助病毒功能)在本领域是标准的。rAAV的产生要求单一细胞(在本文中称为包装细胞)内存在以下组分:rAAV基因组、与rAAV基因组分离(即不在rAAV基因组中)的AAV rep和cap基因、以及辅助病毒功能组分。假型rAAV的产生披露于例如WO01/83692中,将该文献通过援引以其全文并入本文。
在各种实施例中,可以修饰AAV衣壳蛋白以增强重组载体的递送。衣壳蛋白的修饰通常是本领域已知的。参见例如US 2005/0053922和US 2009/0202490,将这些文献的披露内容通过援引以其全文并入本文。
产生rAAV的一般原则例如综述于以下文献中:Carter,1992,Current Opinionsin Biotechnology[生物技术当前述评],1533-539;和Muzyczka,1992,CUM Topics inMicrobial.And Immunol.[微生物学和免疫学的当前课题],158:97-129)。各种方法描述于以下文献中:Ratschin等人,Mol.Cell.Biol.[分子细胞生物学]4:2072(1984);Hennonat等人,Proc.Natl.Acad.Sci.USA[美国国家科学院院刊],81:6466(1984);Tratschin等人,Mol.Cell.Biol.[分子细胞生物学]5:3251(1985);McLaughlin等人,J.Virol.[病毒学杂志],62:1963(1988);和Lebkowski等人,1988Mol.Cell.Biol.[分子细胞生物学],7:349(1988).Samulski等人(1989,J.Virol.[病毒学杂志],63:3822-3828);美国专利号5,173,414;WO 95/13365和相应的美国专利号5,658,776;WO 95/13392;WO 96/17947;PCT/US98/18600;WO 97/09441(PCT/US96/14423);WO 97/08298(PCT/US96/13872);WO 97/21825(PCT/US96/20777);WO 97/06243(PCT/FR96/01064);WO 99/11764;Perrin等人(1995)Vaccine[疫苗]13:1244-1250;Paul等人(1993)Human Gene Therapy[人类基因疗法]4:609-615;Clark等人(1996)Gene Therapy[基因疗法]3:1124-1132;美国专利号5,786,211;美国专利号5,871,982;和美国专利号6,258,595。上述文献特此通过援引以其全文并入本文,特别强调文献中的与rAAV产生相关的那些部分。因此,本发明提供了产生感染性rAAV的包装细胞。在一个实施例中,可以使用任何合适的包装细胞系,诸如HeLa细胞、HEK-293细胞和PerC.6细胞(同源293系),优选HEK293细胞。在其他实施例中,本发明提供了包含本发明的rAAV基因组的rAAV9(即,感染性衣壳化rAAV9颗粒)。在本发明的一个方面,rAAV基因组是自身互补型基因组。
在另一个实施例中,该方法允许定量测量目的蛋白的水平的剂量依赖性增加。
在其他实施例中,本发明提供了包含本发明的rAAV基因组的rAAV9(即,感染性衣壳化rAAV9颗粒)。在本发明的一个方面,rAAV基因组是自身互补型基因组。
在另一个实施例中,提供了rAAV,诸如名为“rAAV9-SMN”或“AAV9-SMN1”的rAAV9。rAAV SMN基因组依次具有AAV2 ITR、具有巨细胞病毒增强子的鸡β-肌动蛋白启动子、SV 40内含子、(GenBank登录号NM_000344.2)中列出的SMN编码DNA、来自牛生长激素的聚腺苷酸化信号序列和另一AAV2 ITR。示例性SMN编码序列包括以下序列:
1 CCACAAATGT GGGAGGGCGA TAACCACTCG TAGAAAGCGT GAGAAGTTAC TACAAGCGGT61 CCTCCCGGCC ACCGTACTGT TCCGCTCCCA GAAGCCCCGG GCGGCGGAAG TCGTCACTCT 121TAAGAAGGGA CGGGGCCCCA CGCTGCGCAC CCGCGGGTTT GCTATGGCGA TGAGCAGCGG 181CGGCAGTGGT GGCGGCGTCC CGGAGCAGGA GGATTCCGTG CTGTTCCGGC GCGGCACAGG 241CCAGAGCGAT GATTCTGACA TTTGGGATGA TACAGCACTG ATAAAAGCAT ATGATAAAGC 301TGTGGCTTCA TTTAAGCATG CTCTAAAGAA TGGTGACATT TGTGAAACTT CGGGTAAACC 361AAAAACCACA CCTAAAAGAA AACCTGCTAA GAAGAATAAA AGCCAAAAGA AGAATACTGC 421AGCTTCCTTA CAACAGTGGA AAGTTGGGGA CAAATGTTCT GCCATTTGGT CAGAAGACGG 481TTGCATTTAC CCAGCTACCA TTGCTTCAAT TGATTTTAAG AGAGAAACCT GTGTTGTGGT 541TTACACTGGA TATGGAAATA GAGAGGAGCA AAATCTGTCC GATCTACTTT CCCCAATCTG 601TGAAGTAGCT AATAATATAG AACAGAATGC TCAAGAGAAT GAAAATGAAA GCCAAGTTTC 661AACAGATGAA AGTGAGAACT CCAGGTCTCC TGGAAATAAA TCAGATAACA TCAAGCCCAA 721ATCTGCTCCA TGGAACTCTT TTCTCCCTCC ACCACCCCCC ATGCCAGGGC CAAGACTGGG 781ACCAGGAAAG CCAGGTCTAA AATTCAATGG CCCACCACCG CCACCGCCAC CACCACCACC 841CCACTTACTA TCATGCTGGC TGCCTCCATT TCCTTCTGGA CCACCAATAA TTCCCCCACC 901ACCTCCCATA TGTCCAGATT CTCTTGATGA TGCTGATGCT TTGGGAAGTA TGTTAATTTC 961ATGGTACATG AGTGGCTATC ATACTGGCTA TTATATGGGT TTCAGACAAA ATCAAAAAGA 1021AGGAAGGTGC TCACATTCCT TAAATTAAGG AGAAATGCTG GCATAGAGCA GCACTAAATG 1081ACACCACTAA AGAAACGATC AGACAGATCT GGAATGTGAA GCGTTATAGA AGATAACTGG 1141CCTCATTTCT TCAAAATATC AAGTGTTGGG AAAGAAAAAA GGAAGTGGAA TGGGTAACTC 1201TTCTTGATTA AAAGTTATGT AATAACCAAA TGCAATGTGA AATATTTTAC TGGACTCTTT 1261TGAAAAACCA TCTGTAAAAG ACTGGGGTGG GGGTGGGAGG CCAGCACGGT GGTGAGGCAG 1321TTGAGAAAAT TTGAATGTGG ATTAGATTTT GAATGATATT GGATAATTAT TGGTAATTTT 1381ATGGCCTGTG AGAAGGGTGT TGTAGTTTAT AAAAGACTGT CTTAATTTGC ATACTTAAGC 1441ATTTAGGAAT GAAGTGTTAG AGTGTCTTAA AATGTTTCAA ATGGTTTAAC AAAATGTATG 1501TGAGGCGTAT GTGGCAAAAT GTTACAGAAT CTAACTGGTG GACATGGCTG TTCATTGTAC 1561TGTTTTTTTC TATCTTCTAT ATGTTTAAAA GTATATAATA AAAATATTTA ATTTTTTTTT 1621 A(SEQID NO:2)。
还设想了SMN DNA的保守核苷酸取代(例如,GenBank登录号NM_000344.2的位置625处鸟嘌呤至腺嘌呤改变)。在一些实施例中,rAAV的基因组缺少AAV rep和cap DNA,即,在基因组的ITR之间不存在AAV rep或cap DNA。所设想的SMN多肽包括但不限于NCBI蛋白数据库编号NP_000335.1中列出的人SMN1多肽及其同种型。所设想的SMN多肽还包括但不限于人SMN2多肽和任何SMN多肽的同种型。还设想了SMN1-修饰物多肽网素-3(PLS3)[Oprea等人,Science[科学]320(5875):524-527(2008)]编码其他多肽的序列可以取代SMN DNA。rAAV9 SMN载体描述于Foust等人,Nature Biotechnology[自然生物技术]28(3):271-274(2010)中。
在一个实施例中,病毒载体是腺相关病毒血清型9(AAV9),该腺相关病毒血清型9包含在巨细胞病毒(CMV)增强子/鸡-β-肌动蛋白杂合启动子(CB)的控制下表达SMN1蛋白的cDNA、和来自AAV血清型2(AAV2)DNA的AAV反向末端重复序列(ITR)。在另一个实施例中,AAV是具有AAV2来源的ITR的复制缺陷型AAV9,优选scAAV9。在一实施例中,AAV载体携带SMN转基因。在优选的实施例中,SMN编码DNA在GenBank登录号NM_000344.2中列出。还设想了SMNDNA的保守核苷酸取代(例如,如GenBank登录号NM_000344.2中所示的位置625处鸟嘌呤至腺嘌呤改变)。
在一些实施例中,术语“载体相关杂质”是指除了真正重组AAV颗粒以外的所有类型的AAV颗粒。载体相关杂质包括空的AAV衣壳(也称为“空体”或“空颗粒”),以及含有除了预期的载体基因组以外的多核苷酸序列的AAV颗粒(也称为“AAV衣壳化核酸杂质”或“AAV衣壳化DNA杂质”)。
在一些实施例中,“重组病毒”意指例如通过将异源核酸构建体添加或插入至颗粒中已经发生遗传改变的病毒。“重组”可以缩写为“r”,例如,rAAV可以指重组AAV。如本文所使用的术语“AAV”旨在涵盖“重组AAV”或“rAAV”。
在一些实施例中,“AAV病毒体”意指完整病毒颗粒,诸如野生型(wt)AAV病毒颗粒(包含与AAV衣壳蛋白外壳缔合的线性单链AAV核酸基因组)。在这方面,可以将具有互补意义的单链AAV核酸分子(例如“有义”或“反义”链)包装到任何一个AAV病毒体中,并且两条链具有相等的感染性。
在一些实施例中,术语“重组AAV病毒体”、“rAAV病毒体”、“AAV载体颗粒”、“完全衣壳”和“完全颗粒”在本文中定义为包括AAV蛋白外壳的感染性复制缺陷型病毒,该AAV蛋白外壳将在两侧均侧接AAV ITR的目的异源核苷酸序列衣壳化。在合适的宿主细胞中产生rAAV病毒体,该宿主细胞中已引入了指定AAV载体、AAV辅助功能和辅加功能的序列。以这种方式,使宿主细胞能够编码提供用于将AAV载体(含有重组目的核苷酸序列)包装至感染性重组病毒体颗粒中以用于后续基因递送的AAV多肽。
在一些实施例中,术语“空衣壳”和“空颗粒”是指包括AAV蛋白外壳但全部或部分地缺少包含在两侧均侧接AAV ITR的目的异源核苷酸序列的多核苷酸构建体的AAV病毒体。
术语“宿主细胞”表示例如微生物、酵母细胞、昆虫细胞和哺乳动物细胞,它们可以或已经用作AAV辅助构建体、AAV载体质粒、辅加功能载体或其他转移DNA的受体。该术语包括已转染的原始细胞的后代。因此,如本文所用的“宿主细胞”通常是指已用外源DNA序列转染的细胞。应理解,由于天然、偶然或故意突变,单个亲代细胞的子代并不一定与原始亲代在形态或基因组或总DNA互补体方面完全相同。
在另一个实施例中,术语“AAV辅助功能”是指AAV来源的编码序列,这些编码序列可经表达以提供AAV基因产物,这些AAV基因产物进而对于生产性AAV复制以反式起作用。因此:AAV辅助功能包括主要的AAV开放阅读框(ORF)rep和cap两者。Rep表达产物已显示出具有许多功能,尤其包括:DNA复制的AAV起点的识别、结合和切口;DNA解旋酶活性;以及AAV(或其他异源)启动子的转录的调节。Cap表达产物提供必要的包装功能。AAV辅助功能在本文中用于以反式补充AAV载体中缺失的AAV功能。
在一个实施例中,术语“AAV辅助构建体”通常是指这样的核酸分子,该核酸分子包括提供在用于产生递送目的核苷酸序列的转导载体的AAV载体中缺失的AAV功能的核苷酸序列。AAV辅助构建体通常用于提供AAV rep和/或cap基因的瞬时表达,以补充缺失的对于AAV复制所必需的AAV功能;然而,辅助构建体缺少AAV ITR,并且自身既不能复制也不能包装。AAV辅助构建体可以是呈质粒、噬菌体、转座子、粘粒、病毒或病毒体的形式。已经描述了许多AAV辅助构建体,诸如编码Rep和Cap表达产物两者的常用质粒pAAV/Ad和plM29+45。参见例如Samulski等人.(1989)J.Virol.[病毒学杂志]63:3822-3828;和McCarty等人.(1991)J.Virol.[病毒学杂志]65:2936-2945。已经描述了许多其他编码Rep和/或Cap表达产物的载体。参见例如美国专利号5,139,941和6,376,237。
在另一个实施例中,术语“转染”是用于指细胞摄取外来DNA,并且当外源DNA已引入细胞膜内部时,细胞已经被“转染”。多种转染技术通常是本领域已知的。参见例如Graham等人(1973)Virology[病毒学],52:456;Sambrook等人(1989)Molecular Cloning,alaboratory manual[分子克隆实验指南],Cold Spring Harbor Laboratories[冷泉港实验室],New York[纽约];Davis等人(1986)Basic Methods in Molecular Biology[分子生物学基本方法],Elsevier[爱思唯尔];以及Chu等人(1981)Gene[基因]13:197。此类技术可用于将一个或多个外源DNA部分引入合适的宿主细胞中。
如本文所用,术语“细胞系”是指能够在体外连续或延长生长和分裂的细胞群。在本领域中进一步已知在此类克隆群体的储存或转移期间,核型可能发生自发性或诱导性变化。因此,源自所提及细胞系的细胞可能与祖先细胞或培养物不完全相同,并且所提及的细胞系包括此类变体。在一些实施例中,术语“HEK293细胞”、“293细胞”或其语法等同物在此可互换使用,并且是指在本文披露的方法中使用的宿主/包装细胞系。
在一些实施例中,术语“洗脱液”在上下文中可以理解为是指用于洗脱物质的缓冲液。在一些实施例中,术语“洗脱液”在上下文中可以理解为是指经洗脱的物质,例如,来自先前纯化步骤的所需产物或物质(例如,用于测定或进一步纯化)。
在一些实施例中,在此所述的方法是使用良好制造规范(GMP)并以工业规模进行的。GMP是监管规范,例如由联邦药品管理局(FDA)强制实施以确保药品质量的那些规范。GMP法规确立了对制造工艺的控制。当前GMP法规的实例由FDA发布。在一些实施例中,本文所述的方法采用GMP程序以工业规模生产AAV病毒载体。迄今为止,由于可扩展性问题,用于基因疗法的AAV病毒载体的工业规模生产一直具有挑战性。因此,在一些实施例中,本文所述的方法通过例如在粘附型细胞中以工业规模和足以向人施用的纯度水平产生AAV病毒载体提供了优势。术语“工业规模”是指以大于实验室规模(例如商业规模)在细胞中生产病毒载体的方法,例如在每个制造批次的产量超过5x10
作为本文披露的基于细胞的测定的一部分,可以使用高内涵成像平台(CellInsight CX5)进行图像分析。这个平台使得能够定量测量基于每个细胞的细胞内蛋白质表达(积分荧光强度/细胞)。此外,CellInsight CX5允许适当的通量用于批次处置和稳定性研究。
在高内涵筛选中,首先将细胞与物质一起孵育,并且一段时间后,对细胞的结构和分子组分进行分析。最常见的分析涉及用荧光标签标记蛋白质,并且最后使用自动图像分析来测量细胞表型的变化。通过使用具有吸收和发射最大值的荧光标签,可以并行测量几种不同的细胞组分。此外,成像能够检测亚细胞水平的变化(例如,细胞质与细胞核与其他细胞器)。因此,对每个细胞可以收集大量数据点(参见Proll G,Steinle L,
在一个实施例中,提供了细胞筛选系统,该细胞筛选系统包括:高倍荧光光学系统,该高倍荧光光学系统具有显微镜物镜、具有用于保持细胞的位置阵列并具有用于移动板以使这些位置与显微镜物镜对准的器件的适于保持板的XY工作台、和用于使板沿实现聚焦的方向移动的器件;数字相机;光源,该光源具有用于将激发光引导至位置阵列中的细胞的光学器件和用于将从细胞发射的荧光引导至数字相机的器件;以及用于接收和处理来自数字相机的数字数据的计算机器件,其中该计算机器件包括:用于接收来自相机的图像的数字帧抓取器、用于用户交互和显示测定结果的显示器、用于数据存储和归档的数字存储介质以及用于控制、采集、处理和显示结果的器件。使用这种系统的方法披露于美国专利号6,756,207中,将该文献以其全文并入本文。
板扫描完成后,可以使用系统的图像查看、数据查看和汇总查看工具来查看图像和数据。来自扫描的所有图像、数据和设置都可以归档在系统的数据库中,以供以后查看或与网络信息管理系统对接。也可以将数据导出至其他第三方统计包中,以将结果制表并生成其他报告。作为完整扫描的最后阶段,可以对所测量特征的一个或多个统计信息生成报告。用户可以使用交互式报告生成程序,对于板的扫描区生成基于逐孔汇总的数据的图形报告。此报告可以包括呈表格和图形格式的对孔的统计信息的汇总以及关于样品的识别信息。
对板进行成像的方法是本领域普通技术人员已知的。示例性成像平台包括CellInsight高内涵筛选(HCS)平台,该平台使用HSC studio软件和标准化方案。然而,等同的成像和/或软件平台也可以用于实践本披露内容的方法。
用于数据采集的示例性CellInsight设置包括以下设置。测定设置:成像模式:荧光1(F1)%荧光2(F2);采集明视野图像;F1图像细胞类型:小鼠ES细胞;说明:mNPC荧光团AOVC-535-403;荧光经验值:700.0ms;F2图像细胞类型:小鼠ES细胞;说明:mNPC荧光团P1 VC-660-503;荧光经验值:5000.0ms;设定用于测定的稀释因子:2.000;显示F1、F2百分比:F1/(F1+F2)*100%。细胞类型设置:小鼠ES细胞;细胞直径:最小9.0微米,最大30.0微米;圆度:0.10;对比增强:0.40;解簇边缘因子:0.5;解簇Th因子:1.0;背景调整:1.0。台盼蓝活力参数:死细胞直径:最小8.0微米,最大30微米;灵敏度:1.0;均匀度:150;非常暗的死细胞对比增强:0.60。方案设置:物镜:20x;视野大小:455.4x455.4微米;相机:X1;相机采集模式:1104x1104(2x2像素合并);使用软件自动对焦;软件聚焦通道:1;自动对焦间隔:1。通道1设置:复合、相机增益中包括的通道:2;光强度(以%计):100;成像模式:宽视野;染料:386-23_BGRFRN_BGRFRN;视野深度:6.563;固定的曝光时间;目标%:25;曝光时间(秒):0.08。通道2设置:复合、相机增益中包括的通道:2;光强度(以%计):100;成像模式:宽视野;染料:485-20_BGRFRN_BGRFRN;视野深度:6.563;固定的曝光时间;目标%:25;曝光时间(秒):0.08。
本文提供了产生AAV载体、和包含这些AAV载体的药物组合物的方法,和使用本文所述的基于细胞的效力测定来测定这些AAV载体的效力的方法。在一些实施例中,AAV载体包含编码SMN1的序列。在一些实施例中,病毒载体的相对效力是相对于参考标准品的至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、至少99.9%、至少100%、至少110%、至少120%、至少130%或至少140%。
在一些实施例中,病毒载体的相对效力是相比于参考标准品的至少90%。
如本文所述的基于细胞的相对效力测定可以用于测定AAV-SMN1载体的相对效力,旨在用于AAV-SMN1载体药物物质和药物产品的批次处置以及稳定性测试。
上游工艺
在一些实施例中,上游工艺用于产生源自工作细胞库的中间物,其中上游工艺包括以下步骤:(a)培养细胞,例如粘附型细胞,(b)用三种质粒转染经培养的细胞,例如粘附型细胞,(c)培养期之后,例如通过全细胞裂解,从细胞中收获经扩增的病毒颗粒,(d)经由过滤纯化病毒颗粒,以去除任何完整细胞或细胞碎片,(e)对来自步骤(d)的洗脱液进行切向流过滤,并且(f)任选地冷冻经纯化病毒颗粒的所得中间制剂。在一些实施例中,可以将中间制剂冷冻。在其他实施例中,中间制剂在下游处理之前不需要冷冻。在一些实施例中,用本文披露的上游工艺制备的AAV是如本文所述的包含编码SMN1的多核苷酸的AAV。在一些实施例中,上游工艺在GMP下并以工业规模进行。
1.细胞系转染和培养
在一个方面,本文披露了rAAV基因组。rAAV基因组包含一个或多个AAV ITR,该一个或多个AAV ITR侧接编码多肽(包括但不限于SMN多肽)或编码针对突变蛋白或其基因的控制序列的siRNA、shRNA、反义和/或miRNA的多核苷酸。该多核苷酸可操作地连接至在靶细胞中起作用以形成基因盒的转录控制DNA,特别是启动子DNA、增强子DNA和聚腺苷酸化信号序列DNA。基因盒还可以包括内含子序列以当在哺乳动物细胞中表达时促进对RNA转录物的加工。
在一些实施例中,本文披露的rAAV基因组缺少AAV rep和cap DNA。rAAV基因组中的AAV DNA(例如ITR)可以来自可衍生重组病毒的任何AAV血清型,包括但不限于AAV血清型AAV-1、AAV-2、AAV-3、AAV-4、AAV-5、AAV-6、AAV-7、AAV-8、AAV-9、AAV-10和AAV-11。AAV血清型的基因组的核苷酸序列是本领域已知的。例如,AAV-1的完整基因组在GenBank登录号NC_002077中提供;AAV-2的完整基因组在GenBank登录号NC 001401和Srivastava等人Virol.[病毒学],45:555-564{1983)中提供;AAV-3的完整基因组在GenBank登录号NC_1829中提供;AAV-4的完整基因组在GenBank登录号NC_001829中提供;AAV-5基因组在GenBank登录号AF085716中提供;AAV-6的完整基因组在GenBank登录号NC_00 1862中提供;AAV-7和AAV-8基因组的至少一部分别在GenBank登录号AX753246和AX753249中提供;AAV-9基因组在Gao等人,J.Virol.[病毒学杂志],78:6381-6388(2004)中提供;AAV-10基因组在Mol.Ther.[分子疗法],13(1):67-76(2006)中提供;并且AAV-11基因组在Virology[病毒学],330(2):375-383(2004)中提供。
如本文所用,“pSMN”载体质粒包含编码SMN蛋白的多核苷酸,即SMN cDNA表达盒,其中该盒例如在编码SMN基因的多核苷酸的“左侧”和“右侧”侧接有腺相关病毒反向末端重复(ITR)序列。在一些实施例中,编码SMN的多核苷酸是人SMN序列,例如天然存在的人SMN序列或其同种型、变体或突变体。在一些实施例中,ITR序列是天然、变体型或经修饰的AAVITR序列。在一些实施例中,至少一个ITR序列是天然、变体型或经修饰的AAV2 ITR序列。在一些实施例中,两个ITR序列均是天然、变体型或经修饰的AAV2 ITR序列。在一些实施例中,“左侧”ITR是允许产生自身互补型基因组的经修饰的AAV2 ITR序列,并且“右侧”ITR是天然AAV2 ITR序列。在一些实施例中,“右侧”ITR是允许产生自身互补型基因组的经修饰的AAV2ITR序列,并且“左侧”ITR是天然AAV2 ITR序列。在一些实施例中,pSMN质粒进一步包含CMV增强子/鸡β-肌动蛋白(“CB”)启动子。在一些实施例中,pSMN质粒进一步包含猿猴病毒40(SV40)内含子。在一些实施例中,pSMN质粒进一步包含牛生长激素(BGH)聚腺苷酸化(polyA)终止信号。可用于上文讨论的一种或多种组分的示例性序列示出于下表1中。在一些实施例中,使用下表1中所示的所有序列。在一些实施例中,“AVXS-101”是使用表1中的所有序列并且落入术语pSMN的范围内的载体构建体的非限制性实例。
在一些实施例中,pSMN载体可以包含SMN cDNA表达盒、经修饰的AAV2 ITR、鸡β-肌动蛋白(CB)启动子、巨细胞病毒(CMV)即刻/早期增强子、经修饰的SV40晚期16s内含子、牛生长激素(BGH)聚腺苷酸化信号和未经修饰的AAV2 ITR。经修饰的和未经修饰的ITR可以相对于SMN cDNA表达盒以任一取向(即5'或3')进入。
在一些实施例中,例如,在本文所述的制造工艺期间,载体构建体序列被衣壳化至例如AAV9病毒体中。在这些实施例中,衣壳化是在能够递送稳定功能性转基因(例如完全功能性人SMN转基因)的非复制型重组AAV9衣壳中。在一些实施例中,衣壳由通过选择性剪接产生的60个病毒蛋白(VP1、VP2、VP3)例如以1:1:10的比率构成,该选择性剪接使得VP2和VP3是VP1的两种截短形式,所有均具有共同的C末端序列。在一些实施例中,制造工艺的产物(例如药物产品)可以包含非复制型重组AAV9衣壳以递送稳定的完全功能性人SMN转基因。在一些实施例中,衣壳由通过选择性剪接产生的60个病毒蛋白(VP1、VP2、VP3)以1:1:10的比率构成,该选择性剪接使得VP2和VP3是VP1的两种截短形式,所有均具有共同的C末端序列。
示例性载体构建体(例如AVXS-101(AAV9-SMN1))的DNA序列描述于表1中。
表1.AVXS-101载体构建体DNA序列汇总组分(所有核苷酸起始和终止位置均与SEQID NO:1有关)
在另一个方面,AVXS-101载体构建体的DNA序列在SEQ ID NO:1中提供:
在一些实施例中,由pSMN质粒编码的SMN蛋白的氨基酸序列包括:
MAMSSGGSGGGVPEQEDSVLFRRGTGQSDDSDIWDDTALIKAYDKAVASFKHALKNGDICETSGKPKTTPKRKPAKKNKSQKKNTAASLQQWKVGDKCSAIWSEDGCIYPATIASIDFKRETCVVVYTGYGNREEQNLSDLLSPICEVANNIEQNAQENENESQVSTDESENSRSPGNKSDNIKPKSAPWNSFLPPPPPMPGPRLGPGKPGLKFNGPPPPPPPPPPHLLSCWLPPFPSGPPIIPPPPPICPDSLDDADALGSMLISWYMSGYHTGYYMGFRQNQKEGRCSHSLN(SEQ ID NO:3)。
在一些实施例中,经修饰的AAV2 ITR包含SEQ ID NO:1的核苷酸1-106的序列。在一些实施例中,巨细胞病毒(CMV)增强子/鸡-β-肌动蛋白杂合启动子(CB)包含SEQ ID NO:1的核苷酸153-432的序列。在一些实施例中,表达SMN1蛋白的cDNA的序列包含SEQ ID NO:1的核苷酸1003-1887的序列。在一些实施例中,SV40内含子的序列包含SEQ ID NO:1的核苷酸774-870的序列。在一些实施例中,牛生长激素(BGH)聚腺苷酸化信号的序列包含SEQ IDNO:1的核苷酸1973-2204的序列。在一些实施例中,未经修饰的AAV2 ITR包含SEQ ID NO:1的核苷酸2217-2359的序列。
在一些实施例中,AAV衣壳蛋白VP1、VP2、VP3源自相同的转录物。这些具有替代性起始位点,但共享羧基末端。在下面,VP1特定氨基酸序列以黑体显示并加粗。VP1和VP2共有的氨基酸序列带有下划线并呈斜体。这三个衣壳蛋白共有的氨基酸加粗并呈斜体。
在一个实施例中,AAV衣壳蛋白源自编码SEQ ID NO:4中所示氨基酸序列的转录物。
在另一个方面,本文披露了包含rAAV基因组的DNA质粒。DNA质粒被转移至可允许用AAV的辅助病毒(例如,腺病毒、E1缺失的腺病毒或疱疹病毒)感染以便将rAAV基因组组装到具有AAV9衣壳蛋白的感染性病毒颗粒中的细胞。用于产生rAAV颗粒的技术(其中向细胞提供待包装的AAV基因组、rep和cap基因以及辅助病毒功能)在本领域是标准的。在一些实施例中,rAAV的产生涉及单一细胞(在本文中表示为包装细胞)内存在的以下组分:rAAV基因组、与rAAV基因组分离(即不在rAAV基因组中)的AAV rep和cap基因、以及辅助病毒功能组分。假型rAAV的产生披露于例如WO 01/83692中,将该文献通过援引以其全文并入本文。在各种实施例中,可以修饰AAV衣壳蛋白以增强重组载体的递送。衣壳蛋白的修饰通常是本领域已知的。参见例如US 2005/0053922和US 2009/0202490,将这些文献的披露内容通过援引以其全文并入本文。
产生rAAV的一般原则例如综述于以下文献中:Carter,1992,Current Opinionsin Biotechnology[生物技术当前述评],1533-539;和Muzyczka,1992,CUM Topics inMicrobial.and Immunol.[微生物学和免疫学的当前课题],158:97-129)。各种方法描述于以下文献中:Ratschin等人,Mol.Cell.Biol.[分子细胞生物学]4:2072(1984);Hennonat等人,Proc.Natl.Acad.Sci.USA[美国国家科学院院刊],81:6466(1984);Tratschin等人,Mol.Cell.Biol.[分子细胞生物学]5:3251(1985);McLaughlin等人,J.Virol.[病毒学杂志],62:1963(1988);和Lebkowski等人,1988Mol.Cell.Biol.[分子细胞生物学],7:349(1988).Samulski等人(1989,J.Virol.[病毒学杂志],63:3822-3828);美国专利号5,173,414;WO 95/13365和相应的美国专利号5,658,776;WO 95/13392;WO 96/17947;PCT/US98/18600;WO 97/09441(PCT/US96/14423);WO 97/08298(PCT/US96/13872);WO 97/21825(PCT/US96/20777);WO 97/06243(PCT/FR96/01064);WO 99/11764;Perrin等人(1995)Vaccine[疫苗]13:1244-1250;Paul等人(1993)Human Gene Therapy[人类基因疗法]4:609-615;Clark等人(1996)Gene Therapy[基因疗法]3:1124-1132;美国专利号5,786,211;美国专利号5,871,982;和美国专利号6,258,595。上述文献特此通过援引以其全文并入本文,特别强调文献中的与rAAV产生相关的那些部分。
产生包装细胞的示例性方法是产生对于AAV颗粒产生而言稳定表达所有必需组分的细胞系。例如,将包含缺乏AAV rep和cap基因的r AAV基因组、与rAAV基因组分开的AAVrep和cap基因、以及选择性标记(诸如新霉素抗性基因)的质粒(或多个质粒)整合到细胞基因组中。AAV基因组已通过诸如以下的程序引入到细菌质粒中:GC加尾(Samulski等人,1982,Proc.Natl.Acad.S6.[美国国家科学院院刊],79:2077-2081)、添加含有限制性核酸内切酶切割位点的合成接头(Laug hlin等人,1983,Gene[基因],23:65-73)、或通过直接的平端连接(Se napathy和Carter,1984,J.Biol.Chem.[生物化学杂志],259:4661-4666)。然后用辅助病毒诸如腺病毒感染包装细胞系。这种方法的优势在于细胞是可选择的并且适用于大规模产生rAAV。合适方法的其他实例采用腺病毒或杆状病毒而不是质粒来将rAAV基因组和/或rep和cap基因引入包装细胞中。
因此,在各种实施例中,本文的披露内容提供了产生感染性rAAV的包装细胞。包装细胞可以是在悬浮液中培养的非粘附型细胞或粘附型细胞。在一个实施例中,可以使用任何合适的包装细胞系,诸如HeLa细胞、HEK293细胞和PerC.6细胞(同源293系)。在一个实施例中,细胞系是HEK 293细胞。
为了增加病毒载体生产量,可以培养粘附型细胞并针对改善的对培养瓶的粘附性进行选择。在一些实施例中,改善在后续生物反应器接种步骤期间的转染效率和细胞计数。在继代培养期间,可通过本领域已知的方法将细胞从细胞培养表面脱离。例如,可以通过刮擦或通过在包含蛋白酶的溶液中孵育来提升细胞。在一个示例性实施例中,可以将HEK293细胞用PBS洗涤并在室温下用胰蛋白酶解离约2分钟。可以通过添加含有血清的生长培养基来停止解离,并可以通过反复吸移悬浮液来解离细胞团块。然后可以将细胞悬浮液沉淀,并且将分离的沉淀物重悬于合适的完全生长培养基中。然后可以将细胞接种在新的细胞培养室中,并使其粘附。在一段时间后未粘附至表面的细胞可以通过用细胞培养基轻轻抽吸而去除,然后用生长培养基完全替代细胞培养基。在一些实施例中,允许细胞粘附的时间段可以是约2小时、约3小时、约4小时、约5小时、约6小时或约7小时。当细胞已经扩增后,可以重复该过程以增加强粘附至培养瓶上的细胞部分。在一些实施例中,将该过程重复至少2次、至少3次、至少4次、至少5次或任何合适的次数。在一个示例性实施例中,将HEK293细胞接种在75cm
在其他实施例中,rAAV9(即,感染性衣壳化rAAV9颗粒)包含本文披露的rAAV基因组。在一个方面,rAAV基因组是自身互补型基因组。
转染前,将细胞在合适的培养基中,在烧瓶或合适的生物反应器中或两者中扩增。在一些实施例中,可以将细胞在提供细胞培养基连续循环的生物反应器中扩增。在一个实施例中,将细胞在200m
用于转导和将转导的细胞重新引入至受试者中的合适方法是本领域已知的。在一个实施例中,可以通过以下方式来体外转导细胞:将rAAV与细胞例如在适当的培养基中组合,以及使用常规技术诸如DNA印迹和/或PCR,或通过使用选择性标记物筛选携带目的DNA的那些细胞。
在一些实施例中,将包装细胞系用三种质粒转染:编码或包含待包装在AAV载体内的载体序列的质粒(例如pSMN、pMECP2转基因或pSOD1sh)、pHELP和pAAV2/9。可以使用本领域中已知的任何技术进行转染,这些技术包括但不限于电穿孔、脂转染,例如用lipofectamine、阳离子聚合物和阳离子脂质。可以使用任何合适的转染培养基。在转染过程的一个实施例中,通过三重DNA质粒聚乙烯亚胺(PEI)共沉淀转染粘附型人胚肾(HEK293)细胞。在一个实施例中,scAAV9.CB.SMN载体(包含CB启动子和编码SMN的多核苷酸的自身互补型AAV9载体)是在大规模粘附型细胞生物反应器中使用三重DNA质粒转染(利用PEI共沉淀)至粘附型HEK293细胞中而产生。在一个实施例中,将用于细胞扩增的DMEM生长培养基替换为经改良的DMEM转染培养基。此培养基被配制为没有钙和L-谷氨酰胺。在一个实施例中,转染培养基是没有FBS、没有钙、没有L-谷氨酰胺但具有4.5g/L葡萄糖的DMEM。
在一些实施例中,没有血清(例如,没有FBS)的转染培养基改善转染功效。在一个实施例中,转染培养基是OptiMEM(英杰公司(Invitrogen)/赛默飞世尔公司(ThermoFisher))。在一个实施例中,将三种质粒(pSMN、pHELP和pAAV2/9)与PEI在转染培养基中混合在一起并使其反应。在一些实施例中,将三种质粒以约1:1:1摩尔比混合在一起。在一些实施例中,质粒和PEI以1:1量比混合。在一些实施例中,质粒和PEI以小于1:1的DNA:PEI重量比混合。在一个实施例中,将pSMN、pHELP和pAAV2/9以1:1:1摩尔比在OptiMEM培养基中混合。在这种实施例中,添加PEI使得DNA:PEI为按重量计1:1。在一些实施例中,允许反应发生0-60分钟或10-45分钟或20-30分钟。在一个实施例中,允许反应发生15-30分钟。
在一个实施例中,本披露内容提供了一种用于制造基于AAV的病毒载体的方法,该方法包括以下步骤:(i)在工业规模生物反应器中培养粘附型HEK293细胞,(2)用质粒转染粘附型细胞少于60分钟以使得能够产生AAV载体,并任选地施加进一步处理、纯化、配制和填充步骤以产生药学产品。在此方法的一个实施例中,使用利用聚乙烯亚胺(“PEI”)共沉淀的三重DNA质粒转染产生scAAV9.CB.SMN载体。在一个实施例中,用于此转染的3种质粒是pSMN、pAAV2/9和pHELP。
可以通过使包装细胞系与DNA-PEI共沉淀物接触来进行转染。在一些实施例中,将转染培养基中的DNA-PEI共沉淀物填充至培养基再循环袋中。在一些实施例中,将转染培养基中的DNA-PEI共沉淀物循环至生物反应器中并完全置换生长培养基。在一些实施例中,使转染培养基中的DNA-PEI共沉淀物接触生物反应器中的粘附型细胞。在一些实施例中,使转染培养基中的DNA-PEI共沉淀物接触生物反应器中的粘附型细胞长达两个小时。在一些实施例中,转染发生一至两个小时。在一些实施例中,转染发生少于一个小时,例如10分钟、20分钟、30分钟、40分钟或50分钟。在一些实施例中,转染发生一至两个小时。在一些实施例中,通过使完全生长培养基再循环通过生物反应器并完全置换转染培养基来停止转染。
2.收获经扩增的病毒颗粒
在转染后合适的细胞扩增期之后,在一些实施例中,裂解细胞并收获病毒颗粒。在一些实施例中,在细胞裂解过程起始之前,将细胞从反应器解离。在一些实施例中,将细胞原位裂解。任选地,在不裂解的情况下收获病毒颗粒。在一些实施例中,添加核酸内切酶,例如,循环至生物反应器中至最终目标浓度。核酸内切酶可以是降解DNA和RNA两者的核酸内切酶。在一个实施例中,核酸内切酶是来自粘质沙雷氏菌(Serratia marcescens)的基因工程化核酸内切酶(Eaves,G.N.等人J.Bact.[细菌学杂志]1963,85,273-278;Nestle,M.等人J.Biol.Chem.[生物化学杂志]1969,244,5219-5225),以名称全能核酸酶
在一些实施例中,在将裂解缓冲液添加至反应器之前,使核酸内切酶混合。在一些实施例中,使细胞裂解溶液与粘附型细胞混合长达1小时、长达2小时、长达3小时、长达4小时或长达5小时。在一些实施例中,裂解缓冲液可以在合适的缓冲液中包含氯化镁和/或吐温-20。在一个示例性实施例中,裂解缓冲液是500mM HEPES、10%吐温20、20mM MgCl
3.纯化病毒颗粒
收获后,可以典型地经由过滤来浓缩和纯化批量病毒颗粒收获物。在一个实施例中,将病毒颗粒通过以下方式过滤:深层过滤,之后通过去除大分子污染物和细胞碎片但是允许载体基因组从其中穿过的过滤器(例如0.45μm过滤器)过滤。可以使用任何合适的深层过滤器。
如本领域中所理解的,深层过滤是指使用多孔过滤介质来澄清化含有大量大颗粒(例如完整细胞或细胞碎片)的溶液,而相比之下膜过滤在此类条件下会迅速被堵塞。多种不同孔径的深层过滤介质可从多个制造商诸如密理博、颇尔(Pall)、通用电气(GeneralElectric)和赛多利斯(Sartorious)公司商购获得。
可以降低深层过滤的目标流速,以使过滤器入口压力保持在规格内。在某些实施例中,一旦过滤了所有的批量收获物,就可以采用用于后续的第一切向流过滤步骤(“TFF1”)的渗滤缓冲液驱逐深层过滤器。将深层过滤器汇集物(pool)混合。然后可以将深层过滤器汇集物通过0.45μm过滤器过滤,以进一步澄清化批量收获物料。然后用TFF1缓冲液驱逐0.45μm过滤器。
4.切向流过滤
在各种实施例中,使用切向流过滤来浓缩批量收获物,并例如使用切向流过滤去除盐和蛋白质。切向流过滤(TFF)(也称为错流过滤CFF)是本领域技术人员熟知的,并且用于其在宽范围情况下的实施的设备和方案可从多个制造商商购获得,该多个制造商包括但不限于纽约州华盛顿港的颇尔公司和加利福尼亚州兰乔多明格斯的仕必纯实验室(Spectrum Labs)。通常,TFF可能涉及渗余物跨膜表面的再循环。在某些实施例中,此温和的错流进料可使膜积垢最小化、维持高的过滤速率且提供高的产物回收率。在一个实施例中,TFF步骤可以用平片材系统来实施,如本文所例示的。平片材系统可用于大规模生产,其中此类系统设置有防止病毒颗粒上的过度剪切力的器件(例如,开放式流动通道)。可替代地,TFF步骤可以用中空纤维系统来实施,如本文所例示的。在一个实施例中,TFF系统的分子量截留值(MWCO)在200-400kDa之间,例如约300kDa。
在一个实施例中,使用300kDa MW截留值的再生纤维素膜盒进行TFF1步骤。将盒用NaOH溶液冲洗和消毒,并用TFF1缓冲液平衡。在一个实施例中,TFF1缓冲液包含20mM Tris、1mM MgCl2、500mM NaCl、1%蔗糖、pH 8.1。
在一些实施例中,选择TFF1步骤的浓缩阶段以将澄清化的收获物的体积减少大约10倍。一旦达到目标渗余物体积,就可以开始渗滤操作。在一些实施例中,可以用约6个渗滤体积的TFF1缓冲液对渗余物进行渗滤。在一些实施例中,用约5-20、或10-15或12个渗滤体积的TFF1缓冲液对渗余物进行渗滤。一旦实现了6个渗滤体积的渗透物总流量,就可以再浓缩并收获渗余物。可执行对膜的冲洗(例如连续两次冲洗)以增加中间药物物质的产物回收率。
5.中间产物
在一些实施例中,然后可以将中间药物物质在干冰上或在冷冻机中冷冻,接着转移至<-60℃储存。在其他实施例中,中间产物在下游工艺之前不需要冷冻。
在一些实施例中,将多个中间产物物质批次汇集在一起以进行进一步处理(例如,通过下游工艺进行纯化,例如,如本文所述)。可以在冷冻和储存之前汇集该多个中间产物物质批次。在其他实施例中,可在解冻经冷冻和储存的批次之后汇集该多个中间产物物质批次。
在一些实施例中,下游工艺用于将中间产物(例如汇集的中间产物)处理成经过滤的药物物质。在一些实施例中,下游工艺步骤包括:(a)酸化和澄清化(例如,使用过滤)、(b)阳离子交换色谱、(c)切向流过滤(“TFF2”)、(d)CsCl超速离心、(e)病毒载体的收集和(f)进一步切向流过滤(“TFF3”),以产生经过滤的药物物质,其中将经纯化的AAV颗粒悬浮于药学上可接受的载体中。在一些实施例中,下游工艺包括继生产TFF1中间物之后的下列制造步骤:解冻和汇集TFF1中间物,酸化和澄清化,阳离子交换色谱(CEX),切向流过滤(TFF2),用于完全/空衣壳分离的CsCl超速离心,用于浓缩/缓冲液交换的切向流过滤(TFF3),TFF 3汇集物料过滤以产生药物物质,稀释和过滤药物物质以产生药物产品,储存药物产品以及将药物产品填充至小瓶中。
在一些实施例中,本文披露的下游工艺可用于处理如本文所述的包含AAV SMN的中间物。
1.中间物的酸化和澄清化
在中间物被冷冻的实施例中,下游工艺以解冻TFF1中间物料而开始。洗涤剂(例如吐温20)可以用于促进大部分的宿主细胞蛋白和DNA在酸性pH下的絮凝。然后可以降低含有TFF1中间物的洗涤剂的pH。当pH降低时形成的絮凝物和沉淀物可通过使溶液通过深层过滤器和去除大分子污染物和细胞碎片但是允许载体基因组从其中穿过的过滤器(例如0.45μm过滤器)过滤来除去。可以使用任何合适的深层过滤器。
在一个实施例中,将吐温20缓慢地添加至TFF1中间物溶液,以实现10%-20%吐温20之间的最终浓度。在一些实施例中,添加吐温20后的目标组合物是在20mM Tris、1mMMgCl
孵育后,可通过添加任何合适的酸来降低含有TFF1中间物的吐温20的pH。在一些实施例中,添加1M甘氨酸(pH 2.5)以实现3.5±0.1的目标pH。在一些实施例中,目标pH为pH3.0-4.0、约pH 3.3-3.7、约pH 3.4-3.6或约pH 3.5。一旦pH在可接受的范围内,就可以使溶液穿过任何大小的过滤器。在示例性实施例中,使用与0.45μm过滤器(例如,Opticap XL10Durapore过滤器)或0.8/0.45μm PES过滤器联用的深层过滤器(例如,Clarisolve POD)。
2.阳离子交换色谱
在各种实施例中,使用阳离子交换(CEX)捕获色谱步骤,例如以将病毒衣壳与宿主细胞蛋白、宿主细胞DNA、宿主细胞脂质、吐温20和其他过程相关杂质分离。阳离子交换色谱的原理是在本领域熟知的,但简而言之,此方法依赖于待分离的带正电荷的颗粒与所用带负电荷的树脂之间的电荷-电荷相互作用。一般来讲,首先通过流过几个渗滤体积的缓冲液使柱平衡,直至pH和电导率稳定。然后加载样品,并用加载缓冲液洗涤柱。最后,使用洗脱缓冲液从柱洗脱掉目的样品,并收集含有样品的级分。目的样品的存在可以通过洗脱液的光学吸光度量度来检测。
在一个实施例中,CEX步骤利用CIMmultus S03-8000高级复合柱(AdvancedComposite Column)(磺酰基)(2μm孔)色谱柱。在一个实施例中,在OD280急剧上升时开始收集洗脱峰。当电导率在80-85mS/cm之间时,OD280将开始上升。CEX洗脱液可以根据常规程序收集,并且可以分两个级分收集。在一个实施例中,第一级分在OD280急剧上升时开始,并收集1.5个收集体积(CV)。在另一个实施例中,第二级分紧接在第一级分之后开始,并收集1.0CV。将两个级分汇集,然后中和至pH 8.0±0.30。在一个实施例中,中和缓冲液包含1.0MTris,在20℃下pH 9.1±0.1。
3.切向流过滤2
在一些实施例中,使用切向流过滤步骤(TFF2)来浓缩、去除蛋白质杂质,并将缓冲液交换为用于后续CsCl超速离心步骤的适当缓冲液。可以使用任何合适的TFF膜。在一个实施例中,TFF2步骤利用300kD MWCO再生纤维素膜。
在一些实施例中,设计此步骤的浓缩阶段以减少CEX洗脱液的体积。在一个实施例中,用渗滤缓冲液将渗余物稀释2倍,并将渗余物浓缩至其初始体积。在一个实施例中,渗滤缓冲液是含有以下的TFF2 NaCl渗滤缓冲液:20mM Tris、2mM MgCl2、150mM NaCl、0.2%泊洛沙姆188、1%蔗糖,在20℃下pH 8.1±0.1。在此类实施例中,可以重复此过程,直至完成用新缓冲液进行的渗滤。在一个实施例中,用含CsCl的渗滤缓冲液将渗余物稀释2倍,并将渗余物浓缩至其初始体积。在一个实施例中,含CsCl的渗滤缓冲液是含有以下的TFF2 CsCl渗滤缓冲液:20mM Tris、2mM MgCl
4.CsCl超速离心
在将AAV用于体内基因转导的一些实施例中,rAAV的最终产物可以含有最少的杂质和空颗粒。纯化AAV载体的两种方法是使用碘克沙醇梯度或CsCl梯度进行超速离心。一项比较这两种方法的研究证明,与CsCl相比,碘克沙醇产生具有更高载体纯度的AAV载体,但具有更多的空病毒衣壳。Strobel等人“Comparative Analysis of Cesium Chlori de-andIodixanol-Based Purification of Recombinant Adeno-Associated Viral Vectorsfor Preclinical Applications[用于临床前应用的重组腺相关病毒载体的基于氯化铯和碘克沙醇的纯化的比较分析].”Human Gene Therapy Methods[人类基因治疗方法],26(4):147-157。尽管使用CsCl导致较少量的空病毒壳体,但是CsCl可能对细胞有毒,且可能需要多个纯化步骤以去除残留CsCl,从而与较短时间的方法(如碘克沙醇(约1天))相比而导致较长的处理时间(约3.5天)。一项不同的研究显示,去除残留CsCl的许多步骤很多情况下会导致显著的rAAV损失,从而导致收率和回收率低,这常常抵消该方法的其他好处。Hermens等人“P urification of Recombinant Adeno-Associated Virus by IodixanolGradie nt Ultracentrifugation Allows Rapid and Reproducible Preparation of Vector Stocks for Gene Transfer in the Nervous System[通过碘克沙醇梯度超速离心纯化重组腺相关病毒允许快速且可重现地制备用于神经系统中的基因转移的载体原液].”Human Gene Therapy[人类基因疗法],10:1885-1891。此外,虽然这两种方法在用于产生临床前样品的实验室中作用良好,但是它们不可扩展且因此不适用于大规模生产商业产品。参见例如Tomono等人,“Ultracentrifugation-free chromatography-media ted large-scale purification of recombinant adeno-associated virus seroty pe 1(rAAV1)[无超速离心色谱介导的对重组腺相关病毒血清型1(rA AV1)的大规模纯化].”MolecularTherapy-Methods&Clinical Devel opment[分子疗法-方法和临床开发],3:15058(“使用氯化铯(CsCl)或碘克沙醇密度超速离心的纯化方法不适用于大规模生产”)。
在一些实施例中,使用超速离心步骤,例如以将空衣壳与完全衣壳分离。出乎意料的是,本文披露的CsCl超速离心方法是可扩展的并且适用于大规模生产经纯化的AAV载体。超速离心可以通过分析型超速离心来进行,并且可涉及使用梯度缓冲液。梯度缓冲液的实例包括但不限于CsCl、蔗糖、碘克沙醇和本领域已知的其他缓冲液。离心可以在任何能够达到所需g-力的离心机中进行,例如配备有50.2Ti型转子或等效转子的自动化Optima XPN100超速离心机系统或等效系统。超速离心后,空衣壳和完全衣壳在管内分离成不同的区带中,并且可以通过从特定区带中抽出物料来提取。在一些实施例中,将经TFF2纯化的过滤物料以241,600-302,000g(在50.2Ti转子中约40,000-50,000rpm)离心。在一些实施例中,将经TFF2纯化的过滤物料离心过夜。在一些实施例中,将经TFF2纯化的过滤物料离心16-24小时。在一些实施例中,将经TFF2纯化的过滤物料离心20-24小时。在一些实施例中,将经TFF2纯化的过滤物料在15℃-25℃下离心。在一个实施例中,将经TFF2纯化的过滤物料在20℃下以302,000g(在50.2Ti转子中50,000rpm)离心17小时。在一些实施例中,用于CsCl离心的缓冲液可以具有下列成分中的一种或多种,包含(a)CsCl,进一步包含(b)MgCl
空病毒衣壳与非空病毒衣壳之比率可以通过标准实验室技术来测量。在一些实施例中,该测量是通过光学吸光度量度来进行。在一些实施例中,该测量是通过UV吸光度量度来进行。在一些实施例中,衣壳蛋白的总量和DNA的总量可以根据UV吸光度量度来测定。在一些实施例中,该测量是通过光学折射率量度来进行。在一些其他实施例中,该测量是通过分析型超速离心来进行。
在一个实施例中,超速离心后收集的AAV病毒载体具有少于8%的空衣壳、少于7%的空衣壳、少于5%、少于3%或少于1%。在一个实施例中,超速离心后收集的AAV病毒载体具有1%-10%的空衣壳。在一个实施例中,超速离心后收集的AAV病毒载体具有2%-8%的空衣壳。在一个实施例中,空衣壳的数量低于检测限。在另一个实施例中,空衣壳的百分比以占总衣壳的百分比来测定。
5.切向流过滤3以产生经过滤的药物物质
在一些实施例中,使用切向流过滤步骤(TFF3)来去除CsCl并浓缩完全载体衣壳。可以使用合适的膜进行切向流过滤。在一个实施例中,使用300kDa MWCO再生纤维素膜。载体衣壳可以被膜保留。可以设计TFF3操作的浓缩阶段以减少残留CsCl的浓度和超速离心汇集物的体积。在一些实施例中,一旦达到目标渗余物体积,就开始渗滤。用最多10个渗滤体积的合适的TFF3缓冲液对渗余物进行渗滤。在一个实施例中,合适的TFF3缓冲液可以包括下列组分中的一种或多种,这些组分包含(a)s、(b)MgCl
根据本文披露的方法纯化的病毒(例如AAV)颗粒可以以高收率生产,具有足够可以将其施用至人受试者的纯度。在一些实施例中,使用本文所述的基于细胞的体外效力测定来测定包含本文所述的AAV颗粒的药物组合物的效力。在一些实施例中,以在约1-8x10
在一些实施例中,在病毒载体的生产过程期间,可能产生不含有核酸材料的空病毒衣壳。包含低量的空病毒衣壳的药物组合物可能是有利的,因为它们避免将具有不成熟的免疫系统的患者(例如婴儿)不必要地暴露于抗原性物料(空壳体、宿主细胞蛋白、宿主细胞DNA)而无治疗益处。在一些实施例中,此类的药物组合物可以减少潜在的输液反应或更广泛的免疫应答,并且可以改善治疗功效。与具有基因组物质的完全病毒衣壳相比,空衣壳具有不同的密度,从而可以通过梯度离心或本领域已知的其他方法分离这两种物质。在一些实施例中,空衣壳是通过超速离心分离。在一些实施例中,空衣壳是通过CsCl梯度超速离心分离。在其他实施例中,空衣壳是通过碘克沙醇梯度超速离心分离。在一些实施例中,空衣壳是通过蔗糖梯度超速离心分离。
空病毒衣壳与非空病毒衣壳之比率可以通过标准实验室技术来测量。在一些实施例中,该比率是通过吸光度量度来测量。在一些实施例中,该比率是通过UV吸光度量度来测量。在一些实施例中,衣壳蛋白的总量和DNA的总量可以通过UV吸光度量度来测定。在一些实施例中,该测量是通过光学折射率量度来测定。在一些其他实施例中,该测量是通过分析型超速离心来测定。
高水平的空衣壳可能对病毒载体治疗的功效提出挑战。在一个实施例中,药物组合物具有少于10%的空衣壳、少于8%的空衣壳、少于7%、少于约5%、少于3%、少于1%的空衣壳。在另一个实施例中,药物组合物具有1%-10%的空衣壳。在另一个实施例中,药物组合物具有2%-8%的空衣壳。在另一个实施例中,药物组合物具有少于或等于6%的空衣壳、5%的空衣壳、4%的空衣壳、3%的空衣壳、2%的空衣壳或更少。在一个实施例中,空衣壳的数量低于检测限。在另一个实施例中,空衣壳的百分比以占总衣壳的百分比例如使用AUC来测定。在一些实施例中,例如与具有较高百分比的空衣壳的组合物相比,这些低百分比的空衣壳在施用至患者后改善了治疗功效和/或减少了不良事件(例如,炎症应答、肝损伤)。在一些实施例中,与现有方法(例如,不使用粘附型细胞和/或本文所述的纯化方法的那些)中的水平相比,本文披露的制备病毒载体的方法提供了这些改善的空衣壳百分比。
在病毒载体的生产过程期间,来自用于产生病毒载体的粘附型细胞(例如HEK293细胞)的残留蛋白质可能没有被完全分离出。残留宿主细胞蛋白具有引发免疫应答的潜力。残留宿主细胞的量可以通过任何可以区分病毒衣壳蛋白与残留宿主细胞蛋白的标准实验室技术来测量。在一些实施例中,残留宿主细胞蛋白的量可以通过尺寸排阻或离子交换色谱来测量。在一些实施例中,该测量可以通过使用亲代细胞特异性抗体的蛋白质印迹来进行。在一个实施例中,残留宿主细胞蛋白的量可以通过酶联免疫吸附测定(ELISA)来测量。在一些实施例中,残留宿主细胞蛋白的量可以通过商业ELISA试剂盒来测量。在一些实施例中,残留宿主细胞蛋白的量可以通过天鹅科技(Cygnus Technologies)HEK293 HCP ELISA试剂盒来测量。
在另一个实施例中,所述药物组合物中的残留宿主细胞蛋白是每1X10
在病毒载体的生产过程期间,来自粘附型细胞(例如HEK293细胞)的残留宿主细胞DNA或经转染以产生病毒载体的残留质粒DNA可能没有被完全去除。纯化工艺(例如酸化、澄清化、切向流过滤等)去除了大部分的残留宿主细胞或质粒DNA。在一个实施例中,残留宿主细胞或质粒DNA的量的测量是通过PCR进行。在另一个实施例中,残留宿主细胞或质粒DNA的量的测量是通过用对宿主细胞或质粒序列具有特异性的引物的定量PCR(qPCR)进行。在另一个实施例中,残留宿主细胞或质粒DNA的量的测量是通过数字液滴PCR(ddPCR)进行。在一个实施例中,质粒DNA的量是使用利用对质粒的卡那霉素抗性基因区具有特异性的引物的qPCR测定来测定。在另一个实施例中,残留宿主细胞DNA的量是通过商业qPCR测定试剂盒,例如,赛默飞世尔公司的
在一个实施例中,所述药物组合物中的残留宿主细胞DNA是每1X10
在另一个实施例中,所述药物组合物中的残留质粒DNA是每1X10
在一个实施例中,药物组合物中的残留宿主细胞DNA是每1.0x10
在一个实施例中,药物组合物中的残留宿主细胞DNA是每1.0x10
在一些实施例中,药物组合物中的内毒素的量是每1.0x10
在一个实施例中,药物组合物中的牛血清白蛋白(BSA)是每1.0x10
在一个实施例中,本文披露的药物组合物包含下列中的一种或多种:每1.0x10
在一个实施例中,本文披露的药物组合物包含下列中的一种或多种,例如全部:pH7.7-8.3(例如,如按照USP<791>测量的)、约390-430mOsm/kg(例如,如按照USP<785>测量的)、每个容器少于约600个大小≥25μm的颗粒(例如,如按照USP<787>测量的)、每个容器少于约6000个大小≥10μm的颗粒(例如,如按照USP<787>测量的)、约1.7x10
高水平的残留宿主细胞蛋白、宿主细胞DNA、质粒DNA和/或内毒素可能对病毒载体治疗的功效提出挑战。在一些实施例中,例如与具有较高量的组合物相比,这些低量的残留宿主细胞蛋白、宿主细胞DNA、质粒DNA和/或内毒素在施用至患者后改善了治疗功效和/或减少了不良事件(例如,炎症应答、肝损伤)。在一些实施例中,与现有方法(例如,不使用粘附型细胞和/或本文所述的纯化方法的那些)中的水平相比,本文披露的制备病毒载体的方法提供了这些改善的水平。在一些实施例中,除了量的残留宿主细胞蛋白、宿主细胞DNA、质粒DNA和/或内毒素之外,本文的方法还允许制备具有降低的空衣壳百分比的病毒载体。
在一些实施例中,在TFF(例如第二TFF)之后残留铯的量低于约50μg/g。在一些实施例中,在TFF(例如第二TFF)之后残留铯的量低于约30μg/g。在一些实施例中,在TFF(例如第二TFF)之后残留铯的量低于约20ug/g。在一些实施例中,药物组合物中的残留铯少于或等于30ug/g(ppm)。在一些实施例中,残留CsCl的量可以通过质谱、电感耦合等离子体质谱法(ICP-MS)和/或另一种合适的方法来测量。在一些实施例中,在第二TFF之后残留铯的量低于例如使用ICP-MS的定量限。
在一些实施例中,在第二TFF之后收集的AAV病毒载体的浓度大于或等于约5x10
在一个实施例中,药物组合物具有下列中的一种或多种:每1.0x10
在一些实施例中,使用本文所述的基于细胞的体外效力测定测量药物组合物的效力。在一些实施例中,药物组合物包含病毒载体,其中病毒载体的相对效力是相对于参考标准品的至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、至少99.5%、至少99.9%、至少100%、至少110%、至少120%、至少130%或至少140%。在一些实施例中,药物组合物包含病毒载体,其中病毒载体的相对效力是相对于参考标准品的至少90%。
可以根据已知用于制备药学上有用的组合物的方法配制根据本披露内容纯化的病毒颗粒(例如,病毒颗粒)。可以使用本领域已知的技术将本披露内容的组合物配制成用于施用至哺乳动物受试者,例如人。特别地,递送系统可以被配制成用于肌肉内、真皮内、粘膜、皮下、静脉内、鞘内、可注射储库型装置或局部施用。
当将递送系统配制为溶液或悬浮液时,递送系统处于可接受的载体,例如水性载体中。可以使用多种水性载体,例如水、缓冲水、0.8%盐水、0.3%甘氨酸、透明质酸等。这些组合物可以通过常规、熟知的灭菌技术来灭菌,或可进行无菌过滤。所得水性溶液可以按原样包装使用或者是冻干的,冻干制剂在施用之前与无菌溶液组合。
组合物(例如药物组合物)可以含有接近生理条件的药学上可接受的辅助物质,诸如pH调节剂和缓冲剂、张力调节剂、润湿剂等,例如乙酸钠、乳酸钠、氯化钠、氯化钾、氯化钙、脱水山梨糖醇单月桂酸酯、三乙醇胺油酸酯等。在一些实施例中,药物组合物包含防腐剂。在一些其他实施例中,药物组合物不包含防腐剂。
病毒载体(例如本文披露的组合物和配制品中的那些)的基因组滴度可以以多种标准方式测定。使用对病毒载体具有特异性的引物的PCR可以提供相对测量,但定量PCR(qPCR)可以用于较少的样品和绝对测量。液滴数字PCR(ddPCR)是一种用于进行基于水-油乳液滴技术的数字PCR的方法。将样品分成数以万计的液滴,并且模板分子的PCR扩增发生在每个单独的液滴中。不需要绘制标准曲线或使用具有高扩增效率的引物,因此ddPCR典型地不使用与传统的基于PCR的技术一样多的样品。在一个实施例中,病毒载体的基因组滴度是使用PCR来测定。在另一个实施例中,病毒载体的基因组滴度是使用qPCR来测定。在另一个实施例中,病毒载体的基因组滴度是使用ddPC来测定。使用ddPC R测定病毒基因组滴度的方法已例如描述于以下文献中:Lock等人,“A bsolute Determination of Single-Stranded and Self-Complementary Aden o-Associated Viral Vector Genome Titersby Droplet Digital PCR[通过液滴数字PCR绝对测定单链和自身互补型腺相关病毒载体基因组滴度],”Human Gene Therapy Methods[人类基因治疗方法],25(2):115-125。
在一些实施例中,基于PCR的方法使用特异性设计的靶向SMN基因的引物和探针来检测和定量衣壳化AAV9病毒基因组。在其他实施例中,基于PCR的方法使用特异性设计的靶向鸡β-肌动蛋白启动子的引物和探针来检测和定量衣壳化AAV9病毒基因组。在其他实施例中,基于PCR的方法使用特异性设计的靶向CMV增强子的引物和探针来检测和定量衣壳化AAV9病毒基因组。在其他实施例中,基于PCR的方法使用特异性设计的靶向ITR序列的引物和探针来检测和定量衣壳化AAV9病毒基因组。在其他实施例中,基于PCR的方法使用特异性设计的靶向牛生长激素聚腺苷酸化信号的引物和探针来检测和定量衣壳化AAV9病毒基因组。
在一些实施例中,药物组合物是约pH 7.7-8.3,并且具有390-430mOsm/kg的摩尔渗透压浓度。在一些实施例中,pH是使用pH计测量。在一些实施例中,pH是根据美国药典(USP)设定的标准(例如<791>)(通过援引以其全文并入)使用具有温度补偿的微电极以电位方式测量。在一些实施例中,摩尔渗透压浓度是根据USP(例如USP<785>)(通过援引以其全文并入)使用凝固点降低测量。在一些实施例中,摩尔渗透压浓度是使用蒸气压降低渗透压计测量。在其他实施例中,渗透压是使用膜渗透压计测量。
在一个实施例中,静脉内配制品具有在7.5与8.5之间的pH、2X10
在一个实施例中,IV配制品在pH 8.0下的20mM Tris缓冲液中包含1mM MgCl
本披露内容提供了用包含含有转基因的病毒载体的疗法治疗有需要的患者的方法,该方法包括:根据本文所述的基于细胞的体外效力测定的方法测定所述含有转基因的病毒载体,并向所述患者施用该含有转基因的病毒载体。在一些实施例中,将病毒载体配制在药物组合物中。
在其他实施例中,本文披露了用于将多核苷酸递送至患者的中枢神经系统的方法,这些方法包括施用具有将包括多核苷酸的基因组的rAAV9。在一些实施例中,递送是将多核苷酸鞘内递送至患者的中枢神经系统,包括施用具有将包括多核苷酸的基因组的rAAV9。在一些实施例中,非离子型低渗透性对比剂也被施用至患者。非离子型低渗透性对比剂可以增加患者中枢神经系统中靶细胞的转导。在一些实施例中,rAAV9基因组是自身互补型基因组。在其他实施例中,rAAV9基因组是单链基因组。
在一些实施例中,非离子型低渗透性对比剂也被施用至患者。更具体地,本发明提供了将载体递送至有需要的患者的中枢神经系统的方法,这些方法包括将rAAV9和非离子型低渗透性对比剂鞘内递送至患者,其中rAAV9包含编码目的蛋白的多核苷酸。在一些实施例中,目的蛋白是SMN1。多核苷酸递送至例如脑、脊髓、神经胶质细胞、星形胶质细胞和/或下运动神经元。非离子型低渗透性对比剂是例如碘比醇(iobitridol)、碘海醇(iohexol)、碘美普尔(iomeprol)、碘帕醇(iopamidol)、碘喷托(iopentol)、碘普胺(iopromide)、碘佛醇(ioversol)或碘昔兰(ioxilan)。在一些实施例中,多核苷酸是运动神经元存活(SMN)多核苷酸。示例性碘海醇不透射线剂包括[Omnipaque.TM.(碘海醇,N,N'-双(2,3-二羟基丙基)-5-[N(2,3-二羟基丙基)-乙酰胺基]-2,4,6-三碘代-异酞酰胺),GE医疗,威斯康星州沃基肖(Waukesha,Wis.)]。在一些实施例中,将载体和对比剂鞘内施用,并利用实时连续荧光检查法记录鞘内扩散。
在一些实施例中,多核苷酸递送至脑区。设想用于递送的脑区域包括但不限于运动皮层和脑干。在一些实施例中,多核苷酸递送至脊髓。在一些实施例中,多核苷酸递送至下运动神经元。本披露内容的实施例采用rAAV9将多核苷酸递送至神经和神经胶质细胞。在一些实施例中,神经胶质细胞是小神经胶质细胞、少突胶质细胞或星形胶质细胞。在一些实施例中,rAAV9用于将多核苷酸递送至施万细胞。
在一些实施例中,指示了这些方法和材料用于治疗脊髓性肌萎缩(SMA)的用途。
有四种类型的SMA,这些类型常规地按发病年龄及所实现的最高运动功能分类。所有形式的SMA均是常染色体隐性遗传,并且由运动神经元存活1(SMN1)基因的突变引起。人还携带称为SMN2的第二几乎相同的SMN基因拷贝。Lefebvre等人“Identification andcharacteriza tion of a spinal muscular atrophy-determining gene[脊髓性肌萎缩决定基因的鉴定和表征].”Cell[细胞],80(1):155-65。Monani等人“Spinal muscularatrophy:a deficiency in a ubiquitous protein;a motor-neuronspecific disease[脊髓性肌萎缩:遍在蛋白的缺乏;运动神经元特异性疾病].”Neuron[神经元],48(6):885-896。SMN1和SMN2基因两者均表达SMN蛋白,然而SMN2在外显子7中含有翻译沉默突变,这导致SMN2转录物中包含无效的外显子7。因此,SMN2产生全长SMN蛋白和缺少外显子7的SMN的截短型,其中截短型为主要形式。因此,由SMN2产生的功能性全长蛋白的量比由SMN1产生的功能性全长蛋白的量少得多(少70%-90%)。Lorson等人“A single nucleotide in the SMN gene regulates splicing and is responsible for spinal muscular atro phy[SMN基因中的单一核苷酸调节剪接并造成脊髓性肌萎缩].”PNAS,96(11)6307-6311。Monani等人,“A single nucleotide difference that al ters splicing patternsdistinguishes the SMA gene SMN1 from the copygene SMN2[改变剪接模式的单一核苷酸差异将SMA基因SMN1与拷贝基因SMN2区分开].”Hum Mol Genet[人类分子遗传学]8(7):1177-1183。尽管SMN2不能完全补偿SMN1基因的丧失,但是患有较轻度形式的SMA的患者通常具有较多的SMN2拷贝数。Lefebvre等人,“Corre lation between severity and SMNprotein level in spinal muscular atrophy[脊髓性肌萎缩的严重程度与SMN蛋白水平之间的相关性].”Nat Genet[自然遗传学]16(3):265-269。Park等人,“Spinal muscularatrophy:new and emerging insights from model mice[脊髓性肌萎缩:来自模型小鼠的新兴见解].”Curr Neurol Neurosci Rep[当代神经学和神经科学报告]10(2):108-117。需要注意的是,SMN2拷贝数不是唯一的表型修饰物。特别地,SMN2基因的外显子7中的c.859G>C变体已经报道为阳性疾病修饰物。具有此特定突变的患者具有较不严重的疾病表型。Prior等人,“A positive modified of spinal muscular atrophy in the SMN2 gene[SMN2基因中脊髓性肌萎缩的阳性修饰].”Am J Hum Genet[美国人类遗传学杂志]85(3):408-413。
当SMA症状在出生时或到6月龄前出现时,则为I型SMA(也称为婴儿发病型或韦德尼希-霍夫曼病(Werdnig-Hoffmann disease))。在此类型中,婴儿典型地具有低肌肉张力(张力过低)、微弱的哭声及呼吸困难。他们常常难以吞咽和吸吮,且没有达到能够无辅助坐起来的发育里程碑。他们常常显示出选自以下的SMA症状中的一种或多种:张力过低、运动技能延迟、头部控制差、圆肩姿势及关节过度活动。典型地,这些婴儿具有两个拷贝的SMN2基因,每个5号染色体上一个拷贝。在所有新的SMA病例中,超过一半是SMA I型。
当SMA在7至18月龄之间和在儿童可独立站立或行走前发病,则为II型或中级SMA。患有2型SMA的儿童通常具有至少三个SMN2基因。迟发型SMA(也称为III和IV型SMA、轻度SMA、成人发病型SMA及库格尔贝格-韦兰德病(Kugelberg-Welander disease))导致不同的无力水平。III型SMA在18个月后发病,并且儿童可独立站立和行走,但是他们可能需要帮助。IV型SMA是在成人期发病,并且人们在其成年期间能够行走。患有III或IV型SMA的人们通常具有在四个与八个之间的SMN2基因,可由此产生相当多的全长SMN蛋白。
在一个实施例中,术语“治疗”包括将有效剂量或有效多个剂量的包含如本文披露的rAAV的组合物静脉内或经由鞘内途径施用至有需要的动物(包括人类)的步骤。如果剂量在障碍/疾病发展之前施用,则该施用是预防性的。如果剂量在疾病发展之后施用,则该施用是治疗性的。在实施例中,有效剂量是缓解(消除或者减少)与所治疗的障碍/疾病状态相关的至少一种症状、减慢或防止进展成障碍/疾病状态、减慢或防止障碍/疾病状态进展、减弱疾病的程度、导致疾病(部分或全部)缓解和/或延长存活期的剂量。本文列出了设想治疗的疾病状态的实例。
在一个实施例中,将包含本披露内容的rAAV的组合物静脉内施用至有需要的患有SMA(例如SMA I型)的患者。在一些实施例中,患有SMA的患者小于2岁。在一些实施例中,患者在SMN1基因中具有双等位基因突变。在另一个实施例中,将包含本披露内容的rAAV的组合物鞘内施用至有需要的患有SMA II、III或IV型的患者。在一些实施例中,将包含本披露内容的rAAV的组合物用于治疗患有SMA且在SMN1基因中具有双等位基因突变的小于2岁的儿科患者。
本文披露了通过经由鞘内或静脉内途径施用AAV9病毒载体治疗有需要的患者的SMA(例如I型SMA)的方法。在一些实施例中,患者为0-9月龄。在一些其他实施例中,患者为0-6月龄。在一些实施例中,患者小于2岁。在一些实施例中,患者小于2岁且在SMN1基因中具有双等位基因突变。在将病毒载体用于治疗患者的SMA(例如I型SMA)的一些实施例中,测定患者的体重。在一些实施例中,患者具有小于13.5kg的体重。在一些实施例中,患者具有小于8.5kg的体重。在一些实施例中,患者具有超过2.6kg的体重。在一些实施例中,患者具有2.6-8.5kg的体重。在一些实施例中,患者具有2.6-13.5kg的体重。
在一些实施例中,患者在一个拷贝的SMN1基因中具有突变,例如无效突变(涵盖使编码的SMN1无功能的任何突变)。在一些实施例中,患者在两个拷贝的SMN1基因中具有突变,例如无效突变。在一些实施例中,患者在所有拷贝的SMN1基因中具有突变,例如无效突变。在一些实施例中,患者在一个拷贝的SMN1基因中具有缺失。在一些实施例中,患者在两个拷贝的SMN1基因中具有缺失。在一些实施例中,患者具有双等位基因SMN1突变,即在染色体的两个等位基因中具有SMN1的缺失或取代。在一些实施例中,患者具有至少一个功能性拷贝的SMN2基因。在一些实施例中,患者具有至少两个功能性拷贝的SMN2基因。在一些实施例中,患者具有至少两个功能性拷贝的SMN2基因。在一些实施例中,患者具有至少三个功能性拷贝的SMN2基因。在一些实施例中,患者具有至少四个功能性拷贝的SMN2基因。在一些实施例中,患者具有至少五个功能性拷贝的SMN2基因。在一些实施例中,患者在至少一个拷贝的SMN2基因的外显子7中没有c.859G>C取代。在一些实施例中,SMN1或SMN2基因的遗传序列可以通过全基因组测序来测定。在其他实施例中,SMN1或SMN2基因的遗传序列和拷贝数可以通过高通量测序来测定。在一些实施例中,SMN1或SMN2基因的遗传序列和拷贝数可以通过微阵列分析来测定。在一些实施例中,SMN1或SMN2基因的遗传序列和拷贝数可以通过桑格(Sanger)测序来测定。在一些实施例中,SMN1或SMN2基因的拷贝数可以通过荧光原位杂交(FISH)来测定。
在一些实施例中,患者显示一种或多种SMA症状。SMA症状可以包括张力过低、运动技能延迟、头部控制差、圆肩姿势及关节过度活动。在一些实施例中,头部控制差是通过使患者置于环坐位置而在肩部(前部及后部)给予辅助下来测定。头部控制是通过患者保持头部直立的能力来评估。在一些实施例中,当患者处于仰卧位时观察自发性移动,并且运动技能是通过患者将其肘部、膝盖、手和脚抬离表面的能力来评估。在某些实施例中,患者的握力是通过将手指置于患者的手掌中且抬起患者直到其肩部离开表面来测量。张力过低和握力是通过患者维持多快/多久的抓握来测量。在一些实施例中,头部控制是通过将患者的头部置于最大可能的旋转处并且测量患者头部向中线转回的能力来评估。在一些实施例中,肩部姿势可以通过使患者在头部和躯干支撑的情况下坐着,且观察患者是否屈曲肘部或肩部以伸手够到放置在臂长处的肩部水平的刺激物来评估。在一些实施例中,肩部姿势也可以通过使患者置于侧卧位,且观察患者是否屈曲肘部或肩部以伸手够到放置在臂长处的肩部水平的刺激物来评估。在一些实施例中,运动技能是通过观察患者在脚被抚摸、挠或捏时是否屈曲其髋部或膝盖来评估。在一些实施例中,肩部屈曲、肘部屈曲、髋部内收、颈屈曲、头部伸展、颈伸展及/或脊柱内曲可以通过已知的临床量度,例如CHOP INTEND来评估。其他SMA症状可以根据已知的临床量度,例如CHOP INTEND来评价。
在一些实施例中,患者是在其显示出如使用本文所述的测试之一所测定的SMA(例如I型SMA)的症状(例如一种或多种症状)后被治疗。在一些实施例中,患者是在其显示出SMA(例如I型SMA)症状之前被治疗。在一些实施例中,患者是在出现症状之前基于基因测试而被诊断为患有SMA(例如I型SMA)。
本文还设想了组合疗法。如本文所用的组合包括同时治疗或依序治疗。方法的组合可以包括添加某些标准医学治疗(例如在ALS中的利鲁唑(ALS)),以及与新型疗法的组合。例如,用于SMA的其他疗法包括改变与前体mRNA的结合并改变其剪接模式的反义寡核苷酸(ASO)。Singh.等人,“A multi-exon-skipping detection assay reveals surprisingdiversity of splice isoforms of spinal muscular atrophy genes[多外显子跳跃检测测定揭示了脊髓性肌萎缩基因的剪接同种型的惊人多样性].”Plos One[公共科学图书馆·综合],7(11):e49595。在一个实施例中,可以使用诺西那生钠(nusinersen)(美国专利8,361,977和US 8,980,853,将这些文献通过援引并入本文)。诺西那生钠是靶向SMN2前体mRNA的内含子6、外显子7或内含子7从而调节SMN2的剪接以更高效地产生全长SMN蛋白的经批准ASO。在一些实施例中,将包含AAV9病毒载体的治疗方法与肌肉增强剂组合施用。在一些实施例中,将包含AAV9病毒载体的治疗方法与神经保护剂组合施用。在一些实施例中,将包含AAV9病毒载体的治疗方法与靶向SMN的基于反义寡核苷酸的药物组合施用。在一些实施例中,将包含AAV9病毒载体的治疗方法与诺西那生钠组合施用。在一些实施例中,将包含AAV9病毒载体的治疗方法与抑制肌生成抑制蛋白的药物组合施用。在一些实施例中,将包含AAV9病毒载体的治疗方法与司达鲁单抗(stamulumab)组合施用。
虽然设想了在出生后递送至有需要的个体,但是也设想了子宫内递送至胎儿。
设想了使用包含病毒载体的药物组合物治疗SMA(例如I型SMA)的患者的方法。在一些实施例中,以约1-8x10
在将病毒载体用于治疗患者的SMA(例如I型SMA)的一些实施例中,将AAV病毒载体(例如AAV SMN)以约1.0-2.5x10
待施用的rAAV病毒载体的滴度将根据例如特定rAAV、施用方式、治疗目标、个体和所靶向的一种或多种细胞类型而变化,并且可以通过本领域的方法标准来测定。rAAV的滴度范围可以是每ml约1X10
剂量还可以根据向人施用的时间安排而变化。在成人中,rAAV的这些剂量范围可以是约1X10
剂量还可以根据向人施用的时间安排而变化。在成人中,rAAV的这些剂量范围可以是约1X10
在一些实施例中,该剂量保留了相对于相同剂量下的参考标准品的至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、至少99.5%、至少99.9%、至少100%、至少110%、至少120%、至少130%或至少140%的效力。在一些实施例中,该剂量保留了相对于在相同剂量下的参考标准品的至少90%的效力。在一些实施例中,相对效力使用本文所述的基于细胞的体外相对效力测定来测定。
在一个实施例中,剂量是约1.1X10
剂量可以以多种标准方式测定。使用对病毒载体具有特异性的引物的PCR可以提供相对测量,但qPCR可以用于较少的样品和绝对测量。ddPCR是一种用于进行基于水-油乳液滴技术的数字PCR的方法。Baker等人,“Digital PCR hits its stride[数字PCR取得了很大的进步].”Nature Methods[自然方法],9(6):541-544。Sykes等人,“Quantitation oftargets for PCR by use of limiting dilution[通过使用有限稀释定量用于PCR的靶标].”Biotechniques[生物技术],13(3)444-449。将样品分成数以万计的液滴,并且模板分子的PCR扩增发生在每个单独的液滴中。不需要绘制标准曲线或使用具有高扩增效率的引物,因此ddPCR典型地不使用与传统的基于PCR的技术一样多的样品。可商购的ddPCR机器的实例包括但不限于伯乐QX100 ddPCR和RainDance Raindrop数字PCR。在一个实施例中,剂量是使用PCR来测定。在另一个实施例中,剂量是使用qPCR来测定。在另一个实施例中,剂量是使用数字液滴PCR(ddPCR)来测定。在一些实施例中,基于PCR的方法使用特异性设计的靶向SMN基因的引物和探针来检测和定量衣壳化AAV9病毒基因组。在其他实施例中,基于PCR的方法使用特异性设计的靶向鸡β-肌动蛋白启动子的引物和探针来检测和定量衣壳化AAV9病毒基因组。在其他实施例中,基于PCR的方法使用特异性设计的靶向CMV增强子的引物和探针来检测和定量衣壳化AAV9病毒基因组。在其他实施例中,基于PCR的方法使用特异性设计的靶向ITR序列的引物和探针来检测和定量衣壳化AAV9病毒基因组。在其他实施例中,基于PCR的方法使用特异性设计的靶向牛生长激素聚腺苷酸化信号的引物和探针来检测和定量衣壳化AAV9病毒基因组。
在一个方面,根据下表施用剂量,使用2.0X10
表2.给药
在一些实施例中,将包含AAV病毒载体的药物组合物经约20-70分钟,例如经约45-70分钟输注至患者中。在一些实施例中,将包含AAV病毒载体的药物组合物经约60min输注至患者中。在一些实施例中,使用输注泵、蠕动泵或本领域已知的任何其他设备将包含AAV病毒载体的药物组合物输注至患者中。在一些实施例中,使用注射器泵将包含AAV病毒载体的药物组合物输注至患者中。
还设想了对顺从治疗的患者的预筛选,以及向根据本文披露的标准鉴定的患者的治疗的施用。AAV可引起细胞免疫应答和体液免疫应答两者。因此,用于基于AAV的基因疗法的一部分潜在患者具有预先存在的针对AAV的抗体。Jeune等人,“Pre-existing anti-Adeno-Associated Virus antibodies as a challenge in AAV gene therapy[作为AAV基因疗法中的挑战的预先存在的抗腺相关病毒抗体].”Hum Gene Ther Methods[人类基因治疗方法],24(2):59-67。Boutin等人,“Prevalence of serum IgG and neutralizingfactors against adeno-associated virus(AAV)types 1,2,5,6,8,and 9 in thehealthy population:implications for gene therapy using AAV vectors[健康群体中针对腺相关病毒(AAV)1、2、5、6、8和9型的血清IgG和中和因子的流行性:用于使用AAV载体的基因疗法的意义].”Hum Gene Ther[人类基因疗法],21:704-712.因为即使非常低水平的抗体也可能阻止成功的转导,所以先前的抗AAV抗体对AAV基因疗法的普遍应用组成严重的障碍。在一些实施例中,在施用AAV病毒载体之前测定患者中抗AAV9抗体滴度的水平。在一些实施例中,患者中抗AAV9抗体滴度的水平是通过ELISA结合免疫测定来测定。在一些实施例中,患者在施用治疗之前具有如通过ELISA结合免疫测定所测定的等于或低于1:100的抗AAV9抗体滴度。在一些实施例中,患者在施用治疗之前具有如通过ELISA结合免疫测定所测定的等于或低于1:50的抗AAV9抗体滴度。在一些实施例中,患者在治疗之后具有如通过ELISA结合免疫测定所测定的高于1:100的抗AAV9抗体滴度,并对该患者监测1-8周或直至滴度降低至低于1:100。在一些实施例中,患者在治疗之后具有如通过ELISA结合免疫测定所测定的高于1:100的抗AAV9抗体滴度,并对该患者监测1-8周或直至滴度降低至低于1:50。
克服高抗AAV抗体滴度的一种方法是使用免疫抑制剂药物。已显示抗CD20单克隆抗体利妥昔单抗(rituximab)与环孢菌素A的组合有效降低抗AAV滴度。Mingozzi等人,“Pharmacological modulation of humoral immunity in a nonhuman primate modelof AAV gene transfer for hemophilia B[用于血友病B的AAV基因转移的非人类灵长类动物模型中体液免疫的药理学调节].”Mol Ther[分子疗法],20:1410-1416。另一种方法是在载体施用之前使用血浆置换耗尽中和抗体。Monteilhet等人,“A 10 patient casereport on the impact of plasmapheresis upon neutralizing factors againstadeno-associated virus(AAV)types 1,2,6,and 8[关于血浆置换对针对腺相关病毒(AAV)1、2、6和8型的中和因子的影响的10名患者病例报吿].”Mol Ther[分子疗法],19(11):2084-2091。在血浆置换期间,从患者中抽出血液,并且通过离心或中空纤维过滤分离血浆和血细胞。然后,将血细胞与经处理的血浆或替代流体(如在盐水中的4.5%人白蛋白)一起返回患者。治疗性单采术的常见用途是去除不需要的免疫球蛋白,但在这种情况下,血浆置换代表了一种耗尽抗AAV抗体的有吸引力的方法。在一些实施例中,患者在治疗之前或之后具有如通过ELISA结合免疫测定所测定的高于1:100的抗AAV9抗体滴度,并用血浆置换治疗。在一些实施例中,患者在治疗之前或之后具有如通过ELISA结合免疫测定所测定的高于1:50的抗AAV9抗体滴度,并用血浆置换治疗。
预先存在的针对AAV9的母体抗体可以通过母乳或子宫中的胎盘转移而转移至婴儿患者。在一些实施例中,患者在治疗之前或之后具有如通过ELISA结合免疫测定所测定的高于1:100的抗AAV9抗体滴度,并转换成配方食品喂养(formula feeding)。在一些实施例中,患者在治疗之前或之后具有如通过ELISA结合免疫测定所测定的高于1:50的抗AAV9抗体滴度,并转换成配方食品喂养。
在施用治疗之前和之后,可以监测患者的病症。一些已接受了基于AAV的治疗的患者已经历了血小板减少症,血小板减少症是以血小板计数低为特征的一种病症。血小板减少症可以使用稀释的血液样品在血细胞计数器上通过全血计数来检测。血小板减少症也可以通过在显微镜下观察用患者血液制备的载玻片(血液薄膜或周边血液涂片)来检测。正常人血小板计数范围是150,000个细胞/ml至约450,000个细胞/ml。
在一些实施例中,患者在施用前具有高于约67,000个细胞/ml或高于约100,000个细胞/ml或高于约150,000个细胞/ml的血小板计数。在一些实施例中,患者在施用前具有低于约150,000个细胞/ml或低于约100,000个细胞/ml、或低于约67,000个细胞/ml的血小板计数,并对该患者监测1-8周或直至血小板计数增加至高于约67,000个细胞/ml、或高于约100,000个细胞/ml、或高于约150,000个细胞/ml。在施用病毒载体之后血小板计数低于约67,000个细胞/ml的一些实施例中,可以用血小板输注来治疗患者。在一些实施例中,患者在施用病毒载体之前不患有血小板减少症。在一些实施例中,患者在施用病毒载体之后患有血小板减少症,并对该患者监测约1-8周或直至患者不患有血小板减少症。在一些实施例中,患者在施用病毒载体之后患有血小板减少症,并用血小板输注来治疗患者。
监测患者的病症可能还涉及测量以下项的标准血液测试:血小板、血清蛋白电泳、血清γ-谷氨酰转移酶(GGT)、天冬氨酸转氨酶(AST)和丙氨酸转氨酶(ALT)、总胆红素、葡萄糖、肌酸激酶(CK)、肌酐、血尿素氮(BUN)、电解质、碱性磷酸酶和淀粉酶。肌钙蛋白I水平是心脏健康的一般量度,并且升高的水平反映出心脏损伤或心脏相关病症。在一些实施例中,在施用病毒载体之后监测肌钙蛋白-I水平。在一些实施例中,在施用病毒载体之前,患者可能具有小于约0.3、0.2、0.15或0.1μg/ml的肌钙蛋白-I水平。在一些实施例中,在施用病毒载体之前,患者可能具有小于约0.176μg/ml的肌钙蛋白-I水平。在一些实施例中,在施用病毒载体之后,患者可能具有高于约0.176μg/ml的肌钙蛋白-I水平。在一些实施例中,患者在施用病毒载体之后接受心脏监测,直至肌钙蛋白-I水平小于约0.176μg/ml。
天冬氨酸转氨酶(AST)和丙氨酸转氨酶(ALT)和总胆红素是肝功能的一般量度,而肌酐追踪肾功能。AST、ALT或总胆红素的水平升高可能指示肝功能不全。在一些实施例中,患者在施用病毒载体前具有正常的肝功能。在一些实施例中,患者在施用病毒载体前具有小于约8-40U/L的肝转氨酶水平。在一些实施例中,患者在施用病毒载体前具有小于约8-40U/L的AST或ALT水平。在一些实施例中,患者在施用病毒载体前具有小于3.0mg/dL的胆红素水平。在一些实施例中,患者在施用病毒载体前具有小于1.8mg/dL的肌酐水平。在一些实施例中,患者在施用病毒载体前具有在8-18g/dL之间的血红蛋白(Hgb)水平。在一些实施例中,患者在施用病毒载体前具有小于20000/mm
治疗方法的功效可以在治疗之前和之后使用多种用于运动技能的测试来测定。特别是,开发费城儿童医院神经肌肉障碍婴儿测试(Children’s Hospital of PhiladelphiaInfant Test of Neuromuscular Disorders)(CHOP INTEND)以评价I型SMA患者的运动技能。Glanzman等人,“The Children’s Hospital of Philadelphia Infant Test ofNeuromuscular Disorders(CHOP INTEND):Test development and reliability[费城儿童医院神经肌肉障碍婴儿测试(CHOP INTEND):测试开发和可靠性].”NeuromuscularDisorders[神经肌肉障碍],20(3):155-161。CHOP INTEND测试是在用新设计用于SMA的运动评估的婴儿运动性能测试(Test of Infant Motor Performance)(TIMP)和费城儿童医院的SMA强度测试(The Children’s Hospital of Philadelphia Test of Strength inSMA)(CHOP TOSS)评价26位平均年龄11.5个月(1.4至37.9个月)、患有I型SMA的婴儿后开发。治疗功效的测试不限于CHOP INTEND测试,但也可包括本领域中已知的其他运动技能测试,包括但不限于TIMP、CHOP TOSS、皮巴迪运动发育量表(Peabody Development MotorScale)、布列兹顿新生儿行为评估测试(Brazelton Neonatal Behavior Assessmenttest)、运动里程碑发育调查(Motor Milestone Development Survey)、通过交互式视频评价捕获的能力(Ability Captured Through Interactive Video Evaluation)(ACTIVE)、贝莉婴儿发育量表(Bayley Scale of Infant Development)和复合运动动作电位测量(measurements of compound motor action potentials)(CMAP)。
在一些实施例中,在治疗之前的基线测试是使用CHOP INTEND量表进行。在一个实施例中,治疗的功效是在追踪访视期间使用CHOP INTEND量表来测定。在一些实施例中,CHOP INTEND包括以下的量度:头部控制,翻正反应,处于支撑就坐、仰卧位和俯卧位的躯干移动。在一些实施例中,CHOP INTEND包括在辅助滚动、腹部悬抱和支撑站立方面的反重力移动的量度。
在许多涉及AAV载体的基因疗法研究中,已经观察到对AAV载体的抗原特异性T细胞应答,并且可以预期是在基因转移后的2-4周之间。这种抗原特异性T细胞应答的一种可能的结果是经转导细胞的清除和转基因表达的丧失。为了抑制宿主对基于AAV的疗法的免疫应答,可以给予患者免疫抑制剂。在一些实施例中,可以在施用病毒载体之前给予患者糖皮质激素。在一些实施例中,可以在施用病毒载体之前给予患者皮质类固醇。在一些实施例中,可以在施用病毒载体之前给予患者口服类固醇。口服类固醇的实例包括但不限于泼尼松、泼尼松龙、甲基泼尼松龙、曲安西龙(triamcinolone)、贝他米松(bethamethasone)、地塞米松和氢化可的松。在一些实施例中,口服类固醇是或包含泼尼松龙。在一些实施例中,在施用病毒载体之前至少24小时患者开始使用预防性类固醇。在一些实施例中,在施用病毒载体之后,给予患者口服类固醇至少30天。在一些实施例中,将口服类固醇每日施用一次。在一些实施例中,将口服类固醇每日施用两次。在一些实施例中,将口服类固醇以约0.1-10mg/kg,例如约1mg/kg的剂量给予。在一些实施例中,将口服类固醇以约0.1-10mg/kg/天,例如约1mg/kg/天的剂量给予。在一些实施例中,在施用病毒载体后监测AST和ALT的水平。在此类实施例中,当AST和ALT水平例如如通过本领域已知的临床标准和方法所测定超过正常上限的两倍、或约120IU/L时,施用口服类固醇治疗。在一些实施例中,只要AST和ALT水平例如如通过本领域已知的临床标准和方法所测定超过正常上限的两倍、或超过约120IU/L时,就施用口服类固醇治疗超过30天。在用皮质类固醇持续治疗期间,肾上腺自然地减少皮质醇的产生。如果突然停止皮质类固醇治疗,身体可能经历皮质醇缺乏症。在将口服类固醇给予患者至少30天的一些实施例中,类固醇剂量按时间表缓慢地逐渐减少。在一些实施例中,当AST和ALT水平例如如通过本领域已知的临床标准和方法所测定下降至低于正常上限的两倍、或约120IU/L时,逐渐减少口服类固醇剂量。在一些实施例中,逐渐减少包括逐步减量至0.5mg/kg/天持续2周,之后为0.25mg/kg/天再持续2周。在一些其他实施例中,口服类固醇的逐渐减少由医生判断进行。
在一个实施例中,本文提供了一种试剂盒,该试剂盒包括:
a.能够用病毒载体转导的多个细胞;
b.编码目的蛋白的病毒载体;
c.能够结合该目的蛋白的第一分子;
d.能够结合该第一分子的第二分子,其中该第二分子包括可检测标记;以及,
e.在成像测定中的使用说明书。
在本披露内容的试剂盒的一些实施例中,多个细胞包括在SMN1-/-遗传背景下的神经祖细胞(mTD-NPC-?7)。
在一些实施例中,病毒载体药物产品是腺相关病毒血清型9(AAV9),该腺相关病毒血清型9包含在巨细胞病毒(CMV)增强子/鸡-β-肌动蛋白杂合启动子(CB)的控制下表达SMN1蛋白的cDNA、和来自AAV血清型2(AAV2)DNA的两个AAV反向末端重复序列(ITR)。在一些实施例中,载体包含SEQ ID NO:2的序列。在一些实施例中,载体包含SEQ ID NO:1的序列。在一些实施例中,载体包含编码含有氨基酸序列SEQ ID NO:3的SMN1蛋白的序列。
在一些实施例中,第一分子包括抗SMN1抗体。示例性抗体包括小鼠单克隆抗体2B1抗体。
在一些实施例中,第二分子包括对所述第一分子具有特异性的抗体。在一些实施例中,第二分子包括可检测标记。
还必须注意的是,如在本披露内容和所附权利要求中所使用,单数形式“一个/一种(a/an)”和“该(the)”包括复数指代物,除非上下文另外清楚地指明。任选的或任选地意指随后描述的事件或情形可以发生,或者可以不发生,并且该描述包括该事件或情形发生的情况和不发生的情况。例如,任选地组合物可以包含组合的短语意指组合物可以包含不同分子的组合或可以不包括组合,以使得该描述包括组合及不存在组合(即组合的单独成员)二者。范围在本文中可以表示为从约一个特定值和/或至约另一个特定值。当表示这种范围时,另一个方面包括从一个特定值和/或至另一个特定值。类似地,当通过使用前导词约来将值表示为近似值时,应当理解该特定值形成另一个方面。应进一步理解,每个范围的端值关于另一个端值以及独立于另一个端值都是有意义的。本披露内容中引用的所有参考文献均特此通过援引以其全文并入本文。
现将通过以下实例对本发明进行说明。应当理解,前述内容仅用于示例性目的,并不旨在限制本发明的范围。本领域的技术人员可以理解,可以在不脱离如权利要求所阐述的本发明的精神或范围的情况下进行修改。
列举的实施例
可以参考以下列举的实施例来理解本发明:
1.一种用于测量转基因表达的方法,该方法包括:
a)提供第一多个终末分化神经祖细胞(NPC);
b)用包含病毒载体的测试样品转导该第一多个终末分化NPC,该病毒载体包含编码目的蛋白的序列;
c)在足以表达该目的蛋白的条件下孵育所转导的该第一多个终末分化NPC;
d)使来自(c)的该第一多个终末分化NPC与对该目的蛋白具有特异性的分子接触;
e)对该第一多个终末分化NPC进行成像,以获得积分荧光强度/细胞(IFI-C)测定读出;并且
f)基于该IFI-C读出测定该目的蛋白的表达。
2.如实施例1所述的方法,其中该第一多个终末分化NPC对于运动神经元存活基因(SMN1)-/-突变是纯合的。
3.如实施例2所述的方法,其中该SMN1-/-突变包括SMN1外显子7的缺失(Δ7)。
4.如实施例1-3中任一项所述的方法,其中孵育步骤c)之后是固定和透化该第一多个终末分化NPC。
5.如实施例1-4中任一项所述的方法,该方法包括:
g)提供第二多个终末分化NPC;
h)用包含该病毒载体的参考标准品转导该第二多个终末分化NPC;
i)在足以表达该目的蛋白的条件下孵育所转导的该第二多个终末分化NPC;
j)使来自(i)的该第二多个终末分化NPC与对该目的蛋白具有特异性的分子接触;
k)对该第二多个终末分化NPC进行成像,以获得积分荧光强度/细胞(IFI-C)测定读出;并且
l)比较该第一多个终末分化NPC的IFI-C与该第二多个终末分化NPC的IFI-C;
从而测定该测试样品的该病毒载体相对于该参考标准品的相对效力。
6.如实施例5所述的方法,其中该第二多个终末分化NPC对于SMN1-/-突变是纯合的。
7.如实施例6所述的方法,其中该SMN1-/-突变包括SMN1外显子7的缺失(Δ7)。
8.如实施例4或5所述的方法,其中孵育步骤(i)之后是固定和透化该第二多个终末分化NPC。
9.如实施例1-8中任一项所述的方法,其中所述第一多个终末分化NPC和所述第二多个终末分化NPC是通过使从SMN1-/-小鼠胚胎的皮层分离的神经祖细胞终末分化而产生的。
10.如实施例9所述的方法,其中这些神经祖细胞(NPC)是通过以下方式终末分化的:
a.将这些NPC在含有表皮生长因子(EGF)和碱性成纤维细胞生长因子(bFGF)的无血清培养基中培养以形成神经球;
b.解离所述神经球以产生经解离的NPC;并且
c.将这些经解离的NPC在不具有生长因子的富血清培养基中培养;从而产生终末分化NPC。
11.如实施例1-10中任一项所述的方法,其中所述第一多个细胞和所述第二多个细胞被该测试样品和该参考标准品在该病毒载体的至少两种不同的感染复数(MOI)下转导。
12.如实施例11所述的方法,其中所述第一多个细胞和所述第二多个细胞在该测试样品和该参考标准品中的该病毒载体的5种不同的MOI下被转导。
13.如实施例12所述的方法,其中该5种MOI包括300,000、150,000、75,000、37,500、18,750个病毒颗粒/细胞。
14.如实施例5-13中任一项所述的方法,其中比较步骤(l)包括针对该测试样品和该参考标准品中的每一种绘制MOI相对于IFI-C的标准曲线。
15.如实施例5-14中任一项所述的方法,其中该比较步骤(l)包括针对该测试样品和该参考标准品中的每一种计算log MOI相对于IFI-C的线性回归,从而得出测试样品斜率和参考标准品斜率。
16.如实施例5-15中任一项所述的方法,其中测定该病毒载体的相对效力是通过平行线分析(PLA)来进行,并且其中该PLA包括测量该测试样品斜率相对于该参考标准品斜率的斜率比。
17.如实施例16所述的方法,其中该参考标准品斜率大于或等于1.02E+05。
18.如实施例16或17所述的方法,其中该斜率比在0.69-1.45之间。
19.如实施例16或17所述的方法,其中该斜率比在0.75与1.33之间。
20.如实施例16-19中任一项所述的方法,该方法包括计算该样品的线性回归的变异系数。
21.如实施例20所述的方法,其中该变异系数在15.6%与29.5%之间。
22.如实施例20所述的方法,其中该变异系数小于或等于40%、小于或等于30%或小于或等于20%。
23.如实施例16-22中任一项所述的方法,该方法包括计算该测试样品和该参考标准品的线性回归的R2值。
24.如实施例23所述的方法,其中该测试样品和该参考标准品的R2值大于或等于0.95。
25.如实施例16-24中任一项所述的方法,该方法包括计算该参考标准品的测定动态窗。
26.如实施例25所述的方法,其中该测定动态窗大于或等于2.69。
27.如实施例1-26中任一项所述的方法,其中该目的蛋白是运动神经元存活(SMN1)蛋白。
28.如实施例27所述的方法,其中该SMN1蛋白包含SEQ ID NO:3的氨基酸序列。
29.如实施例27或28的方法,其中该病毒载体是腺相关病毒血清型9(AAV9)。
30.如实施例27-29中任一项所述的方法,其中该病毒载体包含与编码该SMN1蛋白的序列可操作地连接的编码巨细胞病毒(CMV)增强子/鸡-β-肌动蛋白杂合启动子(CB)的序列。
31.如实施例27-30中任一项所述的方法,其中该病毒载体包含来自AAV血清型2(AAV2)DNA的AAV反向末端重复序列(ITR)。
32.如实施例27-31中任一项所述的方法,其中该病毒载体包含SEQ ID NO:1的序列。
33.如实施例1-32中任一项所述的方法,其中将这些细胞在用该病毒载体转导之前传代8至15次。
34.如实施例1-33中任一项所述的方法,其中该IFI-C读出反映了对蛋白质表达的测量。
35.如实施例1-34中任一项所述的方法,其中在转导后孵育这些终末分化NPC的步骤进行约69-75小时。
36.如实施例1-35中任一项所述的方法,其中对该目的蛋白具有特异性的该分子包括抗体、抗体片段或适体。
37.如实施例36所述的方法,其中该抗体包括对该目的蛋白具有特异性的抗体。
38.如实施例37所述的方法,其中以约4μg/mL的浓度提供该抗目的蛋白抗体。
39.如实施例37所述的方法,其中以约2μg/mL的浓度提供该抗目的蛋白抗体。
40.如实施例1-39中任一项所述的方法,其中该分子包括可检测标记。
41.如实施例1-40中任一项所述的方法,该方法进一步包括洗涤这些终末分化NPC以去除对该目的蛋白具有特异性的该分子。
42.如实施例1-38中任一项所述的方法,该方法进一步包括使这些终末分化NPC与特异性识别对该目的蛋白具有特异性的该分子的第二分子接触。
43.如实施例42所述的方法,其中该第二分子包括可检测标记。
44.如实施例42或43所述的方法,其中该第二分子包括抗体、抗体片段或适体。
45.如实施例1-44中任一项所述的方法,其中在该固定和透化步骤之后,使这些终末分化NPC与抗细胞核可检测标记接触。
46.如实施例1-45中任一项所述的方法,其中这些终末分化NPC在固体表面上。
47.如实施例46所述的方法,其中该固体表面包被有聚D-赖氨酸。
48.如实施例46或47所述的方法,其中以20,000个细胞/孔的密度接种这些终末分化NPC。
49.如实施例1-48中任一项所述的方法,其中该方法允许定量测量该目的蛋白的水平的剂量依赖性增加。
50.一种试剂盒,该试剂盒包括:
a.能够用病毒载体转导的多个细胞;
b.编码目的蛋白的病毒载体;
c.能够结合该目的蛋白的第一分子;
d.能够结合该第一分子的第二分子,其中该第二分子包括可检测标记;以及,
e.在成像测定中的使用说明书。
51.如实施例50所述的试剂盒,其中该多个细胞包括神经祖细胞(NPC)。
52.如实施例51所述的试剂盒,其中这些NPC对于SMN1-/-突变是纯合的。
53.如实施例51所述的试剂盒,其中该SMN1-/-突变是外显子7的缺失(Δ7)。
54.如实施例50-53中任一项所述的试剂盒,其中该病毒载体是腺相关病毒血清型9(AAV9),该腺相关病毒血清型9包含在巨细胞病毒(CMV)增强子/鸡-β-肌动蛋白杂合启动子(CB)的控制下表达SMN1蛋白的cDNA、和来自AAV血清型2(AAV2)DNA的两个AAV反向末端重复序列(ITR)。
55.如实施例50-54中任一项所述的试剂盒,其中该第一分子包括抗SMN1抗体。
56.如实施例50-55中任一项所述的试剂盒,其中该第二分子包括对所述第一分子具有特异性的抗体。
57.如实施例56所述的试剂盒,其中该第二分子包括可检测标记。
58.如实施例50-57中任一项所述的试剂盒,其中该目的蛋白是运动神经元存活(SMN1)蛋白。
59.一种产生包含含有转基因的病毒载体的药物组合物的方法,该方法包括:
a.产生该含有该转基因的病毒载体;
b.根据如实施例1-49中任一项所述的用于测量该转基因的方法测定所述病毒载体;并且
c.将该含有该转基因的病毒载体配制在药物组合物中。
60.如实施例59所述的方法,其中产生该病毒载体包括:
a.培养粘附型细胞;
b.用一种或多种质粒转染这些粘附型细胞以使得能够产生该AAV病毒载体;
c.裂解这些粘附型细胞以分离该AAV病毒载体;
d.酸化和澄清化(c)的该细胞裂解物;
e.使用阳离子交换色谱(CEX)纯化(d)的产物;
f.使用切向流过滤(TFF)过滤(e)的产物;
g.将(f)的产物在氯化铯(CsCl)缓冲液中超速离心;并且
h.从(g)的产物中收集这些AAV病毒载体。
61.如实施例60所述的方法,其中该AAV是AAV9。
62.如实施例60或61所述的方法,其中该AAV是自身互补型的(scAAV)。
63.如实施例60-61中任一项所述的方法,其中这些粘附型细胞是HEK293细胞。
64.如实施例60-63中任一项所述的方法,其中在培养之前针对粘附性对这些粘附型细胞进行选择。
65.如实施例60-64中任一项所述的方法,其中该选择包括多次继代培养这些粘附型细胞以选择粘附性。
66.如实施例60-65中任一项所述的方法,其中将这些粘附型细胞接种在生物反应器中以进行培养。
67.如实施例66所述的方法,其中该生物反应器是可以提供细胞培养基的连续循环的大规模生物反应器。
68.如实施例66或67所述的方法,其中该生物反应器是200m
69.如实施例66-68中任一项所述的方法,其中将这些粘附型细胞添加至再循环培养基袋中的培养基,并循环通过该生物反应器。
70.如实施例69所述的方法,其中将这些细胞使用蠕动泵循环。
71.如实施例70所述的方法,其中该蠕动泵送是连续的,同时将这些粘附型细胞接种在生物反应器中以进行培养。
72.如实施例71所述的方法,其中接种密度是约8,000-12,000个细胞/cm
73.如实施例60-72中任一项所述的方法,其中转染步骤包括将转染培养基添加至该再循环培养基袋,并使该转染培养基循环通过该生物反应器。
74.如实施例73所述的方法,其中将该转染培养基使用蠕动泵循环。
75.如实施例73或74所述的方法,其中该循环在15℃-25℃之间发生。
76.如实施例60-75中任一项所述的方法,其中该转染步骤包括使该粘附型细胞与腺病毒辅助质粒(pHELP)接触。
77.如实施例60-76中任一项所述的方法,其中该转染步骤包括使该粘附型细胞与编码AAV rep基因的质粒接触。
78.如实施例60-77中任一项所述的方法,其中该转染步骤包括使该粘附型细胞与编码AAV cap基因的质粒接触。
79.如实施例60-78中任一项所述的方法,其中该转染步骤包括使该粘附型细胞与在同一质粒(pAAV)上编码AAV rep基因和AAV cap基因的质粒接触。
80.如实施例77或实施例79所述的方法,其中该AAV rep基因是rep2。
81.如实施例78或79所述的方法,其中该AAV cap基因是cap9。
82.如实施例60-81中任一项所述的方法,其中该转染步骤包括使该粘附型细胞与转染剂聚乙烯亚胺(PEI)接触。
83.如实施例82所述的方法,其中PEI与这些质粒中的至少一种的比率是按重量计小于1:1。
84.如实施例82所述的方法,其中PEI与这些质粒中的至少一种的比率是按重量计约1:1。
85.如实施例73-84中任一项所述的方法,其中该转染步骤包括使该粘附型细胞与不含血清的转染培养基接触。
86.如实施例60-85中任一项所述的方法,其中该转染步骤包括使该粘附型细胞与不含钙的转染培养基接触。
87.如实施例60-86中任一项所述的方法,其中该转染步骤包括使该粘附型细胞与不含谷氨酰胺的转染培养基接触。
88.如实施例60-87中任一项所述的方法,其中该转染步骤进行10-60分钟、10-30分钟、20-30分钟、15-30分钟或进行少于30分钟。
89.如实施例60-88中任一项所述的方法,其中裂解步骤包括全细胞裂解。
90.如实施例60-89中任一项所述的方法,其中该裂解步骤包括使用补充有核酸内切酶的裂解缓冲液。
91.如实施例90所述的方法,其中该核酸内切酶是全能核酸酶。
92.如实施例60-91中任一项所述的方法,其中该裂解步骤包括使用补充有吐温的裂解缓冲液。
93.如实施例60-92中任一项所述的方法,其中该裂解步骤在15℃-25℃之间进行。
94.如实施例60-93中任一项所述的方法,该方法进一步包括在(d)的酸化步骤之前冷冻步骤(c)的细胞裂解物。
95.如实施例60-94中任一项所述的方法,其中该CsCl缓冲液是2-4M CsCl缓冲液。
96.如实施例60-94中任一项所述的方法,其中该CsCl是在约3M的浓度下。
97.如实施例60-96中任一项所述的方法,该方法进一步包括(i)将(g)的产物通过切向流过滤进行过滤。
98.如实施例60-98中任一项所述的方法,其中该酸化步骤包括将该细胞裂解物酸化至约3.0-4.0、约3.3-3.7或约3.4-3.6的pH。
99.如实施例98所述的方法,其中该酸化步骤包括将该细胞裂解物酸化至约3.5的pH。
100.如实施例60-99中任一项所述的方法,其中该超速离心在约40,000-50,000rpm之间或约43,000-46,000rpm之间进行。
101.如实施例60-100中任一项所述的方法,其中该超速离心在15℃-25℃之间进行。
102.如实施例60-101中任一项所述的方法,其中该超速离心进行16-24小时或20-24小时。
103.如实施例60-102中任一项所述的方法,其中在该酸化步骤之前将该细胞裂解物与吐温一起孵育。
104.如实施例60-103中任一项所述的方法,其中在该酸化步骤之前将该细胞裂解物与吐温一起孵育约8-20小时。
105.如实施例60-104中任一项所述的方法,其中澄清化步骤包括将该细胞裂解物通过深层过滤器过滤。
106.如实施例60-105中任一项所述的方法,其中该澄清化步骤包括将该细胞裂解物通过0.45微米过滤器过滤。
107.如实施例60-106中任一项所述的方法,其中该CEX包括磺酰基树脂。
108.如实施例60-107中任一项所述的方法,其中至少一个TFF步骤包括使用分子量截留值为300kDa MW的纤维素膜。
109.如实施例60-108中任一项所述的方法,其中该TFF步骤将该阳离子交换步骤的洗脱液体积减少至少六倍。
110.如实施例60-109中任一项所述的方法,其中该CsCl缓冲液包含Tris、MgCl2和泊洛沙姆188。
111.如实施例110所述的方法,其中该CsCl缓冲液包含约20mM Tris。
112.如实施例110或111所述的方法,其中该CsCl缓冲液包含约2mM MgCl2。
113.如实施例110-112中任一项所述的方法,其中该CsCl缓冲液包含泊洛沙姆188,任选地约0.2%w/v泊洛沙姆188。
114.如实施例60-113中任一项所述的方法,其中该CsCl缓冲液在约pH 7.5-8.5之间或在约pH 7.9-8.2之间。
115.如实施例60-114中任一项所述的方法,其中在从经超速离心的细胞裂解物中收集这些AAV病毒载体后,空病毒衣壳的数量占总病毒衣壳的少于7%、少于5%、少于3%或少于1%。
116.如实施例115所述的方法,其中该空病毒衣壳的数量是通过分析型超速离心(AUC)来测量。
117.如实施例60-116中任一项所述的方法,其中使用注射器从该经超速离心的细胞裂解物中收集这些AAV病毒载体。
118.如实施例60-117中任一项所述的方法,其中在第二TFF步骤之后收集的这些AAV病毒载体储存在包含Tris、MgCl2、NaCl和泊洛沙姆188的溶液中。
119.如实施例118所述的方法,其中该溶液包含约20mM Tris。
120.如实施例118或119所述的方法,其中该溶液包含约1mM MgCl2。
121.如实施例118-120中任一项所述的方法,其中该溶液包含约200mM NaCl。
122.如实施例118-121中任一项所述的方法,其中该溶液包含约0.005%w/v泊洛沙姆188。
123.如实施例118-122中任一项所述的方法,其中该溶液在约pH7.5-8.5之间或在约pH 7.7-8.3之间。
124.如实施例60-123中任一项所述的方法,其中在该第二TFF之后收集的这些AAV病毒载体含有少于约30μg/g或少于约20μg/g的CsCl。
125.如实施例60-124中任一项所述的方法,其中在该第二TFF之后收集的AAV病毒载体的浓度大于或等于约3x10
126.如实施例60-125中任一项所述的方法,其中利用用洗涤剂的絮凝来从该细胞裂解物中去除宿主细胞蛋白和/或宿主细胞DNA。
127.如实施例60-120中任一项所述的方法,其中该AAV病毒载体包含编码运动神经元存活(SMN)蛋白的多核苷酸。
128.如实施例76-127中任一项所述的方法,其中编码该SMN蛋白的质粒、编码该pAAV的质粒和编码该pHELP的质粒以1:1:1的比率转染。
129.如实施例60-128中任一项所述的方法,其中该药物组合物包含:
a.1-8x10
b.少于约7%的空病毒衣壳;
c.每1x10
d.每1x10
其中该1-8x10
130.如实施例129所述的方法,其中该药物组合物包含1.7-2.3x10
131.如实施例129所述的方法,其中该药物组合物包含约2x10
132.如实施例129-131中任一项所述的方法,其中该药物组合物包含少于约5%的空衣壳、少于约3%的空衣壳或少于约1%的空衣壳。
133.如实施例129-132中任一项所述的方法,其中该药物组合物包含1-2x10
134.如实施例129-132中任一项所述的方法,其中该药物组合物由1.7 x10
135.如实施例129-134中任一项所述的方法,其中该药物组合物是水性药物配制品。
136.如实施例135所述的方法,其中该配制品包含Tris缓冲液、氯化镁、氯化钠和泊洛沙姆,并且其中该药物组合物不包含防腐剂。
137.如实施例136所述的方法,其中该泊洛沙姆包括泊洛沙姆188。
138.如实施例135-137中任一项所述的方法,其中该配制品的pH是约7.7至约8.3。
139.如实施例138所述的组合物,其中该pH是约pH 8.0。
140.如实施例136-139中任一项所述的方法,其中氯化镁浓度是约0.5-1.5mM。
141.如实施例140所述的方法,其中该氯化镁浓度是约1mM。
142.如实施例136-141中任一项所述的方法,其中氯化钠浓度是约100-300mM。
143.如实施例142所述的方法,其中该氯化钠浓度是约200mM。
144.如实施例136-143中任一项所述的方法,其中该配制品包含约0.005%w/v泊洛沙姆188。
145.如实施例136-144中任一项所述的方法,其中该配制品具有390-430mOsm/kg的摩尔渗透压浓度。
146.如实施例60-145中任一项所述的方法,其中该药物配制品包含下列中的至少一种:
a.每1.0x10
b.少于约30μg/g(ppm)的铯,
c.约20-80ppm的泊洛沙姆188,
d.每1.0x10
e.每1.0x10
f.每1.0x10
g.每1.0x10
h.约pH 7.7-8.3,
i.约390-430mOsm/kg,
j.每个容器少于约600个大小≥25μm的颗粒,
k.每个容器少于约6000个大小≥10μm的颗粒,
l.约1.7x1013-2.3x10
m.每1.0x10
n.每1.0x10
o.约70%-130%的相对效力,以及
p.少于约5%的空衣壳。
147.如实施例60-145中任一项所述的方法,其中该药物配制品包含下列中的至少一种:
a.约pH 7.7-8.3,
b.约390-430mOsm/kg,
c.每个容器少于约600个大小≥25μm的颗粒,
d.每个容器少于约6000个大小≥10μm的颗粒,
e.约1.7x10
f.每1.0x10
g.每1.0x10
h.约20-80ppm的普朗尼克F-68含量,
i.约70%-130%的相对效力,
j.在7.5x10
k.少于约5%的空衣壳,
l.和大于或等于约95%的总纯度,以及
m.少于或等于约0.75EU/mL的内毒素。
148.如实施例60-145中任一项所述的方法,其中该药物配制品包含下列中的至少一种:
a.每1.0x10
b.少于约30μg/g(ppm)的铯,
c.约20-80ppm的泊洛沙姆188,
d.每1.0x10
e.每1.0x10
f.每1.0x10
g.每1.0x10
149.如实施例59-148中任一项所述的方法,其中该病毒载体的相对效力是相对于参考标准品的至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、至少99.5%、至少99.9%、至少100%、至少110%、至少120%、至少130%或至少140%。
150.如实施例59-148中任一项所述的方法,其中该病毒载体的相对效力是相对于该参考标准品的至少90%。
151.如实施例59-148中任一项所述的方法,其中该药物配制品中该病毒载体的效力在该参考标准品的效力的5%内、该参考标准品的效力的10%内或该参考标准品的效力的20%内。
152.一种用包含含有转基因的病毒载体的疗法治疗有需要的患者的方法,该方法包括:
a.根据如实施例1-49中任一项所述的测量转基因表达的方法测定所述含有转基因的病毒载体;并且
b.将该含有转基因的病毒载体施用至所述患者。
153.如实施例152所述的方法,其中将该病毒载体配制在药物组合物中。
154.如实施例146所述的方法,其中该药物组合物包含:
a.1-8x10
b.少于约7%的空病毒衣壳;
c.每1x10
d.每1x10
其中该1-8x10
155.如实施例152-154中任一项所述的方法,其中该有需要的患者患有SMA,例如I型脊髓性肌萎缩(SMA)。
156.如实施例155所述的方法,其中该有需要的患者:
a.为两岁或更小,任选地九月龄或更小;
b.具有至少约2.6kg的体重;
c.具有双等位基因SMN1无效突变或缺失;并且
d.具有至少一个功能性拷贝的SMN2。
157.如实施例153-156中任一项所述的方法,其中将该组合物通过鞘内或静脉内途径施用至该患者。
158.如实施例152-157中任一项所述的方法,其中将该病毒载体以约1-2.5x10
159.如实施例152-157中任一项所述的方法,其中将该病毒载体以约1.1x10
160.如实施例158或159所述的方法,其中该病毒载体基因组的量是使用ddPCR来测量。
161.如实施例155-160中任一项所述的方法,其中该患者具有不超过约13.5kg,任选地不超过约8.5kg的体重。
162.如实施例155-161中任一项所述的方法,其中该患者在至少一个拷贝的SMN2基因的外显子7中没有c.859G>C取代。
163.如实施例155-162中任一项所述的方法,其中将该治疗在2岁之前,任选地在6月龄之前施用至该患者。
164.如实施例155-163中任一项所述的方法,其中将该治疗在选自以下的一种或多种SMA症状发作之前施用至该患者:张力过低、运动技能延迟、头部控制差、圆肩姿势及关节过度活动。
165.如实施例155-164中任一项所述的方法,其中该患者在施用之前具有如通过ELISA结合免疫测定所测定的等于或低于1:100或1:50的抗AAV9抗体滴度。
166.如实施例155-164中任一项所述的方法,其中该患者在施用之后具有如通过ELISA结合免疫测定所测定的高于1:100的抗AAV9滴度,并对该患者监测约1-8周或直至滴度降低至低于1:100。
167.如实施例155-164中任一项所述的方法,其中该患者在施用之后具有如通过ELISA结合免疫测定所测定的高于1:100的抗AAV9滴度,并对该患者监测约1-8周或直至滴度降低至低于1:50。
168.如实施例155-164中任一项所述的方法,其中该患者在施用之前或之后具有如通过ELISA结合免疫测定所测定的高于1:100的抗AAV9滴度,并转换成配方食品喂养。
169.如实施例168所述的方法,其中该患者在施用之前或之后转换成配方食品喂养。
170.如实施例155-164中任一项所述的方法,其中该患者在施用之前或之后具有如通过ELISA结合免疫测定所测定的高于1:50的抗AAV9滴度,并转换成配方食品喂养。
171.如实施例170所述的方法,其中该患者在施用之前或之后转换成配方食品喂养。
172.如实施例155-171中任一项所述的方法,其中该患者在施用之后具有如通过ELISA结合免疫测定所测定的高于1:100或高于1:50的抗AAV9滴度,并使用血浆置换来治疗。
173.如实施例155-172中任一项所述的方法,其中该患者在施用前具有高于约67,000个细胞/ml或高于约100,000个细胞/ml或高于约150,000个细胞/ml的血小板计数。
174.如实施例155-173中任一项所述的方法,其中该患者在施用之后具有低于约67,000个细胞/ml、或低于约100,000个细胞/ml、或低于约150,000个细胞/ml的血小板计数,并对该患者监测约1-8周或直至血小板计数增加至约67,000个细胞/ml、或高于约100,000个细胞/ml、或高于约150,000个细胞/ml。
175.如实施例155-174中任一项所述的方法,其中该患者在施用后具有低于约67,000个细胞/ml的血小板计数,并用血小板输注来治疗。
176.如实施例155-175中任一项所述的方法,其中该患者在施用前不患有血小板减少症。
177.如实施例155-175中任一项所述的方法,其中该患者在施用后患有血小板减少症,并对该患者监测约1-8周或直至该患者不患有血小板减少症。
178.如实施例155-175中任一项所述的方法,其中该患者在施用后患有血小板减少症,并用血小板输注来治疗。
179.如实施例155-178中任一项所述的方法,其中在施用该病毒载体之前,该患者具有小于约0.176ug/ml的肌钙蛋白-I水平。
180.如实施例155-179中任一项所述的方法,其中在施用该病毒载体后监测该患者中的肌钙蛋白-I水平。
181.如实施例179或实施例180所述的方法,其中在施用后进行监测,直至该患者中的肌钙蛋白-I水平小于约0.176ug/ml。
182.如实施例155-181中任一项所述的方法,其中该患者在施用前具有正常的肝功能。
183.如实施例182所述的方法,其中该患者在施用前具有小于约8-40U/L的肝转氨酶水平。
184.如实施例183所述的方法,其中该肝转氨酶选自丙氨酸转氨酶(AST)、天冬氨酸转氨酶(ALT)及其组合。
185.如实施例155-184中任一项所述的方法,其中该患者在施用前具小于3.0mg/dL的胆红素水平、小于1.8mg/dL的肌酐水平、在8-18g/dL之间的Hgb水平和/或小于约20000/mm3的白细胞计数。
186.如实施例155-185中任一项所述的方法,其中将该病毒载体在Tris缓冲盐水中施用。
187.如实施例155-186中任一项所述的方法,其中将该病毒载体在约5-20mL/kg、约10-20mL/kg或约5.5-6.5mL/kg的Tris缓冲盐水中施用。
188.如实施例155-187中任一项所述的方法,其中将该病毒载体经约45-75分钟输注。
189.如实施例155-188中任一项所述的方法,其中将该病毒载体经约60分钟输注。
190.如实施例188或实施例189所述的方法,其中该输注包括注射器泵。
191.如实施例155-189中任一项所述的方法,其中在施用该病毒载体之前至少24小时向该患者施用口服类固醇。
192.如实施例155-191中任一项所述的方法,其中在施用该病毒载体之后,向该患者施用口服类固醇至少30天。
193.如实施例192所述的方法,其中将该口服类固醇每日施用一次。
194.如实施例193所述的方法,其中将该口服类固醇每日施用两次。
195.如实施例191-194中任一项所述的方法,其中在施用该病毒载体之后监测该患者的ALT和/或AST的升高水平,并且其中该口服类固醇在30天后继续施用,直至AST和/或ALT水平低于正常上限的两倍或低于约120IU/L。
196.如实施例191-195中任一项所述的方法,其中向该患者施用口服类固醇,直至AST和/或ALT水平低于正常上限的两倍或低于约120IU/L。
197.如实施例191-195中任一项所述的方法,其中将该口服类固醇以约1mg/kg的剂量施用。
198.如实施例191-197中任一项所述的方法,该方法进一步包括在AST和ALT低于正常上限的两倍或低于约120IU/L之后逐渐减少该口服类固醇施用。
199.如实施例198所述的方法,其中该逐渐减少包括逐步增量至0.5mg/kg/天持续2周,之后为0.25mg/kg/天再持续2周。
200.如实施例191-198中任一项所述的方法,该方法包括以约1mg/kg的剂量施用该口服类固醇30天,且然后逐渐减少至0.5mg/kg/天持续2周,之后为0.25mg/kg/天再持续2周。
201.如实施例191-200中任一项所述的方法,其中该口服类固醇是泼尼松龙或等效物。
202.如实施例155-201中任一项所述的方法,该方法包括向该患者施用肌肉增强剂或神经保护剂。
203.如实施例155-202中任一项所述的方法,该方法包括向该患者施用靶向SMN的反义寡核苷酸。
204.如实施例155-203中任一项所述的方法,该方法包括向该患者施用诺西那生钠。
205.如实施例155-204中任一项所述的方法,该方法包括向该患者施用司达鲁单抗。
206.如实施例155-205中任一项所述的方法,其中功效是使用CHOP-INTEND量表来测定。
207.如155-206中任一项所述的方法,其中该患者具有或不具有疾病发作。
208.如实施例155-207中任一项所述的方法,该方法包括:
a.测定该患者的体重;
b.获得含有AAV9病毒载体药物组合物的小瓶的试剂盒,其中每个小瓶中的病毒载体浓度为约2.0x10
其中该试剂盒中的小瓶的数量和体积选自下组,该组由以下各项组成:
当该患者的体重为2.6至3kg时,2个为7.9-8.8mL该组合物/小瓶的小瓶;当该患者在3.1与3.5kg之间时,2个为5.1至5.9mL该组合物/小瓶的小瓶和1个为7.9-8.8mL该组合物/小瓶的小瓶;当该患者在3.6与4.0kg之间时,1个为5.1至5.9mL该组合物/小瓶的小瓶和2个为7.9-8.8mL该组合物/小瓶的小瓶;当该患者在4.1与4.5kg之间时,3个为7.9-8.8mL该组合物/小瓶的小瓶;当该患者在4.6与5.0kg之间时,2个为5.1至5.9mL该组合物/小瓶的小瓶和2个为7.9-8.8mL该组合物/小瓶的小瓶;当该患者在5.1与5.5kg之间时,1个为5.1至5.9mL该组合物/小瓶的小瓶和3个为7.9-8.8mL该组合物/小瓶的小瓶;当该患者在5.6与6.0kg之间时,4个7.9-8.8mL该组合物/小瓶的小瓶;当该患者在6.1与6.5kg之间时,2个为5.1至5.9mL该组合物/小瓶的小瓶和3个为7.9-8.8mL该组合物/小瓶的小瓶;
当该患者在6.6与7.0kg之间时,1个为5.1至5.9mL该组合物/小瓶的小瓶和4个为7.9-8.8mL该组合物/小瓶的小瓶;当该患者在7.1与7.5kg之间时,5个为7.9-8.8mL该组合物/小瓶的小瓶;当该患者在7.6与8.0kg之间时,2个为5.1至5.9mL该组合物/小瓶的小瓶和4个为7.9-8.8mL该组合物/小瓶的小瓶;当该患者在8.1与8.5kg之间时,1个为5.1至5.9mL该组合物/小瓶的小瓶和5个为7.9-8.8mL该组合物/小瓶的小瓶;当该患者在8.6与9.0kg之间时,6个为7.9-8.8mL该组合物/小瓶的小瓶;当该患者在9.1与9.5kg之间时,2个为5.1至5.9mL该组合物/小瓶的小瓶和5个为7.9-8.8mL该组合物/小瓶的小瓶;当该患者在9.6与10.0kg之间时,1个为5.1至5.9mL该组合物/小瓶的小瓶和6个为7.9-8.8mL该组合物/小瓶的小瓶;当该患者在10.1与10.5kg之间时,7个为7.9-8.8mL该组合物/小瓶的小瓶;当该患者在10.6与11.0kg之间时,2个为5.1至5.9mL该组合物/小瓶的小瓶和6个为7.9-8.8mL该组合物/小瓶的小瓶;当该患者在11.1与11.5kg之间时,1个为5.1至5.9mL该组合物/小瓶的小瓶和7个为7.9-8.8mL该组合物/小瓶的小瓶;当该患者在11.6与12.0kg之间时,8个为7.9-8.8mL该组合物/小瓶的小瓶;当该患者在12.1与12.5kg之间时,2个为5.1至5.9mL该组合物/小瓶的小瓶和7个为7.9-8.8mL该组合物/小瓶的小瓶;当该患者在12.6与13.0kg之间时,1个为5.1至5.9mL该组合物/小瓶的小瓶和8个为7.9-8.8mL该组合物/小瓶的小瓶;以及当该患者在13.1与13.5kg之间时,9个为7.9-8.8mL该组合物/小瓶的小瓶;并且c.向该患者施用来自这些小瓶的该AAV9病毒载体。
209.如实施例208所述的方法,其中将该AAV病毒载体以约1.0x10
210.如208或209所述的方法,其中将该AAV病毒载体以约1.1x10
211.如实施例209或210所述的方法,其中将该病毒载体经约45-70分钟输注。
212.如实施例209-211中任一项所述的方法,其中将该病毒载体经约60分钟输注。
213.如实施例209-212中任一项所述的方法,其中该输注包括注射器泵。
214.如实施例209-213中任一项所述的方法,其中该病毒载体基因组的量是使用ddPCR来测量。
215.如实施例209-214中任一项所述的方法,其中AAV9病毒载体的剂量滴度是通过ddPCR来测量。
216.如实施例155-215中任一项所述的方法,该方法包括施用以下剂量体积:当患者的体重为2.6-3.0kg时为16.5mL,当患者的体重为3.1-3.5kg时为19.3mL,当患者的体重为3.6-4.0kg时为22.0mL,当患者的体重为4.1-4.5kg时为24.8mL,当患者的体重为4.6-5.0kg时为27.5mL,当患者的体重为5.1-5.5kg时为30.3mL,当患者的体重为5.6-6.0kg时为33.0mL,当患者的体重为6.1-6.5kg时为35.8mL,当患者的体重为6.6-7.0kg时为38.5mL,当患者的体重为7.1-7.5kg时为41.3mL,当患者的体重为7.6-8.0kg时为44.0,当患者的体重为8.1-8.5kg时为46.8mL,当患者的体重为8.6-9.0kg时为49.5,当患者的体重为9.1-9.5kg时为52.3mL,当患者的体重为9.6-10.0kg时为55.0,当患者的体重为10.1-10.5kg时为57.8mL,当患者的体重为10.6-11.0kg时为60.5,当患者的体重为11.1-11.5kg时为63.3mL,当患者的体重为11.6-12.0kg时为66.0,当患者的体重为12.1-12.5kg时为68.8mL,当患者的体重为12.6-13.0kg时为71.5,并且当患者的体重为13.1-13.5kg时为74.3mL。
217.如实施例155-216中任一项所述的方法,其中该药物组合物包含:
a.自身互补型AAV9病毒载体,该自身互补型AAV9病毒载体包含经修饰的AAV2ITR、鸡β-肌动蛋白(CB)启动子、巨细胞病毒(CMV)即刻/早期增强子、经修饰的SV40晚期16s内含子、编码SMN1多肽的序列、牛生长激素(BGH)聚腺苷酸化信号和未经修饰的AAV2 ITR;
b.pH 8.0下的20mM Tris;
c.1mM MgCl2;
d.200mM NaCl;以及
e.0.005%泊洛沙姆188;
其中该患者小于2岁。
218.如实施例217所述的方法,其中该组合物不包含防腐剂。
219.如实施例152-218中任一项所述的方法,其中该病毒载体的相对效力是相对于参考标准品的至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、至少99.5%、至少99.9%、至少100%、至少110%、至少120%、至少130%或至少140%。
220.如实施例152-218中任一项所述的方法,其中该病毒载体的相对效力是相对于该参考标准品的至少90%。
221.如实施例152-218中任一项所述的方法,其中该药物配制品中该病毒载体的效力在该参考标准品的效力的5%内、该参考标准品的效力的10%内或该参考标准品的效力的20%内。
实例
实例1:鼠类△7细胞的产生
目的
此程序描述了用于在测定确认(qualification)、验证(validation)、制造的基因替代药物物料的释放和稳定性测试中使用的从小鼠原代神经祖细胞(mNPC)创建的细胞系和库的产生。
范围
这特别适用于源自SMA△7小鼠的在表达SMN1蛋白方面为缺陷型的小鼠原代神经祖细胞系的产生,该SMA△7小鼠的外显子7从SMN基因中缺失,从而导致类似于人I型SMA疾病的I型脊髓性肌萎缩(SMA)疾病。
程序
原代神经祖细胞(NPC)的产生
在胚胎学第14±2天(E14±2)给予妊娠△7(+/-)小鼠致死剂量的异氟烷。用乙醇擦拭后,用剪刀打开腹部并移出胚胎。将胚胎置于培养皿中,该培养皿分层铺有冷汉克斯(Hanks)平衡缓冲盐溶液(HBSS)。通过以下方式一次分离一个胚胎:用剪刀切割,放置于干净的培养皿中,并用镊子从羊膜囊中移出。
去除尾巴,并将其放置于Eppendorf管中以进行基因分型。将皮层与脑分离,并尽可能去除脑膜。将皮层切成细小块,并放置于具有14mL冷HBSS的15mL锥形管中。使用干净的工具对每个胚胎重复这些步骤(本段中),以避免污染DNA和细胞。
将含有解剖组织的锥形管以300g离心5分钟。
神经祖细胞的分离
在每个管之间使用干净的吸液管从每个锥形管中吸出缓冲溶液。将200μLAccumax添加至每个样品,并作为细胞解离过程的一部分在室温下孵育30分钟。然后将400μL完全培养基添加至单独样品,并通过上下吸移将组织研磨以解离细胞。对每个样品都进行此程序,之后移动至下一步骤。
再添加400μL完全培养基,以使总体积为1mL。使用70μm细胞粗滤器将细胞过滤至新的15mL锥形管中。
通过以下方式使用自动细胞计数器对细胞进行计数:将一定体积的细胞添加至一定体积的台盼蓝染色剂(或等效的细胞活力试剂,这取决于所使用的细胞计数器)并且将适当的体积添加至插入自动细胞计数器中的载玻片。
将总体积的细胞(1mL)添加至在单独标记的T-75组织培养瓶中的9mL完全培养基,并放置于37℃、5%CO
传代和冷冻细胞
建议体积:
神经球
当细胞准备传代时(即在细胞达到接近最大推荐密度之前),将烧瓶从培养箱中移出并充分混合。
将细胞从烧瓶转移至50mL锥形管,并以300g离心5分钟。如果收集较大体积的在培养基中的细胞,则离心时间可以增加。例如,如果收集50mL,则可以将细胞以300g离心8分钟。
吸出上清液,并添加200μL Accumax。搅拌细胞沉淀物并研磨一至三次,然后在室温下孵育30分钟。
然后通过添加400μL完全生长培养基中和Accumax,并且将细胞研磨10-15次以解离成单一细胞。
再添加400μL完全培养基,以使总体积为1mL。可以添加额外体积的完全培养基以稀释细胞,以便于计数。
移出细胞的少量样品,以根据上文测定细胞总数和活力(使用台盼蓝和自动细胞计数器)。将衍生的细胞命名为第1代(P1)。
将P1细胞悬浮液稀释至100,000个细胞/mL,并且将适当体积(经由移液管)转移至新的细胞培养器皿中,并在37℃、5%CO2下孵育。
重复以上传代步骤,并且对于每个传代循环,将一个传代数加至先前传代。
冷冻细胞
在低温小瓶中冷冻之前,用显微镜检查细胞的细胞形态、活力、密度细胞浓度)和微生物污染。
将细胞在冷冻培养基中冷冻,并在-80℃冷冻器处的低温保存容器中的低温小瓶中储存24-72小时。
初始冷冻之后,将小瓶转移至液氮冷冻机中。
细胞建库
主细胞库(MCB)
通过扩增来自初始来源的细胞来创建主细胞库(MCB),并且在质量控制(QC)测试之后,从初始来源继续扩增,该初始来源用于制备主细胞库并扩增以确立工作细胞库(参见图1至图2)。
主细胞库和工作细胞库的一小部分被隔离并保持在远离所有其他材料的位置。可以将细胞冷冻,且然后解冻并传代以按需用于本文披露的测定。
实例2:基于细胞的稳健定量相对效力测定的方法开发
材料和方法
神经祖细胞(NPC)的分离和传代
在胚胎期约14.5(e14.5)处从SMAΔ7小鼠品系(杰克逊实验室(JacksonLaboratories))的胚胎皮层中收集NPC。通过以下方式将这些细胞解离成单一细胞:在室温下在Accumax(干细胞技术公司(STEMCELL Technologies))中孵育30分钟,并且在5%CO
NPC的分化
为了终末分化NPC,通过在Accumax(干细胞技术公司)中在室温下孵育30分钟来解离神经球,并且将其以1E+06个细胞/孔接种在0.5mL(24孔板,福尔肯公司),或以2E+05个细胞/孔接种在100μL(96孔板,康宁公司)不具有生长因子的富血清培养基中。在分化后24小时,细胞被主要终末分化为神经胶质谱系。
mTD-NPC-Δ7的转导
在分化后24小时,从细胞中移出培养基,并将100μL含有AAV9载体的培养基添加至细胞。这些研究中使用的AAV9载体是AAV9-eGFP批次SAB-138和SMN1编码AAV9(AAV9-SMN1)载体药物产品批次NCHAAV9SMN0613(参考标准品)、816836和600156。
SMN1染色
在转导后的指定时间点,通过在96孔板(康宁公司)的每个孔中添加在PBS中的50μL 4%多聚甲醛(阿法埃莎公司(Alfa Aesar))来固定细胞。在室温(RT)下,将细胞在4%多聚甲醛中孵育5min,且然后用250μL PBS/孔洗涤。然后,使用在PBS中的0.1%曲通X-100(赛默科技公司(ThermoScientific))在室温下将细胞透化5min,之后使用250μL PBS洗涤。对于SMN1的染色,以4μg/mL使用小鼠单克隆抗体2B1(赛默飞世尔公司)。将细胞与稀释于在PBS中的1%BSA(飞世尔公司(Fisher))中的50μL抗体在室温下一起孵育2小时,且然后用250μL PBS洗涤。最后,将细胞与在PBS中的50μL 1%BSA中的二抗(山羊抗小鼠IgGAlexa488,赛默飞世尔公司)和核染色剂(Hoechst33342,英杰公司)在室温下一起孵育1小时。用250μL PBS洗涤细胞之后,用光学透明的板密封件(赛默飞世尔公司)密封板,并如下文所述进行成像。
图像采集与分析
CellInsight CX5(赛默飞世尔公司,在下文中指定为CX5)用于图像采集。CX5是一种自动化的高内涵成像仪器,该仪器允许测量多孔板中单一细胞的生物活性。如下操作CX5:使用HCS Studio(赛默飞世尔公司),以配置诸如物镜和曝光时间的参数。使用用于高动态范围的荧光检测的20倍物镜以固定的曝光时间采集图像。然后使用HCS Studio分析捕获的图像。HCS Studio使用各组算法和过滤器使用核染色来定义每个细胞,且然后使用此核染色作为根据来鉴定细胞。使用HCS Studio分析在SMN1染色之后每个细胞内的积分荧光强度。此软件还计算每个孔的在整个细胞群上的测量平均值,该测量平均值代表孔内的生物学变化。对于数据分析,将积分荧光强度/细胞(IFI-C)用作SMN1蛋白表达的量度。
结果
源自神经祖细胞的小鼠终末分化细胞(mTD-NPC-Δ7)的转导
为了评估mTD-NPC-Δ7对非复制型自身互补型AAV9-SMN1(AVXS-101)的容许性,使用AAV9-eGFP载体以24孔板形式转导mTD-NPC-Δ7。使用来自转导细胞中表达的eGFP的绿色荧光信号监测转导,并在转导后24小时获得图像。MOI依赖性eGFP表达证明mTD-NPC-Δ7细胞容许AAV9载体,而无需化学处理或细胞工程化。图4示出了eGFP阳性细胞随感染复数(MOI)的增加而增加。
使用96孔板形式得出基于mTD-NPC-Δ7的测定的可行性
为了具有可以用作批次处置效力测定的测定的合理通量,评估了使用96孔板形式的可行性。
96孔板上细胞分布的均匀性和细胞铺板密度的确定
为了能够使用成像技术准确地捕获生物学变化,至关重要的是每个孔具有适当的细胞密度。我们测试并比较了20,000个细胞/孔(图5A)和10,000个细胞/孔(图5B)。在20,000个细胞/孔的密度下,细胞彼此足够靠近以培育适当的生物环境而无需广泛接触彼此以便进行最佳图像分析。
在96孔板形式中AAV9载体转导的mTD-NPC-Δ7的SMN1染色方法的确立mTD-NPC-Δ7中SMN1的染色
使用免疫染色针对SMN1蛋白的检测筛选来自商业来源的一些小鼠单克隆抗体(数据未示出),并鉴定出显示出低背景且动态检测范围一致良好的小鼠单克隆抗体(2B1)。
SMN1单克隆抗体(2B1)的特异性
为了确保2B1检测到的蛋白质不是来自AAV9载体或来自转导程序的假象,将AAV9-eGFP转导的mTD-NPC-Δ7用2B1染色。当通过2B1染色时,以100,000MOI转导的细胞未显示任何可检测信号,而展现出成功的AAV9转导,该转导通过GFP表达来证实(图7)。
对用聚D-赖氨酸包被的组织培养板的评估
为了确保在染色程序中细胞损失最小,我们评价了使用聚D-赖氨酸包被的96孔板的需求。图8A和图8B示出了未包被且典型组织培养处理的96孔板(图8A)和聚D-赖氨酸包被板(图8B)的比较。当将细胞铺板并在未包被板上染色时,观察到细胞损失,并许多剩余细胞脱落。然而,在所有染色程序完成之后,铺板在聚D-赖氨酸上的细胞没有显示出这种现象。因此,我们决定使用聚D-赖氨酸包被板进行进一步的测定开发实验。
测量SMN1蛋白水平的基于mTD-NPC-Δ7的定量成像测定的确立
用于检测转基因表达的测定持续时间的确定。
用于检测转基因表达的测定持续时间确定为转导后72小时。由于mTD-NPC-Δ7是终末分化且非分裂的,因此转导后转基因SMN1表达得以积累,这反映了在SMAΔ7疾病模型或SMA患者体内SMN1编码AAV9载体转导后非分裂运动神经元中的转基因表达。对于评估,我们使用AAV9-eGFP作为监测转导后48小时和转导后72小时两个时间点的转基因表达的工具。在转导后72小时,大多数细胞(多达80%)呈GFP阳性,其中每个细胞具有高荧光信号,这提供了良好的测定窗。然而,在转导后48小时,呈GFP阳性的细胞少得多,每个细胞具有低得多的荧光信号。
对于三个AAV9载体批次的SMN1蛋白表达的MOI依赖性增加的检测和分析
使用经确立的测定条件,用三个SMN1表达AAV9载体批次(NCHAAV9SMN0613、816836或600156)在三种不同的MOI下转导mTD-NPC-Δ7,并用抗SMN1 2B1单克隆抗体对细胞进行染色。染色后获得的图像显示SMN1表达随着MOI的渐增而增加。为了确定来自免疫染色的荧光信号是否可用于定量评估SMN1表达,分析了每个细胞的积分荧光强度(积分荧光强度/细胞,IFI-C)。在n=3下进行此实验。对于所测试的临床批次中的每一个,IFI-C随着MOI的渐增而增加(表3)。数据证明,三个临床批次在三种给定的MOI下转导时的SMN1表达是可比的(表3)。图10示出了mTD-NPC-Δ7在转导后72小时的代表性图像。
表3.每个批次的荧光强度/细胞数据
表4.批次之间的荧光强度/细胞数据比较
证明基于mTD-NPC-Δ7的测定在96孔形式中是剂量依赖性定量测定的概念验证数据
为了确定此测定的定量特征,使用开发的基于mTD-NPC-Δ7的测定,在载体的2倍稀释液中进行AAV9-SMN1载体批次NCHAAV9SMN0613(n=5)的12点MOI转导。从背景(MOI=1)至最高MOI(MOI=200K),IFI-C存在4.8倍增加,这证明了可接受的背景信号比。如表3中所示,在12种MOI中来自5个平行测定的SMN1IFI-C的相对标准差(RSD)(或CV%)低于5%(从0.5%到4%)。初步概念验证(POC)数据显示该测定是精确的。图11示出了对SMN1表达随着MOI(仅示出10种MOI)的增加的MOI依赖性增加的视觉证实。为了进一步评价该测定是否是定量的,因此可适合作为基于细胞的效力测定,使用适当的曲线拟合算法对12点数据进行分析。如图12中所示,该测定使用双曲线模型显示出良好的曲线拟合(R
剂量依赖性拟合数据提出了利用基于图像的测定来通过平行线分析(PLA)测定AAV9-SMN1载体的相对效力的可能性。
此外,连同比较三个AAV9-SMN1载体临床批次的数据一起,这些数据支持可以使用基于细胞的体外测定实现SMN1的稳健定量测量的概念验证。
表5. 12点MOI IFI-C数据
统计方法
为了评估基于mTD-NPC-Δ7的成像测定作为潜在批次处置效力测定的适用性,我们测定了5种支持平行线分析(PLA)的MOI。以下统计分析证明,平行线分析(PLA)可用于使用线性回归模型来计算AAV9-SMN1载体的相对效力。
积分荧光强度/细胞(IFI-C)
对于每种剂量和每个平行测定计算积分荧光强度/细胞(IFI-C)值。IFI-C是每种剂量的测定读出。
线性剂量响应模型
对于所测量的每种MOI均获得五个平行测定值,并且应用线性回归模型,且该线性回归模型展现出在x轴(剂量)的对数变换之后具有98.9%R2的良好拟合。
使用PLA测定相对效力(RP)的概念验证研究
在成对分析中,使用五组SMN1 IFI-C对logMOI数据进行“模拟”相对效力计算,该成对分析中作为“模拟参考标准品”的一组数据相对于作为“模拟测试物品”的另一组数据。使用这种方法,有十种可能的成对组合,如下文所列出(表6)。10个模拟测试物品的相对效力(%)在93.6%至101.8%的范围内,其中CV%小于5%。统计分析证明,新开发的测定是定量的,具有覆盖5种相隔2倍的MOI的16倍线性范围。
确定测定的稳健性、确认和验证,之后最终评估此测定作为旨在用于AAV9药物产品的批次处置的效力测定的效用。
表6.相对效力计算数据
对用于mTD-NPC-Δ7免疫染色的最佳SMN抗体(2B1)浓度的评估
使用临时PLA工具来进一步评估不同的抗SMN(2B1)抗体浓度对用AAV9-SMN1载体转导的mTD-NPC-Δ7的染色的影响。与其他免疫分析(诸如ELISA)相比,基于图像的测定中使用的一抗和二抗的可接受浓度通常较宽。这是由于通过仪器的高灵敏度相机实现的基于图像的测定通过调整对光源的曝光时间来检测宽范围的信号的能力。因此,抗体浓度优化的主要目标是确保所选择的一抗或二抗浓度不是定量如由剂量依赖性响应测定的目的蛋白水平(例如SMN1)的限制因素。
为此目的,测试三种不同浓度的SMN(2B1)抗体(4μg/mL、2μg/mL和1μg/mL),以评估通过线性回归确定的剂量依赖性响应的线性。简而言之,将由SMN1编码AAV9载体批次制备的12种MOI剂量如表7中所示添加至孔中,且然后根据板布局通过2μg/mL、1μg/mL和4μg/mL的SMN抗体对细胞进行免疫染色。如上文所述,将范围从200K MOI至12.5K MOI的5种剂量拟合为线性回归,并且对于所测试的所有三种条件,显示出SMN蛋白质水平的剂量依赖性增加的优异线性(R
鉴于从三种不同浓度的SMN1抗体获得的等同数据,选择2μg/mL的中点用于确立SMN1编码AAV9载体的基于细胞的体外相对效力。选择此浓度以避免SMN(2B1)抗体过多消耗,但要确保一抗浓度的轻微变化不会损害测定性能。
根据供应商的建议,将二抗的使用浓度确定为2μg/mL,以确保二抗在对与微孔板布置上铺板的靶蛋白结合的一抗的检测中不是限制因素。图17和表8中所示的数据确立了对SMN的剂量依赖性增加的定量,具有优异的线性(R
表7.比较三种不同SMN抗体浓度的板布局
表8.通过PLA对三种SMN抗体浓度的比较
结论
以上研究描述了对容许AAV9的新型原代小鼠细胞模型系统的成功鉴定;通过使用基于高内涵图像的定量系统对用于测量转基因(SMN1)表达的基于细胞的体外方法的开发;以及在测定验证完成后证明开发的基于mTD-NPC-Δ7的测定作为批次处置效力测定的潜在适用性的POC数据。
此外,已经显示,新确立的基于细胞的测定系统具有以下特征:
·快速复制的NPC使得能够产生细胞库,该细胞库具有在它们分化之前保存的祖细胞表型;
·mTD-NPC-Δ7天然允许AAV9转导并且具有MOA反射性;
·对mTD-NPC-Δ7中SMN1表达水平的测量显示出了良好的测定窗(信号:背景>4),这是因为TD-NPC具有低背景(源自SMN-/-小鼠)以及这些细胞是非分裂的(允许转基因产物的积累);
·测定窗允许定量测量SMN1蛋白水平的剂量依赖性增加;
·测量IFI-C的测定是稳健的并且提供96孔板形式的通量;
·统计分析支持PLA用于在具有准确性和可重复性的情况下计算相对效力。
实例3:针对mNPC中AAV9感染性的新方法开发
确立了利用SMN-/-Δ7小鼠神经祖细胞系(mNPC)和高内涵成像系统CellInsight的稳健定量作用机制(MOA)反映性AAV9感染性测定。使用基于mNPC的测定平台,将AAV9载体的体外相对效力测定开发为一种稳健定量感染性测定。
获得了概念验证数据,显示该测定在诸如定量性质以及更容易且不太繁冗的测定过程的方面优于当前TCID50感染性测定。
进行了概念验证研究,以确立对于感染滴度EC
表9.作为感染滴度的EC
覆盖下平台和上平台两者的感染复数(MOI)的整个剂量范围被确定为具有优异的4-p拟合(0至8000K MOI)。
将以病毒基因组/毫升(vg/mL)计的EC
与目前使用HeLaRC32细胞的基于TCID50的测定相比,使用SMN-/-mNPC细胞的此感染性测定的优势
表10.用于测定AAV9载体感染滴度的两种方法的比较。
实例4:对SMN1编码AAV9载体药物物质和药物产品的体外相对效力的测定
使用实例1-3中开发的基于细胞的体外定量相对效力测定来测定AAV9-SMN1载体药物物质和药物产品的相对效力。
基于细胞的相对效力测定是一种用于测定相对效力的稳健定量体外测定,其旨在用于SMN1编码AAV9载体药物物质和药物产品的批次处置和稳定性测试。用于此测定的细胞源自从SMNΔ7小鼠的皮层中分离的小鼠原代神经祖细胞(NPC),如实例1和2中所述。SMNΔ7小鼠是对于SMN1基因敲除等位基因纯合且对具有外显子7的缺失的SMN2的等位基因纯合的SMA疾病的体内动物模型。此测定中使用的细胞模型系统是终末分化NPC(mTD-NPC-Δ7)。在用渐增剂量的SMN1编码AAV9载体转导的mTD-NPC-Δ7中,通过使用对SMN具有特异性的单克隆抗体染色来测量SMN蛋白表达的渐增水平。
使用由以下方程式描述的平行线分析(PLA)计算样品相对于参考标准品(RS)的相对效力,其中α(截距)和β(斜率)是来自共同斜率模型的线性回归线的估计值:
此测定中使用的高内涵成像平台(CellInsight CX5)使得能够定量测量基于每个细胞的细胞内蛋白质表达(积分荧光强度/细胞)。此外,CellInsight CX5平台允许适当的通量用于批次处置和稳定性研究。
使用以下设备进行基于细胞的相对效力测定:生物学安全工作橱(BSC)、CellInsight CX5(赛默飞世尔CX51110)、设定在37±1℃下具有5%CO
使用以下材料进行基于细胞的相对效力测定:组织培养处理烧瓶(T75、T150和T175)、带盖的聚丙烯离心管15和50mL、移液管(单通道P1000、P200和P20以及8或12通道P1000和P300)、康宁BioCoat聚D-赖氨酸96孔板(康宁354640)、光学透明板密封件(飞世尔品牌8408240)、试剂存储容器、PIPET-AID、Cellometer玻片(耐细隆公司,CHT4-SD100-002),96孔DeepWell
使用下表11中列出的试剂进行基于细胞的相对效力测定。除非另有说明或重新测试,否则试剂应遵守制造商建议的有效日期。
表11.试剂
测定程序
使用下文概述的方案解冻NPC-Δ7细胞。
在使用前,将完全生长培养基在37℃水浴或等效物中预热至少30分钟。
从液氮储存器中移出mNPC细胞的经冷冻的冷冻小瓶。将小瓶保持在干冰上,直至它准备解冻。将小瓶在37℃水浴中快速解冻,偶尔涡旋以确保解冻。
用70%(v/v)异丙醇(IPA)擦拭小瓶表面,然后使用BSC中的无菌移液器将内容物转移至50mL离心管。解冻细胞后,将冷冻保护剂缓慢稀释以防止渗透性休克。约10-20mL通常足以克服毒性作用。
以逐滴方式添加10-20mL的温热完全生长培养基,同时通过涡旋轻轻混合,之后在20℃下以300xg离心5分钟。
吸出上清液,然后轻轻搅动管以破碎细胞沉淀物。
将适当体积(建议为1.0-2.0mL)的温热完全生长培养基添加至细胞并用移液管轻轻混合。
使用Cellometer K2软件中的方案“NPCd7计数活力(AO/PI)”获得活细胞计数和活力。预期每一次计数的活力均为≥60.0%活的。
将细胞转移至T75组织培养瓶中,并记录收集的细胞体积。添加10.0mL完全生长培养基,并且轻轻摇动烧瓶以确保均匀分布。
然后将烧瓶放置于设定在37℃和5%CO
NPC-Δ7细胞的培养
从解冻后的第二代开始,将细胞用于测定中。解冻不被视为是一次传代。将细胞使用至第15代。例如,如果将工作细胞库在第6代(P6)或之后冷冻,则当解冻细胞时,它们保留的传代数为P6。在适当的细胞增殖天数后,将细胞通过用Accumax解离来进行传代,并成为P7。在P7,细胞不能用于测定。当细胞通过用Accumax解离而再次传代(P8)时,这些细胞可用于测定中。
表12.对细胞解冻和传代时的传代名称的实例
随着细胞在悬浮液中增殖,它们形成称为神经球的3维集落。为了防止神经球生长太大并在中心变得坏死,每4±1天对细胞进行传代。
细胞传代程序
根据下文所述程序对细胞进行传代。
在使用前,将基础培养基和完全生长培养基在37℃水浴或等效物中预热30分钟。
为了对细胞进行传代,将含有细胞的烧瓶从培养箱中移出,并使用含有细胞的培养基冲洗烧瓶的表面。
将细胞从烧瓶转移至50mL锥形管,并以300xg离心5分钟。
吸出上清液而不扰动细胞沉淀物,并添加200.0μL Accumax。通过上/下多次吸移将细胞沉淀物轻轻研磨,直至沉淀物解离,然后在室温下孵育30±10分钟。
在Accumax孵育结束时,通过添加400.0μL的预热的基础培养基中和Accumax。将细胞轻轻研磨(例如10-15次)以完全解离为单一细胞。
再添加400.0μL预热的基础培养基以使总体积为1.0mL。额外体积的基础培养基使细胞稀释至5.00E+05个细胞/mL至1.00E+07的对于细胞计数可接受的细胞密度范围。在将细胞已用Accumax解离并分别用基础培养基中和后,此时任选地将在相同传代数下、来自具有相同细胞参考品/批次的多个烧瓶的细胞汇集在一起。可以将总共为1.0mL的每种细胞悬浮液(通过800.0μL基础培养基中和在200.0μL Accumax中的细胞)合并。添加额外体积的基础培养基以将细胞稀释至5.00E+05个细胞/mL至1.00E+07的对于细胞计数可接受的细胞密度范围(例如,将来自烧瓶1的1.0mL细胞和来自烧瓶2的1.0mL细胞混合,且然后再添加3.0mL基础培养基以进一步稀释细胞)。
将细胞混合,且然后移出细胞的少量样品以使用Cellometer K2软件中的方案“NPCd7计数活力(AO/PI)”测定活细胞计数和活力。当每一次细胞计数的活力≥80.0%时,制备mTD NPC-Δ7(终末分化NPCΔ7)板。为了继续培养细胞,每一次细胞计数的活力必须为≥70.0%活的。
如果细胞悬浮液浓度过高,则添加额外体积的基础培养基,并且充分混合并重新测定活细胞计数和活力。
在预热的完全生长培养基中将细胞悬浮液稀释至100,000个细胞/mL。将适当体积吸移至新的细胞培养器皿中,并将细胞返回至37℃±1℃、5%CO
每个烧瓶的示例性计算:
总体积:
表13.建议的组织培养烧瓶的体积
任选地重复传代方案,其中每个传代循环将一个传代数加至先前传代。
mTD NPC-Δ7(终末分化NPCΔ7)板的制备
使用与用于对细胞进行传代的培养基不同的板培养基铺板细胞。板培养基使NPC细胞终末分化。每个板中制备了至少7mL的在板培养基中的细胞。
记录活细胞计数,并确定待用于铺板的适当细胞体积。
将细胞在板培养基中稀释至20,000个细胞/孔/100μL(或2.00x10
每个板的示例性计算:
总体积:
将100.0μL的2.00x10
将100.0μL DPBS(1x)添加至每个板的边缘孔(A行、H行、第1列、第12列)中。
将一个或多个板在环境温度下静置25±5分钟,之后将铺板的细胞放置于37℃、5%CO
在一个或多个96孔板中对mTD NPC-Δ7细胞的转导
板培养基的制备
制备用于多个板的足够板培养基。mTD-NPCΔ7细胞的每个板需要至少10mL板培养基。
AAV9-SMN1载体参考标准品(RS)、对照和测试样品的制备
AAV9-SMN1载体参考标准品(RS)、对照(Crtl)和测试样品(S1、S2、S3等)如下制备。
将参考标准品(RS)、对照和测试样品的等分试样在环境温度下解冻。在使用前,将配制缓冲液和板培养基在37℃水浴或等效物中预热至少30分钟。
使用适当的预热配制缓冲液在1.5mL微量离心管中将样品预稀释至1.00E+12vg/mL。为了确保移液准确性,从样品小瓶中取最小体积10.0μL进行样品预稀释。
为了制备剂量A(300K的MOI),使用板培养基将样品进一步稀释16.67倍至6.00E+10vg/mL。
进行2倍系列稀释以制备剂量B-E。例如,在用P-300移液器轻轻混合剂量A溶液之后,从剂量A溶液中转移250.0μL并与250.0μL板培养基(稀释剂)合并以制备剂量B。重复系列稀释以制备剂量C、D和E。在系列稀释之后,每个剂量被制备成具有足够的剩余体积(250.0μL),使得每个剂量的重复孔各自以100.0μL进行转导。作为实例,参见表14。
表14.参考样品的制备实例
转导
从培养箱中移出所制备的一个或多个分化细胞板,并转移至BSC。记录培养箱温度和CO
每个96孔板的孔被分配用于与单一参考样品和一个或多个测试样品一起使用。作为板分布图的实例,参见表15。边缘孔(A行、H行、第1列、第2列)含有0.1mL DPBS(在板接种期间填充)。边缘孔不进行吸移。
使用多通道移液管,将板培养基从含有细胞的孔中轻轻移出。为防止细胞干燥,可一次从2列中移出板培养基。
使用多通道移液管,将100.0μL制备好的样品轻轻混合,并立即按照板分布图以与相应孔壁成一定角度进行分配。
对于仅细胞(背景)分配的孔(非转导对照),添加100.0μL新鲜板培养基。如果仅测试一个样品,则将100.0μL新鲜板培养基添加至非转导孔中。这些孔未用于计算。
将板转移至培养箱(37℃±1℃、5±1%CO2)。将板孵育72±2小时,并记录开始和结束时间。记录培养箱温度和CO
表15.用于AAV9-SMN1载体参考标准品、对照和测试样品的板形式
细胞染色程序
在72小时±2小时移出经转导的板用于细胞染色。记录培养箱温度和CO
细胞固定
根据下文所述方案固定细胞。
从待染色的孔中吸出培养基。使用受控移液以避免细胞损失。
将50.0μL 4%多聚甲醛以与孔壁成一定角度轻轻添加至60个内孔。
然后将板在环境室温下孵育5至7分钟。记录开始和结束时间。
孵育后,从每个孔中吸出4%多聚甲醛,并用250.0μL DPBS洗涤60个内孔。此时,如果以下步骤无法立即进行,则可以将板在2℃-4℃下储存最多3天。在这种情况下,在储存板之前,移出用于洗涤的250.0μL DPBS,并添加250.0μL新鲜DPBS。使用板密封件来防止在储存期间蒸发。
细胞透化
从每个孔中轻轻吸出DPBS,并且以与孔壁成一定角度向60个内孔中轻轻添加50.0μL 0.1%曲通X-100。
将板在环境室温下孵育5至7分钟,并记录开始和结束时间。
从每个孔中吸出0.1%曲通X-100,并用250.0μL DPBS洗涤60个内孔。
一抗孵育
使用储存在2℃-8℃下的小鼠单克隆抗SMN抗体(克隆2B1)。染色所需的工作抗体量是通过以下方式计算:将待染色的参考样品、测试样品和对照样品的数量相加,并且乘以每个样品的50.0μL体积。制备足够的过量体积以使得就移液体积损失而言是足够的。
使用在DPBS溶液中的1%BSA作为稀释剂,制备小鼠抗SMN抗体的一抗染色溶液。基于开发数据,以1:500稀释度使用圣克鲁斯sc-32313 XS批次号C2818,以1:1000稀释度使用圣克鲁斯sc-32313XS批次号F2118,并且以1:500稀释度使用EMD密理博批次号3054700。一抗溶液制备可以根据需要按比例放大或缩小。例如,为了制备1:500稀释度抗体的4.0mL染色溶液,将8.0μL抗SMN抗体添加至在DPBS中的4.0mL 1%BSA中。
从每个孔中吸出DPBS,并且以与孔壁成一定角度向60个内孔中轻轻添加50.0μL一抗染色溶液。
将一个或多个板在环境室温下孵育120至150分钟,并记录开始和结束时间。
孵育后,从每个孔中吸出一抗溶液。用250.0μL DPBS洗涤60个内孔在移出洗涤步骤中的DPBS之前,制备二抗体染色溶液。
二抗孵育
可以根据需要按比例放大或缩小二抗溶液制备,并且不使用时用铝箔覆盖容器。制备了含有以下的二抗染色溶液:在DPBS中的1%BSA中的最终2μg/mL的山羊抗小鼠IgG(H+L)Alexa Fluor Plus 488(在1:1000稀释度下)和2μg/mL细胞核染料Hoechst 33342(1:5000稀释度)。通过将10.0μL Hoechst 33342细胞核染料添加至40.0μL蒸馏水中来预稀释Hoechst 33342细胞核染料。对于每次染色,预稀释的Hoechst 33342是新鲜制得的。对于1个板,通过将5.0μL预稀释的Hoechst和5.0μL二抗添加至在DPBS中的1%BSA中来制备建议的5mL二抗溶液。
从每个孔中吸出DPBS,并且以与孔壁成一定角度向每个孔中添加50.0μL二抗溶液。将板在环境室温下避光(例如:以箔覆盖)孵育60至80分钟,并记录开始和结束时间。
从每个孔中吸出二抗溶液,并用250.0μL DPBS洗涤60个内孔。
从每个孔中吸出DPBS洗涤液,并将250.0μL DPBS添加至60个内孔。然后用透明的光学板密封件密封板,将该密封件牢固地压在每个孔上。使一个或多个板避光,直至可以进行图像采集。将一个或多个板保持在环境温度下,并在染色的同一天进行读取。
图像采集与分析
使用CellInsight高内涵筛选(HCS)平台采集板的图像,该平台使用HSC studio软件和标准化方案。
用预先用70%乙醇润湿的KimWipes擦拭板密封件的顶部和板的底部以去除灰尘,并且将板加载至HCS接收器中,将板的A1与接收器的A1对齐。
使用自动聚焦来采集细胞,并在视觉上证实细胞核处于焦点上。使用此系统捕获的焦点上细胞核的实例示出在图18中。
将如下所述的CellInsight设置用于数据采集。测定设置:成像模式:荧光1(F1)%荧光2(F2);采集明视野图像;F1图像细胞类型:小鼠ES细胞;说明:mNPC荧光团AO VC-535-403;荧光经验值:700.0ms;F2图像细胞类型:小鼠ES细胞;说明:mNPC荧光团P1 VC-660-503;荧光经验值:5000.0ms;设定用于测定的稀释因子:2.000;显示F1、F2百分比:F1/(F1+F2)*100%。细胞类型设置:小鼠ES细胞;细胞直径:最小9.0微米,最大30.0微米;圆度:0.10;对比增强:0.40;解簇边缘因子:0.5;解簇Th因子:1.0;背景调整:1.0。台盼蓝活力参数:死细胞直径:最小8.0微米,最大30微米;灵敏度:1.0;均匀度:150;非常暗的死细胞对比增强:0.60。方案设置:物镜:20x;视野大小:455.4 x455.4微米;相机:X1;相机采集模式:1104x1104(2x2像素合并);使用软件自动对焦;软件聚焦通道:1;自动对焦间隔:1。通道1设置:复合、相机增益中包括的通道:2;光强度(以%计):100;成像模式:宽视野;染料:386-23_BGRFRN_BGRFRN;视野深度:6.563;固定的曝光时间;目标%:25;曝光时间(秒):0.08。通道2设置:复合、相机增益中包括的通道:2;光强度(以%计):100;成像模式:宽视野;染料:485-20_BGRFRN_BGRFRN;视野深度:6.563;固定的曝光时间;目标%:25;曝光时间(秒):0.08。
对测定结果的分析
使用Excel电子表格来简化和自动化使用下面所述的统计方法对测试样品相对于参考标准品的相对效力%值的计算。
使用平行线分析的相对效力计算
单独线性模型
对于每种样品,将线性回归模型(M2.1)拟合至:板上的重复测定读出(积分荧光强度/细胞)的平均值相对log
对于所有样品(RS、Ctrl和S1、S2、S3等)提供了使用最小二乘法的线性回归线的R平方值(R
对于每种样品(测定对照和测试样品),使用样品斜率估计值相对于参考标准品之比
如果斜率比处于在测定对照样品与参考标准品之间确立的经验范围内,则样品斜率与参考标准品的斜率平行,其中:
y=α+βlog
y是来自给定MOI水平的积分荧光强度/细胞
α和β分别是线性回归线的截距和斜率
e是残差
共同斜率模型
对于每种样品(测定对照和测试样品)和参考标准样品,将具有单独截距和共同斜率的线性回归模型(M2.2)拟合至:板上的积分荧光强度/细胞的重复测定读出的平均值相对log
y=α+βlog
y
α
β是共同斜率
e是残差
相对效力计算
根据来自模型(M2.2)的截距或斜率估计值将样品(测定对照和测试样品)的相对效力计算为
系统适用性标准
如果满足以下标准,则认为测定板有效。
所有样品均满足以下接受标准:IFI-C的CV%≤20%并且线性回归拟合时的R
测定参考标准品(RS)满足以下适用性标准。测定动态窗(仅最大信号/背景信号细胞)≥2.69,并且斜率≥1.02E+05。
测定对照满足以下适用性标准:测定对照与RS的斜率比在0.75-1.33之内,并且测定对照的相对效力在100%±40%之内。
测试样品(测试物品)满足以下适用性标准:测试样品与RS的斜率比必须在0.69-1.45之间。
系统适用性的未通过
如果未满足与参考标准品或测定对照相关的任何系统适用性,则认为板无效,并且重新测试样品。
样品系统适用性标准的未通过
如果任何一个或多个测试样品确实满足如上所述的样品系统适用性的接受标准(CV%、R
可报告值(RP%)
除非另有说明,否则可报告值定义为三个独立有效测定结果的均值。
计算来自三个样品测定结果的RP%的均值、标准差和CV%(RSD)。如果CV%>30%、则将不生成可报告值,并且进行三个另外的有效测定,并计算第二组测试的均值和CV%。
如果参考标准品RP%不是100%,则根据以下计算报告最终样品结果:
报告的样品RP%结果=样品RP%(PLA)x当前WRS或PRS指定的RP%
其中PLA:平行线分析
WRS:工作参考标准品
PRS:基准参考标准品
实例5:对于AAV9-SMN1载体药物产品的基于细胞的体外相对效力测定的验证
进行全面的验证研究,以评估广泛的性能参数,包括基于细胞的体外相对效力测定的准确性、精密度(可重复性、中间精密度和再现性)、线性、平行性、测定范围和特异性以及定量限(LOQ)。基于利用确认数据的统计分析,确立了预定义的接受标准,其中一些在验证方案中比在初始确认方案中更严格。
如表16中所汇总,来自验证研究的结果满足所有预定义的接受标准。这证明,经验证的方法是精确的,其中中间精密度的RSD%(相对标准差)范围的为15.6%-29.5%且合并RSD%为23.5%(表16和表18),可重复性的RSD%范围为4.9%-15.6%且合并RSD%为11.0%(表16和表22),并且再现性的RSD%范围为13.2%-22.7%且合并RSD%为19.7%(表16和表19)。
此外,该方法是准确的,其中相对偏差在-7.5%至8.3%的范围内(表16和表20)或回收率%在92.5%-108.3%的范围内(表19)。准确性也通过来自5种回收样品的测量相对效力的几何均值与预期相对效力之间的优异线性关系得到证明,该线性关系具有0.890的斜率和0.99的R
此外,很明显,效力方法是稳健性的,因为其测定性能不受关键测定参数的有意改变条件的影响,这些关键测定参数诸如细胞接种密度、传代细胞数(P8至P15)、来自相同工作细胞库的不同小瓶的使用、抗体浓度和测定孵育时间(表17)。
总之,经验证的效力方法保证了其对于临床和许可药物产品的批次处置以及对于稳定性研究(鉴于其稳定性指示特征)的适用性。
另外,对潜在的板效应的研究显示,如在板布局中定义的三个不同样品位置(S1、S2和S3)处测量的相对效力值几乎没有系统性偏差(例如,参见表15)。因此,板布局对于基于细胞的体外效力测定的预期用途是可接受的。
表16.方法验证结果的汇总
表17.方法稳健性结果的汇总
材料和方法
除非另有说明,否则测试方法和实验设计是实例4中所述的。
基于细胞的效力方法允许通过测量含有AAV9-SMN1载体的药物产品(DP)转导小鼠原代细胞并表达SMN1蛋白的能力来定量测定SMN1编码AAV9载体药物产品或稳定性样品的相对效力%(RP%)。使用高内涵图像系统来测量来自在表达内源SMN1蛋白方面为缺陷型的小鼠神经祖细胞系的终末分化细胞(mTD-NPCΔ7.2.6)中的免疫染色的SMN1蛋白。使用经验证并锁定的excel模板,使用平行线分析(PLA)计算回收样品相对于参考标准品(RS)(其被指定为100%)的RP%值。
结果
对方法的中间精密度、再现性、准确性、
线性、测定范围和定量限的评估
使用源于由两名分析员进行的2次独立运行(每名分析员2次运行,N=4)的5种回收样品数据来确定中间精密度。该方法的中间精密度通过其在15.6%至29.5%范围内的RSD%值和23.5%的合并RSD%(参见表18和实例6)来展示,该中间精密度满足RSD%≤40%的中间精密度的接受标准。
使用源于由三名分析员在两个实验室中进行的2次独立运行(每名分析员2次运行,N=6)的数据来评估再现性。该方法的再现性测量为范围为13.2%至22.7%的与五种回收样品相关联的RSD%和19.7%的合并RSD%,该再现性满足RSD≤45%的再现性的接受标准。
该方法的准确性使用由三名分析员(N=6)从五种回收样品生成的数据通过其回收率%或相对偏差%值来展现。对应于40%、70%、100%、130%和160%预期相对效力的5种回收样品的RP%测量值的几何均值分别为43.3%、65.1%、101.3%、122.7%和148.1%。回收率%值的范围为92.6%至108.3%(表19)。相对偏差值的范围为-7.5%至8.3%(表20和实例6)。
此外,该方法的线性通过以下方式来评价:使用来自三名分析员的数据(N=6)将线性回归模型(参见实例6)应用于测量相对效力%(RP%)的几何均值相对于预期相对效力%(在40%至160%范围内)。显然,如表21和图19中所见,测量RP%值相对于预期RP%值(为40%、70%、100%、130%和160%)显示出优异的线性关系,其中斜率为0.890并且R
方法的可重复性的测定
使用三种回收样品(其预期RP%为40%、100%和160%)评估可重复性。由于第一运行中两个板的系统适用性未通过(有关说明,参见异常情况章节),因此结果源于两次实验运行。如表22中所汇总,来自这三种回收样品(N=3/样品)的RSD%值分别为15.6%、9.7%、4.9%,并且合并RSD%为11.0%(N=9)(还参见实例6)。所有RSD%值均满足对于可重复性定义的RSD%≤20%的接受标准,这展现了该方法的板内精密度。
方法的特异性
为了进一步确定基于细胞的效力测定是否特异性用于定量表达SMN1的SMN1编码AAV9 DP而不是表达无关蛋白的AAV9载体的相对效力,使用SMN1编码AAV9或表达MeCP2蛋白的MECP2-AAV9转导mTD-NPCΔ7。然后将经转导的细胞通过小鼠抗SMN1(克隆2B1)染色。指示SMN1蛋白表达水平的积分荧光强度/细胞(IFI-C)在AAV9-MECP2转导的细胞中保持在背景水平(与仅细胞可比)(图20A)。为了证实从AAV9-MECP2转导的细胞中背景水平IFI-C读出的发现不是由于转导不成功,将AAV9-MECP2转导的细胞通过抗MeCP2抗体染色。如图20B中所示,观察到指示MeCP2蛋白表达的IFI-C的剂量依赖性增加,这证实了AAV9-MECP2确实成功地转导至细胞中。
方法的稳健性
通过有意改变可能对测定性能具有影响的测定条件来评价方法的稳健性。每个稳健性研究经设计以通过在100%相对效力下测量样品的相对效力来评估每个板的一种测定条件。表23中的结果证明,测定性能不受改变条件的影响,因为测量相对效力值均满足落在目标100%的±40%之内的接受标准。因此,该方法在评估的测定条件下被认为是稳健的,这些测定条件包括细胞接种密度、细胞传代数、来自工作细胞库的细胞小瓶、SMN1抗体浓度、细胞分化时间和感染持续时间。
方法的平行性
平行性是通过样品斜率相对于参考标准品斜率之比来测量的。适当确立确保平行性的斜率比标准对于相对效力的准确且精确的定量是至关重要的。斜率比的标准是使用来自测定对照样品的斜率比的分布来确定的,因为测定对照被制备为与参考标准品相同。使用了在去除异常板后在测定开发和预确认中产生的板,将用于确认研究的斜率比标准确定为0.69-1.45。随后通过排除测定开发板和包括测定确认板,将标准缩小到0.75-1.33以用于验证研究。在验证研究中,在通过所有其他系统适用性标准的样品中,只有两个样品(均来自使用40%回收样品的可重复性研究)不满足0.75-1.33的严格样品斜率比标准,并且这两个样品的确满足确认研究中使用的样品斜率比标准(0.69-1.45)。
进一步评估源于确认和验证研究的五种回收样品和测定对照的斜率比揭示,这两个40%回收样品的未通过归因于与40%回收样品相关联的稍低斜率比和较高变异性(表24)。尽管40%回收样品有较低斜率比和较高变异性,但在测定确认和验证研究两者中此样品都成功地展现在精密度、准确性和线性方面的测定性能(实例6)。因此,对于40%回收样品观察到的斜率比范围(均值±3SD范围:0.67至1.09,表24)被认为是可接受的,并且对相对效力测定结果具有极小影响。总之,证明如表25中所示的经调整的样品斜率比接受标准仍确保了适用于相对效力的准确且精确测量的方法平行性。
与经调整的样品斜率比相关联的偏差记录在本实例的名称为“异常情况”的章节中。
表18.来自针对中间精密度的回收率研究的测量相对效力汇总
该研究使用1.0E+12vg/mL AVXS-101作为目标浓度(指定为100%的相对效力)。由两名分析员用五种回收样品在相对于100%(浓度为1.0E+12vg/mL)的40%-160%相对效力范围内评估中间精密度(N=4/样品)。分别确定每个样品的RSD%(N=4)和合并RSD%(N=20)。在这种情况下,将AVXS-101参考物稀释至0.4E+12、0.7E+12、1.0E+12、1.3E+12和1.6E+12vg/ml的标称浓度,并通过ddPCR测定证实经稀释的样品的基因组滴度。
表19.来自针对再现性研究的回收率研究的测量相对效力的汇总
表20.通过相对偏差展现的方法的准确性(N=6)
表21.用线性回归模型通过斜率和R
表22.来自三种回收样品的可重复性数据
表23.稳健性数据汇总
表24.样品与参考标准品的斜率比估计值的汇总
表25.测定系统适用性标准的汇总
结论
将源于全面验证研究及其统计分析的数据(实例6)合在一起,证明了实例4中对于AAV9-SMN1载体描述的效力方法是准确的,其中相对偏差值在-7.5%-8.3%的范围内;并且是精确的,其中合并中间精密度为23.5%的RSD%(N=20),合并再现性为19.7%的RSD%(N=30)并且合并可重复性为11.0%的RSD%(N=9)。当用线性回归对来自5种回收样品的测量RP%与预期RP%(为40%、70%、100%、130%和160%)的关系进行统计分析时,该方法也在40%到160%的RP%测定范围内显示出优异的线性,其中斜率和R
除了通过此方法验证研究显示的测定性能之外,对热应激样品的最近研究证明,实例4中所述的基于细胞的体外效力方法是指示稳定性的(实例9)。在此研究中,在20℃-25℃下保持3个月(T=3M)的SMN1编码AAV9载体的GMP批次100656的热应激样品损失了超过一半的其效力,测量RP%为42.2%,而对照GMP5样品(T0)和在相同温度下保持1个月(T=1M)的热应激样品完全有效。此外,有关评估潜在的板效应的研究证明,使用按照实例4中所述的方案设计的用于样品测试的板布局未观察到效力测量的系统性偏差(参见实例6和7)。
因此,实例4中所述的经验证且指示稳定性的基于细胞的体外效力方法被认为适用于批次处置临床和许可SMN1编码AAV9载体药物产品(DP)以及适用于评价稳定性样品的效力。
异常情况
偏差
在基于细胞的体外相对效力测定的验证期间,使用三种回收样品(目标效力为40%、100%和160%)进行可重复性研究。观察到,来自含有40%样品的板的样品系统适用性未通过,但该板通过了与参考标准品和测定对照相关联的所有测定系统适用性标准。
在可重复性研究的每个板上,从板布局中设计为S1、S2和S3的样品位置获得三个RP%值。为了从每个样品获得有效数据,系统适用性要求测试样品与参考标准品的斜率比在0.75-1.33之内,并且在其他测定参数接受标准中R2值≥0.95(参见实例4)。然而,在含有40%样品的板测定中,S2和S3的斜率比分别为0.72和0.66。此外,S3的R
根本原因和合理性
对如偏差中所述的可重复性研究中测试样品的样品系统适用性标准的未通过进行研究。
在三个单独的未通过样品(2个来自原始测定并且1个来自40%可重复性研究的重复测定)中不满足系统适用性标准的共同测定参数是斜率比。此外,在验证(使用160%回收样品的可重复性研究)期间,唯一另外的无效测定是由于样品的一个剂量点的CV%未通过,该未通过立即被确定是由测定板上的假象引起的。在包括总共34个板的全面验证研究中,根据实例4的其余系统适用性和预定义的接受标准全部都满足。如在此报吿的验证结果还证明了SMN1编码AAV9载体基于细胞的体外相对效力测定的可接受的稳健性、精密度、准确性、线性和测定范围。因此,研究人员推测,验证方案中样品斜率比的接受标准可能已不适合,并且可能已严格确立了测定后确认和测定前验证方案(从0.69-1.45至0.75-1.33)。
研究人员审查了确立系统适用性接受标准以用于确认且然后使用更严格的标准对其进行修正以用于验证的方式。基于在1个月时段期间获得的可用测定开发和预确认数据,确定了用于确认的系统适用性接受标准,其中斜率比定义为0.69-1.45。经修正的用于验证的系统适用性标准是基于预确认和确认数据的,该经修正的用于验证的系统适用性标准因一些测定参数(包括斜率比范围(从0.69-1.45至0.75-1.33))而变得严格。此外,使系统适用性标准变得严格并未考虑在方法验证期间引入的另外的分析员间、实验室间、仪器间变异性(表26)。
表26.方法确认与方法验证之间的差异
在研究之后,确定的是,斜率比系统适用性标准是基于来自非常短的测定进行史的测定对照,且然后在方法确认后而没有另外证实性数据的情况下立即进一步变严格。尤其是,使用测定对照确定的斜率比标准没有反映出更多的变异性,并且由40%回收样品显示出平均更低的斜率比范围(参见表24)。此外,方法确认与验证的执行环境之间的比较显示,方法验证环境包括另外的变量。因此,研究人员得出的结论是,在非常成功的方法确认之后在有限的测定经验的情况下立即使样品系统适用性接受标准变严格是过早的并且还没有充分证明合理,导致在相比于方法确认在执行环境方面具有许多差异的方法验证期间样品斜率比未通过。
尽管40%回收样品有稍低斜率比,但在测定确认和验证研究两者中此样品都成功地展现在精密度、准确性和线性方面的测定性能。因此,对于40%回收样品观察到的斜率比范围(均值±3SD范围:0.67至1.09)被认为是可接受的,并且对相对效力测定结果具有极小影响。此外,为了适应测试样品的斜率比的较高变异性和40%回收样品的稍低斜率比,将用于测定确认研究的0.69-1.45的较宽样品斜率范围应用于验证研究数据的分析。测定对照的斜率比范围(0.75-1.33)以及所有其他系统适用性接受标准均保持不变,以确保不影响数据质量。使用复原的样品斜率比标准分析的验证数据展现了测定的期望准确性、精密度、线性、稳健性和特异性(实例6)。总之,这显示应用0.69-1.45的样品斜率比接受标准保证了相对效力测量中的数据质量。
实例6:对于SMN1编码AAV9载体药物产品的基于细胞的体外相对效力测定的验证的统计分析
评估来自使用实例4中所述的方法进行的对于SMN1-AAV9的基于细胞的体外相对效力测定的验证研究(实例5)的结果的统计学显著性。
评估验证研究的结果的精密度(可重复性、中间精密度和再现性)、准确性、线性、测定范围和特异性。结果总结于下表27中。在测定精密度、准确性、线性和特异性方面已成功验证40%至160%的相对效力的测定范围。成功的方法验证研究得出的测定范围为40%至160%,这两个值分别表示测定LLOQ和ULOQ。
体外相对效力测定的平行性通过样品相对于参考标准品的斜率比来测量。斜率比的标准使用来自测定对照样品的斜率比的分布来确定,因为测定对照被制备为与参考标准品相同。使用了在去除异常板后在测定开发和预确认中产生的板,将用于确认研究的斜率比标准确定为0.69-1.45。随后通过排除测定开发板和包括测定确认板,将标准缩小到0.75-1.33以用于验证研究(表28)。
在测定验证研究(实例5)中,对于通过所有其他系统适用性标准的样品,样品斜率比全部在0.75-1.33的范围内,除了两个40%回收样品平行测定均在0.69-1.45的范围内(表29和图25)。这两个40%回收样品平行测定的未通过归因于(1)40%回收样品的斜率比平均较低以及(2)对于40%回收样品观察到较高的斜率比变异性(表29)。
尽管40%回收样品有稍低斜率比,但在测定确认和验证研究两者中此样品都成功地展现在精密度、准确性和线性方面的测定性能。因此,对于40%回收样品观察到的斜率比范围(均值±3SD范围:0.67至1.09,表29)被认为是可接受的,并且对相对效力测定结果具有极小影响。对于验证研究(实例5),实施了经调整的斜率比标准(表28)。对于经调整的标准,对于测定对照样品保持0.75-1.33的斜率比范围,而将用于测定确认研究的0.69-1.45的较宽范围应用于测试样品,以适应测试样品的斜率比的较高变异性和如40%回收样品中所示的稍低斜率比(表28和29)。与经调整的斜率比标准相关联的偏差描述于实例5的“异常情况”章节中。
表27.测定验证研究结果的汇总
表28.测定系统适用性标准的汇总
表29.样品与参考标准品的斜率比估计值的汇总
可重复性
可重复性数据包括3种回收样品,每种回收样品具有从同一测定运行生成的3个相对效力结果。可重复性数据列于表30中。在此分析中,假设相对效力遵循对数正态分布。
对于每种回收样品,对于自然对数变换的相对效力结果估计均值
对于3种回收样品的组合,将模型(M2.1)拟合至汇集数据,以估计跨3种回收样品的总体可重复性。使用来自3种回收样品的汇集数据的总体可重复性为11.0%(表30)。
log(y
其中,y
表30.可重复性研究的汇总
中间精密度
中间精密度数据包括5种回收样品,每种回收样品具有由2名分析员在两个测定日从4个独立测定生成的4个相对效力结果。分析样品以评估体外效力测定的中间精密度。来自中间精密度研究的数据列于表41中。在此分析中,假设相对效力遵循对数正态分布。
对于每种回收样品,对于自然对数变换相对效力结果估计均值
对于5种回收样品的组合,将模型(M2.2)拟合至汇集数据,以估计跨5种回收样品的总体中间精密度
log(y
其中y
μ
表31.按回收样品的中间精密度的汇总
表32.合并的5种回收样品的总体中间精密度的汇总
再现性
再现性数据包括5种回收样品,每种回收样品具有由两名分析员从第一实验室在两个测定日从4个独立测定生成以及由一名分析员从第二实验室在两个测定日从2个独立测定生成的6个相对效力结果。分析数据以评估体外效力测定的测定再现性。关于可重复性、准确性和线性的数据列于表41中。在此分析中,假设相对效力遵循对数正态分布。
对于每种回收样品,对于自然对数变换相对效力结果估计均值
对于5种回收样品的组合,将模型(M2.3)拟合至汇集数据,以估计跨5种回收样品的总体再现性
log(y
其中y
μ
表33.按回收样品的再现性的汇总
表34.合并的5种回收样品的总体再现性的汇总
准确性
每种回收样品的相对偏差从几何平均相对效力和预期相对效力估计为
表35.相对偏差的汇总
线性
将线性回归模型拟合至如表35中的测量相对效力的几何均值和预期效力。线性结果汇总于表36中,并且将数据作图于图19中。线性回归模型的R2为0.99,并且估计斜率为0.890。
表36.线性的汇总
特异性
分别在来自SMN1和MeCP2染色的两组数据中证明了特异性,并且分析的数据列于表42中。在第一数据组中,用小鼠抗SMN1 2B1抗体对以18.75k至300k的MOI剂量范围用AAV9-SMN1或AAV9-MECP2载体转导的细胞进行染色。来自在每种MOI剂量水平下用AAV9-MECP2转导的重复孔的平均IFI-C读出未显示出剂量依赖性渐增趋势,而AVXS-101对照显示出如预期的线性剂量响应趋势(图20A)。图20A示出了通过抗SMN1小鼠单克隆抗体2B1染色的AAV9-SMN1和AAV9-MECP2转导的剂量响应趋势的汇总。
在第二数据组中,用抗MeCP2兔单克隆抗体对以18.75K至300K的MOI剂量范围用AAV9-MECP2转导的细胞进行染色。在此数据中,通过指示转导细胞中MECP2表达的荧光信号的剂量依赖性增加证明了AAV9-MECP2高效转导至细胞中(图20B)。图20B示出了通过抗MeCP2兔单克隆抗体染色的经AAV9-SMN1和AAV9-MECP2转导的剂量响应趋势的汇总。
验证研究结果汇总
测定验证研究的分析结果,包括精密度(可重复性、中间精密度和再现性)、准确性、线性和特异性汇总于表37中。测定验证研究通过了所有预先指定的研究标准。
表37.测定验证研究结果的汇总
b
斜率比评估的平行性
体外相对效力测定的平行性是通过测试样品和参考标准品的斜率之比,即斜率
用于测定确认和验证研究的系统适用性标准列于表38中。斜率比的标准使用来自测定对照样品的斜率比的分布来确定,因为测定对照被制备为与参考标准品相同。使用了在去除异常板后在测定开发和预确认中产生的板,将用于确认研究的斜率比标准确定为0.69-1.45,并且随后通过排除测定开发板和包括测定确认板,将该标准缩小到0.75-1.33以用于测定验证研究。
将来自在测定确认研究和验证研究中生成的测定结果的斜率比汇集,并对其进行分析以评价样品相对于参考标准品的总体平行性。对斜率比进行对数变换以便分析。对于测定对照和每种回收样品,对于自然对数变换的斜率比估计均值
在测定验证研究中,对于通过所有其他系统适用性标准的样品,样品斜率比在0.75-1.33的范围内,除了两个40%回收样品平行测定均在0.69-1.45的范围内(表39和图25)。这两个40%回收样品平行测定的未通过归因于(1)40%回收样品的斜率比平均较低以及(2)对于40%回收样品观察到较高的斜率比变异性(表39)。
尽管40%回收样品有稍低斜率比,但在测定确认和验证研究两者中此样品都成功地展现在精密度、准确性和线性方面的测定性能。因此,对于40%回收样品观察到的斜率比范围(均值±3SD范围:0.67至1.09,表39)被认为是可接受的,并且对相对效力测定结果具有极小影响。对于验证研究,实施了经调整的斜率比标准(表39)。对于经调整的标准,对于测定对照样品,保持0.75-1.33的斜率比范围,而将用于测定确认研究的0.69-1.45的较宽范围应用于测试样品,以适应测试样品的斜率比的较高变异性和如40%回收样品中所示的稍低斜率比(表38和39)。
表38.测定系统适用性标准的汇总
表39.样品与参考标准品的斜率比估计值的汇总
a.来自使用邓尼特方法与测定对照的多次比较的p值
b.均值±3SD范围如下计算:使用自然对数变换的斜率比并且反对数变换回至原始比例。
统计软件
使用统计软件JMP Pro 13.2.1进行对测定确认研究和系统适用性的统计分析。
数据
表40.测定验证研究的可重复性数据列表
表41.测定验证的中间精密度、再现性、准确性和线性数据列表
表42.测定验证研究的特异性数据列表
表43.测定确认和验证研究的斜率比和相对效力
实例7:对于SMN1编码AAV9载体的基于细胞的体外相对效力测定的一致性研究
对于SMN1编码AAV9载体的基于细胞的体外相对效力测定进行一致性测试。如图21中所示,使用单剂量的MOI在96孔板中的孔B2-G11中评估一致性,因为这些孔是用于测定的孔(即板的60个内孔)。例如,将实例4中所述的5点标准曲线中的最低剂量MOI(18.75K)用于一致性评估,该最低剂量对应于对变化敏感性最高的点。两名分析员按照实例4中所述的程序各自制备三个板,该三个板代表分析员一次可以测试的最大板数量。使用3D热图绘图分析数据,该3D热图绘图允许检测不一致性(如果存在)。
选择中等剂量MOI(75K)来评价SMN1编码AAV9载体基于细胞的效力测定的一致性。通过使用配制缓冲液(TFF3缓冲液50ppm)将SMN1编码AAV9药物产品(批次60443-05,4.3E+13vg/mL)稀释至1.0E+12vg/mL来制备样品。然后使用板培养基将样品稀释16.7倍,之后使用板培养基进行两轮1:2系列稀释。这些制备步骤与实例4中制备参考标准品的方式一致。
进行另外的测定以解决板位置效应的可能性。来自这两项研究的数据包括在统计分析中,从而确定对基于细胞的体外效力测定的板效应。
根据实例4进行4次测定,并且测量来自4个不同位置的样品相对于参考标准品的相对效力百分比。如实例4中所述制备参考标准品,并且所有4个样品均与参考标准品相同地制备。表44示出了板布局。
表44.用于板效应测定的板布局
这些数据使得能够进行统计分析(实例6)以确定任何板效应是否与实例4中所述的基于细胞的体外相对效力测定中使用的板布局相关联。应注意,使用SMN1编码AAV9药物产品GMP7(批次60443-05,4.3E+13vg/mL)来制备参考标准品和样品两者。
测量的相对效力值几乎没有系统性偏差。
实例8:对于SMN1编码AAV9载体的基于细胞的体外相对效力测定的特异性
在用MECP2编码AAV9载体转导mTD NPC-Δ7细胞时,初始观察到MeCP2染色(IFI-C)的仅轻微的剂量依赖性增加。
用于实验的板的布局显示在下表45中。
表45.用于特异性分析的板布局
制得测定板后,对于在实例4中所述的基于细胞的体外效力测定中获得SMN1编码AAV9载体的数据有三个主要步骤。这些步骤是:
(1)在CellInsight CX5上使用HCS Studio软件进行图像采集;
(2)在CellInsight CX5上使用HCS Studio软件进行图像分析;并且
(3)使用体外相对效力计算电子表格进行数据分析。
在数据分析的步骤(3)之后,产生第10-11列中IFI-C的仅微量增加的初始观察结果(参见图22)。
为了确定观察结果是否真实地反映了生物学事件,或者是否从图像分析产生,对步骤(1)(图像采集)中获得的原始图像数据进行视觉证实。图23示出了表45中所示的板的图像剪辑图。
在图像采集过程期间对MeCP2染色的细胞曝光过度。对于MeCP2染色的细胞,曝光过度并由此IFI-C非常高导致在特定地为SMN1表达分析而设置的图像分析(步骤2)期间排除了那些细胞。这是由于特定地为SMN1染色设置的参数显现为分散的点滴状而不是细胞核内的局部表达(MeCP2染色)。
如图23中所示的初始获得的图像使用经修改以特定地评价MeCP2染色细胞的图像分析方案重新分析。然后,将获得的图像分析数据用于绘制示出IFI-C相对于Log
图24中所示的数据确立了在用AAV9-MECP2转导的细胞中MeCP2染色的剂量依赖性线性增加,这证明抗SMN1抗体仅特异性染色AAV9-SMN1转导的细胞。因此,如实例4中所述的用于SMN1编码AAV9载体的基于细胞的体外效力测定可用于特异性地测定AAV9-SMN1载体药物产品的相对效力。
实例9:对于SMN1编码AAV9载体的基于细胞的体外相对效力测定指示稳定性
使用实例4中所述的基于细胞的体外效力测定方法测试AAV9-SMN1(GMP5批号600156)应激样品在20℃-25℃下保持一和1个月和3个月之后的稳定性。
所有三种样品(S1,DP批号600156;S2,在20℃-25℃下保持1个月,以及S3,在20℃-25℃下保存3个月)均满足如下表46中所示的接受标准。
表46.系统适用性和接受标准
表47.测试样品的RP%
样品3(时间=3个月,在20℃-25℃下)的相对效力降低到小于50%,而样品1(时间=0,在20℃-25℃下)和样品2(时间=1个月,在20℃-25℃下)未指示任何减少。这些数据显示,体外相对效力测定不仅可以测量为评估测定的线性而生成的回收样品的相对效力,而且还可以测量实际制造样品的相对效力。此外,对GMP5应激样品的成功测试证明,AAV9-SMN1体外效力测定是指示稳定性的,且因此适用于测试AAV9-SMN1载体药物产品以进行其批次处置。
实例10:用于AAV9-SMN1制造的预GMP主细胞库的产生
解冻:将单一细胞小瓶(1x10
对增加的粘附性的选择:使用以下技术培养细胞以选择强粘附型细胞。一旦细胞在25cm
细胞扩增:一旦细胞在2x175cm
收获:从20x175cm
将体积分至2x50mL管中,每个管中总共有25mL细胞悬浮液。使用1:2稀释的样品来使用血细胞计数器和甲苯胺(Toludine)蓝(台盼蓝)计算每管细胞的活细胞计数。管1样品具有1.99x10
表48.总收获细胞的计算
然后将填充的小瓶转移至-80℃冷冻机中具有新鲜异丙醇的冷冻室过夜,以进行受控速率冷冻。然后将经冷冻的小瓶转移至液态氮罐中的蒸气相液态氮。将十个小瓶转移在干冰上,以存放于GMP设施中。
将来自ATCC的HEK293细胞解冻且成功地适应在3次传代中增加的粘附性,之后进行扩增和种子库的成功建库。测试种子库的生长和外来因子(支原体、真菌和细菌)的存在。测试显示,种子库适用于GMP设施中的主细胞建库。
实例11:上游制造工艺
使用上游工艺(参见例如图29)来产生源自工作细胞库的中间物,其中上游工艺包括以下步骤:(a)培养粘附型细胞,(b)用如图26A-26C中所示的三种质粒(例如包含本文所述的AAV9-SMN1)转染经培养的细胞以使得能够产生AAV病毒载体,(c)裂解粘附型细胞以分离AAV病毒载体,(d)经由过滤纯化病毒颗粒以去除任何完整细胞或细胞碎片,和(e)对(d)的纯化产物进行切向流过滤,并且(f)将纯化的病毒颗粒的所得中间制剂冷冻。
将HEK293细胞解冻并在使用CO
当细胞汇合时,将其用DPBS洗涤,并用TrypLE Select酶溶液从烧瓶中移出。添加细胞扩增生长培养基以中和酶溶液,并将悬浮的细胞分开并再接种至含有细胞扩增生长培养基的新烧瓶中。将此扩增过程重复7次。在最后一次迭代中,悬浮的细胞不再接种在烧瓶中,而是将细胞浆液接种在生物反应器中以进一步扩增。
在接种前,准备用于接种的iCELLis 500/200m
在从生物反应器接种开始的第4、5或6天,通过三重DNA质粒PEI共沉淀转染粘附型HEK293细胞。用于此转染的3种质粒是pSMN、pAAV2/9和pHELP。将用于细胞扩增的DMEM生长培养基从生物反应器中移出,并用转染培养基替换。在大规模粘附型细胞生物反应器中使用利用聚乙烯亚胺(“PEI”)共沉淀的向粘附型人胚肾(HEK293)细胞中的三重DNA质粒转染产生scAAV9.CB.SMN载体。载体质粒pSMN含有人运动神经元存活蛋白(SMN)的cDNA。用于此转染的3种质粒是pSMN(222mg)、pAAV2/9(333mg)和pHELP(444mg)。可以以1:1:1摩尔的比率转染质粒。在添加PEI-质粒共沉淀物之前,使转染培养基在生物反应器中平衡直至生物反应器温度>30℃。PEI-质粒共沉淀过程涉及将质粒添加至转染培养基,并0.2μ过滤至反应袋中。将PEI添加至转染培养基,且然后添加至反应袋。PEI-质粒比率为按重量计约1:1。手动混合PEI-质粒反应以形成均匀的悬浮液,并且反应在15-30分钟时段内发生。在反应时间结束时,将PEI-质粒共沉淀物从反应袋转移至生物反应器。在重新开始搅拌之前,使PEI-质粒共沉淀物在生物反应器中混合1-2小时(替代性持续时间描述于实例7中)。在下一次培养基更换之前,将转染培养基在生物反应器中再循环18-24小时。
在生物反应器第6天,在转染后18-24小时,排放生物反应器并用转染后培养基替换转染培养基再循环培养基袋。用转染后培养基再填充生物反应器,在生物反应器中再循环。在第7天,在第6天的培养基更换后18至24小时,用新鲜袋的转染后培养基替换再循环袋中的转染后培养基。在此步骤期间,没有排放生物反应器。继续培养基的再循环,直至通常在第9天的收获。
在生物反应器中9天后,从反应器中获取最终的收获前样品,并开始全细胞裂解过程。将全能核酸酶添加至生物反应器至终浓度为100U/mL。使全能核酸酶在反应器中混合,并将裂解缓冲液添加至反应器。将裂解缓冲液在15℃-25℃的反应器中混合2小时,然后将生物反应器的内容物转移至收获袋。将淬灭全能核酸酶反应的盐蔗糖溶液(SSS)添加至收获袋并混合15分钟。然后将生物反应器用生物反应器冲洗缓冲液冲洗15分钟,且然后将冲洗液与经淬灭的细胞裂解溶液一起收集在收获收集袋中。一旦已将冲洗液添加至收集袋,将内容物混合15分钟并获取批量收获样品。
将经混合的批量收获物通过POD深层过滤器过滤至收集袋中。一旦已过滤所有的批量收获物,就用TFF1缓冲液驱逐深层过滤器。将深层过滤器汇集物混合并取样。然后将深层过滤器汇集物通过0.45μm过滤器过滤,以进一步澄清化批量收获物料。然后用TFF1缓冲液驱逐0.45μm过滤器。
对于TFF1步骤,将5.0m
将TFF1中间物在LFH橱中等分至1或2升无菌PETG瓶中,且然后在干冰上或在冷冻机中冷冻并转移至-60℃储存。
表49.上游工艺中使用的缓冲液
实例12:下游制造工艺
使用下游工艺(参见例如图30)将TFF1中间物处理成经过滤的药物物质。在一些实施例中,本文披露的下游工艺可用于处理如本文所述的包含AAV9-SMN的中间物。下游工艺步骤包括:(a)酸化和澄清化中间物(使用过滤),(b)使用阳离子交换色谱进行纯化,(c)使用切向流过滤(“TFF2”)进行过滤,(d)使用CsCl缓冲液进行超速离心以分离填充病毒衣壳和空病毒衣壳,(e)收集AAV病毒载体,并且(d)用第二切向流过滤(“TFF3”)步骤过滤经收集的AAV病毒载体。
将来自上游工艺的TFF1中间物料(如果先前冷冻则解冻至室温)用混合器泵入袋中。将汇集的TFF1中间物混合,并获取样品以测定滴度。通过添加11%-14%的吐温20立即处理汇集的TFF1中间物。使用吐温20促进大部分的宿主细胞蛋白和DNA在酸性pH条件下的絮凝。使混合物孵育12-20小时。然后通过添加酸化缓冲液(1M甘氨酸)将pH降低至pH 3.3-3.7。通过将溶液通过1.1m
使用阳离子交换(CEX)色谱步骤将病毒衣壳与蛋白质、DNA和其他过程杂质(例如宿主细胞脂质、吐温20)分离。此步骤利用使用自动化过程色谱系统操作的CIMmultus S03-8000高级复合柱(磺酰基)(0.2μm孔)色谱柱(8.0L)。缓冲液和溶液描述于下表中:
表50.用于一个CEX循环的缓冲液和溶液
将酸化且澄清化的TFF中间物(即CEX加载物)加载至经清洁且平衡的CEX柱上。条件是使得病毒载体与整体柱结合。用CEX A缓冲液从柱上洗去未结合的物料。用在CEX A缓冲液中的CEX B缓冲液梯度从树脂上洗脱产物。在10个柱体积(CV)的洗脱梯度开始的2.3至2.7CV的各自定义体积开始级分1的收集。每个批次之后都将色谱柱丢弃(即,不重复使用色谱柱)。然后使用中和缓冲液将CEX产物洗脱液(级分2)中和至7.7-8.3的pH。
TFF2步骤浓缩病毒载体、去除蛋白质杂质、并且将缓冲液交换为用于CsCl超速离心步骤的适当缓冲液。使用配有0.3m
将经中和的CEX洗脱液的体积减少至目标渗余物体积。一旦达到目标渗余物体积,就以不连续的TFF模式(批次模式)开始渗滤。将渗余物用TFF2 NaCl渗滤缓冲液稀释2倍,并将渗余物浓缩至其初始体积。重复此举,直至用TFF2 NaCl渗滤缓冲液完成渗滤。然后将渗余物用TFF2 CsCl渗滤缓冲液稀释2倍,并将渗余物浓缩至其初始体积。重复此举,直至用TFF2 NaCl渗滤缓冲液完成渗滤。
基于经中和的CEX洗脱液的物理滴度、系统滞留体积、系统冲洗体积和渗余物密度,将渗余物进一步浓缩至最终质量以实现所需的目标载体浓度并回收至收集袋中。在用TFF2 CsCl渗滤缓冲液对系统进行一个冲洗循环之后进行产物排放,以使来自TFF系统的产物回收率最大化。获取含有渗余物和冲洗液的TFF2渗余物样品以进行物理滴度测量。在每个批次之后丢弃TFF2膜盒(即,不重复使用TFF膜)。
表51.用于TFF2的缓冲液
超速离心步骤的目的是通过利用氯化铯梯度超速离心从完全衣壳中去除空衣壳。将TFF2渗余物添加至超速离心管并将管密封。将管放置于超速离心机,如配备有50.2Ti型转子或等效转子的自动化Optima XPN 100超速离心机系统或等效系统中。将填充的管在20℃下以45,000rpm离心22小时。
在离心步骤完成之后,将管从超速离心机中移出并放置于生物安全柜中。将含有产物的管安装在废物容器上方的环架上。将灯放置在管的正下方以可视化空衣壳区带(区带A,最高区带)、完全衣壳双区带(区带B和区带C,即双区带的上区带和下区带)和在双区带下方的最低区带(区带D)。用附接至注射器的针刺穿管以使管排气,并且通过针移出区带B、C和D。将经收集的物料转移至收集袋。将经收集的超速离心汇集物(UC汇集物)用TFF2缓冲液稀释,以在TFF2加载物料中达到一致的起始CsCl浓度。将经稀释的UC汇集物在TFF3步骤中进行处理。用于CsCl超速离心步骤的缓冲液列于下表中:
表52.用于CsCl超速离心的缓冲液
TFF3步骤去除CsCl,并使用最终配制缓冲液浓缩完全载体。切向流过滤系统与50cm
将经稀释的UC汇集物的体积减少至目标渗余物体积。一旦达到目标体积,就开始以恒定的渗余物体积进行连续渗滤。用TFF3缓冲液渗滤渗余物。获取经渗滤的渗余物样品以进行物理滴度测量。通过确定渗透物重量的目标进一步浓缩渗余物,该渗透物重量通过以下方式计算:1)渗滤结束时TFF系统中渗余物的体积,2)经稀释的UC汇集物物理滴度,3)目标药物物质(DS)浓度,4)系统冲洗和过滤器冲洗的组合体积,以及5)TFF3缓冲液的密度。在每个批次之后丢弃TFF3膜盒(即,不重复使用TFF盒)。
表53.用于TFF3的缓冲液
用TFF3缓冲液对TFF膜进行连续两次20mL冲洗,以从TFF系统中回收载体。通过0.2mm Pall
实例13:制造工艺中的配制和填充
药物产品(DP)是单剂量、无防腐剂、无菌、透明至略微不透明且无色至淡白色的目标浓度为2.0x10
表54.药物产品单元操作-缓冲液组成
将DP填充至无菌即用型10ml Crystal Zenith(CZ)小瓶中,并用无菌即用型氯丁基弹性体塞子塞住,并用无菌20mm可掀式(flip-off)铝密封件密封。将小瓶填充有5.5mL或8.3mL的标称填充体积。目标溢出量为0.4mL,并将小瓶填充至5.9±0.1mL或8.7±0.1mL。
实例14:体内效力测定
使用定量的体内测定测量药物产品的相对效力。测定使用已确立的SMA疾病小鼠模型。SMAΔ7小鼠品系(杰克逊实验室,#005025)的育种对在表型上为正常的,但是其后代的约25%对于靶向SMN基因突变是纯合的且显示出SMA样表型。到第5天,它们显示出肌肉无力的征象,并在接下来的一周内发展出异常的步态和摔倒的倾向。杰克逊实验室报告具有SMA样表型的动物的平均存活期为约15±2天。试验性研究证明,未经治疗的具有SMA类表型的动物的中位存活时间为16.3天(几何均值;n=3次研究;10只小鼠/次研究)。
通过静脉内(IV)输注施用的生物活性药物产品产生存活时间的增加,该增加是剂量(vg/kg)的函数。相对于参考物料(先前批次载体)测量药物产品效力。通过液体数字聚合酶链反应(ddPCR)测定药物产品和参考物料的滴度(载体基因组/mL;vg/mL)。将载体在盐水中稀释以实现将施用至具有SMA样表型的小鼠的三个指定剂量水平中的每一个。
如果测定通过适用性,则测定的结果被认为是可接受的。测定适用性由以下项组成:
1.阴性对照样品的接受限度(15±2天,中位存活期)
2.阳性对照样品的接受限度(>40天,中位存活期)
3.参考标准品中位存活期剂量-响应曲线上的接受限度
在此项研究中使用先前批次载体(在下文中为先前批次)来确定以五种不同剂量水平(包括使用0.9%盐水溶液的0(零)剂量(未经治疗组))用药物产品进行给药时,SMAΔ7小鼠的中位存活期(天)之间的线性相关性。表55示出了使用先前批次的参考批次的校准曲线。
表55.使用AVXS-101的五种剂量水平的校准曲线
*未测定(ND)-尚未达到中位存活期(天)。
来自此项研究的数据证明,中位存活期剂量-反应曲线的线性范围为0-7.4vg/kg。药物产品批次816836的相对效力通过以下方式来确立:将先前批次参考标准品的线性回归曲线与药物产品批次816836的线性回归曲线进行比较。这是通过使用每条线性回归线(即参考标准品和测试物品)的y截距和斜率之比来实现的。相对效力百分比计算描述于下面的方程式(1)中:
RP%=[(测试物品的y轴截距/斜率)÷(参考标准品的y轴截距/斜率)]X100 (1)
将在1期临床试验中使用的NCH0613批次用作参考标准品批次,并向该批次分配100%的效力。
前述数据如下使用中位存活期剂量-响应曲线的线性部分确立初步的测定接受标准,以测定药物产品临床批次的相对效力:
·使用5种剂量(vg/kg)水平生成中位存活期(天)剂量-响应曲线
·选择剂量0、1.2E+13和7.4E+13用于运行线性剂量响应模型。
·盐水(未经治疗组)的适用性限度为13至17天中位存活期。
·参考标准样品的适用性限度确立为:
o斜率≥2.0E-13
o y截距≥16.00(天)
o y截距/斜率比≥8.5E+13
o R2≥0.7
使用Δ7小鼠模型证明SMA治疗剂(包括药物产品)的功效。具有15天±2的中位存活期的未经治疗或经盐水治疗的对照动物提供了可靠的基线对照,可自此将产品效力作为中位存活期的增加进行测量。用药物产品进行的开发工作鉴定了通过使用液滴数字PCR(ddPCR)所得的基因组滴度测定的三(3)种剂量(不包括媒介物处理的剂量),当将施用的剂量(vg/kg)对数变换并相对于经治疗的SMAΔ7新生小鼠的中位存活期(天)绘图时,该三种剂量以线性相关性影响小鼠模型的存活期。有关低、中和高滴度标准品,参见表56中的标准品滴度(vg/mL)。此外,将TFF缓冲液(媒介物)溶液用于零(0)校准曲线点以及阴性对照两者。还包括展现≥40天存活期的剂量(大于展现中位存活期加倍的剂量)作为阳性对照。
表56.目标剂量
剂量溶液制备(有关稀释方案实例,参考表57)。阴性对照--将0.9%盐水溶液用作阴性对照。阳性对照--使用盐水以1.5x10
表57.参考标准品和测试物品稀释方案(实例)
测试物品制备--使用盐水溶液稀释测试物品。计算稀释度以产生每只小鼠最终总体积为50μl的表26中描述的测试剂量(vg/kg)。一次对10只小鼠进行稀释,并以一个额外的体积作为阳性对照,其目标是将经治疗小鼠的最短寿命增加至≥40天的中位存活期(天)。
对照样品的接受限度。阴性对照组(未经治疗小鼠)--阴性对照组的测定接受限度是SMAΔ7鼠满足15±2天的中位存活期。此外,任何在≤10天内死亡的小鼠都将被从分析中排除。如果一组中使用超过7只小鼠,则最多可以排除2只在<=10天死亡的小鼠。
阳性对照组(以目标临床剂量治疗的组)--阳性对照组的测定接受限度是经治疗小鼠的最短寿命为至≥40天中位存活期。此外,任何在≤10天内死亡的小鼠都将被从分析中排除。如果一组中使用超过7只小鼠,则最多可以排除2只在<=10天死亡的小鼠。
参考标准品剂量响应曲线的接受限度。针对中位存活期(天)相对于施用剂量(vg/mL)绘制的参考标准品线性剂量响应曲线,确定测定适用性标准。有关测定适用性标准,参见表58。
表58.测定适用性标准(参考标准品线性剂量-响应曲线)
Y截距/斜率比--确定参考标准品和测试物品的中位存活期(天)对施用的剂量(vg/kg)的线性回归曲线。计算每个线性回归的y截距与斜率之比。
报告结果
相对效力结果的定性报告--在测定阳性对照物料在≥40天时的单点中位存活期(天)读取之前,评价每种测定的测定适用性标准。如果阳性对照组的中位存活期≥40天,则可处置满足以下标准时的测试物品。
相对效力结果的定量报告--在定量测定测试物品的相对效力之前,评价每种测定的测定适用性标准。一旦阳性对照达到≥40天以及代表7.5x10
实例15:表面活性剂灭活研究
为了分开低pH和吐温的影响,将具有7.6pH和4%-8%吐温-20的药物物质TFF1中间物样品用于表面活性剂灭活研究。当在酸化之前将吐温-20添加至TFF1中间物时,TFF1中间物中的吐温-20浓度比整个工艺中的低约2.5倍。此较低的吐温-20浓度被认为是药物物质工艺中表面活性剂驱动的灭活的最坏情况条件。用于通过表面活性剂处理进行的病毒灭活步骤的测试物品是含有4%-8%吐温-20的TFF-1中间物。为了评价通过表面活性剂处理步骤进行病毒灭活的能力,在一式两份的实验中各自使用XMuLV和PRV来向测试物品中掺加病毒。使用空斑形成感染性测定来定量病毒。
TFF1制造步骤产生4%-8%吐温-20的表面活性剂浓度范围。汇集TFF1中间物,并且在16℃-20℃的操作温度下将超过12%的吐温-20添加至TFF1中间物,并混合12-20小时的持续时间。病毒清除过程是在4%-8%吐温-20的浓度下和在16.0℃±0.1℃的受控温度下进行的。灭活过程的持续时间为120分钟,而典型的处理时间为16小时。
对于灭活过程,通过测量测试物品的体积、平衡至目标温度且然后掺加病毒来制备灭活加载物。在以下六(6)个时间点移出经掺加的灭活加载物样品以展现灭活随时间的动力学:<1分钟、15分钟、30分钟、60分钟、90分钟和120分钟。收集后,将每种样品在生长培养基中稀释以停止病毒灭活,并测定病毒。为了增加在90分钟和120分钟的测定灵敏度,还测定了大量体积的这些时间点样品中的病毒。由于此步骤的测试物品中存在吐温-20,因此根据掺加病毒的滴度和掺加的病毒体积计算出灭活加载物的滴度。
通过表面活性剂处理(吐温-20)进行病毒灭活的有效性显示为有效的,如通过两种病毒在90分钟的时间点的LRV值均大于4log10所证明的。通过表面活性剂处理进行的灭活的动力学在图31和图32中展示为在吐温20表面活性剂处理期间在120分钟的过程中病毒灭活的速率的图。
实例16:更高的接种密度、提早的转染和收获以及DNA/PEI混合时间对药物物质生产的影响
评价了更高的接种密度、提早一天转染和收获以及DNA/PEI混合时间对DS生产的影响。在1.6m
细胞按比例增加
将HEK 293细胞解冻并重悬于补充有10%FBS的DMEM中。将细胞在室温下以209xg离心5min,然后移出上清液并添加新鲜的DMEM+10%FBS。针对活细胞密度和活力对细胞进行计数,并将其接种在2x T175cm
细胞接种和监测
在搅拌下以在生长培养基(高葡萄糖DMEM+10%澳洲来源(Australian Origin)FBS+1:100青霉素链霉素(Pen Strep))中的8,000个细胞/cm
转染
细胞接种后第四天(12,000个细胞/cm
转染后培养基交换
转染后24小时,移出生物反应器和再循环回路中的所有培养基并用OptiMEM+1:100 Pen Strep(0.132mL/cm
收获
细胞接种后第八天(12,000个细胞/cm
深层过滤和切向流过滤
在细胞接种后第八天(12,000个细胞/cm
使用质粒在生物反应器中生产DS。数据代表对应于表59中所示的生物反应器编号和条件的一式两份的每种条件。
表59.生物反应器编号和相应条件
细胞生长:在接种当天(第0天)对细胞进行计数,并在接种后第4天(12,000个细胞/cm
pH、营养物和代谢物:在所有生物反应器培养物中,葡萄糖消耗趋势相同,这表明尽管生物反应器221生长曲线增加,但细胞以相似的速率消耗葡萄糖。以12,000个细胞/cm
生产滴度
通过数字液滴(ddPCR)测量来自收获物料的病毒基因组。相对于以8,000个细胞/cm
在澄清化和浓缩步骤的每个步骤处测量的病毒滴度示出在图36中。在TFF1步骤期间的每个步骤处的残留宿主细胞蛋白示出在图37A至37B中。
实例17:接种密度对药物物质生产的影响
评价了接种密度对DS生产的影响。评价了四种接种密度,并且每种接种密度以一式两份在生物反应器中。
细胞按比例增加
将HEK 293细胞解冻并重悬于补充有10%FBS的DMEM中。将细胞在室温下以209xg离心5min,然后移出上清液并添加新鲜的DMEM+10%FBS。针对活细胞密度和活力对细胞进行计数,并将其接种在2x T175cm
细胞接种和监测
在搅拌下用HEK 293细胞以各自一式两份的下述四种目标密度接种生物反应器:在700ml生长培养基(高葡萄糖DMEM+10%澳洲来源FBS+1:100Pen Strep)中的8,000个细胞/cm
转染
细胞接种后第五天,停止再循环,并将每个生物反应器腔室(不是再循环瓶)内的培养基替换为600ml DMEM-/-培养基(高葡萄糖、-CaCl2、-谷氨酰胺)。将每个反应器均用1:1质量比的质粒DNA和聚乙烯亚胺(PEIpro)转染。将质粒DNA以1:1.5:2质量比(pSMN-3.56mg、pAAV2/9-5.34mg、pHELP-7.1mg)混合,添加至300mL DMEM-/-培养基,经0.2μM过滤并通过倒置混合。将PEI(16mL)添加至300mL DMEM-/-培养基,并通过倒置混合。将PEI和DNA混合物组合,通过倒置混合并在室温下孵育20分钟。使用每种600ml PEI/DNA复合物混合物来转染针对每种相应的接种密度进行重复的两个生物反应器。将PEI/DNA复合物添加至每个生物反应器,并在过程参数下孵育两小时。转染后两小时重新开启再循环回路(12.5mL/min)。
转染后培养基交换
转染后24小时,移出生物反应器和再循环回路中的所有培养基并用OptiMEM(0.132mL/cm
收获
细胞接种后第九天,添加全能核酸酶(100U/mL),用裂解缓冲液(50mM HEPES,1%吐温20)驱逐,并在过程参数下孵育两小时。排放生物反应器且添加蔗糖盐溶液(500mMNaCl,1%w/v蔗糖),通过颠倒混合。在过程参数下,用生物反应器冲洗缓冲液(500mM NaCl、1%w/v蔗糖,20mM Tris碱、1%v/v吐温20、1mM MgCl
使用质粒在生物反应器中生产药物物质。将反应器以不同的密度接种,并按相同的时间表进行转染和收获(分别在接种后第5天、第9天)。数据代表一式两份的每种接种密度,如下表60中所示:
表60.起始接种密度生物反应器编号
细胞生长:在接种当天(第0天)对细胞进行计数,并在接种后第5天和第9天对细胞核进行计数。数据表明,所有反应器中的细胞在第0天与第5天之间呈指数生长。尽管起始接种密度不同,但细胞核计数并未指示出在第5天在组之间较大的细胞数量差异。转染后,第9天的细胞核计数表明,五个反应器(221、224、225、226、228)的总细胞核从第5天至第9天加倍。如图39A中所示,两个反应器(222、223)的总细胞核增加1.4倍。反应器227的总细胞核从第5天至第9天增加3.8倍。此差异可能是基于细胞不均匀分布在用于计数的单独纤维之间的假象。基于图39B-E中所示的代谢物数据,所有反应器中的细胞有可能类似地生长。
pH、营养物和代谢物:在所有生物反应器培养物中,葡萄糖消耗(图39B)趋势相同,这表明尽管起始接种密度不同,但培养物以相似的速率消耗葡萄糖。在所有培养物中,离线pH(图39C)在前三天保持一致(pH 7.25),随着营养物代谢的增加而下降,并且在第8天后同时随着铵离子水平的上升而增加(图39E)。乳酸(图39D)增加至第6天,且然后在生产即将结束时趋于平稳,这表明在此阶段利用乳酸作为能源。在以不同起始密度接种的反应器之间,未观察到代谢物曲线的显著差异。这可能是因为起始接种密度的差异很小,为<1.2倍的差异。
生产滴度:通过数字液滴(ddPCR)测量来自收获物料的病毒基因组。滴度在8,000个细胞/cm
如图40B中所示,评价了接种密度和DS的产量。在8E+03至10E+03cells/cm
实例18:可比性评估
1期临床研究(工艺A)中使用的AVXS-101药物产品与关键临床研究(工艺B)中使用的药物产品之间的可比性作为主要目的评估,次要目的是通过比较药物产品批次600156和600307来评估使用工艺B的制造一致性产品。图41表示1期(工艺A)和3期试验(工艺B)制造工艺流程及其之间的差异。
可比性评估是使用在全国儿童医院(Nationwide Children’s Hospital)(NCH)制造的1期临床药物产品批次NCHAAV9SMN0613和在AveXis制造的药物产品批次600156进行的。
产品
对以下物料批次进行评价,如表61中所汇总。评估包括直接比较来自使用工艺A的1期临床药物产品批次NCHAAV9SMN0613和使用工艺B的AVXS-101药物产品批次600156的所得质量属性。此外,还针对按比例放大的工艺再现性和一致性全面评价了批次600156和批次600307的释放测试。
表61:有待用于评价工艺A(1期)与工艺B(3期)之间的可比性以及工艺B的制造一致性的AVXS-101药物产品
制造工艺概述
图42A至42B提供了可比性结果的汇总。
可比性和制造一致性评估
工艺A和工艺B物料被评估为可比的,并且工艺B物料被评估为一致的。还确定工艺B物料具有另外益处,例如用于工业规模生产。
测试方法
pH
对批次NCHAAV9SMN0613(工艺A)、批次600156(工艺B)和批次600307(工艺B)进行pH分析。来自两种工艺的结果范围为7.9-8.0。这证明了工艺A和工艺B物料的pH是可比的,并且工艺B物料是一致的。
外观
对批次NCHAAV9SMN0613(工艺A)、批次600156(工艺B)和批次600307(工艺B)进行通过目视检查测得外观。工艺A与工艺B之间的外观结果的明显差异是由于不同的载体浓度(基因组滴度)所致。批次NCH AAV9SMN0613具有低于工艺B批次的载体浓度。因此,批次NCHAAV9SMN0613更稀,导致更澄清且无色的溶液,而对于工艺B批次的无色至白色和略微不透明的观察结果起因于每mL溶液中大约4倍浓度的病毒颗粒。
考虑到浓度差异,工艺A和工艺B物料的外观被评估为可比的,并且工艺B物料被评估为一致的。
摩尔渗透压浓度
对批次NCHAAV9SMN0613(工艺A)、批次600156(工艺B)和批次600307(工艺B)进行通过凝固点降低测得摩尔渗透压浓度。来自两种工艺的结果范围为410-415mOSm/kg。这证明了工艺A和工艺B物料的摩尔渗透压浓度是可比的,并且工艺B物料是一致的。
亚可见颗粒
对批次NCHAAV9SMN0613(工艺A)、批次600156(工艺B)和批次600307(工艺B)进行通过掩光法测得亚可见颗粒。来自两种方法的结果均远低于USP著作中针对可注射药物产品的建议限度。这证明了工艺A和工艺B物料的亚可见颗粒计数是可比的,并且工艺B物料是一致的。
基因组滴度
对批次NCHAAV9SMN0613(工艺A)、批次600156(工艺B)和批次600307(工艺B)进行通过ddPCR测得基因组滴度。预期AVXS-101批次的基因组滴度根据制造中的目标浓度而波动。由工艺B产生的基因组滴度(3.7x10
感染滴度
对批次NCHAAV9SMN0613(工艺A)、批次600156(工艺B)和批次600307(工艺B)进行通过TCID50测得感染滴度。工艺B(1.3x10
总蛋白质
对批次NCHAAV9SMN0613(工艺A)、批次600156(工艺B)和批次600307(工艺B)进行通过micro BCA测得总蛋白质。针对1.0x10
体内相对效力
批次NCHAAV9SMN0613用作测定的参考物料。基于参考标准曲线,对于批次600156和批次600307获得的每个效力结果分别为97%和96%。这些结果证明,工艺A和工艺B物料是可比的,并且工艺B物料是一致的。
通过蛋白质印迹测得的身份
对批次NCHAAV9SMN0613(工艺A)、批次600156(工艺B)和批次600307(工艺B)进行通过蛋白质印迹测得身份。工艺A和工艺B物料的主要条带(VP1、VP2和VP3)的印迹谱和表观分子量值被评估为可比的,并且还评估工艺B物料为一致的。
通过AUC测得的空衣壳%
对批次NCHAAV9SMN0613(工艺A)、批次600156(工艺B)和批次600307(工艺B)进行通过AUC测得空衣壳%。批次NCHAAV9SMN0613(工艺A)的结果为7%。批次600156和600307(工艺B)的结果分别为2%和4%。如通过AUC测量的,工艺B(2%和4%)产生比工艺A(7%)少约两倍的空衣壳。因此,工艺B能够产生包含较低浓度的空衣壳的改善组合物。
通过SDS-PAGE测得的身份和纯度
对批次NCHAAV9SMN0613(工艺A)、批次600156(工艺B)和批次600307(工艺B)进行通过SDS-PAGE测得身份和纯度。两种工艺的总纯度%≥98%,并且三种衣壳蛋白中的每一种的条带模式和表观分子量均是高度一致的。这些结果证明,工艺A和工艺B物料是可比的,并且工艺B物料是一致的。
残留宿主细胞蛋白
对批次NCHAAV9SMN0613(工艺A)、批次600156(工艺B)和批次600307(工艺B)进行通过ELISA测得残留宿主细胞蛋白。所有测试批次的结果均<测定的LOQ(8ng/mL)。这些结果证明,工艺A和工艺B物料是可比的,并且工艺B物料是一致的。
残留牛血清白蛋白(BSA)
对批次NCHAAV9SMN0613(工艺A)、批次600156(工艺B)和批次600307(工艺B)进行残留BSA。所有测试批次的结果均<测定的LOQ(0.50ng/mL)。这些结果证明,工艺A和工艺B物料是可比的,并且工艺B物料是一致的。
残留全能核酸酶
对批次NCHAAV9SMN0613(工艺A)、批次600156(工艺B)和批次600307(工艺B)进行通过ELISA测得残留全能核酸酶。所有测试批次的结果均<测定的LOQ(0.20ng/mL)。这些结果证明,工艺A和工艺B物料是可比的,并且工艺B物料是一致的。
残留宿主细胞DNA
对批次NCHAAV9SMN0613(工艺A)、批次600156(工艺B)和批次600307(工艺B)进行通过qPCR测得残留宿主细胞DNA。针对1.0x10
统计分析
对定量质量属性进行统计分析。如下面所列出,在工艺A批次(NCHAAV9SMN0613)与每个工艺B批次(600156和600307)之间成对进行比较。结果示出在图43和图44中。
这些研究显示,工艺B是生产病毒载体的优越方法。工艺B一致地产生更大量的病毒载体(如通过基因组滴度和感染滴度测量的),具有很少的杂质(较低的残留hcDNA)和较少的空衣壳。
下一代测序
还进行了下一代测序(NGS)以确立身份(测定和/或证实基因组序列),并评估来自工艺B的AVXS-101药物产品3期物料是否存在序列变体(亚群)。序列数据集相对于资助者提供的参考序列(pscSMN)的比对揭示了在整个基因组全长上的完整(100%)宽度和足够的覆盖深度,从而使得能够进行变体检测。注意到总共四个较小的变体位置,然而这些位置似乎代表了难以测序的区域内的测序错误(例如,由于其高GC含量和回文序列而出名地难以测序的AAV的反向末端重复序列(ITR)),而不是真正的变体。有关测序结果,参考表62。
表62.来自工艺B的AVXS-101 3期批次600156的DNA测序结果
1期批次NCHAAV9SMN0613稳定性概况
将批次NCHAAV9SMN0613在≤-60℃下储存12个月。在每个时间点,分析该批次。没有注意到不利的趋势。图45示出了迄今为止的稳定性结果。
完成对用于1期临床研究的AVXS-101的可比性研究。评估是使用在全国儿童医院制造的1期临床药物产品批次NCHAAV9SMN0613和在AveXis制造的AVXS-101药物产品批次600156进行的。此外,使用工艺B批次600156和600307评价制造一致性。对于可比性评估(工艺A与工艺B)和制造一致性(工艺B批次600156与600307)两者,该研究使用新改进的工艺和分析方法评价了AVXS-101临床试验物料的身份、质量、纯度和效力,以使得能够稳健评估可比性和制造一致性。
对定量质量属性进行统计分析。在工艺A批次NCHAAV9SMN0613与工艺B批次600156之间成对进行比较。工艺B是更好的方法,该方法可以以比工艺A更高的纯度生产更大量的病毒载体。例如,与工艺A相比,工艺B生产的病毒载体具有高48%的感染滴度、高8%的基因组滴度、少92%的超过10μm大小的亚可见颗粒、少50%的超过25μm的亚可见颗粒、少100%的空衣壳和少11%的残留hcDNA。所有结果相对于每种质量属性的测试限度都是一致的。
此外,为了使用工艺B确立制造一致性,使用批次600156和600307进行成对比较。来自工艺B批次600156与600307之间的初始成对比较的结果展现出制造的一致性。所有结果相对于每种质量属性的测试限度也都是一致的。
基于结果评价,来自使用工艺A的1期临床药物产品批次NCHAAV9SMN0613和使用工艺B的AVXS-101药物产品批次600156的所得质量属性证明,工艺B得到更高量的病毒载体和改善的纯度,这可能有利于例如大规模制造rAAV。另外,发现从工艺B产生的两个批次物料(批次600156和600307)是可再现的,这进一步展现出制造一致性。
实例19:分析型超速离心(AUC)分析
使用AUC方法分析来自1期(工艺A,批次NCHAAV9SMN0613)和3期(工艺B,批次600156和600307)的物料。NCHAAV9SMN0613、600156和600307的AUC概况(以一式两份分析)分别示出在图46、图47和图48中。
每种物料的AUC分析展现出空衣壳和完全衣壳的沉降系数类似,其中当与3期物料(工艺B,批次600156和600307)(空衣壳含量分别为2%和4%)相比时,1期物料(工艺A,批次NCHAAV9SMN0613)显示升高的空衣壳含量(7%)。这是由于与工艺A所采用的碘克沙醇梯度超速离心制造步骤相比,工艺B中的CsCl梯度超速离心制造步骤能够更有效地将空衣壳与完全衣壳分离。
当以在全国儿童医院(NCHAAV9SMN0613)生产的1期临床试验物料中和以AveXis的每个后续生产批次使用超速离心进行CsCl梯度纯化工艺时,使用临床和商业呈现的AVXS-101生产批次一致地展现出三个可见的衣壳区带。基于使用工艺A的1期临床药物产品批次NCHAAV9SMN0613和使用工艺B的AVXS-101药物产品批次600156的AUC概况,这些物料被认为是可比的。另外,从工艺B产生的两个批次物料(批次600156和600307)的AUC概况被评估为一致的。
实例20:上游制造工艺
上游工艺用于产生源自工作细胞库的中间物,其中上游工艺包括以下步骤:(a)培养细胞,(b)用如图26A至26C中所示的三种质粒转染经培养的细胞,(c)培养期之后,从细胞中收获经扩增的病毒颗粒,(d)经由过滤纯化病毒颗粒,以去除任何完整细胞或细胞碎片,(e)对来自步骤(d)的洗脱液进行切向流过滤,并且(f)冷冻经纯化病毒颗粒的所得中间制剂。
转染前,将细胞在合适的培养基中,在烧瓶或合适的生物反应器中或两者中扩增。一种培养基是具有10%FBS、4.5g/L葡萄糖、4mM L-谷氨酰胺的DMEM。在一个实施例中,最初使粘附型细胞在烧瓶中生长,且然后转移至iCELLis生物反应器中,以在生物反应器内进一步进行粘附型细胞扩增。
细胞扩增后,通过三重DNA质粒PEI共沉淀转染粘附型HEK293细胞。用于此转染的3种质粒是:pSMN、pAAV2/9和pHELP。将用于细胞扩增的DMEM生长培养基替换为经改良的DMEM转染培养基。DMEM转染培养基不含FBS、不含钙、不含L-谷氨酰胺但含有4.5g/L葡萄糖。在大规模粘附型细胞生物反应器中使用利用PEI共沉淀的向粘附型HEK293细胞中的三重DNA质粒转染产生scAAV9.CB.SMN载体。载体质粒pSMN含有人SMN的cDNA。用于此转染的3种质粒是:pSMN(222mg)、pAAV2/9(333mg)和pHELP(444mg)。在添加PEI-质粒共沉淀物之前,使转染培养基在生物反应器中平衡直至生物反应器温度>30℃。PEI-质粒共沉淀过程涉及将质粒添加至转染培养基,并0.2μ过滤至反应袋中。将PEI添加至转染培养基,且然后添加至反应袋。手动混合PEI-质粒反应以形成均匀的悬浮液,并且反应在15-30分钟时段内发生。在反应时间结束时,将PEI-质粒共沉淀物添加至生物反应器。在重新开始再循环之前,使PEI-质粒共沉淀物在生物反应器中混合1-2小时。在下一次培养基更换之前,将DMEM生长培养基在生物反应器中再循环18-24小时。
rAAV SMN基因组依次具有AAV2 ITR、具有巨细胞病毒增强子的鸡β-肌动蛋白启动子、SV40内含子、(GenBank登录号NM_000344.2)中列出的SMN编码DNA、来自牛生长激素的聚腺苷酸化信号序列和另一AAV2 ITR。还设想了SMN DNA的保守核苷酸取代(例如,GenBank登录号NM_000344.2的位置625处鸟嘌呤至腺嘌呤改变)。基因组缺少AAV rep和cap DNA,即,在基因组的ITR之间不存在AAV rep或cap DNA。所设想的SMN多肽包括但不限于NCBI蛋白数据库编号NP_000335.1中列出的人SMN1多肽。
在生物反应器第6天,在转染后18-24小时,排放生物反应器并用200升新鲜的OptiMEM转染后培养基替换DMEM再循环培养基袋。以64升再填充生物反应器,并重新开始生物反应器中的再循环。在第7天,在第6天的培养基更换后18至24小时,用新鲜袋的OptiMEM培养基替换再循环袋(约135升)中的OptiMEM转染后培养基。在此步骤期间,没有排放生物反应器。继续培养基的再循环,直至在第9天的收获。
在生物反应器中9天后,从反应器中获取最终的收获前样品,并开始细胞裂解过程。将全能核酸酶添加至生物反应器至终浓度为100U/mL。在使全能核酸酶在反应器中混合之后,将7.1升裂解溶液添加至反应器。在第一收获步骤之前,将裂解溶液在反应器中混合2小时。在2小时裂解结束时,将生物反应器的内容物转移至收获袋。将8.9升蔗糖盐溶液(SSS)添加至收获袋并混合15分钟。SSS溶液淬灭收获培养基中的全能核酸酶。然后用生物反应器冲洗缓冲液冲洗生物反应器。对于生物反应器冲洗,将64升生物反应器冲洗缓冲液添加至生物反应器并混合15分钟。然后将冲洗液转移至共同的收获收集袋。一旦已将冲洗液添加至收集袋,将内容物混合15分钟并获取批量收获样品。
将经混合的批量收获物通过深层过滤器过滤至收集袋中。一旦已过滤所有的批量收获物,就用50升TFF1渗滤缓冲液驱逐深层过滤器。将深层过滤器汇集物混合并取样。然后将深层过滤器汇集物通过0.45μm过滤器过滤,以进一步澄清化批量收获物料。然后用6升TFF1缓冲液驱逐0.45μm过滤器。
对于TFF1步骤,将5.0m
表63.上游工艺中使用的缓冲液
实例21:下游制造工艺
使用下游工艺将中间物处理成经过滤的药物物质。下游工艺步骤包括酸化和澄清化步骤(使用过滤),之后是阳离子交换色谱、切向流过滤(“TFF2”)、CsCl超速离心和进一步切向流过滤步骤(“TFF3”),以产生经过滤的药物物质,其中将经纯化的AAV颗粒悬浮于药学上可接受的载体中。具体地,下游工艺包括继生产TFF1中间物之后的下列制造步骤:解冻和汇集TFF1中间物,酸化和澄清化,阳离子交换色谱(CEX),切向流过滤(TFF2),用于完全/空衣壳分离的CsCl超速离心,用于浓缩/缓冲液交换的切向流过滤(TFF3),TFF 3汇集物料过滤以产生药物物质,稀释和过滤药物物质以产生药物产品,储存药物产品以及将药物产品填充至小瓶中。
将TFF1中间物料解冻并轻轻混合。使用吐温20促进大部分的宿主细胞蛋白和DNA在酸性pH下的絮凝。降低含有15%吐温20的TFF1中间物汇集物的pH以进行CEX色谱(pH3.5)。通过将溶液通过深层过滤器和0.45μm过滤器过滤而去除在降低pH后形成的沉淀物。
将吐温20(在20mM Tris、1mM MgCl
使用阳离子交换(CEX)捕获色谱步骤将病毒衣壳与蛋白质、DNA和其他过程杂质分离。此步骤利用使用自动化过程色谱系统操作的CIMmultus S03-8000高级复合柱(磺酰基)(2μm孔)色谱柱(8.0L)。缓冲液和溶液描述于下表中:
表64.用于一个CEX循环的缓冲液和溶液
CEX柱加载量由经澄清化、酸化的TFF1中间物的蛋白质含量确定。CEX柱的蛋白质加载量设定为最大柱容量的70%。
在OD280急剧上升时开始手动收集洗脱峰。当电导率在80-85mS/cm之间时,OD280上升。CEX洗脱液(产物)的大约体积为约20升或2.5CV(柱体积)。分两个级分收集CEX洗脱液。第一级分在OD280急剧上升时开始,并收集1.5CV。第二级分紧接在第一级分之后开始,并收集1.0CV。使用pH 9.0中和缓冲液将两个级分中和至pH 8.0±0.30。
TFF2步骤浓缩、去除蛋白质杂质、并且将缓冲液交换为用于CsCl超速离心步骤的适当缓冲液。切向流过滤系统与0.4m
此操作的浓缩阶段减少CEX洗脱液的体积。一旦达到目标渗余物体积,就以不连续的TFF模式(批次模式)开始渗滤。将渗余物稀释2倍并用8个渗滤体积的TFF2 NaCl渗滤缓冲液渗滤,然后以不连续的TFF模式用8个渗滤体积的TFF2 CsCl渗滤缓冲液渗滤。一旦完成CsCl渗滤,就将渗余物浓缩至指定体积,该指定体积取决于系统滞留体积。执行对膜的连续两次冲洗以使来自TFF2系统的产物回收率最大化。
渗余物进料速率设定为5L/m
表65.用于TFF2的缓冲液
超速离心可用于通过利用氯化铯梯度超速离心从完全衣壳中去除空衣壳。将配备有50.2型Ti转子或等效转子的自动化Optima XPN 100超速离心机系统或等效系统用于CsCl超速离心步骤。将经TFF2纯化的过滤物料沿管壁内部缓慢添加在超速离心管中,而不引入气泡至溶液中。将经填充的管用手持式热密封机密封,并且在20℃下以302,000g(在50.2Ti转子中50,000rpm)离心17小时。在离心步骤完成之后,将管从超速离心机中移出并放置于生物安全柜中。将含有产物的管安装在废物容器上方的环架上。将灯放置在管的正下方,并且在管上标记空衣壳区带(区带A是最高区带)、完全衣壳双区带(区带B和C,即双区带的上区带和下区带)和在双区带下方的最低区带(区带D)。通过附接至30mL注射器的18G针移出区带B、C和D,该针恰好在区带D下方插入至管的中间。将经收集的物料转移至无菌1LPETG瓶。将来自所有离心管的物料汇集至无菌1L PETG瓶中,以产生超速离心(UC)汇集物。用于CsCl超速离心步骤的缓冲液列于下表中:
表66.用于CsCl超速离心的缓冲液
TFF3步骤去除CsCl,并使用最终配制缓冲液浓缩完全载体。切向流过滤系统与两个50cm
执行对膜的连续冲洗以从TFF3系统中回收载体。将TFF3缓冲液添加至先前保留TFF3渗余物的初次锥形管中。此物料通过纤维素膜再循环。再循环后,将冲洗液通过0.2μmPall
执行对膜的连续冲洗以使来自TFF3系统的产物回收率最大化。将TFF3缓冲液添加至先前保留TFF3渗余物和初始冲洗物料的初次锥形管中。此物料通过纤维素膜再循环。将二次冲洗液通过0.2μm Pall
表67.用于TFF3的缓冲液
使用灭菌的一次性组件将DS用Pall
用于过滤器冲洗和DS稀释以制备DP的TFF3缓冲液由以下配方食品构成。
表68.药物产品单元操作-缓冲液组成
将DP填充至5mL无菌即用型Crystal Zenith(CZ)小瓶中,并用无菌即用型塞子塞住,并用无菌即用型密封件密封。
实例22:用于脊髓性肌萎缩的单剂量基因替代疗法:剂量研究
脊髓性肌萎缩(SMA)是由编码运动神经元存活蛋白1(SMN1)的基因的丧失或功能障碍引起的严重儿童单基因疾病。此疾病的发病率为10,000例活产婴儿中约1例,具有1/54的携带者频率。SMA的特征在于下运动神经元的退化和缺失,从而导致肌肉萎缩。该疾病根据发病年龄和里程碑成就而分为四种亚型(1至4)。SMA 1型(SMA1)是最严重的形式,并且是婴儿中死亡的最常见遗传原因。有两种SMN形式;SMN1是负责SMN蛋白的功能性产生的主要基因。SMN2在剪接期间优先排除外显子7,且因此与SMN1相比,仅产生一小部分的功能性SMN蛋白。因此,SMN2拷贝数改变疾病表型,并且两个拷贝的SMN2的存在与SMA1相关联。
具有SMN1双等位基因缺失和两个拷贝的SMN2的婴儿具有97%的SMA1风险。
SMA1的自然历史的最新研究(历史性队列)显示,患有该疾病的婴儿中的症状发作的中位年龄是1.2个月(范围0至4个月),并且疾病的特征在于张力过低、从婴儿早期的重度无力以及在无支撑下无法坐着。在具有两个拷贝的SMN2的SMA1婴儿中,死亡或每天需要至少16小时非侵入性通气持续至少连续14天(被认为相当于永久性通气)的中位年龄是10.5个月。在一个受影响儿童的队列中,仅25%在13.6个月时在没有永久性通气支持的情况下而存活,并且8%在没有此支持的情况下而存活20个月。由国家卫生研究院(NationalInstitutes of Health)(NeuroNEXT)资助的涉及具有两个拷贝的SMN2的患者的另一项前瞻性、多中心历史性研究显示8个月的无气管造口术的中位存活期(95%置信区间,6至17)。所有SMA1患者出生后具有急剧下降的呼吸和吞咽功能,并且最终需要机械式营养支持(通过鼻胃管或胃造口术管)以维持足够的营养并降低与吸气相关的呼吸风险。对于症状发作在3月龄大时出现的SMA1患者,大多数患者在12月龄时需要喂养支持。SMA1患者在运动功能方面也未实现重要的里程碑并且具有下降的功能,如在CHOP INTEND(费城儿童医院的婴儿神经肌肉障碍测试(Children’s Hospital of Philadelphia Infant Test ofNeuromuscular Disorders))量表上所测量,该量表的范围为从0至64,其评分越高指示运动功能越好,是一种对微小的运动功能变化(诸如四肢的反重力运动)敏感的工具。在34名SMA1患者的历史性分析中,除了1名以外的所有患者在6月龄后均未达到至少40分的评分。在NeuroNEXT队列中,CHOP INTEND评分从6月龄至12月龄平均下降10.7分。
增加运动神经元中的SMN蛋白水平的治疗性策略集中于增强SMN2的有效性。一种方法是中枢神经系统递送诺西那生钠(Ionis Pharmaceuticals/Biogen),诺西那生钠是为抑制SMN2中的外显子7剪接而开发的一种反义寡核苷酸。此药物已显示出改善重度SMA鼠类模型的无力并且使受影响的小鼠的中位寿命从16天增加至25天。在2016年12月,诺西那生钠经食品药物管理局批准用于治疗SMA。此药物是在生命的前2个月内在四个负荷剂量后通过重复的鞘内注射来施用。
SMA1的可能的替代性治疗是以一次性静脉内施用给出的基因疗法,该基因疗法递送呈自身互补型腺相关病毒血清型9(scAAV9)的SMN拷贝。(此重组病毒的编码区形成分子内双股DNA[或自身互补型]模板。)此方法诱发了在运动神经元和周边组织中的SMN表达,这反击了鼠类模型中的SMA效应,并且在此模型中以低载体剂量(6.7×10
除了跨越血脑屏障和靶向脊髓的所有区域的中枢神经系统神经元以外,鉴于SMN蛋白遍在表达并且SMA1连同许多细胞类型(例如心脏、胰脏和骨骼肌)一起影响多个系统(例如自主神经系统和肠神经系统、心血管系统和胰脏),AAV9介导的基因疗法的全身性施用可能是有利的。与杂合巨细胞病毒增强子-鸡β肌动蛋白启动子组合的载体的自身互补特征使得能够快速且持续表达SMN。在2014年4月,我们发起涉及SMA1婴儿的基因替代疗法的研究,使这些婴儿接受一次性剂量的在鸡β-肌动蛋白启动子的控制下、伴有人运动神经元存活基因(hSMN)的递送的scAAV9(scAAV9.CB.hSMN)(AVXS-101)。
根据施用的基因疗法剂量,将患者入选在两个队列中。使队列1中的患者接受低剂量(6.7×10
将载体在生理盐水(大约10至20ml/公斤)中递送,该生理盐水在大约60分钟期间经静脉内输注。在入选时,一些患者需要通过胃造口管或鼻胃管(其选择是基于父母或主治医师的偏好)进行肠道喂养。一旦入选研究时,所有需要营养支持的患者均经受胃造口管的放置,并且在研究期间不移出管。
在应用CHOP INTEND量表时,评分维持超过40分在SMA中被认为具有临床意义。将无辅助坐着根据下列标准进行评价和分类:根据婴儿和幼儿发育粗大运动子测试(Infantand Toddler Development gross motor subtest)的贝莉量表的第22项,无辅助坐着至少5秒(“无辅助坐着”);根据世界卫生组织(the World Health Organization)(WHO)标准,无辅助坐着至少10秒(“依照WHO标准的无辅助坐着”);以及根据上文提及的贝莉量表的第26项,无辅助坐着至少30秒(“独立功能性坐着”)。通过独立评论者以通过互动视频评价补获的能力-小型(ACTIVE-mini)检查患者的视频记录来证实主要的运动里程碑。从表面电极记录在基线和输注后每6个月的复合肌肉动作电位(CMAP)。通过电阻抗肌动描记术(EIM)定量肌肉的病理状态。
表69. 15名患者的人口统计学和临床特征
表70.队列2的12名患者中的无事件存活期以及运动和其他里程碑事件。
表71:不良事件。
在SMA1患者中单一静脉内输注含有编码SMN的DNA的腺相关病毒载体导致比患有此疾病的历史性队列更长的存活期。所有15名患者均超过先前报告的中位存活年龄,具有两个SMN2拷贝的SMA1患者未持续通气10.5个月。所有的患者也超过20个月的基准,在此时患有此疾病的患者在没有永久性通气的情况下典型地仅8%存活。4在队列2中的12名患者中,除了1位以外的所有患者均实现未曾在历史性队列中报告过的运动功能里程碑。获得的运动功能具有临床意义,如反映为喂养(手伸到嘴巴)、坐着和说话。大多数在入选时不需要支持性照护的患者在最后一次追踪访视时无需营养支持(7名患者中有6名)和通气支持(10名患者中有7名)。在两个队列中,患者的CHOP INTEND量表评分自基线起增加。在队列2中的第一个月内,平均增加为9.8分,与在NeuroNEXT研究中的历史性队列中在6与12月龄之间超过10分的平均值下降形成对比。
SMNΔ7小鼠模型中的SMN基因替代疗法的临床前研究显示大概在运动神经元仍然完整的时候,通过早期治疗在存活期及运动功能方面的改善。在我们研究中的早期治疗的临床发现反映出那些在临床前研究中的趋势。在早期治疗之后,两名患者能够在无支撑下爬行、站立和行走。该两名患者具有SMA家族史,这可能归因于早期诊断。尽管在我们研究的两个队列中的所有患者持续具有改善的运动功能,但是临床前和临床数据表明针对SMA的早期治疗和新生儿筛检的益处。
由AAV基因替代疗法造成的严重不良事件仅限于两名患者中在治疗后大约3周升高的转氨酶水平而无其他的肝酶异常;另外两名患者具有未达到严重不良事件定义的截止值(即>10倍的正常范围)的升高。肝酶的升高通过泼尼松龙治疗而减低。一名患者由于抗AAV9抗体的存在而未通过筛选,这与群体研究一致,这些群体研究显示在儿童和年青人中具有低比率的抗AAV9血清阳性并且在40岁以上的人群中具有渐增比率的抗AAV9血清阳性。然而,针对病毒的抗体的存在可能是AAV基因替代疗法的限制因素。
此研究使用单组设计,以历史性队列作为对照组,当疾病的自然历史得到充分表征并且是致命的时,该对照是有限数量的选项之一。为了入选与已发表的历史性研究相似的同型样本,我们限制入选仅包括具有双等位基因SMN1突变和两个SMN2拷贝的有症状SMA1患者,并且不入选在SMN2的外显子7中具有c.859G→C疾病修饰物的患者,因为此基因修饰物预测较轻度的疾病表型。然而,此基因替代疗法不必限于有症状患者、或具有特定基因组亚型的患者。
总之,在SMA1患者中一次性静脉内输注高剂量的含有编码SMN的DNA的腺相关病毒载体导致存活期延长、运动功能改善以及CHOP INTEND量表评分增加至先前未曾在此疾病中观察到的水平。此类改善导致需要支持性照护的患者百分比低于历史性研究中的那些。在长达2年的追踪中,没有运动功能效应衰退或临床消退的报告。若干名患者具有转氨酶水平的短暂且无症状升高。需要进一步的研究以评估基因替代疗法在SMA1患者中的长期安全性和耐久性。
实例23:scAAV9.CB.hSMN的药代动力学
常规的临床药代动力学研究不适用于基因替代疗法产品。然而,评估通过体液和废物自身体排除的载体量的scAAV9.CB.hSMN载体脱落研究是可代替常规的药代动力学研究而用于基因替代疗法的一种措施。
在临床研究期间的多个时间点研究在用scAAV9.CB.hSMN输注后的载体脱落。每周收集唾液、尿液和粪便样品至第30天,并且接着每月收集至第12个月切之后每3个月收集一次。使用来自5名患者的样品来经过第18个月访视通过液滴数字聚合酶链反应进行scAAV9.CB.hSMN载体脱落分析。分析scAAV9.CB.hSMN载体脱落的所有5名患者均以1.1×10
在输注后第1天在尿液和唾液中的scAAV9.CB.hSMN浓度为体内初始浓度的0.1%至0.01%,之后浓度下降至低于定量限度。在粪便中,在输注后第1天可检测出为体内初始浓度的10%至30%的水平。一名患者在输注后第14天在粪便中显示出峰浓度,该峰浓度为体内初始浓度的280%。相比之下,3名可取得数据的患者在输注后第14天显示出为体内初始浓度的<1%的浓度,在输注后经30天浓度下降大约4log(10,000倍)。总的来说,scAAV9.CB.hSMN主要在粪便中自体内清除,并且在输注后第60天在粪便中低于定量限度。
实例24:非临床毒理学测试
动物药理学:在有病的Δ7SMA小鼠模型(SMNΔ7小鼠)中输注scAAV9.CB.hSMN载体后,与未经治疗的SMNΔ7小鼠相比,体重增加,扶正行为改善,存活期以剂量依赖方式显著延长并且SMA相关心脏缺陷恢复至正常。
动物毒理学:在小鼠中静脉内输注后,载体和转基因广泛地分布,通常最高的表达在心脏和肝脏中观察到,并且显著的表达在脑和脊髓中。在顺从关键的良好实验室规范(Good Laboratory Practice)(GLP)的3个月小鼠毒物学研究中,毒性的主要靶器官是心脏和肝脏。scAAV9.CB.hSMN载体相关发现在心室中由剂量相关性炎症、浮肿和纤维化构成,并且在心房中由炎症和血栓构成。肝脏发现包括肝细胞肥大、枯氏(Kupffer)细胞激活和分散型肝细胞坏死。在小鼠中未鉴定出scAAV9.CB.hSMN载体相关心脏和肝脏发现的无不良影响水平(NoAEL),并且最大耐受剂量定义为1.5×10
实例25:儿科患者中的脊髓性肌萎缩
此试验是评价scAAV9.CB.hSMN载体在经基因测试而证实双等位基因SMN1缺失、2个拷贝的运动神经元存活基因2(SMN2)、对外显子7中的c.859G>C修饰呈阴性结果并在6月龄前具有临床症状发作的SMA 1型患者中的安全性和功效的1期研究。将scAAV9.CB.hSMN载体在单剂量输注期间静脉内递送在0.9至7.9月龄的患者中。对两个队列如下给药:使队列1(n=3)接受本研究中使用的低剂量,并且使队列2(n=12)接受本研究中使用的高剂量(治疗剂量:1.1x10
存活期和至事件的时间分析支持scAAV9.CB.hSMN载体的功效。在队列2中,所有12名患者(100%)均超过24月龄且无事件,而自然历史研究中只有8%的患者。这表明与未经治疗的患者相比,输注scAAV9.CB.hSMN载体的患者的总存活期显著且具有临床意义地增加。输注后2年,没有患者死亡的报告。
检查发育运动里程碑;对所有15名患者的评估进行了视频记录,以允许证实发育运动里程碑的成就。队列2中的患者一致地实现并维持关键的发育运动里程碑。在给药后追踪24个月时,11名患者(91.7%)能够保持其头部直立≥3秒且在无支撑下坐着≥5秒,10名患者(83.3%)能够在无支撑下坐着≥10秒,9名患者(75.0%)能够在无支撑下坐着≥30秒,并且2名患者(16.7%)各自能够独自站立、在辅助下行走和独自行走。目前入选本研究的持续观察的长期追踪中的队列2患者维持其发育运动里程碑,其中有一些实现额外的运动里程碑。
表72.基于给药后追踪24个月的独立中心评论,发育出显著的运动功能里程碑的患者(全分析集)
在基线时未使用非侵入性通气(NIV)的队列2的中10名患者中,7名在追踪24个月时没有每日使用NIV。几乎所有患者均经历过常见的儿童呼吸道疾病,在SMA 1型儿童中,这些呼吸道疾病典型地导致气管造口术或死亡。所有的患者在没有气管造口术或需要永久性通气的情况下在呼吸性入院中存活。
还观察了营养增益。在队列2中,七名患者在基因替代疗法之前未接受肠道喂养。这7名患者之一(1)名在因脊柱侧凸手术难以恢复后具有营养支持以辅助伤口愈合,但也经口喂养。在基因替代疗法之前接受肠道喂养的队列2中5名患者中的四(4)名能够在研究结束时经口喂养;因此,在队列2中的12名患者中共有11名能够经口喂养,排除第6名。
接受治疗剂量的患者在第1个月和第3个月实现统计学上显著的运动功能改善;费城儿童医院神经肌肉障碍婴儿测试(CHOP INTEND)平均值分别自基线起增加9.8分(n=12,P<0.001)和15.4分(n=12,P<0.001)。
在输注scAAV9.CB.hSMN载体的患者中,随着时间持续改善运动功能。十二名队列2患者中有十一名(91.7%)患者在24个月时实现达成≥50 CHOP-INTEND评分。早期干预和剂量似乎对反应有积极影响。在一般的临床实践中,未经治疗的6月龄或更大的SMA 1型儿童在CHOP INTEND上未超过40分。此外,在作为前瞻性自然历史的一部分跟踪的未经治疗的婴儿之中,据报告在6与12月龄之间平均下降10.7分。
实例26:使用qPCR对AAV9病毒载体中残留宿主细胞DNA的测量
方法
此方法用于通过qPCR定量AAV药物物质(例如AVXS-101)和过程中样品中的残留hcDNA。每个板测试至多六个样品。使用TaqMan探针进行qPCR测定。TaqMan探针具有与5'端结合的荧光报告染料和与3'末端结合的非荧光淬灭剂。在探针完整时,淬灭剂与报吿染料的接近大大地降低由报吿染料发射的荧光。对探针的切割分离报吿染料和淬灭剂,从而增加报告荧光。
将经设计以结合人基因组内的重复序列的侧接正向和反向引物添加至反应混合物,并且退火至样品和标准品中存在的靶序列。TaqMan荧光探针在引物位点之间退火。模板变性、引物退火和产物延伸的连续循环扩增了靶序列。在扩增循环的延伸步骤期间,TaqDNA聚合酶的核酸外切酶活性从探针释放报告染料,使染料脱离淬灭剂,从而导致荧光发射与模板量成比例。
通过qPCR仪器测量96孔板的每个孔的荧光。通过额外的PCR循环,增加靶序列的量,并且结果是使更多的报吿染料从探针释放并且在每个连续的PCR循环中释放更高的荧光。测量荧光信号达到预定阈值所需的扩增循环次数。此循环称为阈值周期或CT值。样品或标准品孔中DNA的起始浓度越大,达到阈值荧光水平所需的PCR循环次数越少,并且CT值越低。通过绘制log
首先使用Wako DNA提取试剂盒(Wako,295-50201)制备样品。简而言之,将用于测试的样品充分混合并稀释1000倍。将经稀释的样品分至四个管(各自500μL)中,并且将50μL水添加至两个管(未掺加的平行测定),同时将50μL 30,000pg/mL DNA标准品添加至其他两个管(掺加的对照)。通过以下方式进行蛋白质溶解:向每个管中添加20μL N-月桂酰肌氨酸钠溶液、涡旋5秒,然后短暂离心。将含有糖原和Pellet Paint(Novagen,70748)的NaI溶液制备为使得它们的比率为2000:5:4的NaI:糖原:Pellet Paint。将500μL NaI混合物添加至每个管,并在53℃±1℃下孵育15分钟。将管从加热中移出,与900μL异丙醇混合,并在室温下孵育15分钟。然后将管在18℃下以10,000g离心15分钟,并倾析上清液。将剩余的沉淀物用800μL洗涤溶液A洗涤、旋转并再沉淀两次。最后,将沉淀物用1500μL含有糖原的冷却异丙醇洗涤溶液洗涤、旋转并再沉淀。将最终的沉淀物重悬于500μL无核酸酶的水中。
使用resDNA SEQ人定量试剂盒(Applied Biosystems,A26366)进行qPCR。通过以下方式制备反应混合物:如试剂盒中说明的,将2x环境主混合物、10x人DNA测定混合物和阴性对照组合。将20μL反应混合物与10μL制备的样品混合,并添加至PCR板上的每个孔。每个样品以一式三份铺板。用光学粘合剂膜密封板。在热循环期间,首先在95℃下进行熔融10min,且然后将样品在95℃持续15秒与60℃持续1min之间循环40次。
通过绘制CT值对以log计的DNA量([pg/mL])来产生标准曲线。将数据拟合至由以下方程式给出的直线:
CT值=m xlog10(x)+b
其中x=标准品浓度(以pg/mL计),m是斜率并且b是y-截距。使用以上方程式,根据孔的CT值反算宿主细胞DNA的浓度,然后将该浓度通过稀释因子进行校正。
通过qPCR测量的残留宿主细胞DNA对于先前批次载体是3.7x10
实例27:通过ELISA对AAV9病毒载体中残留宿主细胞蛋白(HCP)的测量
方法
使用商业酶联免疫吸附测定(ELISA)试剂盒测量了AVXS-101样品中的宿主细胞蛋白(HCP)浓度。天鹅科技人类胚肾293HCP ELISA试剂盒是固相双位点酶免疫测定。它是基于直接夹心技术,在该技术中,两种多克隆抗体是针对HCP的不同抗原决定簇的。在孵育期间,样品中的HCP与结合微孔板的抗HCP抗体并且与溶液中过氧化物酶缀合的抗HCP抗体结合。
孵育期之后,洗涤孔以去除任何未结合的酶缀合抗体。然后将3,3’,5,5’-四甲基联苯胺(TMB)底物溶液添加至孔。结合的过氧化物酶缀合物催化底物中的变色反应。通过添加酸来终止反应,这给出了比色终点,该比色终点可以在450nm处以分光光度法读取。经水解的底物的量与存在的HCP浓度成正比。
将待测试的样品稀释以满足该方法的从4ng/mL至200ng/mL的范围。然后将每个样品在SDB中稀释2倍(110μL样品和110μL SDB)并混合。还制备掺加的对照以检查一致性。在掺加的对照中,将110μL的每个样品与27.5μL 200ng/mL HCP标准品和82.5μL SDB混合。最后,将50μL的每个标准品、对照或测试样品添加至96孔板上的孔,并与100μL抗HEK 293-HRP缀合物混合。所有条件均以一式三份铺板。用密封带密封板,并在室温下以400-600rpm摇动2小时。孵育后,通过轻弹倒置的板并用吸收巾吸干以去除孔中的溶液。用洗涤瓶洗涤孔,迅速吸干并轻拍,而不使洗涤溶液浸泡在孔中。重复洗涤4次,并在最后一次洗涤后使其倒置约20秒以排干。最后,将100μL TMB底物添加至板的每个孔,并在室温下不搅拌孵育20-30min。通过向每个孔中添加100μL终止溶液来终止反应。在添加终止溶液的45min内将板加载至板读取器上,并且在450nm和650nm下读取板。
将标准品的平均吸光度相对于标准品的理论HCP浓度以半对数图绘制,以产生基于以下方程式的四参数对数(4PL)拟合曲线:
Y=[(A-D)/(1+(X/C)^B)]+D
其中A是底部渐近线,B是希尔斜率,C是对应于两个渐近线之间的中点吸光度值的浓度(ng/mL),D是顶部渐近线,X是样品浓度(ng/mL)并且Y是吸光度。然后使用标准曲线利用SoftMaxPro软件确定掺加的样品对照和未掺加的测试样品中的HCP浓度。仅在标准曲线的r
HCP浓度
对于先前批次载体AVXS-101批次600156、AVXS1-101批次600307和AVXS-201DS,通过ELISA测量的残留宿主细胞蛋白低于定量限度(8ng/mL)。
实例28:通过ELISA对AAV9病毒载体中残留全能核酸酶的测量方法
使用商业酶联免疫吸附测定(ELISA)试剂盒测量AAV产品(例如AVXS-101)中的残留全能核酸酶浓度。默克全能核酸酶核酸内切酶ELISA试剂盒II(Merck BenzonaseEndonuclease ELISA Kit II)是固相双位点酶免疫测定。它是基于直接夹心技术,在该技术中,两种多克隆抗体是针对全能核酸酶的不同抗原决定簇的。在孵育期间,样品中的全能核酸酶与结合微孔板的抗全能核酸酶抗体并且与溶液中过氧化物酶缀合的抗全能核酸酶抗体结合。
孵育期之后,洗涤孔以去除任何未结合的酶缀合抗体。然后将3,3’,5,5’-四甲基联苯胺(TMB)底物溶液添加至孔。结合的过氧化物酶缀合物催化底物中的变色反应。通过添加酸来终止反应,这给出了比色终点,该比色终点可以在450nm处以分光光度法读取。经水解的底物量与存在的全能核酸酶浓度成正比。
简而言之,通过将175μL样品与175μL PBST组合来将样品稀释2倍。平行地,还通过以下方式制备了掺加全能核酸酶的样品对照:将175μL样品与35μL 10ng/mL全能核酸酶标准品和140μL PBST组合。将来自试剂盒的预涂ELISA条带安装在条带支架上,并且每个孔加载100μL的每种测试混合物。对于空白,加载100μL PBST代替样品。每种条件以一式三份加载。将板密封并在室温下在板振荡器(450rpm)上搅拌孵育2小时±5分钟。孵育后,丢弃内容物,并将板使用免疫洗涤器通过添加约350μL PBST洗涤并孵育1分钟,然后倒置并轻拍在吸收巾上。在将100μL稀释的HRP缀合抗体添加至每个孔之前,总共进行3次洗涤。将板密封并在室温下在板振荡器(450rpm)上搅拌孵育1小时±5分钟。孵育后,丢弃内容物,并将板使用免疫洗涤器通过添加约350μL PBST洗涤并孵育1分钟,然后倒置并轻拍在吸收巾上。在将100μL TMB底物添加至每个孔之前,总共进行3次洗涤。将板密封并将内容物在室温下在黑暗中不搅拌孵育15-40分钟。通过向每个孔中添加100μL 0.2N H
将标准品的平均吸光度相对于标准品的理论全能核酸酶浓度以半对数图绘制,以产生基于以下方程式的四参数对数(4PL)拟合曲线:
Y=[(A-D)/(1+(X/C)^B)]+D
其中A是底部渐近线,B是希尔斜率,C是对应于两个渐近线之间的中点吸光度值的浓度(ng/mL),D是顶部渐近线,X是样品浓度(ng/mL)并且Y是吸光度。然后使用标准曲线利用SoftMaxPro软件确定掺加的样品对照和未掺加的测试样品中的HCP浓度。仅在标准曲线的r
全能核酸酶浓度
对于先前批次载体AVXS-101批次600156和AVXS1-101批次600307,通过ELISA测量的残留全能核酸酶低于定量限度(0.2ng/mL)。
实例29:通过Micro BCA测定对AAV9病毒载体中蛋白质浓度的测量
方法
使用2mg/mL牛血清白蛋白(赛默飞世尔科技公司(Thermo Fisher Scientific),23209)参考蛋白质标准品和Micro BCA蛋白测定试剂盒(赛默飞世尔科技公司,23235),通过micro BCA板测定来测量例如AVXS-101的过程中样品、药物物质样品和药物产品样品中的蛋白质含量。测定是基于用于总蛋白质的比色检测和定量的去污剂相容性二喹啉甲酸(BCA)配制品。BCA检测Cu
简而言之,通过以下方式来制备标准品:将2mg/mL BSA在稀释剂中进行系列稀释(以配制缓冲液(200mM NaCl、20mM Tris、1mM MgCl2、0.001%w/v普朗尼克F-68、pH 8.0)进行20倍稀释)。也将AVXS-101的测试样品在水中稀释20倍并且在稀释剂中制得系列稀释液。目标浓度是约7.5μg/mL。通过将来自试剂盒的25份Micro BCA试剂A、24份试剂B和1份试剂C混合来制备工作试剂(WR)。将150μL的每个标准品和测试样品以一式三份加载至96孔板中,并与150μL WR混合。将板密封并在板振荡器上以300rpm振荡30秒。然后将板在37℃±2℃下不振荡孵育2小时。孵育后,将板以1000rpm离心2分钟以收集冷凝物,并且孵育后将板冷却15-60min。在板读取器中在562nm处读取板,并使用SoftMax Pro分析数据。
将标准品的平均吸光度对标准品的理论蛋白质浓度以半对数图绘制,并产生二次拟合。二次拟合是基于以下方程式:
Y=A+Bx+Cx
其中A、B、C是曲线拟合参数,x是以μg/mL计的样品浓度,并且Y是以OD计的吸光度。仅在标准曲线的r
通过Micro BCA测量的总蛋白质浓度对于先前批次载体是每1.0x10
实例30:AVXS-101(AAV9-SMN1)的纯度和释放规格
测试来自实例1至4的AVXS-101药物物质和AVXS-101药物产品的纯度。表78和79示出了这些产品的规格和释放标准。
表73.AVXS-101药物物质的释放规格
表74.AVXS-101药物产品的释放规格
参考附图描述了本发明的实施例,应理解,本发明不限于这些确切的实施例,并且本领域技术人员可在不脱离如在所附权利要求中定义的本发明的范围或精神的情况下在其中实现各种变化和修改。
- 用于测量药物产品效力的基于细胞的测定
- 基于细胞的去纤维蛋白多核苷酸效力测定方法
