包含基于PD-1的嵌合蛋白的组合疗法
文献发布时间:2023-06-19 11:05:16
优先权
本申请要求2018年8月29日提交的美国临时申请号62/724,600;2018年9月21日提交的美国临时申请号62/734,951;2019年1月16日提交的美国临时申请号62/793,235;2019年4月11日提交的美国临时申请号62/832,830;2019年8月22日提交的美国临时申请号62/890,217的权益和优先权;所述临时申请各自的内容以引用的方式整体并入本文。
技术领域
本发明尤其涉及包含嵌合蛋白的组合物的组合,所述组合物的组合可用于治疗疾病的方法如用于癌症和自身免疫的免疫疗法中。
以电子方式提交的文本文件的说明
本申请含有序列表。它已经由EFS-Web以名称为“SHK-022PC_SequenceListing_ST25”的ASCII文本文件形式通过电子方式提交。序列表的大小是50,896字节,并且创建于2019年8月28日。所述序列表特此以引用的方式整体并入。
背景技术
免疫系统对于人体对癌细胞和引起疾病的异物的响应至关重要。然而,许多癌症已经发展了通过例如传递或传播免疫抑制性信号来避免免疫系统的机制。另外,许多抗癌治疗剂不直接刺激和/或激活免疫响应。目前使用双特异性抗体、连接的scFv或T细胞衔接器的组合免疫疗法不能阻断检查点(免疫抑制性信号),也不能激动(刺激)TNF受体。这可能是因为这些分子在工程化以通过单价抗原结合臂结合多个靶标时失去靶标亲合力。因此,仍然需要开发至少具有多种功能但仍保留靶标亲合力-例如,反向免疫抑制性信号和刺激抗癌免疫响应的治疗剂。
发明内容
因此,在各个方面,本发明提供了可用于癌症免疫疗法的组合物和方法。例如,本发明部分地涉及用于治疗癌症的方法,所述方法包括(同时或顺序地)施用至少一种针对免疫检查点分子的抗体;干扰素基因刺激因子(STING)激动剂;和/或一种或多种异源嵌合蛋白,其中每种异源嵌合蛋白能够阻断免疫抑制性信号和/或刺激免疫激活信号。
本发明的一个方面提供了用于治疗有需要的受试者的癌症的方法。所述第一药物组合物包含能够结合细胞毒性T淋巴细胞相关抗原4(CTLA-4)的抗体。所述第二药物组合物包含免疫疗法,所述免疫疗法选自:(i)异源嵌合蛋白,所述异源嵌合蛋白包含:(a)第一结构域,所述第一结构域包含PD-1的细胞外结构域的一部分,其中所述部分能够结合PD-1配体,(b)第二结构域,所述第二结构域包含GITRL的细胞外结构域的一部分,其中所述部分能够结合GITRL受体,和(c)接头,所述接头连接所述第一结构域和所述第二结构域;(ii)异源嵌合蛋白,所述异源嵌合蛋白包含:(a)第一结构域,所述第一结构域包含PD-1的细胞外结构域的一部分,其中所述部分能够结合PD-1配体,(b)第二结构域,所述第二结构域包含4-1BBL的细胞外结构域的一部分,其中所述部分能够结合4-1BBL受体,和(c)接头,所述接头连接所述第一结构域和所述第二结构域;以及(iii)异源嵌合蛋白,所述异源嵌合蛋白包含:(a)第一结构域,所述第一结构域包含PD-1的细胞外结构域的一部分,其中所述部分能够结合PD-1配体,(b)第二结构域,所述第二结构域包含CD40L的细胞外结构域的一部分,其中所述部分能够结合CD40L受体,和(c)接头,所述接头连接所述第一结构域和所述第二结构域。
本发明的另一方面提供了用于治疗受试者的癌症的方法。所述方法包括向所述受试者提供包含免疫疗法的药物组合物的步骤。所述免疫疗法选自:(i)异源嵌合蛋白,所述异源嵌合蛋白包含:(a)第一结构域,所述第一结构域包含PD-1的细胞外结构域的一部分,其中所述部分能够结合PD-1配体,(b)第二结构域,所述第二结构域包含GITRL的细胞外结构域的一部分,其中所述部分能够结合GITRL受体,和(c)接头,所述接头连接所述第一结构域和所述第二结构域;(ii)异源嵌合蛋白,所述异源嵌合蛋白包含:(a)第一结构域,所述第一结构域包含PD-1的细胞外结构域的一部分,其中所述部分能够结合PD-1配体,(b)第二结构域,所述第二结构域包含4-1BBL的细胞外结构域的一部分,其中所述部分能够结合4-1BBL受体,和(c)接头,所述接头连接所述第一结构域和所述第二结构域;以及(iii)异源嵌合蛋白,所述异源嵌合蛋白包含:(a)第一结构域,所述第一结构域包含PD-1的细胞外结构域的一部分,其中所述部分能够结合PD-1配体,(b)第二结构域,所述第二结构域包含CD40L的细胞外结构域的一部分,其中所述部分能够结合CD40L受体,和(c)接头,所述接头连接所述第一结构域和所述第二结构域。在此方面,所述受试者已经进行或正在进行用能够结合细胞毒性T淋巴细胞相关抗原4(CTLA-4)的抗体治疗。
本发明的另一方面是用于治疗受试者的癌症的方法。所述方法包括向所述受试者提供药物组合物的步骤,所述药物组合物包含能够结合细胞毒性T淋巴细胞相关抗原4(CTLA-4)的抗体。在此方面,所述受试者已经进行或正在进行用免疫疗法治疗,所述免疫疗法选自:(i)异源嵌合蛋白,所述异源嵌合蛋白包含:(a)第一结构域,所述第一结构域包含PD-1的细胞外结构域的一部分,其中所述部分能够结合PD-1配体,(b)第二结构域,所述第二结构域包含GITRL的细胞外结构域的一部分,其中所述部分能够结合GITRL受体,和(c)接头,所述接头连接所述第一结构域和所述第二结构域;(ii)异源嵌合蛋白,所述异源嵌合蛋白包含:(a)第一结构域,所述第一结构域包含PD-1的细胞外结构域的一部分,其中所述部分能够结合PD-1配体,(b)第二结构域,所述第二结构域包含4-1BBL的细胞外结构域的一部分,其中所述部分能够结合4-1BBL受体,和(c)接头,所述接头连接所述第一结构域和所述第二结构域;以及(iii)异源嵌合蛋白,所述异源嵌合蛋白包含:(a)第一结构域,所述第一结构域包含PD-1的细胞外结构域的一部分,其中所述部分能够结合PD-1配体,(b)第二结构域,所述第二结构域包含CD40L的细胞外结构域的一部分,其中所述部分能够结合CD40L受体,和(c)接头,所述接头连接所述第一结构域和所述第二结构域。
在一方面,本发明提供了用于治疗有需要的受试者的癌症的方法。所述方法包括向所述受试者提供第一药物组合物和第二药物组合物的步骤。所述第一药物组合物包含干扰素基因刺激因子(STING)激动剂。所述第二药物组合物包含免疫疗法,所述免疫疗法选自:(i)异源嵌合蛋白,所述异源嵌合蛋白包含:(a)第一结构域,所述第一结构域包含PD-1的细胞外结构域的一部分,其中所述部分能够结合PD-1配体,(b)第二结构域,所述第二结构域包含GITRL的细胞外结构域的一部分,其中所述部分能够结合GITRL受体,和(c)接头,所述接头连接所述第一结构域和所述第二结构域;(ii)异源嵌合蛋白,所述异源嵌合蛋白包含:(a)第一结构域,所述第一结构域包含PD-1的细胞外结构域的一部分,其中所述部分能够结合PD-1配体,(b)第二结构域,所述第二结构域包含4-1BBL的细胞外结构域的一部分,其中所述部分能够结合4-1BBL受体,和(c)接头,所述接头连接所述第一结构域和所述第二结构域;以及(iii)异源嵌合蛋白,所述异源嵌合蛋白包含:(a)第一结构域,所述第一结构域包含PD-1的细胞外结构域的一部分,其中所述部分能够结合PD-1配体,(b)第二结构域,所述第二结构域包含CD40L的细胞外结构域的一部分,其中所述部分能够结合CD40L受体,和(c)接头,所述接头连接所述第一结构域和所述第二结构域。
在另一方面,本发明提供了用于治疗受试者的癌症的方法。所述方法包括向所述受试者提供包含免疫疗法的药物组合物的步骤。所述免疫疗法选自:(i)异源嵌合蛋白,所述异源嵌合蛋白包含:(a)第一结构域,所述第一结构域包含PD-1的细胞外结构域的一部分,其中所述部分能够结合PD-1配体,(b)第二结构域,所述第二结构域包含GITRL的细胞外结构域的一部分,其中所述部分能够结合GITRL受体,和(c)接头,所述接头连接所述第一结构域和所述第二结构域;(ii)异源嵌合蛋白,所述异源嵌合蛋白包含:(a)第一结构域,所述第一结构域包含PD-1的细胞外结构域的一部分,其中所述部分能够结合PD-1配体,(b)第二结构域,所述第二结构域包含4-1BBL的细胞外结构域的一部分,其中所述部分能够结合4-1BBL受体,和(c)接头,所述接头连接所述第一结构域和所述第二结构域;以及(iii)异源嵌合蛋白,所述异源嵌合蛋白包含:(a)第一结构域,所述第一结构域包含PD-1的细胞外结构域的一部分,其中所述部分能够结合PD-1配体,(b)第二结构域,所述第二结构域包含CD40L的细胞外结构域的一部分,其中所述部分能够结合CD40L受体,和(c)接头,所述接头连接所述第一结构域和所述第二结构域。在此方面,所述受试者已经进行或正在进行用干扰素基因刺激因子(STING)激动剂治疗。
在另一方面,本发明提供了用于治疗受试者的癌症的方法。所述方法包括向所述受试者提供包含干扰素基因刺激因子(STING)激动剂的药物组合物的步骤。在此方面,所述受试者已经进行或正在进行用免疫疗法治疗,所述免疫疗法选自:(i)异源嵌合蛋白,所述异源嵌合蛋白包含:(a)第一结构域,所述第一结构域包含PD-1的细胞外结构域的一部分,其中所述部分能够结合PD-1配体,(b)第二结构域,所述第二结构域包含GITRL的细胞外结构域的一部分,其中所述部分能够结合GITRL受体,和(c)接头,所述接头连接所述第一结构域和所述第二结构域;(ii)异源嵌合蛋白,所述异源嵌合蛋白包含:(a)第一结构域,所述第一结构域包含PD-1的细胞外结构域的一部分,其中所述部分能够结合PD-1配体,(b)第二结构域,所述第二结构域包含4-1BBL的细胞外结构域的一部分,其中所述部分能够结合4-1BBL受体,和(c)接头,所述接头连接所述第一结构域和所述第二结构域;以及(iii)异源嵌合蛋白,所述异源嵌合蛋白包含:(a)第一结构域,所述第一结构域包含PD-1的细胞外结构域的一部分,其中所述部分能够结合PD-1配体,(b)第二结构域,所述第二结构域包含CD40L的细胞外结构域的一部分,其中所述部分能够结合CD40L受体,和(c)接头,所述接头连接所述第一结构域和所述第二结构域。
本文公开的任何方面或实施方案可与本文公开的任何其他方面或实施方案组合。
附图说明
图1A至图1D示出I型跨膜蛋白(图1A和图1B,左侧蛋白)和II型跨膜蛋白(图1A和图1B,右侧蛋白)的示意图。可对I型跨膜蛋白和II型跨膜蛋白进行工程化,以使得它们的跨膜结构域和细胞内结构域被省略,并且所述跨膜蛋白的细胞外结构域使用接头序列邻接在一起,以生成单一嵌合蛋白。如图1C和图1D所示,将I型跨膜蛋白(例如PD-1)的细胞外结构域与II型跨膜蛋白(例如CD40L、GITRL和4-1BBL)的细胞外结构域组合成单一嵌合蛋白。图1C描绘通过省略每种蛋白的跨膜结构域和细胞内结构域I型跨膜蛋白和II型跨膜蛋白的连接,以及其中来自每种蛋白的释放的细胞外结构域已通过接头序列邻接。此描绘中的细胞外结构域可包括I型蛋白(例如PD-1)和/或II型蛋白(例如CD40L、GITRL和4-1BBL)的完整氨基酸序列(其通常位于细胞膜外部),或其保留与预期受体或配体结合的任何部分。此外,用于本发明的方法中的异源嵌合蛋白在结构域之间包含足够的总体柔性和/或物理距离,以使得第一细胞外结构域(在图1C和图1D)中的异源嵌合蛋白的左端示出)在空间上能够结合其受体/配体和/或第二细胞外结构域(在图1C和图1D中的异源嵌合蛋白的右端示出)在空间上能够结合其受体/配体。图1D描绘线性嵌合蛋白中的邻接细胞外结构域,其中异源嵌合蛋白的每个细胞外结构域都面向“向外”。
图2示出与本发明相关的免疫抑制性和免疫刺激信号传导(来自Mahoney,NatureReviews Drug Discovery2015:14;561-585)。
图3A是示出用于图3B至图3D和图4A至图4B中公开的体内实验的抗肿瘤治疗方案的表。图3B示出对照治疗的体内肿瘤体积尺寸减小,并且图3C和图3D示出由根据本发明的癌症治疗方法产生的体内肿瘤体积尺寸减小。对于图3B,在18天时间点,曲线从上至下是:媒介物,抗PD1(RMP1-14)抗体,抗OX40(OX86)抗体,抗CTLA4(9D9)抗体和PD1-Fc-GITRL嵌合蛋白。对于图3C,在18天时间点,曲线从上至下是:媒介物,抗CTLA4抗体、然后PD1抗体,抗CTLA4抗体、然后抗OX40抗体和抗CTLA4、然后PD1-Fc-GITRL嵌合蛋白。对于图3D,顶部曲线是媒介物,并且底部曲线是PD1-Fc-GITRL嵌合蛋白、然后抗CTLA4抗体。
图4A至图4C显示当与抗CTLA-4抗体组合施用时,PD-1-Fc-GITRL嵌合蛋白的体内抗肿瘤活性。对于图4B,在30天时间点,曲线从上至下是:PD1-Fc-GITRL嵌合蛋白和抗CTLA4抗体;PD1-Fc-GITRL嵌合蛋白;和抗CTLA4抗体。在15天时间点之前,媒介物小鼠全部死亡。
图5A至图5C显示当与抗CTLA-4抗体组合施用时,PD-1-Fc-CD40L嵌合蛋白的体内抗肿瘤活性。对于图5A,在5天时间点,曲线从上至下是:PD1-Fc融合蛋白,媒介物,PD1-Fc融合蛋白与CD40L-Fc融合蛋白,抗CTLA4抗体,CD40L-Fc融合蛋白,PD1-Fc-CD40L嵌合蛋白,以及PD1-Fc-CD40L嵌合蛋白与抗CTLA4抗体。对于图5B,在大约10天时间点,曲线从上至下是:PD1-Fc-CD40L嵌合蛋白治疗与PD1-Fc-CD40L嵌合蛋白和抗CTLA4抗体共同治疗重叠,抗CTLA4抗体;PD1-Fc融合蛋白与CD40L-Fc融合蛋白。在大约10天时间点之前,CD40L-Fc融合蛋白小鼠全部死亡。在8天时间点之前,媒介物和PD1-Fc融合蛋白小鼠全部死亡。
图6A至图6C显示当与抗CTLA-4抗体组合施用时,PD-1-Fc-4-1BBL嵌合蛋白的体内抗肿瘤活性。对于图6B,在20天时间点,曲线从上至下是:PD1-Fc-4-1BBL嵌合蛋白与抗CTLA4抗体,PD1-Fc-4-1BBL嵌合蛋白,和抗CTLA4抗体。在15天时间点之前,媒介物小鼠全部死亡。图6D包括展示相对于单一疗法,从组合治疗获得的改善的数据。
图7A示出对照治疗的体内肿瘤体积尺寸减小,并且图7B示出由根据本发明的癌症治疗方法产生的体内肿瘤体积尺寸减小。对于图7A,在大约20天时间点,曲线从上至下是:媒介物(IP),媒介物(IT),抗PD1(RMP1-14)抗体,PD-1-Fc-GITRL嵌合蛋白,DMXAA,和抗OX40(OX86)抗体。对于图7B,在大约20天时间点,曲线从上至下是:媒介物(IP),媒介物(IT),DMXAA、然后抗PD1抗体,DMXAA、然后抗OX40抗体,和DMXAA、然后PD-1-Fc-GITRL嵌合蛋白。
具体实施方式
本发明部分地基于用于治疗癌症的方法的发现,所述方法包括(同时或顺序地)施用至少一种针对免疫检查点分子(例如CTLA-4)的抗体;干扰素基因刺激因子(STING)激动剂;和/或一种或多种异源嵌合蛋白,其中每种异源嵌合蛋白能够阻断免疫抑制性信号和/或刺激免疫激活信号。
重要的是,因为针对本发明的方法中使用的免疫检查点分子(例如CTLA-4)的抗体、STING激动剂和/或异源嵌合蛋白破坏、阻断、减少、抑制和/或隔离例如源自试图避免其检测和/或破坏和/或增强、增加和/或刺激免疫刺激信号至抗癌免疫细胞的传递的癌细胞的免疫抑制性信号的传递,所以所述方法可通过多种不同的途径提供抗肿瘤作用。通过经由多种不同的途径治疗癌症,本发明的方法更可能在患者中提供任何抗肿瘤作用和/或在患者中提供增强的抗肿瘤作用。此外,因为所述方法通过多种不同的途径起作用,因此至少在对靶向所述途径中的一者的治疗没有反应、反应不良或产生抗性的患者中,它们可以是有效的。因此,对经由两种途径之一起作用的治疗的响应差的患者可通过靶向多种途径来获得治疗益处。
抗体
本发明的方法包括用于治疗癌症的方法,在实施方案中,所述方法包括施用包含能够结合免疫检查点分子的抗体的免疫疗法。
所述抗体可选自以下中的一者或多者:单克隆抗体、多克隆抗体、抗体片段、Fab、Fab′、Fab′-SH、F(ab′)2、Fv、单链Fv、双抗体、线性抗体、双特异性抗体、多特异性抗体、嵌合抗体、人源化抗体、人抗体和包含抗体的抗原结合部分的融合蛋白。在实施方案中,抗体是单克隆抗体,例如人源化单克隆抗体。
在实施方案中,能够结合免疫检查点分子的抗体结合CTLA-4。能够结合CTLA-4的说明性抗体包括YERVOY(伊匹单抗)、9D9、曲美木单抗(以前为替奇木单抗,CP-675,206;MedImmune)、AGEN1884和RG2077。
STING激动剂
本发明的方法包括用于治疗癌症的方法,在实施方案中,所述方法包括施用包含干扰素基因刺激因子(STING)激动剂的药物组合物。
在实施方案中,STING激动剂选自由以下组成的组:5,6-二甲基呫吨酮-4-乙酸(DMXAA)、MIW815(ADU-S100)、CRD5500、MK-1454以及在US20140341976、US20180028553、US20180230178、US9549944、WO2017106740、WO2018045204或WO2018098203中描述的任何STING激动剂,所述专利的内容以引用的方式整体并入本文。
异源嵌合蛋白
本发明包括用于治疗癌症的方法,在实施方案中,所述方法包括施用包含能够阻断免疫抑制性信号和/或刺激免疫激活信号的异源嵌合蛋白的药物组合物。
在本发明的方法中使用的异源嵌合蛋白包含以下通用结构:N末端-(a)-(b)-(c)-C末端,其中(a)是包含I型跨膜蛋白(例如,PD-1)的细胞外结构域的第一结构域,(b)是邻接所述第一结构域和第二结构域的接头,例如,包含至少一个能够形成二硫键的半胱氨酸残基和/或包含铰链-CH2-CH3 Fc结构域的接头,并且(c)是包含II型跨膜蛋白(例如,CD40L、GITRL和4-1BBL)的细胞外结构域的第二结构域;其中所述接头连接所述第一结构域和所述第二结构域。
跨膜蛋白通常由细胞外结构域、一个或一系列跨膜结构域以及细胞内结构域组成。不希望受理论束缚,跨膜蛋白的细胞外结构域负责与细胞外环境中的可溶性受体或配体或膜结合的受体或配体(即,相邻细胞的膜)相互作用。不希望受理论束缚,跨膜结构域负责将跨膜蛋白定位于质膜。不希望受理论束缚,跨膜蛋白的细胞内结构域负责协调与细胞信号传导分子的相互作用,以协调细胞内响应与细胞外环境(反之亦然)。
在实施方案中,细胞外结构域是指跨膜蛋白的一部分,所述部分足以结合至配体或受体并且有效地将信号传递至细胞。在实施方案中,细胞外结构域是通常存在于细胞或细胞膜的外部的跨膜蛋白的整个氨基酸序列。在实施方案中,细胞外结构域是跨膜蛋白的氨基酸序列的一部分,所述部分在细胞或细胞膜的外部并且是信号转导和/或配体结合所需的,如可使用本领域已知的方法所测定(例如,体外配体结合和/或细胞激活测定)。
通常存在两种类型的单程跨膜蛋白:具有细细胞外氨基末端和细胞内羧基末端的I型跨膜蛋白(参见图1A,左侧蛋白)和具有细胞外羧基末端和细胞内氨基末端的II型跨膜蛋白(参见图1A,右侧蛋白)。I型和II型跨膜蛋白可以是受体或配体。对于I型跨膜蛋白(例如,PD-1),所述蛋白的氨基末端面向细胞外部,并且因此含有负责在细胞外环境中与其他结合配偶体(配体或受体)相互作用的功能结构域(参见,图1B,左侧蛋白)。对于II型跨膜蛋白(例如,CD40L、GITRL和4-1BBL),所述蛋白的羧基末端面向细胞外部,并且因此含有负责与细胞外环境中的其他结合配偶体(配体或受体)相互作用的功能结构域(参见图1B,右侧蛋白)。因此,这两种类型的跨膜蛋白相对于细胞膜具有彼此相反的取向。
在本发明的方法中使用的异源嵌合蛋白包含I型跨膜蛋白(即PD-1)的细胞外结构域和选自CD40L、GITRL和4-1BBL的II型跨膜蛋白的细胞外结构域。因此,在本发明的方法中使用的异源嵌合蛋白至少包含含有PD-1的细胞外结构域的第一结构域,所述第一结构域直接或通过接头连接至包含CD40L、GITRL或4-1BBL的细胞外结构域的第二结构域。如图1C和图1D所示,当结构域以氨基末端至羧基末端取向连接时,第一结构域位于异源嵌合蛋白的“左”侧并且“面向外”,并且第二结构域位于异源嵌合蛋白的“右”侧并且“面向外”。
设想第一结构域和第二结构域的其他构型,例如,第一结构域面向内并且第二结构域面向外,第一结构域面向外并且第二结构域面向内,并且第一结构域和第二结构域都面向内。当两个结构域均“面向内”时,异源嵌合蛋白将具有氨基末端至羧基末端构型,其包含II型跨膜蛋白的细胞外结构域、接头和I型跨膜蛋白的细胞外结构域。在此类构型中,如本文其他地方所述,异源嵌合蛋白可能必须包含额外的“松弛”,以允许异源嵌合蛋白的结构域结合至其受体/配体之一或两者。
在实施方案中,在本发明的方法中使用的异源嵌合蛋白包含人PD-1的细胞外结构域,其包含以下氨基酸序列:
LDSPDRPWNPPTFSPALLVVTEGDNATFTCSFSNTSESFVLNWYRMSPSNQTDKLAAFPEDRSQPGQDCRFRVTQLPNGRDFHMSVVRARRNDSGTYLCGAISLAPKAQIKESLRAELRVTERRAEVPTAHPSPSPRPAGQFQ(SEQ ID NO:57)。
在实施方案中,在本发明的方法中使用的异源嵌合蛋白包含PD-1的细胞外结构域的变体。作为实例,所述变体可与SEQ ID NO:57具有至少约60%、或至少约61%、或至少约62%、或至少约63%、或至少约64%、或至少约65%、或至少约66%、或至少约67%、或至少约68%、或至少约69%、或至少约70%、或至少约71%、或至少约72%、或至少约73%、或至少约74%、或至少约75%、或至少约76%、或至少约77%、或至少约78%、或至少约79%、或至少约80%、或至少约81%、或至少约82%、或至少约83%、或至少约84%、或至少约85%、或至少约86%、或至少约87%、或至少约88%、或至少约89%、或至少约90%、或至少约91%、或至少约92%、或至少约93%、或至少约94%、或至少约95%、或至少约96%、或至少约97%、或至少约98%、或至少约99%序列同一性。
在实施方案中,异源嵌合蛋白的第一结构域包含与SEQ ID NO:57的氨基酸序列至少95%同一的氨基酸序列。
在实施方案中,异源嵌合蛋白基本上包含PD-1的整个细胞外结构域。
普通技术人员可通过参考文献来选择PD-1的已知氨基酸序列的变体,所述文献例如Zhang等人“Structural and Functional Analysis of the Costimulatory ReceptorProgrammed Death-1”Immunity.2004年3月;20(3):337-47;Lin等人“The PD-1/PD-L1complex resembles the antigen-binding Fv domains of antibodies and Tcellreceptors”,Proc Natl Acad Sci U S A.2008年2月26日;105(8):3011-6;Zak等人“Structure of the Complex of Human Programmed Death 1,PD-1,and Its Ligand PD-L1”,Structure.2015年12月1日;23(12):2341-2348;和Cheng等人“Structure andInteractions of the Human Programmed Cell Death 1Receptor”,J Biol Chem.2013年4月26日;288(17):11771-85,其各自以引用的方式整体并入。
在实施方案中,在本发明的方法中使用的异源嵌合蛋白包含人GITRL的细胞外结构域,其包含以下氨基酸序列:
ETAKEPCMAKFGPLPSKWQMASSEPPCVNKVSDWKLEILQNGLYLIYGQVAPNANYNDVAPFEVRL YKNKDMIQTLTNKSKIQNVGGTYELHVGDTIDLIFNSEHQVLKNNTYWGIILLANPQFIS(SEQ ID NO:58)。
在实施方案中,在本发明的方法中使用的异源嵌合蛋白包含GITRL的细胞外结构域的变体。作为实例,所述变体可与SEQ ID NO:58具有至少约60%、或至少约61%、或至少约62%、或至少约63%、或至少约64%、或至少约65%、或至少约66%、或至少约67%、或至少约68%、或至少约69%、或至少约70%、或至少约71%、或至少约72%、或至少约73%、或至少约74%、或至少约75%、或至少约76%、或至少约77%、或至少约78%、或至少约79%、或至少约80%、或至少约81%、或至少约82%、或至少约83%、或至少约84%、或至少约85%、或至少约86%、或至少约87%、或至少约88%、或至少约89%、或至少约90%、或至少约91%、或至少约92%、或至少约93%、或至少约94%、或至少约95%、或至少约96%、或至少约97%、或至少约98%、或至少约99%序列同一性。
在实施方案中,异源嵌合蛋白的第二结构域包含与SEQ ID NO:58的氨基酸序列至少95%同一的氨基酸序列。
在实施方案中,异源嵌合蛋白基本上包含GITRL的整个细胞外结构域。
普通技术人员可通过参考文献来选择GITRL的已知氨基酸序列的变体,所述文献例如Chattopadhyay等人“Evolution of GITRL immune function:Murine GITRLexhibits unique structural and biochemical properties within the TNFsuperfamily.”PNAS,第105卷,第2期,2008,第635-640页和Zjou,等人“Structural basisfor ligand-mediated mouse GITR activation Structural basis for ligand-mediated mouse GITR activation.”PNAS January 15,2008.105(2)641-645,所述文献各自以引用的方式整体并入。。
在实施方案中,在本发明的方法中使用的异源嵌合蛋白包含人CD40L的细胞外结构域,其包含以下氨基酸序列:
HRRLDKIEDERNLHEDFVFMKTIQRCNTGERSLSLLNCEEIKSQFEGFVKDIMLNKEETKKENSFEMQKGDQNPQIAAHVISEASSKTTSVLQWAEKGYYTMSNNLVTLENGKQLTVKRQGLYYIYAQVTFCSNREASSQAPFIASLCLKSPGRFERILLRAANTHSSAKPCGQQSIHLGGVFELQPGASVFVNVTDPSQVSHGTGFTSFGLLKL(SEQID NO:60)。
在实施方案中,在本发明的方法中使用的异源嵌合蛋白包含CD40L的细胞外结构域的变体。作为实例,所述变体可与SEQ ID NO:60具有至少约60%、或至少约61%、或至少约62%、或至少约63%、或至少约64%、或至少约65%、或至少约66%、或至少约67%、或至少约68%、或至少约69%、或至少约70%、或至少约71%、或至少约72%、或至少约73%、或至少约74%、或至少约75%、或至少约76%、或至少约77%、或至少约78%、或至少约79%、或至少约80%、或至少约81%、或至少约82%、或至少约83%、或至少约84%、或至少约85%、或至少约86%、或至少约87%、或至少约88%、或至少约89%、或至少约90%、或至少约91%、或至少约92%、或至少约93%、或至少约94%、或至少约95%、或至少约96%、或至少约97%、或至少约98%、或至少约99%序列同一性。
在实施方案中,异源嵌合蛋白的第二结构域包含与SEQ ID NO:60的氨基酸序列至少95%同一的氨基酸序列。
在实施方案中,异源嵌合蛋白基本上包含CD40L的整个细胞外结构域。
普通技术人员可通过参考文献来选择CD40L的已知氨基酸序列的变体,所述文献例如An,等人“Crystallographic and Mutational Analysis of the CD40-CD154Complex and Its Implications for Receptor Activation”,The Journal ofBiological Chemistry 286,11226-11235,所述文献以引用的方式整体并入。
在实施方案中,在本发明的方法中使用的异源嵌合蛋白包含人4-1BBL的细胞外结构域,其包含以下氨基酸序列:
ACPWAVSGARASPGSAASPRLREGPELSPDDPAGLLDLRQGMFAQLVAQNVLLIDGPLSWYSDPGLAGVSLTGGLSYKEDTKELVVAKAGVYYVFFQLELRRVVAGEGSGSVSLALHLQPLRSAAGAAALALTVDLPPASSEARNSAFGFQGRLLHLSAGQRLGVHLHTEARARHAWQLTQGATVLGLFRVTPEIPAGLPSPRSE(SEQ ID NO:61)。
在实施方案中,在本发明的方法中使用的异源嵌合蛋白包含4-1BBL的细胞外结构域的变体。作为实例,所述变体可与SEQ ID NO:61具有至少约60%、或至少约61%、或至少约62%、或至少约63%、或至少约64%、或至少约65%、或至少约66%、或至少约67%、或至少约68%、或至少约69%、或至少约70%、或至少约71%、或至少约72%、或至少约73%、或至少约74%、或至少约75%、或至少约76%、或至少约77%、或至少约78%、或至少约79%、或至少约80%、或至少约81%、或至少约82%、或至少约83%、或至少约84%、或至少约85%、或至少约86%、或至少约87%、或至少约88%、或至少约89%、或至少约90%、或至少约91%、或至少约92%、或至少约93%、或至少约94%、或至少约95%、或至少约96%、或至少约97%、或至少约98%、或至少约99%序列同一性。
在实施方案中,异源嵌合蛋白的第二结构域包含与SEQ ID NO:61的氨基酸序列至少95%同一的氨基酸序列。
在实施方案中,异源嵌合蛋白基本上包含4-1BBL的整个细胞外结构域。
普通技术人员可通过参考文献来选择4-1BBL的已知氨基酸序列的变体,所述文献例如Goodwin等人,“Molecular cloning of a ligand for the inducible T cell gene4-1BB:a member of an emerging family of cytokines with homology to tumornecrosis factor.”Eur.J.Immunol.23(10),2631-2641(1993);Alderson等人,“Molecularand biological characterization of human 4-1BB and its ligand.”Eur.J.Immunol.24(9),2219-2227(1994);以及Arch和Thompson“4-1BB and Ox40 aremembers of a tumor necrosis factor(TNF)-nerve growth factor receptorsubfamily that bind TNF receptor-associated factors and activate nuclearfactor kappaB.”Mol.Cell.Biol.18(1),558-565(1998),所述文献各自以引用的方式整体并入,所述文献以引用的方式整体并入。
在实施方案中,异源嵌合蛋白包含第一结构域,所述第一结构域包含PD-1的细胞外结构域的变体;和/或第二结构域,所述第二结构域包含GITRL的细胞外结构域的变体。
在实施方案中,异源嵌合蛋白包含第一结构域,所述第一结构域基本上包含PD-1的整个细胞外结构域;和/或第二结构域,所述第二结构域基本上包含GITRL的整个细胞外结构域。
在实施方案中,异源嵌合蛋白包含第一结构域,所述第一结构域包含PD-1的细胞外结构域的变体;和/或第二结构域,所述第二结构域包含CD40L的细胞外结构域的变体。
在实施方案中,异源嵌合蛋白包含第一结构域,所述第一结构域基本上包含PD-1的整个细胞外结构域;和/或第二结构域,所述第二结构域基本上包含CD40L的整个细胞外结构域。
在实施方案中,异源嵌合蛋白包含第一结构域,所述第一结构域包含PD-1的细胞外结构域的变体;和/或第二结构域,所述第二结构域包含4-1BBL的细胞外结构域的变体。
在实施方案中,异源嵌合蛋白包含第一结构域,所述第一结构域基本上包含PD-1的整个细胞外结构域;和/或第二结构域,所述第二结构域基本上包含4-1BBL的整个细胞外结构域。
在本文公开的任何方面和实施方案中,异源嵌合蛋白可包含相对于本文公开的任何蛋白质序列具有一种或多种氨基酸突变的氨基酸序列。在实施方案中,所述一种或多种氨基酸突变可独立地选自取代、插入、缺失和截短。
在实施方案中,氨基酸突变是氨基酸取代,并且可包括保守性取代和/或非保守性取代。可例如基于所涉及的氨基酸残基的极性、电荷、大小、溶解度、疏水性、亲水性和/或两亲性质的相似性来进行“保守性取代”。20种天然氨基酸可分为以下六个标准氨基酸组:(1)疏水性:Met、Ala、Val、Leu、Ile;(2)中性亲水性:Cys、Ser、Thr;Asn、Gln;(3)酸性:Asp,Glu;(4)碱性:His、Lys、Arg;(5)影响链取向的残基:Gly、Pro;以及(6)芳香族:Trp、Tyr、Phe。如本文所用,“保守性取代”定义为氨基酸被上面所示六个标准氨基酸组中的同一组中列出的另一种氨基酸交换。例如,Asp被Glu交换在这样修饰的多肽中保留一个负电荷。另外,基于甘氨酸和脯氨酸破坏α-螺旋的能力,它们可彼此取代。如本文所用,“非保守性取代”定义为氨基酸被上面所示六个标准氨基酸组(1)至(6)中的不同组中列出的另一种氨基酸交换。
在实施方案中,取代还可包括非经典氨基酸(例如,硒代半胱氨酸、吡咯赖氨酸、N-甲酰基甲硫氨酸β-丙氨酸、GABA和δ-氨基乙酰丙酸、4-氨基苯甲酸(PABA)、常见氨基酸的D-异构体、2,4-二氨基丁酸、α-氨基异丁酸、4-氨基丁酸、Abu、2-氨基丁酸、γ-Abu、ε-Ahx、6-氨基己酸、Aib、2-氨基异丁酸、3-氨基丙酸、鸟氨酸、正亮氨酸、正缬氨酸、羟脯氨酸、肌氨酸、瓜氨酸、高瓜氨酸、磺丙氨酸、叔丁基甘氨酸、叔丁基丙氨酸、苯基甘氨酸,环己基丙氨酸、β-丙氨酸、氟代-氨基酸、设计者氨基酸如β-甲基氨基酸、Cα-甲基氨基酸、Nα-甲基氨基酸以及一般的氨基酸类似物)。
还可参考遗传密码,包括将密码子简并性考虑在内来对异源嵌合蛋白的核苷酸序列进行突变。
在实施方案中,异源嵌合蛋白能够结合一种或多种鼠配体/受体。
在实施方案中,异源嵌合蛋白能够结合一种或多种人配体/受体。
在实施方案中,异源嵌合蛋白的每个细胞外结构域(或其变体)以约1nM至约5nM,例如约1nM、约1.5nM、约2nM、约2.5nM、约3nM、约3.5nM、约4nM、约4.5nM或约5nM的KD结合至其同源受体或配体。在实施方案中,异源嵌合蛋白以约5nM至约15nM,例如5nM、约5.5nM、约6nM、约6.5nM、约7nM、约7.5nM、约8nM、约8.5nM、约9nM、约9.5nM、约10nM、约10.5nM、约11nM、约11.5nM、约12nM、约12.5nM、约13nM、约13.5nM、约14nM、约14.5nM或约15nM的KD结合至同源受体或配体。
在实施方案中,异源嵌合蛋白的每个细胞外结构域(或其变体)以小于约1μM、约900nM、约800nM、约700nM、约600nM、约500nM、约400nM、约300nM、约200nM、约150nM、约130nM、约100nM、约90nM、约80nM、约70nM、约60nM、约55nM、约50nM、约45nM、约40nM、约35nM、约30nM、约25nM、约20nM、约15nM、约10nM、或约5nM、或约1nM的KD(例如,如通过表面等离子体共振或生物层干涉法所测量)结合至其同源受体或配体。在实施方案中,异源嵌合蛋白以小于约1nM、约900pM、约800pM、约700pM、约600pM、约500pM、约400pM、约300pM、约200pM、约100pM、约90pM、约80pM、约70pM、约60pM、约55pM、约50pM、约45pM、约40pM、约35pM、约30pM、约25pM、约20pM、约15pM、或约10pM、或约1pM的KD(例如,如通过表面等离子体共振或生物层干涉法所测量)结合至人CSF1。
如本文所用,细胞外结构域的变体能够结合天然细胞外结构域的受体/配体。例如,变体可在细胞外结构域中包含一种或多种不影响其与其受体/配体的结合亲和力的突变;或者,细胞外结构域中的一种或多种突变可改善对受体/配体的结合亲和力;或者细胞外结构域中的一种或多种突变可降低对受体/配体的结合亲和力,但不完全消除结合。在实施方案中,一种或多种突变位于结合口袋外部,其中细胞外结构域与其受体/配体相互作用。在实施方案中,一种或多种突变位于结合口袋内部,其中细胞外结构域与其受体/配体相互作用,只要所述突变不完全消除结合即可。基于熟练技术人员的知识以及本领域中关于受体-配体结合的知识,他/她将知道哪些突变将允许结合以及哪些突变将消除结合。
在实施方案中,相对于单结构域融合蛋白或抗体对照,嵌合蛋白表现出增强的稳定性、高亲合力结合特性、延长的靶标结合的解离速率和蛋白质半衰期。
在本发明的方法中使用的异源嵌合蛋白可包含多于两个细胞外结构域。例如,异源嵌合蛋白可包含三个、四个、五个、六个、七个、八个、九个、十个或更多个细胞外结构域。如本文所公开的,第二细胞外结构域可经由接头与第三细胞外结构域分开。或者,第二细胞外结构域可直接连接(例如,经由肽键)至第三细胞外结构域。在实施方案中,异源嵌合蛋白包含直接连接的细胞外结构域和经由接头间接连接的细胞外结构域,如本文所公开。
本发明的异源嵌合蛋白和/或在本发明的方法中使用的异源嵌合蛋白具有在空间上能够结合其配体/受体的第一结构域和/或在空间上能够结合其配体/受体的第二结构域。这意味着异源嵌合蛋白中存在足够的总体柔性和/或细胞外结构域(或其一部分)与异源嵌合蛋白的剩余部分之间存在物理距离,以使得细胞外结构域的配体/受体结合结构域在空间上不受阻碍地结合其配体/受体。这种柔性和/或物理距离(在本文中称为“松弛”)通常可存在于一个或多个细胞外结构域中,通常存在于接头中,和/或通常存在于异源嵌合蛋白中(作为整体)。或者或另外地,可通过包含一个或多个另外的氨基酸序列(例如,下文描述的接合接头)或合成接头(例如,聚乙二醇(PEG)接头)来修饰异源嵌合蛋白,其提供了避免空间位阻所需的额外松弛。
接头
在实施方案中,在本发明的方法中使用的异源嵌合蛋白包含接头。
在实施方案中,所述接头包含至少一个能够形成二硫键的半胱氨酸残基。所述至少一个半胱氨酸残基能够在一对(或更多)嵌合蛋白之间形成二硫键。不希望受理论束缚,这种二硫键的形成负责维持嵌合蛋白的有用的多聚体状态。这允许异源嵌合蛋白的有效产生;它允许体外和体内的所需活性。
尤其重要的是,在包含一个或多个二硫键的接头区域中的稳定化提供了可维持稳定且可生产的多聚体状态的改进的嵌合蛋白。
在本发明的方法中使用的异源嵌合蛋白中,接头是选自柔性氨基酸序列、IgG铰链区或抗体序列的多肽。
在实施方案中,接头源自天然存在的多结构域蛋白,或者是例如,如Chichili等人,(2013),Protein Sci.22(2):153-167;Chen等人,(2013),Adv Drug Deliv Rev.65(10):1357-1369中所描述的经验接头,所述文献的全部内容特此以引用的方式并入。在实施方案中,接头可使用诸如以下文献中描述的那些的接头设计数据库和计算机程序来设计:Chen等人,(2013),Adv Drug Deliv Rev.65(10):1357-1369和Crasto等人,(2000),Protein Eng.13(5):309-312,所述文献的全部内容特此以引用的方式并入。
在实施方案中,接头包含多肽。在实施方案中,所述多肽小于约500个氨基酸长、约450个氨基酸长、约400个氨基酸长、约350个氨基酸长、约300个氨基酸长、约250个氨基酸长、约200个氨基酸长、约150个氨基酸长或约100个氨基酸长。例如,接头的长度可小于约100、约95、约90、约85、约80、约75、约70、约65、约60、约55、约50、约45、约40、约35、约30、约25、约20、约19、约18、约17、约16、约15、约14、约13、约12、约11、约10、约9、约8、约7、约6、约5、约4、约3或约2个氨基酸。
在实施方案中,接头是柔性的。
在实施方案中,接头是刚性的。
在实施方案中,接头基本上包含甘氨酸和丝氨酸残基(例如,约30%、或约40%、或约50%、或约60%、或约70%、或约80%、或约90%、或约95%、或约97%、或约98%、或约99%、或约100%的甘氨酸和丝氨酸)。
在实施方案中,接头包含抗体(例如,IgG、IgA、IgD和IgE,包括亚类(例如,IgG1、IgG2、IgG3和IgG4、以及IgA1和IgA2))的铰链区。在IgG、IgA、IgD和IgE类抗体中所见的铰链区充当柔性间隔区,由此允许Fab部分在空间中自由移动。与恒定区相反,铰链结构域在结构上是多样的,在免疫球蛋白类和亚类中在序列和长度上都有所不同。例如,IgG亚类中的铰链区的长度和柔性有所不同。IgG1的铰链区包含氨基酸216-231,并且,由于它是自由灵活的,因此Fab片段可以围绕其对称轴旋转并在以两个重链间二硫桥中的第一个为中心的球体内移动。IgG2具有比IgG1短的铰链,带有12个氨基酸残基和四个二硫桥。缺乏甘氨酸残基的IgG2的铰链区相对较短,并且含有刚性的聚脯氨酸双螺旋,通过额外的重链间二硫桥而稳定。这些特性限制了IgG2分子的柔性。IgG3由于其独特的延长铰链区(约为IgG1铰链的四倍长)而与其他亚类不同,所述独特的延长铰链区含有62个氨基酸(包含21个脯氨酸和11个半胱氨酸),形成了非柔性的聚脯氨酸双螺旋。在IgG3中,Fab片段是相对远离Fc片段的,赋予了该分子以更大的柔性。IgG3中的细长铰链还是其比其他亚类具有更高分子量的原因。IgG4的铰链区比IgG1的短,并且其柔性介于IgG1与IgG2的柔性之间。据报告,铰链区的柔性按以下顺序降低:IgG3>IgG1>IgG4>IgG2。在实施方案中,接头可源自人IgG4并且含有一种或多种突变以增强二聚化(包括S228P)或FcRn结合。
根据晶体学研究,免疫球蛋白铰链区可在功能上进一步细分为三个区域:上铰链区、核心区和下铰链区。参见Shin等人,1992Immunological Reviews 130:87。上铰链区包括从C
在实施方案中,接头包含抗体(例如,IgG、IgA、IgD和IgE,包括亚类(例如,IgG1、IgG2、IgG3和IgG4、以及IgA1和IgA2))的Fc结构域。
在本发明的方法中使用的异源嵌合蛋白中,接头包含源自IgG4的铰链-CH2-CH3Fc结构域。在实施方案中,接头包含源自人IgG4的铰链-CH2-CH3 Fc结构域。在实施方案中,接头包含与SEQ ID NO:1至SEQ ID NO:3中任一项的氨基酸序列至少95%同一,例如与SEQID NO:2的氨基酸序列至少95%同一的氨基酸序列。在实施方案中,接头包含一个或多个接合接头,此类接合接头独立地选自SEQ ID NO:4至SEQ ID NO:50(或其变体)。在实施方案中,接头包含两个或更多个接合接头,每个接合接头独立地选自SEQ ID NO:4至SEQ ID NO:50(或其变体);其中一个接合接头在铰链-CH2-CH3 Fc结构域的N末端,并且另一个接合接头在铰链-CH2-CH3 Fc结构域的C末端。
在实施方案中,接头包含源自人IgG1抗体的铰链-CH2-CH3 Fc结构域。在实施方案中,Fc结构域对新生儿Fc受体(FcRn)表现出增加的亲和力和增强的结合。在实施方案中,Fc结构域包含一种或多种突变,所述一种或多种突变增加对FcRn的亲和力并增强与FcRn的结合。不希望受理论束缚,据信对FcRn的亲和力增加和与FcRn的结合增强增加了在本发明的方法中使用的异源嵌合蛋白的体内半衰期。
在实施方案中,接头中的Fc结构域在氨基酸残基250、252、254、256、308、309、311、416、428、433或434(根据Kabat编号,如,Kabat,等人,Sequences of Proteins ofImmunological Interest,第5版Public Health Service,National Institutes ofHealth,Bethesda,Md.(1991),明确地以引用的方式并入本文)处含有一个或多个氨基酸取代,或其等效物。在实施方案中,在氨基酸残基250处的氨基酸取代是被谷氨酰胺取代。
在实施方案中,在氨基酸残基252处的氨基酸取代是被酪氨酸、苯丙氨酸、色氨酸或苏氨酸取代。在实施方案中,在氨基酸残基254处的氨基酸取代是被苏氨酸取代。在实施方案中,在氨基酸残基256处的氨基酸取代是被丝氨酸、精氨酸、谷氨酰胺、谷氨酸、天冬氨酸或苏氨酸取代。在实施方案中,在氨基酸残基308处的氨基酸取代是被苏氨酸取代。在实施方案中,在氨基酸残基309处的氨基酸取代是被脯氨酸取代。在实施方案中,在氨基酸残基311处的氨基酸取代是被丝氨酸取代。在实施方案中,在氨基酸残基385处的氨基酸取代是被精氨酸、天冬氨酸、丝氨酸、苏氨酸、组氨酸、赖氨酸、丙氨酸或甘氨酸取代。在实施方案中,在氨基酸残基386处的氨基酸取代是被苏氨酸、脯氨酸、天冬氨酸、丝氨酸、赖氨酸、精氨酸、异亮氨酸或甲硫氨酸取代。在实施方案中,在氨基酸残基387处的氨基酸取代是被精氨酸、脯氨酸、组氨酸、丝氨酸、苏氨酸或丙氨酸取代。在实施方案中,在氨基酸残基389处的氨基酸取代是被脯氨酸、丝氨酸或天冬酰胺取代。在实施方案中,在氨基酸残基416处的氨基酸取代是被丝氨酸取代。在实施方案中,在氨基酸残基428处的氨基酸取代是被亮氨酸取代。在实施方案中,在氨基酸残基433处的氨基酸取代是被精氨酸、丝氨酸、异亮氨酸、脯氨酸或谷氨酰胺取代。在实施方案中,在氨基酸残基434处的氨基酸取代是被组氨酸、苯丙氨酸或酪氨酸取代。
在实施方案中,Fc结构域接头(例如,包含IgG恒定区)包含一种或多种突变,如在氨基酸残基252、254、256、433、434或436(根据Kabat编号,如Kabat,等人,Sequences ofProteins of Immunological Interest,第5版Public Health Service,NationalInstitutes of Health,Bethesda,Md.(1991),明确地以引用的方式并入本文)处的取代。在实施方案中,IgG恒定区包含三重M252Y/S254T/T256E突变或YTE突变。在实施方案中,IgG恒定区包含三重H433K/N434F/Y436H突变或KFH突变。在实施方案中,IgG恒定区包含组合的YTE和KFH突变。
在实施方案中,接头包含IgG恒定区,所述IgG恒定区在氨基酸残基250、253、307、310、380、428、433、434和435(根据Kabat编号,如Kabat,等人,Sequences of Proteins ofImmunological Interest,第5版Public Health Service,National Institutes ofHealth,Bethesda,Md.(1991),明确地以引用的方式并入本文)处含有一种或多种突变。示例性突变包括T250Q、M428L、T307A、E380A、I253A、H310A、M428L、H433K、N434A、N434F、N434S和H435A。在实施方案中,IgG恒定区包含M428L/N434S突变或LS突变。在实施方案中,IgG恒定区包含T250Q/M428L突变或QL突变。在实施方案中,IgG恒定区包含N434A突变。在实施方案中,IgG恒定区包含T307A/E380A/N434A突变或AAA突变。在实施方案中,IgG恒定区包含I253A/H310A/H435A突变或IHH突变。在实施方案中,IgG恒定区包含H433K/N434F突变。在实施方案中,IgG恒定区包含组合的M252Y/S254T/T256E和H433K/N434F突变。
IgG恒定区中的另外示例性突变描述于例如Robbie,等人,Antimicrobial Agentsand Chemotherapy(2013),57(12):6147-6153;Dall’Acqua等人,JBC(2006),281(33):23514-24;Dall’Acqua等人,Journal of Immunology(2002),169:5171-80;Ko等人Journalof Immunology.(2015),194(11):5497-508;以及美国专利号7,083,784中,所述文献的全部内容特此以引用的方式并入。
说明性的Fc稳定化突变体是S228P。说明性的延长Fc半衰期的突变体是T250Q、M428L、V308T、L309P和Q311S,并且本发明的接头可包含这些突变体中的1者、或2者、或3者、或4者、或5者。
在实施方案中,异源嵌合蛋白以高亲和力结合至FcRn。在实施方案中,异源嵌合蛋白可以约1nM至约80nM的K
在实施方案中,接头中的Fc结构域具有SEQ ID NO:1的氨基酸序列(参见下文表1),或与其具有至少90%、或93%、或95%、或97%、或98%、或99%同一性。在实施方案中,对SEQ ID NO:1进行突变以增加稳定性和/或半衰期。例如,在实施方案中,接头中的Fc结构域包含SEQ ID NO:2的氨基酸序列(参见下文表1),或与其具有至少90%、或93%、或95%、或97%、或98%、或99%同一性。例如,在实施方案中,接头中的Fc结构域包含SEQ ID NO:3的氨基酸序列(参见下文表1),或与其具有至少90%、或93%、或95%、或97%、或98%、或99%同一性。
此外,可采用一个或多个接合接头来连接接头中的Fc结构域(例如,SEQ ID NO:1、SEQ ID NO:2、SEQ ID NO:3之一或与其至少90%、或93%、或95%、或97%、或98%、或99%同一性)和细胞外结构域。例如,SEQ ID NO:4、SEQ ID NO:5、SEQ ID NO:6、SEQ ID NO:7、SEQ ID NO:8、SEQ ID NO:9中的任一者或其变体可连接如本文所公开的细胞外结构域和如本文所公开的接头中的Fc结构域。任选地,SEQ ID NO:4至SEQ ID NO:50中的任一者或其变体位于如本文公开的细胞外结构域和如本文公开的Fc结构域之间。
在实施方案中,在本发明的方法中使用的异源嵌合蛋白可包含下文表1中公开的接合接头的变体。例如,接头可与SEQ ID NO:4至SEQ ID NO:50中的任一者的氨基酸序列具有至少约60%、或至少约61%、或至少约62%、或至少约63%、或至少约64%、或至少约65%、或至少约66%、或至少约67%、或至少约68%、或至少约69%、或至少约70%、或至少约71%、或至少约72%、或至少约73%、或至少约74%、或至少约75%、或至少约76%、或至少约77%、或至少约78%、或至少约79%、或至少约80%、或至少约81%、或至少约82%、或至少约83%、或至少约84%、或至少约85%、或至少约86%、或至少约87%、或至少约88%、或至少约89%、或至少约90%、或至少约91%、或至少约92%、或至少约93%、或至少约94%、或至少约95%、或至少约96%、或至少约97%、或至少约98%、或至少约99%序列同一性。
在实施方案中,第一和第二接合接头可不同或它们可相同。
不希望受理论束缚,在异源嵌合蛋白中包括包含Fc结构域的至少一部分的接头有助于避免形成不溶性和可能的非功能性蛋白级联低聚物和/或聚集体。这部分是由于在Fc结构域中存在半胱氨酸,所述半胱氨酸能够在嵌合蛋白之间形成二硫键。
在实施方案中,异源嵌合蛋白可包含如本文所公开的一个或多个接合接头,并且缺乏如本文所公开的Fc结构域接头。
在实施方案中,第一和/或第二接合接头独立地选自SEQ ID NO:4至SEQ ID NO:50的氨基酸序列,并且提供在下文表1中:
表1:说明性接头(Fc结构域接头和接合接头)
在实施方案中,接合接头基本上包含甘氨酸和丝氨酸残基(例如,约30%、或约40%、或约50%、或约60%、或约70%、或约80%、或约90%、或约95%、或约97%、或约98%、或约99%、或约100%的甘氨酸和丝氨酸)。例如,在实施方案中,接合接头是(Gly
在实施方案中,接合接头是GGGSE(SEQ ID NO:47)、GSESG(SEQ ID NO:48)、GSEGS(SEQ ID NO:49)、GEGGSGEGSSGEGSSSEGGGSEGGGSEGGGSEGGS(SEQ ID NO:50)和每4个氨基酸间隔随机放置G、S和E的接合接头中的一者或多者。
在实施方案中,在本发明的方法中使用的异源嵌合蛋白包含第一跨膜蛋白的细胞外结构域(ECD)、在Fc结构域之前的一个接合接头、在所述Fc结构域之后的第二接合接头以及第二跨膜蛋白的ECD,所述异源嵌合蛋白可包含以下结构:
ECD–接合接头1–Fc结构域–接合接头2–ECD。
第一接合接头、Fc结构域接头和第二接合接头的组合在本文中称为“模块化接头”。在实施方案中,在本发明的方法中使用的异源嵌合蛋白包含如表2中所示的模块化接头:
表2:说明性模块化接头
在实施方案中,在本发明的方法中使用的异源嵌合蛋白可包含以上表2中公开的模块化接头的变体。例如,接头可与SEQ ID NO:51至SEQ ID NO:56中的任一者的氨基酸序列具有至少约60%、或至少约61%、或至少约62%、或至少约63%、或至少约64%、或至少约65%、或至少约66%、或至少约67%、或至少约68%、或至少约69%、或至少约70%、或至少约71%、或至少约72%、或至少约73%、或至少约74%、或至少约75%、或至少约76%、或至少约77%、或至少约78%、或至少约79%、或至少约80%、或至少约81%、或至少约82%、或至少约83%、或至少约84%、或至少约85%、或至少约86%、或至少约87%、或至少约88%、或至少约89%、或至少约90%、或至少约91%、或至少约92%、或至少约93%、或至少约94%、或至少约95%、或至少约96%、或至少约97%、或至少约98%、或至少约99%序列同一性。
在实施方案中,接头可以是柔性的,包括但不限于高度柔性的。在实施方案中,接头可以是刚性的,包括但不限于刚性α螺旋。说明性接合接头的特征在下文表3中示出:
表3:说明性接合接头的特征
在实施方案中,接头可以是功能性的。例如但不限于,接头可起到提高折叠和/或稳定性、提高表达、改善药物动力学和/或改善本发明方法中使用的异源嵌合蛋白的生物活性的作用。在另一个实例中,接头可起到将异源嵌合蛋白靶向特定细胞类型或位置的作用。
在实施方案中,在本发明的方法中使用的异源嵌合蛋白仅包含一个接合接头。
在实施方案中,在本发明的方法中使用的异源嵌合蛋白缺乏接合接头。
在实施方案中,接头是合成接头,如聚乙二醇(PEG)。
在实施方案中,异源嵌合蛋白具有在空间上能够结合其配体/受体的第一结构域和/或在空间上能够结合其配体/受体的第二结构域。因此,异源嵌合蛋白中存在足够的总体柔性和/或细胞外结构域(或其部分)与异源嵌合蛋白的剩余部分之间存在物理距离,以使得细胞外结构域的配体/受体结合结构域在空间上不受阻碍地结合其配体/受体。这种柔性和/或物理距离(其被称为“松弛”)通常可存在于一个或多个细胞外结构域中,通常存在于接头中,和/或通常存在于异源嵌合蛋白中(作为整体)。或者或另外地,可将氨基酸序列(例如)添加至一个或多个细胞外结构域和/或接头,以提供避免空间位阻所需的松弛。可添加提供松弛的任何氨基酸序列。在实施方案中,所添加的氨基酸序列包含序列(Gly)
在实施方案中,异源嵌合蛋白包含第一结构域,所述第一结构域包含PD-1的一部分;第二结构域,所述第二结构域包含GITRL的一部分;和接头。在实施方案中,接头是选自柔性氨基酸序列、IgG铰链区和抗体序列的多肽。在实施方案中,接头包含至少一个能够形成二硫键的半胱氨酸残基和/或包含铰链-CH2-CH3 Fc结构域。在实施方案中,接头包含例如来自IgG1或来自IgG4(包括人IgG1或IgG4)的铰链-CH2-CH3 Fc结构域。在实施方案中,接头包含与SEQ ID NO:1、SEQ ID NO:2或SEQ ID NO:3的氨基酸序列至少95%同一的氨基酸序列。因此,在实施方案中,当在本发明的方法中使用的异源嵌合蛋白包含PD-1的细胞外结构域(或其变体)、包含铰链-CH2-CH3 Fc结构域的接头和GITRL的细胞外结构域(或其变体)时,它在本文中可称为“PD-1-Fc-GITRL”。
在实施方案中,本发明的PD-1-Fc-GITRL异源嵌合蛋白和/或在本发明的方法中使用的PD-1-Fc-GITRL异源嵌合蛋白包含:(1)包含SEQ ID NO:57的氨基酸序列的第一结构域,(b)包含SEQ ID NO:58的氨基酸序列的第二结构域,和(c)接头,所述接头包含与SEQ IDNO:1、SEQ ID NO:2或SEQ ID NO:3至少95%同一的氨基酸序列。
在实施方案中,本发明的PD-1-Fc-GITRL异源嵌合蛋白和/或在本发明的方法中使用的PD-1-Fc-GITRL异源嵌合蛋白具有以下氨基酸序列:
LDSPDRPWNPPTFSPALLVVTEGDNATFTCSFSNTSESFVLNWYRMSPSNQTDKLAAFPEDRSQPGQDCRFRVTQLPNGRDFHMSVVRARRNDSGTYLCGAISLAPKAQIKESLRAELRVTERRAEVPTAHPSPSPRPAGQFQSKYGPPCPPCPAPEFLGGPSVFLFPPKPKDQLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLSGKEYKCKVSSKGLPSSIEKTISNATGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVLHEALHNHYTQKSLSLSLGKIEGRMDQLETAKEPCMAKFGPLPSKWQMASSEPPCVNKVSDWKLEILQNGLYLIYGQVAPNANYNDVAPFEVRLYKNKDMIQTLTNKSKIQNVGGTYELHVGDTIDLIFNSEHQVLKNNTYWGIILLANPQFIS(SEQ ID NO:62)。
在实施方案中,本发明的异源嵌合蛋白和/或在本发明的方法中使用的异源嵌合蛋白包含PD-1-Fc-GITRL异源嵌合蛋白的变体。作为实例,所述变体可与SEQ ID NO:62具有至少约60%、或至少约61%、或至少约62%、或至少约63%、或至少约64%、或至少约65%、或至少约66%、或至少约67%、或至少约68%、或至少约69%、或至少约70%、或至少约71%、或至少约72%、或至少约73%、或至少约74%、或至少约75%、或至少约76%、或至少约77%、或至少约78%、或至少约79%、或至少约80%、或至少约81%、或至少约82%、或至少约83%、或至少约84%、或至少约85%、或至少约86%、或至少约87%、或至少约88%、或至少约89%、或至少约90%、或至少约91%、或至少约92%、或至少约93%、或至少约94%、或至少约95%、或至少约96%、或至少约97%、或至少约98%、或至少约99%序列同一性。
在实施方案中,异源嵌合蛋白包含第一结构域,所述第一结构域包含PD-1的一部分;第二结构域,所述第二结构域包含CD40L的一部分;和接头。在实施方案中,接头是选自柔性氨基酸序列、IgG铰链区和抗体序列的多肽。在实施方案中,接头包含至少一个能够形成二硫键的半胱氨酸残基和/或包含铰链-CH2-CH3 Fc结构域。在实施方案中,接头包含例如来自IgG1或来自IgG4(包括人IgG1或IgG4)的铰链-CH2-CH3 Fc结构域。在实施方案中,接头包含与SEQ ID NO:1、SEQ ID NO:2或SEQ ID NO:3的氨基酸序列至少95%同一的氨基酸序列。因此,在实施方案中,当在本发明的方法中使用的异源嵌合蛋白包含PD-1的细胞外结构域(或其变体)、包含铰链-CH2-CH3 Fc结构域的接头和CD40L的细胞外结构域(或其变体)时,它在本文中可称为“PD-1-Fc-4-CD40L”。
在实施方案中,本发明的PD-1-Fc-CD40L异源嵌合蛋白和/或在本发明的方法中使用的PD-1-Fc-CD40L异源嵌合蛋白包含:(1)包含SEQ ID NO:57的氨基酸序列的第一结构域,(b)包含SEQ ID NO:60的氨基酸序列的第二结构域,和(c)接头,所述接头包含与SEQ IDNO:1、SEQ ID NO:2或SEQ ID NO:3至少95%同一的氨基酸序列。
在实施方案中,本发明的PD-1-Fc-CD40L异源嵌合蛋白和/或在本发明的方法中使用的PD-1-Fc-CD40L异源嵌合蛋白具有以下氨基酸序列:
LDSPDRPWNPPTFSPALLVVTEGDNATFTCSFSNTSESFVLNWYRMSPSNQTDKLAAFPEDRSQPGQDCRFRVTQLPNGRDFHMSVVRARRNDSGTYLCGAISLAPKAQIKESLRAELRVTERRAEVPTAHPSPSPRPAGQFQSKYGPPCPPCPAPEFLGGPSVFLFPPKPKDQLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLSGKEYKCKVSSKGLPSSIEKTISNATGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVLHEALHNHYTQKSLSLSLGKIEGRMDHRRLDKIEDERNLHEDFVFMKTIQRCNTGERSLSLLNCEEIKSQFEGFVKDIMLNKEETKKENSFEMQKGDQNPQIAAHVISEASSKTTSVLQWAEKGYYTMSNNLVTLENGKQLTVKRQGLYYIYAQVTFCSNREASSQAPFIASLCLKSPGRFERILLRAANTHSSAKPCGQQSIHLGGVFELQPGASVFVNVTDPSQVSHGTGFTSFGLLKL(SEQ IDNO:63)。
在实施方案中,本发明的异源嵌合蛋白和/或在本发明的方法中使用的异源嵌合蛋白包含PD-1-Fc-CD40L异源嵌合蛋白的变体。作为实例,所述变体可与SEQ ID NO:63具有至少约60%、或至少约61%、或至少约62%、或至少约63%、或至少约64%、或至少约65%、或至少约66%、或至少约67%、或至少约68%、或至少约69%、或至少约70%、或至少约71%、或至少约72%、或至少约73%、或至少约74%、或至少约75%、或至少约76%、或至少约77%、或至少约78%、或至少约79%、或至少约80%、或至少约81%、或至少约82%、或至少约83%、或至少约84%、或至少约85%、或至少约86%、或至少约87%、或至少约88%、或至少约89%、或至少约90%、或至少约91%、或至少约92%、或至少约93%、或至少约94%、或至少约95%、或至少约96%、或至少约97%、或至少约98%、或至少约99%序列同一性。
在实施方案中,异源嵌合蛋白包含第一结构域,所述第一结构域包含PD-1的一部分;第二结构域,所述第二结构域包含4-1BBL的一部分;和接头。在实施方案中,接头是选自柔性氨基酸序列、IgG铰链区和抗体序列的多肽。在实施方案中,接头包含至少一个能够形成二硫键的半胱氨酸残基和/或包含铰链-CH2-CH3 Fc结构域。在实施方案中,接头包含例如来自IgG1或来自IgG4(包括人IgG1或IgG4)的铰链-CH2-CH3 Fc结构域。在实施方案中,接头包含与SEQ ID NO:1、SEQ ID NO:2或SEQ ID NO:3的氨基酸序列至少95%同一的氨基酸序列。因此,在实施方案中,当在本发明的方法中使用的异源嵌合蛋白包含PD-1的细胞外结构域(或其变体)、包含铰链-CH2-CH3 Fc结构域的接头和CD40L的细胞外结构域(或其变体)时,它在本文中可称为“PD-1-Fc-4-1BBL”。
在实施方案中,本发明的PD-1-Fc-4-1BBL异源嵌合蛋白和/或在本发明的方法中使用的PD-1-Fc-4-1BBL异源嵌合蛋白包含:(1)包含SEQ ID NO:57的氨基酸序列的第一结构域,(b)包含SEQ ID NO:61的氨基酸序列的第二结构域,和(c)接头,所述接头包含与SEQID NO:1、SEQ ID NO:2或SEQ ID NO:3至少95%同一的氨基酸序列。
在实施方案中,本发明的PD-1-Fc-4-1BBL异源嵌合蛋白和/或在本发明的方法中使用的PD-1-Fc-4-1BBL异源嵌合蛋白具有以下氨基酸序列:
LDSPDRPWNPPTFSPALLVVTEGDNATFTCSFSNTSESFVLNWYRMSPSNQTDKLAAFPEDRSQPGQDCRFRVTQLPNGRDFHMSVVRARRNDSGTYLCGAISLAPKAQIKESLRAELRVTERRAEVPTAHPSPSPRPAGQFQSKYGPPCPPCPAPEFLGGPSVFLFPPKPKDQLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLSGKEYKCKVSSKGLPSSIEKTISNATGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVLHEALHNHYTQKSLSLSLGKIEGRMDACPWAVSGARASPGSAASPRLREGPELSPDDPAGLLDLRQGMFAQLVAQNVLLIDGPLSWYSDPGLAGVSLTGGLSYKEDTKELVVAKAGVYYVFFQLELRRVVAGEGSGSVSLALHLQPLRSAAGAAALALTVDLPPASSEARNSAFGFQGRLLHLSAGQRLGVHLHTEARARHAWQLTQGATVLGLFRVTPEIPAGLPSPRSE(SEQ ID NO:64)。
在实施方案中,本发明的异源嵌合蛋白和/或在本发明的方法中使用的异源嵌合蛋白包含PD-1-Fc-4-1BBL异源嵌合蛋白的变体。作为实例,所述变体可与SEQ ID NO:64具有至少约60%、或至少约61%、或至少约62%、或至少约63%、或至少约64%、或至少约65%、或至少约66%、或至少约67%、或至少约68%、或至少约69%、或至少约70%、或至少约71%、或至少约72%、或至少约73%、或至少约74%、或至少约75%、或至少约76%、或至少约77%、或至少约78%、或至少约79%、或至少约80%、或至少约81%、或至少约82%、或至少约83%、或至少约84%、或至少约85%、或至少约86%、或至少约87%、或至少约88%、或至少约89%、或至少约90%、或至少约91%、或至少约92%、或至少约93%、或至少约94%、或至少约95%、或至少约96%、或至少约97%、或至少约98%、或至少约99%序列同一性。
疾病、治疗方法和作用机制
所述方法包括以下步骤:向有需要的受试者(同时或顺序地)施用有效量的至少一种针对免疫检查点分子(例如CTLA-4)的抗体;干扰素基因刺激因子(STING)激动剂;和/或一种或多种异源嵌合蛋白,其中每种异源嵌合蛋白能够阻断免疫抑制性信号和/或刺激免疫激活信号。
通常期望破坏、阻断、减少、抑制和/或隔离免疫抑制性信号的传递,并且同时或同期地增强、增加和/或刺激免疫刺激信号至抗癌免疫的传递,以增强免疫响应,例如增强患者的抗肿瘤免疫响应。
在实施方案中,在本发明方法中使用的针对免疫检查点分子的抗体、STING激动剂和/或异源嵌合蛋白能够调节免疫响应的幅度,例如调节效应子输出的水平,或者可用于包括调节免疫响应的幅度,例如调节效应子输出的水平的方法中。
在实施方案中,例如当用于治疗癌症时,与免疫抑制相比,本发明方法中使用的针对免疫检查点分子(例如CTLA-4)的抗体;STING激动剂;和/或异源嵌合蛋白改变免疫刺激的程度以增加T细胞响应的幅度,包括但不限于刺激细胞因子产生、增殖或靶标杀伤潜力的水平增加。在实施方案中,患者的T细胞通过本发明方法中使用的针对免疫检查点分子的抗体、STING激动剂和/或异源嵌合蛋白激活和/或刺激,其中激活的T细胞能够分裂和/或分泌细胞因子。
癌症或肿瘤是指不受控制的细胞生长和/或异常增加的细胞存活和/或细胞凋亡的抑制,其干扰身体器官和系统的正常功能。包括良性和恶性癌症、息肉、增生以及休眠状态肿瘤或微转移。此外,包括具有不受免疫系统阻碍的异常增殖的细胞(例如,病毒感染的细胞)。所述癌症可以是原发性癌症或转移性癌症。原发性癌症可以是在临床上可检测到的起源部位处的癌细胞区域,并且可以是原发性肿瘤。相比之下,转移性癌症可以是疾病从一个器官或部分扩散至另一非相邻器官或部分。转移性癌症可由癌细胞引起,所述癌细胞具有穿透并浸润局部区域中的周围正常组织的能力,从而形成新的肿瘤,其可以是局部转移。癌细胞也可由癌细胞引起,所述癌细胞具有穿透淋巴管和/或血管壁的能力,此后癌细胞能够通过血流循环(从而成为循环中肿瘤细胞)至体内的其他部位和组织。癌症可由于诸如淋巴或血源性播散的过程引起。癌症也可由肿瘤细胞引起,所述肿瘤细胞停留在另一个部位,重新穿透血管或壁,继续繁殖,并且最终形成另一种临床上可检测的肿瘤。癌症可以是这种新肿瘤,其可以是转移性(或继发性)肿瘤。
癌症可由已转移的肿瘤细胞引起,其可以是继发性或转移性肿瘤。肿瘤的细胞可与原始肿瘤中的细胞相似。例如,如果乳腺癌或结肠癌转移至肝脏,则继发性肿瘤虽然存在于肝脏中,但由异常的乳腺癌或结肠细胞而不是异常的肝细胞组成。因此,肝脏中的肿瘤可以是转移性乳腺癌或转移性结肠癌,而不是肝癌。
癌症可起源于任何组织。癌症可起源于黑素瘤、结肠、乳腺或前列腺癌;因此,癌症可包含起初分别是皮肤、结肠、乳腺或前列腺组织的细胞。癌症也可以是血液系统恶性肿瘤,其可以是白血病或淋巴瘤。癌症可侵入诸如肝脏、肺、膀胱或肠的组织。
本发明的代表性癌症和/或肿瘤包括但不限于基底细胞癌;胆道癌;膀胱癌;骨癌;脑和中枢神经系统癌症;乳腺癌;腹膜癌;宫颈癌;绒毛膜癌;结肠和直肠癌;结缔组织癌症;消化系统癌症;子宫内膜癌;食道癌;眼癌;头颈部癌症;胃癌(包括胃肠道癌);成胶质细胞瘤;肝癌;肝细胞瘤;上皮内赘瘤;肾癌或肾脏癌;喉癌;白血病;肝癌;肺癌(例如,小细胞肺癌、非小细胞肺癌、肺腺癌和肺鳞癌);黑素瘤;骨髓瘤;成神经细胞瘤;口腔癌(嘴唇、舌、口和咽);卵巢癌;胰腺癌;前列腺癌;成视网膜细胞瘤;横纹肌肉瘤;直肠癌;呼吸系统癌症;唾液腺癌;肉瘤;皮肤癌;鳞状细胞癌;胃癌;睾丸癌;甲状腺癌;子宫或子宫内膜癌;泌尿系统癌症;外阴癌;淋巴瘤,包括霍奇金淋巴瘤和非霍奇金淋巴瘤,以及B细胞淋巴瘤(包括低级/滤泡性非霍奇金淋巴瘤(NHL);小淋巴细胞(SL)NHL;中级/滤泡性NHL;中级弥漫性NHL;高级成免疫细胞NHL;高级成淋巴细胞性NHL;高级小无裂细胞NHL;巨大肿块疾病NHL;套细胞淋巴瘤;AIDS相关淋巴瘤;和瓦尔登斯特伦氏巨球蛋白血症;慢性淋巴细胞性白血病(CLL);急性成淋巴细胞性白血病(ALL);毛细胞白血病;慢性成骨髓细胞性白血病;以及其他癌症和肉瘤;和移植后淋巴组织增生性病症(PTLD),以及与瘢痣病、水肿(如与脑肿瘤相关的水肿)和梅格斯氏综合征(Meigs’syndrome)相关的异常血管增生。
在实施方案中,在本发明的方法中使用的针对免疫检查点分子的抗体、STING激动剂和/或异源嵌合蛋白治疗患有难治性癌症的受试者。在实施方案中,在本发明的方法中使用的针对免疫检查点分子的抗体、STING激动剂和/或异源嵌合蛋白治疗对一种或多种免疫调节剂而言难治的受试者。例如,在实施方案中,在本发明的方法中使用的针对免疫检查点分子的抗体、STING激动剂和/或异源嵌合蛋白治疗在治疗约12周后对治疗无响应或甚至进展的受试者。例如,在实施方案中,所述受试者对PD-1和/或PD-L1和/或PD-L2剂而言是难治性的,包括例如纳武单抗(ONO-4538/BMS-936558,MDX1106,OPDIVO,BRISTOL MYERSSQUIBB)、派姆单抗(KEYTRUDA,MERCK)、西米普利单抗(REGN-2810)、MK-3475(MERCK)、BMS936559(BRISTOL MYERS SQUIBB)、依鲁替尼(PHARMACYCLICS/ABBVIE)、阿特珠单抗(TECENTRIQ,GENENTECH)和/或MPDL328OA(ROCHE)难治性患者。例如,在实施方案中,所述受试者对抗CTLA-4剂而言是难治性的,例如伊匹单抗(YERVOY)难治性患者(例如,黑素瘤患者)。因此,在实施方案中,本发明提供了挽救对各种疗法(包括一种或多种免疫调节剂的单一疗法)无响应的患者的癌症治疗方法。
在实施方案中,本发明提供了靶向肿瘤微环境内的细胞或组织的针对免疫检查点分子的抗体、STING激动剂和/或异源嵌合蛋白。在实施方案中,肿瘤微环境内的细胞或组织表达针对本发明方法中使用的免疫检查点分子的抗体、STING激动剂和/或异源嵌合蛋白的一种或多种靶标或结合配偶体。肿瘤微环境是指细胞环境,包括存在肿瘤的细胞、分泌的蛋白质、生理小分子和血管。在实施方案中,肿瘤微环境内的细胞或组织是以下中的一者或多者:肿瘤血管;肿瘤浸润淋巴细胞;成纤维细胞网状细胞;内皮祖细胞(EPC);癌症相关的成纤维细胞;周细胞;其他基质细胞;细胞外基质(ECM)的组分;树突细胞;抗原呈递细胞;T细胞;调控性T细胞;巨噬细胞;嗜中性粒细胞;以及位于肿瘤近端的其他免疫细胞。在实施方案中,本发明方法中使用的针对免疫检查点分子的抗体、STING激动剂和/或异源嵌合蛋白靶向癌细胞。在实施方案中,癌细胞表达针对本发明方法中使用的免疫检查点分子的抗体、STING激动剂和/或异源嵌合蛋白的一种或多种靶标或结合配偶体。
在实施方案中,本发明的方法在对于另外的剂而言难治的患者中提供用针对免疫检查点分子的抗体、STING激动剂和/或异源嵌合蛋白进行的治疗,此类“另外的剂”在本文中其他地方公开,包括但不限于本文公开的各种化学治疗剂。
调控性T细胞的激活受到共刺激信号和共抑制信号的严重影响。共刺激分子的两个主要家族包括B7和肿瘤坏死因子(TNF)家族。这些分子分别结合至T细胞上属于CD28或TNF受体家族的受体。许多明确定义的共抑制剂及其受体属于B7和CD28家族。
在实施方案中,免疫刺激信号是指增强免疫响应的信号。例如,在肿瘤学的背景下,此类信号可增强抗肿瘤免疫性。例如但不限于,可通过直接刺激白细胞的增殖、细胞因子产生、杀伤活性或吞噬活性来鉴定免疫刺激信号。具体实例包括使用受体激动剂抗体或使用包含此类受体的配体(分别OX40L、LIGHT、CD70、CD30L、4-1BBL、TL1A)的异源嵌合蛋白直接刺激TNF超家族受体(如OX40、LTbR、CD27、CD30、4-1BB或TNFRSF25)。来自这些受体中任一者的刺激都可直接刺激单独T细胞亚群的增殖和细胞因子产生。另一个实例包括通过抑制这种免疫遏制细胞的活性的受体直接刺激免疫抑制性细胞。例如,这将包括用GITR激动剂抗体或含有嵌合蛋白的GITRL刺激CD4+FoxP3+调控性T细胞,这将降低那些调控性T细胞遏制常规CD4+或CD8+T细胞增殖的能力。在另一个实例中,这将包括使用CD40激动剂抗体或包含CD40L的异源嵌合蛋白刺激抗原呈递细胞表面上的CD40,从而引起抗原呈递细胞的激活,包括在适当天然共刺激分子(包括B7或TNF超家族中的那些)的背景下那些细胞呈递抗原的能力增强。在另一个实例中,这将包括使用含LIGHT的嵌合蛋白刺激淋巴样或基质细胞表面上的LTBR,从而引起淋巴样细胞的激活和/或促炎性细胞因子或趋化因子的产生,从而进一步刺激免疫响应,任选地在肿瘤内。
在实施方案中,针对免疫检查点分子的抗体、STING激动剂和/或异源嵌合蛋白能够增强、恢复、促进和/或刺激免疫调节,或者适用于涉及增强、恢复、促进和/或刺激免疫调节的方法中。在实施方案中,在本文所述的本发明方法中使用的针对免疫检查点分子的抗体、STING激动剂和/或异源嵌合蛋白恢复、促进和/或刺激一种或多种针对肿瘤细胞的免疫细胞的活性或激活,所述免疫细胞包括但不限于:T细胞、细胞毒性T淋巴细胞、T辅助细胞、自然杀伤(NK)细胞、自然杀伤T(NKT)细胞、抗肿瘤巨噬细胞(例如M1巨噬细胞)、B细胞和树突细胞。在实施方案中,在本发明的方法中使用的针对免疫检查点分子的抗体、STING激动剂和/或异源嵌合蛋白增强、恢复、促进和/或刺激T细胞的活性和/或激活,包括(作为非限制性实例)激活和/或刺激一种或多种T细胞内源信号,包括促存活信号;自分泌或旁分泌生长信号;p38 MAPK-、ERK-、STAT-、JAK-、AKT-或PI3K-介导的信号;抗凋亡信号;和/或促进以下中的一者或多者和/或对于以下中的一者或多者必要的信号:促炎性细胞因子产生或T细胞迁移或T细胞肿瘤浸润。
在实施方案中,在本发明的方法中使用的针对免疫检查点分子的抗体、STING激动剂和/或异源嵌合蛋白能够引起进入肿瘤或肿瘤微环境中的T细胞(包括但不限于细胞毒性T淋巴细胞、T辅助细胞、自然杀伤T(NKT)细胞)、B细胞、自然杀伤(NK)细胞、自然杀伤T(NKT)细胞、树突细胞、单核细胞和巨噬细胞(例如,M1和M2中的一者或多者)中的一者或多者增加,或者适用于涉及引起进入肿瘤或肿瘤微环境中的T细胞(包括但不限于细胞毒性T淋巴细胞、T辅助细胞、自然杀伤T(NKT)细胞)、B细胞、自然杀伤(NK)细胞、自然杀伤T(NKT)细胞、树突细胞、单核细胞和巨噬细胞(例如,M1和M2中的一者或多者)中的一者或多者增加的方法中。在实施方案中,在本发明的方法中使用的针对免疫检查点分子的抗体、STING激动剂和/或异源嵌合蛋白增强CD8+T细胞,特别是已经渗透到肿瘤微环境中的那些T细胞对肿瘤抗原的识别。在实施方案中,在本发明的方法中使用的针对免疫检查点分子的抗体、STING激动剂和/或异源嵌合蛋白诱导CD19表达和/或增加CD19阳性细胞(例如,CD19阳性B细胞)的数量。在实施方案中,在本发明的方法中使用的针对免疫检查点分子的抗体、STING激动剂和/或异源嵌合蛋白诱导IL-15Rα表达和/或增加IL-15Rα阳性细胞(例如,IL-15Rα阳性树突细胞)的数量。
在实施方案中,在本发明的方法中使用的针对免疫检查点分子的抗体、STING激动剂和/或异源嵌合蛋白能够抑制和/或引起免疫遏制细胞(例如,骨髓来源的遏制细胞(MDSC)、调控性T细胞(Treg)、肿瘤相关的嗜中性粒细胞(TAN)、M2巨噬细胞和肿瘤相关的巨噬细胞(TAM))、并且特别是在肿瘤和/或肿瘤微环境(TME)内减少,或者适用于涉及抑制和/或引起免疫遏制细胞(例如,骨髓来源的遏制细胞(MDSC)、调控性T细胞(Treg)、肿瘤相关的嗜中性粒细胞(TAN)、M2巨噬细胞和肿瘤相关的巨噬细胞(TAM))、并且特别是在肿瘤和/或肿瘤微环境(TME)内减少的方法中。在实施方案中,本发明的疗法可改变肿瘤部位和/或TME中M1与M2巨噬细胞的比例,以有利于M1巨噬细胞。
在实施方案中,在本发明的方法中使用的针对免疫检查点分子的抗体、STING激动剂和/或异源嵌合蛋白能够增加各种细胞因子或趋化因子的血清水平,所述细胞因子或趋化因子包括但不限于以下中的一者或多者:IFNγ、TNFα、IL-2、IL-4、IL-5、IL-6、IL-7、IL-9、IL-10、IL-13、IL-15、IL-17A、IL-17F、IL-22、CCL2、CCL3、CCL4、CXCL8、CXCL9、CXCL10、CXCL11和CXCL12。在实施方案中,在本发明的方法中使用的针对免疫检查点分子的抗体、STING激动剂和/或异源嵌合蛋白能够增强所治疗受试者的血清中的IL-2、IL-4、IL-5、IL-10、IL-13、IL-17A、IL-22、TNFα或IFNγ。在实施方案中,在本发明的方法中使用的针对免疫检查点分子的抗体、STING激动剂和/或异源嵌合蛋白的施用能够增强TNFα分泌。在具体实施方案中,在本发明的方法中使用的针对免疫检查点分子的抗体、STING激动剂和/或异源嵌合蛋白的施用能够增强白细胞的超抗原介导的TNFα分泌。对这种细胞因子响应的检测可提供用于确定本发明方法中使用的针对免疫检查点分子的所示抗体、STING激动剂和/或异源嵌合蛋白的最佳给药方案的方法。
在本发明的方法中使用的针对免疫检查点分子的抗体、STING激动剂和/或异源嵌合蛋白能够增加CD4+和/或CD8+T细胞亚群或防止CD4+和/或CD8+T细胞亚群的减少。
在本发明的方法中使用的针对免疫检查点分子的抗体、STING激动剂和/或异源嵌合蛋白能够增强T细胞的肿瘤杀伤活性。
在实施方案中,在本发明的方法中使用的针对免疫检查点分子的抗体、STING激动剂和/或异源嵌合蛋白抑制、阻断和/或减少抗肿瘤CD8+和/或CD4+T细胞的细胞死亡;或刺激;诱导和/或增加促肿瘤T细胞的细胞死亡。T细胞耗尽是T细胞功能障碍的一种状态,其特征在于增殖和效应子功能逐渐丧失,最终导致克隆缺失。因此,促肿瘤T细胞是指在许多慢性感染、炎症性疾病和癌症期间出现的T细胞功能障碍的状态。这种功能障碍由较差的增殖和/或效应子功能、抑制性受体的持续表达以及与功能性效应子或记忆T细胞的转录状态不同的转录状态定义。耗尽防止感染和肿瘤的最佳控制。说明性的促肿瘤T细胞包括但不限于表达一种或多种检查点抑制性受体的Treg、CD4+和/或CD8+T细胞,Th2细胞和Th17细胞。检查点抑制性受体是指在免疫细胞上表达的可预防或抑制不受控制的免疫响应的受体。相比之下,抗肿瘤CD8+和/或CD4+T细胞是指可发动针对肿瘤的免疫响应的T细胞。
在实施方案中,在本发明的方法中使用的针对免疫检查点分子的抗体、STING激动剂和/或异源嵌合蛋白能够增加效应T细胞与调控性T细胞的比例,并且可用于包括增加效应T细胞与调控性T细胞的比例的方法中。说明性的效应T细胞包括ICOS
在实施方案中,在本发明的方法中使用的针对免疫检查点分子的抗体、STING激动剂和/或异源嵌合蛋白引起效应T细胞(例如,CD4+CD25-T细胞)的增加。
在实施方案中,在本发明的方法中使用的针对免疫检查点分子的抗体、STING激动剂和/或异源嵌合蛋白引起调控性T细胞(例如,CD4+CD25+T细胞)的减少。
在实施方案中,在本发明的方法中使用的针对免疫检查点分子的抗体、STING激动剂和/或异源嵌合蛋白产生记忆响应,所述记忆响应可能能够预防复发或保护动物免于复发和/或预防转移或/或降低转移的可能性。因此,用本发明方法中使用的针对免疫检查点分子的抗体、STING激动剂和/或异源嵌合蛋白治疗的动物稍后在用本发明的方法中使用的针对免疫检查点分子的抗体、STING激动剂和/或异源嵌合蛋白初始治疗后再次攻击时能够攻击肿瘤细胞和/或预防肿瘤发展。因此,在本发明的方法中使用的针对免疫检查点分子的抗体、STING激动剂和/或异源嵌合蛋白刺激主动肿瘤破坏并且还刺激肿瘤抗原的免疫识别,这在编程能够预防复发的记忆响应中是必不可少的。
在实施方案中,在本发明的方法中使用的针对免疫检查点分子的抗体、STING激动剂和/或异源嵌合蛋白能够引起抗原呈递细胞的激活。在实施方案中,在本发明的方法中使用的针对免疫检查点分子的抗体、STING激动剂和/或异源嵌合蛋白能够增强抗原呈递细胞呈递抗原的能力。
在实施方案中,在本发明的方法中使用的针对免疫检查点分子的抗体、STING激动剂和/或异源嵌合蛋白能够瞬时刺激效应T细胞超过约12小时、约24小时、约48小时、约72小时或约96小时或约1周或约2周,并且可用于包括刺激效应T细胞超过约12小时、约24小时、约48小时、约72小时或约96小时或约1周或约2周的方法中。在实施方案中,效应T细胞的瞬时刺激基本上发生在患者的血流中或特定的组织/部位(包括淋巴组织,例如像骨髓、淋巴结、脾、胸腺、粘膜相关的淋巴组织(MALT)、非淋巴组织)中或肿瘤微环境中。
在本发明的方法中使用的异源嵌合蛋白出人意料地提供了细胞外结构域组分与其具有慢解离速率(Kd或K
在本发明的方法中使用的异源嵌合蛋白能够在细胞之间形成稳定的突触。异源嵌合蛋白所促进的细胞的稳定突触(例如,在带有负信号的细胞之间)提供了空间取向以有利于肿瘤减少-如将T细胞定位为攻击肿瘤细胞和/或在空间上阻止肿瘤细胞传递负信号,包括除异源嵌合蛋白所掩蔽的信号以外的负信号。在实施方案中,与异源嵌合蛋白的血清t
在实施方案中,在本发明的方法中使用的针对免疫检查点分子的抗体、STING激动剂和/或异源嵌合蛋白能够提供持续免疫调节作用。
在本发明的方法中使用的针对免疫检查点分子的抗体、STING激动剂和/或异源嵌合蛋白提供协同治疗作用(例如,抗肿瘤作用),因为它允许两种免疫治疗剂的改善的位点特异性相互作用。在实施方案中,在本发明的方法中使用的针对免疫检查点分子的抗体、STING激动剂和/或异源嵌合蛋白提供降低异位和/或全身毒性的潜力。
在实施方案中,在本发明的方法中使用的异源嵌合蛋白表现出增强的安全性概况。在实施方案中,在本发明的方法中使用的异源嵌合蛋白表现出降低的毒性概况。例如,本发明的方法中使用的异源嵌合蛋白的施用可产生减轻的副作用,如腹泻、炎症(例如,肠道炎症)或体重减轻中的一种或多种,所述副作用在施用针对由本发明的方法中使用的异源嵌合蛋白的细胞外结构域所靶向的一种或多种配体/受体的抗体之后发生。在实施方案中,与针对由本发明的方法中使用的异源嵌合蛋白的细胞外结构域所靶向的一种或多种配体/受体的抗体相比,在本发明的方法中使用的异源嵌合蛋白提供了改进的安全性,但是不牺牲功效。
在实施方案中,相对于当前免疫疗法,例如针对由本发明的方法中使用的异源嵌合蛋白的细胞外结构域所靶向的一种或多种配体/受体的抗体,本发明的方法中使用的异源嵌合蛋白提供减少的副作用,例如GI并发症。说明性的GI并发症包括腹痛、食欲不振、自身免疫作用、便秘、痉挛、脱水、腹泻、进食问题、疲劳、肠胃气胀、腹部积液或腹水、胃肠(GI)生态失调、GI粘膜炎、炎症性肠病、肠易激综合征(IBS-D和IBS-C)、恶心、疼痛、粪便或尿液变化、溃疡性结肠炎、呕吐、由于积液所致的体重增加和/或虚弱。
治疗方法
本发明的一个方面提供了用于治疗有需要的受试者的癌症的方法。所述第一药物组合物包含能够结合细胞毒性T淋巴细胞相关抗原4(CTLA-4)的抗体。所述第二药物组合物包含免疫疗法,所述免疫疗法选自:(i)异源嵌合蛋白,所述异源嵌合蛋白包含:(a)第一结构域,所述第一结构域包含PD-1的细胞外结构域的一部分,其中所述部分能够结合PD-1配体,(b)第二结构域,所述第二结构域包含GITRL的细胞外结构域的一部分,其中所述部分能够结合GITRL受体,和(c)接头,所述接头连接所述第一结构域和所述第二结构域;(ii)异源嵌合蛋白,所述异源嵌合蛋白包含:(a)第一结构域,所述第一结构域包含PD-1的细胞外结构域的一部分,其中所述部分能够结合PD-1配体,(b)第二结构域,所述第二结构域包含4-1BBL的细胞外结构域的一部分,其中所述部分能够结合4-1BBL受体,和(c)接头,所述接头连接所述第一结构域和所述第二结构域;以及(iii)异源嵌合蛋白,所述异源嵌合蛋白包含:(a)第一结构域,所述第一结构域包含PD-1的细胞外结构域的一部分,其中所述部分能够结合PD-1配体,(b)第二结构域,所述第二结构域包含CD40L的细胞外结构域的一部分,其中所述部分能够结合CD40L受体,和(c)接头,所述接头连接所述第一结构域和所述第二结构域。
在实施方案中,同时提供第一药物组合物和第二药物组合物,在提供第二药物组合物之后提供第一药物组合物,或者在提供第二药物组合物之前提供第一药物组合物。
在实施方案中,第一药物组合物的剂量小于提供给尚未进行或未正在进行用第二药物组合物治疗的受试者的第一药物组合物的剂量。
在实施方案中,提供的第二药物组合物的剂量小于提供给尚未进行或未正在进行用第一药物组合物治疗的受试者的第二药物组合物的剂量。
在实施方案中,与仅已经进行或仅正在进行用第一药物组合物治疗的受试者相比,所述受试者具有增加的存活机会而没有胃肠炎症和体重减轻,和/或具有降低的肿瘤大小或癌症患病率。
在实施方案中,与仅已经进行或仅正在进行用第二药物组合物治疗的受试者相比,所述受试者具有增加的存活机会而没有胃肠炎症和体重减轻,和/或具有降低的肿瘤大小或癌症患病率。
在实施方案中,免疫疗法包含异源嵌合蛋白,所述异源嵌合蛋白包含第一结构域,所述第一结构域基本上包含PD-1的整个细胞外结构域;和/或第二结构域,所述第二结构域基本上包含GITRL的整个细胞外结构域。
在实施方案中,免疫疗法包含异源嵌合蛋白,所述异源嵌合蛋白包含第一结构域,所述第一结构域基本上包含PD-1的整个细胞外结构域;和/或第二结构域,所述第二结构域基本上包含4-1BBL的整个细胞外结构域。
在实施方案中,免疫疗法包含异源嵌合蛋白,所述异源嵌合蛋白包含第一结构域,所述第一结构域基本上包含PD-1的整个细胞外结构域;和/或第二结构域,所述第二结构域基本上包含CD40L的整个细胞外结构域。
在实施方案中,接头是选自柔性氨基酸序列、IgG铰链区和抗体序列的多肽。
在实施方案中,接头包含至少一个能够形成二硫键的半胱氨酸残基和/或包含铰链-CH2-CH3 Fc结构域。在实施方案中,接头包含源自IgG1或IgG4例如人IgG1或人IgG4的铰链-CH2-CH3 Fc结构域。在实施方案中,接头包含与SEQ ID NO:1、SEQ ID NO:2或SEQ IDNO:3的氨基酸序列至少95%同一的氨基酸序列。
在实施方案中,异源嵌合蛋白包含:(a)包含PD-1的一部分的第一结构域,(b)包含GITRL的一部分的第二结构域,和(c)包含铰链-CH2-CH3 Fc结构域的接头;(a)包含PD-1的一部分的第一结构域,(b)包含4-1BBL的一部分的第二结构域,和(c)包含铰链-CH2-CH3 Fc结构域的接头;或(a)包含PD-1的一部分的第一结构域,(b)包含CD40L的一部分的第二结构域,和(c)包含铰链-CH2-CH3 Fc结构域的接头。
在实施方案中,能够结合CTLA-4的抗体选自由以下组成的组:YERVOY(伊匹单抗)、9D9、曲美木单抗(以前为替奇木单抗,CP-675,206;MedImmune)、AGEN1884和RG2077。
在实施方案中,所述癌症是或涉及基底细胞癌;胆道癌;膀胱癌;骨癌;脑和中枢神经系统癌症;乳腺癌;腹膜癌;宫颈癌;绒毛膜癌;结肠和直肠癌;结缔组织癌症;消化系统癌症;子宫内膜癌;食道癌;眼癌;头颈部癌症;胃癌(包括胃肠道癌);成胶质细胞瘤;肝癌;肝细胞瘤;上皮内赘瘤;肾癌或肾脏癌;喉癌;白血病;肝癌;肺癌(例如,小细胞肺癌、非小细胞肺癌、肺腺癌和肺鳞癌);黑素瘤;骨髓瘤;成神经细胞瘤;口腔癌(嘴唇、舌、口和咽);卵巢癌;胰腺癌;前列腺癌;成视网膜细胞瘤;横纹肌肉瘤;直肠癌;呼吸系统癌症;唾液腺癌;肉瘤;皮肤癌;鳞状细胞癌;胃癌;睾丸癌;甲状腺癌;子宫或子宫内膜癌;泌尿系统癌症;外阴癌;淋巴瘤,包括霍奇金淋巴瘤和非霍奇金淋巴瘤,以及B细胞淋巴瘤(包括低级/滤泡性非霍奇金淋巴瘤(NHL);小淋巴细胞(SL)NHL;中级/滤泡性NHL;中级弥漫性NHL;高级成免疫细胞NHL;高级成淋巴细胞性NHL;高级小无裂细胞NHL;巨大肿块疾病NHL;套细胞淋巴瘤;AIDS相关淋巴瘤;和瓦尔登斯特伦氏巨球蛋白血症;慢性淋巴细胞性白血病(CLL);急性成淋巴细胞性白血病(ALL);毛细胞白血病;慢性成骨髓细胞性白血病;以及其他癌症和肉瘤;和移植后淋巴组织增生性病症(PTLD),以及与瘢痣病、水肿(如与脑肿瘤相关的水肿)和梅格斯氏综合征相关的异常血管增生。
在实施方案中,受试者患有对于包含能够结合PD-1或结合PD-1配体的抗体的治疗响应差或难治性的癌症。在实施方案中,所述癌症在用能够结合PD-1或结合PD-1配体的抗体治疗大约12周后对这种治疗响应差或无响应。在实施方案中,能够结合PD-1或结合PD-1配体的抗体选自由以下组成的组:纳武单抗(ONO-4538/BMS-936558,MDX1106,OPDIVO,BRISTOL MYERS SQUIBB)、派姆单抗(KEYTRUDA,MERCK)、西米普利单抗(REGN-2810)、MK-3475(MERCK)、BMS 936559(BRISTOL MYERS SQUIBB)、依鲁替尼(PHARMACYCLICS/ABBVIE)、阿特珠单抗(TECENTRIQ,GENENTECH)和MPDL328OA(ROCHE)。
本发明的另一方面提供了用于治疗受试者的癌症的方法。所述方法包括向所述受试者提供包含免疫疗法的药物组合物的步骤。所述免疫疗法选自:(i)异源嵌合蛋白,所述异源嵌合蛋白包含:(a)第一结构域,所述第一结构域包含PD-1的细胞外结构域的一部分,其中所述部分能够结合PD-1配体,(b)第二结构域,所述第二结构域包含GITRL的细胞外结构域的一部分,其中所述部分能够结合GITRL受体,和(c)接头,所述接头连接所述第一结构域和所述第二结构域;(ii)异源嵌合蛋白,所述异源嵌合蛋白包含:(a)第一结构域,所述第一结构域包含PD-1的细胞外结构域的一部分,其中所述部分能够结合PD-1配体,(b)第二结构域,所述第二结构域包含4-1BBL的细胞外结构域的一部分,其中所述部分能够结合4-1BBL受体,和(c)接头,所述接头连接所述第一结构域和所述第二结构域;以及(iii)异源嵌合蛋白,所述异源嵌合蛋白包含:(a)第一结构域,所述第一结构域包含PD-1的细胞外结构域的一部分,其中所述部分能够结合PD-1配体,(b)第二结构域,所述第二结构域包含CD40L的细胞外结构域的一部分,其中所述部分能够结合CD40L受体,和(c)接头,所述接头连接所述第一结构域和所述第二结构域。在此方面,所述受试者已经进行或正在进行用能够结合细胞毒性T淋巴细胞相关抗原4(CTLA-4)的抗体治疗。
在实施方案中,提供给所述受试者的药物组合物的剂量小于提供给尚未进行或未正在进行用能够结合CTLA-4的抗体治疗的受试者的药物组合物的剂量。
在实施方案中,免疫疗法包含异源嵌合蛋白,所述异源嵌合蛋白包含第一结构域,所述第一结构域基本上包含PD-1的整个细胞外结构域;和/或第二结构域,所述第二结构域基本上包含GITRL的整个细胞外结构域。
在实施方案中,免疫疗法包含异源嵌合蛋白,所述异源嵌合蛋白包含第一结构域,所述第一结构域基本上包含PD-1的整个细胞外结构域;和/或第二结构域,所述第二结构域基本上包含4-1BBL的整个细胞外结构域。
在实施方案中,免疫疗法包含异源嵌合蛋白,所述异源嵌合蛋白包含第一结构域,所述第一结构域基本上包含PD-1的整个细胞外结构域;和/或第二结构域,所述第二结构域基本上包含CD40L的整个细胞外结构域。
在实施方案中,接头是选自柔性氨基酸序列、IgG铰链区和抗体序列的多肽。
在实施方案中,接头包含至少一个能够形成二硫键的半胱氨酸残基和/或包含铰链-CH2-CH3 Fc结构域。在实施方案中,接头包含源自IgG1或IgG4例如人IgG1或IgG4的铰链-CH2-CH3 Fc结构域。在实施方案中,接头包含与SEQ ID NO:1、SEQ ID NO:2或SEQ IDNO:3的氨基酸序列至少95%同一的氨基酸序列。
在实施方案中,异源嵌合蛋白包含:(a)包含PD-1的一部分的第一结构域,(b)包含GITRL的一部分的第二结构域,和(c)包含铰链-CH2-CH3 Fc结构域的接头;(a)包含PD-1的一部分的第一结构域,(b)包含4-1BBL的一部分的第二结构域,和(c)包含铰链-CH2-CH3 Fc结构域的接头;或(a)包含PD-1的一部分的第一结构域,(b)包含CD40L的一部分的第二结构域,和(c)包含铰链-CH2-CH3 Fc结构域的接头。
在实施方案中,能够结合CTLA-4的抗体选自由以下组成的组:YERVOY(伊匹单抗)、9D9、曲美木单抗(以前为替奇木单抗,CP-675,206;MedImmune)、AGEN1884和RG2077。
在实施方案中,所述癌症是或涉及基底细胞癌;胆道癌;膀胱癌;骨癌;脑和中枢神经系统癌症;乳腺癌;腹膜癌;宫颈癌;绒毛膜癌;结肠和直肠癌;结缔组织癌症;消化系统癌症;子宫内膜癌;食道癌;眼癌;头颈部癌症;胃癌(包括胃肠道癌);成胶质细胞瘤;肝癌;肝细胞瘤;上皮内赘瘤;肾癌或肾脏癌;喉癌;白血病;肝癌;肺癌(例如,小细胞肺癌、非小细胞肺癌、肺腺癌和肺鳞癌);黑素瘤;骨髓瘤;成神经细胞瘤;口腔癌(嘴唇、舌、口和咽);卵巢癌;胰腺癌;前列腺癌;成视网膜细胞瘤;横纹肌肉瘤;直肠癌;呼吸系统癌症;唾液腺癌;肉瘤;皮肤癌;鳞状细胞癌;胃癌;睾丸癌;甲状腺癌;子宫或子宫内膜癌;泌尿系统癌症;外阴癌;淋巴瘤,包括霍奇金淋巴瘤和非霍奇金淋巴瘤,以及B细胞淋巴瘤(包括低级/滤泡性非霍奇金淋巴瘤(NHL);小淋巴细胞(SL)NHL;中级/滤泡性NHL;中级弥漫性NHL;高级成免疫细胞NHL;高级成淋巴细胞性NHL;高级小无裂细胞NHL;巨大肿块疾病NHL;套细胞淋巴瘤;AIDS相关淋巴瘤;和瓦尔登斯特伦氏巨球蛋白血症;慢性淋巴细胞性白血病(CLL);急性成淋巴细胞性白血病(ALL);毛细胞白血病;慢性成骨髓细胞性白血病;以及其他癌症和肉瘤;和移植后淋巴组织增生性病症(PTLD),以及与瘢痣病、水肿(如与脑肿瘤相关的水肿)和梅格斯氏综合征相关的异常血管增生。
在实施方案中,受试者患有对于包含能够结合PD-1或结合PD-1配体的抗体的治疗响应差或难治性的癌症。在实施方案中,所述癌症在用能够结合PD-1或结合PD-1配体的抗体治疗大约12周后对这种治疗响应差或无响应。在实施方案中,能够结合PD-1或结合PD-1配体的抗体选自由以下组成的组:纳武单抗(ONO-4538/BMS-936558,MDX1106,OPDIVO,BRISTOL MYERS SQUIBB)、派姆单抗(KEYTRUDA,MERCK)、西米普利单抗(REGN-2810)、MK-3475(MERCK)、BMS 936559(BRISTOL MYERS SQUIBB)、依鲁替尼(PHARMACYCLICS/ABBVIE)、阿特珠单抗(TECENTRIQ,GENENTECH)和MPDL328OA(ROCHE)。
本发明的另一方面是用于治疗受试者的癌症的方法。所述方法包括向所述受试者提供药物组合物的步骤,所述药物组合物包含能够结合细胞毒性T淋巴细胞相关抗原4(CTLA-4)的抗体。在此方面,所述受试者已经进行或正在进行用免疫疗法治疗,所述免疫疗法选自:(i)异源嵌合蛋白,所述异源嵌合蛋白包含:(a)第一结构域,所述第一结构域包含PD-1的细胞外结构域的一部分,其中所述部分能够结合PD-1配体,(b)第二结构域,所述第二结构域包含GITRL的细胞外结构域的一部分,其中所述部分能够结合GITRL受体,和(c)接头,所述接头连接所述第一结构域和所述第二结构域;(ii)异源嵌合蛋白,所述异源嵌合蛋白包含:(a)第一结构域,所述第一结构域包含PD-1的细胞外结构域的一部分,其中所述部分能够结合PD-1配体,(b)第二结构域,所述第二结构域包含4-1BBL的细胞外结构域的一部分,其中所述部分能够结合4-1BBL受体,和(c)接头,所述接头连接所述第一结构域和所述第二结构域;以及(iii)异源嵌合蛋白,所述异源嵌合蛋白包含:(a)第一结构域,所述第一结构域包含PD-1的细胞外结构域的一部分,其中所述部分能够结合PD-1配体,(b)第二结构域,所述第二结构域包含CD40L的细胞外结构域的一部分,其中所述部分能够结合CD40L受体,和(c)接头,所述接头连接所述第一结构域和所述第二结构域。
在实施方案中,提供给所述受试者的药物组合物的剂量小于提供给尚未进行或未正在进行用免疫疗法治疗的受试者的药物组合物的剂量。
在实施方案中,免疫疗法包含异源嵌合蛋白,所述异源嵌合蛋白包含第一结构域,所述第一结构域基本上包含PD-1的整个细胞外结构域;和/或第二结构域,所述第二结构域基本上包含GITRL的整个细胞外结构域。
在实施方案中,免疫疗法包含异源嵌合蛋白,所述异源嵌合蛋白包含第一结构域,所述第一结构域基本上包含PD-1的整个细胞外结构域;和/或第二结构域,所述第二结构域基本上包含4-1BBL的整个细胞外结构域。
在实施方案中,免疫疗法包含异源嵌合蛋白,所述异源嵌合蛋白包含第一结构域,所述第一结构域基本上包含PD-1的整个细胞外结构域;和/或第二结构域,所述第二结构域基本上包含CD40L的整个细胞外结构域。
在实施方案中,接头是选自柔性氨基酸序列、IgG铰链区和抗体序列的多肽。
在实施方案中,接头包含至少一个能够形成二硫键的半胱氨酸残基和/或包含铰链-CH2-CH3 Fc结构域。在实施方案中,接头包含源自IgG1或IgG4例如人IgG1或人IgG4的铰链-CH2-CH3 Fc结构域。在实施方案中,接头包含与SEQ ID NO:1、SEQ ID NO:2或SEQ IDNO:3的氨基酸序列至少95%同一的氨基酸序列。
在实施方案中,异源嵌合蛋白包含:(a)包含PD-1的一部分的第一结构域,(b)包含GITRL的一部分的第二结构域,和(c)包含铰链-CH2-CH3 Fc结构域的接头;(a)包含PD-1的一部分的第一结构域,(b)包含4-1BBL的一部分的第二结构域,和(c)包含铰链-CH2-CH3 Fc结构域的接头;或(a)包含PD-1的一部分的第一结构域,(b)包含CD40L的一部分的第二结构域,和(c)包含铰链-CH2-CH3 Fc结构域的接头。
在实施方案中,能够结合CTLA-4的抗体选自由以下组成的组:YERVOY(伊匹单抗)、9D9、曲美木单抗(以前为替奇木单抗,CP-675,206;MedImmune)、AGEN1884和RG2077。
在实施方案中,所述癌症是或涉及基底细胞癌;胆道癌;膀胱癌;骨癌;脑和中枢神经系统癌症;乳腺癌;腹膜癌;宫颈癌;绒毛膜癌;结肠和直肠癌;结缔组织癌症;消化系统癌症;子宫内膜癌;食道癌;眼癌;头颈部癌症;胃癌(包括胃肠道癌);成胶质细胞瘤;肝癌;肝细胞瘤;上皮内赘瘤;肾癌或肾脏癌;喉癌;白血病;肝癌;肺癌(例如,小细胞肺癌、非小细胞肺癌、肺腺癌和肺鳞癌);黑素瘤;骨髓瘤;成神经细胞瘤;口腔癌(嘴唇、舌、口和咽);卵巢癌;胰腺癌;前列腺癌;成视网膜细胞瘤;横纹肌肉瘤;直肠癌;呼吸系统癌症;唾液腺癌;肉瘤;皮肤癌;鳞状细胞癌;胃癌;睾丸癌;甲状腺癌;子宫或子宫内膜癌;泌尿系统癌症;外阴癌;淋巴瘤,包括霍奇金淋巴瘤和非霍奇金淋巴瘤,以及B细胞淋巴瘤(包括低级/滤泡性非霍奇金淋巴瘤(NHL);小淋巴细胞(SL)NHL;中级/滤泡性NHL;中级弥漫性NHL;高级成免疫细胞NHL;高级成淋巴细胞性NHL;高级小无裂细胞NHL;巨大肿块疾病NHL;套细胞淋巴瘤;AIDS相关淋巴瘤;和瓦尔登斯特伦氏巨球蛋白血症;慢性淋巴细胞性白血病(CLL);急性成淋巴细胞性白血病(ALL);毛细胞白血病;慢性成骨髓细胞性白血病;以及其他癌症和肉瘤;和移植后淋巴组织增生性病症(PTLD),以及与瘢痣病、水肿(如与脑肿瘤相关的水肿)和梅格斯氏综合征相关的异常血管增生。
在实施方案中,受试者患有对于包含能够结合PD-1或结合PD-1配体的抗体的治疗响应差或难治性的癌症。在实施方案中,所述癌症在用能够结合PD-1或结合PD-1配体的抗体治疗大约12周后对这种治疗响应差或无响应。在实施方案中,能够结合PD-1或结合PD-1配体的抗体选自由以下组成的组:纳武单抗(ONO-4538/BMS-936558,MDX1106,OPDIVO,BRISTOL MYERS SQUIBB)、派姆单抗(KEYTRUDA,MERCK)、西米普利单抗(REGN-2810)、MK-3475(MERCK)、BMS 936559(BRISTOL MYERS SQUIBB)、依鲁替尼(PHARMACYCLICS/ABBVIE)、阿特珠单抗(TECENTRIQ,GENENTECH)和MPDL328OA(ROCHE)。
在一方面,本发明提供了用于治疗有需要的受试者的癌症的方法。所述方法包括向所述受试者提供第一药物组合物和第二药物组合物的步骤。所述第一药物组合物包含干扰素基因刺激因子(STING)激动剂。所述第二药物组合物包含免疫疗法,所述免疫疗法选自:(i)异源嵌合蛋白,所述异源嵌合蛋白包含:(a)第一结构域,所述第一结构域包含PD-1的细胞外结构域的一部分,其中所述部分能够结合PD-1配体,(b)第二结构域,所述第二结构域包含GITRL的细胞外结构域的一部分,其中所述部分能够结合GITRL受体,和(c)接头,所述接头连接所述第一结构域和所述第二结构域;(ii)异源嵌合蛋白,所述异源嵌合蛋白包含:(a)第一结构域,所述第一结构域包含PD-1的细胞外结构域的一部分,其中所述部分能够结合PD-1配体,(b)第二结构域,所述第二结构域包含4-1BBL的细胞外结构域的一部分,其中所述部分能够结合4-1BBL受体,和(c)接头,所述接头连接所述第一结构域和所述第二结构域;以及(iii)异源嵌合蛋白,所述异源嵌合蛋白包含:(a)第一结构域,所述第一结构域包含PD-1的细胞外结构域的一部分,其中所述部分能够结合PD-1配体,(b)第二结构域,所述第二结构域包含CD40L的细胞外结构域的一部分,其中所述部分能够结合CD40L受体,和(c)接头,所述接头连接所述第一结构域和所述第二结构域。
在实施方案中,同时提供第一药物组合物和第二药物组合物,在提供第二药物组合物之后提供第一药物组合物,或者在提供第二药物组合物之前提供第一药物组合物。
在实施方案中,第一药物组合物的剂量小于提供给尚未进行或未正在进行用第二药物组合物治疗的受试者的第一药物组合物的剂量。
在实施方案中,提供的第二药物组合物的剂量小于提供给尚未进行或未正在进行用第一药物组合物治疗的受试者的第二药物组合物的剂量。
在实施方案中,与仅已经进行或仅正在进行用第一药物组合物治疗的受试者相比,所述受试者具有增加的存活机会而没有胃肠炎症和体重减轻,和/或具有降低的肿瘤大小或癌症患病率。
在实施方案中,与仅已经进行或仅正在进行用第二药物组合物治疗的受试者相比,所述受试者具有增加的存活机会而没有胃肠炎症和体重减轻,和/或具有降低的肿瘤大小或癌症患病率。
在实施方案中,免疫疗法包含异源嵌合蛋白,所述异源嵌合蛋白包含第一结构域,所述第一结构域基本上包含PD-1的整个细胞外结构域;和/或第二结构域,所述第二结构域基本上包含GITRL的整个细胞外结构域。
在实施方案中,免疫疗法包含异源嵌合蛋白,所述异源嵌合蛋白包含第一结构域,所述第一结构域基本上包含PD-1的整个细胞外结构域;和/或第二结构域,所述第二结构域基本上包含4-1BBL的整个细胞外结构域。
在实施方案中,免疫疗法包含异源嵌合蛋白,所述异源嵌合蛋白包含第一结构域,所述第一结构域基本上包含PD-1的整个细胞外结构域;和/或第二结构域,所述第二结构域基本上包含CD40L的整个细胞外结构域。
在实施方案中,接头是选自柔性氨基酸序列、IgG铰链区和抗体序列的多肽。
在实施方案中,接头包含至少一个能够形成二硫键的半胱氨酸残基和/或包含铰链-CH2-CH3 Fc结构域。在实施方案中,接头包含源自IgG1或IgG4例如人IgG1或人IgG4的铰链-CH2-CH3 Fc结构域。在实施方案中,接头包含与SEQ ID NO:1、SEQ ID NO:2或SEQ IDNO:3的氨基酸序列至少95%同一的氨基酸序列。
在实施方案中,异源嵌合蛋白包含:(a)包含PD-1的一部分的第一结构域,(b)包含GITRL的一部分的第二结构域,和(c)包含铰链-CH2-CH3 Fc结构域的接头;(a)包含PD-1的一部分的第一结构域,(b)包含4-1BBL的一部分的第二结构域,和(c)包含铰链-CH2-CH3 Fc结构域的接头;或(a)包含PD-1的一部分的第一结构域,(b)包含CD40L的一部分的第二结构域,和(c)包含铰链-CH2-CH3 Fc结构域的接头。
在实施方案中,STING激动剂选自由以下组成的组:5,6-二甲基呫吨酮-4-乙酸(DMXAA)、MIW815(ADU-S100)、CRD5500或MK-1454以及在US20140341976、US20180028553、US20180230178、US9549944、WO2017106740、WO2018045204或WO2018098203中描述的任何STING激动剂,所述专利的内容以引用的方式整体并入本文。
在实施方案中,所述癌症是或涉及基底细胞癌;胆道癌;膀胱癌;骨癌;脑和中枢神经系统癌症;乳腺癌;腹膜癌;宫颈癌;绒毛膜癌;结肠和直肠癌;结缔组织癌症;消化系统癌症;子宫内膜癌;食道癌;眼癌;头颈部癌症;胃癌(包括胃肠道癌);成胶质细胞瘤;肝癌;肝细胞瘤;上皮内赘瘤;肾癌或肾脏癌;喉癌;白血病;肝癌;肺癌(例如,小细胞肺癌、非小细胞肺癌、肺腺癌和肺鳞癌);黑素瘤;骨髓瘤;成神经细胞瘤;口腔癌(嘴唇、舌、口和咽);卵巢癌;胰腺癌;前列腺癌;成视网膜细胞瘤;横纹肌肉瘤;直肠癌;呼吸系统癌症;唾液腺癌;肉瘤;皮肤癌;鳞状细胞癌;胃癌;睾丸癌;甲状腺癌;子宫或子宫内膜癌;泌尿系统癌症;外阴癌;淋巴瘤,包括霍奇金淋巴瘤和非霍奇金淋巴瘤,以及B细胞淋巴瘤(包括低级/滤泡性非霍奇金淋巴瘤(NHL);小淋巴细胞(SL)NHL;中级/滤泡性NHL;中级弥漫性NHL;高级成免疫细胞NHL;高级成淋巴细胞性NHL;高级小无裂细胞NHL;巨大肿块疾病NHL;套细胞淋巴瘤;AIDS相关淋巴瘤;和瓦尔登斯特伦氏巨球蛋白血症;慢性淋巴细胞性白血病(CLL);急性成淋巴细胞性白血病(ALL);毛细胞白血病;慢性成骨髓细胞性白血病;以及其他癌症和肉瘤;和移植后淋巴组织增生性病症(PTLD),以及与瘢痣病、水肿(如与脑肿瘤相关的水肿)和梅格斯氏综合征相关的异常血管增生。
在实施方案中,受试者患有对于包含能够结合PD-1或结合PD-1配体的抗体的治疗响应差或难治性的癌症。在实施方案中,所述癌症在用能够结合PD-1或结合PD-1配体的抗体治疗大约12周后对这种治疗响应差或无响应。在实施方案中,能够结合PD-1或结合PD-1配体的抗体选自由以下组成的组:纳武单抗(ONO-4538/BMS-936558,MDX1106,OPDIVO,BRISTOL MYERS SQUIBB)、派姆单抗(KEYTRUDA,MERCK)、西米普利单抗(REGN-2810)、MK-3475(MERCK)、BMS 936559(BRISTOL MYERS SQUIBB)、依鲁替尼(PHARMACYCLICS/ABBVIE)、阿特珠单抗(TECENTRIQ,GENENTECH)和MPDL328OA(ROCHE)。
在另一方面,本发明提供了用于治疗受试者的癌症的方法。所述方法包括向所述受试者提供包含免疫疗法的药物组合物的步骤。所述免疫疗法选自:(i)异源嵌合蛋白,所述异源嵌合蛋白包含:(a)第一结构域,所述第一结构域包含PD-1的细胞外结构域的一部分,其中所述部分能够结合PD-1配体,(b)第二结构域,所述第二结构域包含GITRL的细胞外结构域的一部分,其中所述部分能够结合GITRL受体,和(c)接头,所述接头连接所述第一结构域和所述第二结构域;(ii)异源嵌合蛋白,所述异源嵌合蛋白包含:(a)第一结构域,所述第一结构域包含PD-1的细胞外结构域的一部分,其中所述部分能够结合PD-1配体,(b)第二结构域,所述第二结构域包含4-1BBL的细胞外结构域的一部分,其中所述部分能够结合4-1BBL受体,和(c)接头,所述接头连接所述第一结构域和所述第二结构域;以及(iii)异源嵌合蛋白,所述异源嵌合蛋白包含:(a)第一结构域,所述第一结构域包含PD-1的细胞外结构域的一部分,其中所述部分能够结合PD-1配体,(b)第二结构域,所述第二结构域包含CD40L的细胞外结构域的一部分,其中所述部分能够结合CD40L受体,和(c)接头,所述接头连接所述第一结构域和所述第二结构域。在此方面,所述受试者已经进行或正在进行用干扰素基因刺激因子(STING)激动剂治疗。
在实施方案中,提供给所述受试者的药物组合物的剂量小于提供给尚未进行或未正在进行用STING激动剂治疗的受试者的药物组合物的剂量。
在实施方案中,免疫疗法包含异源嵌合蛋白,所述异源嵌合蛋白包含第一结构域,所述第一结构域基本上包含PD-1的整个细胞外结构域;和/或第二结构域,所述第二结构域基本上包含GITRL的整个细胞外结构域。
在实施方案中,免疫疗法包含异源嵌合蛋白,所述异源嵌合蛋白包含第一结构域,所述第一结构域基本上包含PD-1的整个细胞外结构域;和/或第二结构域,所述第二结构域基本上包含4-1BBL的整个细胞外结构域。
在实施方案中,免疫疗法包含异源嵌合蛋白,所述异源嵌合蛋白包含第一结构域,所述第一结构域基本上包含PD-1的整个细胞外结构域;和/或第二结构域,所述第二结构域基本上包含CD40L的整个细胞外结构域。
在实施方案中,接头是选自柔性氨基酸序列、IgG铰链区和抗体序列的多肽。
在实施方案中,接头包含至少一个能够形成二硫键的半胱氨酸残基和/或包含铰链-CH2-CH3 Fc结构域。在实施方案中,接头包含源自IgG1或IgG4例如人IgG1或IgG4的铰链-CH2-CH3 Fc结构域。在实施方案中,接头包含与SEQ ID NO:1、SEQ ID NO:2或SEQ IDNO:3的氨基酸序列至少95%同一的氨基酸序列。
在实施方案中,异源嵌合蛋白包含:(a)包含PD-1的一部分的第一结构域,(b)包含GITRL的一部分的第二结构域,和(c)包含铰链-CH2-CH3 Fc结构域的接头;(a)包含PD-1的一部分的第一结构域,(b)包含4-1BBL的一部分的第二结构域,和(c)包含铰链-CH2-CH3 Fc结构域的接头;或(a)包含PD-1的一部分的第一结构域,(b)包含CD40L的一部分的第二结构域,和(c)包含铰链-CH2-CH3 Fc结构域的接头。
在实施方案中,STING激动剂选自由以下组成的组:5,6-二甲基呫吨酮-4-乙酸(DMXAA)、MIW815(ADU-S100)、CRD5500或MK-1454以及在US20140341976、US20180028553、US20180230178、US9549944、WO2017106740、WO2018045204或WO2018098203中描述的任何STING激动剂,所述专利的内容以引用的方式整体并入本文。
在实施方案中,所述癌症是或涉及基底细胞癌;胆道癌;膀胱癌;骨癌;脑和中枢神经系统癌症;乳腺癌;腹膜癌;宫颈癌;绒毛膜癌;结肠和直肠癌;结缔组织癌症;消化系统癌症;子宫内膜癌;食道癌;眼癌;头颈部癌症;胃癌(包括胃肠道癌);成胶质细胞瘤;肝癌;肝细胞瘤;上皮内赘瘤;肾癌或肾脏癌;喉癌;白血病;肝癌;肺癌(例如,小细胞肺癌、非小细胞肺癌、肺腺癌和肺鳞癌);黑素瘤;骨髓瘤;成神经细胞瘤;口腔癌(嘴唇、舌、口和咽);卵巢癌;胰腺癌;前列腺癌;成视网膜细胞瘤;横纹肌肉瘤;直肠癌;呼吸系统癌症;唾液腺癌;肉瘤;皮肤癌;鳞状细胞癌;胃癌;睾丸癌;甲状腺癌;子宫或子宫内膜癌;泌尿系统癌症;外阴癌;淋巴瘤,包括霍奇金淋巴瘤和非霍奇金淋巴瘤,以及B细胞淋巴瘤(包括低级/滤泡性非霍奇金淋巴瘤(NHL);小淋巴细胞(SL)NHL;中级/滤泡性NHL;中级弥漫性NHL;高级成免疫细胞NHL;高级成淋巴细胞性NHL;高级小无裂细胞NHL;巨大肿块疾病NHL;套细胞淋巴瘤;AIDS相关淋巴瘤;和瓦尔登斯特伦氏巨球蛋白血症;慢性淋巴细胞性白血病(CLL);急性成淋巴细胞性白血病(ALL);毛细胞白血病;慢性成骨髓细胞性白血病;以及其他癌症和肉瘤;和移植后淋巴组织增生性病症(PTLD),以及与瘢痣病、水肿(如与脑肿瘤相关的水肿)和梅格斯氏综合征相关的异常血管增生。
在实施方案中,受试者患有对于包含能够结合PD-1或结合PD-1配体的抗体的治疗响应差或难治性的癌症。在实施方案中,所述癌症在用能够结合PD-1或结合PD-1配体的抗体治疗大约12周后对这种治疗响应差或无响应。在实施方案中,能够结合PD-1或结合PD-1配体的抗体选自由以下组成的组:纳武单抗(ONO-4538/BMS-936558,MDX1106,OPDIVO,BRISTOL MYERS SQUIBB)、派姆单抗(KEYTRUDA,MERCK)、西米普利单抗(REGN-2810)、MK-3475(MERCK)、BMS 936559(BRISTOL MYERS SQUIBB)、依鲁替尼(PHARMACYCLICS/ABBVIE)、阿特珠单抗(TECENTRIQ,GENENTECH)和MPDL328OA(ROCHE)。
在另一方面,本发明提供了用于治疗受试者的癌症的方法。所述方法包括向所述受试者提供包含干扰素基因刺激因子(STING)激动剂的药物组合物的步骤。在此方面,所述受试者已经进行或正在进行用免疫疗法治疗,所述免疫疗法选自:(i)异源嵌合蛋白,所述异源嵌合蛋白包含:(a)第一结构域,所述第一结构域包含PD-1的细胞外结构域的一部分,其中所述部分能够结合PD-1配体,(b)第二结构域,所述第二结构域包含GITRL的细胞外结构域的一部分,其中所述部分能够结合GITRL受体,和(c)接头,所述接头连接所述第一结构域和所述第二结构域;(ii)异源嵌合蛋白,所述异源嵌合蛋白包含:(a)第一结构域,所述第一结构域包含PD-1的细胞外结构域的一部分,其中所述部分能够结合PD-1配体,(b)第二结构域,所述第二结构域包含4-1BBL的细胞外结构域的一部分,其中所述部分能够结合4-1BBL受体,和(c)接头,所述接头连接所述第一结构域和所述第二结构域;以及(iii)异源嵌合蛋白,所述异源嵌合蛋白包含:(a)第一结构域,所述第一结构域包含PD-1的细胞外结构域的一部分,其中所述部分能够结合PD-1配体,(b)第二结构域,所述第二结构域包含CD40L的细胞外结构域的一部分,其中所述部分能够结合CD40L受体,和(c)接头,所述接头连接所述第一结构域和所述第二结构域。
在实施方案中,提供给所述受试者的药物组合物的剂量小于提供给尚未进行或未正在进行用免疫疗法治疗的受试者的药物组合物的剂量。
在实施方案中,免疫疗法包含异源嵌合蛋白,所述异源嵌合蛋白包含第一结构域,所述第一结构域基本上包含PD-1的整个细胞外结构域;和/或第二结构域,所述第二结构域基本上包含GITRL的整个细胞外结构域。
在实施方案中,免疫疗法包含异源嵌合蛋白,所述异源嵌合蛋白包含第一结构域,所述第一结构域基本上包含PD-1的整个细胞外结构域;和/或第二结构域,所述第二结构域基本上包含4-1BBL的整个细胞外结构域。
在实施方案中,免疫疗法包含异源嵌合蛋白,所述异源嵌合蛋白包含第一结构域,所述第一结构域基本上包含PD-1的整个细胞外结构域;和/或第二结构域,所述第二结构域基本上包含CD40L的整个细胞外结构域。
在实施方案中,接头是选自柔性氨基酸序列、IgG铰链区和抗体序列的多肽。
在实施方案中,接头包含至少一个能够形成二硫键的半胱氨酸残基和/或包含铰链-CH2-CH3 Fc结构域。在实施方案中,接头包含源自IgG1或IgG4例如人IgG1或人IgG4的铰链-CH2-CH3 Fc结构域。在实施方案中,接头包含与SEQ ID NO:1、SEQ ID NO:2或SEQ IDNO:3的氨基酸序列至少95%同一的氨基酸序列。
在实施方案中,异源嵌合蛋白包含:(a)包含PD-1的一部分的第一结构域,(b)包含GITRL的一部分的第二结构域,和(c)包含铰链-CH2-CH3 Fc结构域的接头;(a)包含PD-1的一部分的第一结构域,(b)包含4-1BBL的一部分的第二结构域,和(c)包含铰链-CH2-CH3 Fc结构域的接头;或(a)包含PD-1的一部分的第一结构域,(b)包含CD40L的一部分的第二结构域,和(c)包含铰链-CH2-CH3 Fc结构域的接头。
在实施方案中,STING激动剂选自由以下组成的组:5,6-二甲基呫吨酮-4-乙酸(DMXAA)、MIW815(ADU-S100)、CRD5500或MK-1454以及在US20140341976、US20180028553、US20180230178、US9549944、WO2017106740、WO2018045204或WO2018098203中描述的任何STING激动剂,所述专利的内容以引用的方式整体并入本文。
在实施方案中,所述癌症是或涉及基底细胞癌;胆道癌;膀胱癌;骨癌;脑和中枢神经系统癌症;乳腺癌;腹膜癌;宫颈癌;绒毛膜癌;结肠和直肠癌;结缔组织癌症;消化系统癌症;子宫内膜癌;食道癌;眼癌;头颈部癌症;胃癌(包括胃肠道癌);成胶质细胞瘤;肝癌;肝细胞瘤;上皮内赘瘤;肾癌或肾脏癌;喉癌;白血病;肝癌;肺癌(例如,小细胞肺癌、非小细胞肺癌、肺腺癌和肺鳞癌);黑素瘤;骨髓瘤;成神经细胞瘤;口腔癌(嘴唇、舌、口和咽);卵巢癌;胰腺癌;前列腺癌;成视网膜细胞瘤;横纹肌肉瘤;直肠癌;呼吸系统癌症;唾液腺癌;肉瘤;皮肤癌;鳞状细胞癌;胃癌;睾丸癌;甲状腺癌;子宫或子宫内膜癌;泌尿系统癌症;外阴癌;淋巴瘤,包括霍奇金淋巴瘤和非霍奇金淋巴瘤,以及B细胞淋巴瘤(包括低级/滤泡性非霍奇金淋巴瘤(NHL);小淋巴细胞(SL)NHL;中级/滤泡性NHL;中级弥漫性NHL;高级成免疫细胞NHL;高级成淋巴细胞性NHL;高级小无裂细胞NHL;巨大肿块疾病NHL;套细胞淋巴瘤;AIDS相关淋巴瘤;和瓦尔登斯特伦氏巨球蛋白血症;慢性淋巴细胞性白血病(CLL);急性成淋巴细胞性白血病(ALL);毛细胞白血病;慢性成骨髓细胞性白血病;以及其他癌症和肉瘤;和移植后淋巴组织增生性病症(PTLD),以及与瘢痣病、水肿(如与脑肿瘤相关的水肿)和梅格斯氏综合征相关的异常血管增生。
在实施方案中,受试者患有对于包含能够结合PD-1或结合PD-1配体的抗体的治疗响应差或难治性的癌症。在实施方案中,所述癌症在用能够结合PD-1或结合PD-1配体的抗体治疗大约12周后对这种治疗响应差或无响应。在实施方案中,能够结合PD-1或结合PD-1配体的抗体选自由以下组成的组:纳武单抗(ONO-4538/BMS-936558,MDX1106,OPDIVO,BRISTOL MYERS SQUIBB)、派姆单抗(KEYTRUDA,MERCK)、西米普利单抗(REGN-2810)、MK-3475(MERCK)、BMS 936559(BRISTOL MYERS SQUIBB)、依鲁替尼(PHARMACYCLICS/ABBVIE)、阿特珠单抗(TECENTRIQ,GENENTECH)和MPDL328OA(ROCHE)。
除上述方面和实施方案外,本发明还包括将上述方法与一种或多种其他抗癌疗法组合。
另一抗癌疗法可包括放射疗法。
另一抗癌疗法可以是切除癌症即肿瘤的外科手术。
另一抗癌疗法可包括基于细胞的免疫-肿瘤学疗法,例如嵌合抗原受体T细胞(CAR-T),包括其中所述CAR-T连续或响应于特定肿瘤抗原识别而分泌嵌合蛋白。
另一抗癌疗法可包括施用一种或多种化学治疗剂。
在本发明的方面和实施方案中,一种或多种化学治疗剂选自5-FU(氟尿嘧啶)、阿贝西尼、醋酸阿比特龙、阿比曲特(甲氨蝶呤)、白蛋白结合型紫杉醇(紫杉醇白蛋白稳定的纳米颗粒制剂)、ABVD、ABVE、ABVE-PC、AC、阿卡卢替尼(Acalabrutinib)、AC-T、ADE、阿霉素(多柔比星)、二马来酸阿法替尼、Afinitor(依维莫司)、Afinitor Difsperz(依维莫司)、Akynzeo(奈妥吡坦和帕洛诺司琼)、艾特乐(咪喹莫特)、阿地白介素、Alecensa(阿雷替尼)、阿雷替尼、爱宁达(培美曲塞)、Aliqopa(盐酸考泮利司)、爱克兰(美法仑)、阿乐喜(盐酸帕洛诺司琼)、Alunbrig(布加替尼)、氯氨布西(苯丁酸氮芥)、氯氨巴锡(苯丁酸氮芥)、氨磷汀、氨基乙酰丙酸、阿那曲唑、阿瑞匹坦、阿可达(帕米膦酸盐)、瑞宁得(阿那曲唑)、阿诺新(依西美坦)、阿伦恩(奈拉滨)、三氧化二砷、天冬酰胺酶菊欧文氏菌、西罗来塞-阿卡他近(Axicabtagene Ciloleucel)、阿西替尼、阿扎胞苷、BEACOPP、卡氮芥(卡莫司汀)、Beleodaq(贝利司他)、贝利司他、盐酸苯达莫司汀、BEP、贝沙罗汀、比卡鲁胺、BiCNU(卡莫司汀)、Blenoxane(博来霉素)、硼替佐米、Bosulif(博舒替尼)、博舒替尼、布加替尼、BuMel、白消安、白舒非(白消安)C、卡巴他赛、Cabometyx(卡博替尼)、S-苹果酸卡博替尼、CAF、Calquence(阿卡卢替尼)、Camptosar(盐酸伊立替康)、卡培他滨、CAPOX、Caprelsa(凡德他尼)、Carac(氟尿嘧啶-局部)、卡铂、卡铂-紫杉酚、卡非佐米、Carmubris(卡莫司汀)、卡莫司汀、康士得(比卡鲁胺)、CeeNU(洛莫司汀)、CEM、色瑞替尼、Cerubidine(道诺霉素)、希瑞适(重组HPV二价疫苗)、CEV、瘤可宁、瘤可宁-泼尼松、CHOP、顺铂、克拉屈滨、Clafen(环磷酰胺)、氯法拉滨、Clofarex(氯法拉滨)、科罗拉(氯法拉滨)、CMF、考比替尼、Cometriq(卡博替尼)、盐酸考泮利司、COPDAC、COPP、COPP-ABV、Cosmegen(更生霉素)、Cotellic(考比替尼)、克唑替尼、CVP、环磷酰胺、Cyfos(异环磷酰胺)、阿糖孢苷、阿糖胞苷脂质体、赛德萨-U(阿糖孢苷)、癌得星(环磷酰胺)、癌得星(癌得星)、达拉菲尼、达卡巴嗪、达克金(地西他滨)、更生霉素、达沙替尼、盐酸柔红霉素、盐酸柔红霉素和阿糖胞苷脂质体、DaunoXome(道诺霉素脂质体复合物)、Decadron(地塞米松)、地西他滨、去纤苷酸钠、Defitelio(去纤苷酸钠)、地加瑞克、地尼白介素-毒素连接物、DepoCyt(阿糖胞苷脂质体)、地塞米松、地塞米松浓缩口服液(地塞米松)、Dexpak Taperpak(地塞米松)、盐酸右雷佐生、Docefrez(多西他赛)、多西他赛、Doxil(盐酸阿霉素脂质体)、盐酸阿霉素、盐酸阿霉素脂质体、Dox-SL(盐酸阿霉素脂质体)、Droxia(羟基脲)、DTIC(达卡巴嗪)、DTIC-Dome(达卡巴嗪)、Efudex(氟尿嘧啶—局部)、Eligard(亮丙瑞林Leuprolide)、埃立特(拉布立酶)、Ellence(Ellence(表阿霉素))、乐沙定(奥沙利铂)、Elspar(天冬酰胺酶)、艾曲波帕乙醇胺、Emcyt(雌莫司汀)、Emend(阿瑞匹坦)、甲磺酸依那德尼、恩扎鲁胺、盐酸表阿霉素、EPOCH、甲磺酸艾日布林、Erivedge(维莫德吉)、盐酸埃罗替尼、Erwinaze(天冬酰胺酶菊欧文氏菌)、Ethyol(氨磷汀)、凡毕复(磷酸依托泊苷)、依托泊苷、磷酸依托泊苷、Eulexin(氟他胺)、Evacet(盐酸阿霉素脂质体)、依维莫司、易维特(盐酸雷洛昔芬)、Evomela(盐酸美法仑)、依西美坦、法乐通(托瑞米芬)、Farydak(帕比司他)、Faslodex(氟维司群)、FEC、Femara(来曲唑)、非格司亭、Firmagon(地加瑞克)、FloPred(泼尼松龙)、福达华(氟达拉滨)、磷酸氟达拉滨、Fluoroplex(氟尿嘧啶)、氟尿嘧啶、氟他胺、Folex(甲氨蝶呤)、Folex PFS(甲氨蝶呤)、FOLFIRI、FOLFIRINOX、FOLFOX、弗洛泰(普拉曲沙)、FUDR(FUDR(氟尿苷))、FU-LV、氟维司群、加德西(重组HPV四价疫苗)、加德西9(重组HPV九价疫苗)、吉非替尼、盐酸吉西他滨、吉西他滨-顺铂、吉西他滨-奥沙利铂、健择(吉西他滨)、吉泰瑞(二马来酸阿法替尼)、吉泰瑞(阿法替尼)、格列卫(甲磺酸伊马替尼)、Gliadel(卡莫司汀)、羧肽酶、醋酸戈舍瑞林、Halaven(甲磺酸艾日布林)、Hemangeol(盐酸普萘洛尔)、克瘤灵(六甲蜜胺)、重组HPV二价疫苗、重组HPV九价疫苗、重组HPV四价疫苗、Hycamtin(盐酸拓扑替康)、Hycamtin(拓扑替康)、Hydrea(羟基脲)、羟基脲、Hyper-CVAD、Ibrance(帕博西尼)、依鲁替尼、ICE、Iclusig(帕纳替尼)、Idamycin PFS(伊达比星)、盐酸伊达比星、艾代拉里斯、Idhifa(依那德尼)、Ifex(异环磷酰胺)、异环磷酰胺、Ifosfamidum(异环磷酰胺)、甲磺酸伊马替尼、Imbruvica(依鲁替尼)、咪喹莫特、Imlygic(拉他莫金冻干混悬剂)、Inlyta(阿西替尼)、易瑞沙(吉非替尼)、盐酸伊立替康、盐酸伊立替康脂质体、Istodax(罗米地辛)、伊沙匹隆、柠檬酸艾沙佐米、Ixempra(伊沙匹隆)、Jakafi(磷酸鲁索替尼)、Jakafi(鲁索替尼)、JEB、Jevtana(卡巴他赛)、Keoxifene(盐酸雷洛西芬)、Kepivance(帕利夫明)、Kisqali(瑞博西尼)、Kyprolis(卡非佐米)、醋酸兰瑞肽、Lanvima(乐伐替尼)、二甲苯磺酸拉帕替尼、来那度胺、甲磺酸乐伐替尼、Lenvima(甲磺酸乐伐替尼)、来曲唑、亚叶酸钙、瘤可宁(苯丁酸氮芥)、Leukine(沙格司亭)、醋酸亮丙瑞林、Leustatin(克拉屈滨)、Levulan(氨基乙酰丙酸)、Linfolizin(苯丁酸氮芥)、LipoDox(盐酸阿霉素脂质体)、洛莫司汀、Lonsurf(曲氟尿苷和地匹福林)、利普安(亮丙瑞林)、Lynparza(奥拉帕尼)、Lysodren(米托坦)、Marqibo(硫酸长春新碱脂质体)、Marqibo药盒(长春新碱脂质体复合物)、甲基苄肼(丙卡巴肼)、盐酸氮芥、梅格施(甲地孕酮)、醋酸甲地孕酮、Mekinist(曲美替尼)、美法仑、盐酸美法仑、巯嘌呤、Mesnex(美司钠)、Metastron(氯化锶-89)、Methazolastone(替莫唑胺)、甲氨蝶呤、甲氨蝶呤LPF(甲氨蝶呤)、溴化甲基纳曲酮、Mexate(甲氨蝶呤)、Mexate-AQ(甲氨蝶呤)、米哚妥林、丝裂霉素C、盐酸米托蒽醌、Mitozytrex(丝裂霉素C)、MOPP、Mostarina(泼尼莫司汀)、Mozobil(普乐沙福)、Mustargen(氮芥)、Mutamycin(丝裂霉素)、马勒兰(白消安)、Mylosar(阿扎胞苷)、纳米颗粒紫杉醇(紫杉醇白蛋白稳定化的纳米颗粒制剂)、诺维苯(长春瑞滨)、奈拉滨、Neosar(环磷酰胺)、马来酸来那替尼、Nerlynx(来那替尼)、盐酸奈普坦和帕洛诺司琼、Neulasta(非格司亭)、Neulasta(培非格司亭)、优保津(非格司亭)、Nexavar(索拉非尼)、Nilandron(尼鲁米特)、尼罗替尼、尼鲁米特、Ninlaro(艾沙佐米)、Nipent(喷司他丁)、甲苯磺酸尼拉帕尼一水合物、诺瓦得士(他莫苷芬)、Novantrone(米托蒽醌)、Nplate(罗米司亭)、Odomzo(索尼德吉)、OEPA、OFF、奥拉帕尼、高三尖杉酯碱、Oncaspar(培门冬酶)、Oncovin(长春新碱)、盐酸昂丹司琼、Onivyde(盐酸伊立替康脂质体)、Ontak(地尼白介素-毒素连接物)、Onxol(紫杉醇)、OPPA、Orapred(泼尼松龙)、奥希替尼、奥沙利铂、紫杉醇、紫杉醇白蛋白稳定化的纳米颗粒制剂、PAD、帕博西尼、帕利夫明、盐酸帕洛诺司琼、盐酸帕洛诺司琼和奈妥吡坦、帕米膦酸二钠、帕比司他、Panretin(阿利维A酸)、Paraplat(卡铂)、盐酸帕唑帕尼、PCV、PEB、Pediapred(泼尼松龙)、培门冬酶、培非格司亭、培美曲塞二钠、Platinol(顺铂)、PlatinolAQ(顺铂)、普乐沙福、Pomalyst(泊马度胺)、盐酸帕纳替尼、普拉曲沙、泼尼松、盐酸丙卡巴肼、Proleukin(阿地白介素)、Promacta(艾曲波帕乙醇胺)、盐酸普萘洛尔、Purinethol(巯基嘌呤)、Purixan(巯基嘌呤)、二氯化镭223、盐酸雷洛昔芬、拉布立酶、R-CHOP、R-CVP、Reclast(唑来膦酸)、重组人乳头瘤病毒(HPV)二价疫苗、重组人乳头瘤病毒(HPV)九价疫苗、重组人乳头瘤病毒(HPV)四价疫苗、瑞戈非尼、Relistor(溴化甲基纳曲酮)、R-EPOCH、Revlimid(来那度胺)、Rheumatrex(甲氨蝶呤)、瑞博西尼、R-ICE、盐酸罗拉吡坦、罗米地辛、罗米司亭、Rubex(阿霉素)、红比霉素(盐酸柔红霉素)、Rubraca(卢卡帕尼)、樟脑磺酸卢卡帕尼、磷酸鲁索替尼、Rydapt(米哚妥林)、善宁(奥曲肽)、善宁LAR储库(奥曲肽)、Sclerosol胸膜内气雾剂(滑石)、Soltamox(他莫苷芬)、索马杜林储库(醋酸兰瑞肽)、索尼德吉、甲苯磺酸索拉非尼、Sprycel(达沙替尼)、STANFORD V、Sterapred(泼尼松)、Sterapred DS(泼尼松)、无菌滑石粉末(滑石)、Steritalc(滑石)、Sterecyst(泼尼莫司汀)、Stivarga(瑞戈非尼)、苹果酸舒尼替尼、Supprelin LA(组氨瑞林)、索坦(苹果酸舒尼替尼)、索坦(舒尼替尼)、Synribo(高三尖杉酯碱)、Tabloid(硫鸟嘌呤)、TAC、Tafinlar(达拉菲尼)、Tagrisso(奥希替尼)、滑石、拉他莫金冻干混悬剂、柠檬酸他莫昔芬、Tarabine PFS(阿糖孢苷)、特罗凯(埃罗替尼)、Targretin(贝沙罗汀)、Tasigna(达卡巴嗪)、Tasigna(尼罗替尼)、泰素(紫杉醇)、泰素帝(Docetaxel)、Temodar(替莫唑胺)、替莫唑胺、西罗莫司、Tepadina(噻替派)、沙利度胺、Thalomid(沙利度胺)、TheraCysBCG(BCG)、硫鸟嘌呤、Thioplex(噻替派)、噻替派、TICE BCG(BCG)、Tisagenlecleucel、Tolak(氟尿嘧啶—局部)、Toposar(依托泊苷)、盐酸拓扑替康、托瑞米芬、Torisel(西罗莫司)、Totect(盐酸右雷佐生)、TPF、曲贝替定、曲美替尼、Treanda(盐酸苯达莫司汀)、Trelstar(曲普瑞林)、Trexall(甲氨蝶呤)、盐酸曲氟尿苷和地匹福林、Trisenox(三氧化二砷)、Tykerb(拉帕替尼)、尿苷三乙酸酯、VAC、戊柔比星、Valstar(膀胱内戊柔比星)、Valstar(戊柔比星)、VAMP、凡德他尼、Vantas(组氨瑞林)、Varubi(罗拉吡坦)、VeIP、Velban(长春花碱)、万珂(硼替佐米)、Velsar(硫酸长春碱)、威罗菲尼、Venclexta(维奈托克)、凡毕士(依托泊苷)、Verzenio(阿贝西尼)、Vesanoid(维甲酸)、Viadur(醋酸亮丙瑞林)、Vidaza(阿扎胞苷)、硫酸长春碱、Vincasar PFS(长春新碱)、Vincrex(长春新碱)、硫酸长春新碱、硫酸长春新碱脂质体、酒石酸长春瑞滨、VIP、维莫德吉、Vistogard(尿苷三乙酸酯)、Voraxaze(羧肽酶)、伏立诺他、Votrient(帕唑帕尼)、Vumon(替尼泊苷)、Vyxeos(盐酸柔红霉素和阿糖胞苷脂质体)、W,Wellcovorin(亚叶酸钙)、Wellcovorin IV(亚叶酸)、Xalkori(克唑替尼)、XELIRI、希罗达(卡培他滨)、XELOX、Xofigo(二氯化镭223)、Xtandi(恩杂鲁胺)、Yescarta(西罗来塞-阿卡他近)、Yondelis(曲贝替定)、Zaltrap(Ziv-阿柏西普)、Zanosar(链脲菌素)、Zarxio(非格司亭)、Zejula(尼拉帕尼)、Zelboraf(威罗菲尼)、Zinecard(盐酸右雷佐生)、Ziv-阿柏西普、枢复宁(盐酸昂丹司琼)、诺雷德(戈舍瑞林)、唑来膦酸、Zolinza(伏立诺他)、择泰(唑来膦酸)、Zortress(依维莫司)、Zydelig(艾代拉里斯)、Zykadia(色瑞替尼)、Zytiga(醋酸阿比特龙)以及Zytiga(阿比特龙)。
在实施方案中,在本文所公开的本发明的方法中使用的针对免疫检查点分子的任何抗体(例如,能够结合CTLA-4的任何抗体)、STING激动剂和/或异源嵌合蛋白可与本文所公开的任何抗癌疗法组合使用。
在实施方案中,在本文所公开的本发明的方法中使用的针对免疫检查点分子的任何抗体(例如,能够结合CTLA-4的任何抗体)、STING激动剂和/或异源嵌合蛋白当与另一种抗癌疗法(例如,放射疗法和/或化学治疗剂)共同施用时协同作用;从而使得例如另一抗癌疗法以比当将另一抗癌疗法用作单一疗法时通常采用的剂量更低的剂量来施用。在实施方案中,如本文所公开的异源嵌合蛋白使共同施用的抗癌疗法的施用次数减少。
在本发明的方面和实施方案中,需要包括如本文所公开的在本发明的方法中使用的针对免疫检查点分子(例如,CTLA-4)的抗体、STING激动剂和/或异源嵌合蛋白的癌症治疗的患者对或被预测为对免疫疗法,例如,如本文所公开的抗癌免疫疗法响应差或无响应。此外,在实施方案中,需要如本文所公开的抗癌剂的患者被或可被预测为对免疫检查点免疫疗法响应差或无响应。免疫检查点分子可选自PD-1、PD-L1、PD-L2、ICOS、ICOSL和CTLA-4。此外,在实施方案中,需要如本文所公开的抗癌剂的患者被或可被预测对针对表皮生长因子受体(EGFR)、人表皮生长因子受体2(Her2)和CD20中的一者或多者的疗法响应差或无响应。
在实施方案中,在本文公开的本发明的方法中使用的针对免疫检查点分子(例如,CTLA-4)的任何抗体、STING激动剂和/或异源嵌合蛋白(和/或另外的剂)包括经修饰的衍生物,即通过将任何类型的分子共价连接至组合物,以使得共价连接不会阻止所述组合物的活性。例如但不限于,衍生物包括已经尤其通过例如糖基化、脂化、乙酰化、聚乙二醇化、磷酸化、酰胺化、通过已知的保护/封闭基团进行的衍生化、蛋白水解裂解、与细胞配体或其他蛋白质连接等进行修饰的组合物。可通过已知技术,包括但不限于特异性化学裂解、乙酰化、甲酰化、衣霉素的代谢合成等来进行任何多种化学修饰。另外,衍生物可含有一种或多种非经典氨基酸。在其他实施方案中,在本文公开的本发明方法中使用的针对免疫检查点分子(例如,CTLA-4)的抗体、STING激动剂和/或异源嵌合蛋白(和/或另外的剂)还包含细胞毒性剂,在说明性实施方案中,所述细胞毒性剂包括毒素、化学治疗剂、放射性同位素和引起细胞凋亡或细胞死亡的剂。此类剂可与本文公开的组合物缀合。
在本文公开的本发明方法中使用的针对免疫检查点分子(例如,CTLA-4)的抗体、STING激动剂和/或异源嵌合蛋白(和/或其他抗癌疗法)因此可进行翻译后修饰以增加效应部分(如化学接头)、可检测部分(例如像荧光染料、酶、底物、生物发光物质、放射性物质和化学发光部分)或功能部分(例如像链霉亲和素、亲和素、生物素、细胞毒素、细胞毒性剂和放射性物质)。
在本发明的方面和实施方案中,需要治疗炎症性疾病或病症的患者已用、同时用或随后用另一种用于治疗炎症性疾病或病症的药物进行治疗。此类其他剂的实例包括类固醇抗炎剂、非类固醇抗炎剂(NSAID)和/或免疫抑制药物。
NSAID的实例包括水杨酸、乙酰水杨酸、水杨酸甲酯、水杨酸乙二醇酯、水杨酰胺、苄基-2,5-二乙酰氧基苯甲酸、布洛芬、富林达克、萘普生、酮洛芬、依托芬那酯、苯基丁氮酮和吲哚美辛。
类固醇抗炎剂的实例包括选自以下的皮质类固醇:羟基曲安西龙、α-甲基地塞米松、β-甲基倍他米松、二丙酸倍氯米松、苯甲酸倍他米松、二丙酸倍他米松、戊酸倍他米松、戊酸氯倍他索、地奈德、去氧米松、地塞米松、二醋酸双氟拉松、戊酸双氟可龙、氟氢缩松、氟氯缩松、新戊酸氟米松、肤轻松醋酸酯、肤轻松、氟科丁丁酯、氟可龙、醋酸氟泼尼定、氟氢缩松、哈西奈德、醋酸氢化可的松、丁酸氢化可的松、甲基泼尼松、曲安奈德、可的松、可托多松、肤轻松、氟氢可的松、双醋酸双氟若松、氟轻可舒松奈德、甲羟松、安西那非、安西非特、倍他米松及其平衡酯、氯泼尼松、氯可托龙、地西龙、二氯松、二氟泼尼酯、氟二氯松、氟尼缩松、氟米龙、氟培龙、氟泼尼龙、氢化可的松、甲泼尼松、帕拉米松、泼尼松龙、泼尼松、二丙酸倍氯米松。
类固醇抗炎剂同样可具有作为免疫抑制药物的活性。
免疫抑制药物的其他实例包括细胞抑制剂如烷化剂、抗代谢物(例如,硫唑嘌呤、甲氨蝶呤)、细胞毒性抗生素、抗体(例如,巴利昔单抗、达克珠单抗和莫罗单抗)、抗免疫球蛋白(例如,环孢霉素、他克莫司、西罗莫司)、干扰素、阿片类药物、TNF结合蛋白、霉酚酸酯和小型生物剂(例如,芬戈莫德、多球壳菌素)。
在实施方案中,需要用于治疗自身免疫性疾病或病症的剂的患者已用、同时用或随后用如本文其他地方所公开的类固醇抗炎剂、非类固醇抗炎剂和/或免疫抑制药物治疗。
在实施方案中,在本文公开的本发明的方法中使用的针对免疫检查点分子(例如,CTLA-4)的任何抗体、STING激动剂和/或异源嵌合蛋白(和/或用于治疗炎症性疾病或病症的其他剂)包括经修饰的衍生物,即通过将任何类型的分子共价连接至组合物,以使得共价连接不会阻止所述组合物的活性。例如但不限于,衍生物包括已尤其通过糖基化、脂化、乙酰化、聚乙二醇化、磷酸化、酰胺化、通过已知的保护/封闭基团衍生化、蛋白水解裂解、与细胞配体或其他蛋白质连接等进行了修饰的组合物。可通过已知技术进行多种化学修饰中的任一种,包括但不限于特异性化学裂解、乙酰化、甲酰化、衣霉素的代谢合成等。此外,所述衍生物可含有一种或多种非经典氨基酸。
在本文公开的本发明方法中使用的针对免疫检查点分子(例如,CTLA-4)的抗体、STING激动剂和/或异源嵌合蛋白(和/或用于治疗炎症性疾病或病症的其他剂)因此可进行翻译后修饰以增加效应部分(如化学接头)、可检测部分(例如像荧光染料、酶、底物、生物发光物质、放射性物质和化学发光部分)或功能部分(例如像链霉亲和素、亲和素、生物素、细胞毒素、细胞毒性剂和放射性物质)。
药物组合物
本发明的方法包括施用药物组合物,所述药物组合物包含治疗有效量的在如本文所公开的本发明的方法中使用的至少一种针对免疫检查点分子(例如,CTLA-4)的抗体、STING激动剂和/或异源嵌合蛋白。
在本文所公开的本发明的方法中使用的针对免疫检查点分子(例如,CTLA-4)的抗体、STING激动剂和/或异源嵌合蛋白(和/或另外的剂)可具有可与无机或有机酸反应的足够碱性的官能团,或可与无机碱或有机碱反应的羧基,以形成药学上可接受的盐。如本领域众所周知的,药学上可接受的酸加成盐由药学上可接受的酸形成。此类盐包括例如在Journal of Pharmaceutical Science,66,2-19(1977)和The Handbook ofPharmaceutical Salts;Properties,Selection,and Use.P.H.Stahl和C.G.Wermuth(编著),Verlag,Zurich(Switzerland)2002中列出的药学上可接受的盐,所述文献特此以引用的方式整体并入。
在实施方案中,本文公开的组合物呈药学上可接受的盐的形式。
此外,在本文所公开的本发明的方法中使用的针对免疫检查点分子(例如,CTLA-4)的任何抗体、STING激动剂和/或异源嵌合蛋白(和/或另外的剂)可作为包含药学上可接受的载体或媒介物的组合物,例如药物组合物的组分施用于受试者。此类药物组合物可任选地包含适合的量的药学上可接受的赋形剂以便提供用于适当施用的形式。药物赋形剂可为液体,如水和油,包括石油、动物、植物或者合成来源的那些,如花生油、大豆油、矿物油、芝麻油等。药物赋形剂可例如是盐水、阿拉伯树胶、明胶、淀粉糊、滑石、角蛋白、硅胶、尿素等。此外,可使用助剂、稳定剂、增稠剂、润滑剂和着色剂。在实施方案中,当施用给受试者时,药学上可接受的赋形剂是无菌的。当静脉内施用本文公开的任何剂时,水是有用的赋形剂。盐溶液和葡萄糖水溶液以及甘油溶液也可用作液体赋形剂,特别是对于可注射的溶液。适合的药物赋形剂还包括淀粉、葡萄糖、乳糖、蔗糖、明胶、麦芽、大米、面粉、白垩、硅胶、硬脂酸钠、单硬脂酸甘油酯、滑石、氯化钠、脱脂乳粉、甘油、丙烯、乙二醇、水,乙醇等。如果需要,本文公开的任何剂还可包含少量的润湿剂或乳化剂或pH缓冲剂。
在实施方案中,将本文公开的组合物,例如药物组合物重悬于盐水缓冲液(包括但不限于TBS、PBS等)中。
在实施方案中,在本发明的方法中使用的针对免疫检查点分子(例如,CTLA-4)的抗体、STING激动剂和/或异源嵌合蛋白可通过与另一种剂缀合和/或融合来延长半衰期或以其他方式改善药效学和药代动力学性质。在实施方案中,在本发明的方法中使用的针对免疫检查点分子(例如,CTLA-4)的抗体、STING激动剂和/或异源嵌合蛋白可与PEG、XTEN(例如,作为rPEG)、聚唾液酸(POLYXEN)、白蛋白(例如,人血清白蛋白或HAS)、弹性蛋白样蛋白(ELP)、PAS、HAP、GLK、CTP、转铁蛋白等中的一者或多者融合或缀合。在实施方案中,每种单独的嵌合蛋白与BioDrugs(2015)29:215–239中描述的一种或多种剂融合,所述文献的全部内容特此以引用的方式并入。
本发明包括在药物组合物的各种制剂中的在本发明的方法中使用的针对免疫检查点分子(例如,CTLA-4)的任何抗体、STING激动剂和/或异源嵌合蛋白,所述制剂可采取溶液、悬浮液、乳液、滴剂、片剂、丸剂、小丸、胶囊、含液体的胶囊、粉末剂、持续释放制剂、栓剂、乳液、气雾剂、喷雾剂、悬浮液的形式,或任何其他适合使用的形式。也可使用编码蛋白质序列的DNA或RNA构建体。在实施方案中,所述组合物呈胶囊的形式(参见例如,美国专利号5,698,155)。合适的药物赋形剂的其他实例描述于Remington’sPharmaceuticalSciences 1447-1676(Alfonso R.Gennaro编著,第19版1995)中,所述文献以引用的方式并入本文。
必要时,包含在本发明的方法中使用的针对免疫检查点分子(例如,CTLA-4)的抗体、STING激动剂和/或异源嵌合蛋白(和/或另外的剂)的药物组合物还可包含增溶剂。此外,可用本领域已知的合适的媒介物或递送装置来递送剂。本文概述的组合疗法可在单一递送媒介物或递送装置中共同递送。用于施用的组合物可任选地包含局部麻醉剂,例如像利多卡因,以减轻注射部位的疼痛。
包含在本发明的方法中使用的针对免疫检查点分子(例如,CTLA-4)的抗体、STING激动剂和/或异源嵌合蛋白(和/或另外的剂)的药物组合物可方便地以单位剂型存在,并且可通过药学领域公知的任何方法来制备。此类方法一般包括将治疗剂结合于由一种或多种附加成分所构成的载体的步骤。通常,通过将治疗剂与液体载体、细分的固体载体或两者均匀且紧密地结合在一起,然后如果需要,将产品成型为所需制剂的剂型(例如,湿或干法制粒、粉末共混物等,然后使用本领域已知的常规方法压片)来制备药物组合物。
在实施方案中,在本文所公开的本发明的方法中使用的针对免疫检查点分子(例如,CTLA-4)的任何抗体、STING激动剂和/或异源嵌合蛋白(和/或另外的剂)根据常规程序配制为适合于本文所公开的施用模式的药物组合物。
施用、给药和治疗方案
施用途径包括例如:皮内、肿瘤内、肌肉内、腹膜内、静脉内、皮下、鼻内、硬膜外、口服、舌下、鼻内、脑内、阴道内、经皮、直肠、通过吸入或局部,特别是施用至耳、鼻、眼或皮肤。
作为实例,施用使得在本文公开的本发明的方法中使用的针对免疫检查点分子(例如,CTLA-4)的抗体、STING激动剂和/或异源嵌合蛋白(和/或另外的剂)(经由肠内或肠胃外施用)释放到血流中,或者在本发明的方法中使用的针对免疫检查点分子(例如,CTLA-4)的抗体、STING激动剂和/或异源嵌合蛋白(和/或另外的剂)直接施用至活动性疾病的部位。
在本文所公开的本发明的方法中使用的针对免疫检查点分子(例如,CTLA-4)的任何抗体、STING激动剂和/或异源嵌合蛋白(和/或另外的剂)可口服施用。在本文公开的本发明的方法中使用的此类针对免疫检查点分子(例如,CTLA-4)的抗体、STING激动剂和/或异源嵌合蛋白(和/或另外的剂)还可通过任何其他方便的途径施用,例如通过静脉内输注或快速浓注、通过经上皮或粘膜皮肤衬层(例如口腔粘膜、直肠和肠粘膜等)吸收,并且可与另外的生物活性剂一起施用。施用可以是系统的或局部的。不同递送系统是已知的,例如包封在脂质体、微粒、微胶囊、胶囊等中,并且可用于施用。
在具体实施方案中,向需要治疗的区域局部施用可为希望的。在实施方案中,例如在癌症的治疗中,在本发明的方法中使用的针对免疫检查点分子(例如,CTLA-4)的抗体、STING激动剂和/或异源嵌合蛋白(和/或另外的剂)施用在肿瘤微环境(例如,围绕和/或喂养肿瘤细胞的细胞、分子、细胞外基质和/或血管,包括例如肿瘤血管系统;肿瘤浸润淋巴细胞;成纤维细胞网状细胞;内皮祖细胞(EPC);癌症相关的成纤维细胞;周细胞;其他基质细胞;细胞外基质(ECM)的组分;树突细胞;抗原呈递细胞;T细胞;调控性T细胞;巨噬细胞;嗜中性粒细胞;以及位于肿瘤近端的其他免疫细胞)或淋巴结中和/或靶向肿瘤微环境或淋巴结。在实施方案中,例如在癌症的治疗中,在本发明的方法中使用的针对免疫检查点分子(例如,CTLA-4)的抗体、STING激动剂和/或异源嵌合蛋白(和/或另外的剂)通过肿瘤内施用。
在实施方案中,在本发明的方法中使用的针对免疫检查点分子(例如,CTLA-4)的抗体、STING激动剂和/或异源嵌合蛋白允许双重作用,其与常规免疫疗法(例如,用OPDIVO、KEYTRUDA、YERVOY和TECENTRIQ中的一者或多者进行治疗)情况下观察到的相比提供较少副作用。例如,在本发明的方法中使用的针对免疫检查点分子(例如,CTLA-4)的抗体、STING激动剂和/或异源嵌合蛋白减少或预防通常观察到的免疫相关的不良事件,所述不良事件影响各种组织和器官,包括皮肤、胃肠道、肾脏、外周和中枢神经系统、肝脏、淋巴结、眼睛、胰腺和内分泌系统;如垂体炎、结肠炎、肝炎、肺炎、皮疹和风湿病。此外,本发明的局部施用(例如肿瘤内)消除了用于常规免疫疗法(例如,用OPDIVO、KEYTRUDA、YERVOY和TECENTRIQ中的一者或多者进行治疗)的标准全身施用(例如IV输注)情况下所观察到的不良事件。
适用于肠胃外施用(例如,静脉内、肌内、腹膜内、皮下和关节内注射和输注)的剂型包括例如溶液、悬浮液、分散液、乳液等。它们也可以无菌固体组合物(例如冻干组合物)的形式制造,所述无菌固体组合物可在使用前立即溶解或悬浮于无菌可注射介质中。它们可含有例如本领域已知的悬浮剂或分散剂。
在本文所公开的本发明的方法中使用的针对免疫检查点分子(例如,CTLA-4)的任何抗体、STING激动剂和/或异源嵌合蛋白(和/或另外的剂)的剂量以及给药方案可取决于各种参数,包括但不限于所治疗的疾病、受试者的总体健康状况以及施用医师的判断。可在向有需要的受试者施用另外的剂之前(例如,之前5分钟、15分钟、30分钟、45分钟、1小时、2小时、4小时、6小时、12小时、24小时、48小时、72小时、96小时、1周、2周、3周、4周、5周、6周、8周或12周)、同时、或之后(例如,之后5分钟、15分钟、30分钟、45分钟、1小时、2小时、4小时、6小时、12小时、24小时、48小时、72小时、96小时、1周、2周、3周、4周、5周、6周、8周或12周)施用在本文所公开的本发明的方法中使用的针对免疫检查点分子(例如,CTLA-4)的任何抗体、STING激动剂和/或异源嵌合蛋白。
在实施方案中,在本发明的方法中使用的针对免疫检查点分子(例如,CTLA-4)的抗体、STING激动剂和/或异源嵌合蛋白和一种或多种另外的剂间隔1分钟、间隔10分钟、间隔30分钟、间隔小于1小时、间隔1小时、间隔1小时至2小时、间隔2小时至3小时、间隔3小时至4小时、间隔4小时至5小时、间隔5小时至6小时、间隔6小时至7小时、间隔7小时至8小时、间隔8小时至9小时、间隔9小时至10小时、间隔10小时至11小时、间隔11小时至12小时、间隔1天、间隔2天、间隔3天、间隔4天、间隔5天、间隔6天、间隔1周、间隔2周、间隔3周或间隔4周施用。
在一些实施方案中,本发明涉及诱导先天性免疫响应的在本发明的方法中使用的针对免疫检查点分子的抗体、STING激动剂和/或异源嵌合蛋白和诱导适应性免疫响应的在本发明的方法中使用的针对免疫检查点分子的抗体、STING激动剂和/或异源嵌合蛋白的共同施用。在此类实施方案中,诱导先天性免疫响应的在本发明的方法中使用的针对免疫检查点分子(例如,CTLA-4)的抗体、STING激动剂和/或异源嵌合蛋白可在施用诱导适应性免疫响应的在本发明的方法中使用的针对免疫检查点分子(例如,CTLA-4)的抗体、STING激动剂和/或异源嵌合蛋白之前、同时或之后施用。例如,在本发明的方法中使用的针对免疫检查点分子(例如,CTLA-4)的抗体、STING激动剂和/或异源嵌合蛋白可间隔1分钟、间隔10分钟、间隔30分钟、间隔小于1小时、间隔1小时、间隔1小时至2小时、间隔2小时至3小时、间隔3小时至4小时、间隔4小时至5小时、间隔5小时至6小时、间隔6小时至7小时、间隔7小时至8小时、间隔8小时至9小时、间隔9小时至10小时、间隔10小时至11小时、间隔11小时至12小时、间隔1天、间隔2天、间隔3天、间隔4天、间隔5天、间隔6天、间隔1周、间隔2周、间隔3周或间隔4周施用。在说明性实施方案中,诱导先天性免疫响应的在本发明的方法中使用的针对免疫检查点分子(例如,CTLA-4)的抗体、STING激动剂和/或异源嵌合蛋白和诱导适应性响应的在本发明的方法中使用的针对免疫检查点分子(例如,CTLA-4)的抗体、STING激动剂和/或异源嵌合蛋白间隔1周施用,或每隔一周施用(即,诱导先天性免疫响应的在本发明的方法中使用的针对免疫检查点分子(例如,CTLA-4)的抗体、STING激动剂和/或异源嵌合蛋白的施用在诱导适应性响应的在本发明的方法中使用的针对免疫检查点分子(例如,CTLA-4)的抗体、STING激动剂和/或异源嵌合蛋白的施用1周后,如此等等)。
在本文所公开的本发明的方法中使用的针对免疫检查点分子(例如,CTLA-4)的任何抗体、STING激动剂和/或异源嵌合蛋白(和/或另外的剂)的剂量可取决于若干因素,包括疾患的严重程度、是要治疗还是预防所述疾患以及待治疗受试者的年龄、体重和健康状况。另外,关于特定受试者的药物基因组学(基因型对治疗剂的药物动力学、药效学或功效分布的影响)信息可影响所用剂量。此外,可根据多种因素稍微调整精确的单个剂量,所述因素包括所施用的剂的特定组合、施用时间、施用途径、制剂的性质、排泄速率、所治疗的特定疾病、病症的严重程度以及病症的解剖学位置。可预期一些剂量的变化。
关于在本文所公开的本发明的方法中使用的针对免疫检查点分子(例如,CTLA-4)的任何抗体、STING激动剂和/或异源嵌合蛋白(和/或另外的剂)的施用,剂量可以是每天约0.1mg至约250mg、每天约1mg至约20mg或每天约3mg至约5mg。通常,当口服或肠胃外施用时,本文公开的任何剂的剂量可以是每天约0.1mg至约1500mg、或每天约0.5mg至约10mg、或每天约0.5mg至约5mg、或每天约200至约1,200mg(例如,每天约200mg、约300mg、约400mg、约500mg、约600mg、约700mg、约800mg、约900mg、约1,000mg、约1,100mg、约1,200mg)。
在实施方案中,在本文公开的本发明的方法中使用的针对免疫检查点分子(例如,CTLA-4)的抗体、STING激动剂和/或异源嵌合蛋白(和/或另外的剂)的施用是通过肠胃外注射以每次治疗约0.1mg至约1500mg、或每次治疗约0.5mg至约10mg、或每次治疗约0.5mg至约5mg、或每次治疗约200至约1,200mg(例如,每次治疗约200mg、约300mg、约400mg、约500mg、约600mg、约700mg、约800mg、约900mg、约1,000mg、约1,100mg、约1,200mg)的剂量进行。
在实施方案中,在本发明的方法中使用的针对免疫检查点分子(例如,CTLA-4)的抗体、STING激动剂和/或异源嵌合蛋白(和/或另外的剂)的合适剂量在约0.01mg/kg至约100mg/kg体重或约0.01mg/kg至约10mg/kg受试者体重的范围内,例如,约0.01mg/kg、约0.02mg/kg、约0.03mg/kg、约0.04mg/kg、约0.05mg/kg、约0.06mg/kg、约0.07mg/kg、约0.08mg/kg、约0.09mg/kg、约0.1mg/kg、约0.2mg/kg、约0.3mg/kg、约0.4mg/kg、约0.5mg/kg、约0.6mg/kg、约0.7mg/kg、约0.8mg/kg、约0.9mg/kg、约1mg/kg、约1.1mg/kg、约1.2mg/kg、约1.3mg/kg、约1.4mg/kg、约1.5mg/kg、约1.6mg/kg、约1.7mg/kg、约1.8mg/kg,1.9mg/kg、约2mg/kg、约3mg/kg、约4mg/kg、约5mg/kg、约6mg/kg、约7mg/kg、约8mg/kg、约9mg/kg、约10mg/kg体重,包括它们之间的所有值和范围。
在另一个实施方案中,递送可为小囊,特别地为脂质体(参见Langer,1990,Science 249:1527-1533;Treat等人,于Liposomes in Therapy of Infectious Diseaseand Cancer,Lopez-Berestein and Fidler(编辑),Liss,New York,第353-365页(1989)中。
在本文所公开的本发明的方法中使用的针对免疫检查点分子(例如,CTLA-4)的任何抗体、STING激动剂和/或异源嵌合蛋白(和/或另外的剂)可通过受控释放或持续释放方式或通过本领域普通技术人员熟知的递送装置来施用。实例包括但不限于美国专利号3,845,770;3,916,899;3,536,809;3,598,123;4,008,719;5,674,533;5,059,595;5,591,767;5,120,548;5,073,543;5,639,476;5,354,556;和5,733,556中描述的那些,所述专利各自以引用的方式整体并入本文。此类剂型可适用于使用例如羟丙基纤维素、其它聚合物基质、凝胶、可渗透性膜、渗透系统、多层包衣、微粒、脂质体、微球体或其组合来提供一种或多种活性成分的控制或持续释放,从而以不同比例提供所需的释放曲线。可通过不同条件刺激活性成分的控制或持续释放,所述条件包括但不限于pH的变化、温度的变化、经由适当波长的光的刺激、酶的浓度或利用度、水的浓度或利用度或其它生理学条件或化合物。
在另一个实施方案中,可使用聚合材料(参见,Medical Applications ofControlled Release,Langer和Wise(编辑),CRC Pres.,Boca Raton,Florida(1974);Controlled Drug Bioavailability,Drug Product Design and Performance,Smolen和Ball(编辑),Wiley,New York(1984);Ranger和Peppas,1983,J.Macromol.Sci.Rev.Macromol.Chem.23:61;还参见Levy等人,1985,Science 228:190;During等人,1989,Ann.Neurol.25:351;Howard等人,1989,J.Neurosurg.71:105)。
在另一个实施方案中,受控释放系统可邻近待治疗的靶标区域放置,由此仅需要全身剂量的一部分(参见例如,Goodson,Medical Applications of Controlled Release,同上,第2卷,第115-138页(1984))。可使用在Langer,1990,Science 249:1527-1533)的综述中讨论的其它受控释放系统。
在本文所公开的本发明的方法中使用的针对免疫检查点分子(例如,CTLA-4)的任何抗体、STING激动剂和/或异源嵌合蛋白(和/或另外的剂)的施用可独立地为每天1至4次或每月1至4次或每年1至6次或每2年、3年、4年或5年1次。施用可持续一天或一个月、两个月、三个月、六个月、一年、两年、三年的持续时间并且可甚至持续受试者的一生。
使用在本文所公开的本发明的方法中使用的针对免疫检查点分子(例如,CTLA-4)的任何抗体、STING激动剂和/或异源嵌合蛋白(和/或另外的剂)的剂量方案可根据多种因素来选择,所述因素包括受试者的类型、种族、年龄、体重、性别和医学状况;待治疗疾患的严重程度;施用途径;受试者的肾或肝功能;个体的药物基因组学组成;以及所采用的本发明的特定化合物。在本文所公开的本发明的方法中使用的针对免疫检查点分子(例如,CTLA-4)的任何抗体、STING激动剂和/或异源嵌合蛋白(和/或另外的剂)可以单次每日剂量施用,或者每日总剂量可以每日两次、三次或四次的分次剂量施用。此外,在本文所公开的本发明的方法中使用的针对免疫检查点分子(例如,CTLA-4)的任何抗体、STING激动剂和/或异源嵌合蛋白(和/或另外的剂)可在整个剂量方案中连续地而不是间歇地施用。
融合蛋白、核酸和细胞
在本发明的方法中使用的异源嵌合蛋白可以是重组融合蛋白,例如具有本文公开的细胞外结构域的单个多肽。例如,在实施方案中,异源嵌合蛋白在原核细胞、真核细胞或无细胞表达系统中作为单个单元翻译。
在实施方案中,异源嵌合蛋白是包含多个多肽,例如本文公开的多个细胞外结构域的重组蛋白,所述多肽组合(经由共价或非共价键合)以例如在体外产生单个单元(例如具有本文公开的一个或多个合成接头)。
在实施方案中,异源嵌合蛋白被化学合成为一个多肽,或者每个结构域可单独地化学合成且然后组合。在实施方案中,异源嵌合蛋白的一部分是翻译的并且一部分是化学合成的。
可通过将编码三个片段(I型跨膜蛋白的细胞外结构域,然后是接头序列,然后是II型跨膜蛋白的细胞外结构域)的核酸克隆到载体(质粒、病毒或其他)来产生构建体,其中完整序列的氨基末端对应于含有I型跨膜蛋白的细胞外结构域的分子的“左侧”,并且完整序列的羧基末端对应于含有II型跨膜蛋白的细胞外结构域的分子的“右侧”。在实施方案中,在如本文其他地方所述的具有其他构型之一的嵌合蛋白中,构建体将包含三种核酸,以使得所产生的翻译的嵌合蛋白将具有所需的构型,例如双重面向内的嵌合蛋白。因此,在实施方案中,对在本发明的方法中使用的异源嵌合蛋白如此进行工程化。
在本发明的方法使用的异源嵌合蛋白可由克隆到表达载体中的核酸编码。在实施方案中,表达载体包含DNA或RNA。在实施方案中,表达载体是哺乳动物表达载体。
原核载体和真核载体两者均可用于表达异源嵌合蛋白。原核载体包括基于大肠杆菌序列的构建体(参见例如,Makrides,Microbiol Rev 1996,60:512-538)。可用于在大肠杆菌中表达的调控区的非限制性实例包括lac、trp、lpp、phoA、recA、tac、T3、T7和λP
在实施方案中,表达载体包含编码与在哺乳动物细胞中起作用的表达控制区或其补体可操作连接的异源嵌合蛋白或其补体的核酸。表达控制区能够驱动可操作地连接的阻断剂和/或刺激剂编码核酸的表达,以使得所述阻断剂和/或刺激剂在用所述表达载体转化的人细胞中产生。
在实施方案中,在本发明的方法中使用的异源嵌合蛋白在哺乳动物宿主细胞中可产生为可分泌的和完全功能性的单一多肽链。
表达控制区是影响可操作地连接的核酸的表达的调控性聚核苷酸(在本文中有时称为元件),如启动子和增强子。本发明表达载体的表达控制区能够使可操作地连接的编码核酸在人细胞中表达。在实施方案中,细胞是肿瘤细胞。在另一个实施方案中,细胞是非肿瘤细胞。在实施方案中,表达控制区使得可操作地连接的核酸的表达可调节。信号(有时称为刺激物)可增加或减少可操作地连接于这种表达控制区的核酸的表达。响应于信号增加表达的此类表达控制区通常称为诱导型。响应于信号减少表达的此类表达控制区通常称为阻遏型。通常,由此类元件赋予的增加或减少的量与所存在信号的量成比例;信号量越大,表达增加或减少越多。
在实施方案中,本发明设想使用能够瞬时响应于线索实现高水平表达的诱导型启动子。例如,当与肿瘤细胞接近时,通过使转化细胞暴露于适当线索诱导用包含这种表达控制序列的异源嵌合蛋白(和/或另外的剂)的表达载体转化的细胞瞬时产生高水平的所述剂。说明性诱导型表达控制区包括包含用线索(如小分子化合物)刺激的诱导型启动子的那些诱导型表达控制区。在其他实例中,嵌合蛋白由含有嵌合抗原受体的细胞或体外扩增的肿瘤浸润淋巴细胞在对细胞识别抗原敏感的启动子的控制下表达,并导致嵌合蛋白响应于肿瘤抗原识别的局部分泌。特定实例可见于例如美国专利号5,989,910、5,935,934、6,015,709和6,004,941中,所述专利各自以引用的方式整体并入本文。
表达控制区和基因座控制区包括全长启动子序列,如天然启动子和增强子元件,以及保留全部或部分全长或非变异型功能的子序列或聚核苷酸变体。如本文所用,术语“功能性”及其语法变体当在提及核酸序列、子序列或片段的情况下使用时,意指所述序列具有天然核酸序列(例如非变异型或未修饰序列)的一种或多种功能。
如本文所用,“可操作地连接”是指所述组分的物理并置关系允许其以预定方式起作用。在表达控制元件与核酸可操作地连接的实例中,所述关系使得控制元件可调节所述核酸的表达。通常,调节转录的表达控制区并置于所转录核酸的5'端附近(即“上游”)。表达控制区还可位于所转录序列的3’端(即“下游”)或在转录物内(例如在内含子中)。表达控制元件可位于距所转录序列一定距离处(例如距所述核酸100至500、500至1000、2000至5000或更多个核苷酸)。表达控制元件的特定实例是启动子,其通常位于所转录序列的5'。表达控制元件的另一实例是增强子,其可位于所转录序列的5'或3',或在所转录序列内部。
在人细胞中具有功能性的表达系统在本领域中是已知的;这些包括病毒系统。一般来说,在人细胞中具有功能性的启动子是能够结合哺乳动物RNA聚合酶并起始编码序列下游(3')转录成mRNA的任何DNA序列。启动子将具有转录起始区,其通常接近编码序列5'端安置,并且TATA盒通常位于转录起始位点上游25-30个碱基对处。认为TATA盒引导RNA聚合酶II在正确位点开始RNA合成。启动子通常还含有上游启动子元件(增强子元件),其通常位于TATA盒上游100至200个碱基对以内。上游启动子元件决定转录起始的速率;它们可以任何取向起作用。来自哺乳动物病毒基因的启动子特别适用作启动子,因为病毒基因通常高水平表达并且具有广泛宿主范围。实例包括SV40早期启动子、小鼠哺乳动物肿瘤病毒LTR启动子、腺病毒主要晚期启动子、单纯疱疹病毒启动子和CMV启动子。
通常,由哺乳动物细胞识别的转录终止和聚腺苷酸化序列是位于转录终止密码子3'的调控区并且因此连同启动子元件一起侧接编码序列。成熟mRNA的3’末端通过位点特异性翻译后裂解和聚腺苷酸化形成。转录终止子和聚腺苷酸化信号的实例包括来源于SV40的那些。表达构建体中还可包含内含子。
存在多种可用于将核酸引入到存活细胞中的技术。适于在体外将核酸转移至哺乳动物细胞中的技术包括使用脂质体、电穿孔、显微注射、细胞融合、基于聚合物的系统、DEAE-葡聚糖、病毒转导、磷酸钙沉淀法等。对于体内基因转移,也可使用多种技术和试剂,包括脂质体;基于天然聚合物的递送载体,如壳聚糖和明胶;病毒载体也适用于体内转导。在一些情况下,希望提供靶向剂,如对于肿瘤细胞表面膜蛋白具有特异性的抗体或配体。在采用脂质体的情况下,结合至与内吞作用相关的细胞表面膜蛋白的蛋白质可用于靶向和/或促进摄取,例如对于特定细胞类型具有趋向性的衣壳蛋白或其片段、针对在循环中发生内化的蛋白质的抗体、靶向细胞内定位并增强细胞内半衰期的蛋白质。受体介导的内吞作用的技术例如由Wu等人,J.Biol.Chem.262,4429-4432(1987);和Wagner等人,Proc.Natl.Acad.Sci.USA 87,3410-3414(1990)描述。
在适当情况下,也可采用基因递送因子,诸如,例如整合序列。众多整合序列在本领域中是已知的(参见例如,Nunes-Duby等人,Nucleic Acids Res.26:391-406,1998;Sadwoski,J.Bacteriol.,165:341-357,1986;Bestor,Cell,122(3):322-325,2005;Plasterk等人,TIG 15:326-332,1999;Kootstra等人,Ann.Rev.Pharm.Toxicol.,43:413-439,2003)。这些包括重组酶和转座酶。实例包括Cre(Sternberg和Hamilton,J.Mol.Biol.,150:467-486,1981)、λ(Nash,Nature,247,543-545,1974)、FIp(Broach,等人,Cell,29:227-234,1982)、R(Matsuzaki,等人,J.Bacteriology,172:610-618,1990)、cpC31(参见例如,Groth等人,J.Mol.Biol.335:667-678,2004)、睡美人、水手家族的转座酶(Plasterk等人,同上)和整合型病毒的组分,如具有可供病毒整合的组分的AAV、逆转录病毒和抗病毒,如逆转录病毒或慢病毒的LTR序列和AAV的ITR序列(Kootstra等人,Ann.Rev.Pharm.Toxicol.,43:413-439,2003)。另外,直接和靶向遗传整合策略可用于插入编码嵌合融合蛋白的核酸序列,包括CRISPR/CAS9、锌指、TALEN和大范围核酸酶基因编辑技术。
在实施方案中,用于表达异源嵌合蛋白(和/或另外的剂)的表达载体是病毒载体。已知许多适用于基因疗法的病毒载体(参见例如,Lundstrom,Trends Biotechnol.,21:117,122,2003。说明性的病毒载体包括选自抗病毒(LV)、逆转录病毒(RV)、腺病毒(AV)、腺相关病毒(AAV)和α病毒的那些载体,不过也可使用其它病毒载体。对于体内用途,不整合到宿主基因组中的病毒载体是适合使用的,如α病毒和腺病毒。α病毒的说明性类型包括辛德毕斯病毒、委内瑞拉马脑炎(VEE)病毒和塞姆利基森林病毒(SFV)。对于体外使用,整合到宿主基因组中的病毒载体是合适的,如逆转录病毒、AAV和抗病毒。在实施方案中,本发明提供体内转导人细胞的方法,所述发发发包括在体内使实体瘤与本发明的病毒载体接触。
可将表达载体引入宿主细胞中以产生用于本发明方法中的异源嵌合蛋白。例如,细胞可在体外培养或进行遗传工程化。有用的哺乳动物宿主细胞包括但不限于源自人、猴和啮齿动物的细胞(参见例如,Kriegler于“Gene Transfer and Expression:ALaboratory Manual,”1990,New York,Freeman&Co.中)。这些包括被SV40转化的猴肾细胞系(例如,COS-7,ATCC CRL 1651);人胚胎肾系(例如,293,293-EBNA或被亚克隆以在悬浮培养中生长的293细胞,Graham等人,J Gen Virol 1977,36:59);幼仓鼠肾细胞(例如,BHK,ATCC CCL 10);中国仓鼠卵巢细胞DHFR(例如,CHO,Urlaub和Chasin,Proc Natl Acad SciUSA 1980,77:4216);DG44 CHO细胞、CHO-K1细胞、小鼠支持细胞(Mather,Biol Reprod1980,23:243-251);小鼠成纤维细胞(例如,NIH-3T3);猴肾细胞(例如,CV1 ATCC CCL 70);非洲绿猴肾细胞(例如,VERO-76,ATCC CRL-1587);人宫颈癌细胞(例如,HELA,ATCC CCL2);犬肾细胞(例如,MDCK,ATCC CCL 34);水牛大鼠肝细胞(例如,BRL 3A,ATCC CRL 1442);人肺细胞(例如,W138,ATCC CCL 75);人肝细胞(例如,Hep G2,HB 8065);以及小鼠乳腺肿瘤细胞(例如,MMT 060562,ATCC CCL51)。用于表达本文公开的异源嵌合蛋白的说明性癌细胞类型包括小鼠成纤维细胞系NIH3T3、小鼠Lewis肺癌细胞系LLC、小鼠肥大细胞瘤细胞系P815、小鼠淋巴瘤细胞系EL4及其卵白蛋白转染子E.G7、小鼠黑素瘤细胞系B16F10、小鼠纤维肉瘤细胞系MC57和人小细胞肺癌细胞系SCLC#2和SCLC#7。
宿主细胞可从正常受试者或受影响的受试者(包括健康人、癌症患者以及患有感染性疾病的患者)、私人实验室储存物、公共培养物保藏中心诸如美国典型培养物保藏中心(ATCC)或商业供应商处获得。
可用于在体外、离体和/或体内产生用于本发明方法中的异源嵌合蛋白的细胞包括但不限于上皮细胞、内皮细胞、角质形成细胞、成纤维细胞、肌肉细胞、肝细胞;血细胞,如T淋巴细胞、表达嵌合抗原受体的T细胞、肿瘤浸润淋巴细胞、B淋巴细胞、单核细胞、巨噬细胞、嗜中性粒细胞、嗜酸性粒细胞、巨核细胞、粒细胞;各种干细胞或祖细胞,特别是造血干细胞或祖细胞(例如,如从骨髓获得)、脐带血、外周血和胎儿肝脏。细胞类型的选择取决于所治疗或预防的肿瘤或感染性疾病的类型,并且可由本领域技术人员来确定。
含Fc的大分子(如单克隆抗体)的产生和纯化已成为标准化过程,产品之间的修改很小。例如,许多含Fc的大分子由人胚肾(HEK)细胞(或其变体)或中国仓鼠卵巢(CHO)细胞(或其变体)产生,或在一些情况下由细菌或合成方法产生。在产生后,由HEK或CHO细胞分泌的含Fc的大分子通过结合至蛋白A柱上进行纯化,然后使用各种方法进行“精修”。一般而言,纯化的含Fc的大分子以液体形式储存一段时间,冷冻延长的时间段,或者在一些情况下冻干。在实施方案中,与传统的含Fc的大分子相比,本文考虑的异源嵌合蛋白的产生可具有独特的特征。在某些实例中,可使用特定色谱树脂或使用不依赖于蛋白质A捕获的色谱方法来纯化异源嵌合蛋白。在实施方案中,可以低聚状态或以多种低聚状态纯化异源嵌合蛋白,并使用特定方法富集特定低聚状态。不受理论束缚,这些方法可包括用特定缓冲液处理,所述缓冲液包括规定的盐浓度、pH和添加剂组成。在其他实例中,此类方法可包括有利于一种低聚状态而不是另一种低聚状态的治疗。可使用本领域中指定的方法对本文获得的异源嵌合蛋白进行另外“精修”。在实施方案中,异源嵌合蛋白是高度稳定的并且能够耐受广泛范围的pH暴露(介于pH 3-12之间),能够耐受大量的冻/融应激(大于3个冻/融循环)并且能够耐受在高温下的长时间孵育(在40摄氏度下超过2周)。在实施方案中,显示异源嵌合蛋白在此类应激条件下保持完整,没有降解、脱酰胺等的迹象。
受试者和/或动物
在实施方案中,受试者和/或动物是哺乳动物,例如人、小鼠、大鼠、豚鼠、狗、猫、马、牛、猪、兔、绵羊或非人灵长类动物,如猴子、黑猩猩或狒狒。在实施方案中,受试者和/或动物是非哺乳动物,例如像斑马鱼。在实施方案中,受试者和/或动物可包含(例如,用GFP)荧光标记的细胞。在实施方案中,受试者和/或动物是转基因动物,其包含荧光细胞。
在实施方案中,受试者和/或动物是人。在实施方案中,人是儿科人。在实施方案中,人是成年人。在实施方案中,人是老年人。在实施方案中,人可被称为患者。
在某些实施方案中,人的年龄在约0个月至约6个月、约6至约12个月、约6至约18个月、约18至约36个月、约1至约5岁、约5至约10岁、约10至约15岁、约15至约20岁、约20至约25岁、约25至约30岁、约30至约35岁、约35至约40岁、约40至约45岁、约45至约50岁、约50至约55岁、约55至约60岁、约60至约65岁、约65至约70岁、约70至约75岁、约75至约80岁、约80至约85岁、约85至约90岁、约90至约95岁大或约95至约100岁的范围内。
在实施方案中,受试者是非人动物,并且因此本发明涉及兽医用途。在具体实施方案中,非人动物是家养宠物。在另一个具体实施方案中,非人动物是家畜动物。
在实施方案中,受试者患有对于包含能够结合PD-1或结合PD-1配体的抗体的治疗响应差或难治性的癌症。在实施方案中,受试者患有在用能够结合PD-1或结合PD-1配体的抗体治疗大约12周后对这种治疗响应差或无响应的癌症。
药盒和药物
本发明的方面提供了可简化本文所公开的药物组合物和/或嵌合蛋白的施用的药盒。
本发明的说明性药盒包括在本文所公开的本发明的方法中使用的针对免疫检查点分子(例如,CTLA-4)的任何抗体、STING激动剂和/或异源嵌合蛋白,和/或呈单位剂型的本文所公开的药物组合物。在实施方案中,单位剂型是容器,如可以是无菌的预填充注射器,其含有本文公开的任何剂和药学上可接受的载体、稀释剂、赋形剂或媒介物。药盒还可包括指示使用本文公开的任何剂的标签或印刷说明书。药盒还可包括眼睑窥器、局部麻醉剂和用于施用位置的清洁剂。药盒还可包扩本文所公开的一种或多种另外的剂。在实施方案中,药盒包括含有有效量的本发明的组合物和有效量的另一种组合物(如本文公开的那些)的容器。
本发明的方面包括如本文公开的异源嵌合蛋白在制造药物,例如用于治疗癌症和/或治疗炎症性疾病的药物中的用途。
本文公开的任何方面或实施方案可与本文公开的任何其他方面或实施方案组合。
本发明将在以下实施例中进一步描述,所述实施例不限制权利要求书中所述的本发明范围。
实施例
实施例1:针对免疫检查点分子的抗体与嵌合蛋白的特定组合的功能性体内抗肿瘤活性
确定了针对免疫检查点分子的抗体与嵌合蛋白的特定组合在体内靶向和减小肿瘤体积的能力。
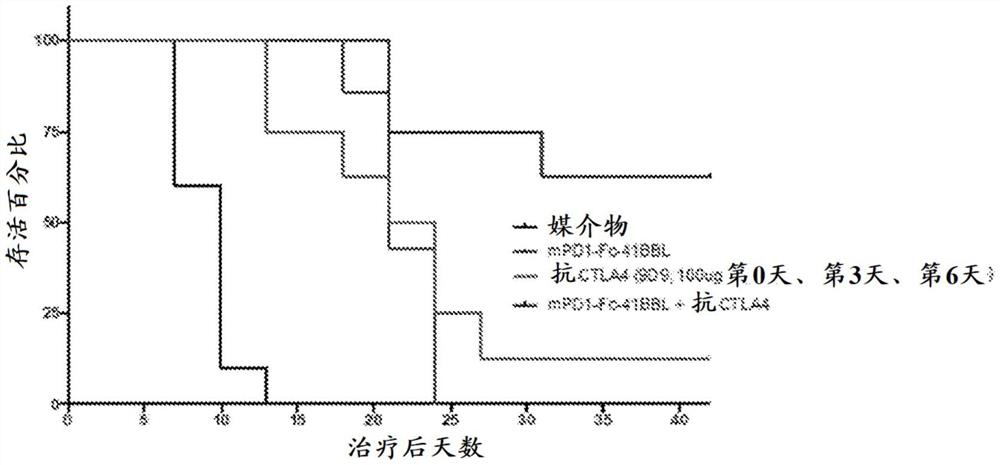
将BALB/C小鼠接种500,000个CT26肿瘤细胞。在接种后八天,小鼠之间的起始肿瘤体积之间没有显著差异,即体积是大约100mm
如图3A的最后一栏中所示,相对于媒介物,所有治疗均有效地促进了携带肿瘤小鼠的存活。然而,只有在CTLA3抗体之前提供的包含PD1-Fc-GITRL嵌合蛋白的组合在第27天展示100%存活。当在CTLA3抗体之后提供PD1-Fc-GITRL嵌合蛋白使或当单独提供PD1-Fc-GITRL嵌合蛋白时,观察到次最大存活率(75%)。
如图3B所示,相对于媒介物,所有单组分治疗均有效地减小肿瘤体积。同样地,如图3C和图3D所示,组合治疗显示在研究过程中肿瘤体积减小。
在其他组体内实验中,向BALB/C小鼠的一侧侧腹中接种CT26细胞。将小鼠分为三个实验组,所述实验组各自细分为治疗组。实验组1包括PD1-Fc-GITRL实验的小鼠,将所述小鼠用抗CTLA4抗体、PD1-Fc-GITRL嵌合蛋白或PD1-Fc-GITRL与抗CTLA4的组合治疗。实验组2包括PD1-Fc-CD40L实验的小鼠,将所述小鼠用PD-1-Fc单侧融合蛋白、Fc-CD40L单侧融合蛋白、PD-1-Fc+Fc-CD40L单侧融合蛋白两者、抗CTLA4抗体、PD-1-Fc-CD40L嵌合蛋白或PD-1-Fc-CD40L与抗CTLA4的组合治疗。并且,实验组3包括PD1-Fc-41BBL实验的小鼠,将所述小鼠用抗CTLA4抗体、PD-1-Fc-4-1BBL嵌合蛋白或PD-1-Fc-4-1BBL与抗CTLA4的组合进行治疗。将排斥肿瘤的小鼠在相对的侧腹上用继发性肿瘤再次攻击,并继续测量原发性/继发性肿瘤。每个实验组包括IP施用PBS的媒介物小鼠。
在接种后第8天,向实验组1的小鼠IP施用100μg的抗CTLA4(克隆9D9)抗体、300μg的PD-1-Fc-GITRL嵌合蛋白或300μg的PD-1-Fc-GITRL嵌合蛋白连同100μg的抗CTLA4抗体。在接种后第十一天和接种后第十三天,重复先前的治疗。定期测量肿瘤体积,并确定存活小鼠的数量。
图4A是示出实验组1的四个治疗组的每只小鼠的肿瘤体积变化的图;图4B是示出实验组1的四个治疗组中的小鼠的存活率的图。图4C是包括与图4A和图4B的图有关的数据的表。这些数据表明PD-1-Fc-GITRL嵌合蛋白与抗CTLA-4抗体的组合改善了存活和排斥。
此外,对存活曲线的曼特尔-考克斯显著性分析表明,与单独抗CTLA4抗体治疗或与单独PD-1-Fc-GITRL治疗相比,由PD-1-Fc-GITRL嵌合蛋白与抗CTLA-4抗体的组合提供的改善的存活是统计学上显著的(p<.0001)。
在接种后第八天,向实验组2的小鼠IP施用150μg的PD-1-Fc单侧融合蛋白、150μg的Fc-CD40L单侧融合蛋白、各自150μg的PD-1-Fc+Fc-CD40L单侧融合蛋白、100μg的抗CTLA4抗体、300μg的PD-1-Fc-CD40L嵌合蛋白或300μg PD-1-Fc-CD40L嵌合蛋白与100μg抗CTLA4抗体的组合。在接种后第十天和接种后第十二天,重复先前的治疗。定期测量肿瘤体积,并确定存活小鼠的数量。
图5A是示出实验组2的七个治疗组的小鼠的平均肿瘤体积变化的图;图5B是示出实验组2的七个治疗组中的小鼠的存活率的图。图5C是包括与图5A和图5B的图有关的数据的表。这些数据表明PD-1-Fc-CD40L嵌合蛋白与抗CTLA-4抗体的组合改善了存活和排斥。
在接种后第8天,向实验组3的小鼠IP施用100μg的抗CTLA4(克隆9D9)抗体、300μg的PD-1-Fc-4-1BBL嵌合蛋白或300μg的PD-1-Fc-4-1BBL嵌合蛋白连同100μg的抗CTLA4抗体。在接种后第十一天和接种后第十三天,重复先前的治疗。定期测量肿瘤体积,并确定存活小鼠的数量。
图6A是示出实验组3的四个治疗组的每只小鼠的肿瘤体积变化的图;图6B是示出实验组3的四个治疗组中的小鼠的存活率的图。图6C是包括与图6A和图6B的图有关的数据的表。图6D包括展示相对于单一疗法,从组合治疗获得的改善的数据。总之,这些数据表明PD-1-Fc-4-1BBL嵌合蛋白与抗CTLA-4抗体的组合改善了存活和排斥。
实施例2:STING激动剂和嵌合蛋白的特定组合的功能性体内抗肿瘤活性
确定了干扰素基因刺激因子(STING)激动剂与嵌合蛋白的特定组合在体内靶向和减小肿瘤体积的能力。
将BALB/C小鼠接种500,000个CT26肿瘤细胞。在接种后八天,小鼠之间的起始肿瘤体积之间没有显著差异,即体积是大约100mm
如图3A的最后一栏中所示,只有包含在STING激动剂(DMXAA)之前或之后提供的PD1-Fc-GITRL嵌合蛋白的组合在第27天展示100%存活。
如图7A所示,相对于媒介物,所有单组分治疗均有效地减小肿瘤体积。同样地,如图7B所示,组合治疗显示在研究过程中肿瘤体积减小。
在任何上述实施例中,可进一步测定所述治疗的治疗活性。特别地,显示肿瘤排斥的药效生物标志物的变化将由血清中的细胞因子升高(体内)或在与超抗原葡萄球菌肠毒素B(SEB测定)一起孵育的免疫相关细胞中的体外药效生物标志物的变化确定,或者当在AIM V培养基中培养时将确定。示例性的药效生物标志物包括IFNγ、IL-2、IL-4、IL-5、IL-6和IL-17A。
以引用的方式并入
本文引用的所有专利和出版物以引用的方式整体并入本文。
具体地,在WO2018/157162;WO2018/157165;WO2018/157164;WO2018/157163;和WO2017/059168中的一者或多者中发现了与本发明有关的另外教义,所述专利各自的内容以引用的方式整体并入本文。
本文所论述的出版物仅仅出于其在本申请的提交日期之前公开而提供。本文中的任何内容均不应解释为承认本发明无权借助在先发明而先于此类公开。
如本文所用的,所有标题仅用于组织,并不意图以任何方式限制本公开。任何单个部分的内容可同样适用于所有部分。
等效方案
尽管已经结合本发明具体的实施方案公开了本发明,但应理解本发明能够具有另外的修改,并且本申请意图涵盖通常遵循本发明原理的、包括虽然不属于本发明所公开内容范围但属于本发明所属领域的公知技术或常用的技术手段并可以应用于上文中阐述和所附权利要求的范围所列出的必要特征的任何变型、用途或者变更。
本领域技术人员仅使用常规实验将会认识到或将能够确定本文中确切公开的具体实施方案的许多等效方案。此类等效方案意图涵盖在所附权利要求书的范围中。
序列表
<110> 沙塔克实验室有限公司(Shattuck Labs, Inc.)
<120> 包含基于PD-1的嵌合蛋白的组合疗法
<130> SHK-022PC
<160> 64
<170> PatentIn version 3.5
<210> 1
<211> 217
<212> PRT
<213> 人工序列(Artificial sequence)
<220>
<223> 合成多肽
<400> 1
Ala Pro Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
1 5 10 15
Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
20 25 30
Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr
35 40 45
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
50 55 60
Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
65 70 75 80
Gln Asp Trp Leu Ser Gly Lys Glu Tyr Lys Cys Lys Val Ser Ser Lys
85 90 95
Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Asn Ala Thr Gly Gln
100 105 110
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met
115 120 125
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
130 135 140
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
145 150 155 160
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
165 170 175
Tyr Ser Arg Leu Thr Val Asp Lys Ser Ser Trp Gln Glu Gly Asn Val
180 185 190
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln
195 200 205
Lys Ser Leu Ser Leu Ser Leu Gly Lys
210 215
<210> 2
<211> 217
<212> PRT
<213> 人工序列(Artificial sequence)
<220>
<223> 合成多肽
<400> 2
Ala Pro Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
1 5 10 15
Pro Lys Asp Gln Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
20 25 30
Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr
35 40 45
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
50 55 60
Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Thr Pro His
65 70 75 80
Ser Asp Trp Leu Ser Gly Lys Glu Tyr Lys Cys Lys Val Ser Ser Lys
85 90 95
Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Asn Ala Thr Gly Gln
100 105 110
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met
115 120 125
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
130 135 140
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
145 150 155 160
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
165 170 175
Tyr Ser Arg Leu Thr Val Asp Lys Ser Ser Trp Gln Glu Gly Asn Val
180 185 190
Phe Ser Cys Ser Val Leu His Glu Ala Leu His Asn His Tyr Thr Gln
195 200 205
Lys Ser Leu Ser Leu Ser Leu Gly Lys
210 215
<210> 3
<211> 217
<212> PRT
<213> 人工序列(Artificial sequence)
<220>
<223> 合成多肽
<400> 3
Ala Pro Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
1 5 10 15
Pro Lys Asp Gln Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
20 25 30
Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr
35 40 45
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
50 55 60
Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
65 70 75 80
Gln Asp Trp Leu Ser Gly Lys Glu Tyr Lys Cys Lys Val Ser Ser Lys
85 90 95
Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Asn Ala Thr Gly Gln
100 105 110
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met
115 120 125
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
130 135 140
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
145 150 155 160
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
165 170 175
Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val
180 185 190
Phe Ser Cys Ser Val Leu His Glu Ala Leu His Asn His Tyr Thr Gln
195 200 205
Lys Ser Leu Ser Leu Ser Leu Gly Lys
210 215
<210> 4
<211> 11
<212> PRT
<213> 人工序列(Artificial sequence)
<220>
<223> 合成多肽
<400> 4
Ser Lys Tyr Gly Pro Pro Cys Pro Ser Cys Pro
1 5 10
<210> 5
<211> 11
<212> PRT
<213> 人工序列(Artificial sequence)
<220>
<223> 合成多肽
<400> 5
Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro
1 5 10
<210> 6
<211> 6
<212> PRT
<213> 人工序列(Artificial sequence)
<220>
<223> 合成多肽
<400> 6
Ser Lys Tyr Gly Pro Pro
1 5
<210> 7
<211> 6
<212> PRT
<213> 人工序列(Artificial sequence)
<220>
<223> 合成多肽
<400> 7
Ile Glu Gly Arg Met Asp
1 5
<210> 8
<211> 9
<212> PRT
<213> 人工序列(Artificial sequence)
<220>
<223> 合成多肽
<400> 8
Gly Gly Gly Val Pro Arg Asp Cys Gly
1 5
<210> 9
<211> 15
<212> PRT
<213> 人工序列(Artificial sequence)
<220>
<223> 合成多肽
<400> 9
Ile Glu Gly Arg Met Asp Gly Gly Gly Gly Ala Gly Gly Gly Gly
1 5 10 15
<210> 10
<211> 8
<212> PRT
<213> 人工序列(Artificial sequence)
<220>
<223> 合成多肽
<400> 10
Gly Gly Gly Ser Gly Gly Gly Ser
1 5
<210> 11
<211> 12
<212> PRT
<213> 人工序列(Artificial sequence)
<220>
<223> 合成多肽
<400> 11
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
1 5 10
<210> 12
<211> 14
<212> PRT
<213> 人工序列(Artificial sequence)
<220>
<223> 合成多肽
<400> 12
Glu Gly Lys Ser Ser Gly Ser Gly Ser Glu Ser Lys Ser Thr
1 5 10
<210> 13
<211> 4
<212> PRT
<213> 人工序列(Artificial sequence)
<220>
<223> 合成多肽
<400> 13
Gly Gly Ser Gly
1
<210> 14
<211> 12
<212> PRT
<213> 人工序列(Artificial sequence)
<220>
<223> 合成多肽
<400> 14
Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Ser Gly
1 5 10
<210> 15
<211> 15
<212> PRT
<213> 人工序列(Artificial sequence)
<220>
<223> 合成多肽
<400> 15
Glu Ala Ala Ala Lys Glu Ala Ala Ala Lys Glu Ala Ala Ala Lys
1 5 10 15
<210> 16
<211> 20
<212> PRT
<213> 人工序列(Artificial sequence)
<220>
<223> 合成多肽
<400> 16
Glu Ala Ala Ala Arg Glu Ala Ala Ala Arg Glu Ala Ala Ala Arg Glu
1 5 10 15
Ala Ala Ala Arg
20
<210> 17
<211> 17
<212> PRT
<213> 人工序列(Artificial sequence)
<220>
<223> 合成多肽
<400> 17
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Ala
1 5 10 15
Ser
<210> 18
<211> 9
<212> PRT
<213> 人工序列(Artificial sequence)
<220>
<223> 合成多肽
<400> 18
Gly Gly Gly Gly Ala Gly Gly Gly Gly
1 5
<210> 19
<400> 19
000
<210> 20
<211> 6
<212> PRT
<213> 人工序列(Artificial sequence)
<220>
<223> 合成多肽
<400> 20
Gly Ser Gly Ser Gly Ser
1 5
<210> 21
<211> 10
<212> PRT
<213> 人工序列(Artificial sequence)
<220>
<223> 合成多肽
<400> 21
Gly Ser Gly Ser Gly Ser Gly Ser Gly Ser
1 5 10
<210> 22
<211> 7
<212> PRT
<213> 人工序列(Artificial sequence)
<220>
<223> 合成多肽
<400> 22
Gly Gly Gly Gly Ser Ala Ser
1 5
<210> 23
<211> 20
<212> PRT
<213> 人工序列(Artificial sequence)
<220>
<223> 合成多肽
<400> 23
Ala Pro Ala Pro Ala Pro Ala Pro Ala Pro Ala Pro Ala Pro Ala Pro
1 5 10 15
Ala Pro Ala Pro
20
<210> 24
<211> 4
<212> PRT
<213> 人工序列(Artificial sequence)
<220>
<223> 合成多肽
<400> 24
Cys Pro Pro Cys
1
<210> 25
<211> 5
<212> PRT
<213> 人工序列(Artificial sequence)
<220>
<223> 合成多肽
<400> 25
Gly Gly Gly Gly Ser
1 5
<210> 26
<211> 10
<212> PRT
<213> 人工序列(Artificial sequence)
<220>
<223> 合成多肽
<400> 26
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10
<210> 27
<211> 15
<212> PRT
<213> 人工序列(Artificial sequence)
<220>
<223> 合成多肽
<400> 27
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10 15
<210> 28
<211> 20
<212> PRT
<213> 人工序列(Artificial sequence)
<220>
<223> 合成多肽
<400> 28
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
1 5 10 15
Gly Gly Gly Ser
20
<210> 29
<211> 25
<212> PRT
<213> 人工序列(Artificial sequence)
<220>
<223> 合成多肽
<400> 29
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
1 5 10 15
Gly Gly Gly Ser Gly Gly Gly Gly Ser
20 25
<210> 30
<211> 30
<212> PRT
<213> 人工序列(Artificial sequence)
<220>
<223> 合成多肽
<400> 30
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
1 5 10 15
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
20 25 30
<210> 31
<211> 35
<212> PRT
<213> 人工序列(Artificial sequence)
<220>
<223> 合成多肽
<400> 31
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
1 5 10 15
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
20 25 30
Gly Gly Ser
35
<210> 32
<211> 40
<212> PRT
<213> 人工序列(Artificial sequence)
<220>
<223> 合成多肽
<400> 32
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
1 5 10 15
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
20 25 30
Gly Gly Ser Gly Gly Gly Gly Ser
35 40
<210> 33
<211> 16
<212> PRT
<213> 人工序列(Artificial sequence)
<220>
<223> 合成多肽
<400> 33
Gly Gly Ser Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10 15
<210> 34
<211> 8
<212> PRT
<213> 人工序列(Artificial sequence)
<220>
<223> 合成多肽
<400> 34
Gly Gly Gly Gly Gly Gly Gly Gly
1 5
<210> 35
<211> 6
<212> PRT
<213> 人工序列(Artificial sequence)
<220>
<223> 合成多肽
<400> 35
Gly Gly Gly Gly Gly Gly
1 5
<210> 36
<211> 5
<212> PRT
<213> 人工序列(Artificial sequence)
<220>
<223> 合成多肽
<400> 36
Glu Ala Ala Ala Lys
1 5
<210> 37
<211> 10
<212> PRT
<213> 人工序列(Artificial sequence)
<220>
<223> 合成多肽
<400> 37
Glu Ala Ala Ala Lys Glu Ala Ala Ala Lys
1 5 10
<210> 38
<211> 15
<212> PRT
<213> 人工序列(Artificial sequence)
<220>
<223> 合成多肽
<400> 38
Glu Ala Ala Ala Lys Glu Ala Ala Ala Lys Glu Ala Ala Ala Lys
1 5 10 15
<210> 39
<211> 12
<212> PRT
<213> 人工序列(Artificial sequence)
<220>
<223> 合成多肽
<400> 39
Ala Glu Ala Ala Ala Lys Glu Ala Ala Ala Lys Ala
1 5 10
<210> 40
<211> 17
<212> PRT
<213> 人工序列(Artificial sequence)
<220>
<223> 合成多肽
<400> 40
Ala Glu Ala Ala Ala Lys Glu Ala Ala Ala Lys Glu Ala Ala Ala Lys
1 5 10 15
Ala
<210> 41
<211> 22
<212> PRT
<213> 人工序列(Artificial sequence)
<220>
<223> 合成多肽
<400> 41
Ala Glu Ala Ala Ala Lys Glu Ala Ala Ala Lys Glu Ala Ala Ala Lys
1 5 10 15
Glu Ala Ala Ala Lys Ala
20
<210> 42
<211> 27
<212> PRT
<213> 人工序列(Artificial sequence)
<220>
<223> 合成多肽
<400> 42
Ala Glu Ala Ala Ala Lys Glu Ala Ala Ala Lys Glu Ala Ala Ala Lys
1 5 10 15
Glu Ala Ala Ala Lys Glu Ala Ala Ala Lys Ala
20 25
<210> 43
<211> 46
<212> PRT
<213> 人工序列(Artificial sequence)
<220>
<223> 合成多肽
<400> 43
Ala Glu Ala Ala Ala Lys Glu Ala Ala Ala Lys Glu Ala Ala Ala Lys
1 5 10 15
Glu Ala Ala Ala Lys Ala Leu Glu Ala Glu Ala Ala Ala Lys Glu Ala
20 25 30
Ala Ala Lys Glu Ala Ala Ala Lys Glu Ala Ala Ala Lys Ala
35 40 45
<210> 44
<211> 5
<212> PRT
<213> 人工序列(Artificial sequence)
<220>
<223> 合成多肽
<400> 44
Pro Ala Pro Ala Pro
1 5
<210> 45
<211> 18
<212> PRT
<213> 人工序列(Artificial sequence)
<220>
<223> 合成多肽
<400> 45
Lys Glu Ser Gly Ser Val Ser Ser Glu Gln Leu Ala Gln Phe Arg Ser
1 5 10 15
Leu Asp
<210> 46
<211> 12
<212> PRT
<213> 人工序列(Artificial sequence)
<220>
<223> 合成多肽
<400> 46
Gly Ser Ala Gly Ser Ala Ala Gly Ser Gly Glu Phe
1 5 10
<210> 47
<211> 5
<212> PRT
<213> 人工序列(Artificial sequence)
<220>
<223> 合成多肽
<400> 47
Gly Gly Gly Ser Glu
1 5
<210> 48
<211> 5
<212> PRT
<213> 人工序列(Artificial sequence)
<220>
<223> 合成多肽
<400> 48
Gly Ser Glu Ser Gly
1 5
<210> 49
<211> 5
<212> PRT
<213> 人工序列(Artificial sequence)
<220>
<223> 合成多肽
<400> 49
Gly Ser Glu Gly Ser
1 5
<210> 50
<211> 35
<212> PRT
<213> 人工序列(Artificial sequence)
<220>
<223> 合成多肽
<400> 50
Gly Glu Gly Gly Ser Gly Glu Gly Ser Ser Gly Glu Gly Ser Ser Ser
1 5 10 15
Glu Gly Gly Gly Ser Glu Gly Gly Gly Ser Glu Gly Gly Gly Ser Glu
20 25 30
Gly Gly Ser
35
<210> 51
<211> 234
<212> PRT
<213> 人工序列(Artificial sequence)
<220>
<223> 合成多肽
<400> 51
Ser Lys Tyr Gly Pro Pro Cys Pro Ser Cys Pro Ala Pro Glu Phe Leu
1 5 10 15
Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu
20 25 30
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
35 40 45
Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu
50 55 60
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr
65 70 75 80
Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Ser
85 90 95
Gly Lys Glu Tyr Lys Cys Lys Val Ser Ser Lys Gly Leu Pro Ser Ser
100 105 110
Ile Glu Lys Thr Ile Ser Asn Ala Thr Gly Gln Pro Arg Glu Pro Gln
115 120 125
Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val
130 135 140
Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
145 150 155 160
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
165 170 175
Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr
180 185 190
Val Asp Lys Ser Ser Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val
195 200 205
Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
210 215 220
Ser Leu Gly Lys Ile Glu Gly Arg Met Asp
225 230
<210> 52
<211> 234
<212> PRT
<213> 人工序列(Artificial sequence)
<220>
<223> 合成多肽
<400> 52
Ser Lys Tyr Gly Pro Pro Cys Pro Ser Cys Pro Ala Pro Glu Phe Leu
1 5 10 15
Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Gln Leu
20 25 30
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
35 40 45
Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu
50 55 60
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr
65 70 75 80
Tyr Arg Val Val Ser Val Leu Thr Thr Pro His Ser Asp Trp Leu Ser
85 90 95
Gly Lys Glu Tyr Lys Cys Lys Val Ser Ser Lys Gly Leu Pro Ser Ser
100 105 110
Ile Glu Lys Thr Ile Ser Asn Ala Thr Gly Gln Pro Arg Glu Pro Gln
115 120 125
Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val
130 135 140
Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
145 150 155 160
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
165 170 175
Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr
180 185 190
Val Asp Lys Ser Ser Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val
195 200 205
Leu His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
210 215 220
Ser Leu Gly Lys Ile Glu Gly Arg Met Asp
225 230
<210> 53
<211> 234
<212> PRT
<213> 人工序列(Artificial sequence)
<220>
<223> 合成多肽
<400> 53
Ser Lys Tyr Gly Pro Pro Cys Pro Ser Cys Pro Ala Pro Glu Phe Leu
1 5 10 15
Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Gln Leu
20 25 30
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
35 40 45
Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu
50 55 60
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr
65 70 75 80
Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Ser
85 90 95
Gly Lys Glu Tyr Lys Cys Lys Val Ser Ser Lys Gly Leu Pro Ser Ser
100 105 110
Ile Glu Lys Thr Ile Ser Asn Ala Thr Gly Gln Pro Arg Glu Pro Gln
115 120 125
Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val
130 135 140
Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
145 150 155 160
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
165 170 175
Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr
180 185 190
Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val
195 200 205
Leu His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
210 215 220
Ser Leu Gly Lys Ile Glu Gly Arg Met Asp
225 230
<210> 54
<211> 234
<212> PRT
<213> 人工序列(Artificial sequence)
<220>
<223> 合成多肽
<400> 54
Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu
1 5 10 15
Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu
20 25 30
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
35 40 45
Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu
50 55 60
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr
65 70 75 80
Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Ser
85 90 95
Gly Lys Glu Tyr Lys Cys Lys Val Ser Ser Lys Gly Leu Pro Ser Ser
100 105 110
Ile Glu Lys Thr Ile Ser Asn Ala Thr Gly Gln Pro Arg Glu Pro Gln
115 120 125
Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val
130 135 140
Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
145 150 155 160
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
165 170 175
Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr
180 185 190
Val Asp Lys Ser Ser Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val
195 200 205
Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
210 215 220
Ser Leu Gly Lys Ile Glu Gly Arg Met Asp
225 230
<210> 55
<211> 234
<212> PRT
<213> 人工序列(Artificial sequence)
<220>
<223> 合成多肽
<400> 55
Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu
1 5 10 15
Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Gln Leu
20 25 30
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
35 40 45
Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu
50 55 60
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr
65 70 75 80
Tyr Arg Val Val Ser Val Leu Thr Thr Pro His Ser Asp Trp Leu Ser
85 90 95
Gly Lys Glu Tyr Lys Cys Lys Val Ser Ser Lys Gly Leu Pro Ser Ser
100 105 110
Ile Glu Lys Thr Ile Ser Asn Ala Thr Gly Gln Pro Arg Glu Pro Gln
115 120 125
Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val
130 135 140
Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
145 150 155 160
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
165 170 175
Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr
180 185 190
Val Asp Lys Ser Ser Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val
195 200 205
Leu His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
210 215 220
Ser Leu Gly Lys Ile Glu Gly Arg Met Asp
225 230
<210> 56
<211> 234
<212> PRT
<213> 人工序列(Artificial sequence)
<220>
<223> 合成多肽
<400> 56
Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu
1 5 10 15
Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Gln Leu
20 25 30
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
35 40 45
Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu
50 55 60
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr
65 70 75 80
Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Ser
85 90 95
Gly Lys Glu Tyr Lys Cys Lys Val Ser Ser Lys Gly Leu Pro Ser Ser
100 105 110
Ile Glu Lys Thr Ile Ser Asn Ala Thr Gly Gln Pro Arg Glu Pro Gln
115 120 125
Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val
130 135 140
Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
145 150 155 160
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
165 170 175
Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr
180 185 190
Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val
195 200 205
Leu His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
210 215 220
Ser Leu Gly Lys Ile Glu Gly Arg Met Asp
225 230
<210> 57
<211> 143
<212> PRT
<213> 人工序列(Artificial sequence)
<220>
<223> 合成序列
<400> 57
Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr Phe Ser Pro Ala
1 5 10 15
Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe Thr Cys Ser Phe
20 25 30
Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr Arg Met Ser Pro
35 40 45
Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu Asp Arg Ser Gln
50 55 60
Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu Pro Asn Gly Arg
65 70 75 80
Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn Asp Ser Gly Thr
85 90 95
Tyr Leu Cys Gly Ala Ile Ser Leu Ala Pro Lys Ala Gln Ile Lys Glu
100 105 110
Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg Ala Glu Val Pro
115 120 125
Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly Gln Phe Gln
130 135 140
<210> 58
<211> 126
<212> PRT
<213> 人工序列(Artificial sequence)
<220>
<223> 合成序列
<400> 58
Glu Thr Ala Lys Glu Pro Cys Met Ala Lys Phe Gly Pro Leu Pro Ser
1 5 10 15
Lys Trp Gln Met Ala Ser Ser Glu Pro Pro Cys Val Asn Lys Val Ser
20 25 30
Asp Trp Lys Leu Glu Ile Leu Gln Asn Gly Leu Tyr Leu Ile Tyr Gly
35 40 45
Gln Val Ala Pro Asn Ala Asn Tyr Asn Asp Val Ala Pro Phe Glu Val
50 55 60
Arg Leu Tyr Lys Asn Lys Asp Met Ile Gln Thr Leu Thr Asn Lys Ser
65 70 75 80
Lys Ile Gln Asn Val Gly Gly Thr Tyr Glu Leu His Val Gly Asp Thr
85 90 95
Ile Asp Leu Ile Phe Asn Ser Glu His Gln Val Leu Lys Asn Asn Thr
100 105 110
Tyr Trp Gly Ile Ile Leu Leu Ala Asn Pro Gln Phe Ile Ser
115 120 125
<210> 59
<400> 59
000
<210> 60
<211> 215
<212> PRT
<213> 人工序列(Artificial sequence)
<220>
<223> 合成序列
<400> 60
His Arg Arg Leu Asp Lys Ile Glu Asp Glu Arg Asn Leu His Glu Asp
1 5 10 15
Phe Val Phe Met Lys Thr Ile Gln Arg Cys Asn Thr Gly Glu Arg Ser
20 25 30
Leu Ser Leu Leu Asn Cys Glu Glu Ile Lys Ser Gln Phe Glu Gly Phe
35 40 45
Val Lys Asp Ile Met Leu Asn Lys Glu Glu Thr Lys Lys Glu Asn Ser
50 55 60
Phe Glu Met Gln Lys Gly Asp Gln Asn Pro Gln Ile Ala Ala His Val
65 70 75 80
Ile Ser Glu Ala Ser Ser Lys Thr Thr Ser Val Leu Gln Trp Ala Glu
85 90 95
Lys Gly Tyr Tyr Thr Met Ser Asn Asn Leu Val Thr Leu Glu Asn Gly
100 105 110
Lys Gln Leu Thr Val Lys Arg Gln Gly Leu Tyr Tyr Ile Tyr Ala Gln
115 120 125
Val Thr Phe Cys Ser Asn Arg Glu Ala Ser Ser Gln Ala Pro Phe Ile
130 135 140
Ala Ser Leu Cys Leu Lys Ser Pro Gly Arg Phe Glu Arg Ile Leu Leu
145 150 155 160
Arg Ala Ala Asn Thr His Ser Ser Ala Lys Pro Cys Gly Gln Gln Ser
165 170 175
Ile His Leu Gly Gly Val Phe Glu Leu Gln Pro Gly Ala Ser Val Phe
180 185 190
Val Asn Val Thr Asp Pro Ser Gln Val Ser His Gly Thr Gly Phe Thr
195 200 205
Ser Phe Gly Leu Leu Lys Leu
210 215
<210> 61
<211> 205
<212> PRT
<213> 人工序列(Artificial sequence)
<220>
<223> 合成序列
<400> 61
Ala Cys Pro Trp Ala Val Ser Gly Ala Arg Ala Ser Pro Gly Ser Ala
1 5 10 15
Ala Ser Pro Arg Leu Arg Glu Gly Pro Glu Leu Ser Pro Asp Asp Pro
20 25 30
Ala Gly Leu Leu Asp Leu Arg Gln Gly Met Phe Ala Gln Leu Val Ala
35 40 45
Gln Asn Val Leu Leu Ile Asp Gly Pro Leu Ser Trp Tyr Ser Asp Pro
50 55 60
Gly Leu Ala Gly Val Ser Leu Thr Gly Gly Leu Ser Tyr Lys Glu Asp
65 70 75 80
Thr Lys Glu Leu Val Val Ala Lys Ala Gly Val Tyr Tyr Val Phe Phe
85 90 95
Gln Leu Glu Leu Arg Arg Val Val Ala Gly Glu Gly Ser Gly Ser Val
100 105 110
Ser Leu Ala Leu His Leu Gln Pro Leu Arg Ser Ala Ala Gly Ala Ala
115 120 125
Ala Leu Ala Leu Thr Val Asp Leu Pro Pro Ala Ser Ser Glu Ala Arg
130 135 140
Asn Ser Ala Phe Gly Phe Gln Gly Arg Leu Leu His Leu Ser Ala Gly
145 150 155 160
Gln Arg Leu Gly Val His Leu His Thr Glu Ala Arg Ala Arg His Ala
165 170 175
Trp Gln Leu Thr Gln Gly Ala Thr Val Leu Gly Leu Phe Arg Val Thr
180 185 190
Pro Glu Ile Pro Ala Gly Leu Pro Ser Pro Arg Ser Glu
195 200 205
<210> 62
<211> 505
<212> PRT
<213> 人工序列(Artificial sequence)
<220>
<223> 合成序列
<400> 62
Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr Phe Ser Pro Ala
1 5 10 15
Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe Thr Cys Ser Phe
20 25 30
Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr Arg Met Ser Pro
35 40 45
Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu Asp Arg Ser Gln
50 55 60
Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu Pro Asn Gly Arg
65 70 75 80
Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn Asp Ser Gly Thr
85 90 95
Tyr Leu Cys Gly Ala Ile Ser Leu Ala Pro Lys Ala Gln Ile Lys Glu
100 105 110
Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg Ala Glu Val Pro
115 120 125
Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly Gln Phe Gln Ser
130 135 140
Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly
145 150 155 160
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Gln Leu Met
165 170 175
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln
180 185 190
Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val
195 200 205
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr
210 215 220
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Ser Gly
225 230 235 240
Lys Glu Tyr Lys Cys Lys Val Ser Ser Lys Gly Leu Pro Ser Ser Ile
245 250 255
Glu Lys Thr Ile Ser Asn Ala Thr Gly Gln Pro Arg Glu Pro Gln Val
260 265 270
Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser
275 280 285
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
290 295 300
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
305 310 315 320
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val
325 330 335
Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Leu
340 345 350
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
355 360 365
Leu Gly Lys Ile Glu Gly Arg Met Asp Gln Leu Glu Thr Ala Lys Glu
370 375 380
Pro Cys Met Ala Lys Phe Gly Pro Leu Pro Ser Lys Trp Gln Met Ala
385 390 395 400
Ser Ser Glu Pro Pro Cys Val Asn Lys Val Ser Asp Trp Lys Leu Glu
405 410 415
Ile Leu Gln Asn Gly Leu Tyr Leu Ile Tyr Gly Gln Val Ala Pro Asn
420 425 430
Ala Asn Tyr Asn Asp Val Ala Pro Phe Glu Val Arg Leu Tyr Lys Asn
435 440 445
Lys Asp Met Ile Gln Thr Leu Thr Asn Lys Ser Lys Ile Gln Asn Val
450 455 460
Gly Gly Thr Tyr Glu Leu His Val Gly Asp Thr Ile Asp Leu Ile Phe
465 470 475 480
Asn Ser Glu His Gln Val Leu Lys Asn Asn Thr Tyr Trp Gly Ile Ile
485 490 495
Leu Leu Ala Asn Pro Gln Phe Ile Ser
500 505
<210> 63
<211> 592
<212> PRT
<213> 人工序列(Artificial sequence)
<220>
<223> 合成序列
<400> 63
Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr Phe Ser Pro Ala
1 5 10 15
Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe Thr Cys Ser Phe
20 25 30
Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr Arg Met Ser Pro
35 40 45
Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu Asp Arg Ser Gln
50 55 60
Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu Pro Asn Gly Arg
65 70 75 80
Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn Asp Ser Gly Thr
85 90 95
Tyr Leu Cys Gly Ala Ile Ser Leu Ala Pro Lys Ala Gln Ile Lys Glu
100 105 110
Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg Ala Glu Val Pro
115 120 125
Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly Gln Phe Gln Ser
130 135 140
Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly
145 150 155 160
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Gln Leu Met
165 170 175
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln
180 185 190
Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val
195 200 205
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr
210 215 220
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Ser Gly
225 230 235 240
Lys Glu Tyr Lys Cys Lys Val Ser Ser Lys Gly Leu Pro Ser Ser Ile
245 250 255
Glu Lys Thr Ile Ser Asn Ala Thr Gly Gln Pro Arg Glu Pro Gln Val
260 265 270
Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser
275 280 285
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
290 295 300
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
305 310 315 320
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val
325 330 335
Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Leu
340 345 350
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
355 360 365
Leu Gly Lys Ile Glu Gly Arg Met Asp His Arg Arg Leu Asp Lys Ile
370 375 380
Glu Asp Glu Arg Asn Leu His Glu Asp Phe Val Phe Met Lys Thr Ile
385 390 395 400
Gln Arg Cys Asn Thr Gly Glu Arg Ser Leu Ser Leu Leu Asn Cys Glu
405 410 415
Glu Ile Lys Ser Gln Phe Glu Gly Phe Val Lys Asp Ile Met Leu Asn
420 425 430
Lys Glu Glu Thr Lys Lys Glu Asn Ser Phe Glu Met Gln Lys Gly Asp
435 440 445
Gln Asn Pro Gln Ile Ala Ala His Val Ile Ser Glu Ala Ser Ser Lys
450 455 460
Thr Thr Ser Val Leu Gln Trp Ala Glu Lys Gly Tyr Tyr Thr Met Ser
465 470 475 480
Asn Asn Leu Val Thr Leu Glu Asn Gly Lys Gln Leu Thr Val Lys Arg
485 490 495
Gln Gly Leu Tyr Tyr Ile Tyr Ala Gln Val Thr Phe Cys Ser Asn Arg
500 505 510
Glu Ala Ser Ser Gln Ala Pro Phe Ile Ala Ser Leu Cys Leu Lys Ser
515 520 525
Pro Gly Arg Phe Glu Arg Ile Leu Leu Arg Ala Ala Asn Thr His Ser
530 535 540
Ser Ala Lys Pro Cys Gly Gln Gln Ser Ile His Leu Gly Gly Val Phe
545 550 555 560
Glu Leu Gln Pro Gly Ala Ser Val Phe Val Asn Val Thr Asp Pro Ser
565 570 575
Gln Val Ser His Gly Thr Gly Phe Thr Ser Phe Gly Leu Leu Lys Leu
580 585 590
<210> 64
<211> 582
<212> PRT
<213> 人工序列(Artificial sequence)
<220>
<223> 合成序列
<400> 64
Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr Phe Ser Pro Ala
1 5 10 15
Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe Thr Cys Ser Phe
20 25 30
Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr Arg Met Ser Pro
35 40 45
Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu Asp Arg Ser Gln
50 55 60
Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu Pro Asn Gly Arg
65 70 75 80
Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn Asp Ser Gly Thr
85 90 95
Tyr Leu Cys Gly Ala Ile Ser Leu Ala Pro Lys Ala Gln Ile Lys Glu
100 105 110
Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg Ala Glu Val Pro
115 120 125
Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly Gln Phe Gln Ser
130 135 140
Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly
145 150 155 160
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Gln Leu Met
165 170 175
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln
180 185 190
Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val
195 200 205
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr
210 215 220
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Ser Gly
225 230 235 240
Lys Glu Tyr Lys Cys Lys Val Ser Ser Lys Gly Leu Pro Ser Ser Ile
245 250 255
Glu Lys Thr Ile Ser Asn Ala Thr Gly Gln Pro Arg Glu Pro Gln Val
260 265 270
Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser
275 280 285
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
290 295 300
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
305 310 315 320
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val
325 330 335
Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Leu
340 345 350
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
355 360 365
Leu Gly Lys Ile Glu Gly Arg Met Asp Ala Cys Pro Trp Ala Val Ser
370 375 380
Gly Ala Arg Ala Ser Pro Gly Ser Ala Ala Ser Pro Arg Leu Arg Glu
385 390 395 400
Gly Pro Glu Leu Ser Pro Asp Asp Pro Ala Gly Leu Leu Asp Leu Arg
405 410 415
Gln Gly Met Phe Ala Gln Leu Val Ala Gln Asn Val Leu Leu Ile Asp
420 425 430
Gly Pro Leu Ser Trp Tyr Ser Asp Pro Gly Leu Ala Gly Val Ser Leu
435 440 445
Thr Gly Gly Leu Ser Tyr Lys Glu Asp Thr Lys Glu Leu Val Val Ala
450 455 460
Lys Ala Gly Val Tyr Tyr Val Phe Phe Gln Leu Glu Leu Arg Arg Val
465 470 475 480
Val Ala Gly Glu Gly Ser Gly Ser Val Ser Leu Ala Leu His Leu Gln
485 490 495
Pro Leu Arg Ser Ala Ala Gly Ala Ala Ala Leu Ala Leu Thr Val Asp
500 505 510
Leu Pro Pro Ala Ser Ser Glu Ala Arg Asn Ser Ala Phe Gly Phe Gln
515 520 525
Gly Arg Leu Leu His Leu Ser Ala Gly Gln Arg Leu Gly Val His Leu
530 535 540
His Thr Glu Ala Arg Ala Arg His Ala Trp Gln Leu Thr Gln Gly Ala
545 550 555 560
Thr Val Leu Gly Leu Phe Arg Val Thr Pro Glu Ile Pro Ala Gly Leu
565 570 575
Pro Ser Pro Arg Ser Glu
580
- 包含基于PD-1的嵌合蛋白的组合疗法
- 包含基于TIM-3的嵌合蛋白的组合疗法
