火花爆破降解生物大分子的方法和装置
文献发布时间:2023-06-19 11:19:16
技术领域
本发明属于生物技术领域,具体涉及一种火花爆破降解生物大分子的方法和装置。
背景技术
生物大分子的降解主要通过两种途径:1)化学法。通过强酸/强碱反应或强氧化反应裂解大分子中的肽键、糖苷键、酯键等连接部位,使其逐步降解为氨基酸、糖、脂肪酸等基本单元(S.Chauhan á,E.Yankelevich á,V.M.Bystritskii,T.K.Wood.Degradation of 2,4,5-trichlorophenol and 2,3,5,6-tetrachlorophenol by combining pulse electricdischarge with bioremediation[J].Appl Microbiol Biotechnol,1999,52:261-266.);2)生物法。使用生物酶定向切开大分子中的特征连接部位,使其解体形成所需要的碎片。目前很少见到用物理学手段降解生物大分子的报道。虽然有学者报道过超声波对多糖和核酸的降解作用(付杰,郭学平,王凤山.超声对生物大分子的作用及其在透明质酸降解中的应用[J].中国生化药物杂志,2008,29(1):71~73.;肖凯,宣利江,徐亚明.拳参的DNA裂解活性成分研究[J].中草药,2003,34(3):203~205),但是由于超声波降解效果有限,鲜见后续报道。
电火花是常见易得的脉冲能量,介质击穿瞬间释放的能量被压缩在极短的时间范围(ms-ns)和极小的空间范围(um-pm)内,因此火花中心温度可达~10′000℃,压力可达~16′000atm,可以在1-2个分子自由程内产生巨大冲击波,足以裂解氢键、二硫键、疏水键等弱键。如控制在低温液体介质中操作,有可能成为一种极具潜力的物理降解方法。
发明内容
有鉴于此,本发明提出了一种火花爆破降解生物大分子的方法和装置,用于方便快捷地降解生物大分子。
为了达到上述目的,一方面,本发明提出了一种火花爆破降解生物大分子的方法,包括:
配制生物大分子溶液;
将正电极和负电极浸入所述生物大分子溶液;
在所述正电极和所述负电极之间施加脉冲电源,使所述正电极和所述负电极之间形成火花放电,从而降解所述生物大分子。
在一些实施例中,所述生物大分子选自蛋白质、核酸、多糖或腐殖酸。
在一些实施例中,所述脉冲电源的频率为500-1000Hz(例如600Hz、700Hz、800Hz或900Hz),电压为1×10
在一些实施例中,火花放电时间为1-5min(例如2min、3min或4min)。
在一些实施例中,所述生物大分子溶液利用去离子水、有机溶剂、Tris-HCl缓冲液、Tris-乙酸缓冲液、Tris-磷酸缓冲液、Tris-甘氨酸缓冲液或邻苯二甲酸-HCl缓冲液配制。
在一些实施例中,所述生物大分子溶液的浓度为0.01-1w/v%。
另一方面,本发明提出了一种火花爆破降解生物大分子的装置,包括:脉冲电源、正电极、负电极、电极固定器和样品池;
其中所述正电极和所述负电极分别与所述脉冲电源相连,并由所述电极固定器固定,在工作时,所述正电极和所述负电极浸入所述样品池。
在一些实施例中,所述脉冲电源为交直流电弧发生器,所述脉冲电源的频率为500-1000Hz(例如600Hz、700Hz、800Hz或900Hz),电压为1×10
在一些实施例中,所述正电极和所述负电极为铜电极。
在一些实施例中,所述正电极和所述负电极之间的距离能够通过所述电极固定器调节。
与现有技术相比,本发明具有以下有益效果:
已有的化学法对蛋白质的降解是肽键非选择性的,降解终产物是氨基酸;已有的酶法对蛋白质的降解有选择性,能够得到多肽片段,但是所得片段和外切酶自身有密切关系,且酶的工作温度需要严格控制。本发明提供的方法通过火花爆破在微小尺度内形成的高强度能量波将蛋白质分子击碎,其破碎位点和目标蛋白的物理结构以及肽键强度有关。该破碎方法既不受蛋白酶的切点制约,也不会完全切碎目标蛋白从而得到低价值的氨基酸。该方法操作便捷,有可能得到与传统酶切方法不同的肽段。本发明还可应用于多糖、核酸和腐殖酸等其他生物大分子,这对生化制药、食品加工和废弃物处理都有重要意义。
附图说明
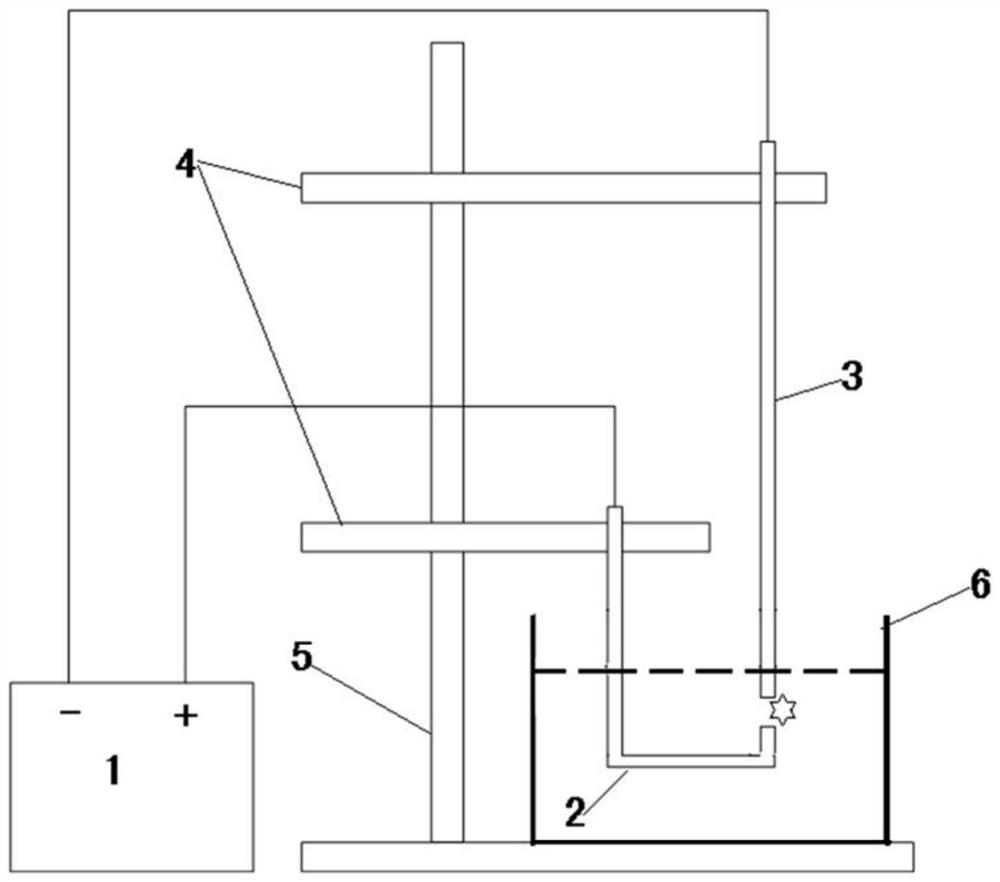
图1为本发明实施例中的装置结构示意图;
图2为本发明实施例中不同浓度BSA未经处理和处理2min后的SDS-PAGE电泳图;
其中:从左至右第1-5道为未经火花放电处理组(NT组),第6道为中低范围分子量MARKER,第7-11道为火花放电处理组(ST组)。Marker标尺分别为:97.4KD,85KD,43KD,31KD,20KD,14.4KD;
图3为本发明实施例中0.02%的BSA溶液经过不同时间火花放电处理的SDS-PAGE电泳图;
其中:第1泳道为未经火花放电处理的BSA,第2-6泳道分别为火花放电处理1-5min的样品;
图4为本发明实施例中0.01%BSA溶液经火花放电处理后的碎片质谱图;
图5为本发明实施例中腐殖酸大分子火花放电处理后的红外谱图。
具体实施方式
为使本发明的目的、技术方案和优点更加清楚明白,以下结合具体实施例,并参照附图,对本发明作进一步的详细说明。
实施例1
蛋白质是生命活动中最重要的生物大分子,本发明的实施例以蛋白质(在该实施例中具体为牛血清白蛋白(BSA))为研究对象,观察火花冲击波对生物大分子的降解作用。
1、材料和方法
1-1仪器和材料
交直流电弧发生器(中国有色金属研究总院),火花电极及夹具(北京朝阳外国语学校),DYCZ-24DN型双垂直蛋白电泳仪(北京六一生物科技有限公司),MOLDI-TOF质谱&液相色谱-三重四级杆质谱联用仪6460(Agilent),UV-1700型紫外可见分光光度计(日本岛津),FD-50真空冷冻干燥机(北京博医康实验仪器有限公司),WaterPro超纯水工作站(LABCONCO),WLD-4C光电直读光谱仪(北京瑞利分析仪器有限责任公司),HD-5电脑紫外监测仪(上海沪西分析仪器厂),KQ-100DE数控超声波清洗器,78-1磁加热搅拌器,直径1mm铜丝导线,手工工具箱。
1-2试剂
牛血清白蛋白BSA(Takara),中低分子量蛋白MARKER(Biomed),超低分子量蛋白MARKER(Biomed)、SDS-PAGE电泳配套试剂(北京经科宏达生物技术有限公司),茚三酮(分析纯,北京经科宏达生物技术有限公司)。
1-3实验方法
1-3-1.实验装置
如图1所示,本发明的装置包括脉冲电源1、正电极2、负电极3、电极固定器4、支架5和样品池6。在该实施例中,脉冲电源1为交直流电弧发生器,正电极2和负电极3为铜丝,分别连接至交直流电弧发生器的正负极,并通过电极固定器4(例如夹具)固定在支架5上。通过电极固定器4可以微调正电极2和负电极3之间的间距,以火花刚刚爆发为最佳间距。将正电极2和负电极3浸渍于样品池6中。启动脉冲电源,进行火花放电。电弧发生器的工作参数为:频率800Hz;电压2×10
1-3-2.BSA溶液配制
用50mM Tris-HCl(pH6.8)配制0.03%(w/v),0.05%(w/v)和0.1%(w/v)的BSA溶液,冰盒存放。使用前于4℃冰箱中暂存,需要测试时迅速取出。
1-3-3.SDS-PAGE电泳
以中低分子量蛋白Marker(117KD-19KD)和未电脉冲作用的样品为参照,使用12%的分离胶和5%的浓缩胶,上样量10微升,电泳3h,考马斯亮蓝(CBB)染色30min,甲醇溶液脱色后观察BSA特征条带的变化。
1-3-4.Tricine-SDS-PAGE电泳
以超低分子量蛋白Marker(17.4KD-3.3KD)和未电脉冲作用的样品为参照,使用16%分离胶(6M尿素胶丙烯酰胺凝胶),4%的浓缩胶,上样量5微升,电泳3h,CBB染色30min,甲醇溶液脱色后观察样品的分子量变化。
1-3-5.质谱检测
根据电泳的指示,将发生蛋白质降解的样品进行脱盐处理,利用MOLDI-TOF质谱和四级杆质谱检测66000道尔顿(BSA的分子量)以下碎片的分子量。
1-3-6.茚三酮反应
根据电泳的结果,取发生降解作用的蛋白溶液1ml,加茚三酮溶液4ml,100℃水浴加热2min,观察溶液颜色变化。如溶液变为蓝紫色,提示其中含有游离氨基酸。
1-3-7.蛋白质降解测试
分别用配制不同浓度的BSA缓冲溶液(4℃),取15ml溶液置于适合的小烧杯中。将安装好的铜丝电极浸入烧杯,用夹具调好电极间距,接通电源火花作用2min。作用后将样品收集到EP管中,根据需要进行SDS-PAGE、Tricine-SDS-PAGE、MOLDI-TOF、四级杆质谱等检测。
2、结果与分析
2-1观察到的主要现象
接通电源后,电极间产生激烈的放电,爆发出炫目的白光。电火花附近的溶液中不断有气泡产生并向四周扩散,使烧杯中的液体不停扰动。放电过程中释放出的气体有明显的臭氧味。在放电2-3min后BSA溶液中开始出现蛋白质沉淀,随着电火花处理时间延长沉淀增多,水温也有所上升,提示火花放电对BSA的生物活性有较大影响。为防止蛋白质沉淀影响观察裂解效应,本研究中设置火花处理时间为2分钟。
2-2不同浓度BSA溶液的火花降解作用
配制浓度0.01-0.05%的BSA溶液,火花放电处理2min,取样上SDS-PAGE电泳。配制同等浓度未经火花放电处理的BSA样品,同步上样作为对照。结果如图2所示。NT组和ST组均在66000D处呈现条带,其中NT组的条带深度明显强于ST组,说明经过火花放电处理后,BSA蛋白浓度有所下降。其中0.01%浓度(第5、7两道)和0.02%浓度(第4、8两道)的电泳差异尤为明显。ST组中,0.01-0.02%浓度的两条泳道中,目标蛋白的条带几乎消失。由于本实验控制火花处理时间在2min,处理后未见BSA蛋白沉淀。因此,经火花放电处理后即使有BSA变性沉淀发生其沉淀量也非常少,特征条带的消失提示火花放电能够降解BSA蛋白,使其成为较小的碎片。从0.03%到0.05%浓度的ST条带也支持这个结果。随着BSA浓度的增加,条带颜色逐渐加深,但ST组的条带颜色均明显弱于NT组。用Tricine-SDS-PAGE电泳重复该实验,得到了同样的结论(图略)。
2-3 BSA溶液火花降解的时间效应
配制浓度0.02%的BSA溶液,火花放电处理1-5min,取样上SDS-PAGE电泳。以未经处理的样品(0min)为对照,结果如图3所示。结果表明,未经火花降解处理的BSA在泳道上呈现清晰条带(BSA电泳有杂带可能是样品不纯引起),经1min电火花处理后,条带颜色明显减弱,经2min处理后特征条带几乎已经无法分辨。经3min及更长时间处理,泳道上无法分辨出特征条带。上述结果表明,对于15ml浓度0.02%(w/v)的BSA溶液,只需≥2min左右即能完全降解溶液中的BSA。
2-4降解碎片质谱分析
取浓度0.01%的BSA溶液,经电火花降解处理2min后,取样送四级杆质谱仪Agilent 6460分析溶液中的碎片情况,结果如图4所示。质谱结果表明,BSA蛋白几乎被完全打碎,10KD以上未见质谱峰信号。碎片集中在1000-5000D范围内,尤其以2900-3400D范围内的碎片为主。由于氨基酸残基的平均分子量约为120,据此推算,此类碎片由大约25个氨基酸构成,说明火花放电只能部分降解BSA分子,但很可能无法将其完全击碎。
2-5降解溶液的茚三酮反应
茚三酮能与氨基酸(或游离α-氨基和α-羧基)发生反应,在加热条件及弱酸环境下生成紫蓝色化合物。取浓度0.01%的BSA溶液,经电火花降解处理2-5min后,取样进行茚三酮检测,结果表明,降解作用后的溶液颜色没有任何变化(pH微酸性符合茚三酮反应条件)。据此表明,BSA的火花降解产物中,不含(或很少含)氨基酸。
实施例2
腐殖酸是富含糖/酯/核苷结构的复杂分子,也是最常见的天然有机大分子。称取10g腐殖酸溶于500ml浓度为0.1M的Tris-甘氨酸缓冲液(pH8.3)中,超声处理30min,使腐殖酸充分溶解。定溶于1L容量瓶,配制0.01g/ml腐殖酸储备液,采用100kDa超滤管进行粒径分离,得到分子量>100kDa的腐殖酸组分A。将A悬浮于Tris-甘氨酸缓冲液中,使得终浓度为10mg/ml,按上述实施例1的操作进行火花降解3min(电弧发生器的工作参数为:频率500Hz;电压5×10
图5表明,腐殖酸大分子A在3500/cm处有明显的属于酚、醇、羧基等的-OH吸收峰,经过火花降解之后-OH吸收峰未见显著变化,说明酚、醇、羧基等官能团未被显著破坏。高分子量腐殖酸在2980/cm和2850/cm处出现了分别归属于脂肪结构的对称和不对称的-CH2-伸缩振动峰,但是在B溶液中该结构几乎被完全破坏。1720/cm处有属于羧酸的C=O伸缩振动,该结构在B中保存下来。1460/cm处的吸收峰通常被认为是芳环(C=C)和脂肪族C-H的振动,高分子量腐殖酸在峰两侧出现多个尖峰,说明其芳环中的取代基数量较多,但是在B中仅有部分结构保留下来。在1180/cm处有属于饱和醇和糖类的吸收峰,AB结果出现了较大的分化,提示在火花降解过程中,糖结构遭到了较大的破坏,同时有新的反应发生。以上结果表明,3min的火花降解对腐殖酸大分子的糖、酯结构产生了充分的破坏作用。
对比例1
按照实施例2准备腐殖酸大分子A,在200ml的1M磷酸二氢钠-NaOH缓冲液(pH8.3)中充分溶解,使其浓度为0.01g/ml。以金刚石电极(BDD)为阳极,铂片(Pt)为阴极,电极间隔为3.0cm的电解装置进行电解实验,设置恒定电流为40mA,实验温度为室温20℃,电解3min后取上清溶液,观察傅里叶红外光谱,结果表明,常规电解方法短时间作用于腐殖酸大分子,所得产物的红外光谱完全没有变化(图略)。
本发明研究了火花放电能量冲击波对BSA蛋白和腐殖酸大分子的降解作用。实验结果表明,火花放电能显著降低溶液中生物/有机大分子的浓度,且作用效率较高。浓度0.02%(w/v)的BSA溶液,只需2min处理,几乎能完全将BSA蛋白击碎。浓度为0.01mg/ml的腐殖酸大分子,只需3min处理,几乎完全打碎酯类和糖类结构。
本发明的研究还表明,火花放电能量冲击波对BSA蛋白的降解作用具有一定的位点选择性。从实验结果看,尽管BSA蛋白几乎被完全击碎,但并未被降解成氨基酸。BSA蛋白大概率是以多肽模块的形式被击碎的,其碎片大部分是含有~25个氨基酸的肽段。这说明火花放电产生的能量冲击波很可能只能击碎生物大分子中的某些弱键,如氢键、二硫键、疏水键等,从而主要形成多肽片段,而很少形成氨基酸。
本发明的研究证明,通过物理学方法形成的能量冲击波有可能以较高效率降解生物大分子。虽然在火花放电的过程中,不可避免存在高温和随之带来的氧化反应,但仅仅从降解产物看,多肽是主要的降解产物。这提示我们,火花放电所产生的能量冲击波对BSA的降解很可能具有一定程度的位点选择性。如果能深入研究并掌握其中的细节,有可能形成一种新的降解生物大分子方法,这对于目前化学降解法和生物酶法来说,是极有意义的补充。
以上所述的具体实施例,对本发明的目的、技术方案和有益效果进行了进一步详细说明,应理解的是,以上所述仅为本发明的具体实施例而已,并不用于限制本发明,凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 火花爆破降解生物大分子的方法和装置
- 一种可生物降解的大分子防污剂及其制备方法与应用
