一种可用于蛋白质阈值检测的传感器及其检测方法
文献发布时间:2023-06-19 11:49:09
技术领域
本发明属于蛋白质阈值检测领域,尤其涉及一种可用于蛋白质阈值检测的传感器及其检测方法。
背景技术
蛋白质是生物体内重要的生物分子,具有很多重要的生理功能,如能量的储存和代谢,细胞功能调节等。独特蛋白质的表达可作为生物体或细胞活动的生物标志。蛋白质的异常表达往往与疾病发生相关。因此,准确无误的蛋白质的测定对基础研究、临床诊断都具有非常重要的意义。目前检测蛋白质的主流方法是基于抗体-抗原作用的免疫分析法,包括放射免疫分析、胶体金免疫分析、酶免疫分析、荧光免疫分析和发光免疫分析等。这些方法需要在抗体上标记放射性元素、酶或者荧光基团等信号指示元件进行信号转换,因此,抗体制备过程复杂耗时,而且抗体的稳定性和修饰效率也对分析性能形成制约。相比之下,有“化学抗体”之称的核酸适配体(简称适配体),作为一段短的单链寡核酸,在稳定性和易于修饰等诸多方面展现的优异性能,更有利于作为分子识别受体,用于检测方法的构建。而由于蛋白质类物质也是目前数量最多的一类适配体靶标,约占总体的79%,因此,蛋白质检测已成为适配体传感器中最常见的应用之一。
基于适配体的蛋白质传感器的研究方向,目前主要集中于探索不同的信号放大策略,不断提高检测的灵敏度,获得更低的检测下限和更广的线性范围,缩短检测的窗口期。而面对以即时、现场、大规模筛查等为特点的基层检测需求而言,能够快速、直观的判断出蛋白质水平是否异常或许更为重要。为了实现这一目的,常规的做法是优化识别元件和信号指示元件中各组分的浓度,使检测信号在正常阈值浓度处产生突变。如《ACS AppliedMaterials&Interfaces》期刊2019年,第11卷,第9841-9849页发表的“Colorimetric andfluorescent dual-mode immunoassay based on plasmon-enhanced fluorescence ofpolymer dots for detection of PSA in whole blood”一文中公开了一种比色、荧光双模式免疫分析方法,用于检测全血中的前列腺特异性抗原(PSA)。通过优化检测抗体/捕获抗体的浓度和Au650@Pdot-抗体复合物的数量,以期实现对PSA阈值浓度(4ng/mL)的检测。实验结果表明,当PSA浓度低于3ng/mL时,试纸条上的测试条带基本不显色;而当PSA浓度达到或超过5ng/mL时,试纸条上出现粉红色/紫色测试条带。
然而,上述以检测体系组分浓度优化的方式进行阈值检测,仍存在以下问题:一方面,通过优化多种组分浓度进行调节,这种方式通常需要对多个因素、多个水平进行多次实验,操作繁杂,费时费力;另一方面,文中公开的调节方式虽然最终实现了在3ng/mL和5ng/mL之间出现检测信号的转折点,然而,这里需要特别注意的是,PSA的正常阈值浓度为4ng/mL。当样品中PSA浓度小于4ng/mL,则表示正常。当样品中PSA浓度小于4ng/mL,则说明需要做进一步确诊检查,而文中显示当PSA浓度达到或超过5ng/mL时,才会出现特征性信号变化,调节精度不够,并未实现准确的阈值检测。
发明内容
针对现有技术存在的不足之处,本发明所要解决的技术问题是克服现有蛋白质阈值检测存在的操作复杂且调节精度不高的问题,提出一种具有操作简单、省时省力,在保证检测灵敏性的同时亦保证调节方式的精确性特点的一种可用于蛋白质阈值检测的传感器及其检测方法。
为解决所述技术问题,本发明采用的技术方案为:
本发明一方面提供一种可用于蛋白质阈值检测的传感器,包括
磁珠,所述磁珠表面富含羧基官能团;
捕获适配体,包括适配体1,所述适配体1的5′端修饰氨基基团;
检测适配体,包括适配体2与引发序列,所述引发序列如SEQ ID NO.1所示;
7组发夹探针组合,由一条HP1分别和7条HP2组合而成,包括存在1个T-T错配位点的HP1、1TT-HP2,存在3个T-T错配位点的HP1、3TT-HP2,存在5个T-T错配位点的HP1、5TT-HP2,存在7个T-T错配位点的HP1、7TT-HP2,存在10个T-T错配位点的HP1、10TT-HP2,存在12个T-T错配位点的HP1、12TT-HP2,存在15个T-T错配位点的HP1、15TT-HP2,序列如下:
显色反应体系,所述显色反应体系中汞离子溶液的浓度为2nM-10nM。
本发明另一方面提供了上述传感器的检测方法,包括捕获适配体@磁珠的制备步骤、纳米金胶体浓缩液的制备步骤、显色试纸的制备步骤、以及蛋白质的阈值检测步骤。
优选的,所述捕获适配体@磁珠的制备步骤包括:
配制MEST溶液,所述MEST溶液中2-(N-吗啉基)乙磺酸的浓度为100mM,Tween 20的体积浓度为0.05%;
配制EDC溶液,向1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐中加入所述MEST溶液,得到10mg/mL的EDC溶液;
配制NHS溶液,向N-羟基琥珀酰亚胺中加入所述MEST溶液,得到10mg/mL的NHS溶液;
磁珠表面羧基活化;
配制100nM的捕获适配体溶液;
配制封闭液;
偶联反应得到捕获适配体@磁珠。
优选的,所述纳米金胶体浓缩液的制备步骤包括:配制10mmol/L氯金酸溶液,配制13.6mol/L柠檬酸钠溶液,配制纳米金胶体溶液;对所述纳米金胶体溶液进行离心,弃掉上清溶液,得到所述纳米金胶体浓缩液。
优选的,所述蛋白质的阈值检测步骤包括标准比色卡的制备步骤,以及定性判断及半定量分析步骤。
优选的,所述标准比色卡的制备步骤包括:
配制标准溶液配制,包括在蛋白质正常阈值附近,以1ng/mL为间隔,选取五个不同的浓度,配制5个浓度的标准溶液;
靶标分析物的识别与捕获,将所述捕获适配体@磁珠与所述标准溶液混合后充分反应,分离,洗涤,完成靶标分析物的识别与捕获;
检测适配体结合,将完成靶标分析物的识别与捕获的所述捕获适配体@磁珠与检测适配体溶液混合后充分反应,分离,洗涤,完成检测适配体结合;
杂交链式反应与汞离子结合,包括配制发夹探针HP1和7TT-HP2溶液,配制汞离子溶液,将完成检测适配体结合的所述捕获适配体@磁珠与所述HP1和7TT-HP2溶液、以及所述汞离子溶液混合充分反应形成HCR-靶标-捕获适配体@磁珠、并利用所述HCR-靶标-捕获适配体@磁珠结合汞离子;
显色反应,包括过氧化氢溶液的配制,以及取完成杂交链式反应与汞离子结合后得到的上清液进行显色反应;
显色阈值调整步骤,包括如果显色阈值高于正常阈值,则选择具有更高T-T错配位点数的发夹探针HP1和HP2重复进行检测,如果显色阈值低于正常阈值,则选择具有更低T-T错配位点数的发夹探针HP1和HP2重复进行检测,直至显色阈值与正常阈值相同,得到适用于所述蛋白质的发夹探针HP1和HP2及标准比色卡。
优选的,各组发夹探针HP1和HP2形成的HCR-靶标-捕获适配体@磁珠结合汞离子后,汞离子的剩余率为8.80%-99.18%;所述显色反应步骤中,汞离子的浓度为2nM<汞离子浓度≤10nM。
优选的,所述配制汞离子溶液得到的汞离子溶液的浓度为60.6-681nM;所述杂交链式反应与汞离子结合步骤中,汞离子结合之前在溶液中的浓度为20.2nM-227nM。
优选的,所述定性判断及半定量分析步骤包括:
靶标分析物的识别与捕获,将所述捕获适配体@磁珠与样品液混合后充分反应,分离,洗涤,完成靶标分析物的识别与捕获;
检测适配体结合,将完成靶标分析物的识别与捕获的所述捕获适配体@磁珠与检测适配体溶液混合后充分反应,分离,洗涤,完成检测适配体结合;
杂交链式反应与汞离子结合,包括选择所述适用于所述蛋白质的发夹探针HP1和HP2作为发夹探针组合进行杂交链式反应与汞离子结合;
显色反应;
定性判断与半定量分析,包括观察上述显色反应得到的检测试纸上显示的颜色,并与所述标准比色卡对比,定性判断样品中的靶标浓度是否超过正常阈值,及半定量分析蛋白质水平。
优选的,所述检测方法可以实现的阈值检测范围是4-25ng/mL。
与现有技术相比,本发明的有益效果在于:
本发明提供了一种可用于蛋白质阈值检测的传感器及其检测方法,为控制肉眼可辨的蓝色到无色的颜色转折点发生在正常阈值浓度处,本发明对发夹探针HP1和HP2的序列进行了合理设计,提供了七组发夹探针HP1和HP2组合,在检测适配体引发下,每个发夹探针组合杂交形成的HCR长链中,存在不同数量的T-T错配位点(以HCR长链中的HP1-HP2杂交单元为单位,其中包含的T-T错配位点数分别为:1、3、5、7、10、12、15个),对汞离子具有区分性结合能力,通过调节HCR长链中T-T错配位点的数量,影响汞离子的结合能力,继而影响汞离子的剩余数量,以及纳米金粒子的过氧化物酶模拟酶活性,最终对颜色转折点形成调节,这种牵一发而动全身的调节方式,操作简单,省时省力,而且,由于设置了杂交链式反应和汞离子促进纳米金粒子过氧化物酶模拟酶活性两个信号放大反应,在保证检测灵敏性的同时,亦保证的调节方式的精确性。
附图说明
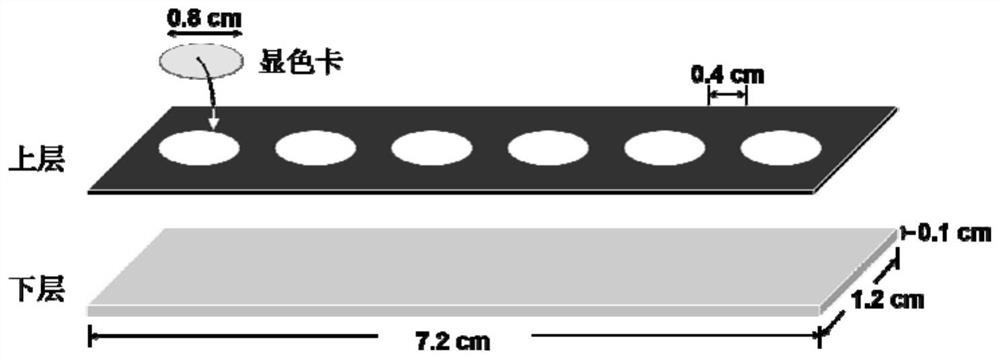
图1为本发明实施例所提供的检测试纸结构示意图;
图2为本发明实施例所提供的不同的发夹探针HP1和HP2组合的得到的显色结果示意图。
具体实施方式
下面将结合附图对本发明具体实施例中的技术方案进行详细、完整的描述。显然,所描述的实施例仅仅是本发明总的技术方案的部分具体实施方式,而非全部的实施方式。基于本发明的总的构思,本领域普通技术人员所获得的所有其他实施例,都落于本发明保护的范围。
本发明一方面提供一种可用于蛋白质阈值检测的传感器,包括
磁珠,所述磁珠表面富含羧基官能团;
捕获适配体,包括适配体1,所述适配体1的5′端修饰氨基基团;
检测适配体,包括适配体2与引发序列,所述引发序列如SEQ ID NO.1所示;
7组发夹探针组合,由一条HP1分别和7条HP2组合而成,包括存在1个T-T错配位点的HP1、1TT-HP2,存在3个T-T错配位点的HP1、3TT-HP2,存在5个T-T错配位点的HP1、5TT-HP2,存在7个T-T错配位点的HP1、7TT-HP2,存在10个T-T错配位点的HP1、10TT-HP2,存在12个T-T错配位点的HP1、12TT-HP2,存在15个T-T错配位点的HP1、15TT-HP2,序列如下:
显色反应体系,所述显色反应体系中汞离子溶液的浓度为2nM-10nM。可以理解的是,适配体1可以替换成抗体,抗体本身就含有氨基,可以通过酰胺键共价结合到羧基磁珠上,构成捕获抗体;适配体2也可以替换成抗体,在引发序列的3′端修饰上巯基,抗体中含有氨基,以sulfo-SMCC(4-(N-马来酰亚胺甲基)环己烷-1-羧酸3-磺基-N-羟基琥珀酰亚胺酯钠盐)为交联剂,即可实现引发序列与抗体的连接,获得检测抗体。
上述技术方案具体限定了7组发夹探针HP1和HP2的序列,序列如表1所示。
表1发夹探针HP1和HP2的序列
发夹探针HP1和HP2的具体序列如表1所示,其中,斜体字表示粘性末端,粗字体表示发夹中的茎序列,T-T错配位点用下划线标出。关于该序列的设计,需要说明的是,本发明中涉及的核酸序列包括发夹探针HP1、HP2和检测适配体中的引发序列。从杂交链式反应的原理来看,HP2和引发序列均与HP1相关,因此,核酸序列的设计关键在于设计HP1。HP1的发夹结构包含粘性末端、茎和环。其中,粘性末端和环的序列我们取序列(5′-TACGTTGCTTCTCTGCCTGTTGCTCTTCTT-3′),从中间剪切开,形成两段序列,每段序列中均含有一个富含T的结构域。将靠近5′端的一段序列(5′-TACGTTGCTTCTCTG)作为HP1的粘性末端,而将靠近3′端的一段序列(5′-CCTGTTGCTCTTCTT-3′)作为HP1的环;为了保证发夹结构的亚稳定性,要求茎长度大于粘性末端的长度,得到HP1序列,组装起来为:5′-TACGTTGCTTCTCTGATGTATGCTTAGGGTCCCTGTTGCTCTTCTTGACCCTAAGCATACAT-3′;
根据HP1的序列及杂交链式反应原理,我们编写出了‘原始’HP2((5′-GACCCTAAGCATACATCAGAGAAGCAACGTAATGTATGCTTAGGGTCAAGAAGAGCAACAGG-3′)和引发序列(5′-GACCCTAAGCATACATCAGAGAAGCAACGTA-3′);
这样三条核酸链形成的HCR长链中,不存在T-T错配位点。接着,我们通过在‘原始’HP2序列的环和粘性末端中将部分A碱基替换成T碱基,使形成的杂交单元中分别含有1、3、5、7、10、12、15个T-T错配位点,最终形成了七组发夹探针。
该实施例还具体限定了显色反应体系中汞离子溶液的浓度为2nM-10nM,原因在于,汞离子是纳米金酶活性的促进剂,可以促进纳米金催化TMB氧化,形成显色。由于汞离子自身的毒性,出于环保的考量,我们希望尽可能减小汞离子的浓度。因此,我们将制备的纳米金胶体溶液浓缩了10倍,形成纳米金胶体浓缩液(浓度约为1.8nM)使用。在这样的纳米金浓度下,我们通过改变汞离子的浓度来观察显色的影响。结果发现,在2nM<汞离子浓度≤10nM范围内,显色卡呈现无色到浅蓝再到深蓝的颜色变化。汞离子浓度为2nM时,显色卡呈现无色。而汞离子浓度大于10nM,显色卡均呈现深蓝色。因此,只需让显色体系中汞离子的剩余浓度在2nM-10nM,均可实现显色的调节。而要想实现阈值检测,则需要在靶标物质的阈值浓度处,剩余的汞离子浓度为2nM。接着我们考察了七组发夹探针形成的HCR-靶标-捕获适配体@磁珠对汞离子的结合能力,如表2所示。
表2各组发夹探针HP1和HP2组合对汞离子的结合能力
因为,阈值检测时,汞离子剩余浓度为2nM。再结合汞离子的剩余率,可以计算出汞离子在结合前,需要的浓度范围为2.02nM-22.7nM。而由于在显色反应体系中,加入的汞离子分离液实际被稀释了10倍。因此,可以推算出,汞离子结合步骤中,汞离子浓度范围为20.2nM-227nM,即实际使用的汞离子初浓度为60.6nM-681nM。若汞离子初浓度小于60.6nM,则说明无论使用怎样的探针组合,即使靶标浓度尚未达到阈值浓度,也显示无色。若汞离子初始浓度大于681nM,则说明即使靶标浓度大于阈值浓度,也显示为蓝色。
本发明另一方面提供了上述传感器的检测方法,包括捕获适配体@磁珠的制备步骤、纳米金胶体浓缩液的制备步骤、显色试纸的制备步骤、以及蛋白质的阈值检测步骤。
上述方法提供的检测原理如下:
蛋白质大分子可以与两条核酸适配体以“三明治”的形式进行结合,其中一条适配体可以作为捕获适配体,而另外一条可以构建成检测适配体。首先,将捕获适配体修饰到磁珠表面,得到捕获探针-捕获适配体@磁珠。将捕获适配体@磁珠与样品作用。只有样品中存在靶标分析物时,捕获适配体@磁珠才能与靶标分子、检测适配体三者结合,形成“三明治”结构,即检测适配体-靶标-捕获适配体@磁珠。由于,检测适配体上除了能与靶标分子结合的适配体序列外,还拼接了能引发杂交链式反应(HCR)的引发链序列。因此,通过简单磁分离,去除样品溶液,加入含有发夹探针HP1和HP2的反应溶液。检测适配体-靶标-捕获适配体@磁珠将引发杂交链式反应,HP1和HP2交替杂交,在磁珠表面形成HCR长链,即HCR-靶标-捕获适配体@磁珠;进一步的,由于我们在发夹探针的“粘性末端”和“环”序列中合理设置了碱基-胸腺嘧啶T,使形成的HCR长链中含有一定数量的T-T错配位点。磁分离去除反应液,加入汞离子溶液,在T-T错配位点对汞离子的特异性亲和作用下,汞离子结合在HCR-靶标-捕获适配体@磁珠上。磁分离操作下,吸取清液,其中包含未结合的汞离子溶液。与含有纳米金粒子、3,3',5,5'-四甲基联苯胺(TMB)、过氧化氢的反应溶液混合后,在汞离子的促进作用下,纳米金粒子获得较强过氧化物酶模拟酶活性,可催化TMB氧化反应,生成蓝色氧化型TMB(oxTMB)。由于HCR-靶标-捕获适配体@磁珠的结合作用,汞离子有部分甚至全部损失。因此,样品中的靶标物质浓度越高,最终呈现出的蓝色信号越浅,甚至为无色。如果样品中不存在靶标物质,捕获适配体@磁珠将不能与检测适配体结合,从而失去引发HCR的能力,最终导致体系中存在大量汞离子,对纳米金粒子的过氧化物酶模拟酶活性有极大提高,大量生成oxTMB,形成较深的蓝色。
上述方法提供的调节原理是这样的:
为控制肉眼可辨的蓝色到无色的颜色转折点发生在正常阈值浓度处,本发明对HP1和HP2的序列进行了合理设计,提供了七组发夹探针HP1和HP2组合。在检测适配体引发下,每个发夹探针组合杂交形成的HCR长链中,存在不同数量的T-T错配位点(以HCR长链中的HP1-HP2杂交单元为单位,其中包含的T-T错配位点数分别为:1、3、5、7、10、12、15个),对汞离子具有区分性结合能力。通过调节HCR长链中T-T错配位点的数量,影响汞离子的结合能力,继而影响汞离子的剩余数量,以及纳米金粒子的过氧化物酶模拟酶活性,最终对颜色转折点形成调节。这种牵一发而动全身的调节方式,操作简单,省时省力。而且,由于设置了杂交链式反应和汞离子促进纳米金粒子过氧化物酶模拟酶活性两个信号放大反应,在保证检测灵敏性的同时,亦保证的调节方式的精确性。
在一优选实施例中,所述捕获适配体@磁珠的制备步骤包括:
配制MEST溶液,所述MEST溶液中2-(N-吗啉基)乙磺酸的浓度为100mM,Tween 20的体积浓度为0.05%,可选的,称取0.0195g MES(2-(N-吗啉基)乙磺酸),加入999.5μL去离子水中,再加入0.5μL Tween 20,混合均匀后,得到MEST溶液(100mM MES,pH 5.0,0.05%Tween 20);
配制EDC溶液,向1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐中加入所述MEST溶液,得到10mg/mL的EDC溶液,可选的,称取0.001g EDC(1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐),加入100μL MEST溶液,混合均匀后,得到浓度为10mg/mL的EDC溶液;
配制NHS溶液,向N-羟基琥珀酰亚胺中加入所述MEST溶液,得到10mg/mL的NHS溶液,可选的,称取0.001g NHS(N-羟基琥珀酰亚胺),加入100μL MEST溶液,混合均匀后,得到NHS溶液(10mg/mL);
磁珠表面羧基活化,可选的,装有磁珠的离心管中,迅速加入上述新鲜配制的100μL EDC溶液和新鲜配制的100μL NHS溶液,涡旋混合使磁珠充分悬浮后,将离心管置于25℃恒温箱中活化30min,即完成磁珠表面羧基活化(注:在活化期间,须利用垂直混合仪进行颠倒混匀保持磁珠的悬浮状态,另外,活化后不宜长时间保存,须立即进行后续偶联反应),进一步的,在磁珠表面羧基活化之前还包括磁珠预处理,可选的,磁珠(BeaverBeads
配制100nM的捕获适配体溶液,可选的,取1μL 100μM捕获适配体母液,置于1.5mL离心管中,加入999μL PBS溶液(pH 7.2-7.6),得到100nM的捕获适配体溶液;
配制封闭液,可选的,称取0.002g牛血清白蛋白,置于1.5mL离心管中,并加入200μL PBS(含0.05%Tween-20)溶液,构成封闭液;
偶联反应得到捕获适配体@磁珠,可选的,将包含有活化好的磁珠悬浮液的离心管,置于磁性分离器中,静置30-60s,待磁珠与溶液完全分离后,去除清液,然后,加入300μL配制的100nM捕获适配体溶液,混合均匀后,放置于25℃恒温箱中偶联反应2h(注:在偶联期间,须利用垂直混合仪进行颠倒混匀保持磁珠的悬浮状态),偶联反应后,将离心管置于磁性分离器中,静置30-60s,待磁珠与溶液完全分离后,去除清液,然后,加入200μL配制的封闭液,混合均匀后,放置于25℃恒温箱中反应1h,对磁珠表面未反应的位点进行封闭(注:在封闭反应期间,须利用垂直混合仪进行颠倒混匀保持磁珠的悬浮状态),封闭反应后,将离心管置于磁性分离器中,静置30-60s,待磁珠与溶液完全分离后,去除清液,然后,加入200μL PBS溶液,涡旋振荡15-30s,再将离心管放置于磁性分离器中,静置30-60s,待磁珠与溶液完全分离后,去除清液,完成一次洗涤,重复洗涤三次后,加入1mL PBS溶液,得到捕获适配体@磁珠悬浮液。
在一优选实施例中,所述纳米金胶体浓缩液的制备步骤包括:配制10mmol/L氯金酸溶液,配制13.6mol/L柠檬酸钠溶液,配制纳米金胶体溶液;对所述纳米金胶体溶液进行离心,弃掉上清溶液,得到所述纳米金胶体浓缩液。可选的,具体包括:称取四氯金酸三水合物0.3938g,溶解于100mL去离子水中,得到10mmol/L氯金酸溶液;称取柠檬酸钠0.3510g,溶解于100mL去离子水中,得到13.6mol/L柠檬酸钠溶液;取上述四氯金酸溶液5mL,加入195mL的去离子水中,加热搅拌至沸腾后,加入上述柠檬酸钠溶液4mL,继续加热6min左右至颜色变成酒红色,停止加热,待溶液冷却至室温后,得到纳米金胶体溶液;将得到的纳米金胶体溶液以8000r/min的速度离心10-15min,弃掉上清溶液,加入10mL蒸馏水,即得到纳米金胶体浓缩液。
在一优选实施例中,所述显色试纸的制备步骤包括TMB溶液的配制以及检测试纸的制备,具体的,称取0.0024g TMB(3,3',5,5'-四甲基联苯胺),溶于1mL二甲基亚砜,得到10mM的TMB溶液;检测试纸由上下两层组成,如图1所示,下层为一塑料胶板(单面胶),尺寸为7.2cm(长)×1.2cm(宽)×0.1cm(厚),用于承载和粘合各部分物料,上层为一黑色卡纸,尺寸为7.2cm(长)×1.2cm(宽),其上均匀分布着六个直径为0.8cm、间隔为0.4cm的圆形通孔,黑色卡纸一方面用于提供黑色背景,便于观察显色点片上的颜色变化;另一方面其上的圆孔,通过下层胶板密封,形成了放置显色卡的腔室。显色卡的制备方法为:取一张定量滤纸(中速),用压花器,压出数个直径为0.8cm的圆形滤纸片,将滤纸片放置于直径30cm的圆形培养皿中,使每片单独放置不重叠,向每个滤纸片上滴加30μL,TMB溶液,然后,将培养皿盖子盖上,于25℃室温放置12-24h进行固定,固定完成后,将培养皿盖子打开,再将培养皿置于80℃烘箱中,烘干30-60min,至滤纸片上液体全部烘干,得到显色卡,组装时,先取下塑料胶板表面的隔离纸,露出背胶,然后,将黑色卡纸粘在胶板上,最后将显色卡分别粘到黑色卡纸上的圆孔内,得到检测试纸。
在一优选实施例中,所述蛋白质的阈值检测步骤包括标准比色卡的制备步骤,以及定性判断及半定量分析步骤。
在一优选实施例中,所述标准比色卡的制备步骤包括:
配制标准溶液配制,包括在蛋白质正常阈值附近,以1ng/mL为间隔,选取五个不同的浓度,配制5个浓度的标准溶液,可选的,在蛋白质正常阈值附近,以1ng/mL为间隔,选取五个不同的浓度,即(阈值-2)ng/mL、(阈值-1)ng/mL、(阈值)ng/mL、(阈值+1)ng/mL、(阈值+2)ng/mL,用PBS为溶剂,分别配制标准样品液;
靶标分析物的识别与捕获,将所述捕获适配体@磁珠与所述标准溶液混合后充分反应,分离,洗涤,完成靶标分析物的识别与捕获,可选的,将100μL的捕获适配体@磁珠悬浮液与100μL标准液混合于1.5mL离心管中,于37℃恒温箱中反应1-3h(注:反应期间,须利用垂直混合仪进行颠倒混匀保持磁珠的悬浮状态),反应结束后,将离心管置于磁性分离器中,静置30-60s,待磁珠与溶液完全分离后,去除清液,再加入200μL PBS溶液,涡旋振荡15-30s后,置于磁性分离器中,静置30-60s,待磁珠与溶液完全分离后,去除清液,完成一次洗涤,重复洗涤三次后,完成靶标分析物的识别与捕获;
检测适配体结合,将完成靶标分析物的识别与捕获的所述捕获适配体@磁珠与检测适配体溶液混合后充分反应,分离,洗涤,完成检测适配体结合,可选的,取1μL检测适配体母液,置于1.5mL离心管中,加入999μL PBS溶液,得到100nM的检测适配体溶液。从其中取300μL加入到含有完成样品识别与捕获的磁珠的离心管中,涡旋混匀使磁珠充分悬浮后,置于37℃恒温箱中,反应1-3h,反应结束后,将离心管置于磁性分离器中,静置30-60s,待磁珠与溶液完全分离后,去除清液,再加入200μL PBS溶液,涡旋振荡15-30s后,置于磁性分离器中,静置30-60s,待磁珠与溶液完全分离后,去除清液,完成一次洗涤,重复洗涤三次后,完成检测适配体的结合;
杂交链式反应与汞离子结合,包括配制发夹探针HP1和7TT-HP2溶液,配制汞离子溶液,将完成检测适配体结合的所述捕获适配体@磁珠与所述HP1和7TT-HP2溶液、以及所述汞离子溶液混合充分反应形成HCR-靶标-捕获适配体@磁珠、并利用所述HCR-靶标-捕获适配体@磁珠结合汞离子,可选的,配制发夹探针HP1和7TT-HP2溶液包括:取3μL 100μM的发夹探针HP1母液,置于1.5mL离心管中,加入999μL去离子水,得到300nM的发夹探针HP1溶液;取3μL 100μM的发夹探针7TT-HP2母液,置于1.5mL离心管中,加入999μL去离子水,得到300nM的发夹探针7TT-HP2溶液;配制汞离子溶液包括:称取0.0034g硝酸汞,溶于10mL去离子水中,得到1mM汞离子母液,然后,以去离子水为溶剂进行稀释,得到浓度为60.6-681nM的汞离子溶液;杂交链式反应与汞离子结合包括:将完成检测适配体结合的磁珠与100μL的300nM发夹探针-HP1溶液、100μL的300nM发夹探针7TT-HP2溶液,以及100μL的60.6-681nM汞离子溶液涡旋混合,待磁珠充分悬浮后,置于37℃恒温箱中,反应1-3h(注:反应期间,须利用垂直混合仪进行颠倒混匀保持磁珠的悬浮状态),反应结束后,将离心管置于磁性分离器中,静置30-60s,待磁珠与溶液完全分离后,取出清液置于1.5mL离心管中,完成杂交链式反应与汞离子结合;
显色反应,包括过氧化氢溶液的配制,以及取完成杂交链式反应与汞离子结合后得到的上清液进行显色反应,可选的,取100μL的30%过氧化氢溶液置于1.5mL离心管中,再加入900μL的去离子水,得到1M的过氧化氢溶液,取5μL杂交链式反应后分离得到的清液,5μL纳米金胶体浓缩液,5μL醋酸-醋酸钠缓冲液(pH 4.0),35μL的1M过氧化氢溶液,置于1.5mL离心管,涡旋振荡15-30s,待混合均匀后,取35μL混合液滴加到检测试纸上,静置5min后,用吸水纸将多余液体吸去,最后,利用手机后置摄像头进行拍摄,完成显色反应;
显色阈值调整步骤,包括如果显色阈值高于正常阈值,则选择具有更高T-T错配位点数的发夹探针HP1和HP2重复进行检测,如果显色阈值低于正常阈值,则选择具有更低T-T错配位点数的发夹探针HP1和HP2重复进行检测,直至显色阈值与正常阈值相同,得到适用于所述蛋白质的发夹探针HP1和HP2及标准比色卡。从原理上讲,样品中的靶标物质浓度越高,最终呈现出的蓝色信号越浅,甚至为无色(即显色点片原本的颜色)。将出现蓝色到无色的显色转折点时的靶标浓度命名为显色阈值,如果显色阈值与正常阈值相同,即可实现阈值检测的目的,因此,需要观察检测试纸中显色卡的显色情况,通过与空白显色卡的颜色比较,确定显色阈值,如果显色阈值高于正常阈值,则说明体系中剩余的汞离子过多,需要提高T-T错配位点数,将探针组合替换为10TT、12TT、15TT,重复检测过程,直至显色阈值与正常阈值相同,如果显色阈值低于正常阈值,则说明体系中剩余的汞离子过少,需要降低T-T错配位点数,将探针组合替换为1TT、3TT、5TT,重复检测过程,直至显色阈值与正常阈值相同,最后,用数码照相机(尼康D7000)分别采集显色试纸上的颜色,通过打印机(惠普377dw)打印在A4纸(道林100g)上形成标准比色卡。
在一优选实施例中,各组发夹探针HP1和HP2形成的HCR-靶标-捕获适配体@磁珠结合汞离子后,汞离子的剩余率为8.80%-99.18%;所述显色反应步骤中,汞离子的浓度为2nM<汞离子浓度≤10nM。
在一优选实施例中,所述配制汞离子溶液得到的汞离子溶液的浓度为60.6-681nM;所述杂交链式反应与汞离子结合步骤中,汞离子结合之前在溶液中的浓度为20.2nM-227nM。
在一优选实施例中,所述定性判断及半定量分析步骤包括:
靶标分析物的识别与捕获,将所述捕获适配体@磁珠与样品液混合后充分反应,分离,洗涤,完成靶标分析物的识别与捕获,可选的,将100μL制备的捕获适配体@磁珠悬浮液与100μL样品液混合于1.5mL离心管中,于37℃恒温箱中反应1-3h(注:反应期间,须利用垂直混合仪进行颠倒混匀保持磁珠的悬浮状态),反应结束后,将离心管置于磁性分离器中,静置30-60s,待磁珠与溶液完全分离后,去除清液,再加入200μL PBS溶液,涡旋振荡15-30s后,置于磁性分离器中,静置30-60s,待磁珠与溶液完全分离后,去除清液,完成一次洗涤,重复洗涤三次后,完成靶标分析物的识别与捕获。
检测适配体结合,将完成靶标分析物的识别与捕获的所述捕获适配体@磁珠与检测适配体溶液混合后充分反应,分离,洗涤,完成检测适配体结合,可选的,取1μL检测适配体母液,置于1.5mL离心管中,加入999μL PBS溶液,得到100nM的检测适配体溶液,从其中取300μL加入到含有完成样品识别与捕获的磁珠的离心管中,涡旋混匀使磁珠充分悬浮后,置于37℃恒温箱中,反应1-3h,反应结束后,将离心管置于磁性分离器中,静置30-60s,待磁珠与溶液完全分离后,去除清液,再加入200μL PBS溶液,涡旋振荡15-30s后,置于磁性分离器中,静置30-60s,待磁珠与溶液完全分离后,去除清液,完成一次洗涤,重复洗涤三次后,完成检测适配体的结合。
杂交链式反应与汞离子结合,包括选择所述适用于所述蛋白质的发夹探针HP1和HP2作为发夹探针组合进行杂交链式反应与汞离子结合,可选的,发夹探针组合的选择包括上述标准比色卡中使用的发夹组合,即为该靶标检测时需使用的发夹组合;发夹探针溶液的配制包括:取3μL 100μM的发夹探针HP1母液,置于1.5mL离心管中,加入999μL去离子水,得到300nM的发夹探针HP1溶液;取3μL 100μM的发夹探针HP2母液,置于1.5mL离心管中,加入999μL去离子水,得到300nM的发夹探针HP2溶液。称取0.0034g硝酸汞,溶于10mL去离子水中,得到1mM汞离子母液,然后,通过梯度稀释的方式,以去离子水为溶剂,得到浓度为300nM的汞离子溶液,将完成检测适配体结合的磁珠与100μL的300nM发夹探针HP1溶液、100μL的300nM发夹探针HP2溶液,以及100μL的300nM汞离子溶液涡旋混合,待磁珠充分悬浮后,置于37℃恒温箱中,反应1-3h(注:反应期间,须利用垂直混合仪进行颠倒混匀保持磁珠的悬浮状态),反应结束后,将离心管置于磁性分离器中,静置30-60s,待磁珠与溶液完全分离后,取出清液置于1.5mL离心管中,完成杂交链式反应与汞离子结合。
显色反应,包括取100μL的30%过氧化氢溶液置于1.5mL离心管中,再加入900μL的去离子水,得到1M的过氧化氢溶液;取5μL上述杂交链式反应后分离得到的清液,5μL纳米金胶体浓缩液,5μL醋酸-醋酸钠缓冲液(pH 4.0),35μL的1M过氧化氢溶液,置于1.5mL离心管,涡旋振荡15-30s。待混合均匀后,取35μL混合液滴加到显色试纸上,静置5min后,用吸水纸将多余液体吸去,最后,利用手机后置摄像头进行拍摄,完成显色反应。
定性判断与半定量分析,包括观察上述显色反应得到的检测试纸上显示的颜色,并与所述标准比色卡对比,定性判断样品中的靶标浓度是否超过正常阈值,及半定量分析蛋白质水平。
在一优选实施例中,所述检测方法可以实现的阈值检测范围是4-25ng/mL。本发明提供的检测方法包括以下功能单元:以磁珠为载体的磁分离单元;识别元件1-靶标分析物-识别元件2构成的“三明治”型识别单元(这里,识别元件1和2可以是一对适配体,或一对抗体,或抗体-适配体对);与识别元件2连接起来的杂交链式反应形成的汞离子结合单元;以及受汞离子影响的纳米金催化的TMB显色反应单元。原理上讲,汞离子结合单元可以与任意靶标分析物的识别单元偶联,而不需改变其中的序列。换句话说,汞离子结合单元的阈值调节能力对任意靶标分析物而言都是相同的。因此,我们以癌胚抗原为例,分别使用七组发夹探针进行检测,确定了它们的显色阈值(如下表所示)。这些显色阈值对其他肿瘤标志物阈值检测时发夹探针的选择具有重要的参考价值,也反映了本发明提供的方法可以实现的阈值检测范围是4-25ng/mL。
为了更清楚详细地介绍本发明实施例所提供的可用于蛋白质阈值检测的传感器及其检测方法,下面将结合具体实施例进行描述。
实施例1
(1)核酸链的序列设计
①捕获适配体
为了将适配体1以酰胺键共价结合到表面富含羧基官能团的磁珠上,设计适配体1的5′端修饰氨基基团。
捕获适配体序列为:
5′NH2-适配体1-3′
(注:这里的适配体1可以替换成抗体。抗体本身就含有氨基,可以通过酰胺键共价结合到羧基磁珠上,构成捕获抗体。)
②检测适配体
检测适配体由两段具有不同功能的结构域组成。
从5′端开始即为一段可以引发发夹探针HP1和HP2发生杂交链式反应的引发序列。与之相连的是,肿瘤标志物的另一条核酸适配体序列(适配体2),可以与肿瘤标志物特异性结合,并与捕获适配体构成“三明治”结构。
检测适配体序列为:
5′-GACCCTAAGCATACATCAGAGAAGCAACGTA-适配体2-3′
(注:这里的适配体2可以替换成抗体。在引发序列的3′端修饰上巯基,抗体中含有氨基,以sulfo-SMCC(4-(N-马来酰亚胺甲基)环己烷-1-羧酸3-磺基-N-羟基琥珀酰亚胺酯钠盐)为交联剂,即可实现引发序列与抗体的连接,获得检测抗体。)
③发夹探针HP1和HP2
本发明提供了七组不同的发夹探针组合,由一条HP1分别和7条HP2组合而成。在检测适配体引发下,每个发夹探针组合杂交形成的HCR长链中,存在不同数量的T-T错配位点。以HCR长链中的HP1-HP2杂交单元为单位,其中包含的T-T错配位点数分别为:1、3、5、7、10、12、15个。据此,对七组发夹探针中的HP2分别命名为:1TT-HP2、3TT-HP2、5TT-HP2、7TT-HP2、10TT-HP2、12TT-HP2、15TT-HP2。发夹探针HP1和HP2的具体序列如表1,其中,斜体字表示粘性末端,粗字体表示发夹中的茎序列,T-T错配位点用下划线标出。本专利中所涉及的核酸均委托生工生物工程(上海)股份有限公司合成,并根据说明书中提供的方法配制成浓度为100μM的核酸母液,以备使用。
(2)捕获适配体@磁珠的制备
步骤1:磁珠表面羧基活化
①MEST溶液的配制
称取0.0195g MES(2-(N-吗啉基)乙磺酸),加入999.5μL去离子水中,再加入0.5μLTween 20,混合均匀后,得到MEST溶液(100mM MES,pH 5.0,0.05%Tween 20)。
②EDC溶液的配制
称取0.001g EDC(1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐),加入100μLMEST溶液,混合均匀后,得到浓度为10mg/mL的EDC溶液。
③NHS溶液的配制
称取0.001g NHS(N-羟基琥珀酰亚胺),加入100μL MEST溶液,混合均匀后,得到NHS溶液(10mg/mL)。
④磁珠预处理
磁珠(BeaverBeads
⑤磁珠表面羧基活化
在(2)步骤1-④得到的装有预处理磁珠的离心管中,迅速加入(2)步骤1-②中新鲜配制的100μL EDC溶液和(2)步骤1-③中新鲜配制的100μLNHS溶液,涡旋混合使磁珠充分悬浮后,将离心管置于25℃恒温箱中活化30min,即完成磁珠表面羧基活化。
(注:在活化期间,须利用垂直混合仪进行颠倒混匀保持磁珠的悬浮状态。另外,活化后不宜长时间保存,须立即进行后续偶联反应。)
步骤2:捕获适配体@磁珠的制备
①捕获适配体溶液的配制
取1μL 100μM捕获适配体母液,置于1.5mL离心管中,加入999μL PBS溶液(pH 7.2-7.6),得到100nM的捕获适配体溶液。
②封闭液的配制
称取0.002g牛血清白蛋白,置于1.5mL离心管中,并加入200μL PBS(含0.05%Tween-20)溶液,构成封闭液。
③捕获适配体@磁珠的制备
将包含有(2)步骤2活化好的磁珠悬浮液的离心管,置于磁性分离器中,静置30-60s,待磁珠与溶液完全分离后,去除清液。然后,加入300μL(2)步骤2-①配制的100nM捕获适配体溶液,混合均匀后,放置于25℃恒温箱中偶联反应2h。(注:在偶联期间,须利用垂直混合仪进行颠倒混匀保持磁珠的悬浮状态。)
偶联反应后,将离心管置于磁性分离器中,静置30-60s,待磁珠与溶液完全分离后,去除清液。然后,加入200μL(2)步骤2-②配制的封闭液,混合均匀后,放置于25℃恒温箱中反应1h,对磁珠表面未反应的位点进行封闭。(注:在封闭反应期间,须利用垂直混合仪进行颠倒混匀保持磁珠的悬浮状态。)
封闭反应后,将离心管置于磁性分离器中,静置30-60s,待磁珠与溶液完全分离后,去除清液。然后,加入200μL PBS溶液,涡旋振荡15-30s。再将离心管放置于磁性分离器中,静置30-60s。待磁珠与溶液完全分离后,去除清液,完成一次洗涤。重复洗涤三次后,加入1mL PBS溶液,得到捕获适配体@磁珠悬浮液。
(3)纳米金胶体浓缩液的制备
①四氯金酸溶液的配制
称取四氯金酸三水合物0.3938g,溶解于100mL去离子水中,得到10mmol/L氯金酸溶液。
②柠檬酸钠溶液的配制
称取柠檬酸钠0.3510g,溶解于100mL去离子水中,得到13.6mol/L柠檬酸钠溶液。
③纳米金胶体溶液的制备
取(3)-①得到的四氯金酸溶液5mL,加入195mL的去离子水中,加热搅拌至沸腾后,加入(3)-②得到的柠檬酸钠溶液4mL,继续加热6min左右至颜色变成酒红色,停止加热,待溶液冷却至室温后,得到纳米金胶体溶液。
④纳米金胶体浓缩液的制备
将(3)-③得到的纳米金胶体溶液以8000r/min的速度离心10-15min,弃掉上清溶液,加入10mL蒸馏水,即得到纳米金胶体浓缩液。
(4)显色试纸的制备
①TMB溶液的配制
称取0.0024g TMB(3,3',5,5'-四甲基联苯胺),溶于1mL二甲基亚砜,得到10mM的TMB溶液。
②检测试纸的制备
检测试纸由上下两层组成,如图1所示。下层为一塑料胶板(单面胶),尺寸为7.2cm(长)×1.2cm(宽)×0.1cm(厚),用于承载和粘合各部分物料。上层为一黑色卡纸,尺寸为7.2cm(长)×1.2cm(宽),其上均匀分布着六个直径为0.8cm、间隔为0.4cm的圆形通孔。黑色卡纸一方面用于提供黑色背景,便于观察显色点片上的颜色变化;另一方面其上的圆孔,通过下层胶板密封,形成了放置显色卡的腔室。显色卡的制备方法为:取一张定量滤纸(中速),用压花器,压出数个直径为0.8cm的圆形滤纸片。将滤纸片放置于直径30cm的圆形培养皿中,使每片单独放置不重叠。向每个滤纸片上滴加30μL(4)-①中制得的TMB溶液,然后,将培养皿盖子盖上,于25℃室温放置12-24h进行固定。固定完成后,将培养皿盖子打开,再将培养皿置于80℃烘箱中,烘干30-60min,至滤纸片上液体全部烘干,得到显色卡。组装时,先取下塑料胶板表面的隔离纸,露出背胶。然后,将黑色卡纸粘在胶板上。最后将显色卡分别粘到黑色卡纸上的圆孔内,得到检测试纸。
(5)蛋白质的阈值检测方法
步骤1:标准比色卡的制备
①标准溶液配制
在蛋白质正常阈值附近,以1ng/mL为间隔,选取五个不同的浓度,即(阈值-2)ng/mL、(阈值-1)ng/mL、(阈值)ng/mL、(阈值+1)ng/mL、(阈值+2)ng/mL,用PBS为溶剂,分别配制标准样品液。
②靶标分析物的识别与捕获
将100μL(2)中制备的捕获适配体@磁珠悬浮液与100μL标准液混合于1.5mL离心管中,于37℃恒温箱中反应1-3h。(注:反应期间,须利用垂直混合仪进行颠倒混匀保持磁珠的悬浮状态。)
反应结束后,将离心管置于磁性分离器中,静置30-60s,待磁珠与溶液完全分离后,去除清液。再加入200μL PBS溶液,涡旋振荡15-30s后,置于磁性分离器中,静置30-60s,待磁珠与溶液完全分离后,去除清液,完成一次洗涤。重复洗涤三次后,完成靶标分析物的识别与捕获。
③检测适配体结合
取1μL检测适配体母液,置于1.5mL离心管中,加入999μL PBS溶液,得到100nM的检测适配体溶液。从其中取300μL加入到含有(5)-步骤1-②完成样品识别与捕获的磁珠的离心管中,涡旋混匀使磁珠充分悬浮后,置于37℃恒温箱中,反应1-3h。
反应结束后,将离心管置于磁性分离器中,静置30-60s,待磁珠与溶液完全分离后,去除清液。再加入200μL PBS溶液,涡旋振荡15-30s后,置于磁性分离器中,静置30-60s,待磁珠与溶液完全分离后,去除清液,完成一次洗涤。重复洗涤三次后,完成检测适配体的结合。
④杂交链式反应与汞离子结合
A.发夹探针HP1和7TT-HP2溶液的配制
取3μL 100μM的发夹探针HP1母液,置于1.5mL离心管中,加入999μL去离子水,得到300nM的发夹探针HP1溶液。
取3μL 100μM的发夹探针7TT-HP2母液,置于1.5mL离心管中,加入999μL去离子水,得到300nM的发夹探针7TT-HP2溶液。
B.汞离子溶液的配制
称取0.0034g硝酸汞,溶于10mL去离子水中,得到1mM汞离子母液。然后,以去离子水为溶剂进行稀释,得到浓度为60.6-681nM的汞离子溶液。
C.杂交链式反应与汞离子结合
将(5)-步骤1-③得到的完成检测适配体结合的磁珠与100μL的300nM发夹探针HP1溶液、100μL的300nM发夹探针7TT-HP2溶液,以及100μL的60.6-681nM汞离子溶液涡旋混合,待磁珠充分悬浮后,置于37℃恒温箱中,反应1-3h。(注:反应期间,须利用垂直混合仪进行颠倒混匀保持磁珠的悬浮状态。)
反应结束后,将离心管置于磁性分离器中,静置30-60s,待磁珠与溶液完全分离后,取出清液置于1.5mL离心管中,完成杂交链式反应与汞离子结合。
⑤显色反应
A.过氧化氢溶液的配制
取100μL的30%过氧化氢溶液置于1.5mL离心管中,再加入900μL的去离子水,得到1M的过氧化氢溶液。
B.显色反应
取5μL(5)-步骤1-④杂交链式反应后分离得到的清液,5μL(2)制备的纳米金胶体浓缩液,5μL醋酸-醋酸钠缓冲液(pH 4.0),35μL的1M过氧化氢溶液,置于1.5mL离心管,涡旋振荡15-30s。待混合均匀后,取35μL混合液滴加到(4)制备的检测试纸上,静置5min后,用吸水纸将多余液体吸去。最后,利用手机后置摄像头进行拍摄,完成显色反应。
⑥显色阈值调整
A.显色阈值与正常阈值的比较
从原理上讲,样品中的靶标物质浓度越高,最终呈现出的蓝色信号越浅,甚至为无色(即显色点片原本的颜色)。将出现蓝色→无色的显色转折点时的靶标浓度命名为显色阈值。如果显色阈值与正常阈值相同,即可实现阈值检测的目的。因此,需要观察(5)-步骤1-⑤得到的检测试纸中显色卡的显色情况,通过与空白显色卡的颜色比较,确定显色阈值。
如果显色阈值高于正常阈值,则说明体系中剩余的汞离子过多,需要提高T-T错配位点数。将(5)-步骤1-④中的探针组合替换为10TT、12TT、15TT。重复(5)-步骤1中①-⑥,直至显色阈值与正常阈值相同。
如果显色阈值低于正常阈值,则说明体系中剩余的汞离子过少,需要降低T-T错配位点数。将(5)-步骤1-④中的探针组合替换为1TT、3TT、5TT。重复(5)-步骤1中①-⑥,直至显色阈值与正常阈值相同。
最后,用数码照相机(尼康D7000)分别采集显色试纸上的颜色,通过打印机(惠普377dw)打印在A4纸(道林100g)上形成标准比色卡。
步骤2:定性判断及半定量分析
①靶标分析物的识别与捕获
将100μL(2)中制备的捕获适配体@磁珠悬浮液与100μL样品液混合于1.5mL离心管中,于37℃恒温箱中反应1-3h。(注:反应期间,须利用垂直混合仪进行颠倒混匀保持磁珠的悬浮状态。)
反应结束后,将离心管置于磁性分离器中,静置30-60s,待磁珠与溶液完全分离后,去除清液。再加入200μL PBS溶液,涡旋振荡15-30s后,置于磁性分离器中,静置30-60s,待磁珠与溶液完全分离后,去除清液,完成一次洗涤。重复洗涤三次后,完成靶标分析物的识别与捕获。
②检测适配体结合
取1μL检测适配体母液,置于1.5mL离心管中,加入999μL PBS溶液,得到100nM的检测适配体溶液。从其中取300μL加入到含有(5)-步骤2-①完成样品识别与捕获的磁珠的离心管中,涡旋混匀使磁珠充分悬浮后,置于37℃恒温箱中,反应1-3h。
反应结束后,将离心管置于磁性分离器中,静置30-60s,待磁珠与溶液完全分离后,去除清液。再加入200μL PBS溶液,涡旋振荡15-30s后,置于磁性分离器中,静置30-60s,待磁珠与溶液完全分离后,去除清液,完成一次洗涤。重复洗涤三次后,完成检测适配体的结合。
③杂交链式反应与汞离子结合
发夹探针组合的选择
(5)-步骤1获得的标准比色卡中使用的发夹组合,即为该靶标检测时需使用的发夹组合。
发夹探针溶液的配制
取3μL 100μM的发夹探针HP1母液,置于1.5mL离心管中,加入999μL去离子水,得到300nM的发夹探针HP1溶液。
取3μL 100μM的发夹探针HP2母液,置于1.5mL离心管中,加入999μL去离子水,得到300nM的发夹探针HP2溶液。
C.汞离子溶液的配制
称取0.0034g硝酸汞,溶于10mL去离子水中,得到1mM汞离子母液。然后,通过梯度稀释的方式,以去离子水为溶剂,得到浓度为300nM的汞离子溶液。
D.杂交链式反应与汞离子结合
将(5)-步骤2-②得到的完成检测适配体结合的磁珠与100μL的300nM发夹探针HP1溶液、100μL的300nM发夹探针HP2溶液,以及100μL的300nM汞离子溶液涡旋混合,待磁珠充分悬浮后,置于37℃恒温箱中,反应1~3h。(注:反应期间,须利用垂直混合仪进行颠倒混匀保持磁珠的悬浮状态。)
反应结束后,将离心管置于磁性分离器中,静置30~60s,待磁珠与溶液完全分离后,取出清液置于1.5mL离心管中,完成杂交链式反应与汞离子结合。
④显色反应
A.过氧化氢溶液的配制
取100μL的30%过氧化氢溶液置于1.5mL离心管中,再加入900μL的去离子水,得到1M的过氧化氢溶液。
B.显色反应
取5μL(5)-步骤2-③杂交链式反应后分离得到的清液,5μL(2)制备的纳米金胶体浓缩液,5μL醋酸-醋酸钠缓冲液(pH 4.0),35μL的1M过氧化氢溶液,置于1.5mL离心管,涡旋振荡15-30s。待混合均匀后,取35μL混合液滴加到(4)制备的显色试纸上,静置5min后,用吸水纸将多余液体吸去。最后,利用手机后置摄像头进行拍摄,完成显色反应。
⑤定性判断与半定量分析
观察(5)-步骤2-④中得到的检测试纸上显示的颜色,并与标准比色卡对比,定性判断样品中的靶标浓度是否超过正常阈值,及半定量分析蛋白质水平。
检测结果
癌胚抗原是一种具有人类胚胎抗原特性的酸性糖蛋白,经大量的临床实践,发现不仅胃肠道的恶性肿瘤癌胚抗原值可以升高,在乳腺癌、肺癌及其他恶性肿瘤的血清中也有升高。
(1)癌胚抗原的阈值检测
捕获适配体的序列为:
5′NH2-AAAAAGGGGGTGAAGGGATACCC-3′
引发适配体的序列为:
5′-GACCCTAAGCATACATCAGAGAAGCAACGTA-TTAACTTATTCGACCATA-3′
癌胚抗原的正常值为≤5ng/mL,因此,在做标准比色卡时,选取3ng/mL、4ng/mL、5ng/mL、6ng/mL、7ng/mL这五个浓度,分别顺序进行癌胚抗原的识别与捕获、检测适配体的结合、杂交链式反应(发夹探针组合为7TT)与汞离子结合(使用的汞离子溶液浓度为300nM)、显色反应。结果发现,五个样本所得的检测试纸上均呈现较深的蓝色。因此,将发夹组合换为10TT,重新进行实验。结果发现,显色试纸上开始出现蓝色向无色的转变,显色阈值出现在6ng/mL。接着,继续将发夹组合换为12TT,重新进行实验。结果发现,显色阈值出现在5ng/mL,与正常阈值浓度相同。显色结果如下图2所示。
(2)阈值检测的范围
本发明提供的检测方法包括以下功能单元:以磁珠为载体的磁分离单元;识别元件1-靶标分析物-识别元件2构成的“三明治”型识别单元(这里,识别元件1和2可以是一对适配体,或一对抗体,或抗体-适配体对。);与识别元件2连接起来的杂交链式反应形成的汞离子结合单元;以及受汞离子影响的纳米金催化的TMB显色反应单元。原理上讲,汞离子结合单元可以与任意靶标分析物的识别单元偶联,而不需改变其中的序列。换句话说,汞离子结合单元的阈值调节能力对任意靶标分析物而言都是相同的。因此,我们以癌胚抗原为例,分别使用七组发夹探针进行检测,确定了它们的显色阈值(如下表所示)。这些显色阈值对其他肿瘤标志物阈值检测时发夹探针的选择具有重要的参考价值,也反映了本发明提供的方法可以实现的阈值检测范围是4-25ng/mL。
- 一种可用于蛋白质阈值检测的传感器及其检测方法
- 一种蛋白质的检测方法及蛋白质检测阵列传感器
