基于流感病毒M2蛋白的细胞穿透肽
文献发布时间:2024-04-18 20:01:55
本申请是2019年11月01日提交的专利申请《基于流感病毒M2蛋白的细胞穿透肽》(申请号2019800688830)的分案申请。
技术领域
本发明属于蛋白质工程领域,涉及一种细胞穿透肽。具体而言,本发明提供了基于流感病毒M2蛋白的细胞穿透肽、其制备和改造方法以及相关用途。本发明还提供了包含这些细胞穿透肽的缀合物、融合蛋白和组合物,以及使用细胞穿透肽穿透细胞、向细胞中导入分子以及治疗疾病的方法。
背景技术
细胞穿透肽(cell penetrating peptides,CPP)是一类能够“穿透”细胞的多肽。细胞穿透肽的来源、序列长度和氨基酸组成各异,但都具有使质膜移位,并将生物活性分子例如蛋白质、肽、DNA、RNA和小分子药物等运输到细胞中的功能。自1988年首次报道了HIV-1病毒的转录反式激活蛋白(trans-activator of transcription,TAT)能够被细胞高效内化以来,本领域已经陆续发现了一些其它细胞穿透肽,包括Penetratin、DPV1047、MPG和Pep-1等。
许多治疗性分子例如抗生素、抗炎性药物、抗肿瘤药物和神经保护剂等由于细胞和组织障碍的存在而不能到达其特定靶标,特别是在靶标存在于细胞内的情况下,因此其治疗效果受到限制。由于细胞穿透肽能够穿透细胞,其可以用作媒介物将多种类型的治疗性分子运输到细胞中,使其到达靶标。目前已经有大量临床前研究评估了一些细胞穿透肽在疾病治疗中的价值,并在许多疾病模型包括癌症和心血管疾病中获得了有希望的结果。
尽管已经鉴定和评估了一些细胞穿透肽,然而,现有的细胞穿透肽存在各种问题,例如穿透细胞和将分子运输到细胞中的效率低,以及能够穿透的细胞类型有限等。因此,本领域对于新的细胞穿透肽存在需要,其具有高穿透效率,从而能够以低浓度将生物活性分子高效率递送到多种类型的细胞中。
流感病毒M2(Matrix-2)蛋白是一种存在于甲型流感病毒的病毒包膜中的质子选择性离子通道蛋白。该通道作为同源四聚体(由4个相同的M2单元组成)存在。在甲型流感病毒中,M2蛋白的质子传导对于病毒复制至关重要,因为它能够形成高选择性,pH调节的质子传导通道。
在甲型流感病毒中,M2蛋白单元由包含由97个氨基酸残基组成的三个结构域,分别为:(i)细胞外N末端结构域(氨基酸残基1-24);(ii)跨膜区段(氨基酸残基25-43);和(iii)细胞内C末端结构域(氨基酸残基44-97)。其中,跨膜区段形成离子通道的孔。M2蛋白的细胞质尾部的前17个残基(氨基酸残基45-62)形成高度保守的两亲性螺旋,其在病毒出芽和组装中起作用。此外,细胞质尾部的氨基酸残基70-77对于结合M1蛋白和产生感染性病毒颗粒是重要的。
发明内容
细胞穿透肽
本发明人出乎意料的发现,来源于流感病毒M2蛋白的多肽及其片段具有细胞穿透肽的功能,其穿透效率远高于本领域中的现有细胞穿透肽,并能较低浓度进入多种类型的细胞。进一步研究发现M2蛋白的细胞穿透肽功能主要集中在其氨基酸44-67这段序列。本发明人通过对流感病毒M2蛋白的多肽片段进行改造,获得了穿透效率甚至更高的细胞穿透肽,从而完成了本发明。
因此,在一个方面,本发明涉及一种多肽,其具有选自以下氨基酸序列:
a.包含流感病毒M2蛋白第44-67位氨基酸的序列或其片段的氨基酸序列;
b.包含在流感病毒M2蛋白第44-67位氨基酸的序列或其片段中进行了一个或多个氨基酸残基的修饰的氨基酸序列;和
c.包含与流感病毒M2蛋白第44-67位氨基酸的序列或其片段具有至少60%、至少70%、至少80%、至少85%、至少90%、至少95%或100%序列同一性的氨基酸序列,
其中所述片段长度为至少8个氨基酸,且其中所述多肽具有细胞穿透肽的功能。
术语“细胞穿透肽”(“CPP”)一般用于表示能够跨细胞膜运输不同类型的货物分子并由此促进多种分子货物(从纳米级颗粒到小的化学分子、大分子以及DNA的大片段)的细胞摄入的短肽。“货物”分子通过由共价键的化学连接或者通过非共价相互作用来与细胞穿透肽结合。细胞穿透肽通常具有包括相对高丰度的带正电的氨基酸例如赖氨酸或精氨酸的氨基酸组合物,或者其具有包括极性/带电氨基酸与非极性、疏水氨基酸的交替模式的序列。这两种结构分别被称作多聚阳离子的或两亲的。细胞穿透肽具有不同的大小、氨基酸序列和电荷,但所有CPP均具有共同点,即使细胞膜易位并促进多种分子货物传递到细胞的细胞质或细胞器的能力。目前,CPP易位的理论在三种主要的进入机制上不同:膜中直接穿透、内吞作用调节的进入,以及通过形成临时结构的易位。CPP转导是一个研究正在进行中的领域。已发现细胞穿透肽在医学中作为药物传递剂在治疗不同的疾病(包括癌症)和病毒抑制剂以及用于细胞标记和成像的对比剂中有大量应用。
“货物分子”在本文中是指通过共价或非共价结合与细胞穿透肽相连的分子,所述细胞穿透肽的存在使得其细胞内在化被促进或能够实现。在本发明中,“货物分子”包括肽、蛋白质、多糖、脂质、包括脂蛋白和糖蛋白的其组合物、核酸(例如DNA、siRNA、shRNA、反义寡核苷酸、陷阱DNA、质粒)、小分子药(例如环孢霉素A、紫杉醇、阿霉素、氨甲蝶呤、5-氨基乙酰丙酸)、成像剂(例如荧光团、量子点(QD)、示踪剂、金属螯合剂如钆(Gd
在本发明中,术语“蛋白质”和“多肽”在本文中可互换使用并且通常指通过肽键连接的氨基酸残基的聚合物,并且不限制产物的最小长度。因此,上述术语包含肽、寡肽、多肽、二聚体(异源和同源),多聚体(异源和同源)等等。“蛋白质”和“多肽”涵盖了全长蛋白质及其片段。该术语还包括多肽的表达后修饰,如糖基化、乙酰化、磷酸化等。
在一些实施方案中,所述多肽包括流感病毒M2蛋白的第44-67位的氨基酸序列。所述多肽在M2蛋白第44-67位氨基酸的N末端和/或C末端可以包括另外的氨基酸序列。例如,所述多肽可以包括在M2蛋白第44-67位氨基酸及其两端的天然序列。例如,所述多肽可以包括M2蛋白第44-67位氨基酸的N端延伸的序列,例如M2蛋白第43-67位、第42-67位、第41-67位、第40-67位、第39-67位、第38-67位、第37-67位、第36-67位、第35-67位、第34-67位的氨基酸的序列等。或者,所述多肽可以包括M2蛋白第44-67位氨基酸的C端延伸的序列。例如,所述多肽可以包括M2蛋白的第43-68位、第42-69位、第41-70位、第40-71位、第39-72位、第38-73位、第37-74位、第36-75位、第35-76位、第34-77位的氨基酸的序列等。所述多肽可以包括M2蛋白第44-67位氨基酸N末端和C末端两个方向上延伸的天然序列。
此外,所述多肽也可以在M2蛋白第44-67位氨基酸N末端和/或C末端包括非天然序列,例如异源序列。所述异源序列可以选自各种标签、荧光蛋白、功能性部分和来源于其它蛋白质或多肽的氨基酸序列等,只要该异源序列不影响所述多肽的细胞穿透肽功能即可。
在另一些实施方案中,所述多肽包含上述序列的片段,且该片段具有细胞穿透肽的功能。本发明已经鉴定了流感病毒M2蛋白的第44-67位的氨基酸序列的多个功能性片段。在一些实施方案中,所述片段长度可以为至少8个氨基酸、至少9个氨基酸、至少10个氨基酸、至少11个氨基酸、至少12个氨基酸、至少13个氨基酸、至少14个氨基酸、至少15个氨基酸、至少16个氨基酸、至少17个氨基酸、至少18个氨基酸、至少19个氨基酸、至少20个氨基酸、至少21个氨基酸、至少22个氨基酸或至少23个氨基酸。关于氨基酸片段的选择没有具体限制,只要该片段具有细胞穿透肽的功能。
在一些实施方案中,所述片段包括M2蛋白第44-48位氨基酸或第45-48位氨基酸。具有M2蛋白第44-48位氨基酸或第45-48位氨基酸的多肽片段具有强的细胞穿透肽功能。然而,所述多肽片段也可以不包括具有M2蛋白第44-48位氨基酸或第45-48位氨基酸。
在一些实施方案中,所述片段包括M2蛋白第44-65位氨基酸、第44-61位氨基酸、第45-62位氨基酸或第44-56位氨基酸,或由这些序列组成。所述片段也可以包括在上述序列的N末端和/或C末端延伸和/或截短了一个或多个氨基酸残基的序列。
在一些实施方案中,所述多肽包括在流感病毒M2蛋白的第44-67位的氨基酸序列或其片段中进行了一个或多个氨基酸残基的修饰的氨基酸序列。所述氨基酸残基的修饰包括氨基酸残基的取代、插入、缺失和/或添加。在一些实施方案中,所述氨基酸修饰是氨基酸取代。
在一些实施方案中,可以基于多肽的长度和/或其氨基酸组成来确定氨基酸残基的数量。例如当多肽的长度为约25个氨基酸时,氨基酸取代、插入、缺失的数量可以是1-12个,例如1、2、3、4、5、6、7、8、9、10、11或12个。当多肽的长度为约20个氨基酸时,氨基酸取代、插入、缺失的数量可以是1-10个,例如1、2、3、4、5、6、7、8、9或10个。当多肽的长度为约15个氨基酸时,氨基酸取代、插入、缺失的数量可以是1-7个,例如1、2、3、4、5、6、7个。
氨基酸取代、插入、缺失的方式没有特别限制。在一些实施方案中,所述氨基酸取代是保守氨基酸取代。“保守氨基酸取代”是指具有相似电荷性质或侧链基团的氨基酸残基之间的取代,其通常不影响蛋白质或多肽的正常功能。在一些实施方案中,插入是疏水性氨基酸或带正电荷的氨基酸的插入。在一些实施方案中,缺失是亲水性氨基酸的缺失。
在另一些实施方案中,所述氨基酸取代的至少一个或多个是取代为疏水性氨基酸或带正电荷的氨基酸。在另一些实施方案中,疏水性氨基酸优选是C、A、F、I、L、M、P、V、W、M或Y,更优选是I。在另一些实施方案中,带正电荷的氨基酸优选是K、R或H,更优选K或R。在一些实施方案中,所述疏水性氨基酸或带正电荷的氨基酸选自I、F和R残基。在一些实施方案中,亲水性氨基酸优选是D、E、Q、S或T。
所述多肽还可以包括与M2蛋白第44-67位的氨基酸序列或其片段具有至少60%序列一致性的氨基酸序列,只要该多肽具有细胞穿透肽功能。例如,所述多肽可以包括氨基酸序列,其与M2蛋白第44-67位的氨基酸序列或其片段具有至少60%、至少65%、至少70%、至少80%、至少85%、至少90%、或至少95%序列一致性的氨基酸序列,只要该多肽具有细胞穿透肽功能。
可以通过例如使用数学算法测定两种序列间的序列同一性的百分比。通过使用基于此类数学算法的程序,可以实施用于测定序列同一性的序列比较(即比对)。程序可以由计算机适当执行。此类程序的实例包括但不限于PC/Gene程序的CLUSTAL、ALIGN程序(Version 2.0)、和Wisconsin遗传学软件包的GAP、BESTFIT、BLAST、FASTA、和TFASTA。可以例如通过使用初始参数实施使用这些程序的比对。
在上述多肽的任意实施方案中,其中所述流感病毒可以是任何分型的流感病毒。在一些实施方案中,所述流感病毒可以是H1N1、H5N1、H5N6或H7N9型流感病毒,但不限于此。本领域已知M2蛋白的氨基酸序列在不同分型的流感病毒之间保守。
例如,在一些实施方案中,本发明的M2蛋白可以来源于以下流感病毒株:A/Caledonia/20/1999(H1N1)、A/HongKong/97/98(H5N1)和A/chicken/Jilin/9/2004(H5N1),但不限于此。
在另一个方面,本发明涉及对基于流感病毒M2蛋白的细胞穿透肽的改造方法和获得的变体序列。具体而言,本发明对具有强细胞穿透肽功能的JiLin-2004(H5N1)-M2-44-56、JiLin-2004(H5N1)-M2-45-62和JiLin-2004(H5N1)-M2-44-65多肽进行了改造,并获得了具有相似或甚至更强的细胞穿透肽功能的变体多肽序列。
一方面,本发明涉及多肽,其具有下式X1-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11-X12-X13-X14-X15-X16-X17-X18-X19-X20-X21-X22-X23-X24的氨基酸序列;其中X1是D、R、L、I或不存在;X2是R、I或S;X3是L、I、F、A、R或K;X4是F、R或I;X5是F、R或I;X6是K、R或I;X7是C、I或R;X8是A、I、F、K或R;X9是Y、I、F、K或R;X10是R或S;X11是R、S或不存在;X12是L、I、F、R或K或不存在;X13是K、R、T或不存在;X14是Y、F、R或K,或不存在;X15是G或R或K或不存在;X16是R、L、F或A或不存在;X17是I、K、R或T或不存在;X18是R、I或T或不存在;X19是G、R或K或不存在;X20是P或不存在;X21是S、K或不存在;X22是T、V或不存在;X23是E或不存在;X24是G或不存在;或者
所述多肽具有与所述氨基酸序列具有至少60%、至少70%、至少80%、至少85%、至少90%、至少95%或100%序列同一性的氨基酸序列;或
所述多肽具有所述氨基酸序列中进行了一个或多个氨基酸残基的缺失、插入或取代的氨基酸序列。
相应的,在一个方面,本发明涉及一种多肽,其具有选自以下的氨基酸序列:
a.包含DRLFFKCIYRRLK的氨基酸序列;
b.包含在DRLFFKCIYRRLK的氨基酸序列中进行了一个或多个氨基酸残基的取代、缺失或插入的氨基酸序列,和
c.包含与DRLFFKCIYRRLK具有至少60%、至少70%、至少80%、至少85%、至少90%、至少95%或100%序列同一性的氨基酸序列,
其中所述多肽具有细胞穿透肽的功能。
DRLFFKCIYRRLK对应JiLin-2004(H5N1)流感病毒M2蛋白第44-56位的氨基酸序列(JiLin-2004(H5N1)-M2-44-56),其具有强细胞穿透肽功能。相应的,本发明的细胞穿透肽可以包括该序列或其功能性变体序列。
在一些实施方案中,所述一个或多个氨基酸残基的取代、缺失或插入是1-5个氨基酸残基的取代、缺失或插入,例如1、2、3、4或5个氨基酸取代、缺失或插入。在一些实施方案中,所述取代的至少一个、至少两个、至少三个、至少四个或所有五个可以是取代为疏水性氨基酸或带正电荷的氨基酸,例如选自I、F和R残基。在一些实施方案中,插入是疏水性氨基酸或带正电荷的氨基酸的插入。在一些实施方案中,缺失是亲水性氨基酸的缺失。
在一些实施方案中,多肽具有式X1-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11-X12-X13的氨基酸序列;其中X1是D或R;X2是R;X3是L、I、或F;X4是F;X5是F;X6是K或R;X7是C或R;X8是I或F;X9是Y、I或F;X10是R;X11是R;X12是L、I或F;且X13是K或R;或者所述多肽具有与所述氨基酸序列具有至少60%、至少70%、至少80%、至少85%、至少90%、至少95%或100%序列同一性的氨基酸序列;或所述氨基酸序列中进行了一个或多个氨基酸残基的缺失、插入或取代的氨基酸序列。
在一些实施方案中,所述多肽具有选自下组的氨基酸序列:RRLFFKCIYRRLK、RRLFFRCIYRRLK、RRLFFRRIYRRLK、RRLFFRRIYRRLR、DRIFFKCIYRRLK、DRIFFKCIIRRLK、DRIFFKCIIRRIK、DRFFFKCIYRRLK、DRFFFKCFYRRLK、DRFFFKCFFRRLK、DRFFFKCFFRRFK和RRFFFRRFFRRFR。
在另一个方面,本发明涉及一种多肽,其具有选自以下的氨基酸序列:
a.包含RLFFKCIYRRLKYGLKRG的氨基酸序列;
b.包含在RLFFKCIYRRLKYGLKRG的氨基酸序列中进行了一个或多个氨基酸残基的取代、缺失或插入的氨基酸序列,和
c.包含与RLFFKCIYRRLKYGLKRG具有至少60%、至少70%、至少80%、至少85%、至少90%、至少95%或100%序列同一性的氨基酸序列,其中所述多肽具有细胞穿透肽的功能。
RLFFKCIYRRLKYGLKRG对应JiLin-2004(H5N1)流感病毒M2蛋白第45-62位的氨基酸序列(JiLin-2004(H5N1)-M2-45-62),其具有强细胞穿透肽功能。相应的,本发明的细胞穿透肽可以包括该序列或其功能性变体序列。
在一些实施方案中,所述一个或多个氨基酸残基的取代、缺失或插入是1-6个氨基酸残基的取代、缺失或插入,例如1、2、3、4、5或6氨基酸取代、缺失或插入。在一些实施方案中,所述取代的至少一个、至少两个、至少三个、至少四个、至少五个、或全部六个可以是取代为疏水性氨基酸或带正电荷的氨基酸,例如选自I、F和R残基。在一些实施方案中,插入是疏水性氨基酸或带正电荷的氨基酸的插入。在一些实施方案中,缺失是亲水性氨基酸的缺失。
在一些实施方案中,多肽具有式X1-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11-X12-X13-X14-X15-X16-X17-X18的氨基酸序列;其中X1是R或S;X2是A、L或F;X3是F或I;X4是F或I;X5是R或K;X6是I、C或R;X7是A、I或F;X8是K、Y或F;X9是R或S;X10是R或S;X11是A、L或F;X12是K、R或T;X13是Y、F或K;X14是G、R或K;X15是L、F或A;X16是K、R或T;X17是R或T;且X18是G、R或K或者所述多肽具有与所述氨基酸序列具有至少60%、至少70%、至少80%、至少85%、至少90%、至少95%或100%序列同一性的氨基酸序列;或所述氨基酸序列中进行了一个或多个氨基酸残基的缺失、插入或取代的氨基酸序列。
在另一些实施方案中,所述多肽具有选自下组的氨基酸序列:RLFFRCIYRRLKYGLKRG、RLFFRRIYRRLKYGLKRG、RLFFRRIYRRLRYGLKRG、RLFFRRIYRRLRYRLKRG、RLFFRRIYRRLRYRLRRG、RLFFRRIYRRLRYRLRRR、RFFFKCIYRRLKYGLKRG、RFFFKCFYRRLKYGLKRG、RFFFKCFFRRLKYGLKRG、RFFFKCFFRRFKYGLKRG、RFFFKCFFRRFKFGLKRG、RFFFKCFFRRFKFGFKRG和RFFFRRFFRRFRFRFRRR。
在另一些实施方案中,本发明涉及JiLin-2004(H5N1)-M2-45-62多肽的单位点突变多肽序列。例如,在一些实施方案中,所述多肽具有选自下组的氨基酸序列:SLFFKCIYRRLKYGLKRG、RAFFKCIYRRLKYGLKRG、RLIFKCIYRRLKYGLKRG、RLFIKCIYRRLKYGLKRG、RLFFKIIYRRLKYGLKRG、RLFFKCAYRRLKYGLKRG、RLFFKCIKRRLKYGLKRG、RLFFKCIYSRLKYGLKRG、RLFFKCIYRSLKYGLKRG、SLFFKCIYRRLKYGLKRG、RLFFKCIYRRAKYGLKRG、RLFFKCIYRRLTYGLKRG、RLFFKCIYRRLKKGLKRG、RLFFKCIYRRLKYKLKRG、RLFFKCIYRRLKYGAKRG、RLFFKCIYRRLKYGLTRG、RLFFKCIYRRLKYGLKTG和RLFFKCIYRRLKYGLKRK。
在再一个方面,本发明涉及一种多肽,其具有选自以下的氨基酸序列:
a.包含DRLFFKCIYRRLKYGLKRGPST的氨基酸序列;和
b.包含在DRLFFKCIYRRLKYGLKRGPST的氨基酸序列中进行了一个或多个氨基酸残基的取代、缺失或插入的氨基酸序列,
c.包含与DRLFFKCIYRRLKYGLKRGPST具有至少60%、至少70%、至少80%、至少85%、至少90%、至少95%或100%序列同一性的氨基酸序列,
其中所述多肽具有细胞穿透肽的功能。
DRLFFKCIYRRLKYGLKRGPST对应JiLin-2004(H5N1)流感病毒M2蛋白第44-65位的氨基酸序列(JiLin-2004(H5N1)-M2-44-65),其具有强细胞穿透肽功能。相应的,本发明的细胞穿透肽可以包括该序列或其功能性变体序列。
在一些实施方案中,所述一个或多个氨基酸残基的取代、缺失或插入是1-10个氨基酸残基的取代、缺失或插入,例如1、2、3、4、5、6、7、8、9或10个氨基酸取代、缺失或插入。在一些实施方案中,所述取代的至少一个、至少两个、至少三个、至少四个、至少五个、至少六个、至少七个、至少八个、至少九个或全部十个可以是取代为疏水性氨基酸或带正电荷的氨基酸,例如选自I、F和R残基。在一些实施方案中,插入是疏水性氨基酸或带正电荷的氨基酸的插入。在一些实施方案中,缺失是亲水性氨基酸的缺失。
在一些实施方案中,多肽具有X1-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11-X12-X13-X14-X15-X16-X17-X18-X19-X20-X21-X22的氨基酸序列;其中X1是D或R;X2是R;X3是L或F;X4是F;X5是F;X6是K或R;X7是C或R;X8是I或F;X9是Y或F;X10是R;X11是R;X12是L或F;X13是K或R;X14是Y或F;X15是G或R;X16是L;X17是K或R;X18是R;X19是G、或R或K;X20是P;X21是S或K;且X22是T或V;或者所述多肽具有与所述氨基酸序列具有至少60%、至少70%、至少80%、至少85%、至少90%、至少95%或100%序列同一性的氨基酸序列;或所述氨基酸序列中进行了一个或多个氨基酸残基的缺失、插入或取代的氨基酸序列。
在一些实施方案中,所述多肽具有选自下组的氨基酸序列:DRFFFKCIYRRLKYGLKRGPST、DRFFFKCIYRRLKYGLKRRPST、DRFFFKCIYRRLKFGLKRGPST、DRFFFKCIFRRLKYGLKRGPST、DRFFFKCIFRRLKFGLKRGPST、DRFFFKCFFRRFKFGLKRGPST、RRFFFKCFFRRFKFGLKRGPST、DRFFFKRIYRRLKYRLKRRPST、DRFFFKRIYRRLKYRLKRRPKV、DRFFFKRIFRRLKYRLKRRPST、DRFFFKRIFRRLKFRLKRRPST、DRFFFKRIFRRFKFRLKRRPST、RRFFFKRIFRRFKFRLKRRPST、RRFFFKRIFRRFKFRLKRRPKV、RRLFFKCIYRRLKYGLKRGPST、RRLFFKCIYRRLKYGLKRGPKV、RRFFFKCIYRRLKYGLKRGPST、RRLFFKCIYRRLKYGLKRRPST、RRLFFKCIYRRLKYGLKRKPST、RRLFFRRIYRRLKYGLKRGPST、RRLFFRRIYRRLRYRLRRRPST、DRLFFKRIYRRLKYGLKRGPST、DRLFFRRIYRRLKYGLKRGPST、DRLFFRRIYRRLRYRLRRRPST、DRLFFKCIYRRLKYGLKRRPST、DRLFFKCIYRRLKYRLKRRPST、DRLFFKRIYRRLKYRLKRRPST、RRLFFKRIYRRLKYRLKRRPST、DRLFFKCIYRRLKYGLKRGPKV。
在又一个方面,本发明涉及多肽,其具有选自以下的氨基酸序列:
a.包含DRLFFKCIYRRLKYGLKR的氨基酸序列;和
b.包含在DRLFFKCIYRRLKYGLKR的氨基酸序列中进行了一个或多个氨基酸残基的取代、缺失或插入的氨基酸序列,
c.包含与DRLFFKCIYRRLKYGLKR具有至少60%、至少70%、至少80%、至少85%、至少90%、至少95%或100%序列同一性的氨基酸序列,
其中所述多肽具有细胞穿透肽的功能。
在一些实施方案中,所述一个或多个氨基酸残基的取代、缺失或插入是1-10个或1-6个,例如5、4、3或2个氨基酸残基的取代、缺失或插入。
在一些实施方案中,所述取代的至少一个是取代为疏水性氨基酸或带正电荷的氨基酸。在一些实施方案中,插入是疏水性氨基酸或带正电荷的氨基酸的插入。在一些实施方案中,缺失是亲水性氨基酸的缺失。
在一些实施方案中,多肽具有式X1-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11-X12-X13-X14-X15-X16-X17-X18的氨基酸序列;其中X1是D、R、L或I;X2是R或I;X3是L、R或K;X4是F或R;X5是F或R;X6是K或I;X7是C、R或I;X8是I、K或R;X9是Y、K或R;X10是R;X11是R;X12是L、R或K;X13是K;X14是Y或R;X15是G;X16是L或R;X17是K或I;且X18是R或I;或者所述多肽具有与所述氨基酸序列具有至少60%、至少70%、至少80%、至少85%、至少90%、至少95%或100%序列同一性的氨基酸序列;或所述氨基酸序列中进行了一个或多个氨基酸残基的缺失、插入或取代的氨基酸序列。
在一些实施方案中,多肽具有选自下组的氨基酸序列:RRLFFKCIYRRLKYGLKR、LRLFFKCIYRRLKYGLKR、DILFFKCIYRRLKYGLKR、DRRFFKCIYRRLKYGLKR、DRLRRKCIYRRLKYGLKR、DRLFFICIYRRLKYGLKR、DRLFFKRIYRRLKYGLKR、DRLFFKIIYRRLKYGLKR、DRLFFKCKKRRLKYGLKR、DRRRRKCRRRRRKYGRKR、DRLFFKCIYRRRKRGLKR、DRLFFKCIYRRLKYGRKR、DRKRRKCKYRRKKYGRKR、DRLFFKCIYRRLKYGLII、IILFFKCIYRRLKYGLKR。
缀合物和融合蛋白
本发明还涉及缀合物和融合蛋白,其包含本发明的多肽。
在关于缀合物的实施方案中,所述缀合物包含本发明和与所述多肽缀合的部分,所述部分可以没有特别限制,且可以是治疗部分、可检测部分或美容用部分,选自蛋白质、肽、核酸、抗生素、抗炎症药物、抗肿瘤药物、神经保护剂、化疗剂、细胞毒素、放射性同位素、荧光标记物、发光物、显色物质和酶。
所述蛋白质、肽、核酸、抗生素、抗炎症药物、抗肿瘤药物、神经保护剂、化疗剂、细胞毒素、放射性同位素、荧光标记物、发光物、显色物质和酶的选择没有特别限制,只要其不影响本发明的多肽的细胞穿透肽功能。
在一些实施方案中,治疗部分选自:13-顺-视黄酸、2-氨基-6-巯基嘌呤、2-CdA、2-氯脱氧腺苷、5-氟尿嘧啶、6-硫鸟嘌呤、6-巯基嘌呤、异维生素A酸(Accutane)、放线菌素D、阿霉素、Adrucil、安归宁、Ala-Cort、阿地白介素、阿仑单抗、阿里维A酸(Alitretinoin)、Alkaban-AQ、爱克兰、全反式维甲酸、α干扰素、六甲蜜胺、氨甲蝶呤、氨磷汀、鲁米特、阿那格雷、安得乐、阿那曲唑、阿糖胞苷、安然爱斯普、阿可达、瑞宁得、阿诺、三氧化二砷、天冬酰胺酶、ATRA、阿瓦斯汀、BCG、BCNU、贝伐单抗、蓓萨罗丁、比卡鲁胺、BiCNU、Blenoxane、博来霉素、硼替佐米、白消安、Busulfex、C225、亚叶酸钙、Campath、坎普土沙、喜树碱-11、卡培他滨、Carac、卡铂、卡莫司汀、卡莫司汀片、Casodex、CCNU、CDDP、CeeNU、正定霉素、西妥昔单抗、苯丁酸氮芥、顺铂、亚叶酸因子、克拉屈滨、可的松、可美净、CPT-11、环磷酰胺、Cytadren、阿糖胞苷、阿糖胞苷脂质体、Cytosar-U、Cytoxan、达卡巴嗪(Dacarbazine)、放线菌素、达泊霉素α、道诺霉素、柔红霉素、盐酸柔红霉素、柔红霉素脂质体、DaunoXome、Decadron、Delta-Cortef、强的松、地尼白介素-毒素连接物、DepoCyt、地塞米松、醋酸地塞米松、地塞米松磷酸钠、Dexasone、右雷佐生、DHAD、DIC、Diodex、多西他赛、Doxil、阿霉素、多柔比星脂质体、Droxia、DTIC、DTIC-Dome、杜拉隆、Efudex、艾里咖、艾伦斯、乐沙定、爱施巴、Emcyt、表阿霉素、α依伯汀、爱必妥、欧文氏菌L-天门冬酰胺酶、雌莫司汀、Ethyol、凡毕复、依托泊苷、依托泊苷磷酸盐、Eulexin、易维特、依西美坦、法乐通、法洛德、复乳纳、非格司亭、氟尿苷、福达华、氟达拉滨、Fluoroplex、氟尿嘧啶、氟甲睾酮、氟他胺、氟胺酸、FUDR、氟维司群、G-CSF、吉非替尼、吉西他滨、吉妥单抗、Gemzar、格列卫、醋酸亮丙瑞林、储库型醋酸亮丙瑞林、Matulane、Maxidex、氮芥、-盐酸氮芥、美卓龙、甲泼尼龙、Megace、甲地孕酮、醋酸甲地孕酮、美法仑、巯嘌呤、美司那、Mesnex、氨甲喋呤、甲氨蝶呤钠、甲泼尼龙、Mylocel、来曲唑、Neosar、Neulasta、纽密伽、优保津、Nilandron、尼鲁米特、氮芥、Novaldex、诺肖林、奥曲肽、醋酸奥曲肽、Oncospar、长春新碱、Ontak、Onxal、欧普瑞维尔金、Orapred、Orasone、奥沙利铂、紫杉醇、帕米膦酸、Panretin、伯尔定、Pediapred、PEG干扰素、培门冬酶、培非司亭、PEG-INTRON、PEG-L-天冬酰胺酶、苯丙氨酸氮芥、Platinol、Platinol-AQ、泼尼松龙、泼尼松、Prelone、丙卡巴肼、PROCRIT、普留净、具有卡莫司汀植入物的Prolifeprospan20、Purinethol、雷洛昔芬、氨克生、美罗华、利妥昔单抗、Roveron-A、Rubex、盐酸鲁贝多霉素、善得定、善得定LAR、沙格莫丁、Solu-Cortef、Solu-Medrol、STI-571、链尿霉素、他莫昔芬、塔格雷汀、他克唑、泰索帝、Temodar、替莫唑胺、替尼泊苷、TESPA、沙利度胺、撒利多迈、TheraCys、硫鸟嘌呤、硫鸟嘌呤药片、硫代磷酰胺、Thioplex、塞替派、TICE、Toposar、拓扑替康、托瑞米芬、曲妥珠单抗、维甲酸、Trexall、Trisenox、TSPA、VCR、Velban、万珂、凡毕士、凡善能、Viadur、长春碱、硫酸长春碱、Vincasar Pfs、长春新碱、长春瑞滨、酒石酸长春瑞滨、VLB、VP-16、威猛、希罗达、Zanosar、泽娃灵、Zinecard、诺雷德、唑来膦酸、择泰、格立得晶片、Glivec、GM-CSF、戈舍瑞林、粒细胞集落刺激因子、氟甲睾酮、赫赛汀、Hexadrol、Hexalen、六甲蜜胺、HMM、和美新、Hydrea、乙酸氢化可通、氢化可的松、氢化可的松磷酸钠、氢化可的松琥珀酸钠、磷酸氢化可的松、羟基脲、异贝莫单抗、替坦异贝莫单抗、埃得霉素、伊达比星、Ifex、IFN-化、异环磷酰胺、IL2、IL-11、甲磺酸伊马替尼、咪唑羧酰胺、干扰素α、PEG缀合的干扰素α扰素α、白细胞介素2、白细胞介素-11、甲酰四氢叶酸、留可然、Leukine、亮丙瑞林、闻克斯丁、乐司他丁、脂质体Ara-C、Liquid Pred、洛莫司汀、L-PAM、L-沙可来新、Meticorten、丝裂霉素、丝裂霉素-C、米托蒽醌、M-泼尼松、MTC、MTX、氮芥、密吐霉素、Myleran、Iressa、爱莱诺迪肯、Isotretinoin、Kidrolase、Lanacort、L-门冬酰胺酶和LCR、更昔洛韦、叠氮胸苷(AZT)、拉米夫定(3TC)、阿卡泊隆、乙酰砜钠、阿莱霉素、阿莱西定、氮卓西林、匹美西林、阿米环素、氨氟沙星、甲磺酸氨氟沙星、阿米卡星、硫酸阿米卡星、氨基水杨酸、氨基水杨酸钠、阿莫西林、两性霉素、氨苄青霉素、氨苄青霉素钠、阿帕西林钠、安普霉素、天冬氨酸、硫酸天冬氨酸、阿维霉素、阿伏霉素、阿奇霉素、阿洛西林、阿洛西林钠、盐酸巴卡西林、杆菌肽、杆菌肽亚甲基二水杨酸酯、杆菌肽锌、班贝霉素、苯甲酰钙、硫酸红霉素、硫酸倍他霉素、比阿培南、比尼霉素、盐酸苯柳胺酯、硫酸镁双巯氧吡啶、布替卡星、硫酸丁酰苷菌素、硫酸卷曲霉素、卡巴多、羧苄青霉素二钠、羧苄青霉素茚基钠、羧苄青霉素苯钠、羧苄青霉素钾、香豆素钠、头孢克洛、头孢羟氨苄、头孢孟多、头孢孟多酯钠、头孢孟多钠、头孢帕罗、头孢曲松、头孢唑啉钠、头孢唑啉、头孢唑啉钠、头孢哌酮、头孢地尼、头孢吡肟、盐酸头孢吡肟、头孢醇、头孢克肟、盐酸头孢甲肟、头孢美唑、头孢美唑钠、头孢尼西单钠、头孢尼西钠、头孢哌酮钠、头孢地尼、头孢噻肟钠、头孢替坦、头孢替坦二钠、盐酸头孢替安、头孢西丁、头孢西丁钠、头孢咪唑、头孢哌齐钠、头孢匹胺、头孢匹胺钠、硫酸头孢匹罗、头孢泊肟丙酯、头孢丙烯、头孢罗定、头孢磺啶钠、头孢他啶、头孢布烯、头孢唑肟钠、头孢曲松钠、头孢呋辛、头孢呋辛酯、头孢乙腈钠、头孢氨苄、盐酸头孢氨苄、头孢菌素、头孢噻啶、头孢噻吩钠、头孢匹林钠、头孢拉啶、盐酸西托环素、乙酰氯霉素、氯霉素、氯霉素棕榈酸酯、氯霉素泛酸盐复合物、氯霉素琥珀酸钠、氨基苯磷酸氯己定、氯二甲苯酚、金霉素硫酸氢盐、盐酸金霉素、西诺沙星、环丙沙星、盐酸环丙沙星、西罗霉素、克拉霉素、盐酸克林沙星、克林霉素、盐酸克林霉素、克林霉素棕榈酸盐酸盐、磷酸克林霉素、氯法齐明、苄星邻氯青霉素、邻氯青霉素钠、氯羟喹、粘菌素甲磺酸钠、香豆霉素、香豆霉素钠、环西林、环丝氨酸、达福普汀、氨苯砜、达托霉素、地美环素、盐酸地美环素、去甲环素、地奴真菌素、敌菌净、双氯西林、双氯西林钠、硫酸二氢链霉素、二吡啶硫酮、地红霉素、多西环素、多西环素钙、多西环素磷酸复合物、盐酸多西环素、屈沙星钠、依诺沙星、依匹西林、盐酸差向四环素、红霉素、醋硬脂酸红霉素、依托红霉素、琥乙红霉素、葡庚糖酸红霉素、乳糖醛酸红霉素、丙酸红霉素、硬脂酸红霉素、乙胺丁醇盐酸盐、乙硫异烟胺、氟罗沙星、氟氯西林、氟氚丙氨酸、氟甲喹、磷霉素、磷霉素氨基丁三醇、呋莫西林、氯化呋喃鎓、酒石酸呋喃鎓、夫西地酸钠、夫西地酸、硫酸庆大霉素、格洛莫南、短杆菌肽、卤丙炔氧苯、海他西林、海他西林钾、海克西定、伊巴沙星、亚胺培南、异康唑、异帕米星、异烟肼、交沙霉素、硫酸卡那霉素、基达霉素、左氧氟沙星、左旋丙基西林钾、来红霉素、林可霉素、盐酸林可霉素、洛美沙星、盐酸洛美沙星、甲磺酸洛美沙星、氯碳头孢、磺胺米隆、甲氯环素、磺基水杨酸甲氯环素、巨霉素磷酸钾、mequidox、美罗培南、美他环素、盐酸美他环素、乌洛托品、马尿酸乌洛托品、扁桃酸乌洛托品、甲氧西林钠、美替普林、盐酸甲硝哒唑、磷酸甲硝哒唑、美洛西林、美洛西林钠、米诺环素、盐酸米诺环素、盐酸吡霉素、莫能菌素、莫能菌素钠、萘夫西林钠、萘啶酸钠、萘啶酸、纳豆霉素、尼布霉素、新霉素棕榈酸酯、硫酸新霉素、十一碳烯酸新霉素、硫酸奈替米星、中性霉素、硝呋唑烯、硝呋地腙、硝呋太尔、硝呋隆、硝呋达齐、硝呋米特、硝呋吡醇、硝呋喹唑、硝基噻唑、硝基环素、呋喃妥因、硝基米特、诺氟沙星、新生霉素钠、氧氟沙星、昂纳妥普瑞、苯唑西林、苯唑西林钠、肟、肟钠、草酸、土霉素、土霉素钙、盐酸土霉素、帕利霉素、对氯苯酚、保罗霉素、培氟沙星、甲磺酸培氟沙星、青霉素、青霉素G苄星、青霉素G钾、青霉素G普鲁卡因、青霉素G钠、青霉素V、青霉素V苄星、海巴青霉素V、青霉素V钾、戊唑酮钠、苯基氨基水杨酸盐/酯、哌拉西林钠、吡苯青霉素钠、吡西林钠、盐酸普利霉素、盐酸匹氨青霉素、双羟萘酸匹氨青霉素、丙苯酸匹氨青霉素、硫酸多粘菌素B、甲基丝裂霉素、普匹卡星、吡嗪酰胺、锌吡硫、乙酸喹乙胺、醋酸喹地卡明、奎奴普丁、消旋甲砜霉素、雷莫拉宁、雷尼霉素、雷洛霉素、雷帕霉素、利福布汀、利福美坦、利福昔尔、利福酰胺、利福平、利福喷丁、利福昔明、罗利环素、硝酸罗利环素、罗沙米星、丁酸罗沙米星、丙酸罗沙米星、罗沙米星磷酸钠、硬脂酸罗沙米星、罗索沙星、罗沙胂、罗红霉素、三环素、三萜醇钠、萨莫青霉素、沙莫西林、司可芬净、西索米星、硫酸西索米星、司帕沙星、盐酸壮观霉素、螺旋霉素、盐酸偏端菌素、西替霉素、硫酸链霉素、烟肼链霉素、磺胺苯、磺胺苯酰、磺乙酰胺、磺乙酰胺钠、磺胺西汀、磺胺嘧啶、磺胺嘧啶钠、磺胺多辛、磺胺林、磺胺甲基嘧啶、磺胺对甲氧嘧啶、磺胺甲嘧啶、磺胺甲二唑、磺胺甲噁唑、磺胺甲氧嘧啶、磺胺二甲唑、氨苯磺酸锌、磺胺硝苯、柳氮磺胺吡啶、磺胺异噻唑、磺胺噻唑、磺胺吡唑、磺胺异噁唑、乙酰硫代异噁唑、磺胺异噁唑二乙醇胺、磺粘菌素、硫培南、舒他西林、磺氨苄青霉素钠、盐酸酞氨西林、替考拉宁、盐酸替马沙星、替莫西林四环素、盐酸四环素、磷酸四环素络合物、四氧嘧啶、甲砜霉素、噻吩西林钾、替卡西林甲酚钠、替卡西林二钠、替卡西林单钠、替克拉酮、氯化氯苯噻碘、妥布霉素、硫酸妥布霉素、托氟沙星、甲氧苄啶、硫酸甲氧苄啶、三磺嘧啶、醋竹桃霉素、硫酸丙大观霉素、短杆菌素、万古霉素、盐酸万古霉素、维及霉素或拉来霉素,silybin。
在一些实施方案中,可检测部分选自:UV-Vis标记、近红外标记、发光基团、磷光基团、磁性自旋共振标记、光敏剂、光可裂解部分、螯合中心、重原子、放射性同位素、同位素可检测的自旋共振标记、顺磁性部分、发色团、发光体,例如金属卟啉;苯并卟啉;氮杂苯并卟啉;萘并卟啉、酞菁;多环芳烃,例如苝、苝二亚胺、芘;偶氮染料;呫吨染料;硼二吡咯亚甲基、氮杂-硼二吡咯亚甲基、花青染料、金属-配体络合物例如联吡啶、联吡啶基、菲咯啉、香豆素以及钌和铱的乙酰丙酮化物;吖啶、噁嗪衍生物例如苯并吩噁嗪;氮杂-轮烯、方酸菁;8-羟基喹啉、聚甲炔、发光产生纳米颗粒例如量子点、纳米晶体;喹诺酮、铽络合物;无机荧光体;离子载体例如冠醚附着或衍生染料;Pd(II)八乙基卟啉;Pt(II)-八乙基卟啉;Pd(II)四苯基卟啉;Pt(II)四苯基卟啉;Pd(II)内消旋-四苯基卟啉四苯并吗啡;Pt(II)内消旋-四苯基甲基苯并卟啉;Pd(II)八乙基卟啉酮;Pt(II)八乙基卟啉酮;Pd(II)内消旋-四(五氟苯基)卟啉;Pt(II)内消旋-四(五氟苯基)卟啉;Ru(II)三(4,7-二苯基-1,10-菲咯啉)(Ru(dpp)
在一些实施方案中,美容用部分可以是美容性多肽,例如棕榈酰五肽4、棕榈酰四肽7、肌肽、乙酰基六肽8、aFGF、bFGF或EGF、肉毒杆菌毒素、弹性蛋白、透明质酸。在一些实施方案中,本发明的多肽与一种所述部分缀合。在另一些实施方案中,本发明的多肽与多种所述部分缀合。在一些实施方案中,本发明的多肽与一种所述部分以非共价形式组合。在另一些实施方案中,本发明的多肽与多种所述部分非共价形式组合。
本发明的多肽与所述部分缀合的方式没有特别限制,可以通过例如物理吸附或化学连接进行缀合。例如,本发明的多肽与所述部分可以通过非共价方式或共价方式缀合。
在关于融合蛋白的实施方案中,所述融合蛋白包含本发明的多肽和与所述多肽融合的部分,所述部分可以选自抗原、抗体或其抗原结合部分、配体、受体、细胞因子、转录调节因子、荧光蛋白和酶。
在一些实施方案中,与多肽融合的部分是治疗部分,例如人生长激素、牛生长激素、猪生长激素、生长激素释放激素、生长激素释放肽、粒细胞-集落刺激因子、粒细胞巨噬细胞-集落刺激因子、巨噬细胞-集落刺激因子、促红细胞生成素、骨形态发生蛋白、干扰素、胰岛素、心房肽激素-III、单克隆抗体、肿瘤坏死因子、巨噬细胞激活因子、白介素、肿瘤降解因子、胰岛素样生长因子、表皮生长因子、组织纤溶酶原激活物和尿激酶。
在一些实施方案中,与多肽融合的部分是可检测部分,例如绿色荧光蛋白,例如,GFP、GFP-2、tagGFP、turboGFP、eGFP、Emerald、Azami Green、单体Azami Green、CopGFP、AceGFP、ZsGreenl)、黄色荧光蛋白(例如,YFP、eYFP、Citrine、Venus、YPet、PhiYFP、ZsYellowl)、蓝色荧光蛋白(例如,eBFP、eBFP2、Azurite、mKalamal、GFPuv、Sapphire、T-sapphire)、青色荧光蛋白(例如,eCFP、Cerulean、CyPet、AmCyanl、Midoriishi-Cyan)、红色荧光蛋白(例如,mKate、mKate2、mPlum、DsRed单体、mCherry、mRFP1、DsRed-Express、DsRed2、DsRed-单体、HcRed-Tandem、HcRedl、AsRed2、eqFP611、mRaspberry、mStrawberry、Jred)、橙色荧光蛋白(例如,mOrange、mKO、Kusabira-Orange、单体Kusabira-Orange、mTangerine、tdTomato)以及任何其他适合的荧光蛋白。
在一些实施方案中,与多肽融合的部分是美容用部分,包括美容性多肽,例如棕榈酰五肽4、棕榈酰四肽7、肌肽、乙酰基六肽8、aFGF、bFGF或EGF、肉毒杆菌毒素、弹性蛋白、透明质酸。
所述抗原、抗体或其抗原结合部分、配体、受体、细胞因子、转录调节因子、荧光蛋白和酶的选择没有特别限制,只要其不影响本发明的多肽的细胞穿透肽功能。
在一些实施方案中,所述多肽和所述部分直接融合。在另一些实施方案中,所述多肽和所述部分通过接头融合,例如通过柔性接头融合。
在一些实施方案中,所述多肽可以在其N末端与所述部分融合。在另一些实施方案中,所述多肽可以在其C末端与所述部分融合。在再一些实施方案中,所述多肽可以在其N末端和C末端与多个所述部分融合。
方法和用途
在一个方面,本发明涉及一种使多肽穿透细胞的方法,其包括将本发明的多肽、缀合物或融合蛋白与细胞温育的步骤。
在一些实施方案中,所述细胞是细胞系(例如永生化的细胞系),例如动物或植物细胞系,或微生物细胞,例如细菌细胞或真菌细胞,或从受试者分离的原代细胞或培养的植物细胞。
在一些实施方案中,所述细胞是选自肿瘤细胞、成纤维细胞、上皮细胞、内皮细胞、免疫细胞、皮肤细胞和神经细胞;或者选自分生细胞、石细胞、薄壁细胞、生殖细胞、根毛细胞、导管细胞、筛管细胞、叶肉细胞和保卫细胞、表皮细胞和色素细胞。在一些实施方案中,所述上皮细胞选自消化道上皮细胞和呼吸道上皮细胞。
所述肿瘤细胞的类型没有限制,并且可以来源于各种癌症类型,例如:基底细胞癌、胆道癌;膀胱癌;骨癌;脑和CNS癌;乳腺癌;腹膜癌;宫颈癌;胆管癌;绒毛膜癌;结肠和直肠癌;结缔组织癌;消化系统癌症;子宫内膜癌;食道癌;眼癌;头颈癌;胃癌;胶质母细胞瘤;肝癌;肝癌;上皮内新生物;肾癌;喉癌;白血病;肝癌;肺癌;淋巴瘤,包括霍奇金淋巴瘤和非霍奇金淋巴瘤;黑素瘤;骨髓瘤;神经母细胞瘤;口腔癌;卵巢癌;胰腺癌;前列腺癌;视网膜母细胞瘤;横纹肌肉瘤;直肠癌;呼吸系统癌;唾液腺癌;肉瘤;皮肤癌;鳞状细胞癌;胃癌;畸胎癌;睾丸癌;甲状腺癌;子宫或子宫内膜癌;泌尿系统癌症;外阴癌;以及其它癌和肉瘤;以及B细胞淋巴瘤;慢性淋巴细胞性白血病(CLL);急性成淋巴细胞性白血病(ALL);毛细胞白血病;慢性成髓细胞性白血病等。
在一些实施方案中,所述细胞选自A549细胞、HCT-116细胞、MKN-45细胞、293T细胞、HUVEC细胞、ESF-1细胞、HeLa细胞和MRC-5细胞,且不限于此。
在上述使多肽穿透细胞的方法的任意实施方案中,可以将所述多肽、缀合物或融合蛋白与细胞温育5分钟至24小时,例如10分钟至12小时、30分钟至6小时或1小时至3小时。
在上述使多肽穿透细胞的方法的任意实施方案中,所述多肽、缀合物或融合蛋白的浓度可以为0.01μM至100μM,例如0.03μM至30μM,0.1μM至10μM或1μM至3μM。
在另一个方面,本发明涉及一种将分子导入细胞中的方法,所述方法包括将所述分子与本发明的多肽、缀合物或融合蛋白的混合物与细胞温育的步骤。
在一些实施方案中,所述分子选自蛋白质、核酸、肽、脂质、代谢物、药物和小分子化合物。
在一些实施方案中,所述分子选自抗生素、抗炎症药物、抗肿瘤药物、神经保护剂、化疗剂、细胞毒素、放射性同位素、荧光标记物、发光物、显色物质、抗原、细胞因子、转录调节因子和酶。
在一些实施方案中,所述分子是小RNA(small RNA),例如选自siRNA和microRNA。
在一些实施方案中,所述细胞是细胞系(例如永生化的细胞系)或从受试者分离的原代细胞。
在一些实施方案中,所述细胞选自肿瘤细胞、成纤维细胞、上皮细胞、内皮细胞、免疫细胞、皮肤细胞和神经细胞。在一些实施方案中,所述上皮细胞选自消化道上皮细胞和呼吸道上皮细胞。
在一些实施方案中,所述细胞选自A549细胞、HCT-116细胞、MKN-45细胞、293T细胞、HUVEC细胞、ESF-1细胞、HeLa细胞和MRC-5细胞。
在再一个方面,本发明涉及本发明的多肽、缀合物和融合蛋白在将分子导入细胞中的用途。
在一些实施方案中,所述分子选自蛋白质、核酸、肽、脂质、代谢物、药物和小分子化合物。
在一些实施方案中,所述分子选自抗生素、抗炎症药物、抗肿瘤药物、神经保护剂、化疗剂、细胞毒素、放射性同位素、荧光标记物、发光物、显色物质、抗原、细胞因子、转录调节因子和酶。
在一些实施方案中,所述分子是小RNA,例如选自siRNA和microRNA。
在一些实施方案中,所述细胞是细胞系或从受试者分离的原代细胞。
在一些实施方案中,所述细胞选自肿瘤细胞、成纤维细胞、上皮细胞、内皮细胞、免疫细胞、皮肤细胞和神经细胞。在一些实施方案中,所述上皮细胞选自消化道上皮细胞和呼吸道上皮细胞。
在一些实施方案中,所述细胞选自A549细胞、HCT-116细胞、MKN-45细胞、293T细胞、HUVEC细胞、ESF-1细胞、HeLa细胞和MRC-5细胞。
疾病治疗、诊断疾病、示踪,优选胞内示踪或美容用的方法、用途和相关组合物
在一个方面,本发明涉及一种治疗疾病、诊断疾病、示踪,优选胞内示踪或美容用的方法,所述方法包括向有需要的受试者施用本发明的多肽、缀合物或融合蛋白。
在另一个方面,本发明涉及一种治疗疾病、诊断疾病、示踪,优选胞内示踪或美容用的方法,所述方法包括向有需要的受试者施用本发明的多肽、缀合物或融合蛋白和选自下组的成分:抗生素、抗炎症药物、抗肿瘤药物、神经保护剂、化疗剂、细胞毒素、放射性同位素、荧光标记物、发光物、显色物质、抗原、细胞因子、转录调节因子、酶和核酸,包括小RNA。
在本发明的一个实施方案中,核酸可以是自然的或人工的DNA或RNA分子,其为单链或双链。核酸分子可以是一种或多种同类型的核酸(例如,具有相同的核苷酸序列)或不同类型的核酸。核酸分子包含一种或多种DNA、cDNA、诱饵DNA、RNA、siRNA、miRNA、shRNA、stRNA、snoRNA、snRNA、PNA、反义寡聚体、质粒和其它修饰的核酸,但不限于此。
在一些实施方案中,所述小RNA选自siRNA和microRNA。
在本发明的治疗疾病、诊断疾病、示踪,优选胞内示踪或美容用的方法的任意实施方案中,所述疾病可以选自癌症、病毒感染、中枢神经系统疾病、炎性疾病、自身免疫病、线粒体相关疾病和代谢疾病。
在一个方面,本发明涉及本发明的多肽、缀合物或融合蛋白在治疗疾病或用于美容中的用途。在一些实施方案中,所述疾病选自癌症、病毒感染、中枢神经系统疾病、炎性疾病、自身免疫病、线粒体相关疾病和代谢疾病。
在另一个方面,本发明涉及本发明的多肽、缀合物或融合蛋白在制备用于治疗疾病的、诊断疾病、示踪,优选胞内示踪或美容用的药物组合物中的用途。
在一些实施方案中,所述药物组合物还包含选自下组的成分:抗生素、抗炎症药物、抗肿瘤药物、神经保护剂、化疗剂、细胞毒素、放射性同位素、荧光标记物、发光物、显色物质、抗原、细胞因子、转录调节因子、酶和小RNA。
在一些实施方案中,所述小RNA选自siRNA和microRNA。
在上述用途的任意实施方案中,所述疾病可以选自癌症、病毒感染、中枢神经系统疾病、炎性疾病、自身免疫病、线粒体相关疾病和代谢疾病。
在再一个方面,本发明涉及核酸分子,其包含编码本发明的多肽或融合蛋白的核苷酸序列。
在一个方面,本发明涉及载体,其包含本发明的核酸分子。
在本发明中,美容包括消除延缓皮肤衰老、美白和抗皱。在涉及美容的实施方案中,本领域技术人员可以将美容用的物质,例如美容性多肽,例如棕榈酰五肽-4、棕榈酰四肽7、肌肽、乙酰基六肽8、aFGF、bFGF或EGF、肉毒杆菌毒素、弹性蛋白、透明质酸等与本发明的穿透肽以共价或非共价方式连接以递送到细胞内,从而发挥功效。
本文所用“载体”是指可以将多聚核苷酸插入其中的一种核酸运载工具。而当载体能使插入的多核苷酸编码的蛋白获得表达时,该载体称为表达载体。载体可以通过转化、转导或者转染等方法导入宿主细胞,继而使其携带的遗传物质元件在宿主细胞内获得表达。载体是本领域技术人员公认的、包括但不局限于:(1)质粒;(2)噬菌粒;(3)柯斯质粒;(4)人工染色体,如酵母人工染色体(YAC)、细菌人工染色体(BAC)或P1来源的人工染色体(PAC);(5)噬菌体如λ噬菌体或M13噬菌体及(6)动物病毒,如逆转录酶病毒(包括慢病毒)、腺病毒、腺相关病毒、孢疹病毒(如单纯孢疹病毒)、痘病毒、杆状病毒。一种载体可以含有多种控制表达的元件,包括但不局限于,启动子序列、转录起始序列、增强子序列、选择元件及报告基因;此外,载体还可以含有复制起始位点。
在另一个方面,本发明涉及一种组合物,其包含本发明的多肽、缀合物或融合蛋白。
在一些实施方案中,所述组合物还包含选自下组的成分:抗生素、抗炎症药物、抗肿瘤药物、神经保护剂、化疗剂、细胞毒素、放射性同位素、荧光标记物、发光物、显色物质、抗原、细胞因子、转录调节因子、酶、和小RNA。
在一些实施方案中,所述小RNA选自siRNA和microRNA。
在一些实施方案中,所述组合物是药物组合物,且还包含一种或多种药学上可接受的载体。
短语“药学上可接受的载体”是指药学上可接受的材料、组合物或媒介物,如液体或固体填充剂、稀释剂、赋形剂、溶剂、介质、包封材料、制造助剂(例如润滑剂、滑石镁、硬脂酸钙或锌或硬脂酸)或溶剂包封材料,其涉及维持LAP结合剂的稳定性、溶解度或活性。在与配制剂的其它成分相容并且不对患者有害的意义上,每种载体必须是“可接受的”。可充当药学上可接受的载体的材料的一些实例包括:(1)糖,如乳糖、葡萄糖和蔗糖;(2)淀粉,如玉米淀粉和马铃薯淀粉;(3)纤维素及其衍生物,如羧甲基纤维素钠、甲基纤维素、乙基纤维素、微晶纤维素和乙酸纤维素;(4)粉状黄蓍胶;(5)麦芽;(6)明胶;(7)赋形剂,如可可脂和栓剂蜡;(8)油,如花生油、棉籽油、红花油、芝麻油、橄榄油、玉米油和大豆油;(9)二醇,如丙二醇;(10)多元醇,如甘油、山梨糖醇、甘露醇和聚乙二醇(PEG);(11)酯,如油酸乙酯和月桂酸乙酯;(12)琼脂;(13)缓冲剂,如氢氧化镁和氢氧化铝;(14)海藻酸;(15)无热原水;(16)等张盐水;(17)林格氏溶液;(19)pH缓冲溶液;(20)聚酯、聚碳酸酯和/或聚酐;(21)填充剂,如多肽和氨基酸(22)血清组分,如血清白蛋白、HDL和LDL;(23)C2-C12醇,如乙醇;和(24)药物配制剂中使用的其它无毒相容物质。释放剂、包衣剂、防腐剂和抗氧化剂也可以存在于药物配制剂中。
疾病
如本文所用的,术语“癌症”是指恶性赘生物(Stedman’s Medical Dictionary,25th ed.;Hensyled.;Williams&Wilkins:Philadelphia,1990)。示例性癌症包括但不限于听神经瘤;腺癌;肾上腺癌;直肠癌;血管肉瘤(例如,淋巴管肉瘤、淋巴管内皮肉瘤、血管肉瘤);盲肠癌;良性单克隆丙球蛋白病;胆癌(例如,胆管癌);膀胱癌;乳腺癌(例如,乳房的腺癌、乳房的乳头状癌、乳房癌症、乳房的髓样癌);脑癌(例如,脑脊膜瘤、成胶质细胞瘤、胶质瘤(例如,星形细胞瘤、少突神经胶质瘤)、髓母细胞瘤);支气管癌;类癌瘤;子宫颈癌(例如,宫颈腺癌);绒毛膜癌;脊索瘤;颅咽管瘤;结肠直肠癌(例如,结肠癌、直肠癌、结肠直肠腺癌);结缔组织癌症;上皮癌;室管膜瘤;内皮肉瘤(例如,卡波西肉瘤、多发性特发性出血性肉瘤);子宫内膜癌(例如,子宫癌、子宫肉瘤);食管癌(例如,食道的腺癌、巴雷特腺癌(Barrett’s adenocarcinoma));尤因肉瘤;眼癌(例如,眼内的黑素瘤、视网膜母细胞瘤);家族性嗜伊红细胞增多症;胆囊癌;胃癌(例如,胃腺癌);胃肠道间质瘤(GIST);生殖细胞癌症;头颈癌(例如,头颈鳞状细胞癌、口腔癌(例如,口腔鳞状细胞癌)、喉部癌(例如,喉癌、咽头癌、鼻咽癌、口咽癌));造血干细胞癌(例如,白血病,例如急性淋巴细胞性白血病(ALL)(例如,B-细胞ALL、T-细胞ALL)、急性髓细胞性白血病(AML)(例如,B-细胞AML、T-细胞AML)、慢性髓细胞性白血病(CML)(例如,B-细胞CML、T-细胞CML),以及慢性淋巴细胞性白血病(CLL)(例如,B-细胞CLL、T-细胞CLL));淋巴瘤,例如霍奇金淋巴瘤(HL)(例如,B-细胞HL、T-细胞HL)和非-霍奇金淋巴瘤(NHL)(例如,B-细胞NHL,例如弥散性大细胞淋巴瘤(DLCL)(例如,弥散性大B-细胞淋巴瘤)、滤泡淋巴瘤、慢性淋巴细胞性白血病/小淋巴细胞淋巴瘤(CLL/SLL)、套细胞淋巴瘤(MCL)、边缘区B-细胞淋巴瘤(例如,粘液相关的淋巴组织(MALT)淋巴瘤、结节边缘区B-细胞淋巴瘤、脾边缘区B-细胞淋巴瘤)、原发性纵隔B-细胞淋巴瘤、伯基特淋巴瘤、淋巴质浆细胞淋巴瘤(即,瓦尔登斯特伦巨球蛋白血症)、毛细胞白血病(HCL)、成免疫细胞性大细胞淋巴瘤、前体B-成淋巴细胞性淋巴瘤和原发性中枢神经系统(CNS)淋巴瘤;和T-细胞NHL,例如前体T-成淋巴细胞性淋巴瘤/白血病、外周T-细胞淋巴瘤(PTCL)(例如,皮肤T-细胞淋巴瘤(CTCL)(例如,蕈样肉芽肿病、塞扎里综合征)、血管免疫母细胞性T-细胞淋巴瘤、结节外自然杀伤T-细胞淋巴瘤、肠病型T-细胞淋巴瘤、皮下脂膜炎样T-细胞淋巴瘤和间变性大细胞淋巴瘤);一种或多种上述白血病/淋巴瘤的混合;以及多发性骨髓瘤(MM))、重链病(例如,α链病、γ链病、μ链病);血管母细胞瘤;下咽癌;炎性肌纤维母细胞瘤;免疫细胞淀粉样变性;肾癌(例如,肾胚细胞瘤,也称为威尔姆斯瘤、肾细胞癌);肝癌(例如,肝细胞癌(HCC)、恶性肝癌);肺癌(例如,支气管癌、小细胞肺癌(SCLC)、非-小细胞肺癌(NSCLC)、肺腺癌);平滑肌肉瘤(LMS);肥大细胞增多症(例如,系统性肥大细胞增多症);肌肉癌;骨髓增生异常综合征(MDS);间皮瘤;骨髓增生病(MPD)(例如,真性红细胞增多症(PV)、特发性血小板增多症(ET)、原因不明性髓样化生(AMM),也称为骨髓纤维化(MF)、慢性特发性骨髓纤维化、慢性髓细胞性白血病(CML)、慢性中性粒细胞性白血病(CNL)、高嗜酸粒细胞综合征(HES));成神经细胞瘤;神经纤维瘤(例如,1型或2型神经纤维瘤病(NF)、神经鞘瘤);神经内分泌癌(例如,胃肠胰神经内分泌瘤(GEP-NET)、类癌瘤);骨肉瘤(例如,骨癌);卵巢癌(例如,囊腺癌、卵巢胚胎性癌、卵巢腺癌);乳头状腺癌;胰腺癌(例如,胰腺癌、管内乳头状粘蛋白状赘生物(IPMN)、胰岛细胞瘤);阴茎癌(例如,阴茎和阴囊的佩吉特病);松果体瘤;原发性神经外胚层瘤(PNT);浆细胞瘤;类肿瘤综合征;上皮内瘤样病变;前列腺癌(例如,前列腺的腺癌);直肠癌;横纹肌肉瘤;唾液腺癌症;皮肤癌(例如,鳞状细胞癌(SCC)、角化棘皮瘤(KA)、黑素瘤、基底细胞癌(BCC));小肠癌(例如,盲肠癌);软组织肉瘤(例如,恶性纤维组织细胞瘤(MFH)、脂肉瘤、恶性外周神经鞘瘤(MPNST)、软骨肉瘤、纤维肉瘤、粘液肉瘤);皮脂腺癌;小肠癌;汗腺癌;滑膜瘤;睾丸癌(例如,精细胞瘤、睾丸胚胎性癌);甲状腺癌(例如,甲状腺的乳头状癌、乳头状甲状腺癌(PTC)、甲状腺髓样癌);尿道癌;阴道癌;以及外阴癌(例如,外阴的佩吉特病)。
在本公开中,病毒感染包括但不限于痘病毒科病毒性疾病、疱疹病毒科病毒性疾病、腺病毒科病毒性疾病、乳头瘤病毒科与多瘤病毒科病毒性疾病、细小病毒科病毒性疾病、嗜肝DNA病毒科病毒性疾病、逆转录病毒科病毒性疾病、呼肠孤病毒科病毒性疾病、博尔纳病毒科病毒性疾病、弹状病毒科病毒性疾病、丝状病毒科病毒性疾病、副粘病毒科病毒性疾病、正粘病毒科病毒性疾病、布尼亚病毒科病毒性疾病、沙粒病毒科病毒性疾病、小RNA病毒科病毒性疾病、杯状病毒科病毒性疾病、星状病毒科病毒性疾病、冠状病毒科病毒性疾病、披膜病毒科病毒性疾病、黄病毒科病毒性疾病、分类未定病毒性疾病、慢病毒感染。例如,病毒感染是以下病毒引起的感染:甲型、乙型、丙型肝炎病毒、流感病毒、水痘病毒、Ⅰ型单纯疱疹病毒(HSV-Ⅰ)、Ⅱ型单纯疱疹病毒(HSV-Ⅱ)、牛瘟病毒、呼吸道合胞病毒、巨细胞病毒、海胆病毒、虫媒病毒、汉坦病毒、腮腺炎病毒、麻疹病毒、风疹病毒、Ⅰ型人类免疫缺陷病毒(HIV-1)、Ⅱ型人类免疫缺陷病毒(HIV-2)、任何披盖病毒属病毒(例如登革病毒)、甲病毒属病毒、黄病毒属病毒、冠形病毒属病毒、狂犬病毒、绿猴病毒、伊波拉病毒、副流感病毒、正粘病毒、沙粒病毒、Ⅰ型人T细胞白血病病毒、Ⅱ型人T细胞白血病病毒、猿猴免疫缺陷病毒、慢病毒、埃巴病毒、人疱疹病毒、弥猴疱疹病毒1(B病毒)和痘病毒。
在本公开中,中枢神经系统疾病包括但不限于神经退行性疾病、脑卒中、癫痫、脑外伤、休克、HIV痴呆、青光眼、多发性硬化症等。脑卒中分为出血性和缺血性脑卒中。神经退行性疾病包括阿尔兹海默症、小脑萎缩症、多发性硬化症、原发性侧索硬化、脊髓性肌萎缩症、帕金森病、亨廷顿氏病、克雅二氏病、牛海绵状脑病、共济失调毛细血管扩张症、肌肉萎缩性侧索硬化症。
如本文所用的,“炎性疾病”是指由炎症导致、由炎症产生的疾病或导致炎症的疾病。术语“炎性疾病”还表示失调的炎性反应,其导致巨噬细胞、粒细胞和/或T-淋巴细胞的过度响应,这导致正常组织损伤和/或细胞死亡。炎性疾病可以为急性或慢性炎性病症,并且可以由感染或非-感染原因导致。炎性疾病包括但不限于动脉粥样硬化、动脉硬化、自身免疫性障碍、多发性硬化、系统性红斑狼疮、风湿性多肌痛(PMR)、痛风性关节炎、退行性关节炎、肌腱炎、滑囊炎、牛皮癣、囊性纤维化病、关节骨炎、类风湿性关节炎、炎性关节炎、肖格伦综合征、巨细胞动脉炎、进行性系统性硬化(硬皮病)、强直性脊柱炎、多肌炎、皮肌炎、天疱疮、类天疱疮、糖尿病(例如,I型)、重症肌无力、桥本甲状腺炎、格雷夫斯病、古德帕斯彻病、混合型结缔组织病、硬化性胆管炎、炎性肠病、克罗恩病、溃疡性结肠炎、恶性贫血、炎性皮肤病、常见间质肺炎(UIP)、石棉沉着病、硅肺病、支气管扩张、铍中毒、滑石病、尘肺病、肉瘤样病、脱屑性间质性肺炎、淋巴样间质性肺炎、巨细胞间质性肺炎、细胞性间质性肺炎、外源性变应性肺泡炎、韦格纳肉芽肿病和脉管炎的相关形式(颞动脉炎和结节性多发性动脉炎)、炎性皮肤病、肝炎、迟发型超敏反应(例如,毒葛皮炎)、肺炎、呼吸道炎症、成人呼吸窘迫综合征(ARDS)、脑炎、速发型超敏反应、哮喘、花粉症、变态反应、急性过敏反应、风湿热、肾小球肾炎、肾盂肾炎、蜂窝织炎、膀胱炎、慢性胆囊炎、缺血(局部缺血损伤)、再灌注损伤、同种异体移植排斥、宿主抗移植物、阑尾炎、动脉炎、眼睑炎、毛细支气管炎、支气管炎、子宫颈炎、胆管炎、绒毛膜羊膜炎、结膜炎、泪腺炎、皮肌炎、心内膜炎、子宫内膜炎、肠炎、小肠结肠炎、上髁炎、附睾炎、筋膜炎、纤维组织炎、胃炎、胃肠炎、牙龈炎、回肠炎、虹膜炎、喉炎、脊髓炎、心肌炎、肾炎、脐炎、卵巢炎、睾丸炎、骨炎、耳炎、胰腺炎、腮腺炎、心包炎、咽炎、胸膜炎、静脉炎、肺炎、直肠炎、前列腺炎、鼻炎、输卵管炎、窦炎、口炎、滑膜炎、睾丸炎、扁桃腺炎、尿道炎、膀胱炎、葡萄膜炎、阴道炎、血管炎、外阴炎、外阴阴道炎、脉管炎、慢性支气管炎、骨髓炎、视神经炎、颞动脉炎、横贯性脊髓炎、坏死性筋膜炎,以及坏死性小肠结肠炎。
如本文所用的,“自身免疫病”是指产生自受试者体内针对体内正常存在的物质和组织的不当免疫应答的疾病。换言之,免疫系统误将身体的一部分当做病原体并攻击自身细胞。这可能限制于某些组织(例如,在自身免疫性甲状腺炎)或包括不同部位的特定组织(例如,古德帕斯彻疾病,其可能影响肺和肾二者的基膜)。治疗自身免疫性疾病通常使用免疫抑制剂,例如,降低免疫应答的药物。示例性自身免疫性疾病包括但不限于肾小球肾炎、古德帕斯彻综合征、坏死性血管炎、淋巴结炎、结节性动脉周围炎、系统性红斑狼疮、类风湿病、关节炎、牛皮癣关节炎、系统性红斑狼疮、牛皮癣、溃疡性结肠炎、系统性硬化症、皮肌炎/多肌炎、抗磷脂抗体综合征、硬皮病、寻常天疱疮、ANCA-相关的血管炎(例如,韦格纳肉芽肿病、显微镜下多血管炎)、葡萄膜炎、肖格伦综合征、克罗恩病、赖特综合征、强直性脊柱炎、莱姆关节炎、古兰-巴雷综合征、桥本甲状腺炎和心肌病。
如本文中所用的,代谢疾病包括但不限于苯丙酮尿症、黄色瘤、淀粉样变性、黄疣病、黄瘤症、脂瘤性纤维瘤、脂肪性纤维瘤、脂肪纤维瘤、黄脂增生病、高血脂症、血脂过多、高脂血、脂肪过多症、脂肪过多、淀粉贮积病、淀粉样变性病、淀粉样变、半乳糖血、肥胖症、高脂血症、骨软化症、佝偻病、骨软化症和佝偻病、骨质疏松症、糖尿病如本文所用的,“线粒体相关疾病”包含亨汀顿氏疾病、肌萎缩性脊髓侧索硬化、线粒体脑肌肉病变合并乳酸血症和类中风症候群(MELAS);肌阵挛癫痫合并红色褴褛肌纤维症,MERRF);神经性肌肉松弛、失调症、色素性视网膜炎/母体遗传莱氏症状(NARP/MILS);Leber氏视神经病变(LHON);Kearns-Sayre症候群(KSS);皮尔森骨髓胰腺症(PMPS);慢性渐进性眼外肌麻痹(CPEO);瑞氏症候群;阿尔珀斯氏症候群;多个线粒体DNA缺失症候群;线粒体DNA耗乏症候群;复合体Ⅰ缺陷;复合体Ⅱ(琥珀酸脱氢酶(SDH))缺陷;复合体Ⅲ缺陷;细胞色素c氧化酶(COX,复合体Ⅳ)缺陷;复合体Ⅴ缺陷;腺嘌呤核苷酸转运体(ANT)缺陷;丙酮酸脱氢酶(PDH)缺陷;具有乳酸血症的乙基丙二酸酸性尿;具有乳酸血症的3-甲基戊烯二酸酸性尿;体现为在传染期间的衰减的不应性癫痫;体现为在传染期间的衰减的阿斯伯格症候群;体现为在传染期间的衰减的自闭症;注意力不足过动症(ADHD);体现为在传染期间的衰减的脑性麻痹;体现为在传染期间的衰减的失读症;母系遗传血小板减少症;白血病;MNGIE(线粒体肌病变、周围和自主神经病变、胃肠功能异常和癫痫);MARIAHS症候群(线粒体失调症、复发传染、失语症、低尿酸血症/髓磷脂减少症、癫痫发作和二羧酸酸性尿);ND6肌张力不全症;体现为在传染期间的衰减的周期性呕吐症状;具有乳酸血症的3-羟基异丁酸酸性尿;具有乳酸血症的尿崩症;尿苷反应性神经症状(URNS);家族双侧纹状体坏死(FBSN);与胺基糖苷有关的听力损失;松驰心肌病;脾淋巴瘤;钨症状;多个线粒体DNA缺失症状;和肾小管酸血症/尿崩症/失调症症状。
如本文中所用的,线粒体相关疾病包括但不限于亨汀顿氏疾病、肌萎缩性脊髓侧索硬化、线粒体脑肌肉病变合并乳酸血症和类中风症候群MELAS;肌阵挛癫痫合并红色褴褛肌纤维症,MERRF;神经性肌肉松弛、失调症、色素性视网膜炎/母体遗传莱氏症状NARP/MILS;Leber氏视神经病变LHON;Kearns-Sayre症候群KSS;皮尔森骨髓胰腺症PMPS;慢性渐进性眼外肌麻痹CPEO;瑞氏症候群;阿尔珀斯氏症候群;多个线粒体DNA缺失症候群;线粒体DNA耗乏症候群;复合体I缺陷;复合体II琥珀酸脱氢酶SDH缺陷;复合体III缺陷;细胞色素c氧化酶COX,复合体IV缺陷;复合体V缺陷;腺嘌呤核苷酸转运体ANT缺陷;丙酮酸脱氢酶PDH缺陷;具有乳酸血症的乙基丙二酸酸性尿;具有乳酸血症的3-甲基戊烯二酸酸性尿;体现为在传染期间的衰减的不应性癫痫;体现为在传染期间的衰减的阿斯伯格症候群;体现为在传染期间的衰减的自闭症;注意力不足过动症ADHD;体现为在传染期间的衰减的脑性麻痹;体现为在传染期间的衰减的失读症;母系遗传血小板减少症;白血病;MNGIE线粒体肌病变、周围和自主神经病变、胃肠功能异常和癫痫;MARIAHS症候群线粒体失调症、复发传染、失语症、低尿酸血症/髓磷脂减少症、癫痫发作和二羧酸酸性尿;ND6肌张力不全症;体现为在传染期间的衰减的周期性呕吐症状;具有乳酸血症的3-羟基异丁酸酸性尿;具有乳酸血症的尿崩症;尿苷反应性神经症状URNS;家族双侧纹状体坏死FBSN;与胺基糖苷有关的听力损失;松驰心肌病;脾淋巴瘤;钨症状;多个线粒体DNA缺失症状;和肾小管酸血症/尿崩症/失调症症状。
附图说明
图1:激光共聚焦技术检测罗丹明标记的不同多肽的细胞进入。
图2:流式细胞术检测不同浓度的FITC标记的多肽的细胞进入。
图3:流式细胞术检测FITC标记的多肽的A549细胞进入。多肽浓度:1μM。
图4:流式细胞术检测FITC标记的多肽的A549细胞进入。多肽浓度:3μM。
图5:流式细胞术检测FITC标记的多肽A549细胞的进入。多肽浓度:10μM。
图6:流式细胞术检测不同浓度的FITC标记的多肽的A549细胞进入。
图7:流式细胞术检测FITC标记的多肽的细胞进入。左图,HeLa细胞;多肽浓度:10μM。右图,MRC5细胞,多肽浓度:3μM。
图8:流式细胞术检测FITC标记的不同多肽片段的A549细胞进入。
图9:流式细胞术检测FITC标记的不同多肽片段的A549细胞进入。多肽浓度:1μM。温育时间:1小时。
图10:流式细胞术检测FITC标记的不同多肽片段的A549细胞进入。多肽浓度:1μM。温育时间:1小时。
图11:流式细胞术检测FITC标记的不同多肽片段的A549细胞进入。多肽浓度:1μM。温育时间:3小时。
图12:流式细胞术检测FITC标记的不同多肽片段的A549细胞进入。多肽浓度:1μM。温育时间:3小时。
图13:流式细胞术检测FITC标记的不同多肽片段的293T细胞进入。多肽浓度:1μM。温育时间:1小时。
图14:流式细胞术检测FITC标记的多肽的293T细胞进入。多肽浓度:1μM。温育时间:1小时。
图15:流式细胞术检测FITC标记的不同多肽片段的HUVEC细胞进入。多肽浓度:1μM。温育时间:1小时。
图16:流式细胞术检测FITC标记的TAT和M2(44-65)多肽的HUVEC细胞进入。多肽浓度:1μM。温育时间:1小时。
图17:流式细胞术检测FITC标记的不同多肽片段的HCT-116细胞进入。多肽浓度:1μM。温育时间:1小时。
图18:流式细胞术检测FITC标记的TAT、M2(44-65)和M2(45-62)多肽的HCT-116细胞进入。多肽浓度:1μM。温育时间:1小时。
图19:流式细胞术检测FITC标记的不同多肽片段的MNK-45细胞进入。多肽浓度:1μM。温育时间:1小时。
图20:流式细胞术检测FITC标记的TAT、M2(44-65)和M2(45-62)多肽的MKN-45细胞进入。多肽浓度:1μM。温育时间:1小时。
图21:流式细胞术检测FITC标记的不同多肽片段的U937细胞进入。多肽浓度:1μM。温育时间:1小时。
图22:流式细胞术检测FITC标记的TAT、M2(44-65)和M2(45-62)多肽的U937细胞进入。多肽浓度:1μM。温育时间:1小时。
图23:流式细胞术检测FITC标记的TAT、M2(44-65)和M2(44-61)多肽的MRC5细胞进入。多肽浓度:1μM。温育时间:1小时。
图24:流式细胞术检测FITC标记的TAT和M2(44-65)多肽的ESF-1细胞进入。多肽浓度:1μM。温育时间:1小时。
图25:激光共聚焦实验检测FITC标记的不同多肽片段的ESF-1细胞进入。多肽浓度:3μM。温育时间:1小时。
图26:流式细胞术检测不同的温育时间时多肽的A549细胞进入。多肽浓度:1μM。温育时间为左图:5分钟;中间图:10分钟;右图:30分钟。
图27:流式细胞术检测不同的温育时间时多肽的A549细胞进入。多肽浓度:1μM。
图28:流式细胞术检测比较不同的细胞穿透肽与本发明的Jilin-2004(H5N1)-M2-45-62多肽的A549细胞进入。多肽浓度:1μM。
图29:流式细胞术检测比较不同的细胞穿透肽与本发明的Jilin-2004(H5N1)-M2-44-61多肽的A549细胞进入。多肽浓度:1μM。
图30:流式细胞术检测比较不同的细胞穿透肽与本发明的Jilin-2004(H5N1)-M2-44-65多肽的A549细胞进入。多肽浓度:1μM。
图31:流式细胞术检测比较不同的细胞穿透肽与本发明的Jilin-2004(H5N1)-M2-45-62多肽的A549细胞进入。多肽浓度:3μM。
图32:流式细胞术检测比较不同的细胞穿透肽与本发明的Jilin-2004(H5N1)-M2-44-61多肽的A549细胞进入。多肽浓度:3μM。
图33:流式细胞术检测比较不同的细胞穿透肽与本发明的Jilin-2004(H5N1)-M2-44-65多肽的A549细胞进入。多肽浓度:3μM。
图34:流式细胞术检测Jilin-2004(H5N1)-M2-44-56多肽的突变序列的A549细胞进入。多肽浓度:1μM。温育时间:1小时。
图35:流式细胞术检测Jilin-2004(H5N1)-M2-45-62多肽的突变序列的A549细胞进入。多肽浓度:1μM。温育时间:1小时。
图36:激光共聚焦技术检测Jilin-2004(H5N1)-M2-45-62多肽及其突变序列的A549细胞进入。
图37:流式细胞术检测Jilin-2004(H5N1)-M2-45-62多肽的单位点突变序列的A549细胞进入。多肽浓度:1μM。温育时间:3小时。
图38:激光共聚焦技术检测Jilin-2004(H5N1)-M2-45-62多肽及其单位点突变序列的A549细胞进入。
图39:流式细胞术检测Jilin-2004(H5N1)-M2-44-65多肽的突变序列的A549细胞进入。多肽浓度:1μM。温育时间:1小时。
图40:流式细胞术检测Jilin-2004(H5N1)-M2-44-65多肽的突变序列的A549细胞进入。多肽浓度:3μM。温育时间:1小时。
图41:流式细胞术检测Jilin-2004(H5N1)-M2-44-65多肽的突变序列的293T细胞进入。多肽浓度:1μM。温育时间:1小时。
图42:流式细胞术检测Jilin-2004(H5N1)-M2-44-65多肽的突变序列的MRC5细胞进入。多肽浓度:1μM。温育时间:1小时。
图43:流式细胞术检测Jilin-2004(H5N1)-M2-44-65多肽的突变序列的U937细胞进入。多肽浓度:1μM。温育时间:1小时。
图44:流式细胞术检测Jilin-2004(H5N1)-M2-44-65多肽的突变序列的HCT-116细胞进入。多肽浓度:1μM。温育时间:1小时。
图45:流式细胞术检测不同的细胞穿透肽携带小RNA的细胞进入。
图46:激光共聚焦技术检测Jilin-2004(H5N1)-M2-45-62多肽携带小RNA的细胞进入。
图47:激光共聚焦技术检测Jilin-2004(H5N1)-M2-44-56多肽携带小RNA的细胞进入。
图48:激光共聚焦技术检测Jilin-2004(H5N1)-M2-44-61、Jilin-2004(H5N1)-M2-44-65和Jilin-2004(H5N1)-M2-44-65mut8多肽携带小RNA的细胞进入。
图49:双荧光报告基因检测不同的细胞穿透肽携带PGY-sRNA-6进入细胞的功能检测。
图50:Jilin-2004(H5N1)-M2-44-56携带β-半乳糖苷酶的细胞进入。
图51:激光共聚焦技术检测EGFP与细胞穿透肽的混合物的A549细胞进入。温育时间:1小时。
图52:流式细胞术检测不同浓度的EGFP-M2(71-85)和EGFP-M2(45-62)融合蛋白的A549细胞进入。温育时间:1小时。
图53:流式细胞术检测不同的EGFP融合蛋白的A549细胞进入。蛋白浓度:10nM。温育时间:1小时。
图54:流式细胞术检测不同的EGFP融合蛋白的A549细胞进入。蛋白浓度:30nM。温育时间:1小时。
图55:流式细胞术检测不同的EGFP融合蛋白的A549细胞进入。蛋白浓度:100nM。温育时间:1小时。
图56:激光共聚焦技术检测不同的EGFP融合蛋白的A549细胞进入。蛋白浓度:30nM。温育时间:1小时。
图57:激光共聚焦技术检测不同的EGFP融合蛋白的A549细胞进入。蛋白浓度:100nM。温育时间:1小时。
图58:激光共聚焦技术检测不同的EGFP融合蛋白的A549细胞进入。蛋白浓度:300nM。温育时间:1小时。
图59:流式细胞术检测Jilin-2004(H5N1)-M2-44-61多肽的突变序列的A549细胞进入。多肽浓度:1μM。温育时间:1小时。
图60:超高分辨显微镜检测Jilin-2004(H5N1)-M2-44-61、Jilin-2004(H5N1)-M2-44-65多肽携带小RNA的细胞进入。
图61:荧光定量PCR检测流感病毒M2不同片段多肽携带小RNA进入细胞。
图62:实时定量qPCR检测Jilin-2004(H5N1)-M2-45-62多肽及其单位点突变序列携带小RNA的A549细胞的进入。
图63:荧光定量PCR检测Jilin-2004(H5N1)-M2-45-62多肽及其突变序列携带小RNA的A549细胞的进入。
图64:荧光定量PCR检测Jilin-2004(H5N1)-M2-44-61多肽及其突变序列携带小RNA的A549细胞的进入。
图65:荧光定量PCR检测Jilin-2004(H5N1)-M2-44-65多肽及其突变序列携带小RNA的A549细胞的进入。
图66:双荧光报告基因检测不同的细胞穿透肽携带HJT-sRNA-m7进入细胞的功能检测。
图67:酶联免疫吸附实验检测不同的细胞穿透肽携带小RNA的LPS刺激细胞后的IL-1β表达。
图68:酶联免疫吸附实验检测不同的细胞穿透肽携带小RNA的LPS刺激细胞后的TNF-α表达。
图69:Western blot检测不同的细胞穿透肽携带HJT-sRNA-m7进入细胞的抗纤维化功能检测。
图70:激光共聚焦检测Jilin-2004(H5N1)-M2-44-61和Jilin-2004(H5N1)-M2-45-62多肽携带GFP质粒进入细胞的表达。
图71:激光共聚焦技术检测EGFP与细胞穿透肽融合蛋白进入小鼠不同器官。
图72:荧光定量PCR检测Jilin-2004(H5N1)-M2-44-61多肽携带PGY-sRNA-23进入小鼠器官。
图73:荧光定量PCR检测Jilin-2004(H5N1)-M2-44-61多肽携带PGY-sRNA-26进入小鼠器官。
图74:酶联免疫吸附实验检测Jilin-2004(H5N1)-M2-44-61多肽携带PGY-sRNA-6的抗炎功能。
图75:荧光定量PCR检测Jilin-2004(H5N1)-M2-44-61携带miR-1246antagomir进入小鼠肺组织。
图76:酶联免疫吸附实验检测LPS诱导急性肺损伤小鼠中Jilin-2004(H5N1)-M2-44-61携带miR-1246antagomir进入后的肺泡灌洗液中TNF-α的表达。
图77:酶联免疫吸附实验检测LPS诱导急性肺损伤小鼠中Jilin-2004(H5N1)-M2-44-61携带小分子silybin的肺泡灌洗液中IL-6的表达。
图78:PET-28a-EGFP载体质粒图谱。
图79:pEAK13载体图谱。
具体实施方式
以下将结合实施例进一步说明本发明的内容。应当理解以下实施例仅是说明性的,而不应被认为是对本发明范围的限制。
材料
实施例中使用的所有小RNA和NS1-GFP质粒。
小RNA 序列
PGY-sRNA-23 CCCUCCGCGGCCAGCUUCU
PGY-sRNA-26 UCCGGAAUGAUUGGGCGUAAAGCGU
PGY-sRNA-6 GUUCAGAGUUCUACAGUCCGA
NS1-GFP质粒是本实验室构建的(pEAK13载体),NS1是流感病毒A/HongKong/97/98(H5N1)的NS1蛋白(表达在细胞核中。NS1-GFP是N端NS1,直接融合GFP蛋白)。
EGFP融合蛋白:GFP在N端且多肽在C端直接融合表达(PET-28a-EGFP载体)。
EGFP的编码序列:
atggtgagcaagggcgaggagctgttcaccggggtggtgcccatcctggtcgagctggacggcgacgtaaacggccacaagttcagcgtgtccggcgagggcgagggcgatgccacctacggcaagctgaccctgaagttcatctgcaccaccggcaagctgcccgtgccctggcccaccctcgtgaccaccctgacctacggcgtgcagtgcttcagccgctaccccgaccacatgaagcagcacgacttcttcaagtccgccatgcccgaaggctacgtccaggagcgcaccatcttcttcaaggacgacggcaactacaagacccgcgccgaggtgaagttcgagggcgacaccctggtgaaccgcatcgagctgaagggcatcgacttcaaggaggacggcaacatcctggggcacaagctggagtacaactacaacagccacaacgtctatatcatggccgacaagcagaagaacggcatcaaggtgaacttcaagatccgccacaacatcgaggacggcagcgtgcagctcgccgaccactaccagcagaacacccccatcggcgacggccccgtgctgctgcccgacaaccactacctgagcacccagtccgccctgagcaaagaccccaacgagaagcgcgatcacatggtcctgctggagttcgtgaccgccgccgggatcactctcggcatggacgagctgtacaagtaa(SEQ ID No.125)
NS1蛋白序列(225aa)
MDSNTVSSFQVDCFLWHVRKRFADQELGDAPFLDRLRRDQKSLRGRGNTLGLDIETATRAGKQIVERILEEESDEALKMPASRYLTDMTLEEMSRDWFMLMPKQKVAGSLCIKMDQAIMDKTIILKANFSVIFDRLETLILLRAFTEEGAIVGEISPLPSLPGHTGEDVKNAIGVLIGGLEWNDNTVRVSETIQRFAWRSSDEDGRLPLPPNQKRKMARTIESEV(SEQ ID No.126)。
实施例1:一般实验方法
1、多肽溶液的配置
1)配置1mM的多肽储存液
根据合成的不同多肽(未标记的多肽、罗丹明标记的多肽和FITC标记的多肽)的质量与相对分子质量计算加入的超纯水的量(0.22μm的滤膜过滤),溶解后将储存液分装并于-80度避光保存。
2)配置不同浓度的多肽工作液
根据不同多肽的使用浓度,对于不同类型的细胞选择对应的培养基作为稀释液,配置多肽工作液。
2、流式细胞术检测多肽的进入
2.1流式细胞术检测罗丹明或者FITC标记的多肽的进入
1).将细胞用0.05%的胰蛋白酶消化后,分至12孔板的孔内。控制铺板密度使得细胞在24小时后长至约80%至85%。将细胞放置在37℃,5%CO
2).待细胞生长24小时后,观察细胞密度。将细胞培养基换成用培养基配置好的多肽工作液。将细胞放置在37℃,5%CO
3).弃去培养基,将细胞用无菌PBS清洗三次,每次清洗放置在100转/分钟的水平摇床上摇晃5分钟。
4).使用0.05%胰蛋白酶消化细胞,随后弃去胰酶。将细胞重悬于1mL无菌PBS并置于1.5mL离心管中。4℃,300g离心10分钟。
5).弃去上清液,将细胞重悬于200μL无菌PBS。
6).使用流式细胞仪C6检测多肽的细胞进入。
2.2流式细胞术检测多肽运载FAM标记的小RNA的细胞进入
1).将A549细胞用0.05%的胰蛋白酶消化后,分至12孔板的孔内,控制铺板密度使得细胞在24小时后长至约80%至85%。将细胞放置在37℃,5%CO
2).待细胞生长24小时后,观察细胞密度。将30μM的多肽与300nM的FAM标记的小RNA混合,加入后将细胞放置在37℃,5%CO
3).弃去培养基,将细胞用无菌PBS清洗三次,每次清洗放置在100转/分钟的水平摇床上摇晃5分钟。
4).使用0.05%胰蛋白酶消化细胞,随后弃去胰酶。将细胞重悬于1mL无菌PBS并置于1.5mL离心管中。4℃,300g离心10分钟。
5).弃去上清液,将细胞重悬于200μL无菌PBS。
6).使用流式细胞仪C6检测小RNA的细胞进入。
2.3流式细胞术检测多肽-EGFP融合蛋白的细胞进入
1).将A549细胞用0.05%的胰蛋白酶消化后,分至12孔板的孔内,控制铺板密度使得细胞在24小时后长至约80%至85%。将细胞放置在37℃,5%CO
2).待细胞生长24小时后,观察细胞密度。用培养基配置好不同浓度的融合蛋白工作液,加入后将细胞放置在37℃,5%CO
3).弃去培养基,将细胞用无菌PBS清洗三次,每次清洗放置在100转/分钟的水平摇床上摇晃5分钟。
4).使用0.05%胰蛋白酶消化细胞,随后弃去胰酶。将细胞重悬于1mL无菌PBS并置于1.5mL离心管中。4℃,300g离心10分钟。
5).弃去上清液,将细胞重悬于200μL无菌PBS。
6).使用流式细胞仪C6检测融合蛋白的进入。
3、激光共聚焦技术检测多肽的进入
3.1激光共聚焦技术检测罗丹明或者FITC标记的多肽的细胞进入
1).将多聚赖氨酸包被的细胞载玻片置于48孔板的孔内,使用相应培养基清洗两次。
2).将A549细胞用0.05%的胰蛋白酶消化后,分至48孔板的孔内,控制铺板密度使得细胞在24小时后长至约80%至85%。将细胞放置在37℃,5%CO
3).待细胞生长24小时后,观察细胞密度。将细胞培养基换成用培养基配置好的不同浓度的多肽工作液,加入后将细胞放置在37℃,5%CO
4).弃去培养基,将细胞用无菌PBS清洗三次,每次清洗放置在100转/分钟的水平摇床上摇晃5分钟。
5).弃去PBS,以200μL/孔加入4%的多聚甲醛室温固定15-20分钟。
6).弃去多聚甲醛,用含有0.1%triton的无菌PBS清洗三遍,每次放置在100转/分钟的水平摇床上摇晃5分钟。
7).弃去PBS后,以200μL/孔加入用含有0.1%triton的无菌PBS配置的含有细胞骨架F-actin抗体(体积比为1:200)和DAPI(体积比为1:1000)的溶液,室温避光放置30分钟。
8).弃去上清液,用含有0.1%triton的无菌PBS清洗三次,每次清洗放置在100转/分钟的水平摇床上摇晃5分钟。
9).封片,晾干后使用Zeiss共聚焦显微镜观察多肽的细胞进入。
3.2激光共聚焦技术检测未标记的多肽运载Cy3标记的小RNA的细胞进入
1).将多聚赖氨酸包被的细胞载玻片置于48孔板的孔内,使用相应培养基清洗两次。
2).将A549细胞用0.05%的胰蛋白酶消化后,分至48孔板的孔内,控制铺板密度使得细胞在24小时后长至约80%至85%。将细胞放置在37℃,5%CO
3).待细胞生长24小时后,将细胞培养基换成用培养基配置好的未标记的多肽(30μM)与Cy3标记的PGY-6-dsRNA(100nM)的混合液,加入后将细胞放置在37℃,5%CO
4).弃去培养基,将细胞用无菌PBS清洗三次,每次清洗放置在100转/分钟的水平摇床上摇晃5分钟。
5).弃去PBS,以200μL/孔加入4%的多聚甲醛室温固定15-20分钟。
6).弃去多聚甲醛,用含有0.1%triton的无菌PBS清洗三遍,每次放置在100转/分钟的水平摇床上摇晃5分钟。
7).去PBS后,以200μL/孔加入用含有0.1%triton的无菌PBS配置的含有细胞骨架F-actin抗体(体积比为1:200)和DAPI(体积比为1:1000)的溶液,室温避光放置30分钟。
8).弃去上清液,用含有0.1%triton的无菌PBS清洗三次,每次清洗放置在100转/分钟的水平摇床上摇晃5分钟。
9).封片,晾干后使用Zeiss共聚焦显微镜观察Cy3标记的小RNA的细胞进入。
3.3激光共聚焦实验检测FITC标记的多肽运载Cy3标记的小RNA的细胞进入
1).将多聚赖氨酸包被的细胞载玻片置于48孔板的孔内,使用相应培养基清洗两次。
2).将A549细胞用0.05%的胰蛋白酶消化后,分至48孔板的孔内,控制铺板密度使得细胞在24小时后长至约80%至85%。将细胞放置在37℃,5%CO
3).待细胞生长24小时后,将细胞培养基换成用培养基配置好的FITC标记的多肽(10μM)与Cy3标记的PGY-6-dsRNA(400nM)的混合液,加入后将细胞放置在37℃,5%CO
4).弃去培养基,将细胞用无菌PBS清洗三次,每次清洗放置在100转/分钟的水平摇床上摇晃5分钟。
5).弃去PBS,以200μL/孔加入4%的多聚甲醛室温固定15-20分钟。
6).弃去多聚甲醛,用含有0.1%triton的无菌PBS清洗三遍,每次放置在100转/分钟的水平摇床上摇晃5分钟。
7).弃去PBS后,以200μL/孔加入用含有0.1%triton的无菌PBS配置的含有DAPI(体积比为1:1000)的溶液,室温避光放置30分钟。
8).弃去上清液,用含有0.1%triton的无菌PBS清洗三次,每次清洗放置在100转/分钟的水平摇床上摇晃5分钟。
9).封片,晾干后使用Zeiss共聚焦显微镜观察FITC标记的多肽和Cy3标记的小RNA的细胞进入。
4.显微镜下观察多肽运载β-半乳糖苷酶的细胞进入
1).将A549细胞用0.05%的胰蛋白酶消化后,分至12孔板的孔内,控制铺板密度使得细胞在24小时后长至约80%至85%。将细胞放置在37℃,5%CO
2).待细胞生长24小时后,配置多肽(50μM)与β-半乳糖苷酶(50nM)的混合液,于37℃放置30分钟。将细胞培养基换成用培养基配置好的混合液,加入后将细胞放置在37℃,5%CO
3).按照BioVision的β-半乳糖苷酶染色试剂盒的使用说明(Catalog#K802-250)进行染色实验。
4).弃去培养基,将细胞用无菌PBS清洗一次。加入500μL固定液于室温放置10-15分钟。
5).弃去固定液,将细胞用无菌PBS清洗两次。
6).加入500μL染色溶液(470μL染色液,5μL染色补充液,25μL溶于DMSO的20mg/mlX-gal),37℃过夜染色。
7).在倒置显微镜下观察多肽运载β-半乳糖苷酶的细胞进入。
5.实时定量qPCR检测多肽携带小RNA的进入。
5.1多肽携带小RNA进行A549细胞的样本制备
1).将A549细胞用0.05%的胰蛋白酶消化后,分至12孔板的孔内,控制铺板密度使得细胞在24小时后长至约80%至85%。将细胞放置在37℃,5%CO
2).待细胞生长24小时后,配置多肽(10μM)与小RNA(100nM)的混合液于50μL DEPC处理的H
3).弃去培养基,将细胞用无菌PBS清洗三次,每次摇床100rpm/min摇晃清洗。
4).12孔板细胞每孔加入1mL TRizol,室温裂解10-15min,用于RNA提取。
5.2多肽携带小RNA进行小鼠器官的样本制备
1).C57 BL/6雄性小鼠周龄6至8周,体重20克左右,每组4只,并做好标记。
2).根据合成的多肽的质量与相对分子质量计算加入的超纯水的量(0.22μm的滤膜过滤),溶解多肽。同时根据小RNA的摩尔数计算溶解小RNA所需的超纯水的量。静置、混匀,待多肽和小RNA溶解后进行下一步实验。
3).将小RNA按照1:1的比例进行混合,混匀后,分装到无菌1.5ml EP管中,再将多肽溶液加入到EP管中,使得小RNA与多肽的P:N比为1:10。按照每只小鼠3nmol小RNA的量,在混合物中加入超纯水,使得每只小鼠的注射体积为300μL。混匀,室温放置5分钟。
4).腹腔注射1小时后,牺牲小鼠,取器官,包括脑心脏、肝脏、脾脏、肺、肾脏、胃、小肠、胸腺在内的8种器官或组织。并立即置于液氮保存。
5).在小鼠血液样品中,按照1:3的比例加入TRIzol LS,混匀,置于冰上裂解。取2ml平底离心管,在管中加入1mL TRizol,然后将适量组织块放入离心管中(心脏纵切取一半,肝脏取肝门处约0.2g,脾脏横切取一半,肺取右侧肺叶,肾取一侧肾脏,脑纵切取一半,睾丸取一侧,胸腺的全部,全部胆囊,胃取一半并洗净,小肠约取1厘米长度的肠管)。在冰上研磨组织至可以被TRIzol充分裂解,用于RNA的提取。
5.3细胞或者小鼠组织样本的总RNA提取
1).按照200μL氯仿/mL TRIzol的体积比在样品中加入氯仿,盖紧EP管盖后,用力振荡混匀样品,室温静置15min,期间再震荡摇晃一次。
2).4℃13200g·min
3).缓慢吸取上层水相至备好的相应离心管中。1mL TRIzol裂解样品吸取540μL左右的上层水相。
4).在上层水相中加入0.8倍水相体积的预冷异丙醇,充分混匀,-40℃冰箱放置30min。
5).13200g·min
6).加入1mL 75%乙醇(用DEPC处理过的水配制),震荡悬浮沉淀。
7).13200g·min
8).重复步骤6-7
9).小心将管底多余液体吸走,室温晾干。
10).观察RNA沉淀的大小,根据沉淀大小用不同体积的DEPC处理的H
11).取1μL RNA样品用NanoDrop 2000测定吸光度值,对RNA的纯度和浓度进行测定,以利于后期逆转实验的进行。
5.4RNA逆转录成cDNA
1).按照RNA样品数量及名称标记PCR管子。
2).按如下配制逆转体系:
3).small RNA(sRNA)逆转录专用引物中,应包含所有目的sRNA和内参U6的逆转录引物。在每个PCR小管中加入10μL配好的逆转录体系,再加入2μg相应的RNA(加入RNA的体积为10μL,不足10μL的部分,用Nuclease-free H2O补齐,使其终体积为20μL)。
4).按照如下程序进行逆转
逆转录产物cDNA按照需要加入无菌H
5.5实时定量qPCR检测小RNA的表达
1).配实时荧光定量PCR反应体系,每个反应体系中应含如下组分:
2).根据样品数计算总需体积数,配成混合液后,在384孔板中每孔加入9μL体系,然后加入1μL cDNA。
3).将384孔板加好反应体系后,用封口膜将板子封好,瞬离,使反应体系位于孔底。
4).将384孔板放入仪器的反应托架上,选择程序模板为:
a:95℃5min
b:95℃10s
c:55℃15s
d:72℃20s荧光信号采集b-d循环40次
e:熔点曲线反应程序
f:冷却反应
5).在反应进行时,设置样品名称和检测基因等信息,待反应结束后,选择相对定量,使用Advanced relative compare analysis分析方式,计算出内参基因和目的基因的相对Ct值。
6).根据公式:基因相对表达量值=2
6.双荧光报告基因系统检测多肽携带小RNA进入的功能研究
1).将HEK293T细胞用0.05%的胰蛋白酶消化后,分至48孔板的孔内,控制铺板密度使得细胞在12小时后长至约50%至60%。将细胞放置在37℃,5%CO
2).配置多肽(30μM)分别与两种小RNA(300nM)(HJT-sRNA-m7,PGY-sRNA-6)的混合液于50μL完全培养基中。加入48孔板每孔后将细胞放置在37℃,5%CO
3).用Lipo2000转染试剂转染野生型和突变型带有COLLAGEN3A1基因3’UTR区和RELA基因3’UTR区的双荧光素酶报告基因质粒,0.25μg/孔。
4).转染48小时后,利用Promega的双荧光报告基因检测试剂盒检测荧光素酶的荧光强度。
7.酶联免疫吸附实验检测多肽携带小RNA进入的功能研究。
7.1多肽携带小RNA进入细胞的功能研究
1).THP-1细胞分至12孔板中,细胞放置在37℃,5%CO
2).配置多肽(30μM)分别与PGY-sRNA-6(200nM)的混合液于50μL完全培养基中。加入12孔板细胞每孔后将细胞放置在37℃,5%CO
3).给予1μg/mL脂多糖LPS刺激细胞,作用24h后,将细胞转移至1.5mL EP管中,4℃,1,000rpm,离心5min,转移细胞上清至新1.5mL EP管中,加入100Xcock tail,利用ELISA检测炎症细胞因子(TNF-α和IL-1β)的表达水平。
4).包被:采用R&D公司的自包被ELISA板(IL-1βDY201-05,TNF-αDY210-05),用PBS稀释Capture Antibody(IL-1,TNF-α)(根据说明书上的稀释比例),室温包被过夜,约16-18h;
5).洗板:取出包被好的ELISA板,将CaptureAntibody液倒掉并在滤纸上将残余液体拍干,而后加入已配置好的洗液(PBS+0.1%tween 20)300μL进行清洗,每次停留1min(用ELISA板振荡器),每次也须将液体倒掉并在滤纸上将残余液体拍干(下同),清洗4次;
6).封闭:清洗完毕后,加入300μL封闭液(PBS+1%BSA),室温下温育1h;
7).准备:在1h间须准备相应标准品(IL-1,TNF-α),根据说明书配好最高浓度后按照1/2的浓度梯度进行稀释,稀释7次,最后第八管加入稀释液作为0管;
8).洗板:温育1h后使用洗液清洗4次;
9).加样:将准备好的标准品加入ELISA板的左右两排,其他孔中加入样品,室温孵育2h;
10).加一抗:洗液清洗4次,加入100μL Detection Antibody,封好后室温孵育2h;
11).加二抗:洗液清洗4次,加入100μLAvidin-HRP,封好后室温孵育20min;
12).加底物:洗液清洗4次,加入100μL TMB Substrate Solution,尽量在暗中操作,而后马上置于抽屉中暗置10至20min左右,颜色变蓝后,加入100μL终止液终止反应,颜色由蓝变黄;
13).在30min内进行吸光度测定,450nm检测波长,570nm参考波长。
7.2多肽携带小RNA进入小鼠器官的功能研究
1).C57 BL/6雄性小鼠周龄6至8周,体重20克左右,每组4只,并做好标记。根据合成的多肽的质量与相对分子质量计算加入的超纯水的量(0.22μm的滤膜过滤),溶解多肽。同时根据小RNA的摩尔数计算溶解小RNA所需的超纯水的量。静置、混匀,待多肽和小RNA溶解后进行下一步实验。
2).将PGY-sRNA-6与多肽溶液加入到EP管中,。按照每只小鼠10nmol小RNA的量,在混合物中加入超纯水,使得每只小鼠的注射体积为300μL。混匀,室温放置5分钟。
3).提前24小时和提前1小时两次腹腔注射后,在无菌条件下,将poly(I:C)溶于PBS中配制贮存液浓度为10mg/mL。按每只小鼠给药500ug poly(I:C)的剂量,每管50uL分装。气管滴注法造急性肺损伤模型,6h后牺牲小鼠,收取肺泡灌洗液待检测。
4).包被:采用R&D公司的自包被ELISA板(IL-6DY406,TNF-αDY410),用PBS稀释Capture Antibody(IL-6,TNF-α)(根据说明书上的稀释比例),室温包被过夜,约16-18h;
5).洗板:取出包被好的ELISA板,将CaptureAntibody液倒掉并在滤纸上将残余液体拍干,而后加入已配置好的洗液(PBS+0.1%tween 20)300μL进行清洗,每次停留1min(用ELISA板振荡器),每次也须将液体倒掉并在滤纸上将残余液体拍干(下同),清洗4次;
6).封闭:清洗完毕后,加入300μL封闭液(PBS+1%BSA),室温下温育1h;
7).准备:在1h间须准备相应标准品(IL-6,TNF-α),根据说明书配好最高浓度后按照1/2的浓度梯度进行稀释,稀释7次,最后第八管加入稀释液作为0管;
8).洗板:温育1h后使用洗液清洗4次;
9).加样:将准备好的标准品加入ELISA板的左右两排,其他孔中加入样品,室温孵育2h;
10).加一抗:洗液清洗4次,加入100μL Detection Antibody,封好后室温孵育2h;
11).加二抗:洗液清洗4次,加入100μLAvidin-HRP,封好后室温孵育20min;
12).加底物:洗液清洗4次,加入100μL TMB Substrate Solution,尽量在暗中操作,而后马上置于抽屉中暗置10至20min左右,带颜色变蓝后,加入100μL终止液终止反应,颜色由蓝变黄;
13).在30min内进行吸光度测定,450nm检测波长,570nm参考波长。
8.蛋白免疫印迹实验检测多肽携带小RNA进入细胞的功能研究。
8.1多肽携带小RNA进入MCR-5细胞样品收取
1).MRC-5细胞分至12孔板中,细胞放置在37℃,5%CO
2).配置多肽(10μM)分别与HJT-sRNA-m7(300nM)的混合液于50μL完全培养基中。加入12孔板细胞每孔后将细胞放置在37℃,5%CO
3).给予刺激物3ng/mL转化生长因子TGFβ1)刺激MRC-5细胞,作用72小时后,用强RIPA裂解液收取细胞,用于检测相关基因的蛋白表达水平。
8.2蛋白免疫印迹法检测(Western blot)
制胶:采用10%浓度分离胶(下层胶)和5%浓度的浓缩胶(上层胶),15孔梳子所做泳道,每个泳道样品蛋白上样量相等;
蛋白电泳:加入电泳缓冲液,电泳起始电压80V;当溴酚兰染料到分离胶后,提高电压至120V继续电泳,直至溴酚兰染料达到分离胶底部或全部泳出凝胶;
湿法转膜:按照转膜夹板(负极)-海绵-滤纸-凝胶-PVDF膜-滤纸-海绵-转膜夹板(正极)的顺序进行组装;安装后并将整个转膜装置置于4℃冷室;恒定电流300mA,转膜120min;
封闭:转膜结束后置于3%BSA封闭液中,室温封闭1h;
一抗孵育:将封闭后的PVDF膜转移至杂交袋中,加入含有对应一抗(一抗的信息如下)的3% BSA封闭液,赶出袋中气泡,密封后4℃过夜孵育;
纤连蛋白抗体(sigma F7387)
Actin抗体(sigma A5441)
洗膜:将PVDF膜取出,用TBST洗膜3次,每次10min;
二抗孵育:弃去TBST,加入含有带有辣根过氧化物酶(HRP)的山羊抗兔或山羊抗小鼠的二抗(购自杭州联科生物技术有限公司)的3%BSA封闭液(二抗稀释比例1:5000),室温孵育1小时;
洗膜:用TBST洗膜3次,每次10min;
显影:配制Western显色液(1:1,V/V,Merck Millipore,ECL化学发光显色液购自Millipore公司),并将配制好的显色液均匀滴加于膜结合蛋白的一侧;用保鲜膜小心的将膜包好,显色后观察;
分析:用Image J软件进行分析。
9.激光共聚焦实验检测多肽携带GFP质粒进入细胞并表达。
1).将多聚赖氨酸包被的细胞载玻片置于48孔板的孔内,使用相应培养基清洗两次。
2).将HEK293T细胞用0.05%的胰蛋白酶消化后,分至48孔板的孔内,控制铺板密度使得细胞在12小时后长至约50%至60%。将细胞放置在37℃,5%CO2培养箱中培养。
3).待细胞生长12小时后,用完全培养基配置好的多肽与质粒(0.25μg/孔)的混合液,N/P为400:1,加入后将细胞放置在37℃,5%CO2培养箱中避光温育48小时。
4).弃去培养基,将细胞用无菌PBS清洗三次。
5).弃去PBS,以200μL/孔加入4%的多聚甲醛室温固定15-20分钟。
6).弃去多聚甲醛,用无菌PBS清洗三遍。
7).弃去PBS后,封片,晾干后使用Zeiss共聚焦显微镜观察GFP绿色荧光蛋白的表达。
10.免疫组化检测多肽与EGFP融合蛋白进入小鼠器官的功能研究。
1).C57 BL/6雄性小鼠周龄6至8周,体重20克左右,每组4只,并做好标记。
2).根据融合蛋白的储存浓度和相对分子质量,计算蛋白稀释比例,使得每360μL蛋白溶液中含EGFP融合蛋白1mg。
3).每只小鼠腹腔注射360μL PBS或含1mg融合蛋白的PBS。
4).1小时后,牺牲小鼠,取小鼠器官(肝脏、脾脏、肾脏和脑),石蜡包埋,并进行石蜡切片。
5).脱蜡
a.将切片置于架子上,依据下列方法依次冲洗:
二甲苯:2X 3分钟
二甲苯与无水乙醇1:1混匀:3分钟
无水乙醇:2X 3分钟
95%乙醇:3分钟
70%乙醇:3分钟
50%乙醇:3分钟
冷水流洗
b.抗原修复前确保切片一直浸没在水中,切勿变干,变干后会导致非特异性抗体结合产生高背景。
6).抗原修复
a.按上所述将切片脱蜡至水。
b.依据用户说明书设置蒸煮锅并预热。
c.在烧瓶中预热合适的修复缓冲液并煮沸(用微波炉加热会更方便)。
d.将盛放玻片架的容器放置蒸煮锅中。
e.将热修复缓冲液小心加到容器中,然后放入玻片架。也可以采用更简捷的操作,先向容器中加热修复缓冲液再一同放入蒸煮锅中。
f.加盖。盛放缓冲液的容器也须配备盖子。起始时玻片架可能会使修复溶液温度降低,但几分钟内会回升到95-100℃之间。
g.达到温度后维持20分钟。
h.20分钟后,取出容器放置水中冷却10分钟。
7).封闭
(1)在含0.025% Triton X-100的TBS中漂洗玻片2×5分钟,轻轻震荡。
(2)用含10%正常血清、1% BSA的TBS室温封闭2小时。控干封闭液(不是漂洗),并用纸巾将玻片周围擦干。
8).孵育一抗
a.一抗用含1% BSA的TBS稀释后加到玻片上。
b.4℃孵育过夜。
9).孵育二抗
a.用含0.025% Triton X-100的TBS漂洗2×5分钟,并轻轻震荡。
b.用含0.025% Triton X-100的TBS漂洗2×5分钟,并轻轻震荡。
c.在TBS中漂洗3X 5分钟。
d.封固剂和盖玻片进行封固。
10).使用Zeiss共聚焦显微镜观察EGFP荧光强度,并用ImagJ软件进行统计。
11.酶联免疫吸附实验检测多肽携带小分子药物silybin和小RNA antagomir进入小鼠器官的功能研究。
11.1多肽携带小分子进入小鼠器官的功能研究
1).C57 BL/6雄性小鼠周龄6至8周,体重20克左右,每组4只,并做好标记。根据合成的多肽的质量与相对分子质量计算加入的超纯水的量(0.22μm的滤膜过滤),溶解多肽,DMSO溶解小分子药物。静置、混匀,待多肽和小RNA溶解后进行下一步实验。
2).将10mg/kg的多肽溶液与小分子药物silybin(100mg/kg)加入到EP管中,最后在混合物中加入超纯水,使得每只小鼠的灌胃体积为200μL。混匀,室温放置5分钟。
3).提前48小时、提前24小时和提前1小时三次灌胃后,在无菌条件下,将LPS溶于PBS中配制贮存液浓度为1mg/mL。按每只小鼠给药50μL的剂量,气管滴注法造急性肺损伤模型,9h后牺牲小鼠,收取肺泡灌洗液待检测。
11.2多肽携带小RNA antagomir进入小鼠器官的功能研究
1).C57 BL/6雄性小鼠周龄6至8周,体重20克左右,每组4只,并做好标记。根据合成的多肽的质量与相对分子质量计算加入的超纯水的量(0.22μm的滤膜过滤),溶解多肽,DMSO溶解小分子药物。静置、混匀,待多肽和小RNA溶解后进行下一步实验。
2).将10mg/kg的多肽溶液与miR-1246antagomir(20μg/只)加入到EP管中,最后在混合物中加入超纯水,使得每只小鼠的注射体积为100μL。混匀,室温放置5分钟。
3).提前提前24小时和提前1小时两次腹腔注射后,在无菌条件下,将LPS溶于PBS中配制贮存液浓度为1mg/mL。按每只小鼠给药50μL的剂量,气管滴注法造急性肺损伤模型,9h后牺牲小鼠,收取肺泡灌洗液待检测。
实施例2:来源于流感病毒M2蛋白的多肽序列的细胞进入
基于Caledonia/20/1999(H1N1)和A/HongKong/97/98(H5N1)两株流感病毒的M2蛋白的序列,合成了如表1中列出的多肽序列,其中TAT HIV作为阳性对照细胞穿透肽。为了便于检测多肽的细胞进入,使用罗丹明标签在N端标记了多肽。
表1.罗丹明标记的多肽序列
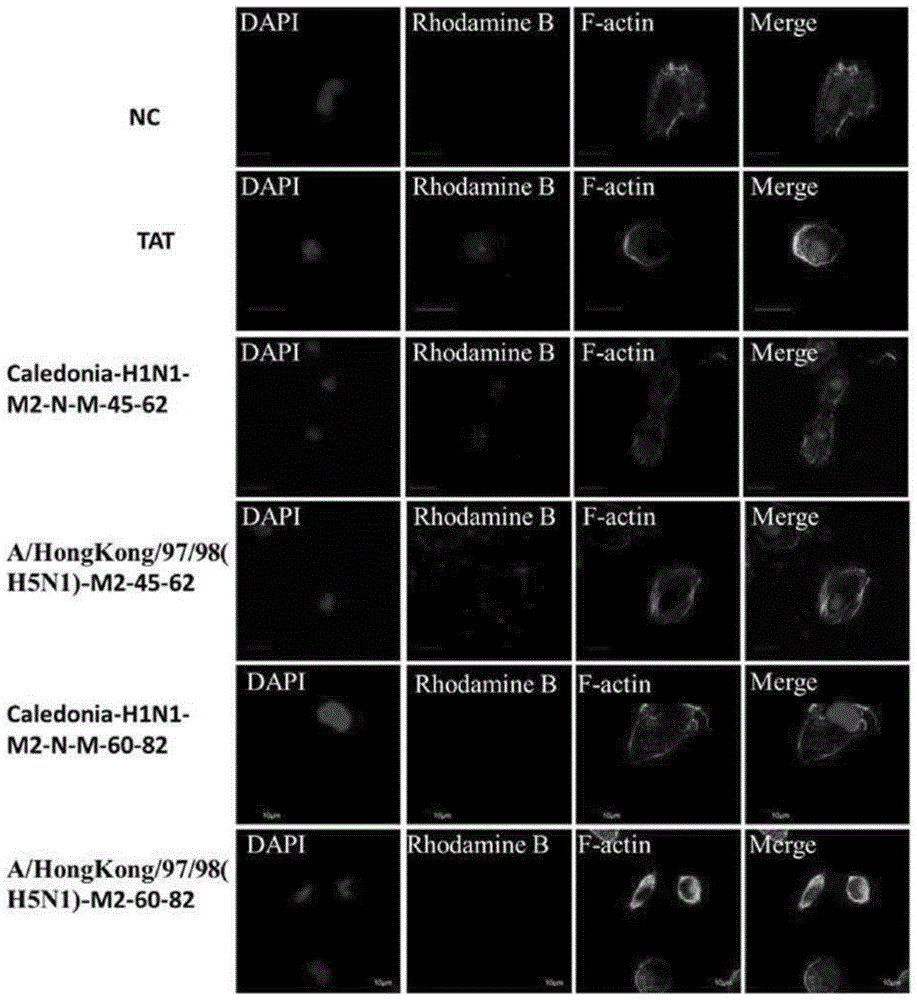
多肽的细胞进入的激光共聚焦实验结果如图1所示。罗丹明标记的Caledonia/20/1999(H1N1)-M2-N-M-AH(45-62)和A/HongKong/97/98(H5N1)-M2-N-M-AH(45-62)多肽以及阳性对照TAT多肽在浓度为30μM时都可进入A549细胞。而罗丹明标记的Caledonia/20/1999(H1N1)-M2-N-M-AH(60-82)和A/HongKong/97/98(H5N1)-M2-N-M-AH(60-82)多肽在浓度为30μM时没有在A549细胞内检测到信号,即没有进入细胞。上述结果表明,流感病毒M2蛋白具有细胞穿透肽的功能,且其细胞穿透肽功能与氨基酸45-62这段片段相关。
实施例3:M2蛋白的细胞穿透肽功能片段的鉴定
为了确定M2蛋白的细胞穿透肽特性的优选作用肽段范围,基于A/chicken/Jilin/9/2004(H5N1)的M2蛋白序列(其与实施例2中使用的A/HongKong/97/98(H5N1)-M2高度保守)合成了表2中所示的多肽序列。根据M2蛋白的结构,对其由97个氨基酸组成的序列进行了分段合成。为了便于检测多肽的细胞进入,使用FITC在N端标记了多肽。
表2.FITC标记的基于M2蛋白的多肽序列
首先检测了FITC标记的Jilin-2004(H5N1)-M2-45-62多肽在不同浓度(100μM、30μM、10μM、3μM和1μM)下的细胞进入功能,其结果如图2所示。从该结果可见,Jilin-2004(H5N1)-M2-45-62多肽在测试的所有浓度下均能实现明显的A549细胞进入,且其进入效果远强于FITC标记的TAT多肽(阳性对照)。值得注意的是,TAT多肽在浓度为3μM时已经观察不到细胞进入,而FITC标记的Jilin-2004(H5N1)-M2-45-62多肽在低至1μM的浓度下细胞进入效果仍然十分明显。上述结果表明,基于流感病毒M2蛋白的Jilin-2004(H5N1)-M2-45-62多肽具有远强于阳性对照TAT的细胞穿透功能,使得其在低浓度在也能实现细胞进入。
检测了表2中的所有合成的FITC标记的多肽的细胞进入功能。使用的多肽浓度为1μM、3μM和10μM,其流式细胞术结果分别如图3、图4和图5所示。其中,当使用浓度为1μM的多肽时,结果如图3所示,Jilin-2004(H5N1)-M2-45-62、Jilin-2004(H5N1)-M2-44-61和Jilin-2004(H5N1)-M2-47-64在温育1小时后进入A549细胞。当使用的多肽浓度为3μM或10μM时,结果分别如图4和图5所示,Jilin-2004(H5N1)-M2-45-62、Jilin-2004(H5N1)-M2-44-61、Jilin-2004(H5N1)-M2-47-64和Jilin-2004(H5N1)-M2-50-67在温育1小时后进入A549细胞。此外,还观察到除了Jilin-2004(H5N1)-M2-50-67外,其它三种多肽的细胞进入效果均强于作为阳性对照的TAT多肽。上述结果表明M2蛋白的细胞穿透肽功能与氨基酸44-67相关。
进一步检测了上述具有细胞穿透功能的四种多肽(Jilin-2004(H5N1)-M2-45-62、Jilin-2004(H5N1)-M2-44-61、Jilin-2004(H5N1)-M2-47-64和Jilin-2004(H5N1)-M2-50-67)在更低浓度下的细胞进入效果。使用0.03μM、0.1μM、0.3μM、1μM、3μM和10μM的浓度进行了检测,其结果如图6所示。该结果表明,当多肽在浓度降低至0.1μM和0.03μM时,多肽依然能够进入A549细胞,其中Jilin-2004(H5N1)-M2-44-61多肽是细胞进入效果甚至更优的多肽。
此外,当使用N端多肽Jilin-2004(H5N1)-M2-1-24,跨末端多肽Jilin-2004(H5N1)-M2-25-43时均没有检测到细胞进入信号。另外,M2蛋白的胞内肽段FITC-Jilin-2004(H5N1)-M2-53-70、FITC-Jilin-2004(H5N1)-M2-56-73、FITC-Jilin-2004(H5N1)-M2-59-76、FITC-Jilin-2004(H5N1)-M2-62-79和FITC-Jilin-2004(H5N1)-M2-65-82都没有显示出细胞进入性质。
为了验证M2相关多肽在其他细胞类型中是否也具有细胞穿透特性,使用HeLa细胞和MRC5细胞检测了Jilin-2004(H5N1)-M2-45-62、Jilin-2004(H5N1)-M2-44-61、Jilin-2004(H5N1)-M2-47-64和Jilin-2004(H5N1)-M2-50-67多肽的细胞穿透特性。其结果如图7所示。上述结果与使用A549细胞所得的结果一致,表明M2相关多肽的细胞穿透肽功能不限于特定的细胞,而具有一定的普遍性。
实施例4:优选多肽片段的鉴定
根据实施例2和实施例3中的结果可知,M2蛋白的细胞穿透肽特性主要集中于片段44-67。因此,进一步合成了上述片段的N端和C端的依次截短片段(表3)。通过检测表3中所示的多肽片段的细胞进入功能鉴定优选多肽片段。
表3.M2蛋白44-67序列的截短片段
使用流式细胞术检测了上述多肽的细胞进入特性。图8显示了从N端依次截短的多肽的数据。该结果表明,随着N端第44位氨基酸到第48位氨基酸的依次去除,多肽的细胞进入效果逐步减弱,其中当存在第44位氨基酸时细胞进入效果更好。
图9和图10显示了从C端(第67位氨基酸)依次截短的多肽的流式细胞术检测结果,其中使用的多肽浓度为1μM,温育时间为1小时。该结果表明,Jilin-2004(H5N1)-M2-44-65和Jilin-2004(H5N1)-M2-44-61多肽相比于其它多肽具有甚至更好的进入效果。图11和图12显示了温育3小时的细胞进入结果,其与图9和图10中的结果一致,表明Jilin-2004(H5N1)-M2-44-65和Jilin-2004(H5N1)-M2-44-61多肽具有甚至更好的进入效果。还显示了JiLin-2004(H5N1)-M2-45-62多肽也有很好的细胞穿透肽效果。
为了证明M2相关多肽的细胞进入功能具有普遍性而不受到特定细胞类型的限制,在293T细胞、HUVEC细胞、HCT-116细胞、MKN-45细胞、MRC5细胞、U397细胞和ESF-1细胞这些类型各异的细胞中检测了M2蛋白第44-67位氨基酸的多肽及其截短片段的细胞穿透特性,其结果如图13至图25所示。其中,图13和图14显示了使用293T细胞的结果;图15和图16显示了使用HUVEC细胞的结果;图17和图18显示了使用HCT-116细胞的结果;图19和20显示了使用MKN-45细胞的结果;图21和图22显示了使用U937细胞的结果;图23显示了使用MRC5细胞的结果;并且图24和图25显示了使用ESF-1细胞的结果。在上述不同细胞中观察到了与A549细胞中一致的结果,即基于M2蛋白第44-67位氨基酸的多肽及其截短片段在不同细胞系中均具有细胞穿透肽的特性,且Jilin-2004(H5N1)-M2-44-65、Jilin-2004(H5N1)-M2-44-61和JiLin-2004(H5N1)-M2-45-62多肽具有甚至更好的进入效果。
实施例5:温育时间对多肽的细胞进入的影响
选择Jilin-2004(H5N1)-M2-44-61多肽,使用A549细胞研究了多肽与细胞的温育时间对多肽的细胞进入的影响。空白A549细胞,NC和TAT分别作为空白对照、阴性对照和阳性对照。首先检测了5min,10min,30min这三个时间点的细胞进入,其结果如图26所示。该结果表明,当使用1μM的Jilin-2004(H5N1)-M2-44-61多肽时,与A549细胞温育5分钟就能检测到其细胞进入,且随着温育时间的增加其细胞进入量也增加。
进一步将温育时间扩展至5分钟、10分钟、30分钟、1小时、2小时、3小时和6小时,并检测多肽的细胞进入效果。如图27中的结果所示,当使用1μM的NC阴性对照多肽时,在所有时间点均没有多肽进入。当使用1μM的阳性对照TAT多肽,其在5分钟时开始进入细胞,且在1小时的时间点进入效果明显。对于1μM的Jilin-2004(H5N1)-M2-44-61多肽,其在5分钟时开始进入细胞,且在30分钟时已经有很强的进入效果,且在1小时、3小时和6小时三个时间点进入效果相差不大。值得注意的是,在相同的时间点,Jilin-2004(H5N1)-M2-44-61多肽的细胞进入效果远强于阳性对照TAT多肽。基于上述结果,选择多肽进入效果明显的最短时间,即1小时作为后续研究的温育时间。
实施例6:基于M2蛋白的细胞穿透肽与现有细胞穿透肽的细胞进入效果比较
合成了FITC标记已报道的17种细胞穿透肽(见表4)。使用A549细胞,在1μM的多肽浓度和1小时的温育时间的条件下比较了基于流感病毒M2蛋白的JiLin-2004(H5N1)-M2-45-62、JiLin-2004(H5N1)-M2-44-61和JiLin-2004(H5N1)-M2-44-65多肽与上述17种细胞穿透肽的细胞进入效果,如图28、图29和图30所示,JiLin-2004(H5N1)-M2-45-62、JiLin-2004(H5N1)-M2-44-61和JiLin-2004(H5N1)-M2-44-65多肽的细胞进入效果明显好于现有的细胞穿透肽。相似的,使用A549细胞,在3μM的多肽浓度和1小时的温育时间的条件下进行了比较。如图31、图32、图33中的结果所示,JiLin-2004(H5N1)-M2-45-62、JiLin-2004(H5N1)-M2-44-61和JiLin-2004(H5N1)-M2-44-65多肽的细胞进入效果明显好于现有的细胞穿透肽。
表4.现有细胞穿透肽序列
实施例7:对JiLin-2004(H5N1)-M2-44-56多肽的改造
进一步,对细胞进入效果明显的JiLin-2004(H5N1)-M2-44-56、JiLin-2004(H5N1)-M2-45-62和JiLin-2004(H5N1)-M2-44-65多肽进行改造。在多肽序列中突变一个或多个氨基酸残基,并检测氨基酸突变对其细胞穿透肽功能的影响。表5显示了JiLin-2004(H5N1)-M2-44-56及其突变的多肽序列。
表5.JiLin-2004(H5N1)-M2-44-56及其突变多肽序列
通过流式细胞术检测12种JiLin-2004(H5N1)-M2-44-56突变体多肽序列与阳性对照TAT多肽和亲本JiLin-2004(H5N1)-M2-44-56之间的细胞穿透肽功能的比较。根据图34的结果所示,JiLin-2004(H5N1)-M2-44-56和其12条突变体多肽序列均有细胞穿透肽的功能,且都强于阳性对照TAT。其中mut9突变体的细胞穿透肽功能相比于亲本多肽增强。
实施例8-1:对JiLin-2004(H5N1)-M2-45-62多肽的改造
合成了如表6中所示的基于JiLin-2004(H5N1)-M2-45-62多肽的突变多肽序列。
表6.JiLin-2004(H5N1)-M2-45-62及其突变多肽序列
通过流式细胞术检测13种JiLin-2004(H5N1)-M2-45-62突变体多肽序列与阳性对照TAT多肽和亲本JiLin-2004(H5N1)-M2-45-62之间的细胞穿透肽功能的比较。根据图35的结果所示,JiLin-2004(H5N1)-M2-45-62和其13条突变体多肽序列均有细胞穿透肽的功能,且都强于阳性对照TAT。值得注意的是,13种JiLin-2004(H5N1)-M2-45-62突变体多肽的细胞穿透肽功能均强于亲本JiLin-2004(H5N1)-M2-45-62多肽。
通过激光共聚焦技术从影像学上检测JiLin-2004(H5N1)-M2-45-62与其突变体的细胞穿透肽功能。结果如图36所示,JiLin-2004(H5N1)-M2-45-62和其13条突变体多肽序列均有细胞穿透肽的功能。且突变体mut2、mut3、mut4、mut5、mut6和mut13的细胞穿透肽功能强于亲本JiLin-2004(H5N1)-M2-45-62多肽。
此外,合成了表7中所示的基于JiLin-2004(H5N1)-M2-45-62多肽的单位点突变多肽序列,并检测了其细胞穿透肽功能。
表7.JiLin-2004(H5N1)-M2-45-62及其单位点突变多肽序列
通过流式细胞术检测18种JiLin-2004(H5N1)-M2-45-62单位点突变体多肽序列与阳性对照TAT多肽和亲本JiLin-2004(H5N1)-M2-45-62之间的细胞穿透肽功能的比较。根据图37的结果所示,JiLin-2004(H5N1)-M2-45-62和其18条突变体多肽序列均有细胞穿透肽的功能,且都强于阳性对照TAT。值得注意的是,单位点突变序列mut46、mut51、mut52、mut53、mut54、mut58、mut59、mut60和mut62的细胞穿透肽功能均强于亲本JiLin-2004(H5N1)-M2-45-62多肽。
通过激光共聚焦技术从影像学上检测JiLin-2004(H5N1)-M2-45-62与其单位点突变体的细胞穿透肽功能。结果如图38所示,JiLin-2004(H5N1)-M2-45-62和其18条单位点突变体多肽序列均有细胞穿透肽的功能。且突变体mut45、mut48、mut50、mut51和mut61的细胞穿透肽功能强于亲本JiLin-2004(H5N1)-M2-45-62多肽。
实施例8-2:对JiLin-2004(H5N1)-M2-44-61多肽的改造
合成了如表8中所示的基于JiLin-2004(H5N1)-M2-44-61多肽的突变多肽序列。
表8.JiLin-2004(H5N1)-M2-44-61及其突变多肽序列
通过流式细胞术检测15种JiLin-2004(H5N1)-M2-44-61突变体多肽序列与阳性对照TAT多肽和亲本JiLin-2004(H5N1)-M2-44-61在A549细胞中的细胞穿透肽功能的比较。
如图59所示,当使用A549细胞和1μM的多肽浓度时,JiLin-2004(H5N1)-M2-44-61多肽及其15种突变体均有细胞穿透肽的功能,且都强于阳性对照TAT。其中,突变体mut13和mut14的细胞穿透肽功能强于亲本JiLin-2004(H5N1)-M2-44-61多肽。
实施例9:对JiLin-2004(H5N1)-M2-44-65多肽的改造
合成了如表9中所示的基于JiLin-2004(H5N1)-M2-45-65多肽的突变多肽序列。
表9.JiLin-2004(H5N1)-M2-44-65及其突变多肽序列
/>
通过流式细胞术检测29种JiLin-2004(H5N1)-M2-44-65突变体多肽序列与阳性对照TAT多肽和亲本JiLin-2004(H5N1)-M2-44-65在A549细胞、293T细胞、MRC5细胞、U937细胞和HCT-116细胞中的细胞穿透肽功能的比较。
如图39所示,当使用A549细胞和1μM的多肽浓度时,JiLin-2004(H5N1)-M2-44-65多肽及其28种突变体均有细胞穿透肽的功能,且都强于阳性对照TAT。其中,突变体mut8、mut25和mut26的细胞穿透肽功能强于亲本JiLin-2004(H5N1)-M2-44-65多肽。此外,如图40所示,当使用3μM的多肽浓度时也获得了类似的结果,其中JiLin-2004(H5N1)-M2-44-65多肽及其28种突变体的细胞穿透肽功能均强于阳性对照TAT。其中突变体mut8、mut9、mut10、mut12、mut24、mut25和mut26的细胞穿透肽功能强于亲本JiLin-2004(H5N1)-M2-44-65多肽。
图41显示了使用293T细胞的检测结果。其中,JiLin-2004(H5N1)-M2-44-65多肽及其28种突变体均有细胞穿透肽的功能,且都强于阳性对照TAT。突变体mut8、mut9、mut12、mut17、mut25、mut26和mut27的细胞穿透肽功能强于亲本JiLin-2004(H5N1)-M2-44-65多肽。
图42显示了使用MRC5细胞的检测结果。其中,JiLin-2004(H5N1)-M2-44-65多肽及其28种突变体均有细胞穿透肽的功能,且都强于阳性对照TAT。突变体mut8、mut9、mut12和mut25的细胞穿透肽功能强于亲本JiLin-2004(H5N1)-M2-44-65多肽。
此外,对于在A549细胞、293T细胞和MRC5细胞中部分突变体多肽,在U937细胞和HCT-116细胞中验证了其细胞穿透肽效果,结果分别如图43和图44所示,其中图43显示了使用U937细胞的结果,图44显示了使用HCT-116细胞的结果。当使用1μM的多肽浓度时,上述突变体多肽均具有细胞穿透肽功能,且都强于阳性对照TAT。
实施例10:细胞穿透肽携带小RNA进入细胞
先前的研究表明,大多数细胞穿透肽可以携带生物活性分子例如小RNA进入细胞。为了验证本发明的细胞穿透肽的上述特性,使用本发明JiLin-2004(H5N1)-M2-45-62、JiLin-2004(H5N1)-M2-44-61和JiLin-2004(H5N1)-M2-44-56多肽研究其携带小RNA进入细胞中的效果。使用FAM标记的小RNA在A549细胞中进行了实验。如图45所示,当使用30μM的多肽和300nM的小RNA时,上述三种多肽在1小时均能够携带小RNA进入细胞,且相比于相同浓度的阳性对照TAT,其携带小RNA的能力显著更强。值得注意的是,JiLin-2004(H5N1)-M2-44-61携带FAM标记的小RNA的能力强于转染试剂RNAiMax。
随后对上述每一种多肽进行了进一步验证。对于JiLin-2004(H5N1)-M2-45-62,使用FITC标记的多肽和Cy3标记的小RNA在A549细胞中进行实验。结果如图46中所示,当使用10μM的多肽和200nM的小RNA时,JiLin-2004(H5N1)-M2-45-62在1小时就能够携带小RNA进入细胞,且相比于相同浓度的阳性对照TAT,其携带小RNA的能力显著更强。
对于JiLin-2004(H5N1)-M2-44-56多肽,当将30μM的多肽和100nM的Cy3标记的小RNA混合并与A549细胞温育时,如图47中的结果所示,在1小时多肽就能够携带小RNA进入细胞,且其效果强于转染试剂RNAiMax。
此外,检测了JiLin-2004(H5N1)-M2-44-61、JiLin-2004(H5N1)-M2-44-65多肽及其突变体mut8(JiLin-2004(H5N1)-M2-44-65mut8)携带小RNA的能力。当将10μM的多肽和200nM的Cy3标记的小RNA混合并与A549细胞温育时,如图48中的结果所示,在1小时多肽就能够携带小RNA进入细胞,且其效果强于转染试剂RNAiMax。其中,JiLin-2004(H5N1)-M2-44-65mut8突变体多肽携带小RNA进入细胞的能力甚至更强。10μM的多肽和200nM的Cy3标记的小RNA混合并与A549细胞温育时,如图60所示,超高分辨显微镜下观察JiLin-2004(H5N1)-M2-44-61和JiLin-2004(H5N1)-M2-44-65多肽可以携带Cy3标记的小RNA进入A549细胞,并且效果明显强于转染试剂RNAiMax,也强于TAT。
上述实验均通过激光共聚焦实验检测多肽携带小RNA的进入,我们又通过实时定量qPCR的方法,通过检测多肽携带的小RNA在细胞内的相对表达丰度确定多肽对小RNA的携带能力。如图61所示,根据流感病毒M2的不同肽段的细胞穿透功能,分别检测对照组空白细胞,多肽溶剂与100nM的PGY-sRNA-26的混合物以及10μM的多肽JiLin-2004(H5N1)-M2-1-24、JiLin-2004(H5N1)-M2-25-43、JiLin-2004(H5N1)-M2-45-62、JiLin-2004(H5N1)-M2-60-82以及对照细胞穿透肽TAT分别和100nM的PGY-sRNA-26混合并与A549细胞温育1小时后,只有多肽JiLin-2004(H5N1)-M2-45-62有携带小RNA进入细胞的能力。在此实验条件下,对照细胞穿透肽TAT携带小RNA的能力很弱。
图62显示,JiLin-2004(H5N1)-M2-45-62及其单位点突变多肽序列全部有携带小RNA进入细胞的能力,且野生型JiLin-2004(H5N1)-M2-45-62、JiLin-2004(H5N1)-M2-45-62mut45、JiLin-2004(H5N1)-M2-45-62mut46、JiLin-2004(H5N1)-M2-45-62mut47、JiLin-2004(H5N1)-M2-45-62mut48、JiLin-2004(H5N1)-M2-45-62mut49、JiLin-2004(H5N1)-M2-45-62mut51、JiLin-2004(H5N1)-M2-45-62mut52、JiLin-2004(H5N1)-M2-45-62mut53、JiLin-2004(H5N1)-M2-45-62mut55、JiLin-2004(H5N1)-M2-45-62mut56、JiLin-2004(H5N1)-M2-45-62mut59和JiLin-2004(H5N1)-M2-45-62mut61携带小RNA进入细胞的能力均强于转染试剂RNAiMax组。
图63显示,JiLin-2004(H5N1)-M2-45-62及其突变多肽序列全部有携带小RNA进入细胞的能力,且野生型JiLin-2004(H5N1)-M2-45-62、JiLin-2004(H5N1)-M2-45-62mut1、JiLin-2004(H5N1)-M2-45-62mut5、JiLin-2004(H5N1)-M2-45-62mut8和JiLin-2004(H5N1)-M2-45-62mut23携带小RNA进入细胞的能力均强于转染试剂RNAiMax组。
图64显示,JiLin-2004(H5N1)-M2-44-61及其突变多肽序列全部有携带小RNA进入细胞的能力,且野生型JiLin-2004(H5N1)-M2-44-61、JiLin-2004(H5N1)-M2-44-61mut1、JiLin-2004(H5N1)-M2-44-61mut4、JiLin-2004(H5N1)-M2-44-61mut6、JiLin-2004(H5N1)-M2-44-61mut8、JiLin-2004(H5N1)-M2-44-61mut10、JiLin-2004(H5N1)-M2-44-61mut12、JiLin-2004(H5N1)-M2-44-61mut14、JiLin-2004(H5N1)-M2-44-61mut16和JiLin-2004(H5N1)-M2-44-61mut17携带小RNA进入细胞的能力均强于转染试剂RNAiMax组。
图65显示,JiLin-2004(H5N1)-M2-44-65及其突变多肽序列全部有携带小RNA进入细胞的能力,且野生型JiLin-2004(H5N1)-M2-44-65、JiLin-2004(H5N1)-M2-44-65mut1、JiLin-2004(H5N1)-M2-44-65mut2、JiLin-2004(H5N1)-M2-44-65mut5、JiLin-2004(H5N1)-M2-44-65mut6、JiLin-2004(H5N1)-M2-44-65mut7、JiLin-2004(H5N1)-M2-44-65mut11、JiLin-2004(H5N1)-M2-44-65mut15、JiLin-2004(H5N1)-M2-44-65mut17、JiLin-2004(H5N1)-M2-44-65mut23、JiLin-2004(H5N1)-M2-44-65mut26和JiLin-2004(H5N1)-M2-44-65mut27携带小RNA进入细胞的能力均强于转染试剂RNAiMax组。
如上所有实验结果总结出,流感病毒来源的有细胞穿透肽功能的多肽均能够携带小RNA进入细胞,并且携带能力均强于对照细胞穿透肽TAT。多数细胞穿透肽携带小RNA进入细胞的能力明显强于目前公认的转染试剂RNAimax。
实施例11-1:细胞穿透肽携带小RNA进入并发挥其功能
在实施例9的基础上进一步验证了本发明的细胞穿透肽携带小RNA进入细胞后是否能实现小RNA的正常功能。先前的实验已经证明PGY-dsRNA-6能够靶向结合RELA基因的3‘-UTR区域并实现抑制其表达的功能。使用JiLin-2004(H5N1)-M2-45-62,JiLin-2004(H5N1)-M2-44-61和JiLin-2004(H5N1)-M2-44-56和293T细胞进行了实验。将浓度为30μM的细胞穿透肽与300nM的PGY-dsRNA-6混合后与细胞温育,并检测细胞中的荧光素酶报告基因。从图49所示的结果可见,JiLin-2004(H5N1)-M2-45-62、JiLin-2004(H5N1)-M2-44-61和JiLin-2004(H5N1)-M2-44-56均可将PGY-dsRNA-6带入细胞并实现其功能,并且携带PGY-dsRNA-6的能力强于阳性对照TAT。其中,JiLin-2004(H5N1)-M2-44-61的细胞穿透肽效果接近转染试剂RNAiMax。
同样,HJT-sRNA-m7能够靶向结合COLLAGEN3A1基因的3‘-UTR区域并实现抑制其表达的功能。使用JiLin-2004(H5N1)-M2-44-61在HEK293T细胞中进行了实验。将浓度为30μM的细胞穿透肽与300nM的HJT-sRNA-m7混合后与细胞温育,并检测细胞中的荧光素酶报告基因。从图66所示的结果可见,JiLin-2004(H5N1)-M2-44-61可将HJT-sRNA-m7带入细胞并实现其功能,并且携带HJT-sRNA-m7的能力强于阳性对照TAT。其中,JiLin-2004(H5N1)-M2-44-61的细胞穿透肽效果接近转染试剂RNAiMax。
PGY-dsRNA-6可以靶向结合RELA基因的3‘-UTR区发挥其抗炎功能,图67和图68显示,LPS诱导的THP-1的炎症模型中,JiLin-2004(H5N1)-M2-44-61携带的PGY-sRNA-6有效的降低THP-1细胞上清液中IL-1β和TNF-α的表达。故JiLin-2004(H5N1)-M2-44-61可携带小RNA进入细胞并发挥其小RNA的功能。
HJT-sRNA-m7可以靶向结合COLLAGEN3A1基因的3‘-UTR区发挥其纤维化的功能,图69显示,TGF-beta1诱导的MRC-5细胞纤维化模型中,JiLin-2004(H5N1)-M2-44-61携带的HJT-sRNA-m7有效的降低MRC-5细胞中Fibronectin的表达。再次证明JiLin-2004(H5N1)-M2-44-61可携带小RNA进入细胞并发挥其小RNA的功能。
实施例11-2:细胞穿透肽携带质粒进入并发挥其表达功能
本发明证实了流感病毒M2来源的细胞穿透肽JiLin-2004(H5N1)-M2-44-61和JiLin-2004(H5N1)-M2-45-62可携带小RNA进入细胞,并发挥其小RNA本身的功能。我们尝试用携带可以在细胞核内表达GFP蛋白的质粒,图70显示,JiLin-2004(H5N1)-M2-44-61和JiLin-2004(H5N1)-M2-45-62均可将NS1-GFP质粒携带至HEK293细胞中,并在细胞核内表达GFP蛋白。而对照TAT组几乎没有GFP荧光蛋白的表达。
实施例12:细胞穿透肽携带蛋白质进入细胞
先前的研究表明,一些细胞穿透肽可以携带蛋白质进入细胞。为了验证本发明的细胞穿透肽的上述特性,使用JiLin-2004(H5N1)-M2-44-56验证其携带β-半乳糖苷酶蛋白进入A549细胞的能力。将50μM的JiLin-2004(H5N1)-M2-44-56多肽与50nM的β-半乳糖苷酶混合30分钟,随后将该混合物与A549细胞温育1小时,并通过β-半乳糖苷酶显色实验检测β-半乳糖苷酶蛋白的细胞进入,其结果如图50所示。该结果表明,本发明的细胞穿透肽能够携带β-半乳糖苷酶蛋白进入细胞,且与相同浓度的阳性对照TAT相比,其携带蛋白质进入细胞的能力显著更强。
此外,使用EGFP蛋白进行了进一步验证。如图51所示,当将3μM的JiLin-2004(H5N1)-M2-44-56多肽与1μM的GFP蛋白混合并与A549细胞温育1小时,观察到JiLin-2004(H5N1)-M2-44-56多肽携带GFP蛋白进入细胞,且其效果强于阳性对照TAT。
实施例13:细胞穿透肽与EGFP的融合蛋白具有细胞穿透肽的功能
进一步使用本发明的细胞穿透肽研究了当其与蛋白质进行融合时该融合蛋白是否仍然具有细胞穿透肽的功能。图52显示了使用不同浓度(10nM、30nM、100nM和300nM)的EGFP-JiLin-2004(H5N1)-M2-45-62融合蛋白以及EGFP-TAT和EGFP-JiLin-2004(H5N1)-M2-71-85作为对照的实验,其中将融合蛋白与A549细胞温育1小时。图53、图54和图55分别显示了使用10nM、30nM以及100nM的EGFP-JiLin-2004(H5N1)-M2-45-62和EGFP-JiLin-2004(H5N1)-M2-44-61融合蛋白的实验结果,其中将融合蛋白与A549细胞温育1小时。
从这些图中的结果可见,EGFP-JiLin-2004(H5N1)-M2-45-62和EGFP-JiLin-2004(H5N1)-M2-44-61融合蛋白在上述浓度下均能进入A549细胞,而EGFP-TAT融合蛋白仅在高浓度(100nM)时才观察到细胞进入。图56、图57和图58显示了相关的激光共聚焦实验结果,其中,图56显示了使用10nM细胞穿透肽的结果,图57显示了使用30nM细胞穿透肽的结果,而图57显示了使用100nM的结果,其与图53至图55的流式细胞术结果一致。上述结果表明,本发明的细胞穿透肽当与其它蛋白质进行融合时,能够保持其细胞穿透肽能力,并使得融合蛋白以高效率进入细胞。
实施例14:细胞穿透肽与EGFP的融合蛋白可直接进入小鼠器官
实施例13证明了EGFP-JiLin-2004(H5N1)-M2-45-62和EGFP-JiLin-2004(H5N1)-M2-44-61融合蛋白仍具有穿透肽功能,并可以高效的进入细胞。图71显示了EGFP-JiLin-2004(H5N1)-M2-44-61在小鼠腹腔注射1小时后均可以进入小鼠脑、肾脏、肝脏和脾脏组织,其进入效果强于同等实验条件下的细胞穿透肽对照TAT。
实施例15:细胞穿透肽可携带小RNA进入小鼠器官
实施例10中,通过激光共聚焦检测和实时定量qPCR方法检测了流感病毒M2蛋白来源的细胞穿透肽和对照细胞穿透肽携带小RNA进入细胞的功能,挑选在细胞实验中携带小RNA能力最强的JiLin-2004(H5N1)-M2-44-61进行小鼠实验验证。图72和图73显示,JiLin-2004(H5N1)-M2-44-61可有效的将小RNA(PGY-sRNA-23和PGY-sRNA-26)递送到小鼠器官中,其中小鼠的心脏、肝脏、脾脏、肺、肾脏、胃、小肠、胸腺在内的8种器官或组织均检测到小RNA的表达。JiLin-2004(H5N1)-M2-44-61在小鼠上递送小RNA的能力明显强于TAT。
实施例16:细胞穿透肽可携带小RNA进入小鼠器官并发挥功能
PGY-dsRNA-6可以靶向结合RELA基因的3‘-UTR区发挥其抗炎功能,在poly(I:C)诱导的小鼠急性肺损伤模型中,如图74显示JiLin-2004(H5N1)-M2-44-61携带的PGY-sRNA-6可以有效的降低小鼠肺泡灌洗液中的IL-6和TNF-α的表达,减轻小鼠急性肺损伤。而细胞穿透肽对照TAT携带的PGY-sRNA-6只可以轻微降低小鼠肺泡灌洗液中IL-6的表达,对TNF-α的表达无降低效果。JiLin-2004(H5N1)-M2-44-61在小鼠器官中携带小RNA的能力强于TAT,且小RNA可以更好的发挥其功能。
实施例17:细胞穿透肽可携带小RNAantagomir进入小鼠器官并发挥功能
已有文献报道,miR1246 antagomir可以有效降低LPS引起的小鼠急性肺损伤,我们通过实验验证JiLin-2004(H5N1)-M2-44-61是否可以携带miR1246 antagomir进入小鼠器官,更好的发挥其抗急性肺损伤的功能。图75显示,JiLin-2004(H5N1)-M2-44-61可以使得miR1246 antagomir更好的进入小鼠肺组织,而对照组TAT几乎对miR1246 antagomir进入肺组织无促进作用。图76所示,LPS刺激小鼠的急性肺损伤模型中,JiLin-2004(H5N1)-M2-44-61携带miR1246antagomir有最好的防止肺损伤的作用。故JiLin-2004(H5N1)-M2-44-61可帮助小RNA antagomir更好的进入小鼠体内,并发挥其作用。
实施例18:细胞穿透肽可携带小分子药物进入小鼠器官并发挥功能
已有文献报道,小分子药物silybin可以有效降低LPS引起的小鼠急性肺损伤,我们通过实验验证JiLin-2004(H5N1)-M2-44-61是否可以携带小分子药物silybin进入小鼠器官并更好的发挥其抗急性肺损伤的功能。图77所示,LPS刺激小鼠的急性肺损伤模型中,JiLin-2004(H5N1)-M2-44-61本身无防止肺损伤的作用,小分子化合物silybin在此剂量下有防止肺损伤的趋势,而JiLin-2004(H5N1)-M2-44-61携带小分子药物silybin有最好的防止肺损伤的作用。故JiLin-2004(H5N1)-M2-44-61可帮助小分子化合物更好的进入小鼠体内,并发挥其作用。
- 垃圾分类激励方法及装置、设备和存储介质
- 垃圾分类激励方法及装置、设备和存储介质
- 垃圾分类激励方法及装置、设备和存储介质
- 垃圾分类激励方法及装置、设备和存储介质
- 一种基于短语评分的广告投放方法、系统以及计算机存储介质
- 一种垃圾分类投放的引导方法、系统、装置及存储介质
- 一种垃圾分类投放的监控方法、系统、装置及存储介质
