红果参精制物及其制备方法、红果参提取物的应用
文献发布时间:2024-04-18 19:52:40
技术领域
本发明涉及一种红果参精制物及其制备方法、红果参提取物的应用。
背景技术
红果参,别名蜘蛛果、山荸荠、肉算盘等,系桔梗科金钱豹属多年生草本植物,学名长叶轮钟草(Campnumoea lancifolia(Roxb.)Merr.),被收录于《贵州草药》、《全国中草药汇编》和《中国植物志》等相关文献中。蜘蛛果茎叶在《浙江药用植物志》中亦有收载。2003年版《贵州省中药材、民族药材质量标准》新增补蜘蛛果品种。红果参俗名“土党参”、“土人参”或“野党参果”等,常被称为“南方人参”,味甘、微苦,性平,具补虚益气、祛痰止痛功效,主要用于气虚乏力、跌打损伤,还可用于治疗肺痨咳嗽、瘰疬、疝气等。其果实普遍作为水果使用,具有滋补、保健等功效。
花色苷作为一种天然色素,其不仅安全、无毒、来源广泛,更为重要的是其具有的生物学价值,广泛存在于植物的花和果实中,能保护植物免受各种生物和非生物胁迫,具有抗氧化、抗癌、延缓衰老等重要的生理活性,可作为天然色素、天然抗氧化剂即营养补充剂,在食品、化妆品和药品行业得到广泛应用。
现代技术文献中仅有红果参中提取多糖、花青素或是其他植物果实如黑枸杞、桑葚、黑加仑或蓝莓中提取花色苷的研究,红果参中提取花色苷的相关文献尚未见报道。
发明内容
本发明解决的技术问题在于克服了现有技术中尚没有红果参中提取花色苷的研发的缺陷,提供了一种红果参精制物及其制备方法、红果参提取物的应用。本发明的红果参精制物的制备方法得到的提取物中花色苷含量高、抗氧化性强,同时具有较强的α-葡萄糖苷酶活性抑制能力,即具有较好的糖尿病治疗活性,并且具有较好的抗炎活性。
本发明采用以下技术方案解决上述技术问题:
本发明提供了一种红果参精制物的制备方法,其包括如下步骤:红果参粗提物经大孔吸附树脂层析,依次用水和乙醇溶液洗脱,收集所述乙醇溶液的洗脱液,即得;所述乙醇溶液的浓度为20~90%,其中百分比为体积百分比。
本发明中,所述红果参粗提物可采用本领域常规的方法制得,一般可为红果参经溶剂提取法或酶解法提取得到。
其中,所述红果参可为本领域常规,较佳地为红果参果,例如可为红果参果鲜品或红果参果冻干品。
所述红果参果鲜品较佳地为红果参果鲜品的浆料。所述浆料一般地可通过将所述红果参果鲜品打浆制得。
所述红果参果冻干品较佳地为红果参果冻干品粉末。所述红果参果冻干品粉末一般地可通过将所述红果参果冻干品粉碎制得。
其中,所述溶剂提取法较佳地可包括如下步骤:将所述红果参在酸性溶液中混合,固液分离,收集所得滤液,即可。
所述溶剂提取法中,所述酸性溶液可为本领域常规,较佳地为酸化水、酸化乙醇溶液或酸化甲醇溶液,更佳地为酸化水或酸化乙醇溶液。
所述酸性溶液中的酸可为本领域常规的无机酸或有机酸,较佳地为盐酸、柠檬酸、醋酸和苹果酸中的一种或多种。
所述酸性溶液的pH值可为本领域常规,较佳地为1~6,例如5。
所述酸性溶液中,所述酸占所述酸性溶液的体积百分比满足上述所述pH值即可,较佳地为0.01~15%,更佳地为0.1~5%,例如1%或1.5%。
所述酸化乙醇溶液中,乙醇的浓度可为本领域常规,较佳地为10~80%,例如40%、50%、60%或65%。
所述溶剂提取法中,所述酸性溶液的用量可为本领域常规,较佳地为20~200mL/g,例如40mL/g、60mL/g、80mL/g或100mL/g,其中mL/g指的是每克所述红果参需要添加的所述酸性溶液的体积。
所述溶剂提取法中,所述混合可采用本领域常规的方法进行,较佳地为恒温振荡或超声混合。
所述溶剂提取法中,所述混合的时间可为本领域常规,较佳地为20~100min,例如30min或60min。
所述溶剂提取法中,所述混合的温度可为本领域常规,较佳地为30~60℃,更佳地为40℃。
其中,所述酶解法可为本领域常规,一般地包括如下步骤:所述红果参在含酶水溶液中进行酶解,得酶解浆料,所述酶解浆料和溶剂混合提取,固液分离,收集滤液,即可。
所述酶解法中,所述含酶水溶液中的酶可为本领域常规,较佳地为纤维素酶、果胶酶和甘露聚糖酶中的一种或多种,更佳地为果胶酶。
所述酶解法中,所述红果参和所述酶的质量比可为本领域常规,较佳地为(1:0.005~0.05),更佳地为1:0.01。
所述酶解法中,所述溶剂可为本领域常规,较佳地为无水乙醇。
所述酶解法中,每克所述酶解浆料所需的所述溶剂体积为8~20mL,例如10mL。
所述酶解法中,所述固液分离可采用本领域常规的方法进行,较佳地为离心。
所述溶剂提取法或所述酶解法所得的滤液较佳地还进行浓缩。
浓缩的目的在于除去溶剂提取法中的酸性溶液或酶解法中的溶剂。
本发明中,所述红果参粗提物在进行所述大孔吸附树脂层析之前,较佳地还包括萃取步骤。
其中,所述萃取的方法可为本领域常规,一般地可为,所述红果参粗提物和萃取溶剂混合,收集萃余相。
所述萃取溶剂可为本领域常规,较佳地为乙酸乙酯。
所述萃取溶剂和所述红果参粗提物的体积比可为本领域常规,较佳地为(0.5~5):1,更佳地为1:1。
本发明的发明人在研究中发现,红果参粗提物在上大孔吸附树脂层析前经过萃取能除去一部分小极性化合物,进而提高红果参精制物中花色苷的含量。
本发明中,所述大孔吸附树脂可为本领域常规,较佳地为D101大孔树脂或AB-8大孔树脂,更佳地为AB-8大孔树脂。
本发明的洗脱过程中,所述水较佳地为酸化水。所述酸化水中酸所占的体积百分数较佳地为0.01~1%,更佳地为0.05~0.5%,例如0.1%。所述酸较佳地如上所述。
本发明水洗脱的目的是除去未吸附在树脂上的大分子的糖类物质等,本领域技术人员一般都可以理解,水洗脱的终点以水洗脱液中大分子的糖类物质的含量作为判断,一般地水洗脱液没有明显浑浊时即可。
本发明的水洗脱过程中,所述水的洗脱体积较佳地为不小于3BV,更佳地为4~10BV,例如5BV或6BV,其中BV为层析柱中固定相体积。
水洗脱过程主要是除去未吸附在树脂上的大分子的糖类物质等。发明人研究中发现,上述水洗脱体积能很好的除去未吸附的杂质等,有效提高提取物中花色苷的含量。
本发明的乙醇洗脱过程中,所述乙醇溶液较佳地为酸化乙醇溶液。所述酸化乙醇溶液中酸所占的体积百分数较佳地为0.01~1%,更佳地为0.05~0.5%,例如0.1%。所述酸较佳地如上所述。
本发明的乙醇洗脱过程中,所述乙醇溶液的浓度较佳地为20~60%,更佳地为30~50%,进一步更佳地为40~50%。
本发明中的洗脱剂的乙醇溶液的浓度是影响红果参精制物中花色苷含量的关键因素,乙醇溶液的浓度过高或过低都会使红果参精制物中杂质含量升高。
本发明的乙醇洗脱过程中,本领域技术人员一般都可以理解,乙醇的洗脱体积达到一定量后吸附在大孔吸附树脂中的有效组分几乎完全被洗脱了出来,再增加乙醇洗脱液的用量不会增加精制物中花色苷的含量。
本发明的乙醇洗脱过程中,所述乙醇溶液的洗脱体积较佳地为不大于15BV,更佳地为5~10BV,进一步更佳地为6~8BV,其中BV为层析柱中固定相体积。
本发明的某些较佳实施例中,所述洗脱过程中,所述乙醇溶液的洗脱体积为6BV、8BV、10BV、11BV或14BV。
本发明的某一较佳实施例中,所述乙醇溶液的洗脱包括依次用20%乙醇溶液、40%乙醇溶液和60%乙醇溶液进行洗脱。
本发明的红果参精制物的制备方法中,所述乙醇溶液的洗脱液较佳地还包括浓缩和干燥步骤。
其中,所述浓缩可采用本领域常规的方法进行,一般地为加热蒸发除去所述乙醇溶液,即可。所述蒸发的设备可为本领域常规,较佳地为旋转蒸发仪。
其中,所述干燥可采用本领域常规的方法进行,较佳地为冷冻干燥。
本发明还提供了一种如上所述的制备方法得到的红果参精制物。
本发明还提供了一种红果参提取物作为抗氧化剂的应用,所述红果参提取物为所述的红果参粗提物或所述的红果参精制物。
本发明还提供了一种红果参提取物在制备治疗糖尿病的药物中的应用,所述红果参提取物为所述的红果参粗提物或所述的红果参精制物。
本发明还提供了一种红果参提取物在制备抗炎药物中的应用,所述红果参提取物为所述红果参粗提物或所述红果参精制物。
本发明还提供了一种红果参花色苷的分离方法,其包括如下步骤:如上所述的红果参精制物利用高效液相色谱法进行分离,得到红果参花色苷单体。
其中,所述高效液相色谱的色谱柱可为本领域常规,较佳地为反相C-18柱。
其中,所述高效液相色谱的流动相可为本领域常规,较佳地为流动相A相为7~15%的甲酸水溶液或7~15%的磷酸水溶液,流动相B相为甲醇和乙腈的混合液,所述甲醇和乙腈的体积比为(1~2):1;更佳地为流动相A相为10%的甲酸,流动相B相为甲醇和乙腈的质量比为3:2的混合液;其中,百分比均为体积百分比。
其中,所述高效液相色谱的洗脱程序较佳地为梯度洗脱程序,所述梯度洗脱程序为0~30min时,所述流动相中A相所占体积比由90%~99%逐渐减少到80~88%;30~35min时,所述流动相中A相所占体积比保持不变,为80~88%;更佳地,0~30min时,所述流动相中A相所占体积比由95%逐渐减少到84%,30~35min时,所述流动相中A相所占体积比为84%。
以上百分比如无特别说明均为体积百分比。
在符合本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
本发明所用试剂和原料均市售可得。
本发明的积极进步效果在于:
(1)本发明的红果参精制物的制备方法简单、易工业化;
(2)本发明的红果参精制物中花色苷含量高,可均高于10%,甚至高达23%;
(3)本发明的红果参精制物和红果参粗提物有很好的抗氧化性能;红果参精制物的DPPH自由基清除能力IC
(4)本发明的红果参精制物和红果参粗提物均有很好的治疗糖尿病的活性,红果参精制物的α-葡萄糖苷酶活性抑制能力显著高于阿卡波糖,与木犀草素基本相当,其IC
(5)本发明的红果参精制物具有很好的抗炎活性,红果参精制物0.2mg/mL的浓度下的TNF-α抑制率为24.60%,IL-6抑制率为13.48%。
附图说明
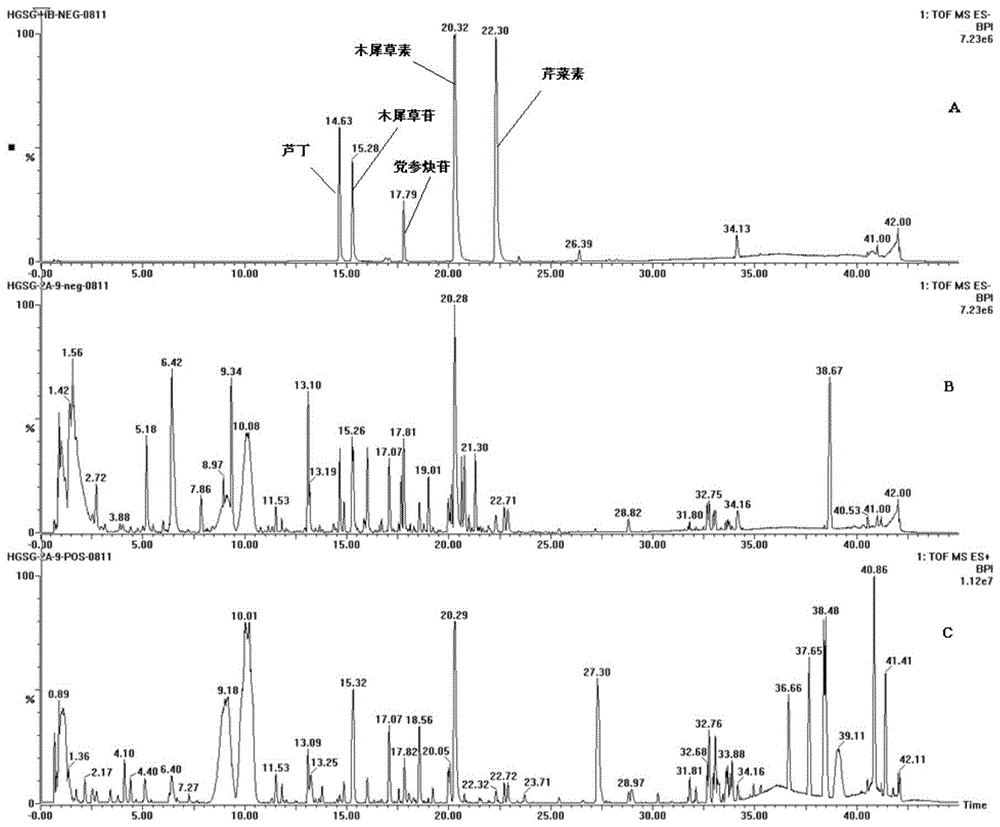
图1为实施例8红果参粗提物基峰色谱图。
具体实施方式
下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
5批红果参鲜果,批号分别记为1-A-7、2-A-9、3-B-11、4-A-12和5-B-5,采摘时间2021年3月8日,贵州创兴农业发展有限责任公司;
红果参果冻干粉为上述红果参鲜果经冻干得到;
蓝莓为盒马超市市售可得;
矢车菊素-3-O-葡萄糖苷,批号ST04290120MG,HPLC测得纯度≥98.0%,上海诗丹德技术有限公司;
水溶性维生素E(Trolox),批号DST201202-049,纯度>98.0%、氯化飞燕草素-3-O-芸香糖苷,批号DSTDL024401,HPLC≥95%、氯化飞燕草素-3-O-葡萄糖苷,批号DSTDL014502,HPLC≥98%、氯化矢车菊素-3-O-芸香糖苷,批号DSTDL019401,HPLC≥98%,均购自成都德思特生物技术有限公司;
1,1-二苯基-2-苦肼基自由基(DPPH),纯度≥97.0%,梯希爱(上海)化成工业发展有限公司;
2,2’-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(Diammonium2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonate2,2,-azino-bis(3-ethylbenzothiazoline-6-sulfonicacid,ABTS)自由基,批号SLCH3887,纯度≥98.0%,西格玛奥德里奇(上海)贸易有限公司;
T-AOC试剂盒(FRAP法)微板法96T,批号20210224,96T,购自南京建成生物工程研究所;
对硝基苯-α-D-葡萄糖苷(p-nitrophenyl-α-D-glucopyranoside,pNPG),批号C12462390,纯度99%,上海麦克林生化科技有限公司;
α-葡萄糖苷,批号SLBT8587,酶活力18.5U/mg(G5003-100UN),美国Sigma公司;
阿卡波糖水合物,批号G1718046,纯度≥98%,阿拉丁试剂(上海)有限公司;
党参炔苷、木犀草素-7-O-葡萄糖苷、芦丁、木犀草素和芹菜素均为实验室自制对照品;乙腈为质谱级;其他试剂为分析纯。
实施例1
S1:制备红果参粗提物
称取红果参果冻干粉于具塞锥形瓶中,按照料液比1∶60(每克红果参果冻干粉配60mL盐酸乙醇溶液)加入盐酸乙醇溶液,盐酸乙醇溶液中盐酸的体积分数为0.1%,乙醇的浓度为80%;密塞,恒温振荡,温度40℃,提取30min,过滤,滤液转入旋转蒸发仪浓缩除去乙醇,得到红果参粗提物,以上百分比均为体积百分比。
S2:制备红果参精制物
S1所得粗提物中加入乙酸乙酯(V/V=1:1)进行萃取,萃取三次,合并萃余相,低温旋转蒸发去除乙酸乙酯,得到浓缩溶液,上D101大孔树脂,先用酸化水溶液(含0.1%(V/V)的HCl)洗脱,洗脱体积为4BV,弃去水洗脱液;再用20%乙醇溶液(含0.1%(V/V)的HCl)洗脱,洗脱体积为5BV;然后再用40%乙醇溶液(含0.1%(V/V)的HCl)洗脱,洗脱体积为6BV;再用60%乙醇溶液(含0.1%(V/V)HCL)洗脱,洗脱体积为3BV,最后用90%乙醇洗脱,洗脱体积为2BV,分别收集各洗脱液,浓缩后冷冻干燥,得到红果参精制物,以上百分比均为体积百分比。
得到的HPLC分析结果如表1。从表1可以看出,20%和40%乙醇洗脱部位的花色苷总含量均超过20%,达到较高的浓度。60%乙醇洗脱液中花色苷含量降至很低,说明20%乙醇和40%乙醇已经将大部分的花色苷都洗脱出来,并且60%乙醇洗脱液的浸膏得率为0.60%,其中浸膏得率指的是60%乙醇洗脱部位浓缩、冷冻后的质量占20%、40%和60%乙醇洗脱部位浓缩干燥后的质量和的比例。90%乙醇洗脱部位中几乎没有花色苷。
表1实施例1不同洗脱部位HPLC分析测试结果
实施例2
S1:制备红果参粗提物
称取红果参果冻干粉于具塞锥形瓶中,按照料液比1∶40(g/mL)加入盐酸乙醇溶液,盐酸乙醇溶液中盐酸的体积分数为0.1%,乙醇的浓度为40%;密塞,恒温搅拌,温度40℃,提取30min,过滤,滤液转入旋转蒸发仪浓缩除去乙醇,得到红果参粗提物,以上百分比均为体积百分比。
S2:制备红果参精制物
S1所得粗提物浓缩后经乙酸乙酯(V/V=1:1)进行萃取,萃取三次,合并萃余相,低温旋转蒸发去除乙酸乙酯,得到浓缩溶液,上AB-8大孔树脂层析柱,先用酸化水溶液(含0.1%(V/V)的HCl)洗脱,水洗脱体积为5BV,弃去水洗脱液;水洗脱后用50%乙醇溶液(含0.1%(V/V)的HCl)洗脱,洗脱体积为8BV,收集洗脱液,浓缩后冷冻干燥,得到红果参精制物,以上百分比均为体积百分比。
本实施例的红果参精制物HPLC分析结果如表2所示。本实施例得到的红果参精制物中花色苷总含量较高,达到23.73%。
对本实施例的红果参精制物进行体外抗氧化实验,其DPPH自由基、ABTS+·和·OH清除能力与VC、VE的比较结果见表3,其中,IC
对本实施例的红果参精制物测定抑制α-糖苷酶活性,测得其α-糖苷酶半数抑制质量浓度(IC
对本实施例的红果参果精制物的体外抗炎作用进行研究。实验采用ELISA法检测肿瘤坏死因子(TNF)-α、白细胞介素(IL)-6分泌,红果参果精制物在0.2mg/mL的浓度下的TNF-α抑制率为24.60%,IL-6抑制率为13.48%。说明红果参精制物具有很好的抗炎活性。
表2实施例2红果参精制物HPLC分析结果
表3实施例2红果参精制物和VC、VE体外抗氧化实验结果
实施例3
S1:制备红果参粗提物
S1与实施例1相同。
S2:制备红果参精制物
水洗脱后用90%乙醇溶液(含0.1%(V/V)的HCl)洗脱,洗脱体积为4BV,其他均与实施例1的S1相同,得到红果参精制物,以上百分比均为体积百分比。
本实施例的红果参精制物的HPLC分析结果如表3所示。从表3可以看出,90%乙醇洗脱较20%、40%、50%等浓度的乙醇洗脱得到的精制物中花色苷总含量较低。
表3实施例3红果参精制物HPLC分析结果
实施例4
S1:制备红果参粗提物
称取红果参果冻干粉于具塞锥形瓶中,按照料液比1∶60(每克红果参果冻干粉配60mL盐酸乙醇溶液)加入盐酸乙醇溶液,盐酸乙醇溶液中盐酸的体积分数为0.1%,乙醇的浓度为50%;密塞,恒温振荡,温度40℃,提取30min,过滤,滤液转入旋转蒸发仪浓缩除去乙醇,得到红果参粗提物,以上百分比均为体积百分比。
S2:制备红果参精制物
S1所得粗提物不经萃取直接上D101大孔树脂,先用酸化水溶液(含0.1%(V/V)的HCl)洗脱,洗脱体积为6BV,弃去水洗脱液;再用40%乙醇溶液(含0.1%(V/V)的HCl)洗脱,洗脱体积为10BV,收集洗脱液,浓缩后冷冻干燥,得到红果参精制物,以上百分比均为体积百分比。
对本实施例所得的红果参精制物进行HPLC分析,结果如表5所示。从表5可以看出,本实施例不经乙酸乙酯萃取,精制物中花色苷含量较其他实施例相对较低,花色苷总含量可达到12.04%。
对本实施例的红果参果精制物、木犀草素和阿卡波糖进行体外抗α-糖苷酶的活性实验,结果如表6,其中,IC
表5实施例4红果参果精制物HPLC分析结果
表6实施例4红果参精制物抗α-糖苷酶的活性实验结果
实施例5
S1:制备红果参粗提物
称取红果参果冻干粉于具塞锥形瓶中,按照料液比1∶20(每克红果参果冻干粉配20mL盐酸乙醇溶液)加入盐酸乙醇溶液,盐酸乙醇溶液中盐酸的体积分数为0.1%,乙醇的浓度为40%;密塞,恒温振荡,温度40℃,提取20min,过滤,滤液转入旋转蒸发仪浓缩除去乙醇,得到红果参粗提物,以上百分比均为体积百分比。
S2:制备红果参精制物
S1所得粗提物不经萃取直接上D101大孔树脂层析柱,先用酸化水溶液(含0.1%(V/V)的HCl)洗脱,洗脱体积为6BV,弃去水洗脱液;再用60%乙醇溶液(含0.1%(V/V)的HCl)洗脱,洗脱体积为8BV,收集洗脱液,浓缩后冷冻干燥,得到红果参精制物,以上百分比均为体积百分比。
本实施例的红果参精制物的HPLC分析结果见表7。从表7可以看出,本实施例得到的红果参精制物中花色苷总含量为16.01%,达到较高水平,但较经乙酸乙酯萃取过程的实施例,花色苷总含量稍有降低。
表7实施例5红果参精制物HPLC分析结果
实施例6
根据实施例1的S1步骤,将5批红果参果得到的红果参果冻干粉进行粗提,得到红果参粗提物,分别记为1-A-7粗提物、2-A-9粗提物、3-B-11粗提物、4-A-12粗提物和5-B-5粗提物。
将实施例1的S1步骤中的红果参果冻干粉替换为蓝莓冻干粉,其他步骤均与实施例1的S1相同,得到蓝莓粗提物。
对红果参粗提物和蓝莓粗提物进行铁离子还原能力测定,结果如表8所示。从表8可以看出,红果参粗提物和蓝莓粗提物的铁离子还原能力,即总抗氧化能力基本相当。
表8实施例6红果参粗提物和蓝莓粗提物铁离子还原能力测试结果
实施例7
称取红果参果鲜品匀浆后置于具塞锥形瓶中,按照料液比1∶100(每克红果参果冻干粉配100mL盐酸乙醇溶液)加入柠檬酸乙醇溶液,柠檬酸乙醇溶液中柠檬酸的体积百分数为1.5%,乙醇的浓度为60%,密塞,恒温振荡,温度40℃,提取50min,过滤,滤液转入旋转蒸发仪浓缩除去乙醇,浓缩后冷冻干燥制得红果参粗提物,以上百分比均为体积百分比。
实施例1的S2中酸化水溶液洗脱后直接用40%乙醇溶液洗脱(含0.1%(V/V)HCL),洗脱体积为6BV,收集洗脱液,浓缩后冷冻干燥,其他步骤与参数均与实施例1相同,得到红果参精制物,以上百分比均为体积百分比。
对本实施例的红果参粗提物和红果参精制物进行抑制α-糖苷酶的活性实验,结果如表9所示。从表9可以看出,红果参粗提物和红果参精制物都具有很高的抑制α-糖苷酶活性,即具有很好的治疗糖尿病活性。其中,红果参精制物较红果参粗提物的抑制α-糖苷酶活性更高。红果参粗提物的浓度为2.797μg/mL时,α-糖苷酶活性抑制率达到67.46%;本实施例的红果参精制物浓度为1.398μg/mL时,α-糖苷酶活性抑制率达到58.61%。本实施例的红果参粗提物的抑制α-糖苷酶的活性较实施例2和实施例3的红果参精制物的抑制α-糖苷酶的活性要高,这可能和精制过程中去除的成分也具有抑制α-糖苷酶的活性有关。
表9实施例7红果参粗提物和精制物抑制α-糖苷酶活性结果
实施例8
分别称取批号为1-A-7、2-A-9、3-B-11、4-A-12和5-B-5的5批红果参鲜果的冻干粉置于5个具塞锥形瓶中,均按照料液比1∶80(每克红果参果冻干粉配100mL盐酸乙醇溶液)加入柠檬酸乙醇溶液,柠檬酸乙醇溶液中柠檬酸的体积百分数为1%,乙醇浓度为60%,密塞,恒温振荡,温度40℃,提取30min,过滤,滤液转入旋转蒸发仪浓缩除去乙醇,浓缩后冷冻干燥制备得到5个批号的红果参粗提物,分别记为1-A-7粗提物、2-A-9粗提物、3-B-11粗提物、4-A-12粗提物和5-B-5粗提物,以上百分比均为体积百分比。
取上述5个批号的红果参粗提物和实施例6得到的蓝莓粗提物分别进行DPPH自由基清除能力实验,结果如表10。从表10可以看出,红果参粗提物的DPPH自由基清除能力和蓝莓粗提物基本相当。
表10红果参粗提物和蓝莓粗提物的DPPH自由基清除能力
实施例9
分别称取批号为1-A-7、2-A-9、3-B-11、4-A-12和5-B-5的5批红果参鲜果的冻干粉置于5个具塞锥形瓶中,均按照料液比1∶100(每克红果参果冻干粉配100mL盐酸乙醇溶液)加入柠檬酸乙醇溶液,柠檬酸乙醇溶液中柠檬酸的体积百分数为1.5%,乙醇的浓度为60%,密塞,恒温振荡,温度40℃,提取50min,过滤,滤液转入旋转蒸发仪浓缩除去乙醇,浓缩后冷冻干燥制得5个批号的红果参粗提物,分别记为1-A-7粗提物、2-A-9粗提物、3-B-11粗提物、4-A-12粗提物和5-B-5粗提物,以上百分比均为体积百分比。
取上述5个批号的红果参粗提物和实施例6得到的蓝莓粗提物进行ABTS
表11红果参粗提物和蓝莓粗提物的ABTS
实施例10
分别称取批号为1-A-7、2-A-9、3-B-11、4-A-12和5-B-5的5批红果参鲜果的冻干粉置于5个具塞锥形瓶中,均按照料液比1∶20(每g红果参果冻干粉配20mL盐酸乙醇溶液)加入盐酸乙醇溶液,盐酸乙醇溶液中盐酸的体积百分比为0.5%,乙醇的浓度为65%,密塞,恒温振荡,温度40℃,提取40min,过滤,滤液转入旋转蒸发仪浓缩除去乙醇,浓缩后冷冻干燥,制得5个批号的红果参粗提物,分别记为1-A-7粗提物、2-A-9粗提物、3-B-11粗提物、4-A-12粗提物和5-B-5粗提物,以上百分比均为体积百分比。
取上述5个批号的红果参粗提物和实施例6得到的蓝莓粗提物进行·OH清除能力实验,结果如表12所示。从表12可以看出,红果参粗提物比蓝莓粗提物具有更好的·OH清除能力。
表12红果参粗提物和蓝莓粗提物的·OH清除能力比较
实施例11
称取红果参果冻干粉6份分别加入到锥形瓶中,按照料液比1∶100(每g红果参果冻干粉配100mL盐酸乙醇溶液)分别加入如表12所示的提取溶剂,密塞,恒温振荡或者超声提取,提取温度40℃,提取时间60min,离心,取上清液1mL按pH示差法分析提取液中的总花色苷含量,结果见表12。
称取红果参果冻干粉3份,每份0.25g,分别加入到3个锥形瓶中,并分别加入3mg纤维素酶、3mg果胶酶和3mg甘露聚糖酶,再各自加入5mL去离子水,40℃先酶解30min,后按照料液比1∶10(每g红果参果冻干粉配10mL盐酸乙醇溶液)各自加入无水乙醇,密塞,恒温振荡30min,离心,取上清液1mL按pH示差法分析提取液中的总花色苷含量,结果见表13。
从表13可以看出,不同粗提方法得到的红果参粗提物中花色苷总含量相差不大。
表13不同粗提方法所得粗提物中花色苷含量结果
上述没有具体列出红果参果鲜果批号的实施例,所用均为批号为2-A-9的红果参果鲜果。
效果实施例
1、高效液相色谱分离花色苷的方法
分离条件如下:
高效液相色谱型号:Waters e2695 HPLC仪;
检测器:2998PDA Detector;
色谱柱:Agilent ZORBAX SB-C18,色谱柱内径为4.5mm,长度为250mm;填料颗粒直径为5μm;
流动相A相:体积百分比为10%的甲酸水溶液;流动相B相:乙腈;流动相C相:甲醇;
流动相流速:1.0mL/min;
检测波长:520nm;检测温度:30℃;
理论塔板数按矢车菊素-3-O-葡萄糖苷计算应不低于2000;
梯度条件如表14所示:
表14高效液相色谱梯度条件
2、DPPH自由基、ABTS+·和·OH清除能力实验方法如下:
DPPH自由基清除测试:
采用乙醇溶液作为溶剂,配制浓度为0.1mmol/L的DPPH自由基溶液,避光保存。用甲醇配置Trolox标准应用液,再用甲醇分别稀释成2.5μg/mL、5μg/mL、7.5μg/mL、10μg/mL和12.5μg/mL的系列标准品溶液,将对照品溶液100μL与DPPH自由基溶液100μL混合,充分振荡,室温避光孵育30min,于波长517nm处测定吸光度,绘制DPPH自由基清除率标准曲线。将不同提取物质量浓度的溶液100μL与DPPH自由基溶液100μL混合,同法测定,按照下述公式计算DPPH自由基清除率,并通过SPSS18.0软件计算提取物清除DPPH自由基半数抑制浓度(IC
DPPH自由基清除率/%={1-(A1-A2)/A0}*100
式中:A1表示实验组吸光度;A2表示背景吸光度;A0表示空白对照组吸光度。
ABTS
配制7.00mmol/L的ABTS水溶液和2.45mmol/L过硫酸钾于室温暗处避光孵育15~18h,制得ABTS基准液。取适量ABTS基准液,用蒸馏水稀释100倍,至A734nm为0.200±0.005,制得工作液。将不同质量浓度的花色苷溶液50μL与ABTS工作液200μL混合,充分振荡,室温避光孵育30min,于波长734nm处测定吸光度。以Trolox作为阳性对照,按照下述公式计算ABTS
ABTS+·清除率/%={1-(A1-A2)/A0}*100
式中:A1表示实验组吸光度;A2表示背景吸光度;A0表示空白对照组吸光度。
羟自由基(·OH)清除能力测试:
在反应体系中依次加入50μL的9mmol/L的FeSO
·OH清除率/%={1-(A1-A2)/A0}*100
式中:A1表示实验组吸光度;A2表示背景吸光度;A0表示空白对照组吸光度。
3、抗α-糖苷酶的活性实验方法
依次向96孔板中加入样品溶液10μL和0.2U/mL的α-葡萄糖苷酶溶液60μL,于37℃摇床中孵育10min,再加入2.0mmo/L的pNPG溶液80μL,继续37℃摇床中孵育20min后立即用0.2mol/L的Na
4、铁离子还原能力实验方法
T-AOC试剂盒(FRAP法)微板法-铁离子还原能力测定:
T-AOC测定原理为在酸性条件下抗氧化物质可以还原Fe
5、抗炎活性实验方法
采用脂多糖诱导巨噬细胞RAW264.7炎症模型,通过ELISA法测定红果参提取物对细胞炎症的作用。
6、红果参粗提物化学成分分析
采用UPLC-QTOF-MS对实施例8所得的红果参粗提物进行化学成分分析,具体方法如下:
供试品溶液制备:取红果参粗提物适量,精密称定,置入25mL锥形瓶中,加入含1%甲酸的甲醇溶液10mL,超声30min,备用。
对照品溶液配制:取党参炔苷、木犀草苷、芦丁、木犀草素和芹菜素的对照品适量,用甲醇配制成混标溶液,备用。
UPLC条件:Waters ACQUITY I-class UPLC超高效液相色谱仪;Waters ACQUITYUPLC HSS T3色谱柱(2.1×100mm,1.8μm);流动相系统:0.1%甲酸水(A):乙腈(B);流速:0.30mL/min;洗脱程序:0~1min,98%A;1~15min,98%A~80%A;15~20min,80%A~69%A;20min~28min,69%A~58%A;28min~35min,58%A~20%A;35min~38min,20%A;38min~41min,20%A~0%A;柱温:35℃;进样量:1.0μL。
MS条件:Waters Xevo G2-XS QTOF质谱仪,离子源为电喷雾离子源(Electrosprayionization,ESI);正、负离子扫描模式,飞行时间质量分析器;源电压:2.5kV(-),3.0kv(+);碰撞气体为氮气,N
采用反向色谱法进行色谱分离,基峰色谱图见图1,化学成分的结构鉴定结果见表15。由表15可以看出,红果参粗提物中除了花色苷,还有有机碱、有机酸、酚酸、黄酮、聚炔等结构类型化合物。
表15红果参粗提物化学成分分析表
/>
/>
/>
/>
