一种用于治疗炎症性肠病的口服多糖及其制备方法
文献发布时间:2024-04-18 19:52:40
技术领域
本发明涉及一种精制肝素类多糖的制备方法,以及其用于预防和/或治疗炎症性肠病的用途。
背景技术
炎症性肠病(Inflammatory Bowel Disease,IBD)是一组病因复杂、无法治愈的慢性肠道炎症疾病,包括溃疡性结肠炎(Ulcerative Colitis,UC)和克罗恩病(Crohn′sdisease,CD)。据报道,在西方国家IBD患病率最高达到0.8%,在亚洲地区IBD的发病率和患病率均呈持续增长趋势并且增速迅猛,成为全球广泛关注的疾病。预计在未来十年内很多国家的患病率增长幅度将超过40%。因而针对IBD的研究和治疗愈发重要。但目前针对IBD的病理研究和临床治疗手段存在极大的瓶颈。以UC为例,在研究领域,主流观点认为“免疫、遗传、环境、肠道菌群”四大因素是影响UC发病的重要因素,但其具体的发病机制仍不清晰,尚没有统一的结论。
而在临床上,针对IBD病人的成熟治疗手段十分有限,主要分为药物疗法、手术治疗等方法。药物疗法主要采用的药物包括:氨基水杨酸类制剂、皮质类固醇、免疫抑制剂、生物制剂等。但上述药物多为广谱类用药,其主要缺陷包括:副作用明显、易产生药物耐受、治疗有效率低等问题。因而,临床IBD用药具有很大的局限性,缺乏特效治疗药物,亟待新型药物和治疗手段的出现。
肝素是一类分子量在3000~30000Da的糖胺聚糖,具有高度的非均一性和复杂性,目前在临床上的唯一用途为其抗凝血功能。虽然目前研究表明,肝素是一种多靶点药物,在体内能与上百种蛋白如细胞生长因子、趋化因子、黏附分子等发生相互作用,因此具有多种多样的生物学功效,并不同程度影响人体生理功能,如调节炎症反应、抗肿瘤转移、抗病毒感染、抑制平滑肌细胞增殖等。这些功能常常被认为是独立于抗凝血活性之外的。但其在临床上未得到应用。
目前,也有一些临床前研究以及临床试验报道肝素类药物具有一定的IBD治疗潜力,但遗憾的是,不同类型的肝素类药物对IBD的治疗效果差异很大,而临床前研究以及临床实验中往往出现疗效结论不一等问题,同时值得注意的是,皮下注射给药形式的肝素类药物治疗IBD往往无效。上述问题的原因在于:一方面,目前商业化的肝素类药物在临床实际应用时全部面向于抗凝血相关的适应症,因而在开发过程中只关注了其抗凝血功能,肝素分子的其他非抗凝活性在以抗凝功能为主导的药物生产过程中被忽视,所对应的有效结构可能遭到了破坏。而肝素类药物的临床用量受到严格监控,发挥其非抗凝活性的药物用量或诱发大出血风险;另一方面,肝素类药物高度复杂的分子结构与未知的构效关系,及其治疗IBD活性功能多糖片段尚不明晰等问题,限制了其用于治疗IBD以及其他相关病症的临床应用方向。
大量研究表明,肝素的非抗凝生物学活性与其分子量大小密切相关,然而肝素的高度非均一性和结构复杂性极大地限制了其非抗凝生物学活性的发掘。在非均一性层面,肝素是一类高度非均一性的线性多糖,分子量在3000~30000Da不等,不属于纯物质,分子组成极度复杂。而在结构复杂性层面,肝素拥有丰富的磺酸基团和乙酰基团修饰,其修饰过程不受中心法则控制,具有高度的随机性,这也使肝素的精细结构复杂度呈指数型增加。由于肝素的这种复杂分子结构特性,其完整糖链分子结构解析至今未能实现。因而,对肝素类多糖进行分离精制对明确肝素类多糖非抗凝生物学活性的作用机制和药物构效关系具有重要意义。
针对肝素类多糖的制备分离,目前大多研究聚焦在肝素的抗凝和非抗凝活性的分离上,这种分离方法尚不能区分不同分子量大小的多糖,现有技术中尚无针对肝素分子量的精细分离制备工艺。虽然现有文献报导使用凝胶排阻色谱技术对肝素分子量进行定量分析,但上述方法仅停留在分析层面,存在多糖分析量少,用于多糖精细分离与提纯的工艺未知,无法直接实现工艺放大等缺陷,因而尚不能实现不同分子量大小的肝素类多糖的可控分离与大量制备。故目前研究领域尚不存在针对肝素类多糖分子量大小进行精细分离制备的工艺和报导。
而针对肝素类药物的抗IBD活性缺乏系统性构效关系研究,其治疗IBD活性功能多糖片段尚不明晰,而在现有研究中也常忽视了抗凝肝素的制备工艺对其抗IBD活性和对应精细结构的破坏等问题,上述问题在本领域函待解决。
发明内容
本申请的目的是要提供一种治疗炎症性肠病的新型口服药物,通过对肝素类多糖的精细分离,使其具有显著的预防和/或治疗炎症性肠病的作用。本申请同时也提供了一种多糖药物的精细分离与制备方法。
炎症性肠病作为一种病因与发病机制极度复杂的慢性非特异性肠道炎性疾病,易反复发作,具有较高的癌变风险,目前尚无法治愈。临床上针对该疾病的治疗手段十分有限,现有药物主要以广谱抗炎为主,治疗效果差强人意,且普遍存在治疗特异性差、副作用强、易产生药物耐受等缺点。因而,亟需研发针对炎症性肠病的新型特效治疗药物。
肝素是一种多靶点药物,在体内能与上百种蛋白如细胞生长因子、趋化因子、黏附分子等发生相互作用,从而具有除抗凝血以外多种多样的非抗凝生物学活性。也有一些文献报导了肝素治疗IBD的潜在功效,但目前存在肝素治疗结论不一致、疗效差异巨大、抗IBD的肝素有效分子结构特征、药物构效关系以及构效解析技术与方法极度缺乏,上述研究与技术瓶颈极大地限制了肝素类多糖治疗IBD生物活性的挖掘。因此,建立高效的肝素类多糖的精细结构制备方法,深入探索其构效关系,挖掘抗IBD等最适的肝素类寡糖结构,是开发肝素类多糖非抗凝新药的研究重点。
肝素类多糖普遍具有分子结构高度复杂、功能多样等特点。在肝素类多糖的制备上,尽管目前存在一些简单的分离手段(如:采用超滤膜按照分子量进行分离),但其分离精度以及分离量有限,对肝素类多糖药物进行更进一步的精细分离制备仍然存在一定的难度。虽然目前采用凝胶排阻色谱等手段可以实现肝素类多糖的分子量定量分析,但其不能满足精细制备的要求,即:没有实现肝素类多糖的提纯、没有实现肝素类多糖的大量制备(mg~g级别)。
本申请的发明人致力于肝素产业技术的创新研究,构建出了一套针对肝素类多糖的精制工艺流程,能够实现对肝素类多糖进行分子量大小可控的制备分离,克服了肝素类多糖结构非均一性高的问题,对其抗炎、抗肿瘤、抗脂肪堆积等非抗凝生物学活性的有效挖掘以及用于治疗炎症性肠病的应用提供了新技术、新方法以及新产品。
具体来说,本发明涉及以下内容:
1.一种精制肝素类多糖的制备方法,其包括:
对原料肝素进行去抗凝处理和酶解以获得肝素类多糖原料;
采用凝胶排阻色谱柱对所述肝素类多糖原料进行分离并收集分离得到的组分;
将所收集的分离后的各组分进行冻干处理;
将各组分的冻干产物通过醇沉进行脱盐处理,得到精制肝素类多糖。
2.根据项1所述的制备方法,其中,
对原料肝素进行去抗凝处理是利用高碘酸氧化法对所述原料肝素进行去抗凝处理以得到去抗凝处理的产物,以及
对去抗凝处理的产物进行酶解是利用肝素酶I对经去抗凝处理的产物进行酶解以获得所述肝素类多糖原料。
3.根据项1或2所述的制备方法,其中,
进行冻干处理是将所收集的分离后的各组分在-80℃条件下进行预冻后,放入冻干机进行冻干处理。
4.根据项1~3中任一项所述的制备方法,其中,
采用凝胶排阻色谱柱对所述肝素类多糖原料进行分离时,所述凝胶排阻色谱柱为尺寸凝胶排阻色谱柱,优选为HiPrep 16/60Sephacryl或TSKgel G2000SW色谱柱,使用的流动相为0.15~1.0M的NaCl水溶液,优选为0.15~0.6M,更优选为0.2M。
5.根据项4所述的制备方法,其中,
所述凝胶排阻色谱柱中流动相的流速为0.1~1.0mL/min,优选为0.3~0.7mL/min,更优选为0.5mL/min。
6.根据项4所述的制备方法,其中,
所述NaCl水溶液的pH值为3~10,优选pH值为5。
7.根据项4所述的制备方法,其中,
所述凝胶排阻色谱柱为HiPrep 16/60Sephacryl色谱柱,色谱柱填料为SephacrylS-100High Resolution、Sephacryl S-200High Resolution或Sephacryl S-300HighResolution。
8.根据项4所述的制备方法,其中,
所述凝胶排阻色谱柱为TSKgel G2000SW色谱柱,色谱柱填料为TSKgel G2000。
9.根据项1~8中任一项所述的制备方法,其中,将各组分的冻干产物通过醇沉进行脱盐处理时,
在各组分的冻干产物加入蒸馏水重悬浓缩;
加入乙醇水溶液后静置醇沉;
将醇沉后的沉淀产物离心后弃去上清;以及
随后加入蒸馏水重悬后得到所述精制肝素类多糖。
10.根据项9所述的制备方法,其中,
在各组分冻干产物中加入其体积20~50%的蒸馏水进行重悬浓缩,优选为30%。
11.根据项10所述的制备方法,其中,
加入所述乙醇水溶液的体积为重悬浓缩后液体体积的2~6倍,优选为5~6倍;以及,
所述乙醇水溶液的浓度为75%~100%。
12.根据项9所述的制备方法,其中,
所述静置醇沉的时间为5~60min,优选为10~30min。
13.根据项1~12所述的制备方法,其还包括,
对通过浓缩醇沉进行脱盐处理后得到所述精制肝素类多糖再进行冻干处理。
14.一种寡糖,其特征在于,所述寡糖具有如下所示的结构:
[a]-[b,c,d,e,f,g]-[h],其中,
a为所述寡糖分子中糖环开环结构的数量;
b为所述寡糖分子中不饱和糖醛酸的数量;
c为所述寡糖分子中饱和糖醛酸的数量;
d为所述寡糖分子中葡糖胺的数量,且1≤d≤10;
e为所述寡糖分子中乙酰基团的数量;
f为所述寡糖分子中磺酸基团的数量,且f≥2.5d,
g为所述寡糖分子中1,6-脱水结构的数量,
h为所述寡糖分子在质谱检测中携带的铵根离子数量。
15.根据项14所述的寡糖,其特征在于,所述寡糖的结构式中,
a≤0.3d,b=1,c=d-1,e≤1.0,g=0。
16.根据项14所述的寡糖,其特征在于,所述寡糖具有如下结构中的一种:[0]-[1,2,3,0,9,0]-[0],[0]-[1,2,3,0,8,0]-[0],[0]-[1,3,4,0,12,0]-[0],[2]-[1,3,4,1,10,0]-[1],[0]-[1,4,5,0,15,0]-[5],[1]-[1,4,5,0,14,0]-[1],[1]-[1,4,5,0,13,0]-[0],[2]-[1,4,5,1,13,0]-[4],[2]-[1,4,5,1,11,0]-[0],[0]-[1,5,6,0,18,0]-[6],[2]-[1,5,6,1,16,0]-[5],[2]-[1,5,6,1,15,0]-[3],[2]-[1,5,6,1,14,0]-[3]或[1]-[1,5,6,0,15,0]-[3]。
17.一种寡糖,其特征在于,
所述寡糖的糖链长度在2~20糖之间,基本二糖单元由[0]-[1,0,1,0,3,0]-[0]和/或[0]-[1,0,1,0,2,0]-[0]重复排列组合构成,其中,
[0]-[1,0,1,0,3,0]-[0]为糖环开环结构数量为0、不饱和糖醛酸数量为1、饱和糖醛酸数量为0、葡糖胺数量为1、乙酰基团数量为0、磺酸基团数量为3、脱水结构数量为0、在质谱检测中携带的铵根离子数量为0的二糖结构片段,
[0]-[1,0,1,0,2,0]-[0]为糖环开环结构数量为0、不饱和糖醛酸数量为1、饱和糖醛酸数量为0、葡糖胺数量为1、乙酰基团数量为0、磺酸基团数量为2、脱水结构数量为0、在质谱检测中携带的铵根离子数量为0的二糖结构片段。
18.根据项17所述的寡糖,其特征在于,所述基本二糖单元中含有的磺酸基团的平均数量大于等于2.5。
19.根据项17或18任一项所述的寡糖,其特征在于,所述基本二糖单元中糖环开环结构的平均数量小于等于0.3。
20.一种含有如项14~19所述的寡糖的肝素衍生物,其特征在于,在所述肝素衍生物中,如项14~19所述的寡糖的含量在17%以上,优选在18%以上,优选在19%以上,优选在20%以上,优选在21%以上,优选在22%以上,优选在23%以上。
21.如项14~19所述的寡糖及如项20所述的肝素衍生物在制备预防或治疗炎症性肠病,以及炎症性肠病相关并发症及发病机理相似的疾病的药物中的用途。
22.根据项21所述的用途,其中,炎症性肠病相关并发症及发病机理相似的疾病包括:肠易激综合征、关节炎和其他肠外并发症包括强直性脊柱炎、坏疽性脓皮病、结节性红斑、虹膜炎、葡萄膜炎、巩膜外层炎、原发性硬化性胆管炎和类风湿关节炎。
23.如项21或22任一项所述的用途,其中,所述寡糖是利用项1~13中任一项所述的方法制备得到的。
发明效果
采用本申请提供的精制肝素类多糖的制备方法,实现了对肝素类多糖的去抗凝修饰以及分子量可控的精细制备分离,可以得到具有分子量分布较为集中的无抗凝活性的各精制多糖组分,去除了肝素类多糖可诱发大出血的潜在用药风险并显著优化了肝素类多糖结构非均一性大的特点。通过体内外药物筛选与药效评价验证,获得了可显著缓解IBD主要临床症型UC的特征性临床疾病症状,且疗效最佳的精制多糖组分,其治疗效果优于UC临床一线用药。进一步通过寡糖结构分析,在疗效最佳的精制多糖组分中解析出发挥UC治疗主要生物学活性的寡糖片段,这为进一步研究其在治疗炎症性肠病的药物中的应用以及研发抗UC多糖新药提供了有利的数据支撑,也对研究肝素类多糖抗炎、抗肿瘤、抗脂肪堆积等非抗凝生物学活性的构效关系提供新思路与新方法。
附图说明
图1为UC小鼠体重曲线的ANOVA分析图
图2为UC小鼠结肠代表性图片与结肠长度测量结果图
图3为UC小鼠脾脏代表性图片与脾重指数示意图
图4为H&E染色评价UC小鼠结肠上皮组织学变化图
图5为肝素衍生物体外抗炎活性指标评价示意图
图6为肝素衍生物及各分离组分完整糖链分析图谱
图7为肝素衍生物及各分离组分的寡糖覆盖度与寡糖富集阈值关系图
图8为肝素衍生物及各分离组分的富集寡糖韦恩图
图9为肝素衍生物有效与无效抗UC寡糖的结构特征分析图
具体实施方式
下面结合具体实施方式对本申请做进一步的详细描述,给出的实施例是为了能够更透彻地理解本发明,并且能够将本发明的范围完整的传达给本领域的技术人员。
需要说明的是,在说明书及权利要求当中使用了某些词汇来指称特定组件。本领域技术人员应可以理解,技术人员可能会用不同名词来称呼同一个组件。本说明书及权利要求并不以名词的差异作为区分组件的方式,而是以组件在功能上的差异作为区分的准则。如在通篇说明书及权利要求当中所提及的“包含”或“包括”为开放式用语,故应解释成“包含但不限定于”。说明书后续描述为实施本申请的较佳实施方式,然而所述描述乃以说明书的一般原则为目的,并非用以限定本申请的范围。本申请的保护范围当视所附权利要求所界定者为准。
本申请涉及一种精制肝素类多糖的制备方法,在一个具体的实施方式中,包括如下步骤:
对原料肝素进行去抗凝处理和酶解以获得肝素类多糖原料;
采用凝胶排阻色谱柱对所述肝素类多糖原料进行分离并收集分离得到的组分;
将所收集的分离后的各组分进行冻干处理;
将各组分的冻干产物通过醇沉进行脱盐处理,得到精制肝素类多糖。
本申请中所述肝素类多糖原料,即去抗凝肝素衍生物,是对肝素或(超)低分子量肝素进行去抗凝处理后得到的物质,是不具有抗凝活性或抗凝活性低的肝素或(超)低分子量肝素,其抗Xa因子小于等于70IU/mg,优选抗Xa因子小于等于60IU/mg,优选抗Xa因子小于等于50IU/mg,优选抗Xa因子小于等于40IU/mg,优选抗Xa因子小于等于30IU/mg,优选抗Xa因子小于等于20IU/mg,优选抗Xa因子小于等于10IU/mg。
在一个具体的实施方式中,先对原料肝素进行去抗凝处理,再对去抗凝处理的产物进行酶解,获得所述肝素类多糖原料。
在本申请一个具体的实施方式中,是利用高碘酸氧化法对所述原料肝素进行去抗凝处理以得到去抗凝处理的产物。
通过高碘酸氧化法能得到去除抗凝活性的肝素衍生物,并且其他生物学活性能很大程度保留,硫酸化程度与形式基本保持不变。高碘酸可以选择性的氧化含有未取代羟基或氨基的邻位碳原子,使得无硫酸化的糖醛酸C(2)-C(3)键断裂,肝素分子内的抗凝血酶结合五糖中的葡萄糖醛酸因而遭到破坏,失去抗凝活性;高碘酸氧化得到的聚醛类氧化肝素通过硼氢化物的还原以保持稳定(Islam,T.,et al.,Further evidence that periodatecleavage of heparin occurs primarily through the antithrombin bindingsite.Carbohydrate Research,2002.337(21–23):p.2239-2243.)。
在一个具体的实施方式中,将原料肝素(例如,肝素钠)溶于水中,并加入高碘酸钠溶液进行反应。反应一段时间后,加入乙二醇以中和过量的高碘酸钠,再添加硼氢化钠反应。调节pH值后,经过滤,收集过滤样品。再利用透析袋等进行浓缩和除盐,最终得到去除抗凝活性的去抗凝肝素衍生物。
在本申请一个具体的实施方式中,是利用肝素酶,例如肝素酶I,对去抗凝处理的产物进行酶解以获得所述肝素类多糖原料。
在现有技术中,肝素酶I的E.C.号为E.C.4.2.2.7。可以采用购买的肝素酶I,例如购自Sigma公司或IBEX公司买到的肝素酶I。肝素酶也可以是通过分子生物学方法构建的重组肝素酶I或者肝素酶I与任何融合伴侣形成的融合蛋白,只要具有肝素酶I的活性即可。优选的,肝素酶I是肝素酶I的融合蛋白,尤其是包含MBP的肝素酶I的融合蛋白。
在一个具体的实施方式中,肝素酶I与所述去抗凝处理的产物进行反应的方式可以分批的、连续的或半连续的,本领域普通技术人员可以根据生产的需要适当地选择。
在本申请一个具体的实施方式中,采用凝胶排阻色谱柱对所述肝素类多糖原料进行分离。优选的,采用一套AKTA Prime纯化系统搭配一根制备液相使用的凝胶排阻色谱柱形成基本的硬件设施。
凝胶排阻色谱也称空间排阻色谱,是一种根据试样分子的尺寸进行分离的色谱技术,主要用于有机溶剂中可溶的高聚物相对分子质量分布分析及分离。凝胶排阻色谱的色谱柱填料是凝胶,它是一种表面惰性,含有许多不同尺寸的孔穴或立体网状结构的物质。凝胶的孔穴仅允许直径小于孔开度的组分分子进入,这些孔对于流动相分子来说是相当大的,以致流动相分子可以自由地扩散出入。根据所用凝胶填料不同,凝胶排阻色谱柱可分离油溶性和水溶性物质,分离相对分子质量的范围从几百万到100以下。
在本申请一个具体的实施方式中,所选用的凝胶排阻色谱柱为HiPrep16/60Sephacryl系列色谱柱,是一种高分辨率的凝胶过滤填料,一般用作精细分离。具体的,可以选择HiPrep 16/60Sephacryl系列下的HiPrep 16/60Sephacryl S-100HighResolution、HiPrep 16/60Sephacryl S-200High Resolution、HiPrep 16/60SephacrylS-300High Resolution等用于本申请的多糖原料的分离。在一个具体的实施方式中,优选色谱柱填料为HiPrep 16/60Sephacryl S-100High Resolution,使用柱压不超过0.15Mpa。
在本申请另一个具体的实施方式中,所选用的凝胶排阻色谱柱为TSKgel G2000SW色谱柱。TSKgel SW系列色谱柱的填料是以刚性的球型硅胶为基质,在其表面通过共价键合亲水基团而成,专用于GFC分离蛋白质和多肽。SW系列色谱柱的填料具有高性能尺寸排阻色谱所必需的性能,即低吸附性和良好的孔径分布其pH适用范围为2.5~7.5,可能使用与水完全互溶的有机溶剂,如乙腈、丙酮、甲醇或乙醇等。在一个具体的实施方式中,优选色谱柱填料为TSKgel G2000,其使用柱压不超过2.00Mpa。
在本申请一个具体的实施方式中,采用所述凝胶排阻色谱柱时所使用的流动相为0.15~1.0M的NaCl水溶液,例如可以为0.15、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0M的NaCl水溶液。优选流动相为0.15~0.6M的NaCl水溶液。更优选流动相为0.2M的NaCl水溶液。
在凝胶排阻色谱的分离理论中,流动相需要有一定浓度的盐离子填充凝胶排阻色谱柱填料中的高能位点以确保分离效果;另一方面,流动相的选择需要兼顾多糖分离和多糖纯化两个部分的需求。目前的流动相可以兼顾上述两个方面的要求。
在本申请一个具体的实施方式中,流动相NaCl水溶液的pH值为3~10,优选pH值为5。
流动相的pH值会影响分离效率,一般pH=5时,肝素类多糖分离效率最好。一些现有文献称pH在5~7之间分离效率不会有显著差异。
在本申请一个具体的实施方式中,采用所述凝胶排阻色谱柱时流动相的流速为0.1~1.0mL/min,例如可以为0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0mL/min。优选流动相的流速为0.3~0.7mL/min。更优选流动相的流速为0.5mL/min。在一个具体的实施方式中,技术人员可以根据色谱柱的可操作范围进行设定。
在一个具体的实施方式中,以10~240mg/mL的浓度将多糖原料溶解于流动相中。优选的,溶解浓度为10~120mg/mL。
在一个具体的实施方式中,一次分离的样品装载量为0.5~5mL。此参数可以根据色谱柱的具体可操作范围进行设定。
在本申请一个具体的实施方式中,将所述肝素类多糖原料溶解于流动相中,根据样品的分子量不同,设定不同的组分收集时间。在一个具体的实施方式中,可以每3~30min收集一个组分。根据凝胶排阻色谱的原理,不同分子量的组分将先后分离出来。先分离出来的为大分子量多糖,后分离出来的为小分子量多糖。相关技术人员可以设定任何能使样品得到有效分离的收集间隔时间,从而实现对特定分子量多糖的富集和提纯,得到具有特定分子量分布的精制多糖的盐溶液。
在一个具体的实施方式中,将所述肝素类多糖原料溶解于流动相,从进样后第70~100min开始进行收集。该参数可根据进样量的大小进行设定。
在本申请一个具体的实施方式中,从进样后第80min开始收集分离组分,随后每10min收集一个组分,收集到分子量不同的11种分离组分。
通过上述对肝素类多糖原料的分离精制步骤,得到具有特定分子量分布的精制多糖的盐溶液。为了提高多糖与盐在溶液中的浓度,以便于醇沉得到更多的多糖产物,可以对上述精制多糖盐溶液进行冻干处理(一次冻干),除去多余的水分。
在一个具体的实施方式中,冻干处理的条件为:将精制多糖的盐溶液在-80℃环境下预冻,随后放入冻干机冻干2日至水分完全除去。
在一个具体的实施方式中,将经过冻干处理的产物进行浓缩醇沉,以得到脱盐后的精制多糖水溶液。
在一个具体的实施方式中,在浓缩醇沉过程中,可对经过冻干处理的产物加入蒸馏水重悬以富集精制多糖,增加醇沉的收率。具体的,可以按照冻干产物体积20%~50%的量加入蒸馏水,优选为30%。在上述过程中,体积的缩小也会使NaCl进一步浓缩,促进多糖的析出。
在一个具体的实施方式中,经过上述重悬浓缩步骤后,加入乙醇水溶液进行静置醇沉。具体的,可以以浓缩后液体体积2~6倍的量加入浓度在75%~100%的乙醇水溶液。优选的,以浓缩液体体积5~6倍的量加入无水乙醇。在肝素的工业生产中,乙醇醇沉步骤常常采用不同乙醇浓度的溶液。醇沉体积与多糖的浓度有关,多糖浓度越高,醇沉体积越小,多糖浓度越低,醇沉体积越大。
在一个具体的实施方式中,醇沉静置时间可以为5~60min。优选为10~30min,进一步优选为10min。静置的主要目的是将多糖充分絮凝,确保收率。
在一个具体的实施方式中,将醇沉后的沉淀产物进行离心处理后弃去所有上清,并再次加入蒸馏水进行重悬,以得到脱盐后的各组分精制多糖水溶液。
在一个优选的实施方式中,在8000g,4℃,10min的条件下将沉淀的产物进行离心处理。
在一个具体的实施方式中,加入0.5~10mL蒸馏水进行重悬。优选的,加入2mL蒸馏水。该参数与多糖浓度有关,多糖浓度越高,需要的蒸馏水体积越大,多糖浓度越低,需要的蒸馏水体积越小。
在一个具体的实施方式中,对上述经过浓缩醇沉后得到的脱盐后的精制肝素类多糖水溶液再次进行冻干处理(二次冻干),可以得到便于储存的精制多糖产物。
在一个具体的实施方式中,二次冻干的处理条件与一次冻干相同。
采用本申请提供的精制肝素类多糖的制备方法,实现了对肝素类多糖进行分子量大小可控的制备分离,可以得到具有较为集中的分子量分布的各精制多糖组分,显著优化了多糖非均一性大的特点,对进一步研究其抗炎、抗肿瘤、抗脂肪堆积等非抗凝生物学活性的有效挖掘以及用于治疗UC的应用提供了有利条件。
将采用上述精制肝素类多糖的制备方法所制备得到的各精制多糖组分进行抗UC生物学活性验证后,发现某些分离组分具有较为优异的抗UC功效。在对相应的精制多糖分离组分进行完整糖链分析及富集寡糖维恩图分析后,发现在抗UC有效的分离组分中存在一类具有特定多糖结构特点的寡糖,推断其很可能为抗UC有效的多糖片段。
在此基础上,本申请提供了一种具有特定多糖结构的寡糖,此种寡糖主要基于抗UC有效的精制多糖得到,其特征在于,所述寡糖具有如下所示的结构:
[a]-[b,c,d,e,f,g]-[h],其中,
a代表所述寡糖分子中糖环开环结构的数量;
b代表所述寡糖分子中不饱和糖醛酸的数量;
c代表所述寡糖分子中饱和糖醛酸的数量;
d代表所述寡糖分子中葡糖胺的数量;
e代表所述寡糖分子中乙酰基团的数量;
f代表所述寡糖分子中磺酸基团的数量;
g代表所述寡糖分子中1,6-脱水结构的数量;
h代表所述寡糖分子在质谱检测中携带的铵根离子数量;
并且,所述寡糖的结构中葡糖胺的数量为1~10之间,即1≤d≤10,磺酸基团的数量为葡糖胺数量的2.5倍以上,即f≥2.5d,这表明此种寡糖具有高度的磺酸化结构。
在一个具体的实施方式中,上述寡糖分子的结构中仅有1个不饱和糖醛酸,即b=1。由于不饱和糖醛酸与饱和糖醛酸的总数量与葡糖胺数量相等,因此饱和糖醛酸的数量为葡糖胺数量-1,即c=d-1。
在一个具体的实施方式中,上述寡糖分子的结构中基本不含有或者含有少量开环结构,因此开环结构的数量不大于葡糖胺数量的0.3倍,即a≤0.3d。
在一个具体的实施方式中,上述寡糖分子的结构中不含有任何脱水结构,即g=0。
在一个具体的实施方式中,上述寡糖分子的结构中乙酰基团数量不大于1,即e≤1.0。
在具体的实施方式中,本申请所提供的寡糖具有如下所示的结构中的一种,
[0]-[1,2,3,0,9,0]-[0],[0]-[1,2,3,0,8,0]-[0],[0]-[1,3,4,0,12,0]-[0],[2]-[1,3,4,1,10,0]-[1],[0]-[1,4,5,0,15,0]-[5],[1]-[1,4,5,0,14,0]-[1],[1]-[1,4,5,0,13,0]-[0],[2]-[1,4,5,1,13,0]-[4],[2]-[1,4,5,1,11,0]-[0],[0]-[1,5,6,0,18,0]-[6],[2]-[1,5,6,1,16,0]-[5],[2]-[1,5,6,1,15,0]-[3],[2]-[1,5,6,1,14,0]-[3]或[1]-[1,5,6,0,15,0]-[3],
上述结构式如以[a]-[b,c,d,e,f,g]-[h]表示,则其中,
a代表所述寡糖分子中糖环开环结构的数量;
b代表所述寡糖分子中不饱和糖醛酸的数量;
c代表所述寡糖分子中饱和糖醛酸的数量;
d代表所述寡糖分子中葡糖胺的数量;
e代表所述寡糖分子中乙酰基团的数量;
f代表所述寡糖分子中磺酸基团的数量;
g代表所述寡糖分子中1,6-脱水结构的数量;
h代表所述寡糖分子在质谱检测中携带的铵根离子数量。
在一个具体的实施方式中,本申请提供的具有有效抗UC特性的寡糖具有如下结构特征:
所述寡糖的糖链长度在2~20糖之间,基本二糖单元由[0]-[1,0,1,0,3,0]-[0]和/或[0]-[1,0,1,0,2,0]-[0]重复排列组合构成,其中,
[0]-[1,0,1,0,3,0]-[0]表示糖环开环结构为0、不饱和糖醛酸数量为1、饱和糖醛酸数量为0、葡糖胺数量为1、乙酰基团数量为0、磺酸基团数量为3、脱水结构数量为0、质谱中带氨数量为0的二糖结构片段,
[0]-[1,0,1,0,2,0]-[0]表示糖环开环结构为0、不饱和糖醛酸数量为1、饱和糖醛酸数量为0、葡糖胺数量为1、乙酰基团数量为0、磺酸基团数量为2、脱水结构数量为0、质谱中带氨数量为0的二糖结构片段。
进一步的,在一个具体的实施方式中,上述寡糖具有高度磺酸化的特性,其基本二糖单元中所含有的磺酸基团的平均数量大于等于2.5。这意味着基本二糖结构单元主要由[0]-[1,0,1,0,3,0]-[0]所示的结构构成,而如[0]-[1,0,1,0,2,0]-[0]所示结构的含量较少。
进一步的,在一个具体的实施方式中,上述寡糖中基本不含有或者含有少量开环结构,基本二糖单元含有开环结构的平均数量小于等于0.3。本申请还提供一种肝素衍生物,其含有如上所述的具有抗UC有效性的寡糖,并且所述寡糖的含量在17%以上,优选在18%以上,优选在19%以上,优选在20%以上,优选在21%以上,优选在22%以上,优选在23%以上。
另一方面,本申请提供了一种具有特定多糖结构的寡糖,此种寡糖主要基于抗炎有效的精制多糖得到,其特征在于,所述寡糖具有如下所示的结构:
[a]-[b,c,d,e,f,g]-[h],其中,
a代表所述寡糖分子中糖环开环结构的数量;
b代表所述寡糖分子中不饱和糖醛酸的数量;
c代表所述寡糖分子中饱和糖醛酸的数量;
d代表所述寡糖分子中葡糖胺的数量;
e代表所述寡糖分子中乙酰基团的数量;
f代表所述寡糖分子中磺酸基团的数量;
g代表所述寡糖分子中1,6-脱水结构的数量;
h代表所述寡糖分子在质谱检测中携带的铵根离子数量;
并且,所述寡糖的结构中葡糖胺的数量为1~10之间,即≤d≤10,由于葡糖胺数量d也等于二糖单元数量,意为该寡糖由d个二糖单元构成,整个寡糖的糖链长度即为2d。每二糖含有的磺酸基团数量小于等于2.7,即f≤2.7d。
在一个具体的实施方式中,上述寡糖分子的结构中仅有1个不饱和糖醛酸,即b=1。由于不饱和糖醛酸与饱和糖醛酸的总数量与葡糖胺数量相等,因此饱和糖醛酸的数量为葡糖胺数量-1,即c=d-1。
在一个具体的实施方式中,上述寡糖分子的结构中每二糖含有的糖环开环数量大于等于0.25,即a≥0.25d。
在一个具体的实施方式中,上述寡糖分子的结构中不含有任何脱水结构,即g=0。
在一个具体的实施方式中,上述寡糖分子的结构中每二糖含有的乙酰基团数量大于等于0.1,即≥0.1d。
在具体的实施方式中,本申请所提供的寡糖具有如下所示的结构中的一种,
[4]-[1,9,10,1,26,0]-[12],[4]-[1,9,10,1,25,0]-[10],[3]-[1,8,9,1,23,0]-[9],[3]-[1,8,9,1,24,0]-[10],[3]-[1,7,8,1,19,0]-[7],[1]-[1,7,8,3,19,0]-[8],[3]-[1,7,8,1,20,0]-[8],[2]-[1,6,7,1,18,0]-[7],[3]-[1,8,9,1,22,0]-[8],[3]-[1,8,9,2,13,0]-[4],[1]-[1,5,6,0,17,0]-[5],[1]-[1,6,7,0,19,0]-[7],[2]-[1,7,8,1,20,0]-[8],[2]-[1,6,7,1,17,0]-[7],[1]-[1,6,7,0,20,0]-[8],[0]-[1,0,1,0,3,0]-[0]或[3]-[1,4,5,1,8,0]-[7],
上述结构式如以[a]-[b,c,d,e,f,g]-[h]表示,则其中,
a代表所述寡糖分子中糖环开环结构的数量;
b代表所述寡糖分子中不饱和糖醛酸的数量;
c代表所述寡糖分子中饱和糖醛酸的数量;
d代表所述寡糖分子中葡糖胺的数量;
e代表所述寡糖分子中乙酰基团的数量;
f代表所述寡糖分子中磺酸基团的数量;
g代表所述寡糖分子中1,6-脱水结构的数量;
h代表所述寡糖分子在质谱检测中携带的铵根离子数量。
本申请还提供一种肝素衍生物,其含有如上所述的抗炎有效的寡糖,并且所述寡糖的含量在52%以上,优选在65%以上,优选在70%以上,优选在75%以上,优选在80%以上,优选在85%以上,优选在90%以上,优选在93%以上。
在本申请中,对于多糖成分结构解析以及含量测定的方法没有具体的限定,可以使用任何本领域技术人员已知的方法来进行。
在一个具体的实施方式中,首先可以通过本领域技术人员已知的方法提取待测样品中的多糖成分。随后将多糖成分依托中国计量科学研究院进行全糖链图谱分析,并获得记载了多糖样品寡糖含量与寡糖分布信息的检测结果。基于该检测结果可以确认寡糖分子中糖环开环结构的数量、寡糖分子中不饱和糖醛酸的数量、寡糖分子中饱和糖醛酸的数量、寡糖分子中葡糖胺的数量、寡糖分子中乙酰基团的数量、寡糖分子中磺酸基团的数量、寡糖分子中1,6-脱水结构的数量,以及寡糖分子在质谱检测中携带的铵根离子数量。
基于寡糖含量与寡糖分布信息还可以通过本领域技术人员已知的方法对该多糖成分的结构进行重构(具体的方法可以参见本发明实验例3中对于重构过程的描述)以确认寡糖的基本二糖单元结构,以及基本二糖单元中含有的磺酸基团的平均数量和基本二糖单元中糖环开环结构的平均数量。
此外,基于全糖链图谱分析方法获得样品寡糖含量与寡糖分布信息还可以计算符合各结构的寡糖的含量。
本申请还涉及利用本申请所提供的寡糖以及含有所述寡糖的去抗凝肝素衍生物治疗炎症性肠病的用途,例如可以用于治疗溃疡性结肠炎和克罗恩病。
本申请还涉及利用本申请所提供的寡糖以及含有所述寡糖的去抗凝肝素衍生物制备治疗炎症性肠病,以及炎症性肠病相关并发症及发病机理相似的疾病的药物中的用途,其中,炎症性肠病相关并发症及发病机理相似的疾病包括但不限于肠易激综合征、关节炎和其他肠外并发症包括强直性脊柱炎、坏疽性脓皮病、结节性红斑、虹膜炎、葡萄膜炎、巩膜外层炎、原发性硬化性胆管炎和类风湿关节炎。
在本申请的具体的实施方式中,具有抗UC有效性的所述寡糖是由本申请所提供的所述精制肝素类多糖的制备方法所制备得到的。
实施例
实施例1多糖原料的制备
将20g精品肝素(购自常山生化药业股份有限公司,产品名称:肝素钠)溶于0.6L去离子水,在0.6L精品肝素(33g/L)中添加同等体积的0.2M高碘酸钠溶液(现配),300rpm、4℃避光反应22小时。加入80mL乙二醇中和过量高碘酸钠,再添加28g硼氢化钠于4℃反应16小时。用HCl调节pH至7.0。经0.22μm滤膜抽滤,收集过滤样品。再利用透析袋除盐或者通过Millipore超滤装置加1K滤膜进行超滤浓缩和除盐,直至滤出液经0.1M AgNO
将上述得到的去抗凝肝素衍生物(NAHP)溶于反应缓冲液,每隔0.5~1h向该溶液添加按照ZL200410038098.6方法制备的肝素酶I,每次添加20IU肝素酶I,使用光程差为1cm的石英比色皿和紫外分光光度计监测溶液231nm的光吸收A231(使用pH 7.4的缓冲液对仪器进行校准调零,为了检测结果的准确性,当紫外分光光度计读数A231大于0.6时,将溶液稀释一定倍数,使读数在0.2~0.6来测定)。当检测到A231达到46时,结束反应,此时添加的总肝素酶I的酶活达到约220-250IU。结束方法为在100℃沸水浴中对反应溶液中的酶灭活5~10min,取出反应体系冷却至室温,向反应溶液中添加6倍体积的无水乙醇,在室温下搅拌10min,然后在室温下以4000r/min的速度离心15min,收集沉淀,向沉淀加入其质量2~3倍的去离子水,使其充分溶解,随后使用0.22μm孔径的滤膜将溶液过滤,收集透过液并放置在-80℃低温冰箱冻成坚实的冰块,之后利用冻干机(冷阱温度为-50℃)进行冻干,再用研钵或者小型粉碎机粉碎成粉末,得到低分子量去抗凝肝素(命名为:LNAHP)。
将上述得到的去抗凝肝素衍生物(NAHP)溶于反应溶液,每隔0.5~1h向该溶液添加按照ZL200410038098.6方法制备的肝素酶I,每次添加20IU肝素酶I,使用光程差为1cm的石英比色皿和紫外分光光度计监测溶液231nm的光吸收A231(使用pH 7.4的缓冲液对仪器进行校准调零,为了检测结果的准确性,当紫外分光光度计读数A231大于0.6时,将溶液稀释一定倍数,使读数在0.2~0.6来测定)。当检测到A231达到106时,使反应结束,此时添加的总肝素酶I的酶活达到约340-380IU。结束的方法为在100℃沸水浴中对反应溶液中的酶灭活5~10min,然后取出反应体系冷却至室温,向反应溶液中添加6倍体积的无水乙醇,在室温下搅拌10min,然后在室温下以4000r/min的速度离心15min,收集沉淀,加入质量是沉淀2~3倍的去离子水溶解,使用0.22μm的膜过滤,收集透过液并放置在-80℃低温冰箱冻成坚实的冰块,然后送入冻干机(冷阱温度为-50℃)冻干,然后用研钵或者小型粉碎机粉碎成粉末,得到超低分子量去抗凝肝素(也命名为:ULNAHP)。
实施例2精制多糖组分的制备
步骤(1):多糖的分离
实验设备:采用一套AKTA Prime纯化系统搭配一根制备液相使用的凝胶排阻色谱柱(HiPrep 16/60Sephacryl S-100HR)。
工艺参数:流动相为0.2M NaCl水溶液(pH=5.00),流动速率为0.5mL/min,色谱柱体积为120mL;一次分离的样品装载量为最大5mL。
实验方法:将实施例1中得到的多糖原料LNAHP以120mg/mL的浓度溶解于流动相中,根据样品的分子量不同,从进样后第80min开始收集分离组分。根据凝胶排阻色谱的原理,先分离出来的为大分子量多糖,后分离出来的为小分子量多糖。分离期间以每10min收集一个组分,至第180min结束。根据收集时间的不同,获得分子量不同的各分离组分,从而实现对特定分子量多糖的富集和提纯,得到具有特定分子量分布的精制多糖盐溶液。其中,将原料进样后第110min时收集到的精制多糖分离组分命名为S4,第130min时收集到的精制多糖分离组分命名为S6。
步骤(2):多糖溶液的一次冻干
将步骤(1)中得到的各组分精制多糖的盐溶液在-80℃环境下预冻,随后放入冻干机冻干至水分完全除去,即得到各组分多糖溶液的一次冻干产物。
步骤(3):浓缩醇沉
将步骤(2)中得到的各组分一次冻干产物分别按照原体积的30%的量加入蒸馏水重悬以富集精制多糖,增加醇沉收率。随后,使用无水乙醇对多糖溶液进行醇沉,充分混合静置后离心。离心后小心弃去所有上清(乙醇与NaCl的混合物,内含少量可溶的多糖)。再向沉淀加入适量蒸馏水重悬,即可得到脱盐后的各组分精制肝素类多糖水溶液。
步骤(4):多糖溶液的二次冻干
将步骤(3)中得到的脱盐后的各组分精制多糖水溶液在-80℃环境下预冻,随后放入冻干机冻干至水分完全除去,即可得到精制多糖冻干产物。
对通过上述方法得到的各分离组分进行初步的抗UC功能及抗炎效果验证后,发现S6组分具有较为优异的抗UC治疗效果;同时,S4和S6组分还具有较为优异的抗炎效果。在本申请下述实验中将进一步针对S4和S6验证其抗炎及抗UC生物学活性并解析其药物构效关系。具体的,下述实验例中所使用的去抗凝肝素衍生物(NAHP)、低分子量去抗凝肝素(LNAHP)、超低分子量去抗凝肝素(ULNAHP)均由实施例1的方法得到;所使用的多糖分离组分S4和S6由实施例2的方法得到;所使用的肝素(HP)来自河北常山生化购买的未分级肝素,该肝素的重均分子量Mw为17223Da;所使用的5-氨基水杨酸制剂(5-Amino SalicylicAcid,5-ASA)来自药店购买的美沙拉秦缓释颗粒,适应症为:溃疡性结肠炎,用于溃疡性结肠炎的急性发作,防止复发;克罗恩病,用于频繁发病的克罗恩病病人,预防急性发作;所使用的NAEno是以依诺肝素(购自常山生化)为原料,经过实施例1中的NAHP相同的去抗凝修饰工艺得到的去抗凝依诺肝素衍生物;所使用的NAI45是以肝素(购自常山生化)为原料,按照ZL201810100469.0中对比例5的方法进行酶解后,再采用本申请实施例1中NAHP相同的去抗凝修饰工艺得到的一种低分子量去抗凝肝素衍生物,其在之前初步的体内功能验证实验中已发现对UC的治疗无效。
实验例1精制肝素多糖组分分子量及其分布的测定
采用凝胶排阻高效液相色谱法测定实施例1得到的多糖原料LNAHP及实施例2得到的精制多糖分离组分S6的重均分子量(Mw)和分布系数(P)。色谱柱为TSK-GEL G2000SWXL(TOSOH,日本),控制流速为0.5mL/min,柱温35℃,进样体积为25μL。采用WATERS(1525,美国)色谱系统,紫外检测器和示差检测器以先后次序串联连接于色谱柱的出口,紫外检测器波长为234nm。分子量及其分布测定方法可以参考Wu,Jingjun等人"Controllableproduction of low molecular weight heparins by combinations of heparinase I/II/III."Carbohydrate polymers 101(2014):484-492中所记载的方法。具体测定结果见表1。
表1精制多糖原料与精制得到的分离组分的分子量
从表1中的分子量信息可知,精制后得到的分离组分S4、S6与多糖原料相比具有明显不同的分子量分布,从具体的指标看,可以体现在多分散性上,即分布系数P(Polydispersity)。多分散性为重均分子量与数均分子量之比值,为一个恒大于1的正数。该数值越接近1,则说明该物质越接近于分子量明确的单一物质。本实施例中采用的多糖原料的多分散性大于1.6,在经过精制分离制备后,分离组分的多分散性甚至小于1.1,说明精制多糖的分子量分布明显更加集中,更接近于纯物质。
实验例2精制多糖分离组分抗UC及抗炎生物学活性验证
1.通过DSS诱导的UC模型小鼠,对上述实施例2中得到的精制多糖分离组分的抗UC生物学活性进行体内药效考察。在评价指标上,主要采用体重变化、结肠长度、脾重指数、血清炎性因子含量、结肠病理组织学评价等指标,系统性地评估精制多糖治疗UC的药效。
实验方法:
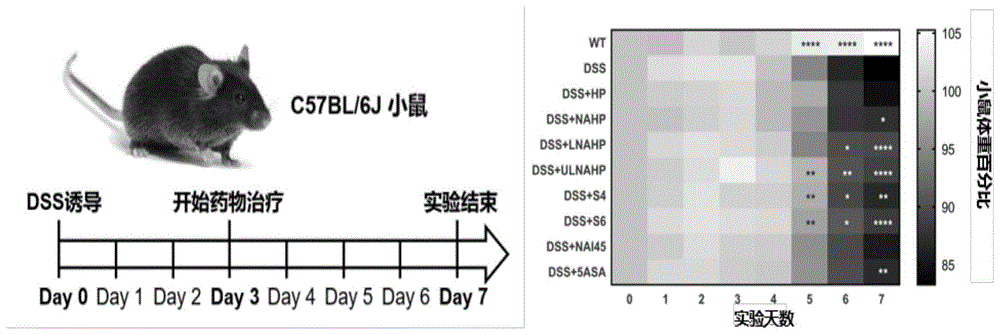
动物实验模型选择6~8周的雄性C57BL/6J小鼠。设置健康对照组(WT组)、DSS造模组、以及造模后药物治疗组。
Day 0,除WT组外,其余组将饮用水更换为3%DSS(葡聚糖硫酸钠,Mw:36,000-50,000Da,MP biomedicals,LLC)水溶液以诱导UC小鼠模型,每日记录小鼠体重。
Day 3,以30mg/kg/只/day的药物剂量,对不同药物治疗组的UC小鼠模型进行灌胃治疗,一直持续到Day 7。
Day 7,实验结束,对实验小鼠施以安乐死,并进行解剖,获得脾脏和结肠组织。对脾脏组织称重,并根据脾脏重量和体重计算得到脾重指数,以评价精制多糖分离组分的体内抗炎、调节免疫功效。对结肠长度进行测量,然后将结肠组织进行石蜡包埋和病理组织切片H&E染色,根据UC小鼠结肠上皮组织结构变化,评价精制多糖分离组分的体内抗UC功效。具体实验结果如图1-图4所示。
实验结果:
(1)体重下降是DSS诱导的UC小鼠模型的重要表型之一,此指标可以表征疾病的严重程度。图1为小鼠体重变化曲线的ANOVA分析图。可以看出,在第3天至第7天的治疗期内,口服HP、NAI45、NAEno治疗组小鼠与DSS组小鼠相比体重下降的趋势没有显著改善。在第6天时,口服有效治疗药物(LNAHP、ULNAHP)和精制多糖分离组分S6小鼠与DSS组小鼠相比体重下降趋势已出现显著缓解(p<0.05,p<0.01,p<0.05)。在第7天时,口服NAHP和临床一线用药(5ASA)小鼠可以显著缓解由DSS诱导的体重下降的趋势(p<0.05,p<0.01),而口服LNAHP、ULNAHP、S6小鼠得到了更为显著的缓解体重曲线下降的趋势(p<0.0001,p<0.0001,p<0.0001)。上述结果显示分离组分S6可以有效缓解UC小鼠的体重下降趋势,且与临床一线用药5ASA相比,在缓解UC小鼠体重下降症状上具有更显著的疗效。
(2)结肠长度缩短是UC小鼠模型的特征表型之一,也与疾病严重程度密切相关。图2所示为各实验组小鼠结肠长度测量结果。与DSS组小鼠相比,除口服HP、NAEno和NAI45治疗组,口服其余肝素衍生物以及5ASA均能够有效缓解由DSS诱导的UC小鼠结肠长度缩短的现象,其中:S6治疗组小鼠缓解结肠长度缩短的效果最佳,与DSS组小鼠相比的显著性差异最大(p<0.0001)。上述结果表明,精制多糖分离组分S6达到更有效缓解UC小鼠结肠长度缩短症状的疗效,且较临床一线用药5ASA的疗效更为显著。
(3)脾脏作为重要的免疫器官,在全身免疫系统激活时会出现脾脏肿大、质量增加的情况。而脾肿大也是UC病人的临床症状之一,这与免疫系统的慢性持续性激活密切相关。通过脾重指数可以表征个体免疫系统的激活情况。图3为脾重指数示意图。可以看出,DSS模型组小鼠与WT组小鼠相比出现了明显的脾肿大与脾重指数增加的表型。与DSS组相比,口服NAHP、LNAHP、S6和5ASA能够非常显著地缓解UC小鼠脾肿大的症状,抑制脾重指数的上升(p<0.01,p<0.01,p<0.01,p<0.01);而口服NAEno和NAI45不能有效缓解脾肿大与脾重指数的上升。上述结果说明,精制多糖分离组分S6能够显著缓解UC小鼠脾肿大并抑制脾重指数上升,具有显著的免疫抑制能力;其抑制脾肿大与脾重指数上升的功效与5ASA相当。
(4)结肠粘膜的病理组织学评价是UC临床诊断、治疗与药效评价的金标准,也是评估去抗凝肝素衍生物和精制分离组分UC治疗生物学活性的重要指标。图4为H&E染色评价UC小鼠结肠上皮病理组织形态学变化图。其中,WT组小鼠具有正常的结肠上皮结构,其结肠上皮细胞完整、隐窝结构正常、隐窝排布规则,存在大量杯状细胞、无嗜中性粒细胞浸润。DSS组小鼠的结肠上皮出现了严重的嗜中性粒细胞与巨噬细胞浸润的现象,与WT组小鼠相比,原有的结肠上皮细胞脱落坏死、杯状细胞大量缺失、结肠上皮屏障被完全破坏、隐窝结构完全消失。与DSS组小鼠相比,口服HP、NAEno和NAI45不能有效缓解结肠上皮结构的破坏与上皮细胞的脱落等疾病症状。而口服NAHP、ULNAHP、和5ASA能够部分改善结肠隐窝缺失和上皮细胞脱落坏死的现象,但结肠上皮和结肠隐窝的完整性较差、隐窝形态和排布存在异常、隐窝间仍然存在明显的炎症细胞浸润、存在杯状细胞缺失的现象。口服LNAHP和S6可以显著保护小鼠的结肠上皮组织,其结肠上皮结构完整、隐窝形状正常、隐窝排列规则、具有正常分布的杯状细胞和少量炎症细胞浸润的情况。病理组织学评价结果表明,精制多糖分离组分S6,可以显著缓解UC小鼠结肠上皮组织结构的破坏并使结肠上皮组织结构恢复正常,并抑制外周血以及肠固有层炎症反应,与临床一线用药5ASA相比具有更优越的UC治疗生物学活性。
通过上述综合指标评估,精制多糖分离组分S6的抗UC生物学活性优异,其疗效相关指标均优于临床一线用药5ASA。
2.采用脂多糖诱导的小鼠巨噬细胞系RAW 264.7构建体外炎症模型,对上述实施例2中得到的精制多糖分离组分S4和S6的抗UC生物学活性进行体外层面的药效考察。
实验方法:
使用小鼠巨噬细胞RAW 264.7(购自ATCC),按照150,000cells/mL的浓度接种到48孔板中,使用高糖DMEM培养基外加10%胎牛血清在37℃,5%CO
实验结果:
持续地慢性炎症反应作为UC的重要临床表型之一,是临床上UC治疗药物最主要的作用靶点。在上述通过DSS诱导的UC小鼠模型实验中,发现了S6具备良好的抗UC生物学活性。但是有效抗UC肝素衍生物抑制炎症的作用机制尚未阐明。为了确认有效抗UC的多糖组分是否具备显著的抗炎活性,通过构建LPS刺激的RAW 264.7细胞作为体外模型,评价肝素衍生物及精制肝素多糖的体外抗炎效果。RAW 264.7作为小鼠巨噬细胞,是固有免疫的重要组成部分,在外源性抗原如LPS的刺激下会大量分泌IL-6、TNF-α等细胞因子,引发免疫系统的持续激活。IL-6、TNF-α在UC病人体内高度表达,也是UC治疗药物的有效作用靶点。因此,通过考察IL-6、TNF-α等细胞因子的表达含量可以对整体的炎症反应水平进行评价。
从图5中各组体外抗炎活性评价示意图中可知,LPS刺激使RAW 264.7大量分泌IL-6与TNF-α。在抗IL-6活性上,抗凝肝素HP可以有效缓解RAW264.7细胞IL-6分泌量的上升(p<0.01),而在HP经过去抗凝修饰后得到的NAHP、LNAHP、S4、S6、NAEno、NAI45展现出了更为显著的抗IL-6分泌的活性(p<0.0001,p<0.0001,p<0.0001,p<0.0001,p<0.0001)。而在抗TNF-α活性上,抗凝肝素HP不能有效缓解RAW 264.7细胞TNF-α含量的上升,而相比之下,LNAHP、S4、S6和5ASA展现出了显著的抑制TNF-α分泌的活性(p<0.01,p<0.001,p<0.05,p<0.01)。上述结果表明,LNAHP、S4和S6展现出了最佳的体外抗炎活性。上述结果也证实了HP在经过去抗凝修饰和生物酶解后,可以展现出更为显著的抗炎活性。这也说明肝素类药物的抗炎活性可能与去抗凝肝素衍生物的制备工艺相关,采用先去抗凝后酶解的制备工艺得到的肝素衍生物总体发挥了最佳的体外抗炎效果。
实验例3精制多糖分离组分的抗UC功效及抗炎活性验证与构效关系分析
通过上述实验例2对抗UC性能及体外抗炎活性的筛选,发现了表现较为优异的去抗凝肝素衍生物和精制多糖分离组分S4、S6等,为了进一步解析本申请中的精制多糖分离组分的抗炎活性及治疗UC的药物构效关系,委托中国计量科学研究院针对几种不同肝素衍生物及精致多糖分离组分S4、S6进行完整糖链图谱分析,以挖掘发挥肝素抗炎及抗UC性能的结构片段。完整糖链图谱分析(Chain Mapping)是表征低分子量去抗凝肝素结构的重要手段,是基于液相色谱-高分辨质谱联用(LC-MS)技术的糖链结构分析方法。
具体方法为:选取LNAHP、ULNAHP、S4、S6和抗UC无效肝素衍生物NAI45,将肝素衍生物溶解于水中,将样品进样到液质联用仪(仪器厂家:Thermo Scientific,仪器型号:UHPLC-LTQ-Orbitrap,仪器编号:SN04010B)进行检测,收集质谱信号。其中,液相色谱检测参数为:色谱柱,
在获得了上述寡糖组分的结构信息和丰度信息之后,如下我们将进一步分析哪种寡糖组分是抗UC有效寡糖。具体方法为:
在Windows 10操作系统上使用R studio软件(Version 1.2.1335),利用R语言编程并结合pheatmap等程序包进行可视化,将不同样品中不同寡糖的含量高低用热图进行可视化表示,得到上述各组物质的全糖链图谱分析结果,如图6所示(图中每一行代表一种寡糖组分,每一列代表不同的样品对应的寡糖富集情况,数据经过行归一化,富集寡糖的组分颜色偏黑,不富集的寡糖组分颜色偏白,不含有的寡糖组分为白色)。
1.由图6可知,有效分离组分S6的寡糖组成成分与其他肝素衍生物具有显著差异。在此基础上,为进一步得到有效肝素衍生物发挥生物学活性的功能片段,将完整糖链图谱分析中的寡糖按照含量从高到低进行排序,并计算其含量,得到寡糖覆盖度与寡糖富集的阈值关系图(图7)。由图7可知,寡糖富集阈值达在0%~40%之间,寡糖覆盖度快速上升,说明含量前40%的寡糖组分具有较好的代表性。因此,在后续的分析中,选择寡糖含量前40%的寡糖作为各肝素衍生物和分离组分的富集寡糖,代表各肝素衍生物和分离组分的主要组成部分。
在此基础上,在Windows 10操作系统上使用R studio软件(Version1.2.1335),利用R语言编程并结合UpSetR等程序包,将各肝素衍生物和分离组分的富集寡糖进行维恩图分析,从图8可知,在抗UC有效的肝素衍生物中,存在一类共有的多糖。因而,将在LNAHP和S6富集并不在NAI45中富集的一类多糖定义为有效组分(Effective component),将在NAI45中富集且在LNAHP和S6中不富集的一类多糖定义为无效组分(Ineffective component),将剩余的组分定义为其他组分(Other component)。
在Windows 10操作系统上使用R studio软件(Version 1.2.1335),利用R语言编程并结合ggplot2,stringr,pheatmap,ggsci,UpSetR等程序包对图8中对应的寡糖数据进行分析,通过提取对应组分的结构特征信息,由图9可知,有效组分与无效组分和其他组分相比,具有较高的磺酸基团数量和较少的糖环开环数量。由此可以推测抗UC有效寡糖具有高度磺酸化和不含有糖环开环结构的特征。根据图8的分类结果,将富集寡糖分类得到的有效组分寡糖信息进行汇总,如表2所示:
表2抗UC有效组分的寡糖信息汇总
注:寡糖结构表示方法意为[多糖开环结构]-[不饱和糖醛酸-饱和糖醛酸-葡糖胺-乙酰基团-磺酸基团-脱水结构]-[氨基(即质谱检测中携带的铵根离子数量,并非多糖本身结构所有)]
在此基础上,统计了各类寡糖在肝素衍生物和分离组分中的含量,结果如表3所示。表3中所列有效组分在抗UC有效肝素衍生物LNAHP、ULNAHP、S6中高度富集,在其他肝素衍生物中的含量较低,这也与肝素衍生物的体内抗UC疗效一致。
表3各类寡糖在肝素衍生物和分离组分中的含量汇总
在此基础上,对表2中的有效组分进行进一步分析,并结合肝素衍生物的生物合成过程按以下方式对有效组分进行寡糖重构:
(1)首先重构多糖骨架:根据不饱和糖醛酸、糖醛酸和葡萄糖胺的数量,确定肝素糖链的长度,并按照糖醛酸和葡萄糖胺交替排列的形式构建有效组分的基本骨架。
(2)其次重构开环结构和乙酰基团:根据肝素多糖的合成机理,将开环结构重构到糖醛酸上,将乙酰基团重构到葡萄糖胺上。根据后续磺酸基团重构情况,上述重构结构可能还需要根据磺酸基团的数量做细微调整。
(3)最后重构磺酸基团:主要根据磺酸基团数量,同时结合开环结构和乙酰基团的数量以及概率论综合考量确定。优先考虑将肝素中高度含有的NS结构域二糖进行磺酸基团重构,再考虑包含开环结构和乙酰基团的糖环上的磺酸基团重构。
经过上述重构即可得到有效抗UC寡糖组分的分子结构特征。表4中展示了有效组分的多糖结构药物组成、分子式和结构式。
表4有效抗UC寡糖的结构组成与分子式
/>
/>
注1:[开环]-[△HexA,HexA,HexN,Ac,SO3,脱水]-[NH3]表示[多糖开环结构]-[不饱和糖醛酸-饱和糖醛酸-葡糖胺-乙酰基团-磺酸基团-脱水结构]-[氨基(质谱检测中携带的铵根离子数量,并非多糖本身结构所有)]
注2:“重构主要结构与次要结构”一栏中,主要结构为根据肝素的生物合成过程和肝素衍生物的制备工艺特点,最有可能出现的分子结构;次要结构为在肝素的生物合成过程和肝素衍生物的制备工艺中存在,但并非主要反应达到的分子结构,据推算,其数量较主要结构至少小一个数量级。
注3:“重构主要结构与次要结构”一栏中,△UA表示不饱和糖醛酸、HexA表示糖醛酸、GlcA表示葡糖醛酸、IdoA表示艾杜糖醛酸、GlcNAc表示N-乙酰葡糖胺;Ω为糖环开环修饰符号,NS/6S/3S/2S分别表示糖醛酸和葡糖胺上的N-磺酸基、6-O-磺酸基、3-O-磺酸基、2-O-磺酸基修饰;“()”、“[]”等符号表示相同符号内的多糖结构在顺序上可以相互替换
根据表2、表3和表4数据,可以发现抗UC有效多糖的结构特征为,不含有或者含有少量开环结构(由肝素去抗凝产生)且高度硫酸化的多糖片段,富集这一类多糖片段以及拥有这一类多糖片段组成的多糖具备治疗UC的疗效。
至此,我们发现了一类具有特定多糖结构组成的寡糖组分,这类寡糖组分主要基于抗UC有效肝素衍生物得来,在LNAHP和S6中高度富集。在此发现的基础上进行进一步的推论可以认为,发挥抗UC生物学活性的理想寡糖片段应具有以下结构特点:
(1)多糖的糖链长度在2~20糖之间,基本二糖结构单元由[0]-[1,0,1,0,3,0]-[0]和[0]-[1,0,1,0,2,0]-[0]重复排列组合构成,其中,上述表示方法意为[多糖开环结构]-[不饱和糖醛酸-饱和糖醛酸-葡糖胺-乙酰基团-磺酸基团-脱水结构]-[氨基(质谱中多糖带氨数量,并非多糖本身结构所有)]
(2)具有高度磺酸化的特性,要求每二糖含有磺酸基团的平均含量大于等于2.5;这意味着基本二糖结构单元主要由[0]-[1,0,1,0,3,0]-[0]构成,[0]-[1,0,1,0,2,0]-[0]的含量较少。
(3)在此基础上,基本不含有或者含有少量开环结构,要求每二糖含有开环结构的平均含量小于等于0.3。
根据上述结构特征,我们根据肝素的生物合成过程特点、肝素衍生物的制备工艺流程以及完整糖链分析结果,可以推断高度磺酸化的、不含有或者含有少量开环结构的肝素衍生物多糖具有治疗UC的效果。利用公式可以将上述结果进行进一步的归纳,推导过程如下:
对于任意一类寡糖物质:[a]-[b,c,d,e,f,g]-[h],其中上述结构式表示:寡糖中的[多糖开环结构]-[不饱和糖醛酸-饱和糖醛酸-葡糖胺-乙酰基团-磺酸基团-脱水结构]-[氨基(质谱中多糖带氨数量,并非多糖本身结构所有)]的各结构的数量。
对于肝素类寡糖,有且仅有1个不饱和糖醛酸,即b=1。且由于糖醛酸和葡糖胺的数量相等,可以有b+c=d。其中葡糖胺数量d也等于二糖单元数量,意为该寡糖由d个二糖单元构成,在这里,1<=d<=10。整个寡糖的糖链长度即为2d。由于有效肝素衍生物在制备过程中不含有任何脱水结构,g=0。h为质谱中多糖带氨数量,与多糖本身结构无关,在这里不做限定。
根据有效抗UC寡糖的结构特征,该类寡糖具有高度磺酸化结构,要求每二糖含有磺酸基团的平均含量大于2.5,即f>=2.5d。同时,该类寡糖基本不含有或者含有少量开环结构,每二糖含有开环结构的平均含量小于0.3,即a<=0.3d。对于乙酰基团数量e,根据图9结果,结合肝素生物合成特点,限定e<=1.0。
根据上述信息,进一步整理变量。可以得到有效抗UC寡糖的结构式:
[a]-[1,d-1,d,e,f,0]-[h]
其中:1<=d<=10,a<=0.3d,f>=2.5d,e<=1.0,h不做限定。
根据上述公式,可以进一步得到该类寡糖物质的分子式:
C
根据分子式,即可推算得到分子量。
2.根据图6的糖链谱图结果,为了进一步分析上述多糖精制组分发挥抗炎活性的功能片段,将全糖链图谱分析中测得的全部寡糖片段在各抗炎活性显著的肝素衍生物(LNAHP、S4、S6和NAI45)中的含量进行加和,根据加和数值从高到低进行排序,取前15%的寡糖片段作为代表性寡糖片段,将数据整理,总结如表5所示。将代表性寡糖片段在各肝素衍生物中的含量进一步总结,如表6所示。
表5抗炎肝素衍生物代表性寡糖片段
注:寡糖结构表示方法意为[多糖开环结构]-[不饱和糖醛酸-饱和糖醛酸-葡糖胺-乙酰基团-磺酸基团-脱水结构]-[氨基(即质谱检测中携带的铵根离子数量,并非多糖本身结构所有)]
表6抗炎有效寡糖在各肝素衍生物和分离组分中的含量汇总
/>
表7抗炎有效寡糖的分子式与分子量信息
至此,我们发现了一类组成明确的寡糖片段,该寡糖片段仅占所有寡糖种类数量的15%,但在抗炎肝素衍生物中高度富集,含量超过了45%,特别是在S4中含量超过了90%。可以推测,上述寡糖就是肝素衍生物发挥抗炎生物学活性的功能片段。
为了进一步归纳上述具有抗炎性能的寡糖结构特征,利用公式对其结构式进行进一步的归纳,推导过程如下:
对于任意一类寡糖物质:[a]-[b,c,d,e,f,g]-[h],其中上述结构式表示:寡糖中的[多糖开环结构]-[不饱和糖醛酸-饱和糖醛酸-葡糖胺-乙酰基团-磺酸基团-脱水结构]-[氨基(质谱中多糖带氨数量,并非多糖本身结构所有)]等各结构的数量。
对于肝素类寡糖,有且仅有1个不饱和糖醛酸,即b=1。且由于糖醛酸和葡糖胺的数量相等,可以有b+c=d。其中葡糖胺数量d也等于二糖单元数量,意为该寡糖由d个二糖单元构成,在这里,1<=d<=10。整个寡糖的糖链长度即为2d。由于有效肝素衍生物在制备过程中不含有任何脱水结构,g=0。h为质谱中多糖带氨数量,与多糖本身结构无关,在这里不做限定。
根据有效抗炎寡糖的结构特征,大部分抗炎寡糖的分子结构数量满足以下条件:要求每二糖含有的乙酰基团数量大于等于0.1,即e>=0.1d;要求每二糖含有的磺酸基团数量小于等于2.7,即f<=2.7d;要求每二糖含有的糖环开环数量大于等于0.25,即a>=0.25d。
根据上述信息,进一步整理变量。可以得到有效抗炎寡糖的结构式:
[a]-[1,d-1,d,e,f,0]-[h]
其中:1<=d<=10,a>=0.25d,f<=2.7d,e>=0.1d,h不做限定。
根据上述公式,可以进一步得到该类寡糖物质的分子式:
C
根据分子式,即可推算得到分子量。
3.抗炎有效寡糖和抗UC有效寡糖的结构异同比较
通过上述对两种寡糖结构式的归纳,对其结构上的异同之处进行比较,具体结果见表8。
表8抗炎有效寡糖和抗UC有效寡糖的结构异同比较
从表8可知,抗UC寡糖和抗炎寡糖在乙酰基团、磺酸基团和糖环开环结构数量上仅存在少量交集,总体上两种寡糖的基团组成仍存在显著差异。是两类组成不同的寡糖组分。
以上所述,仅是本申请的较佳实施例而已,并非是对本申请作任何形式的限制。任何熟悉本专业的技术人员可能利用上述揭示的技术内容加以变更或改型为等同变化的等效实施例。但是凡是未脱离本申请技术方案内容,依据本申请的技术实质对以上实施例所作的任何简单修改、等同变化与改型,仍属于本申请技术方案的保护范围。
