PI3K/m-TOR抑制剂及其应用
文献发布时间:2024-04-18 20:00:25
技术领域
本发明涉及PI3K/m-TOR抑制剂及其应用,属于靶向抗肿瘤药物技术领域。
背景技术
肿瘤目前已经成为世界性的问题,全球几乎每个国家的癌症患者数量都在增加,中国已经成为为亚洲癌症患病和死亡人数最高地区,癌症造成的全球负担已经严重威胁到了人类的健康,癌症的治疗已经成为当今社会的重大难题,同时肿瘤的耐药性问题也越来越突出。许多研究已经表明PI3K/AKT/m-TOR信号调节通路相关基因的改变与肿瘤的形成密切相关,超过70%的肿瘤在PI3K/AKT/m-TOR信号传导途径中带有突变或基因扩增,该靶点已经成为开发肿瘤药物非常具有前景的一个靶标。
目前靶向于PI3K/AKT/m-TOR信号通路药物大多数还处于临床研究之中,只有极少部分上市药物,分别为泛PI3K抑制剂copanlisib;PI3Kδ抑制剂idelalisib;三种m-TOR抑制剂坦罗莫司,依维莫司,地磷莫司。已经上市的药物存在一定的缺陷。比如,泛PI3K抑制剂对PI3K下游抑制作用有限,同时对m-TOR上游信号通路异常抑制作用也非常有限,在临床应用中泛PI3K抑制剂copanlisib适应症受到大大的局限。PI3Kδ抑制剂idelalisib虽然具有选择性作用于PI3Kδ,避免产生的累积毒性作用,但是其适用范围相比PI3K/m-TOR双重选择性抑制剂显得非常局限,在临床使用中idelalisib往往于其他抗肿瘤药物或细胞毒性药物联合使用,同时会加大肿瘤患者的药物不良反应,在临床使用中局限性较大。已经上市的m-TOR抑制剂,因为单纯的m-TOR抑制剂对PI3K激酶与IRS有负反馈调节作用,在抑制m-TOR通路的同时反馈激活上游PI3K通路,所以m-TOR抑制剂单独使用临床上很难获得较好的疗效,m-TOR抑制剂在治疗肿瘤患者一般与其他抗肿瘤药物或细胞毒性药物联合使用。
PI3K/m-TOR双重选择性抑制剂则具备了PI3K型抑制剂和m-TOR型抑制剂的特点,对PI3K通路能够选择性的抑制,同时又对下游m-TOR通路进行抑制,此类抑制剂具有了PI3K、m-TOR抑制剂的优点,在适应症上较PI3K型或m-TOR型抑制剂更加广泛,在单独使用药物时能够取得较好的疗效。目前,虽然已经有PI3K/m-TOR双重选择性抑制剂进入了临床研究,并且取得了一定的成果,但是有大部分药物由于体内疗效较差、溶解度差、血浆清除速率过高、口服生物利用度差等问题,至今仍然没有药物临床上市,所以,解决现在PI3K/m-TOR双重抑制剂面临的问题,开发出具有生物活性更高、药效更好的新一代PI3K/m-TOR双重抑制剂是非常必要的。
发明内容
针对以上缺陷,本发明解决的技术问题是提供一种PI3K/m-TOR双重选择性抑制剂。
本发明化合物,其结构式为式Ⅰ所示:
其中,R
R
R
R
在本发明的一个实施方式中,R
在本发明的一个实施方式中,R
在本发明的一个实施方式中,R
本发明还提供本发明所述的化合物在制备PI3K/m-TOR抑制剂中的用途。
本发明化合物,可以用作PI3K/m-TOR双重选择性抑制剂。
本发明还提供本发明所述的化合物在制备抗肿瘤药物中的用途。
本发明化合物,可以靶向于PI3K/AKT/m-TOR信号通路,起到治疗肿瘤的作用。
在本发明的一个实施方式中,所述肿瘤为结肠癌、肺癌或宫颈癌。
本发明还提供一种药物组合物。
本发明所述药物组合物,由有效成分和药学上可接受的辅料组成,所述有效成分包含治疗有效量的本发明所述的化合物或其可药用的盐。
与现有技术相比,本发明具有如下有益效果:
本发明设计并合成了94个全新的以PI3K/m-TOR为靶点的化合物分子,这些化合物具有优越的抗肿瘤活性和生物安全性,是一种较理想的PI3K/m-TOR双重选择性抑制剂,在治疗结直肠癌、肺癌或宫颈癌方面有良好的前景。
附图说明
图1为化合物14h与PI3Kα/m-TOR蛋白的模拟结合模式图。其中,A为化合物14h与PI3Kα对接作用模式图;B为化合物14h与m-TOR对接作用模式图。
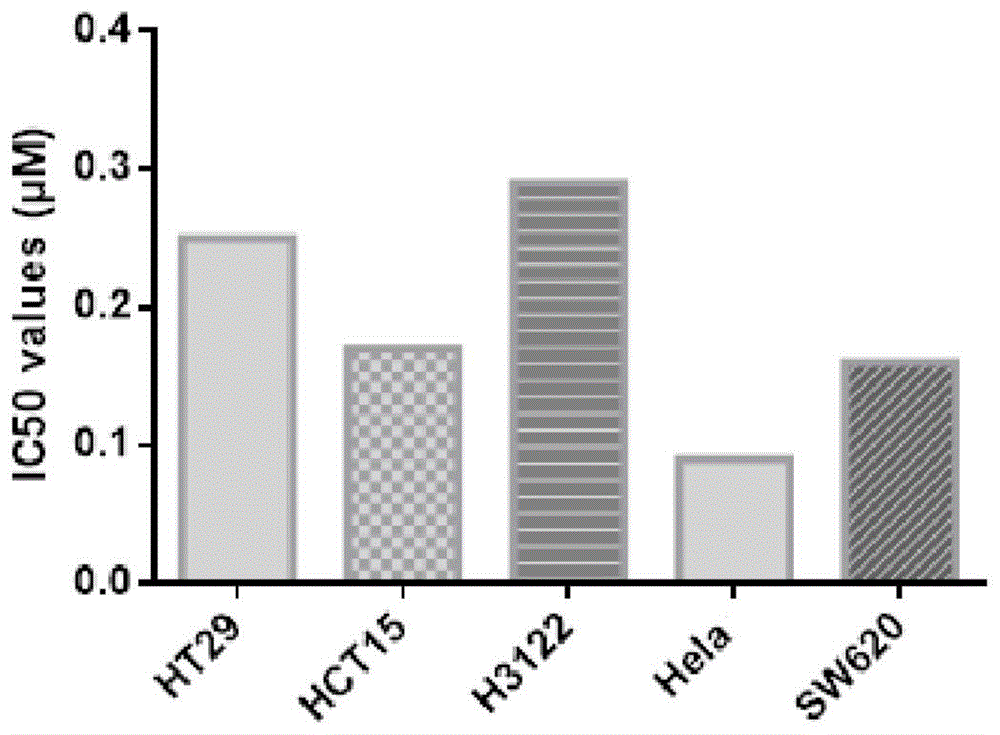
图2为化合物14h对不同肿瘤细胞抑制活性(IC
图3为化合物14h在SW620、Hela平板集落实验结果图。
图4为化合物14h在Hela、SW620移植瘤模型给药期间肿瘤体积图。其中,*P<0.1vsDMSO,**P<0.01vs DMSO;***P<0.001vs DMSO。
图5为化合物14h治疗Hela、SW620移植瘤小鼠30天后肿瘤照片。
图6为Hela、SW620移植瘤小鼠30天治疗期间体重变化示意图。
图7为Hela、SW620不同治疗组肿瘤重量示意图。其中,*P<0.1vs DMSO,**P<0.01vsDMSO;***P<0.001vs DMSO。
具体实施方式
本发明化合物,其结构式为式Ⅰ所示:
其中,R
R
R
R
在本发明的一个实施方式中,R
R
R
R
在本发明的一个实施方式中,R
在本发明的一个实施方式中,R
在一些具体的实施例中,本发明所述化合物的结构式为以下结构式中的任意一种:
/>
本发明还提供本发明所述的化合物在制备PI3K/m-TOR抑制剂中的用途。
本发明化合物,可以用作PI3K/m-TOR双重选择性抑制剂。
本发明还提供本发明所述的化合物在制备抗肿瘤药物中的用途。
本发明化合物,可以靶向于PI3K/AKT/m-TOR信号通路,起到治疗肿瘤的作用。
在本发明的一个实施方式中,所述肿瘤为结肠癌、肺癌或宫颈癌。
本发明还提供一种药物组合物。
本发明所述药物组合物,由有效成分和药学上可接受的辅料组成,所述有效成分包含治疗有效量的本发明所述的化合物或其可药用的盐。
下面结合实施例对本发明的具体实施方式做进一步的描述,并不因此将本发明限制在所述的实施例范围之中。
实施例1化合物的合成
合成路线为:
试剂与条件:(a)POCl
试剂与条件:(a)POCl
中间体化合物2(6-溴-4-氯-3-硝基喹啉)的合成方法
在氩气条件下,将6-溴-3-硝基喹啉-4-醇(10g,37.17mmol)加入反应瓶中,于0℃加入POCl
中间体化合物3的合成通法N1
将中间体化合物2(15.00mmol),加入不同取代基的芳胺(15.00mmol),溶于DMF(20mL)中室温下搅拌反应过夜,TLC监测反应终点。反应完毕后,将反应液倾入200mL冰水中,析出大量固体,抽滤,滤饼用水洗3次,烘干后得到粗品,经柱层析得到纯品,中间体化合物3。
中间体化合物3a(6-溴-N-(4-氟苯基)-3-硝基喹啉-4-胺)的合成
按照合成通法N1,由化合物2和4-氟苯胺制备而成。产率68.22%,黄色固体。
中间体化合物3b(6-溴-N-(4-甲氧基苯基)-3-硝基喹啉-4-胺)的合成
按照合成通法N1,由化合物2和4-甲氧基胺制备而成。产率71.13%,黄棕色固体。
中间体化合物3c(2-(4-((6-溴-3-硝基喹啉-4-基)氨基)苯基)-2-甲基丙腈)的合成
按照合成通法N1,由化合物2和2-(4-氨基苯基)-2-甲基丙腈制备而成。产率68.50%,黄棕色固体。
中间体化合物4的合成通法N2
将中间体化合物3(10.00mmol),加入NH4Cl(30.00mmol),Fe粉(50.00mmol),于EtOH/H2O(V1/V2=2/1;20mL)升温至回流反应,反应3~5h。TLC监测反应终点。反应完毕后,待反应冷却至室温,用抽滤反应液(硅藻土),除去铁粉,滤饼用EA洗2次,真空减压蒸除溶剂,粗品中加入200mL EA,200mL去离子水,萃取两次,合并有机层,减压蒸除溶剂得到粗品经柱层析得到纯品,中间体化合物4。
中间体化合物4a(6-溴-N4-(4-氟苯基)喹啉-3,4-二胺)的合成
按照合成通法N2,由化合物3a制备而成。产率51.35%,棕黄色固体。
中间体化合物4b(6-溴-N4-(4-甲氧基苯基)喹啉-3,4-二胺)的合成
按照合成通法N2,由化合物3b制备而成。产率62.28%,浅黄色固体。
中间体化合物4c(2-(4-((3-氨基-6-溴喹啉-4-基)氨基)苯基)-2-甲基丙腈)的合成
按照合成通法N2,由化合物3c制备而成。产率63.39%,棕黑色固体。
中间体化合物5的合成通法N3
将中间体化合物4(15.00mmol),加入CDI(45.00mmol),于AcOH升温至回流反应,反应过夜。TLC监测反应终点。反应完毕后,待反应冷却至室温,加入300mL EA,300mL去离子水,萃取两次,合并有机层,减压蒸除溶剂得到粗品经柱层析得到纯品,中间体化合物5。
中间体化合物5a(8-溴-1-(4-氟苯基)-2-甲基-1H-咪唑并[4,5-c]喹啉)的合成
按照合成通法N3,由化合物4a制备而成。产率73.21%,浅棕白色固体。
中间体化合物5b(8-溴-1-(4-甲氧基苯基)-2-甲基-1H-咪唑并[4,5-c]喹啉)的合成
按照合成通法N3,由化合物4b制备而成。产率68.29%,浅褐色固体。
中间体化合物5c(2-(4-(8-溴-2-甲基-1H-咪唑并[4,5-c]喹啉-1-基)苯基)-2-甲基丙腈)的合成
按照合成通法N3,由化合物4c制备而成。产率65.21%,棕褐色固体。
终产物的制备通用方法N4
将中间体化合物5(0.50mmol),[1,1'-双(二苯基膦基)二茂铁]二氯化钯(0.05mmol),AcOK(1.5mmol),不同类型硼酸酯取代物(0.60mmol)于二氧六环/H
目标化合物6a(1-(4-(1-(4-氟苯基)-2-甲基-1H-咪唑并[4,5-c]喹啉-8-基)苯基)乙-1-酮)的合成
按照合成通法N4,由化合物5a和对乙酰基苯硼酸制备而成。产率48.23%,浅白色固体。
目标化合物6b(1,8-双(4-氟苯基)-2-甲基-1H-咪唑并[4,5-c]喹啉)的合成
按照合成通法N4,由化合物5a和对氟苯硼酸制备而成。产率51.02%,浅褐色固体。
目标化合物6c(8-(4-氯苯基)-1-(4-氟苯基)-2-甲基-1H-咪唑并[4,5-c]喹啉)的合成
按照合成通法N4,由化合物5a和对氯苯硼酸制备而成。产率42.13%,浅褐色固体。
目标化合物6d(4-(1-(4-氟苯基)-2-甲基-1H-咪唑并[4,5-c]喹啉-8-基)-N-甲基苯甲酰胺)的合成
按照合成通法N4,由化合物5a和4-(N-甲基甲酰氨)苯基硼酸制备而成。产率45.51%,褐色固体。
目标化合物6e(4-(1-(4-氟苯基)-2-甲基-1H-咪唑并[4,5-c]喹啉-8-基)苄腈)的合成
按照合成通法N4,由化合物5a和4-氰基苯硼酸制备而成。产率53.37%,类白色固体。
目标化合物6f(1-(4-氟苯基)-2-甲基-8-(4-(三氟甲基)苯基)-1H-咪唑并[4,5-c]喹啉)的合成
按照合成通法N4,由化合物5a和4-三氟甲基苯硼酸制备而成。产率50.08%,类褐色固体。
目标化合物6g(1-(4-氟苯基)-2-甲基-8-(对甲苯基)-1H-咪唑并[4,5-c]喹啉)的合成
按照合成通法N4,由化合物5a和4-甲基苯硼酸制备而成。产率50.08%,类褐色固体。
目标化合物6h(4-(1-(4-氟苯基)-2-甲基-1H-咪唑并[4,5-c]喹啉-8-基)苯甲酸甲酯)的合成
按照合成通法N4,由化合物5a和4-甲氧羰基苯硼酸制备而成。产率43.51%,褐色固体。
目标化合物6i(4-(1-(4-氟苯基)-2-甲基-1H-咪唑并[4,5-c]喹啉-8-基)苯酚)的合成
按照合成通法N4,由化合物5a和4-羟基苯硼酸制备而成。产率52.72%,浅灰色固体。
目标化合物6j(1-(4-氟苯基)-8-(4-甲氧基苯基)-2-甲基-1H-咪唑并[4,5-c]喹啉)的合成
按照合成通法N4,由化合物5a和4-甲氧基苯硼酸制备而成。产率55.17%,浅褐色固体。
目标化合物6k((5-(1-(4-氟苯基)-2-甲基-1H-咪唑并[4,5-c]喹啉-8-基)-2-甲氧基苯基)甲醇)的合成
按照合成通法N4,由化合物5a和(3-羟甲基-4-甲氧基苯基)硼酸制备而成。产率50.02%,浅褐色固体。
目标化合物6l(8-(3,5-双(三氟甲基)苯基)-1-(4-氟苯基)-2-甲基-1H-咪唑并[4,5-c]喹啉)的合成
按照合成通法N4,由化合物5a和3,5-双(三氟甲基)苯硼酸制备而成。产率47.23%,浅褐色固体。
目标化合物6m(1-(4-氟苯基)-2-甲基-8-(3,4,5-三氟苯基)-1H-咪唑并[4,5-c]喹啉)的合成
按照合成通法N4,由化合物5a和3,4,5-三氟苯硼酸制备而成。产率42.33%,灰黑色固体。
目标化合物6n(8-(3,5-二甲基苯基)-1-(4-氟苯基)-2-甲基-1H-咪唑并[4,5-c]喹啉)的合成
按照合成通法N4,由化合物5a和3,5-二甲基苯硼酸制备而成。产率53.78%,浅灰色固体。
目标化合物6o(4-(1-(4-氟苯基)-2-甲基-1H-咪唑并[4,5-c]喹啉-8-基)苯胺)的合成
按照合成通法N4,由化合物5a和4-胺基苯硼酸制备而成。产率51.36%,浅褐色固体。
目标化合物6p(5-(1-(4-氟苯基)-2-甲基-1H-咪唑并[4,5-c]喹啉-8-基)嘧啶-2-胺)的合成
按照合成通法N4,由化合物5a和2-氨基嘧啶-5-硼酸频哪醇酯制备而成。产率48.78%,浅褐色固体。
目标化合物6q(5-(1-(4-氟苯基)-2-甲基-1H-咪唑并[4,5-c]喹啉-8-基)吡啶-2-胺)的合成
按照合成通法N4,由化合物5a和2-氨基吡啶-5-硼酸频哪醇酯制备而成。产率50.19%,褐色固体。
目标化合物6r(1-(4-氟苯基)-8-(6-甲氧基吡啶-3-基)-2-甲基-1H-咪唑并[4,5-c]喹啉)的合成
按照合成通法N4,由化合物5a和2-甲氧基-5-吡啶硼酸制备而成。产率48.38%,浅褐色固体。
目标化合物6s(4-(1-(4-氟苯基)-2-甲基-1H-咪唑并[4,5-c]喹啉-8-基)-3,5-二甲基异恶唑)的合成
按照合成通法N4,由化合物5a和3,5-二甲基异恶唑-4-硼酸制备而成。产率45.66%,棕褐色固体。
目标化合物6t(1-(4-氟苯基)-2-甲基-8-(1-甲基-1H-吡唑-4-基)-1H-咪唑并[4,5-c]喹啉)的合成
按照合成通法N4,由化合物5a和1-甲基-1H-吡唑-4-硼酸制备而成。产率51.57%,浅褐色固体。
目标化合物6u(1-(4-氟苯基)-2-甲基-8-(喹啉-3-基)-1H-咪唑并[4,5-c]喹啉)的合成
按照合成通法N4,由化合物5a和:喹啉-3-硼酸制备而成。产率51.57%,浅褐色固体。
目标化合物6v(1-(4-氟苯基)-2-甲基-8-(萘-2-基)-1H-咪唑并[4,5-c]喹啉)的合成
按照合成通法N4,由化合物5a和2-萘硼酸制备而成。产率48.78%,褐色固体。
目标化合物6w(4-(5-(1-(4-氟苯基)-2-甲基-1H-咪唑并[4,5-c]喹啉-8-基)嘧啶-2-基)吗啉)的合成
按照合成通法N4,由化合物5a和2-吗啉基嘧啶-5-基硼酸制备而成。产率51.71%,浅褐色固体。
目标化合物6x(1-(4-氟苯基)-2-甲基-8-(1H-吡咯并[2,3-b]吡啶-5-基)-1H-咪唑并[4,5-c]喹啉)的合成
按照合成通法N4,由化合物5a和7-氮杂吲哚-5-硼酸频哪醇酯制备而成。产率49.82%,褐色固体。
目标化合物6y(1-(4-氟苯基)-8-(1H-吲哚-5-基)-2-甲基-1H-咪唑并[4,5-c]喹啉)的合成
按照合成通法N4,由化合物5a和5-吲哚硼酸制备而成。产率45.31%,浅褐色固体。
目标化合物7a(1-(4-(1-(4-甲氧基苯基)-2-甲基-1H-咪唑并[4,5-c]喹啉-8-基)苯基)乙-1-酮)的合成
按照合成通法N4,由化合物5b和对乙酰基苯硼酸制备而成。产率51.27%,浅灰色固体。
目标化合物7b(8-(4-氟苯基)-1-(4-甲氧基苯基)-2-甲基-1H-咪唑并[4,5-c]喹啉)的合成
按照合成通法N4,由化合物5b和对氟苯硼酸制备而成。产率51.32%,浅褐色固体。
目标化合物7c(8-(4-氯苯基)-1-(4-甲氧基苯基)-2-甲基-1H-咪唑并[4,5-c]喹啉)的合成
按照合成通法N4,由化合物5b和对氯苯硼酸制备而成。产率43.07%,浅褐色固体。
目标化合物7d(4-(1-(4-甲氧基苯基)-2-甲基-1H-咪唑并[4,5-c]喹啉-8-基)-N-甲基苯甲酰胺)的合成
按照合成通法N4,由化合物5b和4-(N-甲基甲酰氨)苯基硼酸制备而成。
产率43.23%,灰褐色固体。
目标化合物7e(4-(1-(4-甲氧基苯基)-2-甲基-1H-咪唑并[4,5-c]喹啉-8-基)苄腈)的合成
按照合成通法N4,由化合物5b和4-氰基苯硼酸制备而成。产率54.31%,灰白色固体。
目标化合物7f(1-(4-甲氧基苯基)-2-甲基-8-(4-(三氟甲基)苯基)-1H-咪唑并[4,5-c]喹啉)的合成
按照合成通法N4,由化合物5b和4-三氟甲基苯硼酸制备而成。产率52.71%,类褐色固体。
目标化合物7g(1-(4-甲氧基苯基)-2-甲基-8-(对甲苯基)-1H-咪唑并[4,5-c]喹啉)的合成
按照合成通法N4,由化合物5b和4-甲基苯硼酸制备而成。产率55.13%,褐色固体。
目标化合物7h(4-(1-(4-甲氧基苯基)-2-甲基-1H-咪唑并[4,5-c]喹啉-8-基)苯甲酸甲酯)的合成
按照合成通法N4,由化合物5b和4-甲氧羰基苯硼酸制备而成。产率48.32%,浅褐色固体。
目标化合物7i(4-(1-(4-甲氧基苯基)-2-甲基-1H-咪唑并[4,5-c]喹啉-8-基)苯酚)的合成
按照合成通法N4,由化合物5b和4-羟基苯硼酸制备而成。产率49.37%,浅灰色固体。
目标化合物7j(1,8-双(4-甲氧基苯基)-2-甲基-1H-咪唑并[4,5-c]喹啉)的合成
按照合成通法N4,由化合物5b和4-甲氧基苯硼酸制备而成。产率57.81%,浅褐色固体。
目标化合物7k((2-甲氧基-5-(1-(4-甲氧基苯基)-2-甲基-1H-咪唑并[4,5-c]喹啉-8-基)苯基)甲醇)的合成
按照合成通法N4,由化合物5b和(3-羟甲基-4-甲氧基苯基)硼酸制备而成。产率51.72%,褐色固体。
目标化合物7l(8-(3,5-双(三氟甲基)苯基)-1-(4-甲氧基苯基)-2-甲基-1H-咪唑并[4,5-c]喹啉)的合成
按照合成通法N4,由化合物5b和3,5-双(三氟甲基)苯硼酸制备而成。产率43.25%,褐色固体。
目标化合物7m(1-(4-甲氧基苯基)-2-甲基-8-(3,4,5-三氟苯基)-1H-咪唑并[4,5-c]喹啉)的合成
按照合成通法N4,由化合物5b和3,4,5-三氟苯硼酸制备而成。产率45.07%,褐色固体。
目标化合物7n(8-(3,5-二甲基苯基)-1-(4-甲氧基苯基)-2-甲基-1H-咪唑并[4,5-c]喹啉)的合成
按照合成通法N4,由化合物5b和3,5-二甲基苯硼酸制备而成。产率50.18%,浅褐色固体。
目标化合物7o(4-(1-(4-甲氧基苯基)-2-甲基-1H-咪唑并[4,5-c]喹啉-8-基)苯胺)的合成
按照合成通法N4,由化合物5b和4-胺基苯硼酸制备而成。产率48.78%,浅褐色固体。
目标化合物7p(5-(1-(4-甲氧基苯基)-2-甲基-1H-咪唑并[4,5-c]喹啉-8-基)嘧啶-2-胺)的合成
按照合成通法N4,由化合物5b和2-氨基嘧啶-5-硼酸频哪醇酯制备而成。产率50.03%,褐色固体。
目标化合物7q(5-(1-(4-甲氧基苯基)-2-甲基-1H-咪唑并[4,5-c]喹啉-8-基)吡啶-2-胺)的合成
按照合成通法N4,由化合物5b和2-氨基吡啶-5-硼酸频哪醇酯制备而成。产率48.75%,浅褐色固体。
目标化合物7r(1-(4-甲氧基苯基)-8-(6-甲氧基吡啶-3-基)-2-甲基-1H-咪唑并[4,5-c]喹啉)的合成
按照合成通法N4,由化合物5b和2-甲氧基-5-吡啶硼酸制备而成。产率46.12%,褐色固体。
目标化合物7s(4-(1-(4-甲氧基苯基)-2-甲基-1H-咪唑并[4,5-c]喹啉-8-基)-3,5-二甲基异恶唑)的合成
按照合成通法N4,由化合物5b和3,5-二甲基异恶唑-4-硼酸制备而成。产率43.21%,褐色固体。
目标化合物7t(1-(4-甲氧基苯基)-2-甲基-8-(1-甲基-1H-吡唑-4-基)-1H-咪唑并[4,5-c]喹啉)的合成
按照合成通法N4,由化合物5b和1-甲基-1H-吡唑-4-硼酸制备而成。产率51.29%,褐色固体。
目标化合物7u(1-(4-甲氧基苯基)-2-甲基-8-(喹啉-3-基)-1H-咪唑并[4,5-c]喹啉)的合成
按照合成通法N4,由化合物5b和喹啉-3-硼酸制备而成。产率48.31%,灰褐色固体。
目标化合物7v(1-(4-甲氧基苯基)-2-甲基-8-(萘-2-基)-1H-咪唑并[4,5-c]喹啉)的合成
按照合成通法N4,由化合物5b和2-萘硼酸制备而成。产率53.28%,褐色固体。
目标化合物7w(4-(5-(1-(4-甲氧基苯基)-2-甲基-1H-咪唑并[4,5-c]喹啉-8-基)嘧啶-2-基)吗啉)的合成
按照合成通法N4,由化合物5b和2-吗啉基嘧啶-5-基硼酸制备而成。产率56.51%,浅褐色固体。
目标化合物7x(1-(4-甲氧基苯基)-2-甲基-8-(1H-吡咯并[2,3-b]吡啶-5-基)-1H-咪唑并[4,5-c]喹啉)的合成
按照合成通法N4,由化合物5b和7-氮杂吲哚-5-硼酸频哪醇酯制备而成。产率52.18%,浅褐色固体。
目标化合物7y(8-(1H-吲哚-5-基)-1-(4-甲氧基苯基)-2-甲基-1H-咪唑并[4,5-c]喹啉)的合成
按照合成通法N4,由化合物5b和5-吲哚硼酸制备而成。产率48.11%,褐色固体。
目标化合物8a(2-(4-(8-(4-乙酰基苯基)-2-甲基-1H-咪唑并[4,5-c]喹啉-1-基)苯基)-2-甲基丙腈)的合成
按照合成通法N4,由化合物5c和对乙酰基苯硼酸制备而成。产率53.38%,浅褐色固体。
目标化合物8b(2-(4-(8-(4-氟苯基)-2-甲基-1H-咪唑并[4,5-c]喹啉-1-基)苯基)-2-甲基丙腈)的合成
按照合成通法N4,由化合物5c和对氟苯硼酸制备而成。产率46.88%,棕褐色固体。
目标化合物8c(2-(4-(8-(4-氯苯基)-2-甲基-1H-咪唑并[4,5-c]喹啉-1-基)苯基)-2-甲基丙腈)的合成
按照合成通法N4,由化合物5c和对氯苯硼酸制备而成。产率42.58%,褐色固体。
目标化合物8d(4-(1-(4-(2-氰基丙烷-2-基)苯基)-2-甲基-1H-咪唑并[4,5-c]喹啉-8-基)-N-甲基苯甲酰胺)的合成
按照合成通法N4,由化合物5c和4-(N-甲基甲酰氨)苯基硼酸制备而成。产率46.01%,灰褐色固体。
目标化合物8e(4-(1-(4-(2-氰基丙烷-2-基)苯基)-2-甲基-1H-咪唑并[4,5-c]喹啉-8-基)苄腈)的合成
按照合成通法N4,由化合物5c和4-氰基苯硼酸制备而成。产率51.77%,灰色固体。
目标化合物8f(2-甲基-2-(4-(2-甲基-8-(4-(三氟甲基)苯基)-1H-咪唑并[4,5-c]喹啉-1-基)苯基)丙腈)的合成
按照合成通法N4,由化合物5c和4-三氟甲基苯硼酸制备而成。产率53.29%,灰褐色固体。
目标化合物8g(2-甲基-2-(4-(2-甲基-8-(对甲苯基)-1H-咪唑并[4,5-c]喹啉-1-基)苯基)丙腈)的合成
按照合成通法N4,由化合物5c和4-甲基苯硼酸制备而成。产率57.26%,浅褐色固体。
目标化合物8h(4-(1-(4-(2-氰基丙烷-2-基)苯基)-2-甲基-1H-咪唑并[4,5-c]喹啉-8-基)苯甲酸甲酯)的合成
按照合成通法N4,由化合物5c和4-甲氧羰基苯硼酸制备而成。产率45.17%,浅褐色固体。
目标化合物8i(2-(4-(8-(4-羟苯基)-2-甲基-1H-咪唑并[4,5-c]喹啉-1-基)苯基)-2-甲基丙腈)的合成
按照合成通法N4,由化合物5c和4-羟基苯硼酸制备而成。产率48.25%,浅灰色固体。
目标化合物8j(2-(4-(8-(4-甲氧基苯基)-2-甲基-1H-咪唑并[4,5-c]喹啉-1-基)苯基)-2-甲基丙腈)的合成
按照合成通法N4,由化合物5c和4-甲氧基苯硼酸制备而成。产率54.37%,褐色固体。
目标化合物8k(2-(4-(8-(3-(羟甲基)-4-甲氧基苯基)-2-甲基-1H-咪唑并[4,5-c]喹啉-1-基)苯基)-2-甲基丙腈)的合成
按照合成通法N4,由化合物5c和(3-羟甲基-4-甲氧基苯基)硼酸制备而成。产率50.11%,浅褐色固体。
目标化合物8l(2-(4-(8-(3,5-双(三氟甲基)苯基)-2-甲基-1H-咪唑并[4,5-c]喹啉-1-基)苯基)-2-甲基丙腈)的合成
按照合成通法N4,由化合物5c和3,5-双(三氟甲基)苯硼酸制备而成。产率41.71%,褐色固体。
目标化合物8m(2-甲基-2-(4-(2-甲基-8-(3,4,5-三氟苯基)-1H-咪唑并[4,5-c]喹啉-1-基)苯基)丙腈)的合成
按照合成通法N4,由化合物5c和3,4,5-三氟苯硼酸制备而成。产率47.12%,浅褐色固体。
目标化合物8n(2-(4-(8-(3,5-二甲基苯基)-2-甲基-1H-咪唑并[4,5-c]喹啉-1-基)苯基)-2-甲基丙腈)的合成
按照合成通法N4,由化合物5c和3,5-二甲基苯硼酸制备而成。产率52.87%,浅褐色固体。
目标化合物8o(2-(4-(8-(4-氨基苯基)-2-甲基-1H-咪唑并[4,5-c]喹啉-1-基)苯基)-2-甲基丙腈)的合成
按照合成通法N4,由化合物5c和4-胺基苯硼酸制备而成。产率46.15%,褐色固体。
目标化合物8p(2-(4-(8-(2-氨基嘧啶-5-基)-2-甲基-1H-咪唑并[4,5-c]喹啉-1-基)苯基)-2-甲基丙腈)的合成
按照合成通法N4,由化合物5c和2-氨基嘧啶-5-硼酸频哪醇酯制备而成。产率51.16%,灰褐色固体。
目标化合物8q(2-(4-(8-(6-氨基吡啶-3-基)-2-甲基-1H-咪唑并[4,5-c]喹啉-1-基)苯基)-2-甲基丙腈)的合成
按照合成通法N4,由化合物5c和2-氨基吡啶-5-硼酸频哪醇酯制备而成。产率46.34%,褐色固体。
目标化合物8r(2-(4-(8-(6-甲氧基吡啶-3-基)-2-甲基-1H-咪唑并[4,5-c]喹啉-1-基)苯基)-2-甲基丙腈)的合成
按照合成通法N4,由化合物5c和2-甲氧基-5-吡啶硼酸制备而成。产率42.91%,浅褐色固体。
目标化合物8s(2-(4-(8-(3,5-二甲基异恶唑-4-基)-2-甲基-1H-咪唑并[4,5-c]喹啉-1-基)苯基)-2-甲基丙腈)的合成
按照合成通法N4,由化合物5c和3,5-二甲基异恶唑-4-硼酸制备而成。产率47.81%,灰褐色固体。
目标化合物8t(2-甲基-2-(4-(2-甲基-8-(1-甲基-1H-吡唑-4-基)-1H-咪唑并[4,5-c]喹啉-1-基)苯基)丙腈)的合成
按照合成通法N4,由化合物5c和1-甲基-1H-吡唑-4-硼酸制备而成。产率53.13%,浅褐色固体。
目标化合物8u(2-甲基-2-(4-(2-甲基-8-(喹啉-3-基)-1H-咪唑并[4,5-c]喹啉-基)苯基)丙腈)的合成
按照合成通法N4,由化合物5c和喹啉-3-硼酸制备而成。产率52.37%,褐色固体。
目标化合物8v(2-甲基-2-(4-(2-甲基-8-(萘-2-基)-1H-咪唑并[4,5-c]喹啉-1-基)苯基)丙腈)的合成
按照合成通法N4,由化合物5c和2-萘硼酸制备而成。产率50.97%,浅褐色固体。
目标化合物8w(2-甲基-2-(4-(2-甲基-8-(2-吗啉嘧啶-5-基)-1H-咪唑并[4,5-c]喹啉-1-基)苯基)丙腈)的合成
按照合成通法N4,由化合物5c和2-吗啉基嘧啶-5-基硼酸制备而成。产率51.88%,褐色固体。
目标化合物8x(2-甲基-2-(4-(2-甲基-8-(1H-吡咯并[2,3-b]吡啶-5-基)-1H-咪唑并[4,5-c]喹啉-1-基)苯基)丙腈)的合成
按照合成通法N4,由化合物5c和7-氮杂吲哚-5-硼酸频哪醇酯制备而成。产率55.71%,浅褐色固体。
目标化合物8y(2-(4-(8-(1H-吲哚-5-基)-2-甲基-1H-咪唑并[4,5-c]喹啉-1-基)苯基)-2-甲基丙腈)的合成
按照合成通法N4,由化合物5c和5-吲哚硼酸制备而成。产率48.12%,浅褐色固体。
目标化合物8z(2-(4-(8-(1H-苯并[d]咪唑-5-基)-2-甲基-1H-咪唑并[4,5-c]喹啉-1-基)苯基)-2-甲基丙腈)的合成
按照合成通法N4,由化合物5c和1H-苯并咪唑-5-硼酸频哪醇酯制备而成。产率45.39%,褐色固体。
目标化合物14a(2-甲基-8-(1H-吡咯并[2,3-b]吡啶-5-基)-1-(4-(三氟甲基)苯基)-1H-咪唑并[4,5-c]喹啉)-2-甲基丙腈)的合成
按照合成通法N4,由化合物13a和7-氮杂吲哚-5-硼酸频哪醇酯制备而成。产率48.25%,浅褐色固体。
目标化合物14b(1,2-二甲基-8-(1H-吡咯并[2,3-b]吡啶-5-基)-1H-咪唑并[4,5-c]喹啉)的合成
按照合成通法N4,由化合物13b和7-氮杂吲哚-5-硼酸频哪醇酯制备而成。产率42.33%,浅褐色固体。
目标化合物14c(1-环丙基-2-甲基-8-(1H-吡咯并[2,3-b]吡啶-5-基)-1H-咪唑并[4,5-c]喹啉)的合成
按照合成通法N4,由化合物13c和7-氮杂吲哚-5-硼酸频哪醇酯制备而成。产率45.17%,褐色固体。
目标化合物14d((S)-2-甲基-1-(1-苯乙基)-8-(1H-吡咯并[2,3-b]吡啶-5-基)-1H-咪唑并[4,5-c]喹啉)的合成
按照合成通法N4,由化合物13d和7-氮杂吲哚-5-硼酸频哪醇酯制备而成。产率46.29%,浅褐色固体。
目标化合物14e((R)-2-甲基-1-(1-苯乙基)-8-(1H-吡咯并[2,3-b]吡啶-5-基)-1H-咪唑并[4,5-c]喹啉)的合成
按照合成通法N4,由化合物13e和7-氮杂吲哚-5-硼酸频哪醇酯制备而成。产率45.11%,褐色固体。
目标化合物14f(4-(2-甲基-8-(1H-吡咯并[2,3-b]吡啶-5-基)-1H-咪唑并[4,5-c]喹啉-1-基)苄腈)的合成
按照合成通法N4,由化合物13f和7-氮杂吲哚-5-硼酸频哪醇酯制备而成。产率47.21%,浅褐色固体。
目标化合物14g(2-(4-(2-甲基-8-(1H-吡咯并[2,3-b]吡啶-5-基)-1H-咪唑并[4,5-c]喹啉-1-基)苯基)乙腈)的合成
按照合成通法N4,由化合物13g和7-氮杂吲哚-5-硼酸频哪醇酯制备而成。产率43.69%,浅褐色固体。
目标化合物14h(2-甲基-2-(5-(2-甲基-8-(1H-吡咯并[2,3-b]吡啶-5-基)-1H-咪唑并[4,5-c]喹啉-1-基)吡啶-2-基)丙腈)的合成
按照合成通法N4,由化合物13h和7-氮杂吲哚-5-硼酸频哪醇酯制备而成。产率52.17%,浅褐色固体。
目标化合物14i(2-甲基-8-(1H-吡咯并[2,3-b]吡啶-5-基)-1-((四氢-2H-吡喃-4-基)甲基)-1H-咪唑并[4,5-c]喹啉)的合成
按照合成通法N4,由化合物13i和7-氮杂吲哚-5-硼酸频哪醇酯制备而成。产率51.13%,浅褐色固体。
目标化合物14j(2-甲基-8-(1H-吡咯并[2,3-b]吡啶-5-基)-1-((四氢呋喃-3-基)甲基)-1H-咪唑并[4,5-c]喹啉)的合成
按照合成通法N4,由化合物13j和7-氮杂吲哚-5-硼酸频哪醇酯制备而成。产率50.98%,浅褐色固体。
目标化合物14k(2-甲基-1-苯基-8-(1H-吡咯并[2,3-b]吡啶-5-基)-1H-咪唑并[4,5-c]喹啉)的合成
按照合成通法N4,由化合物13k和7-氮杂吲哚-5-硼酸频哪醇酯制备而成。产率53.13%,褐色固体。
目标化合物14l((R)-1-(1-(4-氟苯基)乙基)-2-甲基-8-(1H-吡咯并[2,3-b]吡啶-5-基)-1H-咪唑并[4,5-c]喹啉)的合成
按照合成通法N4,由化合物13l和7-氮杂吲哚-5-硼酸频哪醇酯制备而成。产率48.37%,浅褐色固体。
目标化合物14m((S)-1-(1-(4-氟苯基)乙基)-2-甲基-8-(1H-吡咯并[2,3-b]吡啶-5-基)-1H-咪唑并[4,5-c]喹啉)的合成
按照合成通法N4,由化合物13m和7-氮杂吲哚-5-硼酸频哪醇酯制备而成。产率46.18%,褐色固体。
目标化合物14n(1-(5-氟吡啶-2-基)-2-甲基-8-(1H-吡咯并[2,3-b]吡啶-5-基)-1H-咪唑并[4,5-c]喹啉)的合成
按照合成通法N4,由化合物13n和7-氮杂吲哚-5-硼酸频哪醇酯制备而成。产率46.18%,棕褐色固体。
目标化合物14o(1-苄基-2-甲基-8-(1H-吡咯并[2,3-b]吡啶-5-基)-1H-咪唑并[4,5-c]喹啉)的合成
按照合成通法N4,由化合物13o和7-氮杂吲哚-5-硼酸频哪醇酯制备而成。产率51.39%,浅褐色固体。
目标化合物14p(2-甲基-8-(1H-吡咯并[2,3-b]吡啶-5-基)-1-(6-(三氟甲基)吡啶-3-基)-1H-咪唑并[4,5-c]喹啉)的合成
按照合成通法N4,由化合物13p和7-氮杂吲哚-5-硼酸频哪醇酯制备而成。产率46.17%,褐色固体。
目标化合物14q(4-(4-(2-甲基-8-(1H-吡咯并[2,3-b]吡啶-5-基)-1H-咪唑并[4,5-c]喹啉-1-基)苯基)吗啉)的合成
按照合成通法N4,由化合物13q和7-氮杂吲哚-5-硼酸频哪醇酯制备而成。产率48.28%,棕褐色固体。
目标化合物14r(2-(4-(7-氟-2-甲基-8-(1H-吡咯并[2,3-b]吡啶-5-基)-1H-咪唑并[4,5-c]喹啉-1-基)苯基)-2-甲基丙腈)的合成
按照合成通法N4,由化合物13r和7-氮杂吲哚-5-硼酸频哪醇酯制备而成。产率47.27%,浅褐色固体。
实施例2目标化合物对肿瘤细胞的抑制活性
本实验所使用的肿瘤细胞株为结肠癌细胞株HT29、HCT15、SW620,肺癌细胞株H3122,宫颈癌细胞株Hela。,以上肿瘤细胞株购自于美国ATCC公司。细胞培养条件参照ATCC培养规则,培养基为Gibco公司提供RPMI 1640、L-15、DMEM;37℃,5%CO
采用MTT法进行肿瘤细胞抑制活性的评估。MTT中的主要成分为3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐,可以与成活的细胞线粒体中产生的琥珀酸脱氢酶发生作用,生成不溶于水的的甲瓒(Formazan),以此现象来评估对细胞活力的影响。将细胞以2~4×10
表1
/>
/>
从实验结果可以看出,首先我们固定R
阳性药PI-103,BEZ235的结构式为:
实施例3目标化合物对PI3K/m-TOR激酶抑制活性测试
目标化合物对m-TOR和PI3K的抑制活性分别采用Kinase-Glo Plus Luminescentassay和Lance ULtra assay方法测定。对化合物普筛所测试的激酶为PI3Kα,PI3Kδ及m-TOR,阳性对照选用PI-103和BEZ235,测试化合物浓度为50nM下对激酶的抑制率,测试结果如表2所示。
表2
-:未测试。
从测试结果可以看出,化合物14h对PI3Kα,PI3Kδ及m-TOR抑制率明显优于其他分子,并且化合物8q,8x均表现出了优于阳性药的抑制率。从实验结果,我们分析得出,当R
对化合物14h在m-TOR和PI3K I类激酶的IC
表3
所有实验结果均代表三次独立重复实验。
从测试结果可以看出,化合物14h明显优于阳性对照PI-103、BEZ235,对PI3Kα、PI3Kδ、m-TOR激酶的IC50值分别为3.5nM,4.6nM,21.3nM,在m-TOR和PI3K I通路中具有明显的选择性抑制作用,间接证明了化合物14h拥有良好的体外抗肿瘤活性。
实施例4目标化合物分子14h分子对接
为了预测化合物14h与PI3Kα/m-TOR蛋白的结合模式,我们使用了GOLD5.0(GOLD5.0,laxoSmithKline,CCDC,UK)进行了分子对接分析。PI3Kα蛋白晶体结构(PDBcode:4JPS),m-TOR蛋白晶体结构(PDB code:4JT6)从RCSB蛋白数据库提供。在分子对接时,除去蛋白晶体中的水分子并添加氢原子,对接binding site值为
从图中可以观察到,化合物分子14h与目标PI3Kα/m-TOR蛋白结合相互作用的模拟示意图。化合物14h可以和PI3Kα/m-TOR蛋白有关键性基团作用,对接结果显示能与蛋白ATP口袋紧密结合。分子对接结果显示,在与PI3Kα蛋白对中可以看到,氮杂吲哚环上NH原子与Asp933有关键性氢键作用,与lLE932有关键性氢键作用,喹啉母核与Cys838、Met922有π-π堆叠作用,与Val850有关键性氢键作用,咪唑环上甲基与Trp780有疏水作用,这些关键性作用基团可能与化合物14h抑制PI3Kα激酶活性密切相关,与体外激酶测试结果相符合;在m-TOR蛋白对接中可以观察到,喹啉苯环与trp2239有π-π堆叠作用,喹啉环上的氮原子与跟val2240有关键性氢键作用,N杂吲哚异喹啉环上的N原子与glu2190有关键性氢键作用,这可能是提高对m-TOR活性抑制的关键性因素;以上结果显示,喹啉环中引入N杂吲哚环和2-(5-氨基吡啶-2-基)-2-甲基丙腈结构能与目标蛋白产生关键性作用,分子对接结果与激酶测试和MTT测试结果的SAR结果保持一致。
实施例5目标化合物14h对正常细胞毒性的研究
为了测定目标化合物分子14h对正常细胞的毒性,我们选取了人正常肝细胞LO2进行了研究,选取PI-103和BEZ235作为阳性药对照组,测定了其在LO2中的IC50值,其检测方法同实施例2,检测结果见表4。
表4
实验结果表明,目标化合物14h对细胞的毒性明显低于阳性药,证明了化合物14h在体外抗肿瘤活性实验中对肿瘤细胞具有一定的选择性,较好的生物安全性。
实施例6目标化合物14h的平板克隆研究
为了进一步测试目标化合物对肿瘤细胞抑制作用,我们选取了细胞活性最好的化合物14h作为目标化合物,结合该化合物在不同肿瘤细胞的MTT测试数据,其IC50值结果如图2。
选取目标分子14h活性最优的细胞株Hela、SW620作为实验组进行平板克隆实验。将HT29细胞和HCT15细胞(500细胞/孔)铺在6孔板中,并在37℃下孵育过夜,然后加入指定剂量的化合物14h(0-1.25μM),以DMSO作为空白对照,用新鲜配制的培养基培养15天。当观察到有明显的细胞形成的集落时终止细胞培养,然后除去上清液并用PBS缓冲溶液洗涤两次,在弃去溶液之前用4%聚甲醛固定菌落15分钟,并用0.5%结晶紫溶液染色15分钟,然后除去结晶紫溶液,并使用PBS缓冲溶液冲洗染色液。实验结果如图3,所有数据均代表三个独立重复的实验。
由实验结果可以看出,化合物14h在不同浓度下对SW620、Hela的细胞集落形成均有一定的抑制作用。当14h的浓度达到1.25μM时,在SW620中几乎能完全抑制细胞集落的形成。在Hela中,化合物14h的浓度达到0.625μM时,几乎无明显的细胞集落形成。测试结果验证了化合物14h对SW620、Hela抑制作用随着浓度增加,抑制作用明显提高,并且具有浓度依赖性,也证实了化合物14h在体外有效的抗肿瘤抑制能力,特别是在Hela细胞中,低浓度下能够明显抑制细胞集落的形成,平板克隆的实验结果预示了化合物14h可能拥有较好的体内抗肿瘤增殖效果。
实施例7化合物在体内抗肿瘤活性研究
为了研究14h在体内抗肿瘤作用,我们综合14h在体外活性的数据,选取了体外活性最好Hela、SW620作为实验细胞株作为体内模型造瘤株。本实验动物为Balb/c nude小鼠。
实验动物饲养与要求:所有动物实验由四川大学实验动物管理委员会的批准下进行,饲养规则按National Institutes of Health Guide for the Care and Use ofLaboratory Animals国际标准执行。
动物模型的建立:分别收集对数期的Hela(6×106)、SW620(8×106)细胞经皮下注射到6-7周龄的雌性BALB/c小鼠中。当接种后裸鼠平均肿瘤体积增长到大约100mm3时,每个小鼠细胞模型组随机分为五组(每组n=7)。(10%DMSO,1%Tween-80和30%PEG300,60%生理盐水),化合物14h(15mg/kg,30mg/kg,60mg/kg溶于10%DMSO,1%Tween-80和,30%PEG300,60%生理盐水),阳性药对照组为BEZ235(30mg/kg溶于10%DMSO,1%Tween-80和,30%PEG300,60%生理盐水),通过经口灌胃的方式给药。每两天测定一次肿瘤大小和体重。用游标卡尺测量肿瘤体积,计算公式为:0.5×最短直径2×最长直径。肿瘤生长的抑制率的公式为:100×{1-[最终肿瘤体积
实验结果:在30天给药期间,Balb/c裸鼠健康,活动正常,进食量正常,皮毛光润,粪便正常,无腹泻发生,肿瘤部位未发生炎症;阳性药组(BEZ235组)和空白对照组,随着给药时间增加,小鼠体重均出现轻微下降现象,阳性药组体重下降略微明显,根据体外活性测试数据我们推测是由于阳性药的毒性所致。从实验结果可以看到,在Hela移植瘤模型中,目标化合物14h和阳性药BEZ235均能一定程度上抑制肿瘤生长,如图4中,在14h给药剂量为60mg/kg,30mg/kg,15mg/kg的组别中分别观察到肿瘤生长抑制率(TGI)为80.22%,73.50%,60.79%,而阳性药BEZ235在30mg/kg肿瘤生长抑制率(TGI)为53.29%,疗效明显低于同等剂量的化合物14h,随着14h给药剂量增加,以瘤率明显提高,表明化合物14h的剂量与肿瘤的生长抑制率呈现出剂量依赖性关系;与之类似,在SW620移植瘤模型中,目标14h和BEZ235也能一定程度上抑制肿瘤生长,14h给药剂量分别为60mg/kg,30mg/kg,15mg/kg时,观察到肿瘤生长抑制率(TGI)分别为81.03%,70.81%,60.58%,而阳性药BEZ235在30mg/kg肿瘤生长抑制率(TGI)为51.67%,疗效低于同等剂量14h,并且14h的剂量与肿瘤的生长抑制率同样呈现出剂量依赖性关系。我们可以看出在Hela和SW620肿瘤移植瘤模型中,化合物14h在同等剂量下均表现出了优于阳性药的体内抗肿瘤效果,并且药物浓度提高,小鼠仍然耐受,在图6中可以观察到,小鼠体重在30天给药期间,目的组14h给药组体重无明显的变化现象,而阳性药组随着治疗时间增加,出现体重减轻的现象,说明了14h在体内的安全性优于阳性药BEZ235,且在30天给药期间,不同剂量的14h给药组之间小鼠体重没有明显差异,体重没有明显的变化,小鼠饮食、饮水正常,皮肤光润,状态健康。由此可以总结出,化合物14h在Hela、SW620两种小鼠移植瘤模型中均显示出了优异的体内抗肿瘤疗效,并且具有一定的安全性。
- 一种基于滑模变结构控制的磁浮列车悬浮控制方法
- 一种基于滑模控制的电力弹簧控制方法
- 一种基于反步滑模的电力弹簧电压控制方法
