使用内源荧光测定佐剂化蛋白质浓度和吸附百分比的方法
文献发布时间:2023-06-19 09:30:39
背景技术
疫苗制剂中抗原的浓度是关键参数,需要对其进行控制以确保生产过程和产品质量的一致性。由于多种原因,诸如控制制剂的准确性,估算与工艺有关的损失,监测产品的均质性,以及确保抗原对给定佐剂的适当吸附
蛋白基的疫苗制剂通常被制成悬浮液或乳剂,因此其包含佐剂如铝盐(即AlOOH、AlPO
显然,需要新的非破坏性方法来准确和可重现地确定疫苗制剂中佐剂化抗原的浓度。
发明概述
本发明涉及旨在克服与准确和可重现地确定包含佐剂化抗原的疫苗制剂中抗原浓度有关的问题的新方法。本文所述的方法克服了诸如待评估疫苗制剂中佐剂化抗原样品中的浊度干扰的问题。本文描述的方法是基于发明人的发现,即当抗原与佐剂一起配制时,可以测量和定量蛋白质的内源荧光(intrinsic fluorescence,IF)。
如本文所报道的,包含某些芳香族氨基酸的蛋白质的内源荧光可以用于测量它们在大多数混合物中的浓度,即使是那些包含铝盐佐剂的混合物,也不需要从佐剂中解吸蛋白质。该发现已经延伸到使用内源荧光来精确测量选择的化合物的制剂,其中所述制剂包含所述选择的化合物的佐剂化复合物,并且其中所述选择的化合物包含至少一种芳香族氨基酸。
在以下段落中简要总结了本发明,其包括但不限于几个实施方案及其特定方面。
因此,在第一实施方案中,本发明涉及用于确定选择的化合物在包含所述选择的化合物的佐剂化复合物的组合物中浓度的方法。在该实施方案中,所述方法包括:
(a)获得包含选择的化合物的佐剂化复合物的组合物的荧光强度值,其中所述选择的化合物包含至少一种芳香族氨基酸,并且其中所述组合物在250-300nm的波长被激发,并在300-500nm的波长确定发射光谱以获得所述组合物的荧光强度值;以及
(b)将(a)中获得的荧光强度值与使用至少三个校准样品的荧光强度值绘制的校准曲线进行比较,从而确定所述选择的化合物在包含所述选择的化合物的佐剂化复合物的组合物中的浓度,所述校准样品包含不同已知浓度的代表所述选择的化合物的代表性化合物。
在该实施方案的某些方面,使用至少三个包含不同已知浓度的代表性化合物的校准样品绘制(b)的校准曲线,其中所述校准样品中的代表性化合物在250-300nm的波长被激发,并且其中对于每个校准样品在300-500nm的波长确定发射光谱。
在该实施方案的某些方面,使用至少五个包含不同已知浓度的代表性化合物的校准样品绘制(b)的校准曲线。
在该实施方案的某些方面,通过下述步骤绘制(b)的校准曲线:(a)制备至少五个代表性化合物的校准样品,所述代表性化合物的浓度代表包含所述选择化合物的佐剂化复合物的组合物中的所述选择的化合物的疑似浓度的约50%、75%、100%、125%和150%;(b)使用250-300nm的波长激发(a)的每个校准样品;(c)使用300-500nm的波长确定(b)的每个样品的发射光谱,对于每个校准样品所述波长产生最大荧光强度;(d)绘制在产生最大荧光强度的波长处的荧光强度值相对于校准样品中代表性化合物的浓度的曲线,从而绘制代表性化合物的校准曲线。
在该实施方案的某些方面,使用280-290nm的激发波长来实施各种方法,并在320-360nm的波长确定发射光谱。
在第二实施方案中,本发明涉及确定选择的化合物在包含所述选择的化合物的佐剂化复合物的组合物中的吸附百分比(%)的方法。在该实施方案中,所述方法包括:
(a)获得包含选择的化合物的佐剂化复合物的组合物的两个测试样品,其中所述选择的化合物包括至少一种芳香族氨基酸,其中在第一测试样品中所述佐剂化复合物基本上在溶液中,并且其中在第二测试样品中所述佐剂化复合物基本上从溶液中沉淀出来;
(b)通过下述步骤确定第一测试样品中所述选择的化合物的浓度:(i)获得第一测试样品的荧光强度值,其中第一测试样品在250-300nm的波长被激发,并在300-500nm的波长确定发射光谱以获得所述第一测试样品的荧光强度值;以及(ii)将所述荧光强度值与使用至少三个校准样品绘制的校准曲线进行比较,从而确定第一测试样品中所述选择的化合物的浓度,所述校准样品包含不同已知浓度的代表所选化合物的代表性化合物;
(c)通过下述步骤确定第二测试样品上清液中所述选择的化合物的浓度:(i)获得第二测试样品上清液的荧光强度值,其中第二测试样品上清液在250-300nm的波长被激发,并在300-500nm的波长确定发射光谱以获得所述第二测试样品上清液的荧光强度值;以及(ii)将所述荧光强度值与使用至少三个校准样品绘制的校准曲线进行比较,从而确定第二测试样品中所述选择的化合物的浓度,所述校准样品包括不同已知浓度的代表所述选择的化合物的代表性化合物;以及
(d)将在(c)中确定的浓度除以在(b)中确定的浓度以计算吸附百分比(%),从而确定选择的化合物在包含所述选择的化合物的佐剂化复合物的组合物中的吸附百分比(%)。
在该实施方案的某些方面,使用至少三个包含不同已知浓度的代表性化合物的校准样品绘制(b)和/或(c)的校准曲线,其中所述校准样品中的代表性化合物在250-300nm的波长被激发,并且其中对于每个校准样品在300-500nm的波长确定发射光谱。
在该实施方案的某些方面,使用至少五个包含不同已知浓度的代表性化合物的校准样品绘制(b)和/或(c)的校准曲线。
在该实施方案的某些方面,通过下述步骤绘制(b)和/或(c)的校准曲线:(a)制备至少五个代表性化合物的校准样品,所述代表性化合物的浓度代表第二测试样品中基本上从溶液中沉淀出来的佐剂化复合物的疑似浓度的约50%、75%、100%、125%和150%;(b)使用250-300nm的波长激发(a)的每个校准样品;(c)使用300-500nm的波长确定(b)的每个样品的发射光谱,对于每个校准样品所述波长产生最大荧光强度;(d)绘制在产生最大荧光强度的波长处的荧光强度值相对于校准样品中代表性化合物的浓度的曲线,从而绘制代表性化合物的校准曲线。
在该实施方案的某些方面,使用280-290nm的激发波长来实施各种方法,并在320-360nm的波长确定发射光谱。
在该实施方案的某些方面,(b)和(c)的校准曲线是相同的校准曲线。
在第三实施方案中,本发明涉及制备包含选择的化合物的佐剂化复合物的组合物的方法。在该实施方案中,所述方法包括以下步骤:使用本申请中定义的方法(如以上概述并在以下详述的第一实施方案的方法)确定选择的化合物在一批所述选择的化合物的佐剂化复合物中的浓度,并根据该测定结果配制包含该批次所述选择的化合物的佐剂化复合物的组合物。
在本发明的相关实施方案和方面,所述选择的化合物可以是但不限于:肽、多肽、蛋白质、多糖-蛋白质结合物、病毒样颗粒或病毒悬浮液。在一个方面,所述选择的化合物为蛋白质。
在本发明的相关实施方案和方面,所述芳香族氨基酸可以是但不限于:色氨酸、酪氨酸和苯丙氨酸中的一种或多种。
在本发明的相关实施方案和方面,所述选择的化合物与选自但不限于下述中的一种或多种佐剂进行佐剂化:铝盐、乳液、肽、核酸和上述化合物的组合。在一个方面,所述佐剂是铝盐,如AlOOH或AlPO
在本发明的相关实施方案和方面,当用波长范围为280-290nm的光激发时,所述佐剂在290-450nm显示的荧光小于20%。
在本发明的相关实施方案和方面,确定所述选择的化合物的内源荧光。在一个方面,在没有加入荧光探针或标记物的情况下确定所述选择的化合物的内源荧光。在另一个方面,通过与所述选择的化合物结合的荧光探针获得荧光强度值。
在本发明的相关实施方案和方面,所述选择的化合物的最大发射为约320-360nm。
在本发明的相关实施方案和方面,所述代表性化合物可以与所述选择的化合物相同或者与所述选择的化合物不同。例如,当所述代表性化合物是肽或蛋白质时,它可以与所述选择的化合物具有至少90%的序列同一性。
在本发明的相关实施方案和方面,所述代表性化合物是代表性化合物的佐剂化复合物。所述佐剂可以是与用于生产所述选择的化合物的佐剂化复合物的相同佐剂或不同佐剂。
在本发明的相关实施方案和方面,通过连接到流通池的荧光探针、通过光度计获得荧光强度值。
在本发明的相关实施方案和方面,所述方法是在位(in-line)、在线(on-line)或离线(off-line)进行的。
本发明的第四、第五和第六实施方案涉及可以实现的系统以执行本发明的第一、第二和第三实施方案的方法。
在这些实施方案的某些方面,所述系统包括具有存储程序的非暂时性存储器的计算机,该程序在被执行时执行本发明所述方法的部分或全部特征。
在这些实施方案的某些方面,所述非暂时性存储器可以是计算机可读介质,如半导体存储器、光盘只读存储器(CD-ROM)、数字视频光盘(DVD)、蓝光光盘或其他电子或光学存储设备。另外,所述程序为计算机程序,其包括用于指示计算机执行本发明所述方法的部分或全部特征的可执行指令或一种或多种算法。
在这些实施方案的某些方面,所述计算机包括控制器,该控制器可以作为通用处理器、中央处理单元(CPU)、专用处理器、现场可编程门阵列(FPGA)、可重构处理器、集成电路(IC)、专用集成电路(ASIC)或大规模集成电路(LSI)来实施,以执行本发明的方法的部分或全部特征。
在这些实施方案的某些方面,所述系统确定选择的化合物在包含所述选择的化合物的佐剂化复合物的组合物中的浓度,并确定选择的化合物在包含所述选择的化合物的佐剂化复合物的组合物中的吸附百分比(%)。
在这些实施方案的某些方面,所述系统包括:(i)输送装置,以及(ii)荧光强度值测定装置。
在这些实施方案的某些方面,所述输送装置(例如管)将包含选择的化合物的佐剂化复合物的组合物或测试样品输送至荧光强度值测定装置。另外,荧光强度值测定装置确定所述组合物的荧光强度值。在一些方面,所述荧光强度值测定装置是连接到流通池的荧光探针,所述组合物或测试样品通过输送装置从流通池中流过。所述荧光探针可以与光度计连通以确定荧光强度值。
在这些实施方案的某些方面,所述计算机接收荧光强度值并将这些值与校准曲线进行比较,从而确定所述选择的化合物在包含所述选择的化合物的佐剂化复合物的组合物中的浓度。
在这些实施方案的某些方面,所述计算机接收荧光强度值并将这些值与校准曲线进行比较,从而确定选择的化合物在包含所述选择的化合物的佐剂化复合物的组合物中的吸附百分比(%)。
前面已经相当广泛地概述了本发明的特征和技术优点,以便可以更好地理解以下对本发明的详细描述。本文将描述构成本发明权利要求的主题的本发明其他特征和优点。本领域技术人员应该认识到,本文公开的任何概念和具体实施方案可以容易地用作修改或设计用于实施本发明相同目的的其他结构的基础。本领域技术人员还应该认识到,这些等效构造不脱离如在所附权利要求书中所阐述的本发明的精神和范围。当结合附图考虑时,将从以下描述中更好地理解被认为是本发明特色的机构和操作方法的新颖特征,以及其他目的和优点。然而,应该清楚地理解,提供的任何描述、附图、示例等仅仅是为了说明和描述的目的,而非旨在确立对本发明的限制。
附图说明
图1.在不存在或存在0.66mg Al/mL铝盐佐剂的情况下,FHA(A)、PRN(B)和FIM(C)在100μg/mL下的荧光光谱。
图2.单独抗原的荧光强度或吸附到佐剂的抗原的荧光强度随时间的变化。在20分钟内(n=2),每间隔2分钟,100μg/mL FHA以及在0.66mg Al/mL AlOOH和AlPO
图3.FHA(A)、PRN(B)、FIM(C)的校准曲线。单独抗原的制剂和吸附到0.66mg Al/mLAlOOH或AlPO
图4.在低、中和高佐剂浓度下绘制的校准曲线。在0.32(低)、0.66(中)和1.32(高)mg Al/mL铝盐(n=2)时吸附到AlOOH(A)的FHA和吸附到AlPO
图5.缓冲液和pH值对校准曲线的影响。使用不同的缓冲液组成和pH值绘制了吸附到0.66mg Al/mL AlOOH的PRN的校准曲线。3种不同缓冲液(TBS、PBS和HEPES)在pH值为7.4(A)时的单独校准曲线,以及缓冲液在3种不同pH值(6、7.4和9)(B)时的单独校准曲线。
图6.在佐剂存在下在位确定蛋白质浓度,以及通过内源荧光光谱近线(at-line)确定抗原吸附%的概念图。
图7.FHA和吸附到0.66mg Al/mL AlOOH的FHA在TBS中的在位标准曲线。
图8.根据本发明系统的第一示例性实施方案,用于测量疫苗制剂中蛋白质浓度的系统的示意图。
图9.根据本发明系统的第二实施方案,用于测量疫苗制剂中蛋白质浓度的系统的示意图。
图10.根据本发明系统的第三示例性实施方案,用于测量疫苗制剂中蛋白质浓度的系统的示意图。
具体实施方式
I.定义
如本文所用,“一个/种(a/an)”可以表示一个/种或多个/种。如本文所用,当与单词“包括”一起使用时,单词“一个/种(a/an)”可以表示一个/种或一个/种以上。如本文所用,“另一个/种”可以表示至少第二个/种或更多个/种。此外,除非上下文另外要求,否则单数术语包括复数,复数术语包括单数。
如本文所用,无论是否明确指出,“约”均是指数值,包括例如整数、分数和百分比。术语“约”通常是指本领域的普通技术人员认为等同于所述值(例如,具有相同功能或结果)的数值范围(例如,所述值的+/-5-10%)。在某些情况下,术语“约”可以包括四舍五入到最接近的有效数字的数值。
II.本发明
本发明总体上涉及化合物(如蛋白质)的内源荧光用于定量溶液中化合物浓度的用途。通过使用荧光强度和蛋白质浓度之间的线性关系,可以测定未知浓度溶液的荧光强度,并将其与基于已知量蛋白质的荧光强度绘制的校准曲线进行比较。
由于芳香族氨基酸的存在,蛋白质在表现出内源荧光的生物分子中是独特的。大多数蛋白质包含芳香族氨基酸,如色氨酸(Trp)、酪氨酸(Tyr)和苯丙氨酸(Phe)。在紫外光区域激发时(Phe约为250nm;Tyr约为275nm;Trp约为290nm),这些芳香族氨基酸可在310-360nm产生最大发射的发射光谱
如本文所讨论的,发现使用内源荧光来测量溶液中蛋白质的浓度可以用于精确测量包含除蛋白质之外的组分的复杂溶液。该发现使发明人克服了与在包含其他成分(如佐剂)的疫苗制剂中对蛋白质抗原进行定量相关的困难。包含佐剂化蛋白质的疫苗制剂通常难以测定,因为这种制剂通常是混浊的。精确测量这种制剂中的蛋白质抗原通常需要蛋白质解吸步骤,这是耗时且破坏性的过程。本发明的方法不包括蛋白质解吸步骤而实现疫苗制剂中蛋白质抗原的精确测量。如本文所示,含有芳香族氨基酸的蛋白质的内源荧光可用于测量其在大多数混合物中的浓度,即使是含有铝盐佐剂的那些蛋白质,也无需解吸。
如以上简要概述的,本发明包括用于确定选择的化合物(如蛋白质)在包含所述选择的化合物的佐剂化复合物的组合物中的浓度的方法。此类方法一般包括:(i)测量组合物的内源荧光,以及(ii)将测得的荧光强度值与使用代表所述选择的化合物的已知浓度的化合物绘制的校准曲线进行比较,从而确定组合物中所述选择的化合物的浓度。显而易见地,本发明还包括基于以下步骤的其他方法:(i)测量组合物的内源荧光,以及(ii)将测得的荧光强度值与校准曲线进行比较。
本发明的方法明确地排除了解吸的步骤。也就是说,本发明的方法可以通过排除将包含所述选择的化合物的佐剂化复合物的组合物中的所述选择的化合物与佐剂分离的步骤来实施。本发明的方法也可以在没有外源荧光探针或标记物的情况下实施。本发明的方法还可以在没有导致所述选择的化合物的佐剂化复合物破坏和/或所述选择的化合物的破坏的测定条件的情况下实施。
如本文所用,术语“选择的化合物”是指在本发明的方法中被分析的化合物。所述选择的化合物通常是包含至少一种芳香族氨基酸的化合物,例如包含至少一种芳香族氨基酸的肽、多肽或蛋白质。然而,在一个替代性方案中,所述选择的化合物可以是与含有至少一种芳香族氨基酸的化合物结合或被其结合的化合物,例如,与含有至少一种芳香族氨基酸的蛋白质(例如抗体或其片段)结合的缺乏芳香族氨基酸的蛋白质。在另一替代性方案中,所述选择的化合物可以结合至荧光探针或标记物,或者被荧光探针或标记物结合。
因此,如本文所用,选择的化合物是下述中的一种或多种:(i)含有至少一种芳香族氨基酸的肽、多肽、蛋白质、多糖-蛋白质结合物、病毒样颗粒或病毒悬浮液,或者(ii)肽、多肽、蛋白质、多糖-蛋白质结合物、病毒样颗粒或病毒悬浮液,其不包含至少一个芳香族氨基酸,但结合至以下物质或被该物质结合:(a)含有至少一种芳族氨基酸的肽、多肽、蛋白质、多糖-蛋白质结合物、病毒样颗粒或病毒悬浮液,或者(b)荧光探针或标记物。在一个方面,所述选择的化合物是含有至少一个芳香族氨基酸的蛋白质。
本发明所述选择的化合物中的芳香族氨基酸的数目将根据所述选择的化合物的特性而变化。因此,本发明所述选择的化合物可以包含至少1、2、3、4、5、6、7、8、9、10或更多个芳香族氨基酸。
如本文所用,术语“芳香族氨基酸”是指氨基酸色氨酸(Trp)、酪氨酸(Tyr)、苯丙氨酸(Phe)、组氨酸(His)、甲状腺素、5-羟基色氨酸和L-DOPA。在一个方面,芳香族氨基酸可以由色氨酸(Trp)、酪氨酸(Tyr)、苯丙氨酸(Phe)组成的亚组定义。
在所述选择的化合物结合至荧光探针或标记物或者被荧光探针或标记物结合的那些情况下,荧光探针或标记物可以是能够产生荧光的任何物质,该荧光可以在结合到荧光探针或者标记物或与被荧光探针或者标记物结合的所述选择的化合物的佐剂化复合物的情况下被检测和测量。
当所述选择的化合物暴露于250-300nm的激发波长时,其还可以(单独地或除本文提供的其他描述之外)被表征为具有约300-500nm的最大发射。对于某些选择的化合物,最大发射为约300-450nm、300-400nm、300-380nm、300-370nm、300-360nm、300-340nm、320-400nm、320-380nm,或320-360nm。
如本文所用,术语“代表性化合物”是指用于产生本文所定义的校准曲线的化合物。显然,在正在被实施的方法中,可以使用含有被测定的所述选择的化合物的校准样品来绘制校准曲线。在这种情况下,代表性化合物与所述选择的化合物相同。但是,还应该理解,可以使用含有仅与所述选择的化合物相似的化合物的校准样品来绘制校准曲线。例如,当将一种蛋白质作为所述选择的化合物进行测定时,可以使用具有不同序列的蛋白质作为代表性化合物来绘制校准曲线。当代表性化合物与所述选择的化合物不相同时,代表性化合物通常会包含与所述选择的蛋白质相同的芳香族氨基酸补体(在数量和特性上),但是当代表性化合物具有较少或较多芳香族氨基酸或者具有不同芳香族氨基酸时,也可以变化。当所述选择的化合物为肽、多肽或蛋白质时,代表性化合物与所述选择的化合物具有至少80%的序列同一性,或与所述选择的化合物具有至少81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的序列同一性。
当用于本发明的方法中时,代表性化合物可以是代表性化合物的佐剂化复合物或代表化合物的非佐剂化形式。当代表性化合物被佐剂化时,它可以被用于产生所述选择的化合物的佐剂化复合物的相同佐剂或不同佐剂佐剂化。
如本文所用,术语“佐剂”在疫苗生产领域中具有其普通和惯常的含义,例如增强受试者对抗原的免疫应答的物质,如药理剂或免疫剂。佐剂通常包含在疫苗制剂中,以增强对受试者体内诱导的抗原的免疫应答,从而使给予受试者的异物量最小化。佐剂可以用作抗原的储库(depot),随着时间的推移,可以缓慢且持续地将抗原呈递给免疫系统。其他佐剂的作用是参与并增强与抗原诱导相结合的在受试者体内产生的免疫应答。
用于本发明方法的合适的佐剂包括诸如铝盐的无机化合物、角鲨烯乳剂、肽、核酸、矿物油、合成和天然磷脂及其组合。用于该方法的示例性佐剂包括氢氧化铝佐剂(也称为铝羟基氧化物或AlOOH)、磷酸铝(例如AlPO
在本发明的一个方面,合适的佐剂是当用250-300nm波长的光激发时在290-450nm表现出不可检测的内源荧光的那些佐剂。或者,合适的佐剂是当用250-300nm波长的光激发时表现出在290-450nm波长的内源荧光的那些佐剂,所述内源荧光小于与该佐剂络合的所述选择的化合物的内源荧光的20%,优选小于与该佐剂络合的所述选择的化合物的内源荧光的20%、19%、18%、17%、16%、15%、14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4%、3%、2%或1%。在一些方面,所述激发波长为280-290nm。
使用这样的组合物可以实施本发明的方法,其中所述选择的化合物与在同一种组合物中的一种类型的佐剂或两种、三种、四种或更多种类型的佐剂络合。
如本文所用,术语“组合物”可以是包含选择的化合物的佐剂化复合物的任何组合物。非限制性示例包括含有佐剂化抗原(如与AlOOH或AlPO
转向本发明的方法,如上所述,在第一实施方案中,本发明可以被定义为用于确定选择的化合物(如蛋白质)在包含所述选择的化合物的佐剂化复合物的组合物中的浓度的方法。此类方法通常包括:(i)测量所述组合物的内源荧光,以及(ii)将测得的荧光强度值与使用代表所述选择的化合物的已知浓度的化合物绘制的校准曲线进行比较,从而确定所述组合物中所述选择的化合物的浓度。
作为示例,该实施方案涵盖的方法可以描述为用于确定选择的化合物在包含所述选择的化合物的佐剂化复合物的组合物中的浓度的方法,包括:
(a)获得包含选择的化合物的佐剂化复合物的组合物的荧光强度值,其中所述选择的化合物包括至少一种芳香族氨基酸,并且其中所述组合物在250-300nm的波长被激发,并在300-500nm的波长确定发射光谱以获得所述组合物的荧光强度值;以及
(b)将(a)中获得的荧光强度值与使用校准样品的荧光值绘制的校准曲线进行比较,从而确定所述选择的化合物在包含所述选择的化合物的佐剂化复合物的组合物中的浓度,所述校准样品包含不同已知浓度的代表所述选择的化合物的代表性化合物。
在该实施方案的某些方面,使用至少2、3、4、5、6、7、8、9、10或更多个包含不同已知浓度的代表性化合物的校准样品来绘制(b)的校准曲线。例如,可以使用至少三个包含不同已知浓度的代表性化合物的校准样品绘制(b)的校准曲线,其中校准样品中的代表性化合物在250-300nm的波长被激发,并且其中在300-500nm的波长确定每个校准样品的发射光谱。
在该实施方案的某些方面,使用至少五个包含不同已知浓度的代表性化合物的校准样品绘制(b)的校准曲线,其中校准样品中的代表性化合物在250-300nm的波长被激发,并且其中在300-500nm的波长确定每个校准样品的发射光谱。
用于绘制校准曲线的校准样品中代表性化合物的浓度,将根据所述选择的化合物的已知浓度或疑似浓度以及用于绘制曲线的样品数量而变化。但是,校准样品通常包括浓度低于所述选择的化合物的已知浓度或疑似浓度的至少一种样品和浓度高于所述选择的化合物的已知浓度或疑似浓度的至少一种样品。在一些方面,校准样品包括浓度低于所述选择的化合物的已知浓度或疑似浓度的1、2、3、4、5个或更多个样品,以及浓度高于所述选择的化合物的已知浓度或疑似浓度的1、2、3、4、5个或更多个样品。浓度低于所述选择的化合物的已知或疑似浓度的校准样品通常是所述选择的化合物的已知浓度或疑似浓度的约20%-100%,包括所述选择的化合物的已知浓度或疑似浓度的约20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%和100%的值。浓度高于所述选择的化合物的已知浓度或疑似浓度的校准样品通常是所述选择化合物的已知浓度或疑似浓度的约100%-200%,包括所述选择的化合物的已知浓度或疑似浓度的约100%、105%、110%、115%、120%、125%、130%、135%、140%、145%、150%、155%、160%、165%、170%、175%、180%、185%、190%、195%和200%的值。
在该实施方案的某些方面,(b)的校准曲线通过下述步骤绘制:(a)制备至少五个代表性化合物的校准样品,其浓度代表包含所述选择的化合物的佐剂化复合物的组合物中的所述选择化合物的疑似浓度的约50%、75%、100%、125%和150%;(b)使用250-300nm的波长激发(a)的每个校准样品;(c)使用300-500nm的波长确定(b)的每个样品的发射光谱,对于每个校准样品所述波长产生最大荧光强度;(d)绘制在产生最大荧光强度的波长处的荧光强度值相对于校准样品中代表性化合物的浓度的曲线,从而绘制代表性化合物的校准曲线。
本发明的方法中使用的校准曲线可以使用任何相关手段来绘制,如但不限于:诸如电子表格软件(微软公司)、JMP(SAS)、GraphPad Prism(GraphPad Software)、MATLAB(MathWorks)、Custom Sensors PX2(Custom Sensors)的计算机软件和绘图纸(手工绘图)。校准曲线拟合模型的类型也可以变化,包括但不限于:线性、多项式、对数、指数、幂和S形(sigmoidal)、代表性化合物和目标浓度范围的回归。
如本文所用,所述选择的化合物在包含所述选择的化合物的佐剂化复合物的组合物中的“疑似浓度”,仅仅是对所述选择的化合物在所述组合物中的浓度的估计或有根据的推测。为了绘制相关的校准曲线,人们试图绘制这样的曲线,其中针对包含所述选择的化合物的佐剂化复合物的组合物获得的荧光强度值,将落在该曲线的最低值和最高值之间的某处,所述最低值和最高值用于绘制该曲线。由于事先不知道包含选择的化合物的佐剂化复合物的组合物的荧光强度值,因此必须估算或猜测该值可能是什么,然后使用浓度高于和低于估计值的代表性化合物的样品来绘制校准曲线。
用于精确测量组合物中佐剂化化合物浓度的方法可以与其他步骤结合使用,以使人们可以收集关于组合物特征的更多信息。例如,在第二实施方案中,本发明包括用于确定选择的化合物在包含所述选择的化合物的佐剂化复合物的组合物中的吸附百分比(%)的方法。因此,例如,可以确定疫苗制剂中与佐剂络合的抗原的百分比。此类方法通常包括:(i)获得包含选择的化合物的佐剂化复合物的组合物的两个样品,其中在第一样品中佐剂化复合物基本上在溶液中,而在第二样品中佐剂化复合物基本上从溶液中沉淀出来,(ii)测量第一样品的内源荧光,(iii)将测得的荧光强度值与使用代表所述选择的化合物的已知浓度的化合物绘制的校准曲线进行比较,以确定第一测试样品中所述选择化合物的浓度,(iv)测量第二样品的内源荧光,(v)将测得的荧光强度值与所述校准曲线进行比较,以确定第二测试样品中所述选择的化合物的浓度,以及(vi)将第二样品确定的浓度除以第一样品确定的浓度来计算吸附百分比(%),从而确定所述组合物中选择的化合物的吸附百分比(%)。
作为示例,该实施方案涵盖的方法可描述为用于确定选择的化合物在包含所述选择的化合物的佐剂化复合物的组合物中的吸附百分比(%)的方法,包括:
(a)获得包含选择的化合物的佐剂化复合物的组合物的两个测试样品,其中所述选择的化合物包括至少一种芳香族氨基酸,其中在第一测试样品中佐剂化复合物基本上在溶液中,并且其中在第二测试样品中佐剂化复合物基本上从溶液中沉淀出来;
(b)通过以下方法确定第一测试样品中所述选择的化合物的浓度:(i)获得第一测试样品的荧光强度值,其中第一测试样品在250-300nm的波长被激发,并在300-500nm的波长确定发射光谱以获得第一测试样品的荧光强度值,以及(ii)将所述荧光强度值与使用包含不同已知浓度的代表性化合物的校准样品绘制的校准曲线进行比较,从而确定第一测试样品中所述选择的化合物的浓度,所述代表性化合物代表所述选择的化合物;
(c)通过以下方法确定第二测试样品上清液中所述选择的化合物的浓度:(i)获得第二测试样品上清液的荧光强度值,其中第二测试样品上清液在250-300nm的波长被激发,并在300-500nm的波长确定发射光谱以获得第二测试样品上清液的荧光强度值,以及(ii)将所述荧光强度值与使用包含不同已知浓度的代表性化合物的校准样品绘制的校准曲线进行比较,从而确定第二测试样品中所述选择的化合物的浓度,所述代表性化合物代表所述选择的化合物;以及
(d)将在(c)中确定的浓度除以在(b)中确定的浓度以计算吸附百分比(%),从而确定选择的化合物在包含所述选择的化合物的佐剂化复合物的组合物中的吸附百分比(%)。
在该实施方案的某些方面,使用至少2、3、4、5、6、7、8、9、10或更多个包含不同已知浓度的代表性化合物的校准样品来绘制(b)和/或(c)的校准曲线。例如,可以使用至少三个包含不同已知浓度的代表性化合物的校准样品来绘制(b)和/或(c)的校准曲线,其中校准样品中的代表性化合物在250-300nm的波长被激发,并且其中在300-500nm的波长确定每个校准样品的发射光谱。
在该实施方案的某些方面,使用至少五个包含不同已知浓度的代表性化合物的校准样品来绘制(b)和/或(c)的校准曲线,其中校准样品中的代表性化合物在250-300nm的波长被激发,并且其中在300-500nm的波长确定每个校准样品的发射光谱。
在该实施方案的某些方面,通过下述步骤绘制(b)和/或(c)的校准曲线:(a)制备至少五个代表性化合物的校准样品,其浓度代表第二测试样品中基本上从溶液中沉淀出来的佐剂化复合物的疑似浓度的约50%、75%、100%、125%和150%;(b)使用250-300nm的波长激发(a)的每个校准样品;(c)使用300-500nm的波长确定(b)的每个样品的发射光谱,对于每个校准样品所述波长产生最大荧光强度;(d)绘制产生最大荧光强度的(c)的波长处的荧光强度值相对于校准样品中代表性化合物浓度的曲线,从而绘制代表性化合物的校准曲线。
显然,(b)和(c)的校准曲线可以是相同的校准曲线,或者可以绘制不同的校准曲线。
另外,可以绘制考虑了在佐剂化复合物基本上从溶液中沉淀出来后第二试验样品上清液中存在残留佐剂的校准曲线。为了确定沉淀后上清液中残留佐剂引起的荧光偏移,每种代表性化合物可制备两组制剂。制备一组不含佐剂的制剂,制备的另一组制剂中一旦沉淀后预计在上清液中残留有代表性化合物的浓度。可以修改本发明的校准曲线以考虑到偏移值。
在用于确定选择的化合物在包含选择的化合物的佐剂化复合物的组合物中的吸附百分比(%)的这些方法中,测定了两个测试样品。在第一测试样品中,佐剂化复合物基本上在溶液中。在第二测试样品中,佐剂化复合物基本上从溶液中沉降出来并测定上清液。应当理解,溶液中或从溶液中出来的佐剂化复合物的量,将根据与该测定有关的具体情况而变化。实际上,由于该测定的目的是获得不同组合物的吸附百分比(%),因此与该测定有关的具体情况预计会有很大差异。因此,术语“基本上在溶液中”和“基本上从溶液中沉淀出来”的定义必然是宽泛的。然而,可以基于第一测试样品中的佐剂化复合物的量与第二测试样品上清液中佐剂化复合物的量之间的至少约10%的差异来定义该术语。在本发明的其他合适方面,第一测试样品中的佐剂化复合物的量与第二测试样品中的量之间至少相差约15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或更多。或者,可以基于测试样品中佐剂化复合物的绝对量来定义该术语。因此,如本文所用,术语“基本上在溶液中”还可以指至少51%的佐剂化复合物在样品中的溶液中。在其他合适的方面,至少55%、60%、65%、70%、75%、80%、85%、90%、95%或更多的佐剂化复合物在样品中的溶液中。类似地,如本文所用,术语“基本上从溶液中沉淀出来”也可以表示至少51%的佐剂化复合物不在样品中的溶液中。在其他合适的方面,至少55%、60%、65%、70%、75%、80%、85%、90%、95%或更多的佐剂化复合物不在样品中的溶液中。作为另一替代方案,可以将第一测试样品定义为佐剂化复合物的溶液,其中将佐剂化复合物混合并在混合的10、20、30、40、50、60、70、80、90、100、110或120秒使其经受激发波长。可以将第二个测试样品定义为佐剂化复合物的溶液,其中将佐剂化复合物混合并在样品上清液经受激发波长之前将其静置至少1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30或更多分钟。
显而易见地,除了其他因素外,本发明的每种方法中使用的激发波长将根据这样的因素而变化,所述因素包括所述选择的化合物的特性、代表性化合物的特性和佐剂的特性。然而,由于Phe在~250nm的波长处发荧光,Tyr在~275nm的波长处发荧光,Trp在~290nm的波长处发荧光,所以通常使用约250-300nm的激发波长来实施本发明的方法。其他合适的范围包括在约250-290nm、250-280nm、250-270nm、250-260nm、260-300nm、260-290nm、260-280nm、260-270nm、270-300nm、270-290nm、270-280nm、280-300nm、280-290nm以及290-300nm。
还显而易见地,除了其他因素外,在实施本发明的每种方法时确定的发射光谱将根据相同因素而变化,即所述化合物的特性、代表性化合物的特性和佐剂的特性。然而,通常在300-500nm的波长确定发射光谱的情况下实施本发明的方法。其他合适的范围包括约300-480nm、300-460nm、300-440nm、300-420nm、300-400nm、320和480nm,320-460nm、320-440nm、320-420nm、320-400nm、340-480nm、340-460nm、340-440nm、340-420nm、340-400nm、360-480nm、360-460nm、360-440nm、360-420nm、360-400nm、380-480nm、380-460nm、380-440nm、380-420nm、380-400nm、300-400nm、300-380nm、300-360nm、300-340nm、300-320nm、320-400nm、320-380nm、320-360nm、320-340nm、340-400nm、340-380nm、340-360nm、360-400nm、360-380nm以及380-400nm。
可以使用任何相关的仪器来实施本发明的方法,该仪器在本文定义的参数内可以产生所需的光激发波长并检测所得的发射光谱。可接受的仪器包括光度计、荧光计和分光光度计。
可以使用用于从校准样品获得的测量值生成校准曲线的任何手段来实施本发明的方法。此类手段包括手工操作,例如使用坐标纸和铅笔,以及电子手段,诸如使用计算机程序。
类似地,可以使用用于将荧光强度值与校准曲线进行比较的任何手段来实施本发明的方法。此类手段包括手工操作,例如使用坐标纸和铅笔在校准曲线上绘制荧光强度值,以及使用电子手段,诸如使用计算机程序。
本发明的方法可以在多种情况下进行。例如,该方法可以在实验室环境中进行的小规模操作中进行,诸如当制备小批疫苗制剂以注射到实验动物中时。可以从各个批次中取出样品并使用本文定义的方法进行测试。该方法还可以在大规模操作中进行,诸如当生产商业级批次的疫苗制剂用于销售时在工业环境中进行。同样,可以从各个批次中取出样品并使用本文定义的方法进行测试。在这种条件下,这些方法是“离线(off-line)”进行的,即在实验室环境中例如使用台式荧光计测试样品的抗原浓度或吸附百分比。
该方法还可以“在位”或“在线”进行,其中荧光探针与流通池结合,流通池又与光度计连接,以允许实时监测蛋白质浓度。也可以使用连接到光度计的荧光探针,并将探针直接与样品接触(例如,通过将探针浸入样品中)“在位”进行该方法。图6提供了使用本发明的方法通过在线装置确定抗原浓度或吸附百分数的一个示例。这种在位和在线分析对于过程分析技术(Process Analytical Technology,PAT)应用很重要。PAT被美国FDA视为通过及时测量(即在加工过程中)原始物料和加工材料以及工艺的关键质量和性能特性来设计、分析和控制制造的系统,目的是确保最终产品质量
在本发明的相关实施方案和方面中,因此通过荧光探针、通过光度计获得荧光值。荧光探针可以结合于流通池。合适的荧光探针是本领域技术人员公知的,包括例如CustomSensors的高压灭菌的前表面荧光探针(Front Surface Fluorescence Probe),部件号:3383-001-305-010-2000-101-101。合适的流通池是本领域技术人员公知的,包括例如与自动进样器和吸管系统一起使用的各种路径长度的Thermo Scientific
作为一个示例,可以使用结合于流通池的荧光探针,通过光度计(图6)进行确定选择的化合物在包含选择的化合物的佐剂化复合物的组合物中的浓度的方法。首先在不存在佐剂的情况下,使用包含选择的化合物或代表性化合物的校准样品对荧光探针进行校准,并绘制校准曲线。然后将佐剂化制剂的样品送入流通池并测量荧光。将所获得的荧光强度值与校准曲线进行比较,并确定选择的化合物在包含所述选择的化合物的佐剂化复合物的组合物中的浓度。
作为另一个示例,还可以使用结合于流通池的荧光探针,通过光度计(图10)进行测量选择的化合物对佐剂的吸附%的方法。首先,在不存在佐剂的情况下,使用包含选择的化合物或代表性化合物的校准样品对荧光探针进行校准。然后将佐剂化制剂的样品送入流通池并测量荧光(作为佐剂化复合物基本上在溶液中的第一测试样品),然后让样品静置以使佐剂化复合物从流通池中沉淀出来,然后再次测量样品中非佐剂化的选择的化合物的荧光(作为其中佐剂化复合物基本上从溶液中沉淀出来的第二测试样品上清液)。测量上清液的另一种方法使用过滤器除去佐剂化复合物,并再次测量非佐剂化的选择的化合物的荧光(作为其中佐剂化复合物基本上从溶液中沉淀出来的第二测试样品上清液)(图6)。使用所述两个测量值进行计算,从而测量选择的化合物的吸附%。
还可以在第三实施例中描述本发明。在该实施方案中,本发明涉及用于制备包含选择的化合物的佐剂化复合物的组合物的方法。该方法包括以下步骤:使用本申请定义的方法(如本文详细描述的第一实施方案的方法)确定选择的化合物在一批选择的化合物的佐剂化复合物中的浓度,根据该确定结果配制包含该批次选择的化合物的佐剂化复合物的组合物。
本发明还包括可以被执行以实施本文定义的本发明的每个方法的系统。
图8所示的系统20包括导管22,包含蛋白质的疫苗制剂可以从导管22流出,并返回到其中装有疫苗制剂的容器24中。
容器24具有出口26和入口28,导管22相对的入口端30和出口端32分别延伸穿过出口26和入口28。入口端30位于容器24中靠近容器底部邻近的搅拌棒34处。容器底部位于搅拌板36上。出口端32位于容器24的顶部附近。导管22可包括挠性管或硅胶管。
导管22形成回路,其中荧光强度传感器38和泵40串联布置在入口端30和出口端32之间,泵40位于传感器38的下游。
以这种方式,容器24、传感器38和泵40的内部流体连通。传感器38优选地是具有探针的荧光流通池,该传感器38测量疫苗制剂中蛋白质的荧光,然后产生并发出代表该荧光的电信号。
计算机42经由PX2光度发射器设备44电气性连接到传感器38,以从传感器38接收荧光测量信号。该计算机包括存储程序的非暂时性存储器,该程序将代表导管中疫苗制剂中的蛋白质的荧光值的信号与预先绘制并存储在计算机中的校准曲线进行比较。然后,计算机提供输出,该输出根据所述信号和校准曲线的比较显示疫苗制剂中蛋白质的浓度。
图9的第二示例性实施方案,使用相同的数字来标识图8的第一示例性实施方案的相同特征。图8实施方案和图9实施方案的主要区别在于,导管22的开环、泵40相对于传感器38的上游位置,以及在图9的实施方案中使用两个容器。导管22具有通向其中吸附了原料药(drug substance)的供应容器46的入口端30。原料药或其上清液由在传感器38上游位置的泵40从容器46抽出,进入到导管22并通过传感器38。原料药从传感器38输送进入导管22中,并从出口端32离开进入容纳最终散装产品的存储容器48。
图10的第三实施方案具有与图8相似的布置,相同的数字标识相同的部分。不同之处在于,容器24通常被显示为空白框。
III.实施例
1A.材料
Sanofi Pasteur(加拿大多伦多)制造提供了丝状血凝素(FHA,分子量(MW)=220kDa)、百日咳杆菌粘附素(PRN,MW=60.3kDa)、菌毛(FIM,2型,MW=19.2kDa;以及3型,MW=17.2kDa)。FHA具有11个色氨酸和28个酪氨酸氨基酸,PRN具有8个色氨酸和6个酪氨酸,FIM 2型没有色氨酸并具有8个酪氨酸,FIM 3型没有色氨酸并具有7个酪氨酸。
分别以973.4–1200.9μg/mL、147.7–241.9μg/mL和242.0–402.0μg/mL的浓度制备一批FHA、PRN和FIM的两种类型。AlOOH佐剂由Brenntag Biosector(丹麦Frederikssund)提供,浓度为10.2mg Al/mL。AlPO
1B.制剂的制备
通过将适量的佐剂添加到适量的蛋白质中,然后使用指定的缓冲液作为最终稀释剂来制备所有制剂。然后将制剂在Adams
除非声明,否则用于标准曲线和测试样品的缓冲液为TBS。但是,其他缓冲液(PBS、HEPES、柠檬酸盐和碳酸氢盐)用于测试缓冲液和pH条件对校准曲线的影响。为了测试吸附百分比的效果,将不同浓度的磷酸盐(0mM、2mM、20mM和80mM)添加到TBS中的制剂中。
制备的以评估佐剂的存在和批间变异系数对校准曲线准确性的影响的含有FHA的测试样品,以含有AlOOH或AlPO
制备的以评估佐剂的存在、缓冲液和pH对校准曲线准确性的影响的含有PRN的测试样品,以含有AlOOH或AlPO
制备的以评估佐剂的存在对校准曲线准确性的影响的含有FIM的测试样品,以含有AlOOH或AlPO
1C.荧光测量值
使用Chirascan Plus分光光度计(Applied Photophysics,英国萨里)收集所有制剂的荧光测量值。使用设定为800V的恒定光电倍增管和20℃的设定温度,以280nm的激发波长激发样品,并以1nm的增量在290-400nm收集发射光谱,每点的测量时间为0.5秒。一旦找到最大发射峰,则将光谱收集设置为距最大发射峰±20nm处。使用标准的10毫米石英比色皿来测量所述制剂。混合后立即读取读数以获得最佳结果。
1D.沉降研究
将FHA样品重复倒置10次进行混合,每隔2分钟收集330nm处的荧光强度,持续20分钟。重复两次收集330nm处的荧光强度取平均值。
1E.校准曲线
用含有AlOOH或AlPO
用含有AlOOH或AlPO4的制剂中0、1、5、10、50和100μg/mL的抗原浓度和0.66mg Al/mL的佐剂浓度的样品,创建了PRN校准曲线以用来评估佐剂的影响。用0、5、10、50和100μg/mL的抗原浓度和0.66mg Al/mL的AlOOH浓度的样品,创建了PRN校准曲线以用于评估缓冲液组成和pH的影响。
用含有AlOOH或AlPO
选择达到最大强度的波长,并且将在这一点的荧光重复两次取平均值,对其浓度作图。对于所产生的用于评估佐剂和佐剂浓度的影响的校准曲线,将荧光强度的所述重复取平均值。对于所有其他校准曲线,不存在重复。检出限(LOD)和定量限(LOQ)是使用人用药品技术要求国际协调理事会(ICH)指南
LOD=3.3σ/S
LOQ=10σ/S
σ=空白的标准偏差
S=线性回归曲线的斜率。
使用GraphPad Prism版本6.00(GraphPad Software,美国加利福尼亚La Jolla),通过从校准曲线的抗原的最高浓度开始删除数据点,直到线性回归的R
使用GraphPad Prism版本6.00(GraphPad Software,美国加利福尼亚La Jolla),通过协方差分析(ANCOVA)对线性回归斜率进行统计比较。如果获得检验统计量F大于通过纯随机计算的概率(p值)为0.05或以下,则认为斜率具有统计学上的差异。
1F.批间变异
通过测定以低浓度(10μg/mL)、中浓度(50μg/mL)和高浓度(100μg/mL)的FHA吸附到0.66mg Al/mL AlOOH制备的10等分测试样品,相对于10等分FHA-AlOOH制剂的校准曲线来研究批间变异。
1G.吸附百分比
在0mM、2mM、20mM和80mM磷酸盐的存在下,使用50μg/mL吸附到0.66mg Al/mL的AlOOH的PRN测试吸附百分比,以得出吸附百分比水平的差异。14000rpm离心10分钟后,收集总的制剂的荧光以及上清的荧光。使用各自的标准曲线对制剂和上清的浓度进行反算。
1H.与微量凯氏定氮法的比较
未知抗原浓度的样品通过微量凯氏定氮法
2A.铝盐佐剂对蛋白质抗原荧光光谱的影响
为了研究IF方法在铝盐佐剂存在下检测蛋白质浓度的可行性,在AlOOH或AlPO
这些结果表明,疫苗中常用佐剂浓度的铝盐的存在不会干扰蛋白质的荧光特性,从而使该方法可用于检测铝盐佐剂化疫苗中的蛋白质。
2B.沉降的影响
已知铝盐佐剂的悬浮液会随着时间而沉淀
2C.校准曲线
一旦证明检测在佐剂存在下是可能的,就进行荧光对蛋白质浓度的线性响应的研究。在0.66mg Al/mL AlOOH或AlPO
可以在单独的抗原和吸附到铝盐佐剂的抗原中清楚地检测到线性趋势,相关系数(R
表1:FHA、PRN和FIM的校准曲线的测定系数、LOD和LOQ
在大多数情况下,佐剂的添加确实导致R
根据空白的标准偏差,使用ICH指南确定了检测限(LOD)和定量限(LOQ)(表1)
制剂中AlPO
计算线性极限(LOL)作为抗原的最高浓度,其是对偏离线性的流程实验产生R2≥0.980和p值>0.05的浓度,并且发现这是抗原依赖性的(表1)。IF测定对于所测试的制剂具有可接受的精确性。FIM制剂产生的测试样品总回收率最高,其次是FHA,然后是PRN(表2)。对于回收率和测试样品浓度或特定铝盐的存在,没有明显的趋势。
表2:FHA、PRN和FIM的校准曲线的精确度
2D.批间变异
在低(10μg/mL)、中(50μg/mL)和高(100μg/mL)蛋白质浓度下吸附到0.66mg Al/mLAlOOH的FHA制剂用于研究批间差异。对于进行的所有10个实验,低浓度、中浓度和高浓度样品的变异系数(CV)分别为7.4%、1.5%和0.6%,表明IF测定具有较高的重现性(表3)。
表3:FHA-AlOOH校准曲线的批间差异
2E.佐剂浓度的影响
为了研究佐剂浓度的影响,在低(0.33mg Al/mL)、中(0.66mg Al/mL)和高(1.32mgAl/mL)佐剂浓度下绘制FHA的校正曲线,并使用ANCOVA进行比较。
校准曲线的斜率根据佐剂的浓度而显著变化,表明灵敏度的变化(图4)。尽管0.66mg Al/mL的斜率和1.32mg Al/mL的斜率(p值=0.6)没有显著差异,但对于0.33mg Al/mL的AlOOH,其校正曲线的斜率明显低于0.66mg Al/mL的制剂和1.32mg Al/mL制剂的斜率(两者的p值<0.0001)。(图4A)。对于AlPO
2F.缓冲液种类和pH值的影响
通过绘制在各种缓冲液种类和pH中配制的0.66mg Al/mL AlOOH的PRN校准曲线,研究了缓冲液组成和pH的影响,并使用ANCOVA进行比较。
当在中性pH下比较不同的缓冲液种类时(图5A),在斜率上未观察到显著差异(p值=0.2)。但是,改变pH会导致PRN-AlOOH制剂的校准曲线的斜率发生显著变化(p值=0.04)(图5B)。这些结果表明,校准曲线应与测试样品的缓冲液pH值相匹配,以确保准确测定抗原浓度。其中精确度是极为重要的,建议测试样品和校准曲线的缓冲液条件和pH值相同。在某些情况下,诸如样品体积限制或高通量需求(即缓冲液组成pH和离子强度筛选),其中精确度可用于提高效率或改善限制条件,利用单个缓冲液条件的校准曲线(或合并多个缓冲液条件)可能是一种选择。
2G.吸附百分比
抗原吸附百分比是重要的参数,需要在疫苗的制剂开发过程中将其调整到所需水平
表4:AlOOH中使用50μg/mL(标准)PRN的内源荧光确定吸附百分比
2H.与微量凯氏定氮法的比较
将IF方法与微凯氏定氮方法进行了比较。这种元素分析技术通过对有机氮的定量来确定蛋白质浓度,可以应用于佐剂化样品和非佐剂化样品。抗原浓度未知的样品(佐剂化和非佐剂化)通过微量凯氏定氮法和IF法测定。FHA、PRN、FHA-AlPO
表5:测试内源荧光相对微量凯氏定氮法的精确度,以确定佐剂中的蛋白质浓度
2I.在位方法:荧光流通池概念验证–A部分
进行概念验证(POC)研究以证明原型系统的功能和准确性,该原型系统包括与一次性使用的流通池结合的荧光探针。这种在位荧光测量是通过将流通池整合到生产线中进行的,从而避免了离线采样的需要。将流通池放置在黑盒中,以避免环境光线干扰。将包括光源和回路的光纤电缆连接到光度计和流通池。将波长为280nm的光源用于激发通过光学窗口的样品中的电子。由位于与光源相同角度的反向散射光电探测器来检测发射的光子。将发射滤光片放置在检测器的前面,以使得只有337nm的光子通过并阻挡任何不需要的波长的光。
荧光强度与荧光团(芳香族氨基酸)的数量成正比,因此与蛋白质的浓度成正比。基于该理论,可以基于目标蛋白质的校准曲线对蛋白质浓度进行定量。FHA被用作POC研究的模型抗原。生成了佐剂化FHA和非佐剂化FHA的校准曲线。测试了已知FHA浓度的样品,以确定该方法的初步准确性和精密度。
FHA浓度与荧光信号之间的相关性表明,对于TBS中单独的FHA以及吸附到0.66mgAl/mL AlOOH上的FHA,为线性响应,R2>0.99(图7)。
在位方法显示了TBS中单独FHA以及吸附到0.66mg Al/mL AlOOH上的FHA的高重现性(变异系数<18.4%),即使在使用各种批次的流通池时也是这样(表6)。
表6:TBS中单独的FHA以及吸附到0.66mg Al/mL AlOOH上的FHA的在位校准曲线多次重复的斜率比较。
在位方法显示了TBS中单独的FHA以及吸附到0.66mg Al/mL AlOOH上的高精确度(精确度>94%)(表7)。
表7:TBS中单独的FHA和吸附到0.66mg Al/mL AlOOH上的在位校准曲线的精确度比较。
2J.在位方法:荧光流通池概念验证–B部分
进行了另外的概念验证(POC)研究,以进一步研究原型系统的功能和准确性,该原型系统包括与一次性使用的流通池结合的荧光探针。
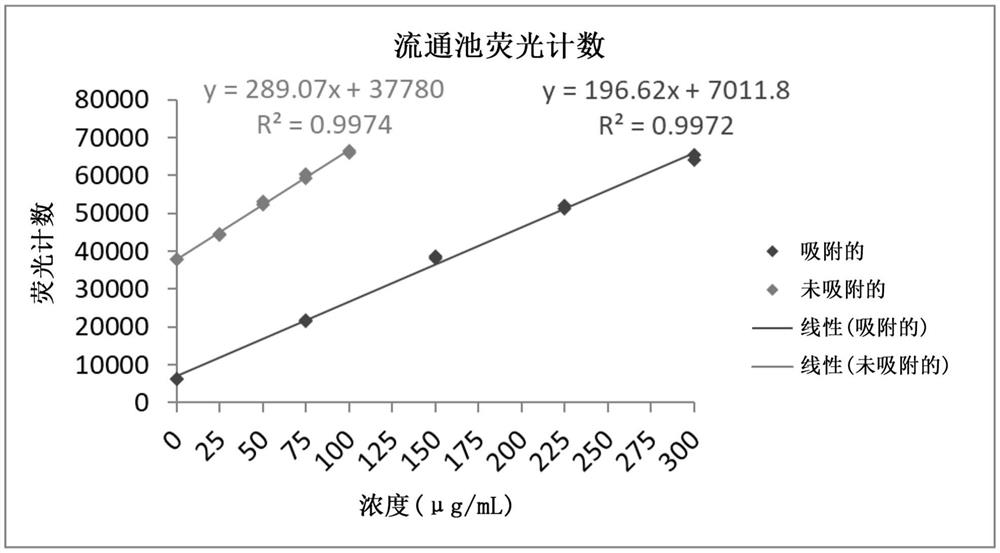
PRN(+/-AlPO
对于每种蛋白质组成,使用荧光流通池计算蛋白质浓度和吸附百分比(如图8所示)。本研究中使用和收集的激发波长和发射波长分别为280nm和337nm。选择五个均匀间隔浓度的样品以构建标准曲线(表8)。然后针对校准范围内的另外五种制剂验证标准曲线的准确性。
表8:
在测定蛋白质浓度时,每种测试的蛋白质(无论是未佐剂化的,还是AlPO
在佐剂颗粒从流通池中沉淀出来后,在位确定AlPO
IV.结论
由于佐剂的固有颗粒性质和抗原对佐剂颗粒通常非常强的吸附,因此在铝盐佐剂存在下测定蛋白质浓度是一项复杂的任务。为了避免浊度驱动的干扰,探索了使用内源荧光(IF)来定量铝盐佐剂化疫苗中的蛋白质。在此证明,可以在两种更常用的铝盐佐剂存在下检测到来自蛋白质的IF,并且可以产生线性响应。结果表明,IF测定在大多数疫苗使用的浓度范围内精度高、可重复性好和灵敏性高,可以很好地定量蛋白质抗原。
当与通常用于确定疫苗中蛋白质浓度的传统方法相比时,IF方法显然具有许多优势。与经典方法相比,IF测定非常简单、是非破坏性的,并且需要最少的测定开发。在这种情况下,IF法显示出与微量凯氏定氮法类似的结果,后者是一种广泛用于测定生物制药产品和疫苗中总蛋白质的方法
本文描述了一种直接的、非破坏性的、简单且廉价的荧光测定法,用于测定包含常用铝盐佐剂的疫苗中的蛋白质浓度。该方法在大多数疫苗中发现的蛋白质浓度范围内显示出精度高、灵敏性高和可重复性好。该技术的应用不仅限于测定含铝佐剂的疫苗中的蛋白质浓度,因为它对定量用其他类型的佐剂系统(如阳离子肽-CpG、角鲨烯乳剂、皂角苷、脂质体等)配制的蛋白质具有巨大的潜力。
尽管已经参考本发明的某些特定实施方案描述了本发明,但是本领域技术人员将理解,可以在不脱离本发明的精神和范围的情况下进行各种修改。所附权利要求的范围不限于所描述的具体实施方案。
参考文献
本说明书中提到的所有专利和出版物表明了本发明所属领域的技术人员的技术水平。每个引用的专利和出版物的全文均通过引用并入本文。在本申请中已经引用了以下所有参考文献:
[1]Agnolon V,Bruno C,Galletti B,Mori E,Ugozzoli M,Pergola C,etal.Multiplex immunoassay for in vitro characterization of acellular pertussisantigens in combination vaccines.Vaccine 2016;34:1040–6.
[2]Katkocin DM,Hsieh C-L.Pharmaceutical Aspects of CombinationVaccines.In:Ellis RW,editor.Comb.Vaccines,Totowa,NJ:Humana Press;1999,p.51–93.
[3]Baldwin SL,Bertholet S,Reese VA,Ching LK,Reed SG,Coler RN.TheImportance of Adjuvant Formulation in the Development of a TuberculosisVaccine.J Immunol 2012;188:2189–97.
[4]Carter D,Reed SG.Role of adjuvants in modeling the immuneresponse:Curr Opin HIV AIDS 2010;5:409–13.
[5]Reed SG,Orr MT,Fox CB.Key roles of adjuvants in modernvaccines.Nat Med 2013;19:1597–608.
[6]Hutcheon CJ,Becker JO,Russell BA,Bariola PA,Peterson GJ,StroopSD.Physiochemical and functional characterization of antigen proteins elutedfrom aluminum hydroxide adjuvant.Vaccine 2006;24:7214–25.
[7]Rinella JV,Workman RF,Hermodson MA,White JL,Hem SL.Elutability ofProteins from Aluminum-Containing Vaccine Adjuvants by Treatment withSurfactants.J Colloid Interface Sci 1998;197:48–56.
[8]Fox CB,Kramer RM,Barnes V L,Dowling QM,Vedvick TS.Workingtogether:interactions between vaccine antigens and adjuvants.Ther AdvVaccines2013;1:7–20.
[9]Zhu D,Saul A,Huang S,Martin LB,Miller LH,Rausch KM.Use of o-phthalaldehyde assay to determine protein contents of Alhydrogel-basedvaccines.Vaccine 2009;27:6054–9.
[10]Hem SL,HogenEsch H,Middaugh CR,Volkin DB.Preformulation studies—The next advance in aluminum adjuvant-containing vaccines.Vaccine 2010;28:4868–70.
[11]Ugozzoli M,Laera D,Nuti S,Skibinski DAG,Bufali S,Sammicheli C,etal.Flow cytometry:An alternative method for direct quantification of antigensadsorbed to aluminum hydroxide adjuvant.Anal Biochem 2011;418:224–30.
[12]Amari JV,Levesque P,Lian Z,Lowden T,deAlwis U.Concentrationdetermination of a recombinant vaccine antigen adsorbed onto an alum adjuvantby chemiluminescent nitrogen detection.Pharm Res 2005;22:33–7.
[13]Wang H,Pampati N,McCormick WM,Bhattacharyya L.Protein NitrogenDetermination by Kjeldahl Digestion and Ion Chromatography.J Pharm Sci 2016;105:1851–7.
[14]Eftink MR.Intrinsic Fluorescence of Proteins.In:Lakowicz JR,editor.Top.Fluoresc.Spectrosc.,vol.6,Boston:Kluwer Academic Publishers;2002,p.1–15.
[15]Ghisaidoobe A,Chung S.Intrinsic Tryptophan Fluorescence in theDetection and Analysis of Proteins:A Focus on
[16]Poveda JA,Prieto M,Encinar JA,González-Ros JM,Mateo CR.IntrinsicTyrosine Fluorescence as a Tool to Study the Interaction of the Shaker B“Ball”Peptide with Anionic Membranes.Biochemistry(Mosc)2003;42:7124–32.
[17]ICH Expert Working Group.Validation of Analytical Procedures:Textand Methodology Q2(R1).Step 4 version 2015.
[18]Ma T,Zuazaga G.Micro-Kjeldahl Determination of Nitrogen.A NewIndicator and an Improved Rapid Method.Ind Eng Chem Anal Ed 1942;14:280–2.
[19]Lakowicz JR,Geddes CD,editors.Topics in FluorescenceSpectroscopy.New York:Plenum Press;1991.
[20]Hem SL,Johnston CT.Production and Characterization of Aluminum-Containing Adjuvants.Vaccine Dev.Manuf.,Hoboken,NJ,USA:John Wiley&Sons,Inc.;2014,p.319–46.
[21]
[22]Hem SL,Hogenesch H.Relationship between physical and chemicalproperties of aluminum-containing adjuvants and immunopotentiation.Expert RevVaccines 2007;6:685–98.
[23]Doshi J.,Ravetkar S.,Ghole V.,Rehani K.Comparative quantitationfor the protein content of diphtheria and tetanus toxoids by DC protein assayand Kjeldahl method.Biologicals 2003;31:187–9.
[24]Pramod K,Tahir Ma,Charoo N,Ansari S,Ali J.Pharmaceutical productdevelopment:A quality by design approach.Int J Pharm Investig 2016;6:129.
[25]Bakeev KA,editor.Process Analytical Technology:SpectroscopicTools and Implementation Strategies for the Chemical and PharmaceuticalIndustries.Chichester,UK:John Wiley&Sons,Ltd;2010.
[26]Faassen S,Hitzmann B.Fluorescence Spectroscopy and ChemometricModeling for Bioprocess Monitoring.Sensors 2015;15:10271–91.
[27](Guidance for Industry PAT—A Framework for InnovativePharmaceutical Development,Manufacturing,and Quality Assurance,PharmaceuticalCGMPs,September 2004).
- 使用内源荧光测定佐剂化蛋白质浓度和吸附百分比的方法
- Fc结合性蛋白质、该蛋白质的制造方法和使用了该蛋白质的抗体吸附剂、以及使用了该吸附剂的抗体的纯化方法及识别方法
