一种面向脑重大疾病的红外光神经调控方法、存储介质
文献发布时间:2023-06-19 18:49:33
技术领域
本发明涉及医用设备技术领域,具体而言,尤其涉及一种面向脑重大疾病的红外光神经调控方法、存储介质。
背景技术
阿尔茨海默病(Alzheimer disease,AD)是一种起病隐匿的进行性发展的神经系统退行性疾病。临床上以记忆障碍、失语、失用、失认、视空间技能损害、执行功能障碍以及人格和行为改变等全面性痴呆表现为特征,病因迄今未明。根据发病形式的不同,可分为散发性阿尔兹海默病和家族性阿尔兹海默病。其中,散发性阿尔兹海默病占阿尔兹海默病患者的90%以上,而家族性阿尔兹海默病呈常染色体显性遗传,大多在65岁之前发病,主要是由淀粉样前体蛋白基因(APP)、早老素-1基因及早老素-2基因突变引起。但是,阿尔兹海默病的具体病因仍不明确且目前无法治愈。因此,对阿尔兹海默病的预防、诊断和治疗是近年来神经退行性疾病领域的研究热点。
目前,阿尔兹海默病的主要治疗手段可分为药物治疗和和非药物治疗:药物治疗主要是抗痴呆药物,包括胆碱能抑制剂、NMDA受体抑制剂和复合制剂;非药物治疗主要有日常干预包括均衡饮食、运动、社交等以及手术治疗包括脑深部电刺激和人源神经干细胞治疗。但是现阶段阿尔茨海默病的药物治疗并不乐观,可用的药物很有限,并且药物治疗并不能逆转病程,只能改善症状;非药物治疗涉及的患者很少而且个体差异性很大。因此,急需一种安全的有效的阿尔兹海默病预防和治疗方法。
红外光(Infrared,IR)是频率介于微波与可见光之间的电磁波,是电磁波谱中频率为0.3THz~400THz,对应真空中波长为1mm~750nm辐射的总称。红外光可分为三部分,即近红外光,波长为(3~2.5)μm~(1~0.75)μm之间;中红外光,波长为(40~25)μm~(3~2.5)μm之间;远红外光,波长为1500μm~(40~25)μm之间。红外光具有很强的热效应,它能够与生物体内大多数无机分子和有机大分子发生共振,使这些分子运动加速并相互摩擦,进而产生热量,因此红外光可以用于加热,也可以应用于分子光谱研究中。法国格勒诺布尔-阿尔卑斯大学Alim-Louis Benabid教授实验室将NIR光纤植入帕金森模型猴子SNc脑区,发现可以改善其运动模式并显著减少细胞死亡、降低氧化应激水平,证明了NIR为神经退行性疾病提供了神经保护作用。德国海德堡大学Werner Hunstein教授实验室将β-淀粉样蛋白转化到人神经母细胞瘤细胞,使用NIR处理细胞后显著增加了ATP水平和总细胞数量,同时减少了β-淀粉样蛋白聚集体,证明了NIR对阿尔兹海默病病理特征的作用效果。美国麻省理工大学Li-Huei Tsai教授实验室对阿尔兹海默病模型小鼠进行40Hz可见光的视觉刺激,可显著减少Aβ的沉积并增加小胶质细胞的数目和对Aβ斑块的围绕,首次证明补充阿尔兹海默病40Hz振荡缺陷可以缓解其病情。复旦大学舒友生教授课题组使用5.8μm中红外光处理细胞,可以改变神经元的放电频率、动作电位的波形,并阐明中红外光的作用效果可能是通过与离子通道共振实现的。上海交通大学魏勋斌教授对阿尔兹海默病模型小鼠APP/PS1进行1070nm 10Hz中红外光视觉刺激,可显著改善该小鼠的学习记忆能力和病理特征。但上述实验结果均存在一定不足,即均为视觉刺激,不能实现特定脑区的精准调控,不利于机制的研究与阐明。
综上所述,目前研究所涉及到的光治疗设备主要为灯光设备,即通过在环境中安装特定频率或波长的LED灯以达到治疗的目的,但某些频率的灯光刺激特别是可见光的高频闪烁会对视觉系统造成伤害。目前研究所涉及到的光调控系统主要是通过视觉系统传入,调控方式和效果不一。主要原因在于这种简单的调控方式可能涉及更复杂的神经环路和信号通路。
发明内容
根据上述提出的技术问题,提供一种面向脑重大疾病的红外光神经调控方法。本发明主要利用微/无创的红外光神经调控系统,通过脑立体定位仪将红外光光纤植入到特定的脑区,或者可穿戴式电极无需植入就可以精确定位特定脑区;使光源作用于与病理特征直接相关的脑区或神经环路,以实现精准调控和机制的阐明。
本发明采用的技术手段如下:
一种面向脑重大疾病的红外光神经调控方法,包括:
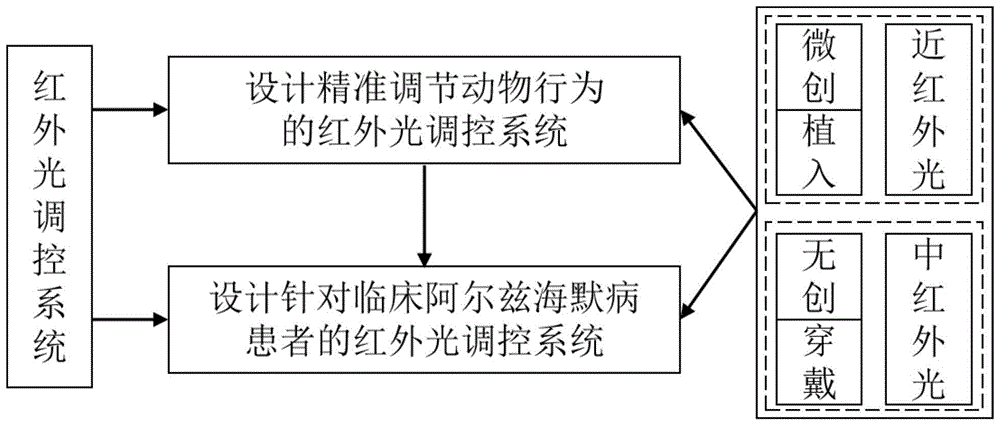
基于阿尔兹海默病动物模型,设计精准调节动物行为的红外光调控系统;
基于动物模型上的红外光调控系统,设计针对临床阿尔兹海默病患者的红外光调控系统。
进一步地,所述设计的精准调节动物行为的红外光调控系统,包括:近红外光二极管、微米级别光纤、脑立体定位仪、控制板以及直流电源;其中:
近红外光二极管连接微米级别光纤,通过脑立体定位仪将连接微米级别光纤的近红外光二极管植入特定脑区,再通过导线将微米级别光纤与控制板和直流电源相连,实现特定脑区的神经调控。
进一步地,所述近红外光二极管连接微米级别光纤,包括:
将微米级别光纤通过UV固化胶水垂直粘在近红外光二极管的发光中心,并在外部套上大小合适的不锈钢毛细管,使用不透光胶水将毛细管固定,并覆盖微米级别光纤外的近红外光二极管,使近红外光二极管不透光。
进一步地,所述设计的针对临床阿尔兹海默病患者的红外光调控系统,包括:光纤刺激模块、电源控制模块、行为检测模块;其中:
光纤刺激模块,用于进行特定频率的光刺激,调控神经环路,改善临床表征;
电源控制模块,通过导线连接光纤刺激模块,用于使光源以特定频率和时间窗进行闪烁刺激;
行为检测模块,用于通过行为学检测验证光学神经调控的作用效果。
进一步地,所述光纤刺激模块包括植入电极或可穿戴式电极,用于将光纤植入或聚焦到特定脑区。
进一步地,所述电源控制模块包括直流电源和频率控制板,直流电源和频率控制板均通过导线连接光纤刺激模块。
本发明还提供了一种存储介质,所述存储介质包括存储的程序,其中,所述程序运行时,执行上述面向脑重大疾病的红外光神经调控方法。
较现有技术相比,本发明具有以下优点:
1、本发明提供的面向脑重大疾病的红外光神经调控方法,其设计的精准调节动物行为的红外光调控系统和针对阿尔兹海默病患者行为的调控系统同时兼具小型化、低功耗、微/无创、可摆脱频率限制、精准治疗等优势,可适用包括阿尔兹海默病在内的多种神经系统疾病。
2、本发明提供的面向脑重大疾病的红外光神经调控方法,利用微/无创的红外光神经调控系统,通过脑立体定位仪将红外光光纤植入到特定的脑区,或者可穿戴式电极无需植入就可以精确定位特定脑区;使光源作用于与病理特征直接相关的脑区或神经环路,以实现精准调控和机制的阐明。
基于上述理由本发明可在医学设备等领域广泛推广。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图做以简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其他的附图。
图1为本发明方法流程框图。
图2为本发明实施例提供的SMT670型号LED光源发光光谱图。
图3为本发明实施例提供的670nm近红外光光纤示意图。
图4为本发明实施例提供的光纤植入海马穹窿脑区的示意图。
图5为本发明实施例提供的接受670nm近红外光照射的小鼠示意图。
图6为本发明实施例提供的条件恐惧实验结果统计图。
图7为本发明实施例提供的蛋白质免疫印迹实验结果示意图。
图8为本发明实施例提供的蛋白质免疫印迹实验结果统计图。
图9为本发明实施例提供的K
具体实施方式
为了使本技术领域的人员更好地理解本发明方案,下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分的实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都应当属于本发明保护的范围。
需要说明的是,本发明的说明书和权利要求书及上述附图中的术语“第一”、“第二”等是用于区别类似的对象,而不必用于描述特定的顺序或先后次序。应该理解这样使用的数据在适当情况下可以互换,以便这里描述的本发明的实施例能够以除了在这里图示或描述的那些以外的顺序实施。此外,术语“包括”和“具有”以及他们的任何变形,意图在于覆盖不排他的包含,例如,包含了一系列步骤或单元的过程、方法、系统、产品或设备不必限于清楚地列出的那些步骤或单元,而是可包括没有清楚地列出的或对于这些过程、方法、产品或设备固有的其它步骤或单元。
如图1所示,本发明提供了一种面向脑重大疾病的红外光神经调控方法,包括:
基于阿尔兹海默病动物模型,设计精准调节动物行为的红外光调控系统;
基于动物模型上的红外光调控系统,设计针对临床阿尔兹海默病患者的红外光调控系统。
具体实施时,作为本发明优选的实施方式,临床上现有的神经调控设备主要集中在电、磁等调控装置上,光学神经调控的概念十分新颖,在临床上几乎没有成型的光学神经调控装备的应用。为解决这一问题,本专利首先基于动物模型,自主研发可精准植入的调节动物行为的近红外光调控装置。本实施例最核心的问题是做到近红外光神经调控既可以有效的发挥作用效果,又兼顾安全性和精准性。因此,本实施例设计了一种小型的、微创的、精准的红外光神经调控元件,包括:近红外光二极管、微米级别光纤、脑立体定位仪、控制板以及直流电源;其中:近红外光二极管连接微米级别光纤,通过脑立体定位仪将连接微米级别光纤的近红外光二极管植入特定脑区,在通过导线将微米级别光纤与控制板和直流电源相连,实现特定脑区的神经调控。
具体实施时,作为本发明优选的实施方式,本实施例使用USHIO公司SMT670型号(670nm,发光光谱如图2所示)发光二极管,将直径300μm的光纤通过UV固化胶水垂直粘在二极管的发光中心,并在外部套上大小合适的不锈钢毛细管,使用不透光胶水将毛细管固定,并覆盖微米级别光纤外的近红外光二极管,使近红外光二极管不透光。(最终装置如图3所示)。本发明选择海马穹窿作为光刺激靶点(如图4所示),然后通过立体定位仪在目标脑区的通过微创手术,将光纤植入,再通过导线将光纤与控制板和直流电源相连。
基于上述实施例在动物模型上实现微创植入式近红外精准神经调控以后,进一步研发更易向临床推广的无创可穿戴式中红外单光粒子神经调控系统。基于中红外光波长更长,聚焦更精准的特点,设计针对动物模型的中红外单光粒子光源调控装置,实现针对深层脑区的无创调控,并在动物模型上评估中红外单光粒子的神经调控效果及其对丘脑底核等深部核团的调控精准性。
具体实施时,作为本发明优选的实施方式,所述设计的针对临床阿尔兹海默病患者的红外光调控系统,包括:光纤刺激模块、电源控制模块、行为检测模块;其中:
光纤刺激模块,用于进行特定频率的光刺激,调控神经环路,改善临床表征;光纤刺激模块包括植入电极或可穿戴式电极,用于将光纤植入或聚焦到特定脑区(如海马穹窿)。
电源控制模块,包括直流电源和频率控制板,直流电源和频率控制板均通过导线连接光纤刺激模块,用于使光源以40Hz,5s ON;60s OFF的特定频率和时间窗进行闪烁刺激;
行为检测模块,用于通过行为学检测验证光学神经调控的作用效果。如图5所示,在模型小鼠脑内可见明显红光,表明本专利设计的近红外光植入式调控系统切实可行。
实施例
本实施例通过有效的行为学和分子生物学检测方法对近红外光的作用效果进行检测,主要思路是:对小鼠进行微创的光纤植入手术,手术完成后对小鼠进行单笼饲养,休息7天后连接电源,使小鼠连续接受14天40Hz 5s ON 60s OFF的红外光刺激,然后进行行为学检测和蛋白质免疫印迹检测,方法如下:
行为学检测使用的是条件恐惧实验,其主要步骤如下:
提前30min将小鼠放到实验房间,使其适应环境。
实验开始时,将小鼠放置到实验笼中使其自由活动2min,随后给予5kHz 80dB 30s的声音提示,并在结束时紧跟0.7mA 2s的足底刺激,1min后重复一次声音提示与足底刺激,1min后将小鼠转移至家笼中。
24h后,将小鼠放在相同的笼子中自由活动5min,即为contextual检测,通过检测小鼠不动的时间(freezing time)检测其学习记忆能力。
随后,将小鼠放置在一个全新的笼子中,并喷洒1%乙酸,使小鼠自由活动5min,随后给予一个5kHz 80dB 30s的声音提示,自由活动5min,即为cued检测,通过检测小鼠不动的时间(freezing time)检测其学习记忆能力。
检测发现,经过红外光照射的阿尔兹海默病模型小鼠的freezing水平显著高于假手术组(sham),表明红外光的照射显著提高了其记忆能力(结果如图6所示)。
分子生物学检测使用的是蛋白质免疫印迹(Western Blot),其主要步骤如下:
将小鼠脱颈处死,断头,取出大脑,剥离海马组织,随后加入裂解液和2颗研磨珠,40Hz 60s研磨组织直至溶液浑浊,无明显组织块,放置冰盒中静置10min。
静置后使用4℃离心机12000rpm离心25min。收集上清液至新的EP管中,并记录体积。
使用BCA试剂盒测定蛋白浓度,562nm测量吸光度值,计算最终浓度,并根据计算结果加水和lodding,使一组样品最终浓度一致。
对所提的蛋白样品进行凝胶电泳,对阿尔兹海默病病理特征蛋白进行相对定量分析。
结果显示,与假手术组相比,淀粉样蛋白前体蛋白APP显著降低,其他蛋白水平也有降低的趋势,表明红外光的照射可以逆转部分阿尔兹海默病的病理特征(蛋白质免疫印迹结果如图7、8所示)。
为了更好地把小鼠模型的治疗迁移到临床中,本发明提出红外光调控的机制之一即光子与Na+、K+通道相互作用,离子通道化学结构模型如图9所示。
综上所述,本发明设计的精准调节动物行为的红外光调控系统和针对阿尔兹海默病患者行为的调控系统同时兼具小型化、低功耗、微/无创、可摆脱频率限制、精准治疗等优势,可适用包括阿尔兹海默病在内的多种神经系统疾病。
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
