用于分配液滴的装置和方法的改进或与之相关的改进
文献发布时间:2023-06-19 19:07:35
技术领域
本发明涉及一种用于分配微液滴的装置和方法,尤其涉及一种包括用于分配一个或多个微液滴的微流体芯片的装置。本发明还涉及一种分配一个或多个微液滴的方法。
背景技术
用于操纵液滴或磁珠的装置在本领域中是公知的。一种用于操纵液滴的技术涉及使液滴(例如在存在不混溶的载体流体的情况下)穿过由盒或微流体管的两个相对壁限定的微流体空间。嵌入在一个或两个壁内的是覆盖有介电层的微电极,每个微电极都连接到A/C偏压电路,A/C偏压电路能够每隔一段时间快速开启和关闭,以改变层的电场特性。这在微电极附近产生局部定向毛细力,其可以用于沿着一个或多个预定路径引导液滴。下文中使用的并且与本发明相关的将被称为“真实”电润湿电极的这些装置在本领域中以缩写EWOD(电介质上的电润湿)装置已知。这种方法的一种变型,其中电润湿力是光学介导的,在本领域中被称为光电润湿,在下文中被称为相应的缩写oEWOD。
采用oEWOD的微流体装置可以包括由第一壁和第二壁限定的微流体腔,其中第一壁是复合设计的并且包括基底层、光导层和绝缘(介电)层。在光导层和绝缘层之间,可以设置导电单元阵列,这些导电单元彼此电隔离并被耦合到光敏层并且其功能是在绝缘层上产生相应的电润湿电极位置。在这些位置,液滴的表面张力特性可以通过电润湿场来改变。然后,这些导电单元可以通过照射在光电导层上的光临时接通。这种方法的优点是,尽管其实用性在某种程度上仍受到电极布置的限制,但切换变得更容易和更快。此外,对于液滴可以移动的速度以及实际液滴路径可以变化的程度存在限制。
在微流体芯片中如上所述使用EWOD或oEWOD进行液滴操纵期间和/或之后,微流体系统上的许多预期工作流程要求将诸如细胞、珠或遗传物质的材料从微流体芯片中回收出来并将其回收到常规液体处理容器(例如384孔板或微管)中。可以进一步分析从微流体芯片分配出来的液滴。这些检测通常包括PCR扩增、DNA测序、RNA测序和细胞扩增。特别是,通常需要回收液滴以用于基因分析,因为这种分析通常涉及极端温度循环,如果该极端温度循环在微流体芯片中进行,则会杀死芯片上保留的任何细胞。
从微流体系统中回收亚纳升液滴是微流体领域长期存在的工程挑战。通常,通过常规机械操作逐个回收液滴是具有挑战性的或不可能的,因为所需的体积移位对用于使流体移位的致动器施加了机械约束。用于连续流动流体的众所周知的现有系统包括按需滴下微致动器和精密设计的分配喷嘴;基本上每一个都需要一个纳升的流体移位步骤。
单液滴回收的另一种方法是使用条形码化学品,如DNA条形码。在这类方案中,在将液滴引入液滴流体系统并进行分析之前,液滴装载有独特的DNA条形码。DNA测序通常需要昂贵、复杂的仪器。然后,在芯片上分析中表现出兴趣的液滴随后以汇集格式回收,并读取条形码以恢复输入细胞的身份。这样的方案避免了逐滴回收的需求,但它们限制了芯片上分析的性质,并增加了昂贵、复杂的制备和分析步骤。
发明内容
因此,需要为用户提供易于与微流体芯片结合使用的液滴回收系统。此外,还需要提供一种从微流体芯片转移微液滴的经济高效的分配系统和方法,以便从芯片回收材料以对该液滴的细胞含量进行分析。还需要一种系统,该系统具有逐个回收亚纳升液滴的灵活性,同时还能够在需要时以汇集形式分配液滴。
本发明就是在这样的背景下产生的。
根据本发明的一个方面,提供了一种用于分配一个或多个微液滴的装置,该装置包括微流体芯片,该微流体芯片具有被配置为产生光学介导的电润湿(oEWOD)力的oEWOD结构,该微流体芯片包括第一区域和第二区域,其中所述第一区域和第二区域由收缩部间隔开;
其中,第一区域适于接收和操纵以第一流率分散在载体流体中的一个或多个微液滴;并且
其中,第二区域被配置为经由收缩部从第一区域接收微液滴,并以第二流率将所述微液滴转移到微流体芯片的出口端口;
其中,第二区域被配置为通过施加光学介导的电润湿(oEWOD)力经由收缩部从第一区域接收所述微液滴;并且
其中,第二区域中的第二流率高于第一区域中的第一流率。
在一些实施例中,可以提供一种用于分配一个或多个微液滴的装置,该装置包括微流体芯片,该微流体芯片包括第一区域和第二区域,其中所述第一区域和所述第二区域由收缩装置间隔开;
其中,第一区域适于接收和操纵以低载体流体流率分散在载体流体中的一个或多个微液滴;并且
其中,第二区域被配置为经由收缩装置从第一区域接收微液滴,并以较高载体流体流率将所述微液滴转移到微流体芯片的出口端口;
其特征在于,所述第二区域被配置为通过施加光学介导的电润湿(oEWOD)力经由收缩装置从第一区域接收所述微液滴。
本发明中公开的装置和方法是有利的,因为它能够在如本发明中所述的简化且成本有效的系统中从微流体系统中回收微液滴,并且在某些情况下回收亚纳升液滴。如本发明所述的液滴回收系统使用户能够有效地从微流体装置中移除液滴,并将感兴趣的液滴收集或分配到诸如多孔板的容器上。这将允许用户能够对微流体芯片上不容易获得的液滴的细胞含量或珠含量进行进一步的分析。这些分析可以包括但不限于PCR扩增、DNA测序、RNA测序和/或细胞扩增。此外,可以选择来自微流体装置的单个液滴进行回收,然后将其沉积在多孔板上。
此外,所公开的装置和方法可以用于分配单独的液滴,然后进行预筛选以仅选择感兴趣的微液滴。这防止了不相关液滴的后续分析,并允许仅选择芯片上液滴的相关子部分。
此外,可以选择包含在微流体装置内的液滴的子群体进行分配,同时任何剩余的液滴保留在芯片内部,而不必影响其环境条件。
在一些实施例中,微液滴可以被单独地从装置分配。在一些实施例中,可以同时从装置分配多个微液滴。在一些实施例中,微液滴可以按活性分组或汇集,并且可以根据需要从装置分配多个选定的微液滴。在一些实施例中,微液滴的活性可以例如通过荧光强度来解决。
在一些实施例中,第一区域中的载体流体处于低流率或零流率。第一区域可以用于保持或储存微液滴。第一区域中的液滴操作还可以包括但不限于oEWOD操作,以对液滴进行排序、合并、拆分或排列,例如排列成阵列。
在一些示例中,可以在芯片的第一区域中操纵微液滴。在一些实施例中,低速率可以在0至20μL/min的范围内。在一些实施例中,第一流率可以在0至20μL/min的范围内。
在一些实施例中,第二区域中的载体流体具有高流率。通过在第二区域中提供高流率,液滴能够朝向微流体装置的出口端口移动。例如,高流率在10至100μL/min的范围内。例如,第二流率在10至100μL/min的范围内。
在一些实施例中,可以动态地控制第二区域中的流率,使得其可以在接收液滴时的低/零速率和喷射一个液滴或多个微液滴时的较高速率之间变化。在另一实施例中,当不分配液滴时,第二区域中的流率可以为0至20μL/min。在一些实施例中,在分配过程中,第二区域中的流率可以为10-100μL/min。
在一些实施例中,其中第二区域接收来自第一区域的多个微液滴,第二区域中的流率可以为0.02至2.00μL/min,或者其可以大于0.02、0.05、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1、1.5或2μL/min。在一些实施例中,第二区域中的流率可以小于2、1.5、1、0.9、0.8、0.7、0.6、0.5、0.4、0.3、0.2、0.1或0.05μL/min。第二区域中的流率高于0μL/min可以防止微液滴堵塞收缩部。随后,一旦第二区域已经接收到多个微液滴,就可以增加流率以有效地从微流体装置分配微液滴。在一些实施例中,在第二区域中的流率增加之前,第二区域可以接收1至10 000个微液滴。在一些示例中,第二区域可以接收多于1、50、100、200、500、700、1000、1250、1500、1750、2000、2500、3000、3500、4500、5000、5500、6000、6500、7500、8000、8500、9000、9500或10000个微液滴。在一些实施例中,第二区域中的流率可以增加到2、5、10、15或20μL/min以上。
在一些实施例中,第一区域的横截面面积可以是1x10
在一些实施例中,第一区域的面积可以大于第二区域的面积。有利的是,第一区域具有大的横截面面积以有效地操纵大量液滴,这有利于高通量装置。除了第一区域的面积之外,第一区域可以同时容纳的液滴的数量取决于液滴的大小。例如,面积为1.245x10
在一些实施例中,本发明的微流体芯片具有被配置为产生oEWOD力的oEWOD结构。oEWOD结构可以是能够产生oEWOD力的任何结构。
在一些实施例中,本发明的微流体芯片包括oEWOD结构,该oEWOD结构包括:
第一复合壁,该第一复合壁包括:第一基底;在该基底上的第一透明导体层,该第一透明导体层的厚度在70至250nm的范围内;在导体层上的由波长范围为400-1000nm的电磁辐射激活的光活性层,该光活性层的厚度在300-1500nm的范围内,以及在光活性层上的第一介电层,该第一介电层的厚度在30至160nm的范围内;
第二复合壁,该第二复合壁包括:第二基底;在该基底上的第二导体层,第二导体层的厚度在70至250nm的范围内,以及可选地,在第二导体层上的第二介电层,第二介电层的厚度在30至160nm或120至160nm的范围内;
其中,第一介电层和第二介电层的暴露表面被设置为间隔开小于180μm,以限定适于容纳微液滴的微流体空间;
A/C源,其用于在第一复合壁和第二复合壁上提供电压并且连接第一导体层和第二导体层;
至少一个电磁辐射源,其具有高于光活性层的能带隙的能量,该电磁辐射源适于撞击在光活性层上以在第一介电层的表面上诱导相应的虚拟电润湿位置;以及
操纵装置,其用于操纵电磁辐射在光活性层上的撞击的点以改变虚拟电润湿位置的布置,从而创建至少一条电润湿路径,微液滴可以被促使沿该电润湿路径移动。
在一些实施例中,第一介电层和第二介电层可以由单种介电材料构成,或者其可以是两种或多种介电材料的复合物。介电层可以由但不限于Al
在一些实施例中,可以在第一介电层和第二介电层之间提供一种结构。第一介电层和第二介电层之间的该结构可以由但不限于环氧树脂、聚合物、硅或玻璃或其混合物或其复合物制成,具有直的、成角度的、弯曲的或微结构化的壁/面。第一介电层和第二介电层之间的结构可以连接到顶部复合壁和底部复合壁,以形成密封的微流体装置并在该装置内限定通道和区域。该结构可以占据两个复合壁之间的间隙。
在一些实施例中,本发明的微流体芯片包括oEWOD结构,其包括:
第一复合壁,该第一复合壁包括:第一基底;在该基底上的第一透明导体层,该第一透明导体层的厚度在70至250nm的范围内;在导体层上由波长范围400-850nm的电磁辐射激活的光活性层,该光活性层的厚度在300-1500nm的范围内,以及在光活性层上的第一介电层,该第一介电层的厚度在20至160nm的范围;
第二复合壁,该第二复合壁包括:第二基底;在该基底上的第二导体层,第二导体层的厚度在70至250nm的范围内,以及可选地,在第二导体层上的第二介电层,第二介电层的厚度在20至160nm的范围;
其中,第一介电层和第二介电层的暴露表面被设置为间隔开20-180μm,以限定适于容纳微液滴的微流体空间;
A/C源,其用于在第一复合壁和第二复合壁上提供电压并且连接第一导体层和第二导体层;
第一电磁辐射源和第二电磁辐射源,其具有高于光活性层的能带隙的能量,第一电磁辐射源和第二电磁辐射源适于撞击在光活性层上以在第一介电层的表面上诱导相应的虚拟电润湿位置;以及
操纵装置,其用于操纵电磁辐射在光活性层上的撞击的点以改变虚拟电润湿位置的布置,从而创建至少一条电润湿路径,微液滴可以被促使沿该电润湿路径移动。
在一些实施例中,本发明的微流体芯片包括oEWOD结构,该oEWOD结构包括第一复合壁和第二复合壁。第一复合壁和第二复合壁中的每一个都包括基底、导体层和介电层。此外,第一复合壁具有光活性层。
每个导体层都可以具有70至250nm范围内的厚度,并且可以是透明的。介电层的厚度可以在20至160nm的范围内。通过波长范围为400-850nm的电磁辐射激活光活性层。光活性层的厚度在300-1500nm的范围内。此外,第一介电层和第二介电层的暴露表面被设置为间隔开20-180μm,以限定在使用中包含微液滴的微流体空间。
芯片还包括A/C源,以在第一复合壁和第二复合壁上提供电压并且连接第一导体层和第二导体层。芯片还包括能量高于光活性层的能带隙的第一电磁辐射源和第二电磁辐射源。所述电磁辐射源适于撞击在光活性层上以在第一介电层的表面上诱导相应的虚拟电润湿位置。该芯片还包括数字微镜装置(DMD),其在使用中操纵电磁辐射在光活性层上的撞击的点,以改变虚拟电润湿位置的布置,从而产生微液滴沿其移动的至少一个电润湿路径。
这些结构的第一壁和第二壁是透明的,微流体空间夹在其间。
合适地,第一基底和第二基底由机械强度高的材料制成,例如玻璃金属或工程塑料。在一些实施例中,基底可以具有一定程度的柔性。在又一实施例中,第一基底和第二基底的厚度在100-1000μm的范围内。在一些实施例中,第一基底由硅、熔融二氧化硅和玻璃中的一种构成。在一些实施例中,第二基底由熔融二氧化硅和玻璃之一构成。
第一导体层和第二导体层位于第一基底和第二基底的一个表面上,并且通常具有70至250nm、优选70至150nm范围内的厚度。这些层中的至少一个由透明导电材料如氧化铟锡(ITO)、导电金属如银的非常薄的膜或导电聚合物如PEDOT等制成。这些层可以形成为连续片或一系列离散结构,例如导线。替代地,导体层可以是导电材料的网格,电磁辐射被定向在网格的间隙之间。
光活性层适当地由半导体材料构成,该半导体材料能够响应于第二电磁辐射源的刺激而产生局部电荷区域。示例包括厚度在300至1500nm范围内的氢化非晶硅层。在一些实施例中,通过使用可见光来激活光活性层。在第一壁的情况下的光活性层和任选地在第二壁的情况下的导电层涂覆有介电层,该介电层通常在20至160nm的厚度范围内。度和大于3的介电常数。优选该层的介电性能优选地包括大于10^7V/m的高介电强地,它尽可能薄,以避免介电击穿。在一些实施例中,介电层选自氧化铝、二氧化硅、二氧化铪或薄的非导电聚合物膜。
在这些结构的另一个实施例中,至少第一介电层(优选两者)涂覆有防污层,以帮助在各种虚拟电润湿电极位置处建立期望的微液滴/载体流体/表面接触角,并且另外防止微液滴的内容物粘附到表面并且随着微液滴移动通过芯片而减少。如果第二壁不包括第二介电层,则第二防污层可以被直接施加到第二导体层上。
为了获得最佳性能,当在250℃下作为气液表面三点界面测量时,防污层应帮助建立微液滴/载体流体/表面接触角,该表面接触角应在50-180°范围内。在一些实施例中,这些层具有小于10nm的厚度,并且通常是单分子层。在另一种情况下,这些层由丙烯酸酯例如甲基丙烯酸甲酯的聚合物或其被亲水基团取代的衍生物例如烷氧基甲硅烷基(alkoxysilyl)构成。防污层中的任何一个或两个都是疏水的,以确保最佳性能。在一些实施例中,厚度小于20nm的二氧化硅的间隙层可以被插入在防污涂层和介电层之间以提供化学兼容的桥。
第一介电层和第二介电层以及因此第一壁和第二壁限定了微流体空间,该微流体空间的宽度至少为10μm,优选地在20-180μm的范围内,并且微液滴被容纳在该微流体空间中。优选地,在微液滴被容纳之前,微液滴本身的固有直径比微液滴空间的宽度大10%以上,适当地大20%以上。因此,在进入芯片时,使微液滴经受压缩,从而通过例如更好的微液滴合并能力来增强电润湿性能。在一些实施例中,第一介电层和第二介电层涂覆有疏水涂层,例如氟硅烷。
在另一实施例中,微流体空间包括一个或多个间隔件,以用于将第一壁和第二壁保持间隔开预定量。间隔件的选项包括珠状物或柱状物、由已经通过光图案化产生的中间抗蚀层形成的脊状物。或者,可以使用诸如氧化硅或氮化硅的沉积材料来形成间隔件。或者,可以使用包括具有或不具有粘合剂涂层的柔性塑料膜的薄膜层来形成间隔件层。各种间隔件几何构造可以用于形成由柱状物的线限定的窄通道、锥形通道或部分封闭通道。通过仔细设计,可以使用这些间隔件来辅助微液滴的变形,随后执行微液滴拆分并对变形的微液滴进行操作。类似地,这些间隔件可以用于物理分隔芯片的区域,以防止液滴群之间的交叉污染,并在液压压力下装载芯片时有助于液滴沿正确方向流动。
使用附接到导体层的A/C电源对第一壁和第二壁进行偏压,以在它们之间提供合适地在10至50伏的范围内的电压电势差。这些oEWOD结构通常与波长在400-850nm范围内,优选660nm且能量超过光活性层的带隙的第二电磁辐射源结合使用。合适的是,在所用辐射的入射强度在0.01至0.2Wcm
在电磁辐射源被像素化的情况下,使用反射式屏幕(例如由LED或其他灯照明的数字微镜装置(DMD))直接或间接地提供电磁辐射源。这使得高度复杂的虚拟电润湿电极位置的图案能够在第一介电层上被快速创建和破坏,从而使得微液滴能够利用紧密受控的电润湿力精确地沿着几乎任一虚拟路径运动。这种电润湿路径可以被看作是由第一介电层上的虚拟电润湿电极位置的连续体构成的。
电磁辐射源在光活性层上的撞击的点可以是任何方便的形状,包括常规的圆形或环形。在一些实施例中,这些点的形态由相应像素化的形态确定,并且在另一个实施例中完全或部分对应于一旦微液滴已经进入微流体空间时微液滴的形态。在一个实施例中,撞击的点以及因此电润湿电极位置可以是新月形的,并且被在微液滴的预期行进方向上定向。适当地,电润湿电极位置本身小于粘附到第一壁的微液滴表面,并且在微液滴和表面电介质之间形成的接触线上给出最大的场强度梯度。
在oEWOD结构的一些实施例中,第二壁还包括光活性层,该光活性层使得也能够通过相同或不同的电磁辐射源在第二介电层上诱导虚拟电润湿电极位置。添加第二介电层使得微液滴的润湿边缘能够从结构的上表面过渡到下表面,并且能够向每个微液滴施加更多的电润湿力。
第一介电层和第二介电层可以由单种介电材料构成,或者其可以是两种或多种介电材料的复合物。介电层可以由但不限于Al
通过最小化针孔缺陷的不利影响,第一介电层和第二介电层可以有助于在相对大的面积上同时操纵数千个微液滴。介电层总是具有稀疏的针孔缺陷,由此它们在小的、隔离的区域中变得导电。针孔缺陷会捕获液滴,使其无法移动。当使用导电介质(如缓冲溶液)的液滴时,效果更为深远。可以在介电击穿电压以下操作本发明的第一介电层和第二介电层,并且可以通过最小化任何单个针孔缺陷形成导电路径的可能性来抵消针孔缺陷的影响。通过第二介电层的存在实现的针孔缓解特征是允许在相对大的区域中同时操纵数千个液滴的关键。在一些实施例中,该装置可以在大于50cm
在一些实施例中,可以通过在第一介电层和第二介电层上施加低于介电层的介电击穿电压的电压来实现光学介导的电润湿。在一些实施例中,可以使用低功率照明源(例如LED)来实现光学介导的电润湿。在一些实施例中,可以使用功率为0.01W/cm
在一些实施例中,该装置可以用于操纵和控制由离子缓冲溶液形成的导电微液滴,该离子缓冲溶液含有能够被高电流损坏的生物分子。在两个介电层上施加的低电压防止导电液滴的破坏性电离,并防止生物分子的破坏。
可以在第一介电层和第二介电层之间提供结构。第一介电层和第二介电层之间的结构可以由但不限于环氧树脂、聚合物、硅或玻璃或其混合物或其复合物制成,该结构具有直的、成角度的、弯曲的或微结构化的壁/面。第一介电层和第二介电层之间的该结构可以连接到顶部复合壁和底部复合壁,以形成密封的微流体装置并在该装置内限定通道和区域。该结构可以占据两个复合壁之间的间隙。可选地或附加地,导体和电介质可以被沉积在已经具有壁的成形基底上。
本发明的方法和设备的一些方面适合于被应用于除电润湿装置之外的光学激活装置,例如被配置为经由介电电泳或光镊操纵微粒的装置。在这种装置中,使用功能相同的光学仪器操纵和检查细胞或颗粒,以产生虚拟的光学介电电泳梯度。如本文所定义的微粒可以是指诸如生物细胞、由包括聚苯乙烯和乳胶的材料制成的微珠、水凝胶、磁性微珠或胶体的微粒。介电电泳和光镊机构在本领域中是公知的,并且可以由技术人员容易地实施。
在一些实施例中,微液滴可以包括生物材料、一个或多个细胞或一个或多个珠。在一些实施例中,微液滴可以包括生物细胞、细胞培养基、化学化合物或组合物、药物、酶、具有任选的结合到其表面的材料的珠或微球。更具体地,细胞可以是哺乳动物、细菌、真菌、酵母、巨噬细胞、杂交瘤,并且可以选自但不限于:CHO、白血病细胞(Jurkat)、CAMA、人宫颈癌细胞、B细胞、T细胞、MCF-7、MDAMB-231、大肠杆菌或沙门氏菌。微液滴中含有的化学物质可以是酶、检测试剂、抗体、抗原、药物、抗生素、裂解(lysis)试剂、表面活性剂、染料或细胞染色剂。可以包含在微液滴内的其他生物或化学材料包括DNA寡核苷酸、核苷酸、装载或卸载的珠/微球、荧光报告分子、纳米颗粒、纳米线或磁性颗粒。
在一些实施例中,收缩部可以是物理元件,例如物理屏障。
在一些实施例中,收缩装置可以包括开口或间隙。来自第一区域的微液滴可以通过间隙进入到第二区域中,反之亦然。开口必须具有足够的宽度以允许微液滴通过第一区域进入到第二区域中。在一些实施例中,开口的宽度可以在20至200微米之间。在一些实施例中,开口的宽度可以大于20、40、60、80、100、120、140、160或180微米。在一些实施例中,开口的宽度可以小于200、180、160、140、120、100、80、60、40或30微米。在一些实施例中,开口的宽度可以在20至400微米之间。在一些实施例中,开口的宽度可以大于20、50、100、150、200、250、300或350微米。在一些实施例中,开口的宽度可以小于400、350、300、250、200、150、100、50或30微米。
如本发明中所公开的,除非另有说明,否则本文中的术语“收缩装置”或“收缩部”是指能够将第一区域和第二区域间隔开的任何构造或装置。收缩装置或收缩部可以是物理元件,例如用于将第一区域和第二区域间隔开的壁或屏障。可选地或附加地,收缩装置或收缩部可以是鞘流体流或半透隔膜。
在一些实施例中,收缩部可以是半透隔膜。可以提供半透隔膜以允许分子或离子的选择性扩散。在一些实施例中,半透隔膜可以是非多孔的。
在一些实施例中,收缩部可以是鞘流体。如本发明所公开的,除非另有说明,术语“鞘流体”或“鞘流”是指密度或速度足够不同使得这些流体不发生混合的至少两种流体。
在一些实施例中,第二区域的几何构造可以是大致新月形的通道。新月形或马蹄形构造可能是有利的,因为它允许在装置内部近距离制造第二区域的入口端口和出口端口。这种构造可以使微流体芯片内的可用空间最大化。此外,新月形构造还具有减少制造该装置的负担和降低制造成本的附加优点。在一些实施例中,第二区域的入口端口和出口端口之间的距离可以是1500μm。可选地,第二区域的几何构造可以是半圆形通道,或者它可以是正方形、矩形或弯曲的几何构造。在一些实施例中,第二区域可以具有直的、弯曲的或曲折的几何构造,以便适应芯片上可能需要的其他微流体特征或结构。在一些实施例中,第二区域的几何构造可以是任何合适的形状或构造。
第二区域的几何构造可以具有10至1000微米之间的通道宽度。第二区域可以包括恒定或变化宽度的通道。在一些实施例中,通道的宽度可以朝向入口端口或出口端口收缩,以减少产生液滴可能被卡住的低流动区域的可能性,并且还减少液滴离开微流体芯片所花费的时间。
在一些实施例中,新月形通道可以具有大于10、20、40、60、80、100、120、140、160、180、200、250、300、350、400、450、500、550、600、650、700、750、800、850、900或950微米的宽度。在一些实施例中,新月形通道可以具有小于1000、950、900、850、700、750、700、650、600、550、500、450、400、350、300、250、200、180、160、140、120、100、80、60、50、40、30或20微米的宽度。
在一些实施例中,第二区域可以进一步包括多个通道,每个通道可以被配置成接收来自第一区域的微液滴并将所述微液滴转移到微流体芯片的出口端口。
在一些实施例中,第二区域可以包括1至1000个通道。在一些实施例中,第二区域可以包括多于1、10、50、100、150、200、250、300、350、400、450、500、550、600、650、700、750、800、850、900或950个通道。在一些实施例中,第二区域可以包括少于1000、950、900、850、750、700、650、600、550、450、400、350、300、250、200、150、100、50或10个通道。
在一些实施例中,第二区域中的多个通道中的每一个都可以具有大致新月形的几何构造。在一些实施例中,第二区域中的多个通道中的每一个都可以具有马蹄形构造。在一些实施例中,第二区域中的多个通道中的每一个可以具有半圆形几何构造,或者每个通道可以是正方形、矩形或弯曲的几何构造。在一些实施例中,第二区域中的多个通道中的每一个都可以具有直的、弯曲的或曲折的几何构造,以便适应芯片上可能需要的其他微流体特征或结构。在一些实施例中,第二区域中的多个通道中的每一个都可以是任何合适的形状或配置。新月形或马蹄形构造可能是有利的,因为它允许在装置内部近距离制造第二区域的入口端口和出口端口。这种构造可以使微流体芯片内的可用空间最大化。此外,新月形构造还具有减少制造该装置的负担和降低制造成本的附加优点。
在一些实施例中,第二区域中的多个通道可以平行布置。在一些实施例中,第二区域中的多个通道可以串联布置。
在一些实施例中,第二区域中的多个通道可以用于促进微液滴的分选。在一些实施例中,多个通道可以在单个出口处组合。在一些实施例中,可以通过相同的出口从装置中分配感兴趣的微液滴和被发现不相关的微液滴。在一些实施例中,第二区域中的多个通道可以通向第二区域中的多个出口。多个通道和多个出口可以被配置为使得可以同时从微流体装置分配多个微液滴。从该装置同时分配多个液滴通过最小化从该装置分配微液滴所需的时间来最大化该装置的吞吐量。
在一些实施例中,可以以任何期望的顺序从微流体装置分配微液滴。在一些实施例中,可以以与微液滴被装载到微流体装置中的顺序相同的顺序从装置中分配微液滴。在一些实施例中,可以以与微液滴被装载到微流体装置中的顺序不同的顺序从装置分配微液滴。
在一些实施例中,该装置还可以包括用于控制载体流体的通过微流体芯片从微流体芯片的入口端口到出口端口的流量的装置。
在一些实施例中,用于控制载体流体的流量的装置可以是阀和/或泵。仅作为示例,泵可以是注射器或压力泵。该阀可以是2端口2通阀或3端口选择阀。
在一些实施例中,用于控制流量的装置可以是软件控制的泵源,例如注射泵或压力泵,其可以连接到微流体芯片的一个入口端口。与一个或多个选择阀结合,泵可以连接到微流体芯片的多个端口,由此一个或多个端口可以接收流,而其他端口被密封。通过具有软件控制的泵,可以自动控制泵源并打开或关闭泵源,而无需手动干预。另外或替代地,阀和/或泵可以被手动控制。此外,用于控制载体流体流的泵和/或阀提供了整个微流体芯片上的从微流体芯片的入口端口到出口端口的恒定流率。
在一些实施例中,用于控制流量的装置(例如阀和/或泵)可以被配置为通过导管被连接到微流体芯片的出口端口。导管可以是内径为20-500微米的管。在一些实施例中,导管可以具有大于20、50、100、150、200、250、300、350、400或350微米的内径。在一些实施例中,导管可以具有小于500、450、400、350、300、250、200、150、50或20微米的直径。
在一些实施例中,阀可以是2端口2通阀、4端口2通阀和/或6端口2通阀。阀可以额外地具有“关闭”位置,由此微流体芯片的出口端口被密封,使得流体不能流动。多个阀可以以序列或网络的方式连接在一起,以实现类似的结果。
通过具有4端口2通阀,该阀可以在液滴被分配时密封微流体芯片,从而降低微流体芯片内不希望的液滴移动的可能性。一旦液滴已经通过4端口2通阀,4端口2通阀还可以允许使用较高的流率来加速分配。此外,芯片内部的压力可能会得到更好的控制。
通过提供6端口2通阀,还有一个额外的好处是通过在捕获环路中仅捕获期望的液滴,可以更容易地大幅减少或去除气泡和/或额外的液滴。此外,使用6端口2通阀可以允许将取样环路引入到导管中,使得仅分配来自芯片内部的少量流体。这可以允许用于分配的载体相是水介质,使得仅小体积的不混溶载体介质与液滴一起被分配,并减少分配过程所需的不混溶载体介质的量。
通过提供4端口2通阀,可以提供旁通路径,使得一旦液滴已经从芯片上被移除并通过阀,流就可以直接从泵被改程到包含液滴的分配导管。液滴的进一步运动将不需要流体通过芯片。这减少了将更多不需要的液滴或其他材料从芯片引入到被分配的体积的可能性。此外,它还可以减少干扰芯片的内容物的可能性。此外,它还可以减少芯片的内容物经受由高流率引起的较高压力的时间。使用4端口2通阀可以允许在第二区域内立即开始进一步的oEWOD操作,从而减少后续分配操作所需的时间。
另外或替代地,可以提供8端口2通阀或10端口2通阀。8端口2通阀或10端口2通阀可以允许将第二取样环路并入到导管中,使得分配过程可以被进一步加速。
在一些实施例中,提供了多端口选择阀。多端口选择阀可以与本文公开的任何其他阀组合使用,以进一步使分配过程更多样化。
根据本发明的装置还可以包括控制器,该控制器被配置为控制流量的装置,例如连接到微流体芯片的第二区域的出口端口的阀和/或泵。控制器可以是计算机或微处理器上的软件应用程序。
在一些实施例中,控制器可以被激活以将阀切换到打开位置或打开泵,使得来自微液滴的载体流体可以流过和流出微流体装置的出口端口。可以控制泵以提供特定的流率和/或也可以控制泵来提供或保持恒定的流率。可以控制(一个或多个)阀以引导流体流流入到微流体装置的特定入口端口中或流出微流体装置的特定入口端口,和/或沿着特定连接的导管引导流体流。
在一些实施例中,本发明中公开的装置还可以包括检测系统,该检测系统用于从自微流体芯片的出口端口分配的微液滴检测检测信号。在一些实施例中,检测系统可以用于通过完全或部分位于连接的导管内部或附近的传感器或检测模块来检测在连接的导管的特定位置或区域中分配的微液滴的存在或不存在。
检测系统可以包括传感器或检测器。在一些实施例中,传感器或检测器可以是光学传感器或电检测器。光学传感器的示例可以是但不限于光源、透镜装置和光电二极管或光电晶体管,或透镜和相机。电传感器或检测器的示例可以是但不限于电容检测器或阻抗检测器。
在一些实施例中,控制器可以被配置为控制所述微液滴或每个所述微液滴在第二区域中的通道中的每一个中的同时流动。微液滴在第二区域中的多个通道中的同时流动可以最小化从装置分配微液滴所花费的时间。在一些实施例中,控制器可以被配置为顺序地控制微液滴在第二区域中的每个通道中的流动。微液滴通过第二区域中的多个通道的顺序流动可以有助于在从装置分配之前对微液滴进行分类。
在一些实施例中,多个微液滴可以被同时转移到微流体芯片的出口端口。在一些实施例中,可以同时从微流体芯片分配多个微液滴。
在一些实施例中,本发明的装置还可以包括第一区域的入口端口或出口端口以及设置到第一区域的入口端口或出口端口的阀。在一些实施例中,该装置还可以包括连接在第一区域的入口端口或出口端口处的阀。有利的是,在第一区域的入口端口和/或出口端口处设置阀以防止第一区域中的流动。因此,这确保了第二区域中的流动不会中断第一区域内的液滴操作或存储。
在一些实施例中,该装置还可以包括读取器模块,该读取器模块包括模拟电路,该读取器模块被配置为从传感器或检测模块读取所生成的信号并将其传输到控制器,在所生成的信号被传输到所述控制器时,该控制器还可以被配置为将阀定位到打开位置以使得微液滴被分配。在一些实施例中,该装置还可以包括读取器模块,该读取器模块被配置为从传感器或检测模块读取所生成的信号并将其传输到控制器,在所生成的信号被传输到所述控制器时,控制器还被配置为将阀定位到打开位置以使得微液滴被分配。读取器模块可以是诸如微控制器的控制器。该阀可以用于控制孔板和/或分配头处的流的方向。在一些实施例中,流可以被引导到废物容器或通道,但是当检测到液滴时,阀被切换以使得液滴被引导到孔板或其他分配容器中。
在一些实施例中,本发明的装置还可以包括容器,其中容器可以被配置为接收被分配的微液滴。在一些实施例中,本发明的装置可以进一步包括容器,其中容器可以被配置为接收被分配的微液滴。
在一些实施例中,容器是多孔板、PCR管或微离心管。容器可以是例如96多孔板或384多孔板的多孔板。或者,容器可以是PCR管或微离心管,例如Eppendorf管或其他合适的容器。
在一些实施例中,多孔板可以被安装到多轴运动受控台上,其中多轴运动受控台可以被配置为将多孔板移动到第一位置,使得目标孔被定位在阀的出口端口下方。多轴运动受控台可以是X、Y、Z轴运动受控台。在一些实施例中,多孔板可以被安装到多轴运动受控台上,其中多轴运动受控台可以被配置为将多孔板移动到第一位置,使得目标孔被定位在被设置到微流体芯片的出口端口的阀下方。
可选地,阀或分配头可以被安装到运动受控台上,使得孔板是静止的,并且分配头在孔板上移动。可选地,孔板和分配头都可以被安装到运动受控台上。
在一些实施例中,传感器可以被定位在导管中,即样品环路中,使得6、8或10端口阀可以切换到打开位置,以将液滴捕获在导管(即样品环路)内。可以提供第二传感器来随后检测分配头附近的分配管中的液滴,以便触发将要被分配到容器中的液滴。在使用采样环路以允许使用水介质分配液滴的实施例中,传感器将检测在采样环路中捕获的不混溶载体流体的塞的存在,该塞将包含微液滴。
在一些实施例中,每个孔都可以预先填充有一定体积的细胞培养基。细胞培养基可以包括但不限于EMEM、DMEM、RPMI、K12、Hams。
在一些实施例中,每个孔都可以预先填充有一定体积的以下中的一种或多种:缓冲剂、水或油。在一些实施例中,缓冲剂可以是裂解缓冲剂。在一些实施例中,缓冲剂或水或油可以包括用于后续分析的组分或先决条件。例如,如果要进行PCR或qPCR,先决条件可以包括引物或适当的对照(controls)。
在一些实施例中,在本文所公开的分配过程中,导管的端部(例如外管的端部)可以被降低到孔内的预填充体积的表面之下。
分配系统可以包括其他部件或过程,以在分配之间清洗导管、阀、分配头和管,以减少交叉污染的可能性。
在本发明的另一方面,提供了一种用于分配一个或多个微液滴的方法,该方法包括以下步骤:
提供微流体芯片,该微流体芯片包括由收缩部间隔开的第一区域和第二区域,
将微液滴从第一区域输送到第二区域中,其中微液滴在第一区域中以第一流率被分散在载体流体中;其中,第二区域被配置为经由收缩装置从第一区域接收微液滴并以更高的载体流体流率将所述微液滴转移到微流体芯片的出口端口,
其中,第二区域被配置为通过施加光学介导的电润湿(oEWOD)力经由收缩部从第一区域接收所述微液滴;并且
其中,第二区域中的第二流率高于第一区域中的第一流率。
在一些实施例中,提供了一种用于分配一个或多个微液滴的方法,该方法包括以下步骤:
提供微流体芯片,该微流体芯片包括由收缩装置间隔开的第一区域和第二区域,
将微液滴从第一区域输送到第二区域中,其中,第二区域被配置为经由收缩装置从第一区域接收微液滴并以较高的载体流体流率将所述微液滴转移到微流体芯片的出口端口,并且
其特征在于,第二区域被配置为通过施加光学介导的电润湿(oEWOD)力经由收缩装置从第一区域接收所述微液滴。
本发明的方法还可以包括使用控制器激活泵和/或阀以控制载体流体通过微流体芯片的出口端口的流量的步骤。在一些实施例中,该方法还可以包括使用控制器激活装置以控制载体流体通过微流体芯片的出口端口的流量的步骤。
在一些实施例中,用于控制载体流体的流量的装置可以通过导管被连接到微流体芯片的出口端口。
在一些实施例中,用于控制载体流体的流量的装置可以是泵和/或阀。
在一些实施例中,泵的激活可以包括移动固定体积的流体通过微流体芯片和导管的步骤。导管可以是管,即外管。外管可以由塑料制成。在一些实施例中,外管是透明的。在一些实施例中,外管由含氟聚合物制成。优选地,外管是氟化乙烯丙烯(FEP),因此操作员和传感器可以看到液滴在外管内移动。管可以具有任何长度,但其可以是在10至1000mm之间的管。例如,外管可以是200mm的管,以便能够延伸到孔板的另一侧(130mm x 85mm)。
被设置成移动通过微流体芯片和导管的流体的量在1至10μl之间。在一些实施例中,流体的固定体积可以大于2、3、4、5、6、7、8或9μl。在一些实施例中,流体的固定体积可以小于10、9、8、7、6、5、4、3或2μl。
优选地,流体的固定量为7μl。7μL的体积基本上小于目标孔板的体积,但可以基本上大于必须冲洗的导管或流体路径的体积。
在一些实施例中,该方法还可以包括容器。容器可以是多孔板或者它可以是PCR管。
本发明的方法还可以包括将多孔板安装到多轴运动受控台上的步骤,其中多轴运动受控台可以被配置为使用控制器将多孔板移动到目标孔,使得目标孔被定位于设置到微流体芯片的出口端口的阀下方。在一些实施例中,该方法还可以包括将多孔板安装到多轴运动受控台上的步骤,其中多轴运动受控台可以被配置为使用控制器将多孔板移动到目标孔,使得目标孔被定位于阀的出口端口下方。
在一些实施例中,该方法还可以包括将阀切换到打开位置以使得微液滴被分配到多孔板上的步骤。
在一些实施例中,该方法还可以包括使用控制器记录目标孔的步骤。通过使用控制器记录目标孔,操作员或用户能够知道哪个孔包含感兴趣的液滴,例如包含细胞的液滴。在某些情况下,可以进行分析,其中可以选择目标孔以将液滴分配到其中。
在一些实施例中,该方法还可以包括使用控制器选择目标孔以使得感兴趣的液滴可以被分配在目标孔中的步骤。
在一些实施例中,软件功能被用于为液滴分配唯一标识符,并记录关于对该液滴执行的操作的元数据。该元数据可以包括该液滴被分配到其中的目标孔的记录。在一个液滴被拆分成两个液滴的情况下,元数据可以包括所分配的一个子液滴的目标回收孔以及保留在芯片上的另一子液滴的唯一标识符的记录。
在一些实施例中,该方法可以包括使用明场显微镜、荧光显微镜或暗场显微镜对液滴进行光学检查。该方法可以包括执行图像分析以对液滴进行分类,然后基于它们的分类来选择待分配液滴的目标孔。
在一些实施例中,该方法还可以包括使用设置在导管附近的检测模块或传感器产生信号的步骤。在一些实施例中,该方法还可以包括使用检测模块或传感器生成信号的步骤。
在一些实施例中,该方法还可以包括检测来自检测模块或传感器的所生成的信号并将所生成的信号传输到所述控制器的步骤,在所生成的信号被传输到所述控制器时,控制器还被配置为将所述阀切换到打开位置,从而分配微液滴。在一些实施例中,该方法还可以包括检测来自检测模块或传感器的所生成的信号并将所生成的信号传输到一控制器的步骤,在所生成的信号被传输到所述控制器时,控制器还被配置为将一阀切换到打开位置,从而分配微液滴。
在一些实施例中,该方法可以进一步包括以下步骤:
使用控制器停用泵;
使用控制器将阀切换到关闭位置;
使用控制器将阀的出口端口定位在不同于第一目标孔的另一目标孔上方;
使用控制器重新激活泵,该泵被配置为使固定量的流体移动通过微流体芯片和导管;
使用控制器将阀切换到打开位置,以使得流体被分配到多孔板中;以及
使用控制器记录该另一目标孔。
根据本发明的另一方面,提供了一种用于分配一个或多个微液滴的设备,该设备包括:
如本文所述的微流体芯片,微流体芯片包括第二区域,该第二区域被配置为将分散在载体流体中的微液滴转移到微流体芯片的出口端口;
泵,该泵被配置为控制载体流体从微流体芯片的入口端口通过微流体芯片到出口端口的流动;
导管,该导管连接到微流体芯片的出口端口以用于一旦从芯片分配微液滴就接收该微液滴;
位于导管附近的传感器,该传感器被配置为生成信号;
读取器模块,该读取器模块被配置为将所生成的信号从传感器读取并传输到控制器;
其中,控制器被配置为控制连接到微流体芯片的出口端口的阀和/或泵;并且
其中,取决于由传感器生成的信号,控制器被配置为将阀切换到使得从设备分配微液滴的位置,或者控制器被配置为将阀切换到使得微液滴被分配到容器上的位置。
附图说明
现在将仅通过示例并参考附图进一步且更具体地描述本发明,其中:
图1示出了本发明中公开的用于分配一个或多个微液滴的微流体装置;
图2A、2B、2C图示了本发明中公开的芯片装载和分配顺序;
图3A和3B图示了根据图2A至2C的液滴分配程序和检测;
图4A、4B、4C和4D示出了微流体装置内的液滴操作;
图5A和5B示出了被分配在多相流中的液滴;和
图6提供了用于分配液滴的设备或系统。
具体实施方式
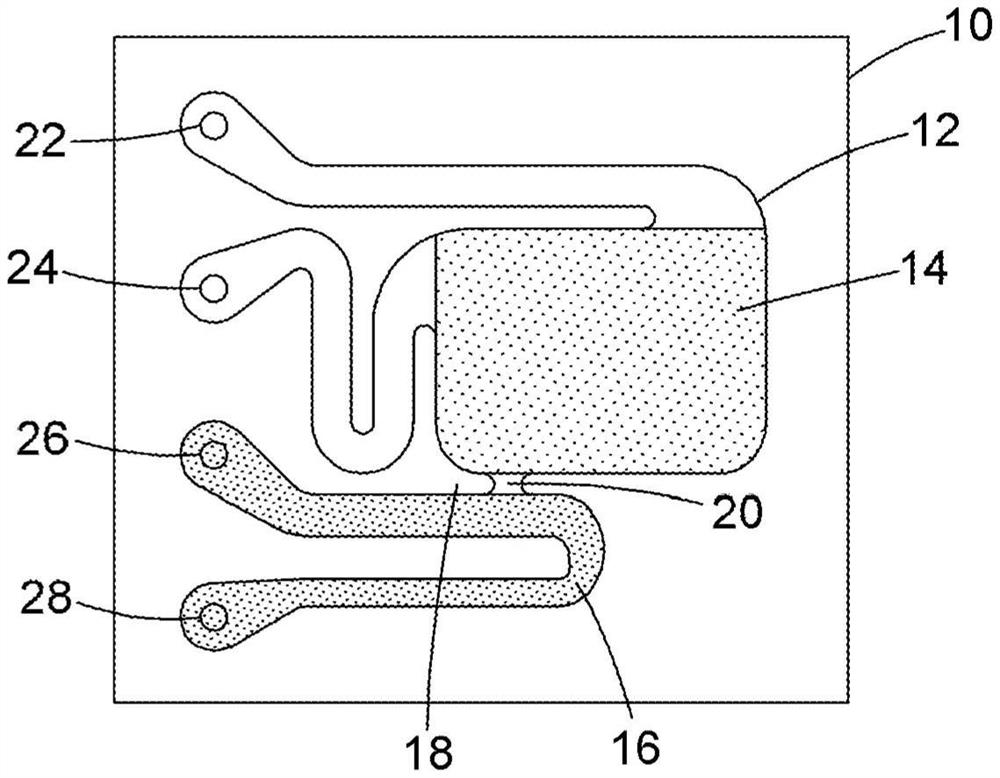
参考图1,提供了一种用于分配一个或多个微液滴的微流体装置10,该微流体装置10包括封闭容积12。封闭容积12包括第一区域14和第二区域16。第一区域14可以是如图1所示的大区域,液滴在该区域中被存储、处理和/或操纵。第一区域14和第二区域16由诸如壁或屏障的收缩装置18间隔开。如图1所示的壁或屏障18将包括足够宽的间隙20,以允许液滴穿过并进入第二区域16。选择含有感兴趣细胞的液滴,然后通过施加光电润湿(oEWOD)力使该液滴移动通过间隙20。该装置还具有多个端口22、24、26、28,这些端口可以使用连接的阀独立地打开或密封。
第一区域14适于以低载体流体流率接收和操纵分散在载体流体中的一个或多个微液滴。在某些情况下,第一区域14中的低载体流体流率为零。这确保了液滴可以被容易地操纵和处理。如果第一区域14中的流率太高,则它克服将液滴保持在适当位置或操纵液滴的oEWOD力。
第一区域中的流率可以在0至20μL/min的范围内,或者它可以超过0、2、4、6、8、10、12、14、16或18μL/min。在一些情况下,第一区域的流率可以小于20、18、16、14、12、10、8、6、4或2μL/min。
第二区域16可以具有两种不同的流率。在液滴被移动到第二区域中的待机模式期间,第二区域中的流率可以在0至20μL/min之间,或者它可以超过0、2、4、6、8、10、12、14、16或18μL/min。在一些情况下,待机模式下第二区域的流率可以小于20、18、16、14、12、10、8、6、4或2μL/min。
在将液滴从芯片中分配出来的分配模式期间,第二区域的流率为10-100μL/min,或者可以超过10、20、30、40、50、60、70、80或90μL/min。在一些情况下,分配期间第二区域的流率小于100、90、80、70、60、50、40、30、20或15μL/min。
液滴可以含有生物材料、细胞或珠。液滴可以包含单个或多个细胞。液滴可以包含单个或多个珠。液滴可以是任何形状或尺寸,但优选地,液滴是球形或圆柱形。液滴的大小可以在20至600μm之间,但它可以大于20、30、40、50、60、80、100、120、140、150、160、180、200、220、240、250、260、280、300、320、340、360、380、400、420、440、460、480、500、520、540、550、560或580μm。在一些实施例中,液滴的尺寸可以小于600、580、560、550、540、520、500、480、460、440、420、400、380、360、340、320、300、280、260、250、240、220、200、180、160、150、140、120、100、80、60、50、40或30μm。多个液滴可以合并在一起以形成更大的液滴。或者,可以适当地将大液滴分开以形成较小尺寸的液滴。
如果液滴相对于微流体腔室的高度太小,则液滴不与微流体腔室内的壁的两侧接触,并且因此液滴不能通过oEWOD移动。相比之下,相对于装置几何构造大的液滴在微流体腔室中移动可能很难和/或很慢,并且通常仅通过阻碍其他正确尺寸的液滴或通过与正确尺寸的微液滴合并而挡道而干扰其他操作。
参考图1,第二区域16是例如连接在第二区域16内的入口端口和出口端口之间的微通道的通道。微通道16被配置为经由通过收缩装置18内的间隙20从第一区域14接收微液滴,并以较高的载体流体流率将所述微液滴转移到微流体芯片10的第二区域16的出口端口。可以通过将泵源附接在位于第二区域16内的端口之一处来产生更高的载体流体流率。泵源可以是连接到微流体芯片10的一个或多个入口端口或出口端口的注射泵或压力泵。此外,阀可以是连接到微流体芯片10的一个或多个出口端口或入口端口的软件控制阀。
微通道可以被图案化在微流体芯片10的第二区域16内,使得微通道被连接在第二区域16内的入口端口和出口端口之间。
如图1所示,泵源通过2通阀连接到一个或多个出口端口,如端口22和端口28。液滴通过另一个端口装载,例如通过从端口22抽吸来装载。液滴在第一区域14中被操纵,然后通过施加oEWOD力被选择移动到第二区域16中。图1还说明了然后通过泵入到端口28中而从出口端口(例如出口端口26)分配液滴,而端口22和24通过阀关闭。然后关闭泵源,并且微流体芯片10的出口端口处的阀处于关闭位置。
参考图2A、2B和2C,示出了装载到微流体芯片10上的微液滴30以及分配顺序。微流体芯片10包括封闭容积12。封闭容积12包括第一区域14和第二区域16。如图2A所示,阀32连接到微流体芯片10的端口22、24、26、28,使得每个端口22、24、26、28可以打开或关闭。通过使含有液滴的载体流体的流在两个端口之间通过而其他端口由阀32密封,将液滴30装载到芯片10的第一区域14中。阀32被关闭以将第一区域14内的流率降低到零。然后在第一区域14中存储和/或操纵液滴30。
参考2B,示出了通过施加oEWOD力,液滴30被选择并从第一区域14通过位于收缩装置18内的间隙20移动到第二区域16中。
如图2C所示,然后通过使用注射泵35将液滴30从出口端口(例如出口端口26)泵入到端口28中,而端口22和24通过阀32关闭。液滴30可以被分配到容器中,例如多孔板34中,如图2C所示。可以在分配循环期间关闭电压以允许液滴从oEWOD力释放。
参考图3A,提供了示出了第二区域16的微流体芯片10。微流体芯片的端口26、28与阀32相连。两个阀都处于打开位置,如图3A所示。从泵35注入载体流体,使液滴30移动通过第二区域16并离开芯片10进入到导管40中。出口阀32通向废物通道36或容器。传感器38位于导管40附近,以监测导管40内的液滴的存在。
检测模块38可以是诸如光电二极管或光电晶体管的光学传感器,或者诸如电容或阻抗传感器的电传感器,或者几个这样的传感器的组合。该组传感器可以被定位在导管附近。当液滴通过检测窗时,传感器将产生电信号。可选地,检查相机可以被定位成对阀的任一侧的管的内部进行成像,从而可以通过读取器模块记录和分析来自检查相机的视频或图像。
该设备还包括读取器模块,例如微控制器(附图中未示出),其被配置为从传感器或检测模块读取所生成的信号并将其传输到控制器。诸如微控制器的读取器模块被配置为读取传感器的输出信号并将传感器的状态传输到控制器。
参考图3B,图中示出了使用传感器或光学检测器38检测液滴,软件控制器将阀32定位为通向定向到容器34中的第二导管42,从而将液滴转移到容器34中。
参考图4A,图中示出了在第一区域14内的光流体腔室内操纵和分析的目标液滴43。液滴43可以移动并重新排列成阵列。
参考图4B和4C,图中示出了选定的液滴43被EWOD力移动通过收缩装置18进入到第二区域16中。
如图4D所示,通过打开连接到第二区域16的端口的阀并注入载体流体以在第二区域16内产生高流率以将液滴输送出装置来分配液滴43。
参考图5A,液滴可以以多相流分配。两个独立的泵,一个带有水介质44,另一个带有不混溶载体流体46,可能通过连接部件47被连接到入口端口48。阀32也如图5A所示设置。阀32可以彼此独立地打开或关闭。在某些情况下,阀可以顺序或串联打开或关闭,或者它们可以同时打开或关闭。在一定体积的不混溶载体流体之前和/或之后,将介质塞50注入到芯片10的第二区域16中。液滴30移动到不混溶载体流体部分中,然后混合相流体通过出口49被注入分配容器。这减少了被引入到分配容器中的不混溶流体的体积。
如图5B所示,通过选择较小的液滴54并将它们合并在一起形成较大的液滴52,可以形成较大尺寸的液滴52。合并后的液滴52可以具有直径大小约为50μm的直径。在一些情况下,较小的液滴54可以在施加到装置的电压为5至10V(优选为10V)之间时被合并在一起以形成较大的液滴52。合并后的液滴52可以通过使用泵被推出微流体芯片的出口端口。第二区域内的流率可以在10至100μL/min之间。
在某些情况下,当液滴在离开芯片后很快就汇入到水(或塞)流中时,最终必须从芯片中喷出并最终进入到孔中的油的量被最小化。因此,这将避免用油填充容器(例如孔)。附加地或替代地,小液滴54可以先于大水塞52或合并后的液滴,并且可以通过注射泵从微流体芯片中泵出,因此它避免了用油填充容器(例如孔)。
参考图6,提供了一种分配设备或系统100。分配设备或设备100包括如本发明先前方面中所公开的装置。用于分配一个或多个微液滴的设备100包括微流体芯片102,微流体芯片102(A)包括第一区域和第二区域,其中第一区域和第二区域由收缩装置间隔开;其中第一区域适于以低载体流体流率接收和操纵分散在载体流体中的一个或多个微液滴;并且其中第二区域被配置为经由收缩装置从第一区域接收微液滴并以更高的载体流体流率将所述微液滴转移到微流体芯片的出口端口,其中第二区域被配置为通过施加光学介导的电润湿(oEWOD)力经由收缩装置从第一区域接收所述微液滴。
该设备还包括控制器,该控制器被配置为控制连接到微流体芯片102的出口端口的阀和/或泵。阀103(B)连接到微流体装置102的出口端口,如图6所示,并且泵(附图中未示出)连接到微流体装置102的入口端口。微流体芯片102的出口端口与导管104(例如管)连接。导管可以是透明的。
容器108是多孔板108。多孔板安装在具有XYZ配置的多轴受控台110上。多孔板108可以是96或384孔板。台110可以被手动或自动控制。容器108还可以是废物容器或贮存器或PCR管或微离心管,例如Eppendorf管。可选地,每个孔都预先填充有一定体积的细胞培养基。控制器被配置为在分配过程中控制多孔板被安装到其上的台的移动。可以在每个孔中分配一个液滴和/或可以在一个孔中分配多个液滴。
在分配过程中,分配头106向下移动到含有含水缓冲剂的孔中。附加地或替代地,孔可以朝向分配头106移动。替代地,分配头106可以固定在适当位置,并且孔板可以朝向分配头106移动。连接到微流体芯片102的入口端口的泵被激活,并以适当的速度泵送一段时间以将所需体积的缓冲剂泵送通过微流体芯片。精确的时间和速度取决于微通道的尺寸、互连的管和接口连接件。例如,连接到微流体芯片102的入口端口的泵可以被激活并以50μL/min的速度泵送12秒。连接到微流体芯片102的出口端口的阀被打开,使得通常约为7μL至10μL的一定量的体积被从微流体芯片推出到管104中,并被分配到废物容器中。7μL至10μL的固定体积可以足以完全清洗微通道以及互连的管和接口连接件。
然后,(一个或多个)液滴可以从微流体芯片102移动并进入到管104中,刚好在阀之前停止。然后泵被停用并停止将流体泵送出微流体装置102,而阀移动到分配位置。控制器再次激活泵达4秒钟,并且液滴被分配到孔108中。然后手动关闭阀,或者通过软件控制的控制器自动关闭阀。
在一些示例中,分配液滴的方法或分配液滴的顺序可以如下:关闭泵源,并且阀处于由控制器控制的关闭位置。在微流体芯片内的光流体腔室内操纵和分析目标液滴。光电润湿传输将目标液滴从光流体腔室移动到微流体芯片内的微通道中。3轴线台移动多孔板,使得目标孔被定位于软件控制的阀的出口管下方。软件控制的泵被激活并开始移位固定体积的流体,通常为7微升,以充分清洗微通道和互连的管和接口连接件。
然后,将软件控制的阀切换到打开位置,使得流体进入到多孔板中。微通道中产生的流体流将液滴连同一定体积的载体相一起排出到多孔板中。可选地,询问传感器或相机并确定在多孔板之前的出口管中是否存在液滴。如果没有检测到液滴,则命令泵源分配额外的体积以回收液滴。关闭泵,并且关闭阀。分配头从多孔板中抽出和/或多孔板从分配头中抽出。任选地,移动多孔板以在分配头下方放置废物孔或替代的废物容器,并清洗微流体通道。重复上述步骤,直到已经从微流体装置回收了所有目标液滴。回收多孔板以用于进一步的实验,如DNA测序或细胞扩增。
或者,液滴可以通过依靠泵和阀来计量正确的体积来回收液滴而被回收。仅作为示例,针对20cm管长和0.1mm内径,可以提供2至5μL的计量体积,以20μL/min的速度分配0.1μm。这意味着不需要提供传感器或相机来检测管内的液滴。附加地或可替代地,本发明中公开的设备可以适当地支持多个分配路径和多个泵源和阀,以便并行一个或多个感兴趣的液滴的回收过程。
本发明的装置、设备和方法可以用于许多应用,例如分配单个细胞。在一些情况下,液滴可以包含多个细胞。液滴可以包含随机数目的细胞,包括单个细胞。此外,可以测定含有单个细胞或多个细胞的回收液滴,其可以包括但不限于PCR扩增、DNA测序、RNA测序和细胞扩增。分配效率可以通过用台盼蓝对液滴进行染色并在分配阀前后使用相机对液滴进行拍摄来评估。仅作为示例,如果在分配开始后的<12秒内在分配阀之后检测到液滴,则认为分配成功。仅在一个示例中,分配单细胞和进行PCR的效率约为80%(40/50),而分配后PCR的总效率为79%(66/84)。
鉴于本公开,本发明的各种其他方面和实施例对于本领域技术人员将是显而易见的。
本文使用的“和/或”应视为对两个指定特征或部件中的每一个的具体披露,包括或不包括另一个特征或部件。例如,“A和/或B”应被视为(i)A、(ii)B和(iii)A和B中的每一项的具体披露,就像本文中单独列出每一个一样。
除非上下文另有规定,否则上述特征的描述和定义不限于本发明的任何特定方面或实施例,并且同样适用于所描述的所有方面和实施例。
本领域技术人员将进一步认识到,尽管已经参考几个实施例以示例的方式描述了本发明,但本发明不限于所公开的实施例,并且可以在不脱离所附权利要求中定义的本发明的范围的情况下构造替代实施例。
权利要求书(按照条约第19条的修改)
1.一种用于分配一个或更多个微液滴的装置,所述装置包括微流体芯片,所述微流体芯片具有oEWOD结构,所述oEWOD结构被配置为产生光学介导的电润湿(oEWOD)力,所述微流体芯片包括第一区域和第二区域,其中所述第一区域和所述第二区域由收缩部间隔开;
其中,所述第一区域适于接收和操纵以第一流率分散在载体流体中的一个或更多个微液滴;并且
其中,所述第二区域被配置为经由所述收缩部从所述第一区域接收所述微液滴,并以第二流率将所述微液滴转移到所述微流体芯片的出口端口;
其中,所述第二区域被配置为借助于光学介导的电润湿(oEWOD)力的施加而经由所述收缩部从所述第一区域接收所述微液滴;和
控制器,所述控制器被配置成控制阀和/或泵,使得在所述第二区域中的所述第二流率高于在所述第一区域中的所述第一流率。
2.根据权利要求1所述的装置,其中,所述收缩部是物理屏障。
3.根据权利要求1所述的装置,其中,所述收缩部是半透隔膜。
4.根据前述权利要求中任一项所述的装置,其中,所述微液滴包括生物材料、一个或更多个细胞或一个或更多个珠。
5.根据权利要求1或2所述的装置,其中,所述收缩部包括开口,其中所述开口的宽度在20微米至400微米之间。
6.根据前述权利要求中任一项所述的装置,其中,所述第二区域的几何构造是大致新月形的通道。
7.根据前述权利要求中任一项所述的装置,其中,所述第二区域还包括多个通道,每个通道被配置为接收来自所述第一区域的微液滴并将所述微液滴转移到所述微流体芯片的所述出口端口。
8.根据前述权利要求中任一项所述的装置,其中,阀和/或泵被配置为通过导管连接到所述微流体芯片的所述出口端口。
9.根据权利要求8所述的装置,还包括控制器,所述控制器被配置为控制连接到所述微流体芯片的所述出口端口的所述阀和/或泵。
10.根据权利要求9所述的装置,其中,所述控制器被配置为控制所述微液滴或所述微液滴中的每一个同时在所述第二区域中的每个通道中的流动。
11.根据前述权利要求中任一项所述的装置,其中多个微液滴被同时转移到所述微流体芯片的所述出口端口。
12.根据前述权利要求中任一项所述的装置,还包括所述第一区域的入口端口或出口端口以及设置到所述第一区域的入口端口或出口端口的阀。
13.根据前述权利要求中任一项所述的装置,还包括检测系统,所述检测系统用于从分配自所述微流体芯片的所述出口端口的所述微液滴检测一检测信号。
14.根据权利要求9所述的装置,还包括读取器模块,所述读取器模块被配置为从传感器或检测模块读取所生成的信号并将所生成的信号传输到所述控制器,在所生成的信号被传输到所述控制器时,所述控制器还被配置为将所述阀定位到打开位置以使得所述微液滴被分配。
15.根据前述权利要求中任一项所述的装置,还包括容器,其中所述容器被配置为接收被分配的微液滴。
16.根据权利要求15所述的装置,其中,所述容器是多孔板、PCR管或微离心管。
17.根据权利要求16所述的装置,其中,所述多孔板被安装到多轴运动受控台上,其中所述多轴运动受控台被配置为将所述多孔板移动到第一位置,使得目标孔被定位在被设置到所述微流体芯片的所述出口端口的阀的下方。
18.根据权利要求13所述的装置,其中,所述检测系统包括光学检测器。
19.根据权利要求17所述的装置,其中,每个孔都预先填充有一定体积的细胞培养基。
20.根据权利要求19所述的装置,其中,每个孔都预先填充有一定体积的缓冲剂、或水或油。
21.根据权利要求1所述的装置,其中,所述收缩部是鞘流体。
22.一种用于分配一个或更多个微液滴的方法,所述方法包括以下步骤:
提供微流体芯片,所述微流体芯片包括由收缩部间隔开的第一区域和第二区域,
将所述微液滴从所述第一区域输送到所述第二区域中,其中所述微液滴在所述第一区域中被以第一流率分散在载体流体中;其中,所述第二区域被配置为经由所述收缩装置从所述第一区域接收所述微液滴并以更高的载体流体流率将所述微液滴转移到所述微流体芯片的出口端口,
其中,所述第二区域被配置为借助于光学介导的电润湿(oEWOD)力的施加而经由所述收缩部从所述第一区域接收所述微液滴;并且
使用控制器启动阀和/或泵以控制所述载体流体的流量,使得在所述第二区域中的所述第二流率高于在所述第一区域中的所述第一流率。
23.根据权利要求22所述的方法,还包括使用控制器启动泵和/或阀以控制通过所述微流体芯片的所述出口端口的所述载体流体的流量的步骤。
24.根据权利要求22和23所述的方法,还包括将多孔板安装到多轴运动受控台上的步骤,其中所述多轴运动受控台被配置为使用所述控制器将所述多孔板移动到目标孔,使得所述目标孔被定位在被设置到所述微流体芯片阀的所述出口端口的阀的下方。
25.根据权利要求24所述的方法,还包括将所述阀切换到打开位置以使得所述微液滴被分配到所述多孔板上的步骤。
26.根据权利要求24所述的方法,还包括使用所述控制器记录所述目标孔的步骤。
27.根据权利要求22至26所述的方法,还包括使用检测模块或传感器生成信号的步骤。
28.根据权利要求27所述的方法,还包括检测来自所述检测模块或所述传感器的所生成的信号并将所生成的信号发送到所述控制器的步骤,在所生成的信号被发送到所述控制器时,所述控制器还被配置为将阀切换到打开位置以使得所述微液滴被分配。
29.一种用于分配一个或更多个微液滴的设备,所述设备包括:
根据权利要求1所述的微流体芯片,所述微流体芯片包括第二区域,所述第二区域被配置为将分散在载体流体中的微液滴转移到所述微流体芯片的出口端口;
泵,所述泵被配置为控制所述载体流体的从所述微流体芯片的入口端口通过所述微流体芯片到所述出口端口的流量;
导管,所述导管连接到所述微流体芯片的所述出口端口,以用于一旦从所述芯片分配所述微液滴就接收所述微液滴;
邻近所述导管定位的传感器,所述传感器被配置为生成信号;
读取器模块,所述读取器模块被配置为从所述传感器读取所生成的信号并将所生成的信号传输到控制器;
其中,所述控制器被配置为控制连接到所述微流体芯片的所述出口端口的阀和/或泵;并且
其中,响应于由所述传感器生成的所述信号,所述控制器被配置为将所述阀切换到使得所述微液滴被从所述设备分配的位置,或者所述控制器被配置为将阀切换到使得所述微液滴被分配到容器上的位置。
- 分配阀的改进或与分配阀相关的改进
- 分配阀的改进或与分配阀相关的改进
