通过mTOR抑制剂和白蛋白的纳米颗粒的施用治疗中枢神经系统障碍的方法
文献发布时间:2023-06-19 09:24:30
相关申请的交叉引用
本申请要求2018年3月20日提交的美国临时专利申请序列号62/645,634和2019年3月7提交的美国临时专利申请序列号62/815,346的优先权权益。这些申请的全部内容出于所有目的通过引用从而并入。
技术领域
本申请涉及治疗CNS障碍的方法和组合物——通过施用单独地或与第二药剂组合的包括包含mTOR抑制剂(如莫司药物(limus drug),例如西罗莫司或其衍生物)和白蛋白的纳米颗粒的组合物。
背景技术
中枢神经系统疾病,也称为中枢神经系统障碍,是影响共同形成中枢神经系统(CNS)的脑或脊髓的结构或功能的一系列神经学障碍。当前的治疗包括外科手术和处方药。但是,由于脑中的天然屏障,许多CNS障碍难以治疗。
雷帕霉素(mTOR)的哺乳动物靶标是保守丝氨酸/苏氨酸激酶,该激酶在细胞中充当信号传导的中心枢纽以整合细胞内和细胞外的信号并调控细胞生长和稳态。mTOR途径的激活与细胞增殖和存活相关,而mTOR信号传导的抑制导致炎症和细胞死亡。mTOR信号传导途径的失调已被牵涉在越来越多的人疾病中,其包括癌症和自身免疫性障碍。因此,mTOR抑制剂已广泛用于治疗各种病理状况,如癌症、器官移植、再狭窄和类风湿性关节炎。
西罗莫司(Sirolimus),也被称为雷帕霉素,是一种免疫抑制药物,用于预防器官移植中的排斥;其在肾脏移植物中特别有用。西罗莫司洗脱支架在美国被批准用于治疗冠状动脉再狭窄。另外,西罗莫司已在各种细胞系和动物模型中被证明是肿瘤生长的有效抑制剂。其他莫司药物,如西罗莫司的类似物,已被设计以提高西罗莫司的药代动力学和药效学性质。例如,替西罗莫司(Temsirolimus)在美国和欧洲被批准用于治疗肾细胞癌。依维莫司(Everolimus)在美国被批准用于治疗晚期乳腺癌、胰腺神经内分泌肿瘤、晚期肾细胞癌和与结节性硬化相关的表皮下巨细胞星形细胞瘤(SEGA)。西罗莫司的作用方式是结合胞质蛋白FK结合蛋白12(FKBP12),并且西罗莫司-FKBPl2复合物进而通过直接与mTOR复合物1(mTORC1)结合而抑制mTOR途径。
已经开发出白蛋白系纳米颗粒组合物作为用于递送基本上水不溶性药物的药物递送系统。参见,例如,美国专利号5,916,596;6,506,405;6,749,868和6,537,579、7,820,788和7,923,536。
本文提及的所有出版物、专利、专利申请和公开的专利申请的公开内容整体通过引用并入本文。
发明内容
本申请提供了治疗个体中CNS障碍(例如癫痫、脑皮质发育不良和恶性胶质瘤)的方法,包括向个体全身性施用有效量的包括纳米颗粒的组合物,该纳米颗粒包括mTOR抑制剂和白蛋白。在一些实施方式中,每次施用的纳米颗粒组合物中mTOR抑制剂的量为约0.1mg/m
在根据本文描述的方法中的任一个的一些实施方式中,mTOR抑制剂是莫司药物。在一些实施方式中,mTOR抑制剂是雷帕霉素。
在根据本文描述的方法中的任一个的一些实施方式中,CNS障碍是癫痫病。在一些实施方式中,个体已经经历了癫痫手术。在一些实施方式中,个体在癫痫手术后30天内患有至少5次癫痫发作或在癫痫手术后不具有一周的无癫痫发作。在一些实施方式中,方法进一步包括向个体施用有效量的抗癫痫药剂。在一些实施方式中,每次施用的纳米颗粒组合物中的mTOR抑制剂为约0.1mg/m
在根据本文描述的方法中的任一个的一些实施方式中,CNS障碍是恶性胶质瘤。在一些实施方式中,恶性胶质瘤是复发性恶性胶质瘤。在一些实施方式中,恶性胶质瘤是新诊断的恶性胶质瘤。在一些实施方式中,个体在开始纳米颗粒施用之前已经经历了新诊断的恶性胶质瘤的手术切除。
在根据本文描述的方法中的任一个的一些实施方式中,方法进一步包括向个体施用有效量的选自抗VEGF抗体、烷基化剂和蛋白酶体抑制剂的第二药剂。在一些实施方式中,每次施用的纳米颗粒组合物中mTOR抑制剂的量为约20mg/m
在根据本文描述的方法中的任一个的一些实施方式中,方法进一步包括放射疗法。在一些实施方式中,放射疗法是局部放射疗法。在一些实施方式中,局部放射疗法每天被施用。在一些实施方式中,约40-80Gy的局部放射疗法每周被施用。
在根据本文描述的方法中的任一个的一些实施方式中,CNS障碍(例如,恶性胶质瘤)包括mTOR激活异常。在一些实施方式中,mTOR激活异常包括PTEN异常。
在根据本文描述的方法中的任一个的一些实施方式中,其中个体是人。
在根据本文描述的方法中的任一个的一些实施方式中,纳米颗粒组合物肠胃外被施用至个体。在一些实施方式中,纳米颗粒组合物被静脉内施用至个体。在一些实施方式中,纳米颗粒组合物被皮下施用至个体。
本申请提供了试剂盒,该试剂盒包括用于治疗CNS障碍的纳米颗粒组合物,该纳米颗粒组合物包括mTOR抑制剂和白蛋白。在一些实施方式中,试剂盒进一步包括选自抗VEGF抗体、烷基化剂和蛋白酶体抑制剂的药剂。在一些实施方式中,进一步包括用于评估mTOR激活异常的药剂。
附图说明
图1提供了在将三种不同剂量(1.7mg/kg、9.5mg/kg和17mg/kg)的ABI-009静脉内施用至大鼠后24小时、72小时和120小时,在脑、心脏、肝脏、肺、胰腺和血液中的雷帕霉素浓度。
图2提供了在将三种不同剂量(1.7mg/kg、9.5mg/kg和17mg/kg)的ABI-009静脉内施用至大鼠后24小时、72小时和120小时,不同器官(脑、心脏、肝脏、肺和胰腺)中的雷帕霉素浓度与血液中的雷帕霉素浓度的比。
图3提供了静脉内施用ABI-009后血液和不同器官中的雷帕霉素浓度。
图4显示了在皮下(SC)或静脉内(IV)施用单剂量的nab-雷帕霉素(ABI-009)在施用后0至24小时之间取自大鼠的全血样品中的雷帕霉素浓度。
图5显示了在皮下(SC)或静脉内(IV)施用单剂量的nab-雷帕霉素(ABI-009)在施用后0至168小时之间取自大鼠的全血样品中的雷帕霉素浓度。
图6显示了在皮下(SC)或静脉内(IV)施用单剂量的nab-雷帕霉素(ABI-009)在施用后0至24小时之间取自大鼠的全血样品中的雷帕霉素浓度。
图7显示了在大鼠中在皮下(subQ)或静脉内(IV)施用单剂量后的nab-雷帕霉素(ABI-009)的生物利用度,如计算的曲线下面积(AUC)所指示的。
图8显示了在皮下(subQ)或静脉内(IV)施用单剂量的nab-雷帕霉素(ABI-009)后的24或168小时,大鼠骨髓(顶部)或脑(底部)中的雷帕霉素浓度。
图9显示了在皮下(subQ)或静脉内(IV)施用单剂量的nab-雷帕霉素(ABI-009)后的24或168小时,大鼠心脏(顶部)或肝脏(底部)中的雷帕霉素浓度。
图10显示了在皮下(subQ)或静脉内(IV)施用单剂量的nab-雷帕霉素(ABI-009)后的24或168小时,大鼠肺(顶部)或胰腺(底部)中的雷帕霉素浓度。
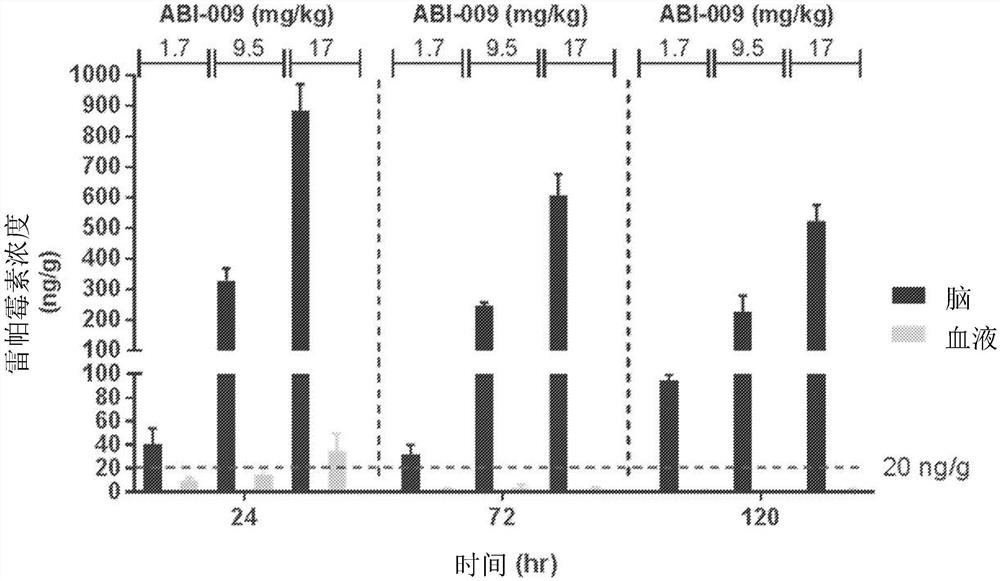
图11显示了在以1.7mg/kg、9.5mg/kg或17mg/kg的剂量的皮下单剂量nab-雷帕霉素(ABI-009)施用后24、72和120小时后,大鼠的脑或全血中雷帕霉素浓度随时间的比较。
图12示出了在不同治疗组之间在对大鼠皮肤评估的组织病理学评分的比较。
图13是第1组(0.9%盐水)中大鼠皮肤的代表性直方图图像。组织学病变仅限于皮下组织(SC)内混合的炎症细胞聚集体(黑色箭头)。标出了真皮(D)和表皮(E)。
图14是第2组(在0.9%盐水中的HSA)中大鼠皮肤的代表性直方图图像。皮下组织(SC)内可见多灶性混合的炎症细胞聚集体(黑色箭头)。表皮(E)和真皮(D)不明显。
图15是第3组(ABI-009,1.7mg/kg)中大鼠皮肤的代表性直方图图像。在皮下组织(SC)中可见最小的混合的炎症细胞浸润(黑色箭头)。标出了表皮(E)和真皮(D)。
图16是第4组(ABI-009,5mg/kg)中大鼠皮肤的代表性直方图图像。皮下组织(SC)中存在分散的混合的炎症细胞浸润(黑色箭头)和最小的坏死部位(蓝色箭头)。表皮(E)和真皮(D)不明显。
图17是第4组(ABI-009,10mg/kg)中大鼠皮肤的代表性直方图图像。捕获了皮下(SC)的混合的炎症细胞浸润(黑色箭头)和坏死区域(蓝色箭头)。表皮(E)和真皮(D)不明显。
图18显示了在以1.7mg/kg、5mg/kg或10mg/kg的ABI-009施用的大鼠中西罗莫司血液水平的平均值。
具体实施方式
本申请提供了用于治疗个体中CNS障碍(例如恶性胶质瘤、癫痫、脑皮质发育不良)的方法,其包括向个体全身性(例如静脉内或皮下)施用有效量的包括mTOR抑制剂(例如莫司药物,例如西罗莫司或其衍生物)和白蛋白的组合物。难以治疗CNS障碍的一个重要原因是许多治疗剂无法通过血脑屏障(BBB)。本申请基于申请人令人惊讶的发现,即全身性施用的包括mTOR抑制剂(例如,莫司药物,例如西罗莫司)和白蛋白的纳米颗粒不仅穿透血脑屏障,而且还在CNS中保持持续的时间段(例如至少120小时)。在一些方面,本申请提供了用于治疗癫痫的方法。在一些方面,本申请提供了用于治疗脑皮质发育不良(例如,局灶性脑皮质发育不良)的方法。在一些方面,本申请提供了用于治疗脑肿瘤例如恶性胶质瘤的方法。
本申请也提供了用于治疗个体中CNS障碍(例如恶性胶质瘤、癫痫、脑皮质发育不良)的方法,其包括a)向个体全身性(例如静脉内或皮下)施用有效量的包括mTOR抑制剂(例如莫司药物,例如西罗莫司或其衍生物)和白蛋白的组合物;b)向个体施用第二药剂(例如抗VEGF抗体、蛋白酶体抑制剂(如马里佐米)、烷基化剂(如替莫唑胺或洛莫司汀)、抗癫痫药))。
定义
除非另外具体指出,否则本文中使用的所有技术和科学术语具有与本申请所属领域的普通技术人员通常理解的相同含义。另外,与本文描述的方法或材料相似或等同的任何方法或材料都可以用于本申请的实践中。出于本申请的目的,定义了以下术语。
应当理解,本文所述的本发明的实施方式包括“由实施方式组成”和/或“基本上由实施方式组成”。
本文中对“约”某值或参数的提及包括(并且描述)针对该值或参数本身的差异。例如,提及“约X”的描述包括对“X”的描述。
本文使用的术语“约X-Y”具有与“约X到约Y”相同的含义。本文使用的表述“约X、Y和/或Z”与“约X、约Y和/或约Z”具有相同的含义。
如本文所用,对“不是”某值或参数的提及一般上意指并且描述“非”某值或参数。例如,方法不用于治疗X型癌症意指该方法用于治疗非X类型的癌症。
本文使用的术语“一个”、“一种”或“该”不仅包括具有一个成员的方面,而且还包括具有一个以上成员的方面。例如,单数形式的“一个”、“一种”和“该”包括复数指代,除非上下文另外明确指出。因此,例如,提及“细胞”包括多个这样的细胞,并且提及“该药剂”包括提及本领域普通技术人员已知的一种或多种药剂,等等。
如本文所用,“nab”
本文中提及“雷帕霉素”适用于雷帕霉素或其衍生物,因此,本申请考虑并包括所有这些实施方式。在本申请中,“雷帕霉素”和“西罗莫司”可互换使用。雷帕霉素有时在其他地方被称为雷帕霉素、雷帕鸣(Rapammune)或雷帕鸣(Rapamune)。提及“雷帕霉素”是为了简化描述并且是示例性的。雷帕霉素的衍生物包括但不限于在结构上与雷帕霉素相似或与雷帕霉素、雷帕霉素类似物、或雷帕霉素或其衍生物或类似物的药学上可接受的盐具有相同的一般化学类别的化合物。在一些实施方式中,mTOR抑制剂(例如雷帕霉素或其衍生物,例如雷帕霉素)增加基础AKT活性、增加AKT磷酸化、增加PI3-激酶活性、增加AKT激活的长度(例如由外源性IGF-1诱导的激活)、抑制IRS-1的丝氨酸磷酸化、抑制IRS-1降解、抑制或改变CXCR4亚细胞定位、抑制VEGF分泌、降低细胞周期蛋白(cyclin)D2的表达、降低存活蛋白的表达、抑制IL-6诱导的多发性骨髓瘤细胞生长、抑制肺动脉高压细胞增殖、增加细胞凋亡、增加细胞周期阻滞、增加聚ADP核糖(ADPribose)聚合酶的裂解、增加caspase-8/caspase-9的裂解、改变或抑制磷脂酰肌醇3-激酶/AKT/mTOR和/或细胞周期蛋白D1/视网膜母细胞瘤途径、抑制血管生成、和/或抑制破骨细胞形成。在一些实施方式中,雷帕霉素的衍生物保留一种或多种与雷帕霉素相似的生物学、药理学、化学和/或物理性质(包括,例如功能性)。示例性的雷帕霉素衍生物包括苯甲酰基雷帕霉素,例如在WO 2006/089207的第[0022]段中公开的那些,该文献通过引用以其全部并入本文。其他示例性雷帕霉素衍生物包括WY-090217、AY-22989、NSC-226080、SiiA-9268A、oxaazacyclohentriacontine、替雷帕霉素(temrapamycin)(CCI 779(Wyeth))、依维莫司(RAD 001(Novartis))、吡美莫司(ASM981)、SDZ-RAD、SAR943、ABT-578、AP23573和生物莫司(Biolimus)A9。
如本文所用,“治疗”(“treatment”或“treating”)是用于获得有益或期望结果(包括临床结果)的方法。为了本申请的目的,有益或期望的临床结果包括但不限于以下一种或多种:减轻由疾病引起的一种或多种症状,减轻疾病的程度,稳定疾病(例如,预防或延缓疾病的恶化),预防或延缓疾病的扩散(例如转移),预防或延缓疾病的复发,降低疾病的复发率,延缓或减慢疾病的进展,改善疾病状态,提供疾病的缓解(部分或全部),减少治疗该疾病所需的一种或多种其他药物的剂量,延缓疾病的进展,提高生活质量,和/或延长生存期。在一些实施方式中,治疗使与癌症有关的一种或多种症状的严重程度,与治疗前同一对象的相应症状相比或与未接受治疗的其他对象的相应症状相比,降低至少约10%、20%、30%、40%、50%、60%、70%、80%、90%、95%或100%中的任一。“治疗”还包括减少癌症的病理结果。本申请的方法考虑这些治疗方面中的任一个或多个。
术语“复发”(“recurrence”、“relapse”或“relapsed”)是指在临床评估疾病消失后癌症或疾病的恢复。远处转移或局部复发的诊断可被认为是复发。
本文所用的术语“有效量”是指足以治疗特定障碍、状况或疾病如改善、缓和、减轻和/或延缓其一种或多种症状的化合物或组合物的量。关于癌症,有效量包括足以导致肿瘤缩小和/或降低肿瘤的生长速率(如抑制肿瘤生长)或预防或延缓癌症中其他不想要的细胞增殖的量。在一些实施方式中,有效量是足以延缓癌症发展的量。在一些实施方式中,有效量是足以预防或延缓复发的量。在一些实施方式中,有效量是足以降低个体的复发速率的量。可以以一次或多次施用来施用有效量。有效量的药物或组合物可以:(i)减少癌细胞的数量;(ii)缩小肿瘤尺寸;(iii)在一定程度上抑制、迟延、减慢,并优选阻止癌细胞浸润到周围器官中;(iv)抑制(即,在一定程度上减慢并且优选阻止)肿瘤转移;(v)抑制肿瘤生长;(vi)预防或延缓肿瘤的发生和/或复发;(vii)降低肿瘤的复发速率;和/或(viii)在一定程度上减轻与癌症相关的症状中的一种或多种。
如本领域中所理解,“有效量”可以是一个或多个剂,即,可需要单剂或多剂来达到期望的治疗终点。有效量可以在施加一种或多种治疗剂的情况下被考虑,并且如果结合一种或多种其他剂可达到或达到期望或有益的结果,则可以以有效量给予纳米颗粒组合物(例如,包含西罗莫司和白蛋白的组合物)。本申请的联合疗法中的组分(例如,第一疗法和第二疗法)可以各组分利用相同或不同的施用途径而被顺序、同时或同步施用。因此,联合疗法的有效量包括顺序、同时或同步施用时产生期望的结果的第一疗法的量和第二疗法的量。
“与……结合”或“与……组合(联合)”是指除了一种治疗方式以外还施用另一种治疗方式,如在相同的治疗方案下向同一个体施用本文所述的纳米颗粒组合物附加施用另一种药物。因此,“与……结合”或“与……组合”是指一种治疗方式在另一种治疗方式递送至个体之前、期间或之后施用。
如本文所用,术语“同时施用”是指联合疗法中的第一疗法和第二疗法以不超过约15分钟的时间间隔被施用,如不超过约10、5或1分钟中的任一。当第一疗法和第二疗法被同时施用时,第一疗法和第二疗法可以被包含在相同的组合物中(例如,包含第一疗法和第二疗法二者的组合物)或单独的组合物中(例如,第一疗法被包含在一种组合物中,并且第二种疗法被包含在另一种组合物中)。
如本文所用,术语“顺序施用”是指联合疗法中的第一疗法和第二疗法以超过约15分钟的时间间隔被施用,如超过约20、30、40、50、60或更多分钟中的任一。第一疗法或第二疗法可以先被施用。第一疗法和第二疗法被包含在单独的组合物中,该单独的组合物可以被包含在相同或不同的包装或试剂盒中。
如本文所用,术语“同步施用”是指联合疗法中第一疗法的施用和第二疗法的施用彼此重叠。
如本文所用,“药学上可接受的”或“药理学上相容的”是指非生物学上或其他方面不期望的材料,例如,该材料可以并入施用于患者的药物组合物中而不会引起任何显著的不期望的生物学效应或以有害的方式与包含其的组合物的任何其他组分相互作用。药学上可接受的载体或赋形剂优选符合毒理学和生产测试的要求标准和/或被包括在美国食品和药品管理局(U.S.Food and Drug administration)准备的非活性成分指南(InactiveIngredient Guide)中。
治疗CNS障碍的方法
本申请提供了使用具有mTOR抑制剂(例如雷帕霉素)和载体蛋白(例如白蛋白)的纳米颗粒组合物以治疗中枢神经(CNS)障碍的多种方法。在一些实施方式中,纳米颗粒组合物全身性(例如静脉内或皮下)施用至个体。在一些实施方式中,CNS障碍是癫痫(例如手术难治性癫痫)。在一些实施方式中,CNS障碍是恶性胶质瘤(例如复发性恶性胶质瘤,例如新诊断的恶性胶质瘤)。在一些实施方式中,个体已经经历了新诊断的恶性胶质瘤的手术切除。在一些实施方式中,方法进一步包括第二药剂,例如烷基化剂、蛋白酶体抑制剂和/或抗VEGF抗体。在一些实施方式中,方法进一步包括非侵入性治疗(例如,干扰细胞(例如恶性胶质瘤癌细胞分裂)的非侵入性治疗,例如通过产生低强度、波状的电场,称其为肿瘤治疗场,例如
在一些实施方式中,提供了用于治疗个体中CNS障碍的方法,包括向个体全身性(例如静脉内或皮下)施用有效量的包括纳米颗粒的组合物,该纳米颗粒包括mTOR抑制剂和白蛋白。在一些实施方式中,mTOR抑制剂是莫司药物。在一些实施方式中,mTOR抑制剂是雷帕霉素。在一些实施方式中,纳米颗粒组合物中mTOR抑制剂的量不超过约100mg/m
在一些实施方式中,提供了用于治疗个体中CNS障碍的方法,包括(a)向个体全身性(例如静脉内或皮下)施用有效量的包括纳米颗粒的组合物,该纳米颗粒包括mTOR抑制剂和白蛋白;和(b)向个体施用有效量的抗VEGF抗体(例如贝伐单抗)。在一些实施方式中,每次施用的抗VEGF的量为约1mg/kg至约5mg/kg。在一些实施方式中,抗VEGF抗体每两周一次被施用。在一些实施方式中,抗VEGF抗体以每周小于约5mg/kg的量被施用。在一些实施方式中,抗VEGF抗体在施用纳米颗粒的一小时内被施用。在一些实施方式中,mTOR抑制剂是莫司药物。在一些实施方式中,mTOR抑制剂是雷帕霉素。在一些实施方式中,纳米颗粒组合物中mTOR抑制剂的量不超过约100mg/m
在一些实施方式中,提供了用于治疗个体中CNS障碍的方法,包括(a)向个体全身性(例如静脉内或皮下)施用有效量的包括纳米颗粒的组合物,该纳米颗粒包括mTOR抑制剂和白蛋白;和(b)向个体施用有效量的烷基化剂(例如替莫唑胺)。在一些实施方式中,烷基化剂的量是约25mg/m
在一些实施方式中,提供了用于治疗个体中CNS障碍的方法,包括(a)向个体全身性(例如静脉内或皮下)施用有效量的包括纳米颗粒的组合物,该纳米颗粒包括mTOR抑制剂和白蛋白;(b)向个体施用有效量的烷基化剂(例如替莫唑胺);和(c)向个体施用有效量的放射疗法。在一些实施方式中,放射疗法是局部放射疗法。在一些实施方式中,烷基化剂的量为约25mg/m
在一些实施方式中,提供了用于治疗个体中CNS障碍的方法,包括(a)向个体全身性(例如静脉内或皮下)施用有效量的包括纳米颗粒的组合物,该纳米颗粒包括mTOR抑制剂和白蛋白;和(b)向个体施用有效量的烷基化剂,其中烷基化剂亚硝基脲化合物(例如洛莫司汀)。在一些实施方式中,每次施用的亚硝基脲化合物的量为约80mg/m
在一些实施方式中,提供了用于治疗个体中CNS障碍的方法,包括(a)向个体全身性(例如静脉内或皮下)施用有效量的包括纳米颗粒的组合物,该纳米颗粒包括mTOR抑制剂和白蛋白;(b)向个体施用有效量的蛋白酶体抑制剂。在一些实施方式中,蛋白酶体抑制剂是脑渗透蛋白酶体抑制剂。在一些实施方式中,蛋白酶体抑制剂是马里佐米。在一些实施方式中,每次施用的蛋白酶体抑制剂的量为约0.1mg/m
在一些实施方式中,提供了用于向个体的脑递送有效量的mTOR抑制剂(例如西罗莫司)的方法,方法包括皮下施用组合物,例如药物组合物,其包括纳米颗粒,该纳米颗粒包括雷帕霉素和白蛋白,其中向脑递送有效量的雷帕霉素的纳米颗粒中雷帕霉素的剂量为约0.1mg/m
在一些实施方式中,提供了用于向个体的脑递送有效量的mTOR抑制剂(例如西罗莫司)的方法,方法包括静脉内(例如通过在5、4或3分钟内的静脉内推注)施用组合物,例如药物组合物,其包括纳米颗粒,该纳米颗粒包括雷帕霉素和白蛋白,其中向脑递送有效量的雷帕霉素的纳米颗粒中雷帕霉素的剂量为约0.1mg/m
本申请提供治疗个体中多种CNS障碍的方法。在一些实施方式中,CNS障碍是中枢神经系统中的肿瘤。在一些实施方式中,CNS障碍中枢神经系统中的发育障碍。在一些实施方式中,CNS障碍是中枢神经系统中的退行性障碍。
在一些实施方式中,CNS障碍是神经胶质瘤。在一些实施方式中,CNS障碍是恶性胶质瘤。在一些实施方式中,CNS障碍是癫痫。在一些实施方式中,CNS障碍是脑皮质发育不良(例如局灶性脑皮质发育不良)。在一些实施方式中,CNS障碍选自结节性硬化症、脑瘤、脆性X综合征、唐氏综合征、Rett综合征、阿尔茨海默病、帕金森氏病和亨廷顿病。
A.治疗恶性胶质瘤的方法
在一些实施方式中,提供了治疗个体中恶性胶质瘤(例如复发性恶性胶质瘤或新诊断的恶性胶质瘤)的方法,包括向个体全身性(例如静脉内或皮下)施用有效量的包括纳米颗粒的组合物,该纳米颗粒包括mTOR抑制剂和白蛋白。在一些实施方式中,个体在开始纳米颗粒施用之前已经历手术切除。在一些实施方式中,mTOR抑制剂是莫司药物。在一些实施方式中,mTOR抑制剂是雷帕霉素。在一些实施方式中,纳米颗粒组合物中mTOR抑制剂的量不超过约100mg/m
在一些实施方式中,提供了治疗个体中恶性胶质瘤(例如复发性恶性胶质瘤)的方法,包括(a)向个体全身性(例如静脉内或皮下)施用包括纳米颗粒的组合物,该纳米颗粒包括有效量的mTOR抑制剂和白蛋白;和(b)向个体施用有效量的抗VEGF抗体(例如贝伐单抗)。在一些实施方式中,每次施用的抗VEGF的量为约1mg/kg至约5mg/kg。在一些实施方式中,抗VEGF抗体每两周一次被施用。在一些实施方式中,抗VEGF抗体以每周小于约5mg/kg的量被施用。在一些实施方式中,抗VEGF抗体在施用纳米颗粒的一小时内被施用。在一些实施方式中,mTOR抑制剂是莫司药物。在一些实施方式中,mTOR抑制剂是雷帕霉素。在一些实施方式中,纳米颗粒组合物中mTOR抑制剂的量不超过约100mg/m
在一些实施方式中,提供了治疗个体中恶性胶质瘤(例如复发性恶性胶质瘤或新诊断的恶性胶质瘤)的方法,包括(a)向个体全身性(例如静脉内或皮下)施用包括纳米颗粒的组合物,该纳米颗粒包括有效量的mTOR抑制剂和白蛋白;和(b)向个体施用有效量的烷基化剂(例如替莫唑胺)。在一些实施方式中,个体在开始纳米颗粒施用之前已经历新诊断的恶性胶质瘤的手术切除。在一些实施方式中,烷基化剂(例如替莫唑胺)的量为约25mg/m
在一些实施方式中,提供了治疗个体中恶性胶质瘤(例如新诊断的恶性胶质瘤)的方法,包括(a)向个体全身性(例如静脉内或皮下)施用有效量的包括纳米颗粒的组合物,该纳米颗粒包括mTOR抑制剂和白蛋白;(b)向个体施用有效量的烷基化剂(例如替莫唑胺);和(c)向个体施用有效量的放射疗法。在一些实施方式中,放射疗法是局部放射疗法。在一些实施方式中,个体在开始纳米颗粒施用之前已经历新诊断的恶性胶质瘤的手术切除。在一些实施方式中,放射疗法是局部放射疗法。在一些实施方式中,烷基化剂的量为约25mg/m
在一些实施方式中,提供了治疗个体中恶性胶质瘤(例如复发性恶性胶质瘤或新诊断的恶性胶质瘤)的方法,包括(a)向个体全身性(例如静脉内或皮下)施用有效量的包括纳米颗粒的组合物,该纳米颗粒包括mTOR抑制剂和白蛋白;和(b)向个体施用有效量的烷基化剂,其中烷基化剂是亚硝基脲化合物(例如洛莫司汀)。在一些实施方式中,个体在开始纳米颗粒施用之前已经历新诊断的恶性胶质瘤的手术切除。在一些实施方式中,每次施用的亚硝基脲化合物的量(例如洛莫司汀)为约80mg/m
在一些实施方式中,提供了治疗个体中恶性胶质瘤(例如复发性恶性胶质瘤)的方法,包括(a)向个体全身性(例如静脉内或皮下)施用有效量的包括纳米颗粒的组合物,该纳米颗粒包括mTOR抑制剂和白蛋白;(b)向个体施用有效量的蛋白酶体抑制剂。在一些实施方式中,蛋白酶体抑制剂是脑渗透蛋白酶体抑制剂。在一些实施方式中,蛋白酶体抑制剂是马里佐米。在一些实施方式中,每次施用的蛋白酶体抑制剂的量为约0.1mg/m
在一些实施方式中,提供了治疗个体中恶性胶质瘤(例如新诊断的恶性胶质瘤)的方法,包括第一治疗、第二治疗和第三治疗,其中:第一治疗包括全身性(例如静脉内或皮下)施用包括纳米颗粒的组合物,该纳米颗粒包括mTOR抑制剂和白蛋白;第二治疗包括a)全身性(例如静脉内或皮下)施用纳米颗粒组合物,b)施用烷基化剂,和c)施用放射疗法;第三治疗包括a)全身性(例如静脉内或皮下)施用纳米颗粒组合物,和b)施用烷基化剂;其中第二治疗在第一治疗完成后开始;并且其中第三治疗在第二治疗完成后开始。在一些实施方式中,个体在开始纳米颗粒施用之前已经历新诊断的恶性胶质瘤的手术切除。在一些实施方式中,第一治疗在手术切除新诊断的恶性胶质瘤后约2-5周开始。在一些实施方式中,第二治疗在第一治疗完成后1-2周开始。在一些实施方式中,第三治疗在第二治疗完成后3-5周开始。在一些实施方式中,烷基化剂是替莫唑胺。在一些实施方式中,放射疗法是局部放射疗法。在一些实施方式中,个体在开始纳米颗粒施用之前已经历新诊断的恶性胶质瘤的手术切除。在一些实施方式中,放射疗法局部放射疗法。在一些实施方式中,烷基化剂的量为约25mg/m
在一些实施方式中,提供了治疗个体中复发性恶性胶质瘤的方法,包括向个体全身性(例如静脉内或皮下)施用有效量的包括纳米颗粒的组合物,该纳米颗粒包括mTOR抑制剂(例如莫司药物,例如西罗莫司)和白蛋白,其中mTOR抑制剂每三周两次被施用,和其中纳米颗粒组合物中mTOR抑制剂的量为约50mg/m
在一些实施方式中,提供了治疗个体中复发性恶性胶质瘤的方法,包括静脉内(例如通过在5、4或3分钟内的静脉内推注)向个体施用有效量的包括纳米颗粒的组合物,该纳米颗粒包括mTOR抑制剂(例如莫司药物,例如西罗莫司)和白蛋白,其中纳米颗粒组合物中mTOR抑制剂(例如莫司药物,例如西罗莫司)的量不超过约100mg/m
在一些实施方式中,提供了治疗个体中复发性恶性胶质瘤的方法,包括向个体皮下施用有效量的包括纳米颗粒的组合物,该纳米颗粒包括mTOR抑制剂(例如莫司药物,例如西罗莫司)和白蛋白,其中纳米颗粒组合物中mTOR抑制剂的量(例如莫司药物,例如西罗莫司)不超过约100mg/m
在一些实施方式中,提供了治疗个体中复发性恶性胶质瘤的方法,包括(a)向个体全身性(例如静脉内或皮下)施用有效量的包括纳米颗粒的组合物,该纳米颗粒包括mTOR抑制剂(例如莫司药物,例如西罗莫司)和白蛋白;和(b)向个体施用有效量的抗VEGF抗体(例如贝伐单抗),其中mTOR抑制剂每四周三次被施用,其中纳米颗粒组合物中mTOR抑制剂的量为约30mg/m
在一些实施方式中,提供了治疗个体中复发性恶性胶质瘤的方法,包括(a)向个体全身性(例如静脉内或皮下)施用有效量的包括纳米颗粒的组合物,该纳米颗粒包括mTOR抑制剂(例如莫司药物,例如西罗莫司)和白蛋白;(b)向个体施用有效量的马里佐米,其中mTOR抑制剂和马里佐米每四周三次被施用,其中纳米颗粒组合物中mTOR抑制剂的量为约30mg/m
在一些实施方式中,提供了治疗个体中复发性恶性胶质瘤的方法,包括(a)向个体全身性(例如静脉内或皮下)施用有效量的包括纳米颗粒的组合物,该纳米颗粒包括mTOR抑制剂(例如莫司药物,例如西罗莫司)和白蛋白;和(b)向个体施用有效量的替莫唑胺,其中mTOR抑制剂每四周三次被施用,其中纳米颗粒组合物中mTOR抑制剂的量为约30mg/m
在一些实施方式中,提供了治疗个体中复发性恶性胶质瘤的方法,包括(a)向个体全身性(例如静脉内或皮下)施用有效量的包括纳米颗粒的组合物,该纳米颗粒包括mTOR抑制剂(例如莫司药物,例如西罗莫司)和白蛋白;和(b)向个体施用有效量的洛莫司汀,其中mTOR抑制剂每三周两次被施用,其中纳米颗粒组合物中mTOR抑制剂的量为约30mg/m
在一些实施方式中,提供了治疗个体中新诊断的恶性胶质瘤的方法,包括向个体全身性(例如静脉内或皮下)施用有效量的包括纳米颗粒的组合物,该纳米颗粒包括mTOR抑制剂(例如莫司药物,例如西罗莫司)和白蛋白,其中mTOR抑制剂每周一次被施用,和其中纳米颗粒组合物中mTOR抑制剂的量为约50mg/m
在一些实施方式中,提供了治疗个体中新诊断的恶性胶质瘤的方法,包括(a)向个体全身性(例如静脉内或皮下)施用有效量的包括纳米颗粒的组合物,该纳米颗粒包括mTOR抑制剂(例如莫司药物,例如西罗莫司)和白蛋白;(b)向个体施用有效量的替莫唑胺,其中mTOR抑制剂每四周三次被施用,其中纳米颗粒组合物中mTOR抑制剂的量为约30mg/m
在一些实施方式中,提供了治疗个体中新诊断的恶性胶质瘤的方法,包括(a)向个体全身性(例如静脉内或皮下)施用有效量的包括纳米颗粒的组合物,该纳米颗粒包括mTOR抑制剂(例如莫司药物,例如西罗莫司)和白蛋白;和(b)向个体施用有效量的替莫唑胺,和(c)向个体施用有效量的放射疗法,其中mTOR抑制剂每三周两次被施用,其中纳米颗粒组合物中mTOR抑制剂的量为约30mg/m
B.治疗癫痫的方法
在一些实施方式中,提供了治疗个体中癫痫(例如手术难治性癫痫)的方法,包括向个体全身性(例如静脉内或皮下)施用有效量的包括纳米颗粒的组合物,该纳米颗粒包括mTOR抑制剂和白蛋白。在一些实施方式中,个体已经历癫痫手术。在一些实施方式中,个体在癫痫手术后的30天内至少5、6、7或8次癫痫发作和/或在癫痫手术后不具有一周的无癫痫发作。在一些实施方式中,个体为不超过约26岁。在一些实施方式中,个体为约3岁或更大。在一些实施方式中,个体为约0-26、1-26、2-26或3-26岁。在一些实施方式中,mTOR抑制剂是莫司药物。在一些实施方式中,mTOR抑制剂是雷帕霉素。在一些实施方式中,纳米颗粒组合物中mTOR抑制剂的量为不超过约100mg/m
在一些实施方式中,提供了治疗个体中癫痫(例如手术难治性癫痫)的方法,包括(a)向个体全身性(例如静脉内或皮下)施用有效量的包括纳米颗粒的组合物,该纳米颗粒包括mTOR抑制剂和白蛋白;和(b)施用第二药剂或非侵入性治疗(例如,干扰细胞(例如恶性胶质瘤癌细胞分裂)的非侵入性治疗,例如通过产生低强度、波状的电场,称其为肿瘤治疗场,例如
在一些实施方式中,提供了治疗个体中癫痫的方法,包括向个体全身性(例如静脉内或皮下)施用有效量的包括纳米颗粒的组合物,该纳米颗粒包括mTOR抑制剂(例如莫司药物,例如西罗莫司)和白蛋白,其中mTOR抑制剂每周被施用,和其中每次施用的纳米颗粒组合物中mTOR的量为约1mg/m
在一些实施方式中,提供了治疗个体中癫痫的方法,包括向个体静脉内(例如通过在5、4或3分钟内的静脉内推注)施用有效量的包括纳米颗粒的组合物,该纳米颗粒包括mTOR抑制剂(例如莫司药物,例如西罗莫司)和白蛋白,其中纳米颗粒组合物中mTOR抑制剂(例如莫司药物,例如西罗莫司)的量不超过约100mg/m
在一些实施方式中,提供了治疗个体中癫痫的方法,包括向个体皮下施用有效量的包括纳米颗粒的组合物,该纳米颗粒包括mTOR抑制剂(例如莫司药物,例如西罗莫司)和白蛋白,其中纳米颗粒组合物中mTOR抑制剂(例如莫司药物,例如西罗莫司)的量不超过约100mg/m
在一些实施方式中,提供了治疗个体中癫痫的方法,包括(a)向个体全身性(例如静脉内或皮下)施用有效量的包括纳米颗粒的组合物,该纳米颗粒包括mTOR抑制剂(例如莫司药物,例如西罗莫司)和白蛋白;和(b)施用第二药剂,其中mTOR抑制剂每周被施用,其中每次施用的纳米颗粒组合物中mTOR的量为约1mg/m
C.治疗脑皮质发育不良的方法
在一些实施方式中,提供了治疗个体中CNS发育异常(例如脑皮质发育不良,例如局灶性脑皮质发育不良)的方法,包括向个体全身性(例如静脉内或皮下)施用有效量的包括纳米颗粒的组合物,该纳米颗粒包括mTOR抑制剂和白蛋白。在一些实施方式中,个体已经历癫痫手术。在一些实施方式中,个体在癫痫手术后的30天内至少5、6、7或8次癫痫发作和/或在癫痫手术后不具有一周的无癫痫发作。在一些实施方式中,个体不超过26岁。在一些实施方式中,个体不小于3岁。在一些实施方式中,mTOR抑制剂是莫司药物。在一些实施方式中,mTOR抑制剂是雷帕霉素。在一些实施方式中,纳米颗粒组合物中mTOR抑制剂的量不超过约100mg/m
在一些实施方式中,提供了治疗个体中CNS发育异常(例如脑皮质发育不良,例如局灶性脑皮质发育不良)的方法,包括(a)向个体全身性(例如静脉内或皮下)施用有效量的包括纳米颗粒的组合物,该纳米颗粒包括mTOR抑制剂和白蛋白;和(b)施用第二药剂。在一些实施方式中,第二药剂是抗癫痫药。在一些实施方式中,抗癫痫药是用于癫痫的标准疗法。在一些实施方式中,抗癫痫药的剂量与标签上的标准或推荐剂量没有显著不同。在一些实施方式中,个体已经历癫痫手术。在一些实施方式中,个体在癫痫手术后的30天内至少5、6、7或8次癫痫发作和/或在癫痫手术后不具有一周的无癫痫发作。在一些实施方式中,个体不超过26岁。在一些实施方式中,个体不小于3岁。在一些实施方式中,mTOR抑制剂是莫司药物。在一些实施方式中,mTOR抑制剂是雷帕霉素。在一些实施方式中,纳米颗粒组合物中mTOR抑制剂的量不超过约100mg/m
在一些实施方式中,提供了治疗个体中脑皮质发育不良(例如局灶性脑皮质发育不良)的方法,包括向个体全身性(例如静脉内或皮下)施用有效量的包括纳米颗粒的组合物,该纳米颗粒包括mTOR抑制剂(例如莫司药物,例如西罗莫司)和白蛋白,其中mTOR抑制剂每周被施用,和其中每次施用的纳米颗粒组合物中mTOR的量为约1mg/m
在一些实施方式中,提供了治疗个体中脑皮质发育不良的方法,包括向个体静脉内(例如通过在5、4或3分钟内的静脉内推注)施用有效量的包括纳米颗粒的组合物,该纳米颗粒包括mTOR抑制剂(例如莫司药物,例如西罗莫司)和白蛋白,其中纳米颗粒组合物中mTOR抑制剂(例如莫司药物,例如西罗莫司)的量不超过约100mg/m
在一些实施方式中,提供了治疗个体中脑皮质发育不良的方法,包括向个体皮下施用有效量的包括纳米颗粒的组合物,该纳米颗粒包括mTOR抑制剂(例如莫司药物,例如西罗莫司)和白蛋白,其中纳米颗粒组合物中mTOR抑制剂(例如莫司药物,例如西罗莫司)的量不超过约100mg/m
在一些实施方式中,提供了治疗个体中脑皮质发育不良(例如局灶性脑皮质发育不良)的方法,包括(a)向个体全身性(例如静脉内或皮下)施用有效量的包括纳米颗粒的组合物,该纳米颗粒包括mTOR抑制剂(例如莫司药物,例如西罗莫司)和白蛋白;和(b)施用第二药剂,其中mTOR抑制剂每周被施用,其中每次施用的纳米颗粒组合物中mTOR的量为约1mg/m
剂量和施用方法
A.纳米颗粒组合物
在一些实施方式中,纳米颗粒组合物被全身性施用。在一些实施方式中,纳米颗粒组合物被肠胃外施用。在一些实施方式中,纳米颗粒组合物被静脉内、动脉内、腹膜内、囊内、皮下、鞘内、肺内、肌内、气管内、眼内、经皮、口服或通过吸入施用。在一些实施方式中,纳米颗粒组合物被静脉内(例如通过在5、4或3分钟内的静脉内推注)施用。在一些实施方式中,纳米颗粒组合物被皮下施用。
在一些实施方式中,mTOR抑制剂纳米颗粒组合物以一周至少约1x、2x、3x、4x、5x、6x或7x(即每天)的任一被施用。在一些实施方式中,纳米颗粒组合物不超过每三天一次、每五天一次或每周一次被施用。在一些实施方式中,纳米颗粒组合物约每两周一次、每三周一次、每四周一次、每三周两次或每四周三次被施用。在一些实施方式中,纳米颗粒组合物每月一次、每两月一次、每三月一次或超过每三月一次被施用。在一些实施方式中,每次施用之间的间隔小于约6个月、3个月、1个月、15天、8天、5天、3天或1天的任一。在一些实施方式中,剂量时间表中没有中断。在一些实施方式中,每次施用之间的间隔不超过约一周。
在一些实施方式中,向个体(例如人)静脉内(例如通过在5、4或3分钟内的静脉内推注)施用mTOR抑制剂纳米颗粒组合物并且纳米颗粒组合物中mTOR抑制剂(例如莫司药物,例如西罗莫司)的量不超过约100mg/m
在一些实施方式中,向个体(例如人)皮下施用mTOR抑制剂纳米颗粒组合物并且纳米颗粒组合物中mTOR抑制剂(例如莫司药物,例如西罗莫司)的量不超过约100mg/m
在一些实施方式中,mTOR抑制剂纳米颗粒组合物中mTOR抑制剂(例如莫司药物,例如西罗莫司)的量被包括在以下范围的任一中:约0.1mg至约1000mg、约0.1mg至约2.5mg、约0.5mg至约5mg、约5mg至约10mg、约10mg至约15mg、约15mg至约20mg、约20mg至约25mg、约20mg至约50mg、约25mg至约50mg、约50mg至约75mg、约50mg至约100mg、约75mg至约100mg、约100mg至约125mg、约125mg至约150mg、约150mg至约175mg、约175mg至约200mg、约200mg至约225mg、约225mg至约250mg、约250mg至约300mg、约300mg至约350mg、约350mg至约400mg、约400mg至约450mg、或约450mg至约500mg、约500mg至约600mg、约600mg至约700mg、约700mg至约800mg、约800mg至约900mg、或约900mg至约1000mg,包括这些值之间的任何范围。在一些实施方式中,每次施用至个体的纳米颗粒组合物中mTOR抑制剂的量为约5mg至约320mg、约10mg至约210mg或约15mg至约160mg。在一些实施方式中,每次施用至个体的纳米颗粒组合物中mTOR抑制剂的量为至少约5mg、10mg或15mg。在一些实施方式中,每次施用至个体的纳米颗粒组合物中mTOR抑制剂的量不大于约320mg、210mg或160mg。在一些实施方式中,个体是人。在一些实施方式中,mTOR抑制剂纳米颗粒组合物中mTOR抑制剂(例如莫司药物,例如西罗莫司)的浓度是稀的(约0.1mg/ml)或浓的(约100mg/ml),包括例如约0.1mg/ml至约50mg/ml、约0.1mg/ml至约20mg/ml、约1mg/ml至约10mg/ml、约2mg/ml至约8mg/ml、约4mg/ml至约6mg/ml或约5mg/ml的任一。在一些实施方式中,mTOR抑制剂纳米颗粒组合物中mTOR抑制剂(例如莫司药物,例如西罗莫司)的浓度至少约为0.5mg/ml、1.3mg/ml、1.5mg/ml、2mg/ml、3mg/ml、4mg/ml、5mg/ml、6mg/ml、7mg/ml、8mg/ml、9mg/ml、10mg/ml、15mg/ml、20mg/ml、25mg/ml、30mg/ml、40mg/ml或50mg/ml的任一。
在上述方面的任一的一些实施方式中,mTOR抑制剂纳米颗粒组合物中mTOR抑制剂(例如莫司药物,例如西罗莫司)的量至少约为0.1mg/kg、0.25mg/kg、0.75mg/kg、1mg/kg、1.5mg/kg、2mg/kg、2.25mg/kg、2.5mg/kg、2.75mg/kg、3.5mg/kg、5mg/kg、6.5mg/kg、7.5mg/kg、10mg/kg、15mg/kg、20mg/kg、25mg/kg、30mg/kg、35mg/kg、40mg/kg、45mg/kg、50mg/kg、55mg/kg或60mg/kg的任一。在一些实施方式中,每次施用至个体的纳米颗粒组合物中mTOR抑制剂的量为约0.1mg/kg至约5mg/kg、约0.2mg/kg至约3.5mg/kg或约0.25mg/kg至约2.75mg/kg。在一些实施方式中,每次施用至个体的纳米颗粒组合物中mTOR抑制剂的量至少约为0.1mg/kg、0.2mg/kg或0.25mg/kg。在一些实施方式中,每次施用至个体的纳米颗粒组合物中mTOR抑制剂的量不大于约5mg/kg、4mg/kg、3.5mg/kg、3mg/kg或2.75mg/kg。在一些实施方式中,个体是人。
在一些实施方式中,每次施用至个体的纳米颗粒组合物中mTOR抑制剂的量为约5mg/m
在一些实施方式中,每次施用的纳米颗粒组合物中mTOR抑制剂的量为约0.1mg/m
在一些实施方式中,每三到四周的纳米颗粒组合物中mTOR抑制剂的量为约25mg/m
纳米颗粒组合物的剂量可以被停止或中断——具有或不具有剂量减少,以处理药物不良反应。
在一些实施方式中,纳米颗粒组合物被施用持续至少1个(例如至少2、3、4、5、6、7、8、9、10、11、12或更多个的任一)周期。在一些实施方式中,纳米颗粒组合物被施用持续至多12个(例如至多11、10、9、8、7、6或更少个的任一)周期。在一些实施方式中,周期由三周或四周组成。在一些实施方式中,纳米颗粒组合物被施用持续至少约一至六个周期,其中每个周期由21或28天组成。在一些实施方式中,纳米颗粒组合物被施用持续约或至少约六周、八周、十二周或二十四周。在一些实施方式中,纳米颗粒组合物被施用持续约或至少约一个月、二个月、三个月、四个月、五个月或六个月。在一些实施方式中,纳米颗粒组合物被施用不大于十二个月、十五个月、十八个月、一年或两年。
在一些实施方式中,mTOR抑制剂纳米颗粒组合物允许在短于约24小时的输液时间内将mTOR抑制剂纳米颗粒组合物输液至个体。例如,在一些实施方式中,mTOR抑制剂纳米颗粒组合物(例如西罗莫司/白蛋白纳米颗粒组合物)在少于约24小时、12小时、8小时、5小时、3小时、2小时、1小时、30分钟,20分钟或10分钟的任一的输液时间段内被施用。在一些实施方式中,mTOR抑制剂纳米颗粒组合物(例如西罗莫司/白蛋白纳米颗粒组合物)在约30分钟的输液时间段内被施用。
在一些实施方式中,纳米颗粒组合物约每三周两次被施用并且每次施用的纳米颗粒组合物中mTOR抑制剂的量为约100mg/m
在一些实施方式中,纳米颗粒组合物约每四周三次或每三周两次被全身性(例如静脉内或皮下)施用,并且每次施用的纳米颗粒组合物中mTOR抑制剂的量不超过约100mg/m
在一些实施方式中,纳米颗粒组合物作为治疗CNS障碍的单一疗法被施用。
mTOR抑制剂纳米颗粒组合物(例如西罗莫司/白蛋白纳米颗粒组合物)的量可以随具体组合物、施用方式和所治疗的CNS障碍的类型而变化。在一些实施方式中,剂量有效地产生客观缓解(例如部分缓解或完全缓解)。在一些实施方式中,剂量足以产生个体中完全缓解。在一些实施方式中,剂量足以产生个体中部分缓解。在一些实施方式中,在使用mTOR抑制剂纳米颗粒组合物(例如西罗莫司/白蛋白纳米颗粒组合物)治疗的个体人群中,所施用的剂量足以产生超过约20%、25%、30%、35%、40%、45%、50%、55%、60%、64%、65%、70%、75%、80%、85%或90%的任一的总体缓解率。可以确定个体对本文所述方法的治疗的反应,例如,基于RECIST水平。
在一些实施方式中,mTOR抑制剂纳米颗粒组合物(例如西罗莫司/白蛋白纳米颗粒组合物)的量足以延长个体的无进展生存期。在一些实施方式中,mTOR抑制剂纳米颗粒组合物(例如西罗莫司/白蛋白纳米颗粒组合物)的量足以延长个体的总生存期。在一些实施方式中,在使用mTOR抑制剂纳米颗粒组合物治疗的个体人群中,mTOR抑制剂纳米颗粒组合物(例如西罗莫司/白蛋白纳米颗粒组合物)的量足以产生超过约50%、60%、70%或77%的任一的临床受益。
在一些实施方式中,与治疗前相同个体的相应肿瘤大小、癌细胞数量或肿瘤生长速率相比,或与未接受治疗的其他个体的相应活性相比,mTOR抑制剂纳米颗粒组合物(例如西罗莫司/白蛋白纳米颗粒组合物)的量足以减小肿瘤(例如脑瘤,例如恶性胶质瘤)的大小、降低癌细胞的数量或使肿瘤的生长速率降低至少约10%、20%、30%、40%、50%、60%、70%、80%、90%、95%或100%的任一。可以使用标准方法来测量这种影响的量级,例如利用纯化酶的体外测定、基于细胞的测定、动物模型或人体测试。
在一些实施方式中,与治疗前相同个体或未接受治疗的其他个体中相应的症状相比,mTOR抑制剂纳米颗粒组合物(例如西罗莫司/白蛋白纳米颗粒组合物)的量足以减轻CNS障碍(例如癫痫)的症状(例如癫痫发作大小或一段时间内癫痫发作的次数)至较小的程度。在一些实施方式中,与治疗前相同个体或未接受治疗的其他个体中相应的症状相比,mTOR抑制剂纳米颗粒组合物(例如西罗莫司/白蛋白纳米颗粒组合物)的量足以将CNS障碍(例如癫痫)的症状(例如癫痫发作大小或一段时间内癫痫发作的次数)减轻至少约5%、10%、20%、30%、40%、50%、60%、70%、80%、90%、95%或100%的任一。示例性症状包括但不限于头痛;面部、背部、手部或腿部疼痛;无法专心;感觉丧失;记忆力丧失;肌肉力量丧失;震颤;癫痫发作;反射、痉挛、抽搐增加;麻痹;和口齿不清。
在一些实施方式中,当向个体施用mTOR抑制剂纳米颗粒组合物时,mTOR抑制剂纳米颗粒组合物(例如西罗莫司/白蛋白纳米颗粒组合物)的量低于如此水平,该水平诱导毒理学作用(即超过临床可接受的毒性水平的作用)或处于可以控制或耐受潜在副作用的水平。
在一些实施方式中,mTOR抑制剂纳米颗粒组合物(例如西罗莫司/白蛋白纳米颗粒组合物)的量接近组合物的最大耐受剂量(MTD)。在一些实施方式中,mTOR抑制剂纳米颗粒组合物(例如西罗莫司/白蛋白纳米颗粒组合物)的量为约或超过约MTD的50%、60%、70%、80%、90%、95%或98%的任一。在一些实施方式中,mTOR抑制剂纳米颗粒组合物(例如西罗莫司/白蛋白纳米颗粒组合物)的量少于约MTD的50%、60%、70%、80%、90%、95%或98%的任一。
B.第二药剂
在一些实施方式中,本申请包括施用第二药剂。在一些实施方式中,第二药剂被全身性施用。在一些实施方式中,第二药剂被肠胃外施用。在一些实施方式中,第二药剂被局部(即局部性(locally)施用。在一些实施方式中,第二药剂被静脉内、动脉内、腹膜内、囊内、皮下、鞘内、肺内、肌内、气管内、眼内、经皮、口服或通过吸入施用。
在一些实施方式中,纳米颗粒组合物和第二药剂同时被同步地施用至个体。在一些实施方式中,纳米颗粒组合物和第二药剂被顺序地施用至个体。在一些实施方式中,纳米颗粒组合物和第二药剂被同时地施用至个体。
在一些实施方式中,第二药剂在施用纳米颗粒组合物之前被施用。在一些实施方式中,纳米颗粒组合物在完成纳米颗粒组合物施用之后的一小时、三十分钟、十五分钟、十分钟内被施用。
在一些实施方式中,第二药剂在完成纳米颗粒组合物施用之后被施用。在一些实施方式中,第二药剂在完成纳米颗粒组合物施用之后的一小时、三十分钟、十五分钟、十分钟内被施用。
在一些实施方式中,第二药剂在纳米颗粒组合物施用的同一天被施用至少一次。在一些实施方式中,第二药剂在纳米颗粒组合物施用的同一天被施用,在三周或四周周期中至少一次、二次、三次或四次。
在一些实施方式中,第二药剂以至少约一周1x、2x、3x、4x、5x、6x或7x(即每天)的任一被施用。在一些实施方式中,第二药剂约每两周一次、每三周一次、每四周一次、每三周两次或每四周三次被施用。在一些实施方式中,第二药剂每月一次、每两月一次、每三月一次或比每三月一次更低频率地被施用。在一些实施方式中,每次施用之间的间隔小于约6个月、3个月、1个月、15天、8天、5天、3天或1天的任一。在一些实施方式中,剂量时间表中没有中断。在一些实施方式中,每次施用之间的间隔不超过约一周。
在一些实施方式中,第二药剂被施用持续至少一(例如至少2、3、4、5、6、7、8、9、10、11、12或更多个的任一)个周期。在一些实施方式中,第二药剂被施用持续至多12(例如至多11、10、9、8、7、6或更少的任一)个周期。在一些实施方式中,周期由三周或四周组成。
在一些实施方式中,本文所述的第二药剂通过输液被施用。在一些实施方式中,输液时间短于约24小时。例如,在一些实施方式中,第二药剂在少于约24小时、12小时、8小时、5小时、3小时、2小时、1.5小时、1小时、30分钟、20分钟或10分钟的任一的输液时间段内被施用。
第二药剂的剂量可以被停止或中断——具有或不具有剂量减少,以处理药物不良反应。在一些实施方式中,第二药剂根据认可的第二药剂品牌的处方信息被施用。
在一些实施方式中,向个体应用第二药剂以使实现相同治疗程度所需的纳米颗粒组合物中的mTOR抑制剂(例如雷帕霉素)的正常量减少至少约5%、10%、20%、30%、50%、60%、70%、80%、90%或更多的任一。在一些实施方式中,纳米颗粒组合物中足够的mTOR抑制剂被施用以便使实现相同治疗程度所需的第二药剂的正常剂量减少至少约5%、10%、20%、30%、50%、60%、70%、80%、90%或更多的任一。
在一些实施方式中,纳米颗粒组合物和第二药剂的联合施用产生超加性效应(supra-additive effect)。
向个体(例如人)施用mTOR抑制剂纳米颗粒组合物(例如西罗莫司/白蛋白纳米颗粒组合物)的量和第二药剂的剂量可以随具体组合物、施用方式和所治疗的CNS障碍的类型而变化。在一些实施方式中,剂量有效地产生客观缓解(例如部分缓解或完全缓解)。在一些实施方式中,剂量足以产生个体中完全缓解。在一些实施方式中,剂量足以产生个体中部分缓解。在一些实施方式中,在使用mTOR抑制剂纳米颗粒组合物(例如西罗莫司/白蛋白纳米颗粒组合物)和第二药剂治疗的个体人群中,所施用的剂量足以产生超过约20%、25%、30%、35%、40%、45%、50%、55%、60%、64%、65%、70%、75%、80%、85%或90%的任一的总体缓解率。可以确定个体对本文所述方法的治疗的反应,例如,基于RECIST水平。
在一些实施方式中,mTOR抑制剂纳米颗粒组合物(例如西罗莫司/白蛋白纳米颗粒组合物)和第二药剂的量足以延长个体的无进展生存期。在一些实施方式中,mTOR抑制剂纳米颗粒组合物(例如西罗莫司/白蛋白纳米颗粒组合物)和第二药剂的量足以延长个体的总生存期。在一些实施方式中,在使用mTOR抑制剂纳米颗粒组合物和第二药剂治疗的个体人群中,mTOR抑制剂纳米颗粒组合物(例如西罗莫司/白蛋白纳米颗粒组合物)和第二药剂的量足以以产生超过约50%、60%、70%或77%的任一的临床受益。
在一些实施方式中,与治疗前相同个体的相应肿瘤大小、癌细胞数量或肿瘤生长速率相比,或与未接受治疗的其他个体的相应活性相比,mTOR抑制剂纳米颗粒组合物(例如西罗莫司/白蛋白纳米颗粒组合物)和第二药剂的量足以减小肿瘤(例如脑瘤,例如恶性胶质瘤)的大小、降低癌细胞的数量或使肿瘤的生长速率降低至少约10%、20%、30%、40%、50%、60%、70%、80%、90%、95%或100%的任一。可以使用标准方法来测量这种影响的量级,例如利用纯化酶的体外测定、基于细胞的测定、动物模型或人体测试。
在一些实施方式中,与治疗前相同个体或未接受治疗的其他个体中相应的症状相比,mTOR抑制剂纳米颗粒组合物(例如西罗莫司/白蛋白纳米颗粒组合物)和第二药剂的量足以减轻CNS障碍(例如癫痫)的症状(例如癫痫发作大小或一段时间内癫痫发作的次数)至较小的程度。在一些实施方式中,与治疗前相同个体或未接受治疗的其他个体中相应的症状相比,mTOR抑制剂纳米颗粒组合物(例如西罗莫司/白蛋白纳米颗粒组合物)和第二药剂的量足以将CNS障碍(例如癫痫)的症状(例如癫痫发作大小或一段时间内癫痫发作的次数)减轻至少约5%、10%、20%、30%、40%、50%、60%、70%、80%、90%、95%或100%的任一。示例性症状包括但不限于头痛;面部、背部、手部或腿部疼痛;无法专心;感觉丧失;记忆力丧失;肌肉力量丧失;震颤;癫痫发作;增加、痉挛、抽搐反射;麻痹;和口齿不清。
在一些实施方式中,当向个体施用mTOR抑制剂纳米颗粒组合物和第二药剂时,mTOR抑制剂纳米颗粒组合物(例如西罗莫司/白蛋白纳米颗粒组合物)和第二药剂的量低于如此水平,该水平诱导毒理学作用(即超过临床可接受的毒性水平的作用)或处于可以控制或耐受潜在副作用的水平。
在一些实施方式中,当与第二药剂一起施用时,遵循相同剂量方案,mTOR抑制剂纳米颗粒组合物(例如西罗莫司/白蛋白纳米颗粒组合物)的量接近组合物的最大耐受剂量(MTD)。在一些实施方式中,当与第二药剂一起施用时,mTOR抑制剂纳米颗粒组合物(例如西罗莫司/白蛋白纳米颗粒组合物)的量超过约MTD的50%、60%、70%、80%、90%、95%或98%的任一。
1.抗VEGF抗体
在一些实施方式中,抗VEGF抗体(例如贝伐单抗)以至少约一周1x、2x、3x、4x、5x、6x或7x(即每天)的任一被施用。在一些实施方式中,抗VEGF抗体约每两周一次、每三周一次、每四周一次、每三周两次或每四周三次被施用。在一些实施方式中,抗VEGF抗体每月一次、每两月一次、每三月一次、或超过每三月一次被施用。在一些实施方式中,每次施用之间的间隔小于约6个月、3个月、1个月、15天、8天、5天、3天或1天的任一。在一些实施方式中,剂量时间表中没有中断。在一些实施方式中,每次施用之间的间隔不超过约一周。
在一些实施方式中,每次施用的抗VEGF的量为约0.1mg/kg至约20mg/kg、约0.5mg/kg至约10mg/kg、约1mg/kg至约7.5mg/kg或约1mg/kg至约5mg/kg。在一些实施方式中,每次施用的抗VEGF的量不超过约20mg/kg、10mg/kg、7.5mg/kg或5mg/kg。
在一些实施方式中,每周的抗VEGF的量(例如如果不是每周被施用则为平均量)为约0.1mg/kg至约20mg/kg、约0.5mg/kg至约10mg/kg、约1mg/kg至约7.5mg/kg或约1mg/kg至约5mg/kg。在一些实施方式中,每周的抗VEGF的量不超过约20mg/kg、10mg/kg、7.5mg/kg或5mg/kg。
在一些实施方式中,每两周的抗VEGF的量为约0.1mg/kg至约20mg/kg、约0.5mg/kg至约10mg/kg、约1mg/kg至约7.5mg/kg或约1mg/kg至约5mg/kg。在一些实施方式中,每两周的抗VEGF的量不超过约20mg/kg、10mg/kg、7.5mg/kg或5mg/kg。
在一些实施方式中,抗VEGF抗体被静脉内施用。
在一些实施方式中,抗VEGF抗体允许在短于约24小时的输液时间内将抗VEGF抗体输液至个体。例如,在一些实施方式中,抗VEGF抗体在不超过约24小时、12小时、8小时、5小时、3小时、2小时、1.5小时、1小时、30分钟、20分钟或10分钟的任一的输液时间段内被施用。在一些实施方式中,与后续剂量的抗VEGF抗体的输注时间段相比,第一剂量的抗VEGF抗体在更长的输注时间段内被施用。在一些实施方式中,第一剂量抗VEGF抗体在约60-120分钟的输液时间段内被施用。在一些实施方式中,第二或随后剂量的抗VEGF抗体在约30-90分钟的输液时间段内被施用。
在一些实施方式中,抗VEGF抗体(例如贝伐单抗)每两周一次被静脉内施用,并且抗VEGF抗体以每两周约1mg/kg至约10mg/kg的量被施用。在一些实施方式中,抗VEGF抗体在完成纳米颗粒组合物施用之后的一小时内被施用。
2.蛋白酶体抑制剂
在一些实施方式中,蛋白酶体抑制剂(例如马里佐米)以一周至少约1x、2x、3x、4x、5x、6x或7x(即每天)的任一被施用。在一些实施方式中,蛋白酶体抑制剂(例如马里佐米)约每两周一次、每三周一次、每四周一次、每三周两次或每四周三次被施用。在一些实施方式中,蛋白酶体抑制剂(例如马里佐米)每月一次、每两月一次、每三月一次、或超过每三月一次被施用。在一些实施方式中,每次施用之间的间隔小于约6个月、3个月、1个月、15天、8天、5天、3天或1天的任一。在一些实施方式中,剂量时间表中没有中断。在一些实施方式中,每次施用之间的间隔不超过约一周。
在一些实施方式中,每次施用的蛋白酶体抑制剂(例如马里佐米)的量为约0.05mg/m
在一些实施方式中,每周的蛋白酶体抑制剂(例如马里佐米)的量(例如如果不是每周被施用则为平均量)为约0.05mg/m
在一些实施方式中,每四周的蛋白酶体抑制剂(例如马里佐米)的量为0.05mg/m
在一些实施方式中,蛋白酶体抑制剂(例如马里佐米)被静脉内地施用。
在一些实施方式中,蛋白酶体抑制剂(例如马里佐米)允许在短于约24小时的输液时间内将蛋白酶体抑制剂(例如马里佐米)输液至个体。例如,在一些实施方式中,蛋白酶体抑制剂(例如马里佐米)在不超过约24小时、12小时、8小时、5小时、3小时、2小时、1.5小时、1小时、30分钟、20分钟或10分钟的任一的输液时间段内被施用。
在一些实施方式中,蛋白酶体抑制剂(例如马里佐米)每四周三次被静脉内施用,并且每次施用的蛋白酶体抑制剂(例如马里佐米)以约0.6mg/m
3.烷基化剂
在一些实施方式中,烷基化剂(例如替莫唑胺)以至少约一周1x、2x、3x、4x、5x、6x或7x(即每天)的任一被施用。在一些实施方式中,烷基化剂(例如替莫唑胺)约每两周一次、每三周一次、每四周一次、每三周两次或每四周三次被施用。在一些实施方式中,烷基化剂(例如替莫唑胺)每月一次、每两月一次、每三月一次或超过每三月一次被施用。在一些实施方式中,每次施用之间的间隔小于约6个月、3个月、1个月、15天、8天、5天、3天或1天的任一。在一些实施方式中,剂量时间表中没有中断。在一些实施方式中,每次施用之间的间隔不超过约一周。
在一些实施方式中,烷基化剂(例如替莫唑胺)每天被施用持续约或至少约3天、5天、一周、两周、三周、四周、五周或六周。在一些实施方式中,烷基化剂(例如替莫唑胺)以交替的每周时间表被施用(七天进行和七天没有)。在一些实施方式中,烷基化剂(例如替莫唑胺)在21天周期或28天周期中至少连续2天、连续3天、连续4天、连续5天被施用。
在一些实施方式中,每次施用的烷基化剂(例如替莫唑胺)的量为约1mg/m
在一些实施方式中,每天的烷基化剂(例如替莫唑胺)的量为约1mg/m
在一些实施方式中,每周的烷基化剂(例如替莫唑胺)的量为约10mg/m
在一些实施方式中,四周(即28天)周期的烷基化剂(例如替莫唑胺)的量为约500mg/m
在一些实施方式中,烷基化剂(例如替莫唑胺)被口服施用。
在一些实施方式中,烷基化剂(例如替莫唑胺)每天被口服施用,并且每次施用的烷基化剂(例如替莫唑胺)以约25mg/m
a)亚硝基脲化合物
在一些实施方式中,烷基化剂是亚硝基脲化合物。在一些实施方式中,亚硝基脲化合物是洛莫司汀(CCNU)。在一些实施方式中,亚硝基脲化合物(例如洛莫司汀)约每周一次、每两周一次、每三周一次、每四周一次、每五周一次或每六周一次被施用。在一些实施方式中,亚硝基脲化合物(例如洛莫司汀)以至少约一周1x、2x、3x、4x、5x、6x、或7x(即每天)的任一被施用。在一些实施方式中,亚硝基脲化合物(例如洛莫司汀)约每三周两次或每四周三次被施用。在一些实施方式中,亚硝基脲化合物(例如洛莫司汀)每月一次、每两月一次、每三月一次或超过每三月一次被施用。在一些实施方式中,每次施用之间的间隔小于约6个月、3个月、1个月、15天、8天、5天、3天或1天的任一。在一些实施方式中,剂量时间表中没有中断。在一些实施方式中,每次施用之间的间隔不超过约一周。
在一些实施方式中,每次施用的亚硝基脲化合物(例如洛莫司汀)的量为约30mg/m
在一些实施方式中,每六周的亚硝基脲化合物(例如洛莫司汀)的量为约30mg/m
在一些实施方式中,亚硝基脲化合物(例如洛莫司汀)被口服施用。
在一些实施方式中,亚硝基脲化合物(例如洛莫司汀)每六周一次被口服施用,并且每次施用的亚硝基脲化合物(例如洛莫司汀)以约70mg/m
C.放射疗法
在一些实施方式中,方法进一步包括放射疗法。本文考虑的放射包括例如7射线、X射线(外粒子束)以及放射性同位素向与CNS障碍相关的细胞/组织的定向递送。也考虑其他形式的DNA破坏因素,例如也考虑微波和UV照射。可以按剂量分级的时间表以单剂量或一系列小剂量给予放射。
在一些实施方式中,向个体应用足够的放射疗法以使实现相同治疗程度所需的纳米颗粒组合物中的mTOR抑制剂(例如雷帕霉素)的正常量和/或第二药剂的剂量减少至少约5%、10%、20%、30%、50%、60%、70%、80%、90%或更多的任一。在一些实施方式中,纳米颗粒组合物中足够的mTOR抑制剂和/或第二药剂被施用以便使实现相同治疗程度所需的放射疗法的正常剂量减少至少约5%、10%、20%、30%、50%、60%、70%、80%、90%或更多的任一。在一些实施方式中,与当不以三联组合使用时各自的相应正常剂量相比,纳米颗粒组合物中的mTOR抑制剂(如雷帕霉素)的量、第二药剂的剂量和放射疗法的剂量均减少。
在一些实施方式中,纳米颗粒组合物(任选地与第二药剂)和放射疗法的联合施用产生超加性效应。
在一些实施方式中,放射疗法是全脑放射疗法。在一些实施方式中,放射疗法是强度调节的放射疗法(IMRT)。在一些实施方式中,放射疗法局部放射疗法。
在一些实施方式中,放射疗法一周至少约1、2、3、4或5天被施用。在一些实施方式中,放射疗法被施用持续约或至少约1、2、3、4、5或6周。在一些实施方式中,放射疗法被施用持续至多约12、11、10、9、8、7或6周。
在一些实施方式中,每天持续一周至少1、2、3、4或5天,向个体施用约10-120Gy、20-100Gy、30-90Gy、40-80Gy、50-70Gy、55-65Gy或60Gy的放射疗法的总剂量。在一些实施方式中,每天持续一周至少1、2、3、4或5天,向个体施用约或至少约10Gy、20Gy、30Gy、40Gy、50Gy、55Gy或60Gy的放射疗法的总剂量。在一些实施方式中,每天持续一周至少1、2、3、4或5天向个体施用至多约120Gy、110Gy、100Gy、90Gy、80Gy、75Gy、70Gy、65Gy或60Gy的放射疗法的总剂量。
在一些实施方式中,向个体每天施用的放射疗法的总剂量具有约10-50、15-45、20-40、25-35、28-32、或30次放射(fractions of radiation)。在一些实施方式中,每次的剂量为约50-350cGy、100-300cGy、125-275cGy、150-250cGy、175-225cGy、190-210cGy或约200cGy。
在一些实施方式中,每天持续一周至少5天向个体施用约50-70Gy的放射疗法的总剂量,其中每个放射疗法的总剂量具有约25-35次放射,并且每次的剂量为约150-250cGy。
放射性同位素的剂量范围变化很大,并且取决于同位素的半衰期以及所发射的辐射的强度和类型。
CNS障碍
本申请提供了治疗个体中CNS障碍的方法。在一些实施方式中,CNS障碍是中枢神经系统中的肿瘤。在一些实施方式中,CNS障碍是中枢神经系统中的发育障碍。在一些实施方式中,CNS障碍是中枢神经系统中的退行性障碍。
在一些实施方式中,CNS障碍是神经胶质瘤。在一些实施方式中,CNS障碍是恶性胶质瘤。在一些实施方式中,CNS障碍是癫痫。在一些实施方式中,CNS障碍是脑皮质发育不良(例如局灶性脑皮质发育不良)。在一些实施方式中,CNS障碍选自结节性硬化症、脑瘤、脆性X综合征、唐氏综合征、Rett综合征、阿尔茨海默病、帕金森氏病和亨廷顿病。
A.肿瘤
在一些实施方式中,CNS障碍是中枢神经系统中的肿瘤。在一些实施方式中,肿瘤是恶性的。在一些实施方式中,肿瘤是脑瘤。在一些实施方式中,肿瘤是原发性脑瘤。在一些实施方式中,肿瘤是继发性脑瘤。在一些实施方式中,肿瘤是神经胶质瘤。
1.恶性胶质瘤
在一些实施方式中,CNS障碍是恶性胶质瘤(GBM)。在一些实施方式中,恶性胶质瘤分为经典、神经前、神经或间充质亚型。参见Verhaaket al.,Cancer Cell.2010Jan 19;17(1):98。
在一些实施方式中,恶性胶质瘤包括脑中的肿瘤。在一些实施方式中,肿瘤在大脑中。在一些实施方式中,肿瘤在小脑中。在一些实施方式中,肿瘤在脑干中。在一些实施方式中,肿瘤在间脑中。
在一些实施方式中,肿瘤具有小于约5-6cm的大小。在一些实施方式中,肿瘤具有超过约5-6cm的大小。在一些实施方式中,肿瘤横跨中间线。在一些实施方式中,肿瘤不横跨中间线。
在一些实施方式中,恶性胶质瘤包括受体酪氨酸激酶/Ras/磷酸肌醇3-激酶信号通路的基因改造。在一些实施方式中,恶性胶质瘤包括表皮生长因子受体(EGFR)的基因改造。在一些实施方式中,改造的特征在于EGFR的过表达。在一些实施方式中,恶性胶质瘤包括磷酸酶和张力蛋白同源物(PTEN)的基因改造。在一些实施方式中,恶性胶质瘤包括PTEN上的突变。在一些实施方式中,恶性胶质瘤具有染色体10q的损失。在一些实施方式中,恶性胶质瘤包括异柠檬酸脱氢酶1(IDH1)上的突变。在一些实施方式中,恶性胶质瘤包括p53上的突变。在一些实施方式中,恶性胶质瘤具有染色体19q的损失。
在一些实施方式中,恶性胶质瘤包括颞叶中的原发性神经胶质瘤。在一些实施方式中,恶性胶质瘤包括颞叶外中的原发性神经胶质瘤。在一些实施方式中,恶性胶质瘤包括额叶中的原发性神经胶质瘤。在一些实施方式中,恶性胶质瘤包括顶叶中的原发性神经胶质瘤。在一些实施方式中,恶性胶质瘤包括枕叶中的原发性神经胶质瘤。
在一些实施方式中,恶性胶质瘤是原发性的。在一些实施方式中,恶性胶质瘤是新生的(de novo)。在一些实施方式中,恶性胶质瘤是继发性的。在一些实施方式中,恶性胶质瘤在没有已知前体的情况下产生。
a)复发性恶性胶质瘤
在一些实施方式中,恶性胶质瘤是复发性恶性胶质瘤。
在一些实施方式中,复发性恶性胶质瘤的特征在于根据RANO标准(在2个垂直直径中≥10mm)至少有1、2、3、4或5个可测量的病变。
在一些实施方式中,个体在治疗前已经经受放射疗法。在一些实施方式中,当开始施用纳米颗粒组合物和/或第二药剂时,是在放射疗法后至少1、2、3、4、5、6、7、8、9、10、11或12周。
在一些实施方式中,复发性恶性胶质瘤的特征在于在放射疗法后具有放射领域外的新病变。在一些实施方式中,复发性恶性胶质瘤的特征在于放射疗法后复发。在一些实施方式中,复发性恶性胶质瘤与恶性胶质瘤的先前发生至少间隔4、6或8周。在一些实施方式中,复发性恶性胶质瘤的特征在于具有放射领域外的新病变、放射疗法后复发,或者复发性恶性胶质瘤与恶性胶质瘤的先前发生至少间隔4、6或8周发生以及放射疗法后小于约1、2、3、4、5、6、7、8、9、10、11或12周开始治疗。
在一些实施方式中,个体在治疗前已经经受烷基化剂(例如替莫唑胺)。在一些实施方式中,个体在治疗前已经经受放射疗法和烷基化剂(例如替莫唑胺)二者。
在一些实施方式中,个体在治疗前已经经受手术切除。在一些实施方式中,当开始施用纳米颗粒组合物和/或第二药剂时,是在手术切除后至少1、2、3或4周。
在一些实施方式中,个体在治疗前没有经受抗血管生成剂(例如抗VEGF抗体)。在一些实施方式中,个体在治疗前没有经受mTOR抑制剂(例如莫司药物,例如雷帕霉素)。在一些实施方式中,个体在治疗前没有经受抗血管生成剂和mTOR抑制剂。在一些实施方式中,用于治疗个体中复发性恶性胶质瘤的方法包括a)向个体全身性(例如静脉内或皮下)施用有效量的包括mTOR抑制剂和白蛋白的纳米颗粒组合物,和b)向个体施用抗VEGF抗体,其中个体在治疗前没有经受抗血管生成剂和mTOR抑制剂。
在一些实施方式中,个体在治疗前没有经受蛋白酶体抑制剂(例如马里佐米)。在一些实施方式中,个体在治疗前没有经受mTOR抑制剂(例如莫司药物,例如雷帕霉素)。在一些实施方式中,个体在治疗前没有经受蛋白酶体抑制剂和mTOR抑制剂。在一些实施方式中,用于治疗个体中复发性恶性胶质瘤的方法包括a)向个体全身性(例如静脉内或皮下)施用有效量的包括mTOR抑制剂和白蛋白的纳米颗粒组合物,和b)向个体施用蛋白酶体抑制剂,其中个体在治疗前没有经受蛋白酶体抑制剂和mTOR抑制剂。
在一些实施方式中,个体在治疗前至少约7、10或14天没有癫痫发作。在一些实施方式中,个体的卡尔诺夫斯基行为状态分数为至少50%、55%、60%、65%或70%。
b)新诊断的恶性胶质瘤
在一些实施方式中,恶性胶质瘤是新诊断的恶性胶质瘤(ndGBM)。
在一些实施方式中,个体在治疗前已经经受切除手术。在一些实施方式中,新诊断的恶性胶质瘤的特征在于在手术后根据RANO标准(在2个垂直直径中≥10mm)至少有1、2、3、4或5个可测量的病变。
在一些实施方式中,个体在治疗前已经经受mTOR抑制剂(例如莫司药物,例如雷帕霉素)。在一些实施方式中,个体在治疗前没有经受局部疗法。在一些实施方式中,个体在治疗前没有经受全身疗法。在一些实施方式中,个体在治疗前没有经受局部疗法和全身疗法。
在一些实施方式中,个体在治疗前至少约7、10或14天没有癫痫发作。在一些实施方式中,个体的卡尔诺夫斯基行为状态分数为至少50%、55%、60%、65%或70%。
B.癫痫
在一些实施方式中,CNS障碍是癫痫。在一些实施方式中,癫痫是疗法抗性的(即难治的)。在一些实施方式中,个体具有每月至少1、2、3、4或5次癫痫发作,其在使用至少2、3、4种抗癫痫药(AED)或非侵入性治疗(例如,干扰细胞(例如恶性胶质瘤癌细胞分裂)的非侵入性治疗,例如通过产生低强度、波状的电场,称其为肿瘤治疗场,例如
癫痫发作和癫痫通常根据癫痫发作开始的方式分为局灶性的和全身性的,以及根据根本原因或病因将其分为遗传、结构、代谢、免疫、感染或未知。在一些实施方式中,癫痫具有遗传基础(例如特发性定位相关性癫痫)。在一些实施方式中,癫痫是隐源性癫痫。在一些实施方式中,癫痫是代谢性癫痫。在一些实施方式中,癫痫是结构性癫痫。在一些实施方式中,癫痫是免疫性癫痫。在一些实施方式中,癫痫是感染性癫痫(infectious epilepsy)。
在一些实施方式中,个体癫痫发作开始在六个月、十二个月、一岁、一岁半、两岁、三岁、四岁、五岁、六岁、九岁、十二岁、十五岁或十八岁的年龄之前。
在一些实施方式中,个体具有智力迟钝、围产期缺氧、新生儿惊厥史和/或癫痫持续状态史。
在一些实施方式中,个体具有频繁的癫痫发作(例如一月至少1x、2x、3x、4x、5x、6x、7x、8x、9x或10x癫痫发作)。另一个实例,个体具有一周至少1x、2x、3x、4x、5x、6x或7x(即每天)癫痫发作。另一个实例,个体具有一天至少1x、2x或3x癫痫发作。
在一些实施方式中,个体具有频繁的最初癫痫发作(例如在第一个月、或前两个、三个、四个、五个、六个、九个、十二个、或二十四个月中至少1x、2x、3x、4x、5x、6x、7x、8x、9x或10x癫痫发作)。另一个实例,个体具有第一周中至少1x、2x、3x、4x、5x、6x或7x(即每天)癫痫发作。另一个实例,个体具有第一天、或前两、三、四、五或六天中至少1x、2x、3x、4x、5x、6x或7x癫痫发作。
在一些实施方式中,个体在基线具有相对较低的癫痫发作率。例如,在一些实施方式中,个体在治疗开始前的过去30天中具有不超过一周平均约10、9、8、7、6、5、4、3或2次癫痫发作。
在一些实施方式中,个体在基线具有相对较高的癫痫发作率。例如,在一些实施方式中,个体在治疗开始前的过去30天中具有至少一周平均约12、13、14、15、16、17、18、19、20、21、22、23或24次癫痫发作。
在一些实施方式中,个体在癫痫发作期间具有至少1、2、3、4、5、6、7、8、9、10、11或12次异常脑电图(EEG)发现事件。在一些实施方式中,癫痫发作是部分癫痫发作(即局灶性癫痫发作)。在一些实施方式中,EEG是局灶性EEG。在一些实施方式中,癫痫发作是全身性癫痫发作。在一些实施方式中,异常EEG发现包括额叶中的发现。在一些实施方式中,异常EEG发现包括颞叶中的情况。在一些实施方式中,异常EEG发现包括顶叶中的发现。在一些实施方式中,异常EEG发现包括枕叶中的发现。在一些实施方式中,癫痫的特征在于弥散性脑电图模式。
在一些实施方式中,癫痫包括颞叶癫痫。在一些实施方式中,癫痫包括不受控制的和/或单侧颞叶癫痫。
在一些实施方式中,癫痫包括颞叶外癫痫。
在一些实施方式中,癫痫包括难治性癫痫,其在6个月、9个月、12个月、18个月、一岁、一岁半、两岁、三岁、四岁、五岁、六岁、十二岁或十八岁的年龄前发展。
在一些实施方式中,个体在治疗前已经经受癫痫手术。在一些实施方式中,癫痫手术在癫痫发作开始的半年、一年、一年半或两年内进行。在一些实施方式中,当个体小于半岁、一岁、一岁半、两岁、五岁、八岁、十二岁、十五岁或十八岁时进行癫痫手术。在一些实施方式中,手术是局灶性或大叶切除手术。在一些实施方式中,手术是半球切除手术。在一些实施方式中,切除是全切除(即切除在MRI上的可见病变或切除由颅内EEG确定的癫痫病灶)。在一些实施方式中,切除是次全切除(subtotal resection)。参见Kabatet al.,Pol.J.Radiol,2012;77(2):35-43。在一些实施方式中,个体对于手术是难治的。
在一些实施方式中,手术包括颞叶切除。在一些实施方式中,手术不包括颞叶外切除。在一些实施方式中,手术包括颞叶外切除。在一些实施方式中,手术不包括颞叶切除。在一些实施方式中,癫痫的特征在于在手术后零癫痫发作的时间段。在一些实施方式中,该时间段为约1、2、3、4、5、6个月。
在一些实施方式中,癫痫对手术和至少一(例如一、二、三、或更多)种抗癫痫药或非侵入性治疗(例如,干扰细胞(例如恶性胶质瘤癌细胞分裂)的非侵入性治疗,例如通过产生低强度、波状的电场,称其为肿瘤治疗场,例如
在一些实施方式中,癫痫与脑皮质发育不良(例如2A型和/或2B型脑皮质发育不良)相关联。
在一些实施方式中,癫痫与婴儿痉挛(例如难治性婴儿痉挛)相关联。在一些实施方式中,癫痫与轻偏瘫(例如左侧先天性轻偏瘫)相关联。
在一些实施方式中,癫痫与肿瘤相关联。在一些实施方式中,肿瘤是低级赘生性肿瘤(low-grade neoplastic tumor)。在一些实施方式中,肿瘤是神经胶质瘤。在一些实施方式中,肿瘤是神经节神经胶质瘤(gangliogliomas)。在一些实施方式中,肿瘤是胚胎发育不良性神经上皮瘤(DNET)。在一些实施方式中,DNET与脑皮质发育不良相关联。
在一些实施方式中,癫痫与围产期梗塞相关联。在一些实施方式中,癫痫与感染(例如细菌性或病毒性脑炎)相关联。在一些实施方式中,癫痫与硬化症相关联。在一些实施方式中,硬化症是海马硬化。
在一些实施方式中,癫痫与结节性硬化症相关联。在一些实施方式中,结节性硬化症的特征在于引发局灶性或多病灶的癫痫发作。在一些实施方式中,癫痫发作是治疗抗性的。在一些实施方式中,癫痫发作损害神经认知发育。
在一些实施方式中,癫痫与拉斯穆森综合征相关联。在一些实施方式中,癫痫与下丘脑错构瘤相关联。在一些实施方式中,癫痫与半侧巨脑症相关联。在一些实施方式中,癫痫与Lennox-Gastaut综合征相关联。
在一些实施方式中,个体小于1、2、3、5、10、12、15、16、18或26岁。在一些实施方式中,个体超过约0.5、1、1.5、2、3、5、10、12、15、16、18或26岁。在一些实施方式中,个体为约0-26、1-26、2-26、3-26、0-18、0-15或0-12岁。
C.脑皮质发育不良(例如局灶性脑皮质发育不良)
在一些实施方式中,CNS障碍是脑皮质发育不良(例如局灶性脑皮质发育不良)。
在一些实施方式中,脑皮质发育不良(例如局灶性脑皮质发育不良)是轻型。在一些实施方式中,脑皮质发育不良(例如局灶性脑皮质发育不良)是重型。参见Palmini etal.,Neurology,2004.62(6Suppl 3):p.S2-8.;和Vinterset al.,Int.Rev.Neurobiol,2002.49:p.63-76。在一些实施方式中,脑皮质发育不良(例如局灶性脑皮质发育不良)是重型并且是颞外的。
在一些实施方式中,脑皮质发育不良(例如局灶性脑皮质发育不良)为I型、II型或III型。在一些实施方式中,脑皮质发育不良(例如局灶性脑皮质发育不良)为Ia型或Ib型。在一些实施方式中,脑皮质发育不良(例如局灶性脑皮质发育不良)为IIa型或IIb型。在一些实施方式中,脑皮质发育不良(例如局灶性脑皮质发育不良)为IIIa型、IIIb型或IIIc型。参见Kabatet al.,Pol.J.Radiol,2012:77(2):35-43。
在一些实施方式中,脑皮质发育不良(例如局灶性脑皮质发育不良)包括结节性硬化。
在一些实施方式中,脑皮质发育不良(例如局灶性脑皮质发育不良)的特征在于可测量的病变。在一些实施方式中,病变在颞叶中。在一些实施方式中,病变在颞叶外。
在一些实施方式中,脑皮质发育不良(例如局灶性脑皮质发育不良)的特征在于不明确的癫痫病灶。在一些实施方式中,脑皮质发育不良(例如局灶性脑皮质发育不良)的特征在于继发性全身性强直阵挛性癫痫发作。在一些实施方式中,脑皮质发育不良(例如局灶性脑皮质发育不良)的特征在于颅内电极应用。在一些实施方式中,脑皮质发育不良(例如局灶性脑皮质发育不良)的特征在于广泛切除。
在一些实施方式中,脑皮质发育不良(例如局灶性脑皮质发育不良)的特征在于癫痫。在一些实施方式中,癫痫是难治的。在一些实施方式中,脑皮质发育不良(例如局灶性脑皮质发育不良)的特征在于智力迟钝。在一些实施方式中,脑皮质发育不良(例如局灶性脑皮质发育不良)的特征在于早开始的癫痫发作。例如,癫痫发作开始的年龄为约六个月、十二个月、一岁、一岁半或两岁。在一些实施方式中,脑皮质发育不良(例如局灶性脑皮质发育不良)的特征在于高频率的癫痫发作。例如,癫痫发作发生一周至少1x、2x、3x、4x、5x、6x或7x(即每天)。另一个实例,癫痫发作发生一天至少1x、2x或3x。另一个实例,癫痫发作发生一月至少1x、2x、3x、4x、5x、6x、7x、8x、9x或10x。
在一些实施方式中,脑皮质发育不良(例如局灶性脑皮质发育不良)的特征在于先前的切除手术。在一些实施方式中,先前的切除手术在疾病症状(例如癫痫)开始的半年、一年、一年半或两年内进行。在一些实施方式中,当个体小于半岁、一岁、一岁半、两岁、五岁、八岁、十二岁、十五岁或十八岁时,进行切除手术。在一些实施方式中,手术是局灶性或大叶切除手术。在一些实施方式中,手术是半球切除手术。在一些实施方式中,切除是全切除(即切除在MRI上的可见病变或切除由颅内EEG确定的癫痫病灶)。在一些实施方式中,切除是次全切除。参见Kabat et al.,Pol.J.Radiol,2012;77(2):35-43。
在一些实施方式中,手术包括颞叶切除。在一些实施方式中,手术不包括颞叶外切除。在一些实施方式中,手术包括颞叶外切除。在一些实施方式中,手术不包括颞叶切除。在一些实施方式中,癫痫的特征在于手术后零癫痫发作的时间段。在一些实施方式中,该时间段为约1、2、3、4、5、6个月。
在一些实施方式中,个体小于1、2、3、5、10、15、16、18或26岁。在一些实施方式中,个体超过约0.5、1、1.5、2、3、5、10、15、16、18或26岁。在一些实施方式中,个体为约0-26、1-26、2-26或3-26岁。
个体
在一些实施方式中,个体是哺乳动物。在一些实施方式中,个体是人。
在一些实施方式中,个体小于1、2、3、5、10、12、15、16、18或26岁。在一些实施方式中,个体超过约0.5、1、1.5、2、3、5、10、12、15、16、18或26岁。在一些实施方式中,个体为约0-26、1-26、2-26、3-26、0-18、0-15或0-12岁。
在一些实施方式中,个体是雄性。
在一些实施方式中,个体被诊断出患有医学上难治性癫痫。医学上难治性癫痫被定义为在六个月的时间段内,至少有2种适当剂量和耐受的AED无法消除所有临床癫痫发作。在一些实施方式中,AED治疗(一个或多个)在癫痫手术之前。
在一些实施方式中,个体已经经受各自的癫痫(即癫痫切除手术)。
在一些实施方式中,个体的临床癫痫发作持续至少1、2或3个月。在一些实施方式中,临床癫痫发作在各自的癫痫手术后发生。
在一些实施方式中,个体在治疗开始前的过去30天内至少1、2、3、4、5、6、7、8、或9次癫痫发作。在一些实施方式中,个体在治疗开始前的过去30天内不具有持续超过7天、10天或14天的无癫痫发作。在一些实施方式中,个体在治疗开始前的过去30天内至少8或9次癫痫发作,而不具有2周的无癫痫发作。
在一些实施方式中,个体在基线具有相对较低的癫痫发作率。例如,在一些实施方式中,个体在治疗开始前的过去30天中不超过一周平均约10、9、8、7、6、5、4、3或2次癫痫发作。
在一些实施方式中,个体在基线具有相对较高的癫痫发作率。例如,在一些实施方式中,个体在治疗开始前的过去30天中一周至少平均约12、13、14、15、16、17、18、19、20、21、22、23或24次癫痫发作。
在一些实施方式中,个体具有脑皮质发育不良(例如2A型和/或2B型)。在一些实施方式中,个体具有难治性婴儿痉挛。在一些实施方式中,个体具有左侧先天性轻偏瘫。
在一些实施方式中,个体没有经受切除手术。在一些实施方式中,个体已经经受切除手术。在一些实施方式中,手术在障碍(例如癫痫)开始的半年、一年、一年半或两年内进行。在一些实施方式中,当个体小于半岁、一岁、一岁半、两岁、五岁、八岁、十二岁、十五岁或十八岁时进行手术。在一些实施方式中,手术是局灶性或大叶切除手术。在一些实施方式中,手术是半球切除手术。在一些实施方式中,切除是全切除(即切除在MRI上的可见病变或切除由颅内EEG确定的癫痫病灶)。在一些实施方式中,切除是次全切除。参见Kabatet al.,Pol.J.Radiol,2012;77(2):35-43。在一些实施方式中,手术包括颞叶切除。在一些实施方式中,手术不包括颞叶外切除。在一些实施方式中,手术包括颞叶外切除。在一些实施方式中,手术不包括颞叶切除。在一些实施方式中,先前切除手术在疾病症状(例如癫痫)开始的半年、一年、一年半或两年内进行。
在一些实施方式中,个体具有手术后零癫痫发作的时间段。在一些实施方式中,该时间段为约1、2、3、4、5或6个月。在一些实施方式中,该时间段为约1、2、3或4周。在一些实施方式中,个体在手术后的约1、2、3、4、5、6个月中至少1、2、3、4、5、6、7、8、9或10次癫痫发作。在一些实施方式中,个体在手术后的约1、2、3或4周内至少1、2、3、4、5、6、7、8、9或10次癫痫发作。
在一些实施方式中,根据RANO标准(在2个垂直直径中≥10mm),个体具有至少1、2、3、4或5个可测量的病变。
在一些实施方式中,个体在治疗前已经经受放射疗法。在一些实施方式中,当开始施用纳米颗粒组合物和/或第二药剂时,是在放射疗法后至少1、2、3、4、5、6、7、8、9、10、11或12周。
在一些实施方式中,个体在放射疗法后在具有放射领域外的新病变。在一些实施方式中,个体放射疗法后复发。在一些实施方式中,个体具有复发性恶性胶质瘤,并且复发性恶性胶质瘤与恶性胶质瘤的先前发生至少间隔4、6或8周。在一些实施方式中,个体具有放射领域外的新病变、放射疗法后复发,或者复发性恶性胶质瘤与恶性胶质瘤的先前发生至少间隔4、6、或8周发生以及放射疗法后小于约1、2、3、4、5、6、7、8、9、10、11或12周开始治疗。在一些实施方式中,个体具有3级或4级恶性胶质瘤。在一些实施方式中,个体具有间变型少突胶质细胞瘤(例如3级间变型少突胶质细胞瘤)。在一些实施方式中,个体对恶性胶质瘤的先前手术和/或先前治疗(例如标准的替莫唑胺(TMZ)/放射疗法(RT)治疗、
在一些实施方式中,个体在治疗前已经经受烷基化剂(例如替莫唑胺)。在一些实施方式中,个体在治疗前已经经受放射疗法和烷基化剂(例如替莫唑胺)二者。
在一些实施方式中,个体在治疗前已经经受手术切除。在一些实施方式中,当开始施用纳米颗粒组合物和/或第二药剂时,是在手术切除后至少1、2、3或4周。
在一些实施方式中,个体在治疗前没有经受抗血管生成剂(例如抗VEGF抗体)。在一些实施方式中,个体在治疗前没有经受mTOR抑制剂(例如莫司药物,例如雷帕霉素)。在一些实施方式中,个体在治疗前没有经受抗血管生成剂和mTOR抑制剂。在一些实施方式中,用于治疗个体CNS障碍的方法包括a)向个体全身性(例如静脉内或皮下)施用有效量的包括mTOR抑制剂和白蛋白的纳米颗粒组合物,和b)向个体施用抗VEGF抗体,其中个体在治疗前没有经受抗血管生成剂和mTOR抑制剂。
在一些实施方式中,个体在治疗前没有经受蛋白酶体抑制剂(例如马里佐米)。在一些实施方式中,个体在治疗前没有经受mTOR抑制剂(例如莫司药物,例如雷帕霉素)。在一些实施方式中,个体在治疗前没有经受蛋白酶体抑制剂和mTOR抑制剂。在一些实施方式中,用于治疗个体CNS障碍的方法包括a)向个体全身性(例如静脉内或皮下)施用有效量的包括mTOR抑制剂和白蛋白的纳米颗粒组合物,和b)向个体施用蛋白酶体抑制剂,其中个体在治疗前没有经受蛋白酶体抑制剂和mTOR抑制剂。
在一些实施方式中,个体在治疗前没有经受局部疗法。在一些实施方式中,个体在治疗前没有经受全身疗法。在一些实施方式中,个体在治疗前没有经受局部疗法和全身疗法。
在一些实施方式中,个体的卡尔诺夫斯基行为状态分数为至少50%、55%、60%、65%或70%。
在一些实施方式中,个体每月至少1、2、3、4或5次癫痫发作,其在使用至少2、3或4种抗癫痫药(AED)或非侵入性治疗(例如,干扰细胞(例如恶性胶质瘤癌细胞分裂)的非侵入性治疗,例如通过产生低强度、波状的电场,称其为肿瘤治疗场,例如
在一些实施方式中,个体癫痫发作开始在六个月、十二个月、一岁、一岁半、两岁、三岁、四岁、五岁、六岁、九岁、十二岁、十五岁或十八岁的年龄之前。
在一些实施方式中,个体具有智力迟钝、围产期缺氧、新生儿惊厥史和/或癫痫持续状态史。
在一些实施方式中,个体具有频繁的癫痫发作(例如一月至少1x、2x、3x、4x、5x、6x、7x、8x、9x或10x癫痫发作)。另一个实例,个体一周至少1x、2x、3x、4x、5x、6x或7x(即每天)癫痫发作。另一个实例,个体一天至少1x、2x或3x癫痫发作。
在一些实施方式中,个体具有频繁的最初癫痫发作(例如在第一个月、或前两个、三个、四个、五个、六个、九个、十二个、或二十四个月中至少1x、2x、3x、4x、5x、6x、7x、8x、9x或10x癫痫发作)。另一个实例,个体在第一周中至少1x、2x、3x、4x、5x、6x或7x(即每天)癫痫发作。另一个实例,个体在第一天、或前两、三、四、五或六天中至少1x、2x、3x、4x、5x、6x或7x癫痫发作。
在一些实施方式中,个体在癫痫发作期间具有至少1、2、3、4、5、6、7、8、9、10、11或12次异常脑电图(EEG)发现事件。在一些实施方式中,癫痫发作是部分癫痫发作(即局灶性癫痫发作)。在一些实施方式中,EEG是局灶性EEG。在一些实施方式中,癫痫发作是全身性癫痫发作。在一些实施方式中,异常EEG发现包括额叶中的发现。在一些实施方式中,异常EEG发现包括颞叶中的发现。在一些实施方式中,异常EEG发现包括顶叶中的发现。在一些实施方式中,异常EEG发现包括枕叶中的发现。在一些实施方式中,个体具有弥散性EEG模式。
在一些实施方式中,个体具有难治性癫痫,其在6个月、9个月、12个月、18个月、一岁、一岁半、两岁、三岁、四岁、五岁、六岁、十二岁或十八岁的年龄前发展。
在一些实施方式中,个体具有先前的癫痫手术。在一些实施方式中,先前的癫痫手术在癫痫开始的半年、一年、一年半或两年内进行。在一些实施方式中,当个体小于半岁、一岁、一岁半、两岁、五岁、八岁、十二岁、十五岁或十八岁时,进行癫痫手术。在一些实施方式中,手术是局灶性或大叶切除手术。在一些实施方式中,手术是半球切除手术。在一些实施方式中,切除是全切除(即切除在MRI上的可见病变或切除由颅内EEG确定的癫痫病灶)。在一些实施方式中,切除是次全切除。参见Kabat et al.,Pol.J.Radiol,2012;77(2):35-43。
在一些实施方式中,手术包括颞叶切除。在一些实施方式中,手术不包括颞叶外切除。在一些实施方式中,手术包括颞叶外切除。在一些实施方式中,手术不包括颞叶切除。在一些实施方式中,癫痫的特征在于手术后的零癫痫发作的时间段。在一些实施方式中,该时间段为约1、2、3、4、5、6个月.
在一些实施方式中,个体具有不明确的癫痫病灶。在一些实施方式中,个体具有继发性全身性强直阵挛性癫痫发作。在一些实施方式中,个体具有广泛切除。
在一些实施方式中,个体具有早开始的癫痫发作。例如,癫痫发作开始的年龄为约六个月、十二个月、一岁、一岁半或两岁。
在一些实施方式中,个体具有癫痫并且对手术或至少一种抗癫痫药是难治的。在一些实施方式中,个体具有癫痫并且对手术和至少一种抗癫痫药二者均是难治的。
纳米颗粒组合物
本文所述的mTOR抑制剂纳米颗粒组合物包含纳米颗粒,所述纳米颗粒包含下列(在各种实施方式中,主要由下列组成或由下列组成):mTOR抑制剂(如莫司药物,例如西罗莫司或其衍生物)和白蛋白(如人血清白蛋白)。水溶性不良的药物(如大环内酯类)的纳米颗粒已被公开于例如美国专利号5,916,596;6,506,405;6,749,868、6,537,579、7,820,788和8,911,786,以及美国专利公开号2006/0263434和2007/0082838;PCT专利申请WO008/137148中,其每一篇均整体通过引用并入本文。
在一些实施方式中,组合物包含平均或均值直径不大于约1000纳米(nm),如不大于约900、800、700、600、500、400、300、200和100nm中任一的纳米颗粒。在一些实施方式中,纳米颗粒的平均或均值直径不大于约200nm。在一些实施方式中,纳米颗粒的平均或均值直径不大于约150nm。在一些实施方式中,纳米颗粒的平均或均值直径不大于约100nm。在一些实施方式中,纳米颗粒的平均或均值直径为约10至约400nm。在一些实施方式中,纳米颗粒的平均或均值直径为约10至约150nm。在一些实施方式中,纳米颗粒的平均或均值直径为约40至约120nm。在一些实施方式中,纳米颗粒的平均或均值直径不小于约50nm。在一些实施方式中,纳米颗粒是可无菌过滤的。
在一些实施方式中,本文所述的组合物中的纳米颗粒的平均直径不大于约200nm,包括例如不大于约190、180、170、160、150、140、130、120、110、100、90、80、70或60nm中的任一。在一些实施方式中,所述组合物中至少约50%(例如,至少约60%、70%、80%、90%、95%或99%中的任一)的纳米颗粒的直径不大于约200nm,包括例如不大于190、180、170、160、150、140、130、120、110、100、90、80、70或60nm中的任一。在一些实施方式中,组合物中至少约50%(例如60%、70%、80%、90%、95%或99%中的任一)的纳米颗粒落在约10nm至约400nm的范围内,包括例如约10nm至约200nm、约20nm至约200nm、约30nm至约180nm、约40nm至约150nm、约40nm至约120nm和约60nm至约100nm。
确定平均粒度的方法是本领域已知的,例如,动态光散射(DLS)常规用于确定基于亚微米级颗粒的大小。国际标准ISO22412粒度分析-动态光散射,国际标准化组织(ISO)2008和定义的动态光散射通用术语,Malvern仪器有限公司,2011年。在一些实施方式中,粒度被测量为组合物中纳米颗粒的体积加权平均粒度(Dv50)。
在一些实施方式中,纳米颗粒包括与白蛋白缔合的mTOR抑制剂。在一些实施方式中,纳米颗粒包括包被有白蛋白的mTOR抑制剂。
在一些实施方式中,白蛋白具有可以形成二硫键的巯基。在一些实施方式中,组合物的纳米颗粒部分中至少约5%(包括例如至少约10%、15%、20%、25%、30%、40%、50%、60%、70%、80%或90%中的任一)的白蛋白是交联的(例如通过一个或多个二硫键交联的)。
在一些实施方式中,将包含mTOR抑制剂(如莫司药物,例如西罗莫司或其衍生物)的纳米颗粒与白蛋白(如人白蛋白或人血清白蛋白)缔合(例如包被)。在一些实施方式中,该组合物包含纳米颗粒和非纳米颗粒形式(例如,溶液形式或可溶性白蛋白/纳米颗粒复合物形式)的mTOR抑制剂(如莫司药物,例如西罗莫司或其衍生物),其中组合物中至少约50%、60%、70%、80%、90%、95%或99%中的任一的mTOR抑制剂为纳米颗粒形式。在一些实施方式中,纳米颗粒中的mTOR抑制剂(如莫司药物,例如西罗莫司或其衍生物)按重量计构成纳米颗粒的超过约50%、60%、70%、80%、90%、95%或99%中的任一。在一些实施方式中,纳米颗粒具有非聚合物基质。在一些实施方式中,纳米颗粒包含基本上不含聚合物材料(如聚合物基质)的mTOR抑制剂(如莫司药物,例如西罗莫司或其衍生物)的核心。
在一些实施方式中,组合物在组合物的纳米颗粒和非纳米颗粒部分中均包含白蛋白,其中组合物中至少约50%、60%、70%、80%、90%、95%或99%中的任一的白蛋白处于组合物的非纳米颗粒部分中。
在一些实施方式中,mTOR抑制剂纳米颗粒组合物中白蛋白(如人白蛋白或人血清白蛋白)和mTOR抑制剂(如莫司药物,例如西罗莫司或其衍生物)的重量比为约18:1或更少,如约15:1或更少,例如约10:1或更少。在一些实施方式中,所述组合物中白蛋白(如人白蛋白或人血清白蛋白)和mTOR抑制剂(如莫司药物,例如西罗劳斯或其衍生物)的重量比落在以下任一项的范围内:约1:1至约18:1、约2:1至约15:1、约3:1至约13:1、约4:1至约12:1、约5:1至约10:1。在一些实施方式中,组合物的纳米颗粒部分中白蛋白和mTOR抑制剂(如莫司药物,例如西罗莫司或其衍生物)的重量比为约1:2、1:3、1:4、1:5、1:9、1:10、1:15或更少中的任一。在一些实施方式中,组合物中白蛋白(如人白蛋白或人血清白蛋白)与mTOR抑制剂(如莫司药物,例如西罗莫司或其衍生物)的重量比为以下任一:约1:1至约18:1、约1:1至约15:1、约1:1至约12:1、约1:1至约10:1、约1:1至约9:1、约1:1至约8:1、约1:1至约7:1、约1:1至约6:1、约1:1至约5:1、约1:1至约4:1、约1:1至约3:1、约1:1至约2:1、约1:1至约1:1。
在一些实施方式中,mTOR抑制剂纳米颗粒组合物(如西罗莫司/白蛋白纳米颗粒组合物)包含一种或多种上述特征。
本文所述的纳米颗粒可以以干燥制剂(如冻干的组合物)存在或悬浮在生物相容性介质中。合适的生物相容性介质包括但不限于水、缓冲水性介质、盐水、缓冲盐水、氨基酸的任选缓冲溶液、蛋白质的任选缓冲溶液、糖的任选缓冲溶液、维生素的任选缓冲溶液、合成聚合物的任选缓冲溶液、含脂质的乳液等。
在一些实施方式中,药学上可接受的载体包括白蛋白(如人白蛋白或人血清白蛋白)。白蛋白可以是天然来源或合成制备的。在一些实施方式中,白蛋白是人白蛋白或人血清白蛋白。在一些实施方式中,白蛋白是重组白蛋白。
人血清白蛋白(HSA)是Mr 65K的高度可溶性球状蛋白,由585个氨基酸组成。HSA是血浆中最丰富的蛋白质,占人血浆胶体渗透压的70-80%。HSA的氨基酸序列包含总共17个二硫桥,一个自由硫醇(Cys 34)和一个色氨酸(Trp 214)。已经指出HSA溶液的静脉内使用用于预防和治疗低血容量性休克(参见,例如,Tullis,JAMA,237:355-360,460-463,(1977)和Houser et al.,Surgery,Gynecology and Obstetrics,150:811-816(1980))以及结合交换输血用于新生儿高胆红素血症的治疗(参见,例如,Finlayson,Seminars inThrombosis and Hemostasis,6,85-120,(1980))。考虑其他白蛋白,如牛血清白蛋白。这种非人白蛋白的使用可以是适当的,例如,在非人哺乳动物中使用这些组合物的情况下,如兽医(包括家养宠物和农业环境)。人血清白蛋白(HSA)具有多个疏水结合位点(总共8个用于脂肪酸,HSA的内源性配体),并结合多种药物,特别是中性和带负电荷的疏水化合物(Goodman et al.,The Pharmacological Basis of Therapeutics,9th ed,McGraw-HillNew York(1996))。已提出在HSA的亚结构域IIA和IIIA中的两个高亲和力结合位点,其是高度细长的疏水袋,在表面附近具有带电荷的赖氨酸和精氨酸残基,用作极性配体特征的附接点(例如,参见Fehske et al.,Biochem.Pharmcol.,30,687-92(198a)、Vorum,Dan.Med.Bull.,46,379-99(1999)、Kragh-Hansen,Dan.Med.Bull.,1441,131-40(1990)、Curry et al.,Nat.Struct.Biol.,5,827-35(1998)、Sugio et al.,Protein.Eng.,12,439-46(1999)、He et al.,Nature,358,209-15(199b)和Carter et al.,Adv.Protein.Chem.,45,153-203(1994))。已经显示雷帕霉素和丙泊酚结合HSA(参见,例如,Paal et al.,Eur.J.Biochem.,268(7),2187-91(200a)、Purcell et al.,Biochim.Biophys.Acta,1478(a),61-8(2000)、Altmayer et al.,Arzneimittelforschung,45,1053-6(1995)和Garrido et al.,Rev.Esp.Anestestiol.Reanim.,41,308-12(1994))。另外,已显示多西紫杉醇与人血浆蛋白结合(参见,例如,Urien et al.,Invest.New Drugs,14(b),147-51(1996))。
在一些实施方式中,本文所述的组合物基本上不含(如,不含)表面活性剂,如Cremophor(或聚氧乙烯化蓖麻油,包括
本文所述的组合物中白蛋白的量将根据组合物中的其他组分而变化。在一些实施方式中,组合物包含的白蛋白的量足以使mTOR抑制剂(如莫司药物,例如西罗莫司或其衍生物)在水性悬浮液中稳定化,例如稳定胶体悬浮液形式(如纳米颗粒的稳定悬浮液)。在一些实施方式中,白蛋白处于降低mTOR抑制剂(如莫司药物,例如西罗莫司或其衍生物)在水性介质中的沉降率的量。对于含颗粒的组合物,白蛋白的量还取决于mTOR抑制剂的纳米颗粒的尺寸和密度。
如果mTOR抑制剂(如莫司药物,例如西罗莫司或其衍生物)长时间段在水性介质中保持悬浮(如没有可见的沉淀或沉降),如至少约0.1、0.2、0.25、0.5、1、2、3、4、5、6、7、8、9、10、11、12、24、36、48、60或72小时中的任一,则其被“稳定化”在水性悬浮液中。悬浮液总体上但不一定适于施用至个体(例如人)。悬浮液的稳定性总体上(但不一定)在储存温度(如室温(如20-25℃)或冷藏条件(如4℃))下评估。例如,如果在悬浮液制备后约15分钟悬浮液不呈现肉眼或用光学显微镜以1000倍观察时可见的絮凝或颗粒凝聚,则其在储存温度下是稳定的。还可以在加速测试条件下(如,在约40℃或更高的温度下)评估稳定性。
在一些实施方式中,白蛋白的存在量足以使一定浓度的mTOR抑制剂(如莫司药物,例如西罗莫司或其衍生物)在水性悬浮液中稳定化。例如,组合物中的mTOR抑制剂(例如莫司药物,例如西罗莫司或其衍生物)的浓度为约0.1至约100mg/ml,包括例如约0.1至约50mg/ml、约0.1至约20mg/ml、约1至约10mg/ml、约2mg/ml至约8mg/ml、约4至约6mg/ml或约5mg/ml中的任一。在一些实施方式中,mTOR抑制剂(如莫司药物,例如西罗莫司或其衍生物)的浓度为至少约1.3mg/ml、1.5mg/ml、2mg/ml、3mg/ml、4mg/ml、5mg/ml、6mg/ml、7mg/ml、8mg/ml、9mg/ml、10mg/ml、15mg/ml、20mg/ml、25mg/ml、30mg/ml、40mg/ml和50mg/ml中的任一。在一些实施方式中,白蛋白以避免使用表面活性剂(如Cremophor)的量存在,使得组合物不含或基本上不含表面活性剂(如Cremophor)。
在一些实施方式中,液体形式的组合物包含约0.1%至约50%(w/v)(例如,约0.5%(w/v)、约5%(w/v)、约10%(w/v)、约15%(w/v)、约20%(w/v)、约30%(w/v)、约40%(w/v)或约50%(w/v))的白蛋白。在一些实施方式中,液体形式的组合物包含约0.5%至约5%(w/v)的白蛋白。
在一些实施方式中,mTOR抑制剂纳米颗粒组合物中白蛋白与mTOR抑制剂(如莫司药物,例如西罗莫司或其衍生物)的重量比使得足量的mTOR抑制剂结合至细胞或被细胞运输。尽管白蛋白与mTOR抑制剂(如莫司药物,例如西罗莫司或其衍生物)的重量比必须针对不同的白蛋白和mTOR抑制剂组合优化,但总体上白蛋白与mTOR抑制剂(例如莫司药物,例如西罗莫司或其衍生物)的重量比(w/w)为约0.01:1至约100:1、约0.02:1至约50:1、约0.05:1至约20:1、约0.1:1至约20:1、约1:1至约18:1、约2:1至约15:1、约3:1至约12:1、约4:1至约10:1、约5:1至约9:1或约9:1。在一些实施方式中,白蛋白与mTOR抑制剂(如莫司药物,例如西罗莫司或其衍生物)的重量比为约18:1或更小、15:1或更小、14:1或更小、13:1或更小、12:1或更小、11:1或更小、10:1或更小、9:1或更小、8:1或更小、7:1或更小、6:1或更小、5:1或更小、4:1或更小或和3:1或更小。在一些实施方式中,组合物中白蛋白(如人白蛋白或人血清白蛋白)与mTOR抑制剂(如莫司药物,例如西罗莫司或其衍生物)的重量比为以下任一:约1:1至约18:1、约1:1至约15:1、约1:1至约12:1、约1:1至约10:1、约1:1至约9:1、约1:1至约8:1、约1:1至约7:1、约1:1至约6:1、约1:1至约5:1、约1:1至约4:1、约1:1至约3:1、约1:1至约2:1、约1:1至约1:1。
在一些实施方式中,白蛋白允许将组合物施用至个体(如,人)而没有显著副作用。在一些实施方式中,白蛋白(如人血清白蛋白或人白蛋白)的量有效减少向人施用mTOR抑制剂(如莫司药物,例如西罗莫司或其衍生物)的一种或多种施用的副作用。术语“减少施用mTOR抑制剂(如莫司药物,例如西罗莫司或其衍生物)的一种或多种副作用”是指减少、减轻、消除或避免由mTOR抑制剂引起的一种或多种不期望作用以及由用于递送mTOR抑制剂的递送媒介(如使莫司药物适于注射的溶剂)引起的副作用。这种副作用包括例如骨髓抑制、神经毒性、过敏(超敏,hypersensitivity)、炎症、静脉刺激、静脉炎、疼痛、皮肤刺激、周围神经病、中性粒细胞减少发热、过敏反应、静脉血栓形成、外渗及其组合。但是,这些副作用仅仅是示例性的,并且与莫司药物(如莫司药物,例如西罗莫司或其衍生物)相关的其他副作用或副作用组合可以被减少。
在一些实施方式中,本文所述的mTOR抑制剂纳米颗粒组合物包括纳米颗粒,该纳米颗粒包括mTOR抑制剂(如莫司药物,例如西罗莫司或其衍生物)和白蛋白(如人白蛋白或人血清白蛋白),其中纳米颗粒具有不大于约200nm的平均直径。在一些实施方式中,本文所述的mTOR抑制剂纳米颗粒组合物包括纳米颗粒,该纳米颗粒包括mTOR抑制剂(如莫司药物,例如西罗莫司或其衍生物)和白蛋白(例如人白蛋白或人血清白蛋白),其中纳米颗粒具有不大于约150nm的平均直径。在一些实施方式中,本文所述的mTOR抑制剂纳米颗粒组合物包括纳米颗粒,该纳米颗粒包括mTOR抑制剂(如莫司药物,例如西罗莫司或其衍生物)和白蛋白(如人白蛋白或人血清白蛋白),其中纳米颗粒具有不大于约150nm(例如约100-120nm,例如约100nm)的平均直径。在一些实施方式中,本文所述的mTOR抑制剂纳米颗粒组合物包括纳米颗粒,该纳米颗粒包括西罗莫司和人白蛋白(例如人血清白蛋白),其中纳米颗粒具有不大于约150nm(例如约100-120nm,例如约100nm)的平均直径。在一些实施方式中,本文所述的mTOR抑制剂纳米颗粒组合物包括纳米颗粒,该纳米颗粒包括西罗莫司和人白蛋白(例如人血清白蛋白),其中纳米颗粒的平均或均值直径为约10至约150nm。在一些实施方式中,本文所述的mTOR抑制剂纳米颗粒组合物包括纳米颗粒,该纳米颗粒包括西罗莫司和人白蛋白(例如人血清白蛋白),其中纳米颗粒的平均或均值直径为约40至约120nm。
在一些实施方式中,本文所述的mTOR抑制剂纳米颗粒组合物包括纳米颗粒,该纳米颗粒包括mTOR抑制剂(如莫司药物,例如西罗莫司或其衍生物)和白蛋白(如人白蛋白或人血清白蛋白),其中纳米颗粒具有不大于约200nm的平均直径,其中组合物中白蛋白和mTOR抑制剂的重量比不大于约9:1(如约9:1或约8:1)。在一些实施方式中,本文所述的mTOR抑制剂纳米颗粒组合物包括纳米颗粒,该纳米颗粒包括mTOR抑制剂(如莫司药物,例如西罗莫司或其衍生物)和白蛋白(如人白蛋白或人血清白蛋白),其中纳米颗粒具有不大于约150nm的平均直径,其中组合物中白蛋白和mTOR抑制剂的重量比不大于约9:1(如约9:1或约8:1)。在一些实施方式中,本文所述的mTOR抑制剂纳米颗粒组合物包括纳米颗粒,该纳米颗粒包括mTOR抑制剂(如莫司药物,例如西罗莫司或其衍生物)和白蛋白(如人白蛋白或人血清白蛋白),其中纳米颗粒具有约150nm的平均直径,其中组合物中白蛋白和mTOR抑制剂的重量比不大于约9:1(如约9:1或约8:1)。在一些实施方式中,本文所述的mTOR抑制剂纳米颗粒组合物包括纳米颗粒,该纳米颗粒包括西罗莫司和人白蛋白(如人血清白蛋白),其中纳米颗粒具有不大于约150nm(例如约100-120nm,例如约100nm)的平均直径,其中组合物中白蛋白和mTOR抑制剂的重量比为约9:1或约8:1。在一些实施方式中,纳米颗粒的平均或均值直径为约10nm至约150nm。在一些实施方式中,纳米颗粒的平均或均值直径为约40nm至约120nm。
在一些实施方式中,本文所述的mTOR抑制剂纳米颗粒组合物包括纳米颗粒,该纳米颗粒包括与白蛋白(如人白蛋白或人血清白蛋白)缔合的(例如包被的)mTOR抑制剂(如莫司药物,例如西罗莫司或其衍生物)。在一些实施方式中,本文所述的mTOR抑制剂纳米颗粒组合物包括纳米颗粒,该纳米颗粒包括与白蛋白(如人白蛋白或人血清白蛋白)缔合的(例如包被的)mTOR抑制剂(如莫司药物,例如西罗莫司或其衍生物),其中纳米颗粒的平均直径不大于约200nm。在一些实施方式中,本文所述的mTOR抑制剂纳米颗粒组合物包括纳米颗粒,该纳米颗粒包括与白蛋白(如人白蛋白或人血清白蛋白)缔合的(例如包被的)mTOR抑制剂(如莫司药物,例如西罗劳斯或其衍生物),其中该纳米颗粒的平均直径不大于约150nm。在一些实施方式中,本文所述的TOR抑制剂纳米颗粒组合物包括纳米颗粒,该纳米颗粒包括与白蛋白(如人白蛋白或人血清白蛋白)缔合的(例如包被的)mTOR抑制剂(如莫司药物,例如西罗莫司或其衍生物),其中纳米颗粒的平均直径为约10nm至约150nm。在一些实施方式中,本文所述的mTOR抑制剂纳米颗粒组合物包括纳米颗粒,该纳米颗粒包括与白蛋白(如人白蛋白或人血清白蛋白)缔合的(例如包被的)mTOR抑制剂(如莫司药物,例如西罗莫司或其衍生物),其中纳米颗粒的平均直径为约40nm至约120nm。在一些实施方式中,本文所述的mTOR抑制剂纳米颗粒组合物包括纳米颗粒,该纳米颗粒包括与人白蛋白(如人血清白蛋白)缔合的(例如包被的)西罗莫司,其中纳米颗粒具有不大于约150nm(例如约100-120nm,例如100nm)的平均直径。在一些实施方式中,本文所述的mTOR抑制剂纳米颗粒组合物包括纳米颗粒,该纳米颗粒包括与人白蛋白(如人血清白蛋白)缔合的(例如包被的)西罗莫司,其中纳米颗粒的平均直径为约10nm至约150nm。在一些实施方式中,本文所述的mTOR抑制剂纳米颗粒组合物包括纳米颗粒,该纳米颗粒包括与人白蛋白(如人血清白蛋白)缔合的(例如包被的)西罗莫司,其中所述纳米颗粒的平均直径为约40nm至约120nm。
在一些实施方式中,本文所述的mTOR抑制剂纳米颗粒组合物包括纳米颗粒,该纳米颗粒包括与白蛋白(如人白蛋白或人血清白蛋白)缔合的(例如包被的)mTOR抑制剂(如莫司药物,例如西罗莫司或其衍生物),其中在组合物中白蛋白和mTOR抑制剂的重量比不大于约9:1(如约9:1或约8:1)。在一些实施方式中,本文所述的mTOR抑制剂纳米颗粒组合物包括纳米颗粒,该纳米颗粒包括与白蛋白(如人白蛋白或人血清白蛋白)缔合的(例如包被的)mTOR抑制剂(如莫司药物,例如西罗莫司或其衍生物),其中纳米颗粒的平均直径不大于约200nm,其中组合物中白蛋白和mTOR抑制剂的重量比不大于约9:1(如约9:1或约8:1)。在一些实施方式中,本文所述的mTOR抑制剂纳米颗粒组合物包括纳米颗粒,该纳米颗粒包括与白蛋白(如人白蛋白或人血清白蛋白)缔合的(例如包被的)mTOR抑制剂(如莫司药物,例如西罗莫司或其衍生物),其中纳米颗粒的平均直径不大于约150nm,其中组合物中白蛋白和mTOR抑制剂的重量比不大于约9:1(如约9:1或约8:1)。在一些实施方式中,本文所述的mTOR抑制剂纳米颗粒组合物包括纳米颗粒,该纳米颗粒包括与白蛋白(如人白蛋白或人血清白蛋白)缔合的(例如包被的)mTOR抑制剂(如莫司药物,例如西罗莫司或其衍生物),其中纳米颗粒具有约150nm的平均直径,其中组合物中白蛋白和mTOR抑制剂的重量比不大于约9:1(如约9:1或约8:1)。在一些实施方式中,本文所述的mTOR抑制剂纳米颗粒组合物包括纳米颗粒,该纳米颗粒包括与人白蛋白(如人血清白蛋白)缔合的(例如包被的)的西罗莫司,其中纳米颗粒具有不大于约150nm(例如约100-120nm,例如100nm)的平均直径,其中组合物中白蛋白和西罗莫司的重量比为约9:1或约8:1。在一些实施方式中,纳米颗粒的平均或均值直径为约10nm至约150nm。在一些实施方式中,纳米颗粒的平均或均值直径为约40nm至约120nm。
在一些实施方式中,本文所述的mTOR抑制剂纳米颗粒组合物包括纳米颗粒,该纳米颗粒包括被白蛋白(例如人白蛋白或人血清白蛋白)稳定化的mTOR抑制剂(例如莫司药物,例如西罗莫司或其衍生物)。在一些实施方式中,本文所述的mTOR抑制剂纳米颗粒组合物包括纳米颗粒,该纳米颗粒包括被白蛋白(例如人白蛋白或人血清白蛋白)稳定化的mTOR抑制剂(例如莫司药物,例如西罗莫司或其衍生物),其中纳米颗粒具有不大于约200nm的平均直径。在一些实施方式中,本文所述的mTOR抑制剂纳米颗粒组合物包括纳米颗粒,该纳米颗粒包括被白蛋白(例如人白蛋白或人血清白蛋白)稳定化的mTOR抑制剂(例如莫司药物,例如西罗莫司或其衍生物),其中纳米颗粒具有不大于约150nm的平均直径。在一些实施方式中,本文所述的mTOR抑制剂纳米颗粒组合物包括纳米颗粒,该纳米颗粒包括被白蛋白(例如人白蛋白或人血清白蛋白)稳定化的mTOR抑制剂(例如莫司药物,例如西罗莫司或其衍生物),其中纳米颗粒具有不大于约150nm(例如约100-120nm,例如约100nm)的平均直径。在一些实施方式中,本文所述的mTOR抑制剂纳米颗粒组合物包括纳米颗粒,该纳米颗粒包括被人白蛋白(例如人血清白蛋白)稳定化的西罗莫司,其中纳米颗粒具有不大于约150nm(例如约100-120nm,例如约100nm)的平均直径。在一些实施方式中,纳米颗粒的平均或均值直径为约10nm至约150nm。在一些实施方式中,纳米颗粒的平均或均值直径为约40nm至约120nm。
在一些实施方式中,本文所述的mTOR抑制剂纳米颗粒组合物包括纳米颗粒,该纳米颗粒包括被白蛋白(例如人白蛋白或人血清白蛋白)稳定化的mTOR抑制剂(例如莫司药物,例如西罗莫司或其衍生物),其中组合物中白蛋白和mTOR抑制剂的重量比不大于约9:1(例如约9:1或约8:1)。在一些实施方式中,本文所述的mTOR抑制剂纳米颗粒组合物包括纳米颗粒,该纳米颗粒包括被白蛋白(例如人白蛋白或人血清白蛋白)稳定化的mTOR抑制剂(例如莫司药物,例如西罗莫司或其衍生物),其中纳米颗粒的平均直径不大于约200nm,其中组合物中白蛋白和mTOR抑制剂的重量比不大于约9:1(例如约9:1或约8:1)。在一些实施方式中,本文所述的mTOR抑制剂纳米颗粒组合物包括纳米颗粒,该纳米颗粒包括被白蛋白(例如人白蛋白或人血清白蛋白)稳定化的mTOR抑制剂(例如莫司药物,例如西罗莫司或其衍生物),其中纳米颗粒的平均直径不大于约150nm,其中组合物中白蛋白和mTOR抑制剂的重量比不大于约9:1(例如约9:1或约8:1)。在一些实施方式中,本文所述的mTOR抑制剂纳米颗粒组合物包括纳米颗粒,该纳米颗粒包括被白蛋白(例如人白蛋白或人血清白蛋白)稳定化的mTOR抑制剂(例如莫司药物,例如西罗莫司或其衍生物),其中纳米颗粒的平均直径为约150nm,其中组合物中白蛋白和mTOR抑制剂的重量比不大于约9:1(例如约9:1或约8:1)。在一些实施方式中,本文所述的mTOR抑制剂纳米颗粒组合物包括纳米颗粒,该纳米颗粒包括被人白蛋白(例如人血清白蛋白)稳定化的西罗莫司,其中纳米颗粒的平均直径不大于约150nm(例如约100-120nm,例如约100nm),其中组合物中白蛋白和西罗莫司的重量比为约9:1或约8:1。在一些实施方式中,纳米颗粒的平均或均值直径为约10nm至约150nm。在一些实施方式中,纳米颗粒的平均或均值直径为约40nm至约120nm。
在一些实施方式中,mTOR抑制剂纳米颗粒组合物包含nab-西罗莫司。在一些实施方式中,mTOR抑制剂纳米颗粒组合物是nab-西罗莫司。Nab-西罗莫司是被人白蛋白USP稳定化的西罗莫司的制剂,其可被分散在可直接注射的生理溶液中。人白蛋白与西罗莫司的重量比为约8:1至约9:1。当分散在合适的水性介质中(如0.9%氯化钠注射液或5%右旋糖注射液)时,nab-西罗莫司形成西罗莫司的稳定胶体悬浮液。胶体悬浮液中的纳米颗粒的平均粒度为约100纳米。由于HSA易溶于水,nab-西罗莫司可以在稀(0.1mg/ml西罗莫司或其衍生物)至浓(20mg/ml西罗莫司或其衍生物)的宽范围浓度下重构,该浓度范围包括例如约2mg/ml至约8mg/ml,或约5mg/ml。
制备纳米颗粒组合物的方法是本领域已知的。例如,可以在高剪切力(例如声波处理、高压均质化等)的条件下制备包含mTOR抑制剂(如莫司药物,例如西罗莫司或其衍生物)和白蛋白(如人血清白蛋白或人白蛋白)的纳米颗粒。这些方法被公开于例如美国专利号5,916,596;6,506,405;6,749,868、6,537,579、7,820,788和8,911,786,以及美国专利公开号2007/0082838、2006/0263434和PCT申请WO08/137148。
简而言之,将mTOR抑制剂(如莫司药物,例如西罗莫司或其衍生物)溶解在有机溶剂中,并且可以将该溶液加入白蛋白溶液。将混合物进行高压均质化。然后可以通过蒸发除去有机溶剂。所得分散液可以进一步被冻干。合适的有机溶剂包括,例如,酮、酯、醚、氯化溶剂和本领域已知的其他溶剂。例如,有机溶剂可以是二氯甲烷或氯仿/乙醇(例如比例为1:9、1:8、1:7、1:6、1:5、1:4、1:3、1:2、1:1、2:1、3:1、4:1、5:1、6:1、7:1、8:1或9:1)。
A.mTOR抑制剂
在一些实施方式中,本文所述的方法包括施用mTOR抑制剂的纳米颗粒组合物。本文所用的“mTOR抑制剂”是指mTOR的抑制剂。mTOR是磷脂酰肌醇3激酶(PI3K)/Akt(蛋白激酶B)途径下游的丝氨酸/苏氨酸特异性蛋白激酶,是细胞存活、增殖、应激和代谢的关键调控因子。已经在许多人癌症中发现mTOR通路失调,并且mTOR抑制对肿瘤进展产生实质性的抑制作用。
雷帕霉素的哺乳动物靶标(mTOR)(也称为雷帕霉素或FK506结合蛋白12-雷帕霉素相关蛋白1(FRAP1)的机械靶标)是一种非典型的丝氨酸/苏氨酸蛋白激酶,其以两种不同的复合物存在:mTOR复合物1(mTORC1)和mTOR复合物2(mTORC2)。mTORC1由mTOR、mTOR的调控-相关蛋白(Raptor)、具有SEC 13蛋白8的哺乳动物致死因子(MLST8)、PRAS40和DEPTOR构成(Kim et al.(2002).Cell 110:163–75;Fang et al.(2001).Science 294(5548):1942-5)。mTORC1集成了四个主要信号输入:营养素(如氨基酸和磷脂酸)、生长因子(胰岛素)、能量和应激(如缺氧和DNA损伤)。氨基酸可利用性通过涉及Rag和Ragulator(LAMTOR1-3)生长因子的途径被信号传导至mTORC1,并且激素(例如胰岛素)通过Akt被信号传导至mTORC1,Akt使TSC2失活以防止mTORC1的抑制。可选地,低ATP水平导致TSC2的AMPK依赖性激活和raptor的磷酸化,以减少mTORC1信号传导蛋白。
活性mTORC1具有多个下游生物学效应,包括mRNA翻译——通过下游靶标(4E-BP1和p70 S6激酶)的磷酸化、自噬的抑制(AtgT3、TJLK1)、核糖体的生物发生以及转录的激活——导致线粒体代谢或脂肪形成。因此,mTORC1活性在条件有利时促进细胞生长,或在应激期间或条件不利时促进分解代谢过程。
mTORC2由mTOR、mTOR的雷帕霉素不敏感伴侣(RICTOR)、GβL和哺乳动物应激激活的蛋白激酶相互作用蛋白1(mSIN1)构成。与多种上游信号和细胞功能已被限定的mTORC1(见上文)相比,对mTORC2生物学的了解相对较少。mTORC2通过其刺激F-肌动蛋白应激纤维、桩蛋白、RhoA、Rac1、Cdc42和蛋白激酶Cα(PKCα)来调控细胞骨架组织。已经观察到,敲低mTORC2组分影响肌动蛋白聚合并扰乱细胞形态(Jacinto et al.(2004).Nat.CellBiol.6,1122-1128;Sarbassov et al.(2004).Curr.Biol.14,1296-1302)。这表明mTORC2通过促进蛋白激酶Cα(PKCα)磷酸化、桩蛋白的磷酸化及其重新定位至粘着斑、以及RhoA和Rac1的GTP负载,来控制肌动蛋白细胞骨架。mTORC2调控这些过程的分子机制尚未确定。
在一些实施方式中,mTOR抑制剂(如莫司药物,例如西罗莫司或其衍生物)是mTORC1的抑制剂。在一些实施方式中,mTOR抑制剂(如莫司药物,例如西罗莫司或其衍生物)是mTORC2的抑制剂。在一些实施方式中,mTOR抑制剂(如莫司药物,例如西罗莫司或其衍生物)是mTORC1和mTORC2的抑制剂。
在一些实施方式中,mTOR抑制剂是莫司药物,其包括西罗莫司及其类似物。莫司药物的实例包括但不限于坦罗莫司(temsirolimus)(CCI-779)、依维莫司(everolimus)(RAD001)、地磷莫司(ridaforolimus)(AP-23573)、地福莫司(deforolimus)(MK-8669)、佐他莫司(zotarolimus)(ABT-578)、吡美莫司(pimecrolimus)和他克莫司(tacrolimus)(FK-506)。在一些实施方式中,莫司药物选自坦罗莫司(CCI-779)、依维莫司(RAD001)、地磷莫司(AP-23573)、地福莫司(MK-8669)、佐他莫司(ABT-578)、吡美莫司和他克莫司(FK-506)。在一些实施方式中,mTOR抑制剂是mTOR激酶抑制剂,如CC-115或CC-223。
在一些实施方式中,mTOR抑制剂是西罗莫司。西罗莫司是与FKBP-12复合并通过结合mTORC1抑制mTOR途径的大环内酯类抗生素。
在一些实施方式中,mTOR抑制剂选自西罗莫司(雷帕霉素)、BEZ235(NVP-BEZ235)、依维莫司(也称为RAD001、Zortress、Certican和Afimtor)、AZD8055、坦罗莫司(也称为CCI-779和Torisel)、CC-115、CC-223、PI-103、Ku-0063794、INK 128、AZD2014、NVP-BGT226、PF-04691502、CH5132799、GDC-0980(RG7422)、Torin 1、WAY-600、WYE-125132、WYE-687、GSK2126458、PF-05212384(PKI-587)、PP-121、OSI-027、Palomid 529、PP242、XL765、GSK1059615、WYE-354和地磷莫司(也称为地福莫司)。
BEZ235(NVP-BEZ235)是咪唑喹啉(imidazoquilonine)衍生物,其是mTORC1催化抑制剂(Roper J,et al.PLoS One,2011,6(9),e25132)。依维莫司是西罗莫司的40-O-(2-羟基乙基)衍生物,并与亲环蛋白FKBP-12结合,并且也复合mTORC1。AZD8055是抑制mTORC1(p70S6K和4E-BP1)磷酸化的小分子。坦罗莫司是与FK506结合蛋白形成复合物并且当其居于mTORC1复合物中时阻止mTOR激活的小分子。PI-103是抑制雷帕霉素敏感性(mTORC1)复合物激活的小分子(Knight et al.(2006)Cell.125:733-47)。KU-0063794是以剂量依赖性和时间依赖性方式抑制mTORC1的Ser2448处磷酸化的小分子。INK 128、AZD2014、NVP-BGT226、CH5132799、WYE-687各自均是mTORC1的小分子抑制剂。PF-04691502抑制mTORC1活性。GDC-0980是抑制I类PI3激酶和TORC1的口服生物可利用小分子。Torin 1是mTOR的有效小分子抑制剂。WAY-600是有效ATP竞争性和选择性mTOR抑制剂。WYE-125132是mTORC1的ATP竞争性小分子抑制剂。GSK2126458是mTORC1的抑制剂。PKI-587是PI3Kα、PI3Kγ和mTOR的高效双重抑制剂。PP-121是PDGFR、Hck、mTOR、VEGFR2、Src和Abl的多靶标抑制剂。OSI-027是mTORC1和mTORC2的选择性且有效的双重抑制剂,其中IC50分别为22nM和65nM。Palomid 529是mTORC1的小分子抑制剂,其对ABCB1/ABCG2缺乏亲和力,并且具有良好的脑渗透性(Lin et al.(2013)Int J Cancer DOI:10.1002/ijc.28126(印刷前发布电子版)。PP242是选择性mTOR抑制剂。XL765是mTOR、p110α、p110β、p110γ和p110δ的mTOR/PI3k双重抑制剂。GSK1059615是PI3Kα、PI3Kβ、PI3Kδ、PI3Kγ和mTOR的新型双重抑制剂。WYE-354抑制HEK293细胞(0.2μM–5μM)和HUVEC细胞(10nM-1μM)中的mTORC1。WYE-354是mTOR的有效的特异性的和ATP竞争性的抑制剂。地福莫司(地磷莫司,AP23573,MK-8669)是选择性mTOR抑制剂。
B.在mTOR抑制剂纳米颗粒组合物中的其他组分
本文所述的纳米颗粒可以存在于包含其他试剂、赋形剂或稳定剂的组合物中。例如,为了通过增加纳米颗粒的负ζ电位来增加稳定性,可以添加某些带负电荷的组分。这种带负电荷的组分包括但不限于胆汁酸的胆汁盐,该胆汁酸由下列组成:甘氨胆酸、胆酸、鹅去氧胆酸、牛磺胆酸、甘氨鹅去氧胆酸、牛磺鹅去氧胆酸、石胆酸、熊去氧胆酸、脱氢胆酸等;磷脂,包括基于卵磷脂(卵黄)的磷脂,其包括以下磷脂酰胆碱:棕榈酰油酰磷脂酰胆碱、棕榈酰亚油酰磷脂酰胆碱、硬脂酰亚油酰磷脂酰胆碱、硬脂酰油酰磷脂酰胆碱、硬脂酰花生酰磷脂酰胆碱和二棕榈酰磷脂酰胆碱。其他磷脂包括L-α-二肉豆蔻酰磷脂酰胆碱(DMPC)、二油酰磷脂酰胆碱(DOPC)、二硬脂酰磷脂酰胆碱(DSPC)、氢化大豆磷脂酰胆碱(HSPC)和其他相关化合物。带负电荷的表面活性剂或乳化剂也适合作为添加剂,例如胆甾醇硫酸钠等。
在一些实施方式中,该组合物适于施用至人。在一些实施方式中,该组合物适于施用至哺乳动物,如在兽医环境下的家养宠物和农业动物。mTOR抑制剂纳米颗粒组合物(如西罗莫司/白蛋白纳米颗粒组合物)有多种合适的制剂(例如参见美国专利号5,916,596和6,096,331)。以下制剂和方法仅是示例性的,而不以任何方式是限制性的。适于口服施用的制剂可以由下列组成:(a)液体溶液,如溶解于稀释剂(如水、盐水或橙汁)中的有效量的化合物;(b)胶囊、小袋或片剂,各自包含预定量的作为固体或颗粒的活性成分,(c)在适当液体中的悬浮液,和(d)适当的乳液。片剂形式可以包括下列的一种或多种:乳糖、甘露醇、玉米淀粉、马铃薯淀粉、微晶纤维素、阿拉伯胶、明胶、胶体二氧化硅、交联羧甲基纤维素钠、滑石、硬脂酸镁、硬脂酸、以及其他赋形剂、着色剂、稀释剂、缓冲剂、润湿剂、防腐剂、调味剂和药理上相容的赋形剂。糖锭形式(lozenge forms)可以在调味剂(通常蔗糖和阿拉伯树胶或西黄蓍胶)中包含活性成分,以及锭剂(pastilles)包含活性成分——其在惰性基质中,如明胶和甘油、或蔗糖和阿拉伯胶、乳液、凝胶等,除活性成分外其还包含本领域已知的这类赋形剂。
合适的载体、赋形剂和稀释剂的实例包括但不限于乳糖、右旋糖、蔗糖、山梨糖醇、甘露醇、淀粉、阿拉伯胶、磷酸钙、藻酸盐、西黄蓍胶、明胶、硅酸钙、微晶纤维素、聚乙烯吡咯烷酮、纤维素、水、盐水溶液、糖浆、甲基纤维素、甲基和丙基羟基苯甲酸酯、滑石、硬脂酸镁和矿物油。制剂可以另外包括润滑剂、湿润剂、乳化剂和悬浮剂、防腐剂、甜味剂或调味剂。
适用于肠胃外施用的制剂包括水性和非水性等渗无菌注射溶液,其可以包含抗氧化剂、缓冲剂、抑菌剂和使制剂与目标接受者的血液相容的溶质;以及水性和非水性无菌悬浮液,其可以包括悬浮剂、增溶剂、增稠剂、稳定剂和防腐剂。制剂可以在单剂量或多剂量密封容器如安瓿瓶和小瓶中给出,并且可以在冷冻干燥(冻干)条件下储存,仅需在使用前刻添加无菌液体赋形剂(例如水)以进行注射。即时注射溶液和悬浮液可以由前述种类的无菌粉末、颗粒和片剂制备。可注射制剂是优选的。
在一些实施方式中,组合物被配制以具有约4.5至约9.0的pH范围,包括例如约5.0至约8.0、约6.5至约7.5和约6.5至约7.0中任一的pH范围。在一些实施方式中,将组合物的pH配制成不小于约6,包括例如不小于约6.5、7或8中的任一(如,约8)。通过添加合适的张力改性剂,如甘油,也可以使组合物与血液等渗。
第二药剂
本文所述的第二药剂是对治疗CNS障碍有用的任何药物或疗法。
在一些实施方式中,第二药剂是抗癫痫药。
在一些实施方式中,第二药剂能够穿透血脑屏障(BBB)。
在一些实施方式中,第二药剂是血管生成抑制剂(例如抗VEGF抗体)。在一些实施方式中,第二药剂是蛋白酶体抑制剂(例如马里佐米)。在一些实施方式中,第二药剂是烷基化剂(例如替莫唑胺、洛莫司汀)。在一些实施方式中,第二药剂是VEGFR抑制剂。
A.抗VEGF抗体
血管生成是血管内皮细胞增殖、修整和重组以由预先存在的血管网络形成新血管的重要细胞事件。血管生成还涉及多种疾病(障碍)的发病机理,其包括但不限于肿瘤、增生性视网膜病、年龄相关性黄斑变性、类风湿关节炎(RA)和银屑病。血管生成对于大多数原发性肿瘤的生长及其随后的转移至关重要。肿瘤可以通过简单扩散达到1-2mm的尺寸来吸收足够的营养和氧气,这时其进一步生长需要完善血管供应。认为该过程涉及募集相邻宿主的成熟脉管系统以开始萌生新血管毛细血管,其朝向肿瘤物生长并随后渗入肿瘤物。另外,肿瘤血管生成涉及从骨髓募集循环内皮前体细胞以促进新血管形成。Kerbel(2000)Carcinogenesis 21:505-515;Lynden et al.(2001)Nat.Med.7:1194-1201。
血管内皮细胞生长因子(VEGF),也称为VEGF-A或血管通透因子(VPF),是正常和异常血管生成的关键调控因子。Ferrara and Davis-Smyth(1997)Endocrine Rev.18:4-25;Ferrara(1999)J.Mol.Med.77:527-543。
术语“VEGF”和“VEGF-A”可互换使用,指代165个氨基酸的血管内皮细胞生长因子和相关的121、189和206个氨基酸的血管内皮细胞生长因子,如Leung et al.Science,246:1306(1989),and Houck et al.Mol.Endocrin.,5:1806(1991)所述,以及其天然存在的等位基因和加工形式。在一些实施方式中,术语“VEGF”还用于指包含165个氨基酸的人血管内皮细胞生长因子的氨基酸8至109或1至109的多肽的截短形式。“截短的”天然VEGF的氨基酸位置如天然VEGF序列所示编号。例如,截短的天然VEGF中的氨基酸位置17(甲硫氨酸)在天然VEGF中也是位置17(甲硫氨酸)。截短的天然VEGF对KDR和Flt-1受体的结合亲和力与天然VEGF相当。
在一些实施方式中,本文所述的方法包括施用抗VEGF抗体。“抗VEGF抗体”是以足够的亲和力和特异性结合VEGF的抗体。在一些实施方式中,抗VEGF抗体在靶向和干扰涉及VEGF活性的疾病或状况中用作治疗剂。抗VEGF抗体通常不会与其他VEGF同源物(如VEGF-B或VEGF-C)结合,也不会与其他生长因子(例如PlGF、PDGF或bFGF)结合。在一些实施方式中,抗VEGF抗体是单克隆抗体。在一些实施方式中,抗VEGF抗体与由杂交瘤ATCC HB 10709产生的单克隆抗VEGF抗体A4.6.1结合相同的表位。在一些实施方式中,抗VEGF抗体是重组抗体。在一些实施方式中,抗VEGF抗体是人源化抗体。在一些实施方式中,抗VEGF是重组人源化抗体。在一些实施方式中,重组人源化抗VEGF抗体是按照Presta et al.(1997)CancerRes.57:4593-4599生成的抗体,其包括但不限于被称为贝伐单抗(BV;Avastin
在一些实施方式中,抗VEGF抗体是抗VEGF抗体的片段(例如,Fab片段)。在一些实施方式中,抗VEGF抗体是雷珠单抗(Ranibizumab)。
在一些实施方式中,抗VEGF抗体能够穿透血脑屏障(BBB)。
B.蛋白酶体抑制剂
术语“蛋白酶体”是指26S蛋白酶体,如Coux,O.,Tanaka,K.and Goldberg,A.,Ann.Rev.Biochem.65(1996)801-847;Voges,D.,Annu Rev Biochem.68(1999)1015-68或Kisselev,A.L.,et al.,Chem Biol Vol.8(8)(2001)739-758所描述的。
如本文所用,术语“蛋白酶体抑制剂”是指抑制26S蛋白酶体活性的试剂。这样的蛋白酶体抑制剂尤其包括例如肽衍生物,例如肽醛(例如MG132、MGl 15、CEP-1615、PSI或免疫蛋白酶体特异性抑制剂IPSI-OOl(Cbz-LnL-CHO=N-苄氧羰基-亮氨酰-正亮氨醛(norleucinal),参见US 2006/0241056)、肽硼酸酯(例如硼替佐米(PS-341)或DFLB)、肽环氧酮(例如环氧酶素、dihydroeponemycin或环氧霉素衍生物卡非佐米(PR-171))、或肽乙烯基砜(例如NLVS)和非肽衍生物(例如盐孢菌酰胺A(salinosporamide A)(NPI-0052)、盐孢菌酰胺A衍生物、乳胞素或乳胞素衍生物(例如裂-乳胞素-L-内酯(clasto-lactacystin-L-lactone)(omuralide)或PS-519))。例如Kisselev,A.L.,et al.,Chem Biol Vol.8(8)(2001)739-758,WO 2004/004749和Joazeiro,C,et al.,Cancer Res.66(16)(2006)7840-7842),Kanagasabaphy,P.,et al.,Curr Opin Investig Drugs 8(2007)447-51,Adams,J.,Nat Rev Cancer 4(2004)349-360和US 2006/0241056中描述了不同类型和结构的所述蛋白酶体抑制剂。
本文所述的蛋白酶体抑制剂包括任何已知的蛋白酶体抑制剂,以及可以常规测试其抑制蛋白酶体活性的能力的其他分子。鉴定此类抑制剂的多种策略在本领域中举例说明。例如,可以通常对包含来自植物或更简单生物的提取物的小分子文库针对其抑制特定蛋白酶类型的能力进行筛选。可选地,可以使用例如具体设计为与蛋白酶体组分的活性位点相互作用的肽或拟肽化合物来应用合理的设计方法(参见例如Siman,et al.,WO91/13904;Powers,et al.,in Proteinase Inhibitors,Barrett,et al.,(eds.),Elsevier,pp.55-152(1986))。抑制剂可以是催化过渡态的稳定类似物,例如Z-Gly-Gly-Leu-H,其抑制蛋白酶体的胰凝乳蛋白酶样活性(Orlowski,Biochemistry 29:10289(1990);也参见Kennedy and Schultz,Biochem.18:349(1979))。
另外,本申请旨在涵盖文献中报道的多种天然和化学蛋白酶体抑制剂或其类似物,其包括含有α-二酮或α-酮酯的肽、肽氯甲基酮、异香豆素、肽磺酰氟、肽基硼酸酯、肽环氧化物和肽基重氮甲烷。Angelastro,et al.,J.Med.Chem.33:11(1990);Bey,et al.,EPO363,284;Bey,et al.,EPO 363,284;Bey,et al.,EPO 364,344;Grubb,et al.,WO 88/10266;Higuchi,et al.,EPO 393,457;Ewoldt,et al.,Mol.Immunol.29(6):713(1992);Hernandez,et al.,J.Med.Chem.35(6):1121(1992);Vlasak,et al.,J.Virol.63(5):2056(1989);Hudig,et al.,J.Immunol.147(4):1360(1991);Odakc,et al.,Biochem.30(8):2217(1991);Vijayalakshmi,et al.,Biochem.30(8):2175(1991);Kam,et al.,Thrombosis and Haemostasis 64(1):133(1990);Powers,et al.,J.Cell.Biochem.39(1):33(1989);Powers,et al.,Proteinase inhibitors,Barrett et al.,Eds.,Elsevier,pp.55-152(1986);Powers,et al.,Biochem 29(12):3108(1990);Oweida,etal.,Thrombosis Res.58(2):391(1990);Hudig,et al.,Mol.Immunol.26(8):793(1989);Orlowski,et al.,Arch.Biochem.and Biophys.269(1):125(1989);Zunino,et al.,Biochem.et Biophys.Acta 967(3):331(1988);Kam,et al.,Biochem.27(7):2547(1988);Parkes,et al.,Biochem.J.230:509(1985);Green,et al.,J.Biol.Chem.256:1923(1981);Angliker,et al.,Biochem.J.241:871(1987);Puri,et al.,Arch.Biochem.Biophys.27:346(1989);Hanada,et al.,Proteinase inhibitors:Medicaland Biological Aspects,Katunuma,et al.,Eds.,Springer-Verlag pp.25-36(1983);Kajiwara,et al.,Biochem.Int.15:935(1987);Rao,et al.,Thromb.Res.47:635(1987);Tsujinaka,et al.,Biochem.Biophys.Res.Commun.153:1201(1988))。
本申请也旨在涵盖由Vinitsky et al.(Biochem.31:9421(1992),也参见Orlowski,et al.,Biochem.32:1563(1993))测试的在P.sub.1位置含有疏水残基的肽醛和肽α-酮酯作为蛋白酶体的胰凝乳蛋白酶样活性的潜在抑制剂。文献中描述的其他三肽包括Ac-Leu-Leu-Leu-H、Ac-Leu-Leu-Met-OR、Ac-Leu-Leu-Nle-OR、Ac-Leu-Leu-Leu-OR、Ac-Leu-Leu-Arg-H、Z-Leu-Leu-Leu-H、Z-Arg-Leu-Phe-H和Z-Arg-Ile-Phe-H,其中OR以及之前氨基酸残基的羰基一起代表酯基,并且旨在被本申请涵盖。
本申请也旨在涵盖Siman,et al.(WO 01/13904)公开的胰凝乳蛋白酶样蛋白酶和其抑制剂。这些抑制剂具有式R-A4-A3-A2-Y,其中R是是氢或N端阻断基团;A4是共价键、氨基酸或肽;A3是共价键、D-氨基酸、苯丙氨酸、酪氨酸、缬氨酸或缬氨酸的保守氨基酸取代;A2为疏水性氨基酸或赖氨酸或其保守氨基酸取代,或当A4包括至少两个氨基酸时,A2为任何氨基酸;Y是与所述蛋白酶的活性位点反应的基团。本申请也旨在涵盖Powers(WO92/12140)公开的肽酮酰胺、酮酸和酮酸酯及其在抑制丝氨酸蛋白酶和半胱氨酸蛋白酶中的用途,和Bartus,et al.(WO 92/1850)公开的钙蛋白酶抑制剂化合物和包括其的药物组合物的用途。
还考虑将以下化合物或其类似物用作本申请中的蛋白酶体抑制剂:钙蛋白酶抑制剂I,MG101,钙蛋白酶抑制剂II,环氧酶素,组分Ⅰ(Fraction I)(FrI,Hela),组分II(FII),裂-乳胞素β-内酯,乳胞素,MG-115,MG-132,NEDD8的抗血清,PA28激活剂,20S蛋白酶体,蛋白酶体20Sα-1型亚基的多克隆抗体,蛋白酶体26S亚基S10B的多克隆抗体,蛋白酶体26S亚基S2的多克隆抗体,蛋白酶体26S亚基S4的多克隆抗体,蛋白酶体26S亚基S5A的多克隆抗体,蛋白酶体26S亚基S6的多克隆抗体,蛋白酶体26S亚基S6'的多克隆抗体,蛋白酶体26S亚基S7的多克隆抗体,蛋白酶体26S亚基S8的多克隆抗体,蛋白酶体激活剂PA28α的多克隆抗体,蛋白酶体激活剂PA28γ的多克隆抗体,蛋白酶体激活剂PA700亚基10B的多克隆抗体,26S蛋白酶体组分,蛋白酶体抑制剂I,蛋白酶体抑制剂II,蛋白酶体底物I(荧光的),蛋白酶体底物II(荧光的),蛋白酶体底物III(荧光的),蛋白酶体底物IV(荧光的),S-100组分,SUMO-1/Sentrin-1(1-101),SUMO-1/Sentrin-1(1-97),SUMO-1/Sentrin-1的抗血清、Ubc10、Ubc5b、Ubc5c、Ubc6、Ubc7,Ubc9的抗血清、Ubc9、UbCH2/E2-14K、UbCH3/Cdc34、UbCH5a,泛素活化酶(E1),泛素活化酶(E1),泛素醛,泛素结合酶组分,泛素C末端水解酶,泛素K48R,甲基化的泛素,GST-泛素,(His)6泛素,泛素-AMC,泛素-琼脂糖。
在一些实施方式中,蛋白酶体抑制剂是可逆的蛋白酶体抑制剂。在一些实施方式中,蛋白酶体抑制剂是不可逆的蛋白酶体抑制剂。
在一些实施方式中,蛋白酶体抑制剂选自硼替佐米、地兰佐米、依沙佐米、卡非佐米、奥泊佐米(oprozomib)、MG132和马里佐米。在一些实施方式中,蛋白酶体抑制剂选自肽醛(优选N-苄氧羰基-亮氨酰-正亮氨醛(IPSI-001))、肽硼酸酯(优选硼替佐米(PS-341))、肽环氧酮(优选环氧酶素衍生物卡非佐米(PR-171))或盐孢菌酰胺A(NPI-0052,即马里佐米)。
在一些实施方式中,蛋白酶体抑制剂是马里佐米(MRZ)。
在一些实施方式中,蛋白酶体抑制剂具有约10μM、7.5μM、5μM、2.5μM、1μM或更小的抗蛋白酶体抑制剂活性的IC50。在一些实施方式中,蛋白酶体抑制剂具有约500nM、250nM、100nM、80nM、60nM、40nM、20nM、10nM或更小的抗蛋白酶体抑制剂活性的IC50。
在一些实施方式中,蛋白酶体抑制剂能够穿透血脑屏障(BBB)。
C.烷基化剂
在一些实施方式中,第二药剂是烷基化剂。在一些实施方式中,烷基化剂是烷基化抗肿瘤药剂。
示例性的烷基化剂包括但不限于环磷酰胺(Cytoxan)、氮芥、苯丁酸氮芥、米尔法兰、卡莫司汀(BCNU)、塞替派、白消安、烷基磺酸酯、氮丙环、氮芥类似物、雌莫司汀磷酸钠、异环磷酰胺、亚硝基脲、洛莫司汀和链脲菌素。
在一些实施方式中,烷基化剂是双官能的烷基化物(alkylator)(例如环磷酰胺、氮芥、苯丁酸氮芥、米尔法兰)。
在一些实施方式中,烷基化剂是单官能的烷基化物(例如达卡巴嗪(DTIC)、亚硝基脲、替莫唑胺)。
烷基化剂的实例包括替莫唑胺(TMZ);MeOSO2(CH2)2-lexitropsin(Me-Lex);顺二氨二氯铂II(cis-DDP);丝裂霉素生物还原烷基化剂;醌;STZ(链脲佐菌素);环磷酰胺;氮芥类家族成员,例如苯丁酸氮芥;喷司他丁(嘌呤类似物);氟达拉滨;盐酸苯达莫司汀,其是Ribomustin的活性成分(与氮芥家族共有的烷基化基团,也是抗代谢物);氯乙基化亚硝基脲(洛莫司汀、福替莫司汀、半胱胺亚硝脲);达卡巴嗪(DTIC);和丙卡巴肼。
在一些实施方式中,烷基化剂是替莫唑胺。
在一些实施方式中,烷基化剂能够穿透血脑屏障。
a)亚硝基脲化合物
在一些实施方式中,烷基化剂是亚硝基脲化合物。亚硝基脲化合物的实例包括阿拉伯吡喃糖基-N-甲基-亚硝基脲(arabinopyranosyl-N-methyl-N-nitrosourea)(aranose)、卡莫司汀(BCNU、BiCNU)、氯脲霉素、乙基亚硝基脲(ENU)、福替莫司汀、洛莫司汀(CCNU)、尼莫司汀、N-亚硝基-N-甲脲(NMU)、雷莫司汀(MCNU)、司莫司汀和链脲菌素(链脲佐菌素)。在一些实施方式中,烷基化剂选自洛莫司汀、司莫司汀和链脲佐菌素。
在一些实施方式中,烷基化剂是洛莫司汀(CCNU)。
在一些实施方式中,亚硝基脲化合物(例如洛莫司汀)能够穿透血脑屏障。
D.抗癫痫药(AED)
在一些实施方式中,第二药剂是抗癫痫药。在一些实施方式中,抗癫痫药选自乙酰唑胺(例如Diamox SR)、卡马西平(例如Carbagen SR)、氯巴占(例如Frisium、Tapclob)、氯硝西泮(例如Rivotril)、醋酸艾司利卡西平(例如Zebinix)、乙琥胺(例如Emeside、Zarotin)、加巴喷丁(例如Neurotin)、拉科酰胺(例如Vimpat)、拉莫三嗪(例如Lamictal)、左乙拉西坦(例如Desitrend、Keppra)、硝基安定、奥卡西平(例如Trileptal)、吡仑帕奈(例如Fycompa)、吡拉西坦(例如Nootropil)、苯巴比妥、苯妥英(例如Epanutin、PhenotyoinSodium Flynn)、普瑞巴林(例如Lyrica)、普里米酮、卢非酰胺(例如Inovelon)、丙戊酸钠(例如Convulex、Epilim、Epilim Chrono、Epilim Chronosphere、Episenta、Epival)、司替戊醇(例如Diacomit)、噻加宾(例如Gabitril)、托吡酯(例如Topomax)、氨己烯酸(例如Sabril)、唑尼沙胺(例如Zonegran)。
E.VEGFR抑制剂
在一些实施方式中,第二药剂是VEGFR抑制剂。在一些实施方式中,VEGFR抑制剂是酪氨酸激酶抑制剂。本申请的VEGFR抑制剂可以是小分子(例如小于约1000道尔顿)或大分子(例如超过约1000道尔顿的多肽)。示例性的VEGFR抑制剂包括但不限于贝伐单抗、帕唑帕尼、舒尼替尼、阿西替尼、帕纳替尼、卡博替尼、乐伐替尼、雷莫芦单抗、瑞格非尼、凡德他尼和阿柏西普。
基于生物标志存在的治疗方法
一方面,本申请提供了基于一种或多种mTOR相关基因中的一种或多种mTOR激活异常的状态来治疗个体CNS障碍的方法。在一些实施方式中,一种或多种生物标志指示对用mTOR抑制剂治疗的有利响应。
A.mTOR激活异常
本申请考虑了上述任何一种或多种mTOR相关基因中的mTOR激活异常,包括与参考序列的偏差(即遗传异常)、一种或多种mTOR相关基因的异常表达水平和/或异常活性水平。本申请涵盖基于本文公开的任何一种或多种mTOR激活异常的状态的治疗和方法。
本文描述的mTOR激活异常与增加的(即,超激活的(hyperactivated))mTOR信号传导水平或活性水平相关联。本申请所述的mTOR信号传导水平或mTOR活性水平可以包括响应于上述上游信号的任何一种或任何组合的mTOR信号传导,并且可以包括通过mTORC1和/或mTORC2的mTOR信号传导,这可能导致下游分子、细胞或生理过程(例如蛋白质合成、自噬、代谢、细胞周期阻滞、细胞凋亡等)的任何一种或组合的可测量变化。在一些实施方式中,mTOR激活异常使mTOR活性超激活在没有mTOR激活异常情况下的mTOR活性水平之上至少约10%、20%、30%、40%、60%、70%、80%、90%、100%、200%、500%或更多的任一。在一些实施方式中,超激活的mTOR活性仅由mTORC1介导。在一些实施方式中,超激活的mTOR活性仅由mTORC2介导。在一些实施方式中,超激活的mTOR活性由mTORC1和mTORC2两者介导。
确定mTOR活性的方法是本领域已知的。参见,例如,Brian CG et al.,CancerDiscovery,2014,4:554-563。如上所述,可以通过定量mTOR信号传导通路的任何一个下游输出(例如在分子、细胞和/或生理水平)来测量mTOR活性。例如,可以通过确定磷酸化的4EBP1(例如P-S65-4EBP1)的水平和/或磷酸化的S6K1(例如P-T389-S6K1)的水平和/或磷酸化的AKT1(例如P-S473-AKT1)的水平来测量通过mTORC1的mTOR活性。可以通过确定磷酸化的FoxO1和/或FoxO3a的水平来测量通过mTORC2的mTOR活性。磷酸化蛋白的水平可以使用本领域已知的任何方法来确定,例如使用特异性识别感兴趣的磷酸化蛋白的抗体进行的蛋白质印迹分析。
可以通过多种方法,例如通过文献检索或通过本领域已知的实验方法,来鉴定候选mTOR激活异常,所述实验方法包括但不限于基因表达概况分析实验(例如,RNA测序或微阵列实验)、定量蛋白质组学实验和基因测序实验。例如,与对照样品相比,对从具有CNS障碍的个体收集的样品进行的基因表达概况分析实验和定量蛋白质组学实验可以提供以异常水平存在的基因和基因产物(例如RNA、蛋白质和磷酸化蛋白质)的列表。在一些情况下,与对照样品相比,对从具有CNS障碍的个体收集的样品进行的基因测序(例如外显子组测序)实验可以提供遗传异常的列表。可以对从具有CNS障碍的个体人群中收集的实验数据进行统计关联研究(例如全基因组关联研究),以将在实验中鉴定的异常(例如异常水平或遗传异常)与CNS障碍相关联。在一些实施方式中,进行靶向测序实验(例如ONCOPANEL
ONCOPANEL
ONCOPANEL
候选遗传异常或异常水平是否是mTOR激活异常可以用本领域已知的方法确定。可以在细胞(如细胞系)或动物模型中进行遗传实验,以确定由实验中观察到的所有异常鉴定的CNS障碍相关异常是mTOR激活异常。例如,可以在细胞系或动物模型中克隆和改造遗传异常,并且可以测量改造的细胞系或动物模型的mTOR活性并将其与不具有该遗传异常的相应细胞系或动物模型进行比较。这种实验中mTOR活性增加可表明该遗传异常是可以在临床研究中测试的候选mTOR激活异常。
B.遗传异常
一种或多种mTOR相关基因的遗传异常可包括改变核酸(例如DNA和RNA)或蛋白质序列(即突变)或与mTOR相关基因相关联的表观遗传特征,其包括但不限于,mTOR相关基因的编码、非编码、调控、增强子、沉默子、启动子、内含子、外显子和非翻译区域。
遗传异常可以是种系突变(包括染色体重排)或体细胞突变(包括染色体重排)。在一些实施方式中,遗传异常存在于个体的所有组织中,包括正常组织和与CNS障碍相关的组织。在一些实施方式中,遗传异常仅存在于与CNS障碍相关的组织中。在一些实施方式中,遗传异常仅存在于与CNS障碍相关的组织的一部分中。
在一些实施方式中,mTOR激活异常包括mTOR相关基因的突变,包括但不限于缺失、移码、插入、插入缺失、错义突变、无义突变、点突变、单核苷酸变异(SNV)、沉默突变、剪接位点突变、剪接变体和易位。在一些实施方式中,所述突变可以是mTOR信号传导途径的负调控因子的功能丧失突变或mTOR信号传导途径的正调控因子的功能获得突变。
在一些实施方式中,遗传异常包括mTOR相关基因的拷贝数变异。通常,每个基因组的每个mTOR相关基因都有两个拷贝。在一些实施方式中,mTOR相关基因的拷贝数通过遗传异常而扩增,导致基因组中mTOR相关基因的至少约3、4、5、6、7、8或更多个拷贝中的任一。在一些实施方式中,mTOR相关基因的遗传异常导致基因组中mTOR相关基因的一个或两个拷贝的损失。在一些实施方式中,mTOR相关基因的拷贝数变异是mTOR相关基因的杂合性的损失。在一些实施方式中,mTOR相关基因的拷贝数变异是mTOR相关基因的缺失。在一些实施方式中,mTOR相关基因的拷贝数变异是由基因组的结构重排引起的,其包括染色体或其片段的缺失、重复、倒位和易位。
在一些实施方式中,遗传异常包括与mTOR相关基因相关的异常表观遗传特征,其包括但不限于DNA甲基化、羟甲基化、异常组蛋白结合、染色质重塑等。在一些实施方式中,mTOR相关基因的启动子在个体中被超甲基化,例如与对照水平(如标准化测试中临床接受的正常水平)相比超甲基化至少约10%、20%、30%、40%、50%、60%、70%、80%、90%或更多中的任一。
在一些实施方式中,mTOR激活异常是上述任一mTOR相关基因中的遗传异常(如突变或拷贝数变异)。在一些实施方式中,mTOR激活异常是选自AKT1、MTOR、PIK3CA、PIK3CG、TSC1、TSC2、RHEB、STK11、NF1、NF2、PTEN、TP53、FGFR4和BAP1的一个或多个基因的突变或拷贝数变异。在一些实施方式中,mTOR激活异常是PTEN中的突变或拷贝数变异。在一些实施方式中,mTOR激活异常是TSC1中的突变或拷贝数变异。在一些实施方式中,mTOR激活异常是TSC2中的突变或拷贝数变异。
已经在包括遗传性癌症和散发性癌症在内的多种人类癌症中鉴定了mTOR相关基因的遗传异常。例如,TSC1/2中的种系失活突变导致结节性硬化,患有这种状况的患者会出现包括皮肤和脑错构瘤、肾血管肌脂瘤和肾细胞癌(RCC)在内的病变(Krymskaya VP etal.2011FASEB Journal 25(6):1922-1933)。PTEN错构瘤肿瘤综合征(PHTS)与失活种系PTEN突变相关,并与一系列临床表现相关,包括乳腺癌、子宫内膜癌、滤泡性甲状腺癌、错构瘤和RCC(Legendre C.et al.2003Transplantation proceedings 35(3Suppl):151S-153S)。此外,散发性肾癌还显示在PI3K-Akt-mTOR途径的几个基因中具有体细胞突变(例如,AKT1、MTOR、PIK3CA、PTEN、RHEB、TSC1、TSC2)(Power LA,1990Am.J.Hosp.Pharm.475.5:1033-1049;Badesch DB et al.2010Chest 137(2):376-387l;Kim JC&Steinberg GD,2001,The Journal of urology,165(3):745-756;McKiernan J.et al.2010,J.Urol.183(Suppl 4))。在透明细胞肾细胞癌中由Cancer Genome Atlas鉴定的前50个显著突变的基因中,汇合于mTORC1激活的基因突变的突变率为约17%(Cancer Genome Atlas ResearchNetwork.“Comprehensive molecular characterization of clear cell renal cellcarcinoma.”2013Nature 499:43-49)。已经发现mTOR相关基因的遗传异常赋予患有癌症的个体对莫司药物治疗的敏感性。参见,例如,Wagle et al.,N.Eng.J.Med.2014,371:1426-33;Iyer et al.,Science 2012,338:221;Wagle et al.Cancer Discovery 2014,4:546-553;Grabiner et al.,Cancer Discovery 2014,4:554-563;Dickson et al.IntJ.Cancer 2013,132(7):1711-1717;和Lim et al,J Clin.Oncol.33,2015suppl;abstr11010。以上参考文献描述的mTOR相关基因的遗传异常并入本文。下文描述了一些mTOR相关基因中的示例性遗传异常,并且应理解,本申请不限于本文所述的示例性遗传异常。
在一些实施方式中,mTOR激活异常包括MTOR中的遗传异常。在一些实施方式中,遗传异常包含MTOR的激活突变。在一些实施方式中,MTOR的激活突变在选自下列的MTOR的蛋白质序列中的一个或多个位置处(如约1、2、3、4、5、6或更多个位置中的任一):N269、L1357、N1421、L1433、A1459、L1460、C1483、E1519、K1771、E1799、F1888、I1973、T1977、V2006、E2014、I2017、N2206、L2209、A2210、S2215、L2216、R2217、L2220、Q2223、A2226、E2419、L2431、I2500、R2505和D2512。在一些实施方式中,MTOR的激活突变是选自下列的一种或多种错义突变(如约1、2、3、4、5、6或更多种突变中的任一):N269S、L1357F、N1421D、L1433S、A1459P、L1460P、C1483F、C1483R、C1483W、C1483Y、E1519T、K1771R、E1799K、F1888I、F1888IL、I1973F、T1977R、T1977K、V2006I、E2014K、I2017T、N2206S、L2209V、A2210P、S2215Y、S2215F、S2215P、L2216P、R2217W、L2220F、Q2223K、A2226S、E2419K、L2431P、I2500M、R2505P和D2512H。在一些实施方式中,MTOR的激活突变破坏了MTOR与RHEB的结合。在一些实施方式中,MTOR的激活突变破坏了MTOR与DEPTOR的结合。
在一些实施方式中,mTOR激活异常包括TSC1或TSC2中的遗传异常。在一些实施方式中,遗传异常包括TSCT或TSC2的杂合性的丧失。在一些实施方式中,遗传异常包括TSC1或TSC2中的功能丧失突变。在一些实施方式中,功能丧失突变为TSC1或TSC2中的移码突变或无义突变。在一些实施方式中,功能丧失突变是TSC1中的移码突变c.1907_1908del。在一些实施方式中,功能丧失突变是TSC1:c.1019+1G>A剪接变体。在一些实施方式中,功能丧失突变是TSC2中的无义突变c.1073G>A,和/或TSC1中的p.Trp103*。在一些实施方式中,功能丧失突变包括TSC1或TSC2中的错义突变。在一些实施方式中,错义突变在TSC1的位置A256和/或TSC2的位置Y719。在一些实施方式中,错义突变包含在TSC1中的A256V或在TSC2中的Y719H。
在一些实施方式中,mTOR激活异常包括RHEB中的遗传异常。在一些实施方式中,遗传异常包括RHEB中的功能丧失突变。在一些实施方式中,功能丧失突变在RHEB蛋白质序列中的选自Y35和E139的一个或多个位置处。在一些实施方式中,RHEB中的功能丧失突变选自Y35N、Y35C、Y35H和E139K。
在一些实施方式中,mTOR激活异常包括NF1中的遗传异常。在一些实施方式中,遗传异常包括NF1中的功能丧失突变。在一些实施方式中,NF1中的功能丧失突变是NF1中D1644位置的错义突变。在一些实施方式中,错义突变是NF1中的D1644A。
在一些实施方式中,mTOR激活异常包括NF2中的遗传异常。在一些实施方式中,遗传异常包括NF2中的功能丧失突变。在一些实施方式中,NF2中的功能丧失突变是无义突变。在一些实施方式中,NF2中的无义突变是c.863C>G。
在一些实施方式中,mTOR激活异常包括PTEN中的遗传异常。在一些实施方式中,遗传异常包括基因组中PTEN的缺失。在一些实施方式中,遗传异常包括PTEN中功能丧失突变。在一些实施方式中,功能丧失突变包括错义突变、无义突变或移码突变。在一些实施方式中,突变包含在PTEN中的选自K125E、K125X、E150Q、D153Y D153NK62R、Y65C、V217A和N323K的位置处。在一些实施方式中,遗传异常包括PTEN基因座的杂合性丧失(LOH)。
在一些实施方式中,mTOR激活异常包括PI3K中的遗传异常。在一些实施方式中,遗传异常包括PIK3CA或PIK3CG中的功能丧失突变。在一些实施方式中,功能丧失突变包括PIK3CA中选自E542、I844和H1047的位置处的错义突变。在一些实施方式中,功能丧失突变包括PTK3CA中选自E542K、I844V和H1047R的错义。
在一些实施方式中,mTOR激活异常包括AKT1中的遗传异常。在一些实施方式中,遗传异常包括AKT1中的激活突变。在一些实施方式中,激活突变是AKT1中位置H238的错义突变。在一些实施方式中,错义突变是AKT1中的H238Y。
在一些实施方式中,mTOR激活异常包括TP53中的遗传异常。在一些实施方式中,遗传异常包括TP53中的功能丧失突变。在一些实施方式中,功能丧失突变是TP53中的移码突变,如A39fs*5。
可以基于样品,如来自个体的样品和/或参考样品,评估mTOR相关基因的遗传异常。在一些实施方式中,样品是组织样品或从组织样品提取的核酸。在一些实施方式中,样品是细胞样品(例如CTC样品)或从细胞样品提取的核酸。在一些实施方式中,样品是肿瘤活检。在一些实施方式中,样品是肿瘤样品或从肿瘤样品提取的核酸。在一些实施方式中,样品是活检样品或从活检样品提取的核酸。在一些实施方式中,样品是甲醛固定石蜡包埋的(FFPE)样品或从FFPE样品提取的核酸。在一些实施方式中,样品是血液样品。在一些实施方式中,从血液样品分离无细胞DNA。在一些实施方式中,生物样品是血浆样品或从血浆样品提取的核酸。
可以通过本领域已知的任何方法来确定mTOR相关基因的遗传异常。参见,例如,Dickson et al.Int.J.Cancer,2013,132(7):1711-1717;Wagle N.Cancer Discovery,2014,4:546-553;和Cancer Genome Atlas Research Network.Nature 2013,499:43-49。示例性方法包括但不限于基因组DNA测序、亚硫酸氢盐测序或利用Sanger测序或下一代测序平台的其他基于DNA测序的方法;聚合酶链反应测定;原位杂交测定;和DNA微阵列。可以将从个体分离的样品中的一种或多种mTOR相关基因的表观遗传特征(如DNA甲基化、组蛋白结合或染色质修饰)与来自对照样品的一种或多种mTOR相关基因的表观遗传特征进行比较。可以对从样品提取的核酸分子测序或分析相对于参考序列(如AKT1、FLT-3、MTOR、PIK3CA、PIK3CG、TSC1、TSC2、RHEB、STK11、NF1、NF2、TP53、FGFR4、BAP1、KRAS、NRAS和PTEN的野生型序列)是否存在mTOR激活遗传异常。
在一些实施方式中,使用无细胞DNA测序方法评估mTOR相关基因的遗传异常。在一些实施方式中,使用下一代测序评估mTOR相关基因的遗传异常。在一些实施方式中,使用下一代测序评估从血液样品分离的mTOR相关基因的遗传异常。在一些实施方式中,使用外显子组测序评估mTOR相关基因的遗传异常。在一些实施方式中,使用荧光原位杂交分析评估mTOR相关基因的遗传异常。在一些实施方式中,在开始本文所述的治疗方法之前评估mTOR相关基因的遗传异常。在一些实施方式中,在本文所述的治疗方法开始之后评估mTOR相关基因的遗传异常。在一些实施方式中,在开始本文描述的治疗方法之前和之后评估mTOR相关基因的遗传异常。
C.异常水平
mTOR相关基因的异常水平可以指异常表达水平或异常活性水平。
mTOR相关基因的异常表达水平包括与对照水平相比,mTOR相关基因编码的分子的水平升高或降低。mTOR相关基因编码的分子可以包括RNA转录物(一种或多种)(如mRNA)、蛋白质同工型(一种或多种)、蛋白质同工型(一种或多种)的磷酸化和/或去磷酸化状态、蛋白质同工型(一种或多种)的泛素化和/或去泛素化状态、蛋白质同工型(一种或多种)的膜定位(例如肉豆蔻酰基化、棕榈酰基化等)状态、蛋白同工型(一种或多种)的其他翻译后修饰状态或其任何组合。
mTOR相关基因的异常活性水平包括mTOR相关基因的任何下游靶基因编码的分子的增强或抑制,包括下游靶基因的表观遗传调控、转录调控、翻译调控、翻译后调控或其任何组合。另外,mTOR相关基因的活性包括响应mTOR激活异常的下游细胞和/或生理作用,包括但不限于蛋白质合成、细胞生长、增殖、信号转导、线粒体代谢、线粒体生物发生、应激反应、细胞周期停滞、自噬、微管组织和脂质代谢。
在一些实施方式中,mTOR激活异常(例如异常表达水平)包括异常蛋白质磷酸化水平。在一些实施方式中,异常磷酸化水平是在选自AKT、TSC2、mTOR、PRAS40、S6K、S6和4EBP1的mTOR相关基因编码的蛋白质中。可以用作相关生物标志的示例性mTOR相关基因磷酸化种类包括但不限于AKT S473磷酸化、PRAS40 T246磷酸化、mTOR S2448磷酸化、4EBP1 T36磷酸化、S6K T389磷酸化、4EBP1 T70磷酸化和S6 S235磷酸化。在一些实施方式中,如果个体中的蛋白质被磷酸化,则该个体被选择进行治疗。在一些实施方式中,如果个体中的蛋白质未被磷酸化,则该个体被选择进行治疗。在一些实施方式中,通过免疫组织化学确定蛋白质的磷酸化状态。
个体的mTOR相关基因的水平(如表达水平和/或活性水平)可以基于样品(例如,来自个体的样品或参考样品)来确定。在一些实施方式中,样品来自组织、器官、细胞或肿瘤。在一些实施方式中,样品是生物样品。在一些实施方式中,生物样品是生物流体样品或生物组织样品。在进一步实施方式中,生物流体样品是体液。在一些实施方式中,样品是与CNS障碍相关的组织、与所述CNS障碍相关的组织相邻的正常组织、与所述CNS障碍相关的组织远离的正常组织、血液样品或其他生物样品。在一些实施方式中,样品是固定的样品。固定的样品包括但不限于福尔马林固定的样品、石蜡包埋的样品或冷冻的样品。在一些实施方式中,样品是包含来自CNS障碍组织的细胞的活检。在进一步实施方式中,活检是来自与CNS障碍相关的组织的细胞的细针穿刺。在一些实施方式中,将活检的细胞离心成团粒、固定并包埋在石蜡中。在一些实施方式中,活检的细胞被快速冷冻。在一些实施方式中,将活检细胞与识别由TOR相关基因编码的分子的抗体混合。在一些实施方式中,至少一个mTOR相关基因包括由mTOR相关基因的任何下游靶基因编码的分子的增强或抑制,包括下游靶基因的表观遗传调控、转录调控、翻译调控、翻译后调控或其任何组合。另外,mTOR相关基因的活性包括响应mTOR激活异常的下游细胞和/或生理作用,包括但不限于蛋白质合成、细胞生长、增殖、信号转导、线粒体代谢、线粒体生物发生、应激反应、细胞周期停滞、自噬、微管组织和脂质代谢。
在一些实施方式中,mTOR激活异常(例如异常表达水平)包括异常蛋白质磷酸化水平。在一些实施方式中,异常磷酸化水平是在选自AKT、TSC2、mTOR、PRAS40、S6K、S6和4EBP1的mTOR相关基因编码的蛋白质中。可以用作相关生物标志的示例性mTOR相关基因磷酸化种类包括但不限于AKT S473磷酸化、PRAS40 T246磷酸化、mTOR S2448磷酸化、4EBP1 T36磷酸化、S6K T389磷酸化、4EBP1 T70磷酸化和S6 S235磷酸化。在一些实施方式中,如果个体中的蛋白质被磷酸化,则选择该个体进行治疗。在一些实施方式中,如果个体中的蛋白质未被磷酸化,则选择该个体进行治疗。在一些实施方式中,通过免疫组织化学确定蛋白质的磷酸化状态。
mTOR相关基因的异常水平已与癌症关联。例如,在人膀胱癌组织组(array)中发现了高水平(74%)的磷酸化mTOR表达,并且磷酸化的mTOR强度与生存率降低相关(Hansel DE等,(2010)Am.J.Pathol.176:3062-3072)。显示mTOR表达随从浅表疾病到浸润性膀胱癌的进展中的疾病阶段而增加,如pS6激酶的激活证明的,pS6激酶在70例T2浸润性膀胱肿瘤中的54例(77%)中被激活(Seager CM等,(2009)Cancer Prev.Res.(Philo)2,1008-1014)。mTOR信号传导通路也已知在肺动脉高压中被超激活。
个体中mTOR相关基因的水平(如表达水平和/或活性水平)可以基于样品(例如,来自个体的样品或参考样品)来确定。在一些实施方式中,样品来自组织、器官、细胞或肿瘤。在一些实施方式中,样品是生物样品。在一些实施方式中,生物样品是生物流体样品或生物组织样品。在进一步实施方式中,生物流体样品是体液。在一些实施方式中,样品是与CNS障碍相关的组织、与CNS障碍相关的组织相邻的正常组织、与CNS障碍相关的组织远离的正常组织、血液样品或其他生物样品。在一些实施方式中,样品是固定的样品。固定的样品包括但不限于福尔马林固定的样品、石蜡包埋的样品或冷冻的样品。在一些实施方式中,样品是包含来自与CNS障碍相关的组织的细胞的活检。在进一步实施方式中,活检是来自与CNS障碍相关的组织的细胞的细针穿刺。在一些实施方式中,将活检细胞离心成团粒、固定并包埋在石蜡中。在一些实施方式中,活检细胞被快速冷冻。在一些实施方式中,将活检细胞与识别由mTOR相关的生物标志编码的分子的抗体混合,包含由mTOR相关基因编码的蛋白质的异常磷酸化水平,其包括mTOR相关基因的任何下游靶基因编码的分子的增强或抑制,包括下游靶基因的表观遗传调控、转录调控、翻译调控、翻译后调控或其任意组合。另外,mTOR相关基因的活性包括响应于mTOR激活异常的下游细胞和/或生理作用,包括但不限于蛋白质合成、细胞生长、增殖、信号转导、线粒体代谢、线粒体生物发生、应激反应、细胞周期停滞、自噬、微管组织和脂质代谢。
在一些实施方式中,mTOR激活异常(例如异常表达水平)包括异常蛋白质磷酸化水平。在一些实施方式中,异常磷酸化水平是在选自以下的mTOR相关基因编码的蛋白质中:PTEN、AKT、TSC2、mTOR、PRAS40、S6K、S6和4EBP1。可以用作相关生物标志的示例性mTOR相关基因磷酸化种类包括但不限于PTEN Thr366、Ser370、Ser380、Thr382、Thr383和/或Ser385磷酸化、AKT S473磷酸化、PRAS40 T246磷酸化、mTOR S2448磷酸化、4EBP1 T36磷酸化、S6KT389磷酸化、4EBP1 T70磷酸化和S6 S235磷酸化。在一些实施方式中,如果个体中的蛋白质被磷酸化,则选择该个体进行治疗。在一些实施方式中,如果个体中的蛋白质未被磷酸化,则选择该个体进行治疗。在一些实施方式中,通过免疫组织化学确定蛋白质的磷酸化状态。
mTOR相关基因的异常水平已与癌症关联。例如,在人膀胱癌组织组中发现了高水平(74%)的磷酸化mTOR表达,并且磷酸化的mTOR强度与生存率降低相关(Hansel DE etal,(2010)Am.J.Pathol.176:3062-3072)。显示mTOR表达随从浅表疾病到浸润性膀胱癌的进展中的疾病阶段而增加,如pS6激酶的激活证明的,pS6激酶在70例T2浸润性膀胱肿瘤中的54例(77%)中被激活(Seager CM et al,(2009)Cancer Prev.Res.(Philo)2,1008-1014)。mTOR信号传导通路也已知在肺动脉高压中被超激活。
个体中mTOR相关基因的水平(如表达水平和/或活性水平)可以基于样品(例如,来自个体的样品或参考样品)来确定。在一些实施方式中,样品来自组织、器官、细胞或肿瘤。在一些实施方式中,样品是生物样品。在一些实施方式中,生物样品是生物流体样品或生物组织样品。在进一步实施方式中,生物流体样品是体液。在一些实施方式中,样品是与CNS障碍相关的组织、与CNS障碍相关的组织相邻的正常组织、与CNS障碍相关的组织远离的正常组织、血液样品或其他生物样品。在一些实施方式中,样品是固定的样品。固定的样品包括但不限于福尔马林固定的样品、石蜡包埋的样品或冷冻的样品。在一些实施方式中,样品是包含来自与CNS障碍相关的组织的细胞的活检。在进一步实施方式中,活检是与CNS障碍相关的细胞的细针穿刺。在一些实施方式中,将活检细胞离心成团粒、固定并包埋在石蜡中。在一些实施方式中,活检细胞被快速冷冻。在一些实施方式中,将活检细胞与识别由mTOR相关基因编码的分子的抗体混合。在一些实施方式中,进行活检以确定个体是否患有CNS障碍,然后用作样品。在一些实施方式中,样品包含手术获得的来自与CNS障碍相关的组织的细胞。在一些实施方式中,可以在与mTOR相关基因表达水平确定发生时不同的时间获得样品。
在一些实施方式中,样品包含循环的转移性癌细胞。在一些实施方式中,通过从血液中分选循环肿瘤细胞(CTC)获得样品。在进一步实施方式中,CTC已与原发性肿瘤分离并在体液中循环。在又一个实施方式中,CTC已经与原发性肿瘤分离并在血流中循环。在进一步实施方式中,CTC是转移的指示。
在一些实施方式中,确定由mTOR相关基因编码的蛋白质的水平,以评估mTOR相关基因的异常表达水平。在一些实施方式中,确定由mTOR相关基因的下游靶基因编码的蛋白质的水平,以评估mTOR相关基因的异常活性水平。在一些实施方式中,使用对个体蛋白质或其蛋白水解片段的一个或多个表位具有特异性的一种或多种抗体来确定蛋白质水平。适用于实践本申请的检测方法包括但不限于免疫组织化学、酶联免疫吸附测定(ELISA)、蛋白质印迹、质谱和免疫PCR。在一些实施方式中,由样品中mTOR相关基因和/或其下游靶基因(一个或多个)编码的蛋白质(一种或多种)的水平通过同一样品中的管家蛋白质(如甘油醛3-磷酸脱氢酶或GAPDH)的水平标准化(如除以管家蛋白质的水平)。
在一些实施方式中,确定由mTOR相关基因编码的mRNA的水平,以评估mTOR相关基因的异常表达水平。在一些实施方式中,确定由mTOR相关基因的下游靶基因编码的mRNA的水平,以评估mTOR相关基因的异常活性水平。在一些实施方式中,利用逆转录(RT)聚合酶链反应(PCR)测定(包括定量RT-PCR测定)确定mRNA水平。在一些实施方式中,利用基因芯片或下一代测序方法(如RNA(cDNA)测序或外显子组测序)确定由mTOR相关基因和/或其下游靶基因编码的RNA(如mRNA)的水平。在一些实施方式中,样品中mTOR相关基因和/或其下游靶基因的mRNA水平通过同一样品中的管家基因(如GAPDH)的mRNA水平标准化(如除以管家基因的水平)。
与对照或参考相比,mTOR相关基因的水平可以是高水平或低水平。在一些实施方式中——其中mTOR相关基因是mTOR活性(如mTORC1和/或mTORC2活性)的正调控因子,mTOR相关基因的异常水平与对照相比是高水平。在一些实施方式中——其中mTOR相关基因是mTOR活性(如mTORC1和/或mTORC2活性)的负调控因子,mTOR相关基因的异常水平与对照相比是低水平。
在一些实施方式中,将个体中mTOR相关基因的水平与对照样品中mTOR相关基因的水平进行比较。在一些实施方式中,将个体中mTOR相关基因的水平与多个对照样品中mTOR相关基因的水平进行比较。在一些实施方式中,多个对照样品用于产生统计数据,该统计数据用于对患有CNS障碍的个体中的mTOR相关基因水平进行分类。
可以相对于对照水平的统计分布确定mTOR相关基因的水平的分类或排序(即,高或低)。在一些实施方式中,分类或排序是相对于对照样品,如正常组织(例如,外周血单核细胞)或从个体获得的正常上皮细胞样品(例如颊部擦拭或皮肤穿孔)。在一些实施方式中,将mTOR相关基因的水平相对于对照水平的统计分布分类或排序。在一些实施方式中,将mTOR相关基因的水平相对于来自从个体获得的对照样品的水平分类或排序。
可以使用与非对照样品相同的来源和方法获得对照样品。在一些实施方式中,对照样品获自不同的个体(例如,未患有CNS障碍的个体;具有对应于CNS障碍的良性或次晚期(less advanced)疾病形式的个体;和/或具有相似种族、年龄和性别的个体)。在一些实施方式中,当样品是肿瘤组织样品时,对照样品可以是来自同一个体的非癌样品。在一些实施方式中,使用多个对照样品(例如来自不同个体)来确定具体组织、器官或细胞群体中的mTOR相关基因的水平范围。
在一些实施方式中,对照样品是已被确定是适当对照的培养组织或细胞。在一些实施方式中,对照是不具有mTOR激活异常的细胞。在一些实施方式中,在标准化测试中临床上接受的正常水平被用作用于确定TOR相关基因的异常水平的对照水平。在一些实施方式中,根据评分系统,如基于免疫组织化学的评分系统,将个体中mTOR相关基因或其下游靶基因的水平分类为高、中或低。
在一些实施方式中,通过测量个体中mTOR相关基因的水平并与对照或参考(例如,给定患者群体的中位水平或第二个体的水平)比较,来确定mTOR相关基因的水平。例如,如果确定单个个体的mTOR相关基因的水平高于患者群体的中位水平,则确定该个体具有高表达水平的mTOR相关基因。可选地,如果确定单个个体的mTOR相关基因的水平低于患者群体的中位水平,则确定该个体具有低表达水平的mTOR相关基因。在一些实施方式中,将该个体与对治疗有响应的第二个体和/或患者群体进行比较。在一些实施方式中,将该个体与对治疗无响应的第二个体和/或患者群体进行比较。在一些实施方式中,该水平通过测量由mTOR相关基因和/或其下游靶基因编码的核酸的水平来确定。例如,如果确定单个个体的mTOR相关基因编码的分子(如mRNA或蛋白质)的水平高于患者群体的中位水平,则该个体被确定具有高水平的mTOR相关基因编码的分子(如mRNA或蛋白质)。可选地,如果确定单个个体的mTOR相关基因编码的分子(如mRNA或蛋白质)的水平低于患者群体的中位水平,则确定该个体具有低水平的mTOR相关基因编码的分子(如mRNA或蛋白质)。
在一些实施方式中,通过获得mTOR相关基因水平的统计学分布来确定mTOR相关基因的对照水平。在一些实施方式中,相对于对照水平或对照水平的统计分布,对mTOR相关基因的水平进行分类或排序。
在一些实施方式中,生物信息学方法用于mTOR相关基因的水平的确定和分类,包括mTOR相关基因的下游靶基因的水平作为mTOR相关基因的活性水平的度量。已经开发出许多生物信息学方法来利用基因表达概况分析数据评估基因集表达概况。方法包括但不限于下列所述的那些:Segal,E.et al.Nat.Genet.34:66-176(2003);Segal,E.etal.Nat.Genet.36:1090-1098(2004);Barry,W.T.et al.Bioinformatics 21:1943-1949(2005);Tian,L.et al.Proc Nat’l Acad Sci USA 102:13544-13549(2005);Novak B Aand Jain A N.Bioinformatics 22:233-41(2006);Maglietta R et al.Bioinformatics23:2063-72(2007);Bussemaker H J,BMC Bioinformatics 8Suppl 6:S6(2007)。
在一些实施方式中,对照水平是预定阈值水平。在一些实施方式中,确定mRNA水平,并且低水平是低于被认为临床正常的水平或从对照获得的水平的约1、0.9、0.8、0.7、0.6、0.5、0.4、0.3、0.2、0.1、0.05、0.02、0.01、0.005、0.002、0.001倍或更低倍数中任一的mRNA水平。在一些实施方式中,高水平是高于被认为临床正常的水平或从对照获得的水平的约1.1、1.2、1.3、1.5、1.7、2、2.2、2.5、2.7、3、5、7、10、20、50、70、100、200、500、1000倍或超过1000倍的mRNA水平。
在一些实施方式中,蛋白质表达水平例如通过蛋白质印迹或酶联免疫吸附测定(ELISA)确定。例如,低水平或高水平的标准可以根据蛋白质凝胶上通过特异性识别由mTOR相关基因编码的蛋白质的抗体印迹的mTOR相关基因编码的蛋白质的相应条带的总强度来形成,并且通过相同样品的相同蛋白质凝胶上通过特异性识别管家蛋白质(例如GAPDH)的抗体印迹的管家蛋白质(例如GAPDH)的相应条带而归一化(如除以管家蛋白质的相应条带)。在一些实施方式中,如果蛋白质水平是低于被认为临床正常的水平或从对照获得的水平的约1、0.9、0.8、0.7、0.6、0.5、0.4、0.3、0.2、0.1、0.05、0.02、0.01、0.005、0.002、0.001或更低倍数中任一的mRNA水平,则蛋白质水平低。在一些实施方式中,如果蛋白质水平高于被认为临床正常的水平或从对照获得的水平的约1.1、1.2、1.3、1.5、1.7、2、2.2、2.5、2.7、3、5、7、10、20、50或100倍或超过100倍,则蛋白质水平高。
在一些实施方式中,蛋白质表达水平例如通过免疫组织化学确定。例如,可以基于阳性染色细胞的数量和/或染色强度,例如通过使用特异性识别由mTOR相关基因编码的蛋白质的抗体,来确定低水平或高水平的标准。在一些实施方式中,如果少于约1%、5%、10%、15%、20%、25%、30%、35%、40%、45%或50%的细胞具有阳性染色,则该水平低。在一些实施方式中,如果染色的强度比阳性对照染色低1%、5%、10%、15%、20%、25%、30%、35%、40%、45%或50%,则该水平低。在一些实施方式中,如果多于约40%、45%、50%、55%、60%、65%,70%、75%、80%、85%或90%的细胞具有阳性染色,则该水平高。在一些实施方式中,如果染色强度与阳性对照染色一样,则该水平高。在一些实施方式中,如果染色强度是阳性对照染色的80%、85%或90%,则该水平高。
在一些实施方式中,评分基于美国专利公开号2013/0005678中所述的“H分数”。H分数通过以下公式获得:3×强染色细胞%+2×中染色细胞%+弱染色细胞%,给出0到300的范围。
在一些实施方式中,强染色、中染色和弱染色是校准的染色水平,其中建立了范围,并且染色强度在该范围内进行分档(bin)。在一些实施方式中,强染色是强度范围的75%分位以上的染色,中染色是强度范围的25%分位至75%分位的染色,而低染色是强度范围的25%分位以下的染色。在一些方面,本领域的并且熟悉具体染色技术的技术人员,调整分档尺寸,并限定染色类别。
在一些实施方式中,在多于50%的染色细胞呈现强反应性的情况下分配高染色标签,在少于50%的染色细胞中未观察到染色的情况下分配未染色标签,而所有其他情况分配低染色标签。
在一些实施方式中,样品、患者等中的mTOR相关基因的遗传异常或水平的评估和/或评分是由一位或多位有经验的临床医生进行的,即具有mTOR经验相关基因表达和mTOR相关基因产物染色模式经验的临床医生。例如,在一些实施方式中,临床医生(一个或多个)对被评估和评分的样品、患者等的临床特征和结果不知情。
在一些实施方式中,确定蛋白质磷酸化的水平。可以评估来自多种样品来源的蛋白质的磷酸化状态。在一些实施方式中,样品是肿瘤活检。可以通过多种方法评估蛋白质的磷酸化状态。在一些实施方式中,利用免疫组织化学评估磷酸化状态。蛋白质的磷酸化状态可以是位点特异性的。可以将蛋白质的磷酸化状态与对照样品进行比较。在一些实施方式中,在开始本文所述的治疗方法之前评估磷酸化状态。在一些实施方式中,在开始本文描述的治疗方法之后评估磷酸化状态。在一些实施方式中,在开始本文所述的治疗方法之前和之后评估磷酸化状态。
本文还提供了通过下列指导CNS障碍治疗的方法:将样品递送至诊断实验室以确定mTOR相关基因的水平;提供具有已知水平的mTOR相关基因的对照样品;提供针对由mTOR相关基因编码的分子的抗体或针对由mTOR相关基因的下游靶基因编码的分子的抗体;使样品和对照样品单独与抗体接触,和/或检测抗体结合的相对量,其中样品的水平用于提供结论:患者应接受用任一种本文所述方法进行治疗。
本文还提供了指导CNS障碍治疗的方法,进一步包括复查或分析样品中mTOR激活异常状态(例如存在/不存在或水平)有关的数据;和向诸如医疗保健提供人员或医疗保健管理人员的个体提供有关该个体对治疗作出响应的可能性或适合性的结论,该结论基于数据的复查或分析。在本申请的一方面,结论是通过网络的数据传输。
D.抗性生物标志
某些基因的遗传异常和异常水平可与对本文所述治疗方法的抗性相关。在一些实施方式中,抗性生物标志异常(如遗传异常或异常水平)的个体被从使用本文所述的mTOR抑制剂纳米颗粒的治疗方法排除。在一些实施方式中,抗性生物标志的状态与一种或多种mTOR激活异常的状态结合作为基础用于选择个体进行任一种如本文所述的使用mTOR抑制剂纳米颗粒的治疗方法。
例如,TFE3,也称为与IGHM增强子3、TFEA、RCCP2、RCCX1或bHLHe33结合的转录因子,是特异性识别并结合基因启动子中MUE3型E盒(E-box)序列的转录因子。TFE3促进转化生长因子β(TGF-βeta)信号传导下游的基因的表达。TFE3的易位已与肾细胞癌和其他癌症关联。在一些实施方式中,根据人基因组的GRCh38.p2装配,通过Genbank登录号NC_000023.11由X染色体的互补链的核苷酸49028726至核苷酸49043517鉴定野生型TFE3基因的核酸序列。可与对如本文所述的使用mTOR抑制剂纳米颗粒治疗的抗性相关的TFE3的示例性易位包括但不限于Xp11易位,如t(X;1)(p11.2;q21)、t(X;1)(p11.2;p34)、(X;17)(p11.2;q25.3)和inv(X)(p11.2;q12)。可以利用免疫组织化学方法或荧光原位杂交(FISH)评估TFE3基因座的易位。
制品和试剂盒
在本申请的一些实施方式中,提供了包含对治疗CNS障碍有用的材料的制品,该材料包括mTOR抑制剂纳米颗粒组合物(例如西罗莫司/白蛋白纳米颗粒组合物)。在一些实施方式中,提供了包含对治疗CNS障碍有用的材料的制品,该材料包括mTOR抑制剂纳米颗粒组合物(例如西罗莫司/白蛋白纳米颗粒组合物)和选自抗VEGF抗体、蛋白酶体抑制剂(例如马里佐米)、烷基化剂(例如替莫唑胺或洛莫司汀)和抗癫痫药的第二药剂。在本申请的一些实施方式中,提供了包含对治疗CNS障碍有用的材料的制品,该材料包括mTOR抑制剂纳米颗粒组合物(例如西罗莫司/白蛋白纳米颗粒组合物)和用于评估mTOR激活异常的药剂。在一些实施方式中,提供了包含对治疗CNS障碍有用的材料的制品,该材料包括mTOR抑制剂纳米颗粒组合物(例如西罗莫司/白蛋白纳米颗粒组合物);选自抗VEGF抗体、蛋白酶体抑制剂(例如马里佐米)、烷基化剂(例如替莫唑胺或洛莫司汀)和抗癫痫药的第二药剂;和用于评估mTOR激活异常的第三药剂。
制品可以包括容器以及在容器上或与容器相关联的标签或包装插页。合适的容器包括例如瓶、小瓶、注射器等。容器可以由多种材料形成,例如玻璃或塑料。通常地,容器容纳本文所述的有效治疗疾病或障碍的组合物,并且可以具有无菌进入口(例如,容器可以是静脉注射溶液袋或小瓶,其具有可通过皮下注射针刺穿的塞子)。组合物中至少一种激活剂是a)mTOR抑制剂的纳米颗粒制剂;或)选自由抗VEGF抗体、蛋白酶体抑制剂(例如马里佐米)、烷基化剂(例如替莫唑胺或洛莫司汀)和抗癫痫药组成的列表的药剂。标签或包装插页表明组合物用来治疗个体的具体CNS障碍。标签或包装插页将进一步包括用于向个体施用组合物的说明。也考虑包括本文所述的联合疗法的制品和试剂盒。
包装插页是指通常包含在治疗产品的商业包装中的说明,该说明包含关于使用此类治疗产品的适应症、用法、剂量、施用、禁忌症和/或警告的信息。在一些实施方式中,包装插页指示组合物用于治疗CNS障碍。
另外,制品可以进一步包括第二容器,该第二容器包含药学上可接受的缓冲液,例如抑菌注射用水(BWFI)、磷酸盐缓冲盐水、林格氏溶液和右旋糖溶液。从商业和用户的角度来看,其可以进一步包括其他期望的材料,其包括其他缓冲液、稀释剂、过滤器、针头和注射器。
也提供了试剂盒,其可用于多种目的,例如用于治疗CNS障碍。本申请的试剂盒包括一个或多个容器,该容器包括mTOR抑制剂纳米颗粒组合物(例如西罗莫司/白蛋白纳米颗粒组合物)(或单位剂型和/或制品),和在一些实施方式中,进一步包括选自抗VEGF抗体、蛋白酶体抑制剂(例如马里佐米)、烷基化剂(例如替莫唑胺或洛莫司汀)和抗癫痫药的药剂,和/或根据本文所述任何方法的使用说明。在一些实施方式中,试剂盒进一步包括用于评估mTOR激活异常(例如PTEN异常)的药剂。试剂盒可以进一步包括选择适合治疗的个体的说明书。本申请的试剂盒中提供的说明通常是在标签或包装插页(例如,试剂盒中包括的纸)上的书面说明,但是机器可读的说明(例如,磁或光存储磁盘上携带的说明)也是可以接受的。
例如,在一些实施方式中,试剂盒包括组合物,该组合物包括mTOR抑制剂纳米颗粒组合物(例如西罗莫司/白蛋白纳米颗粒组合物)。在一些实施方式中,试剂盒包括a)组合物,该组合物包括mTOR抑制剂纳米颗粒组合物(例如西罗莫司/白蛋白纳米颗粒组合物),和b)选自抗VEGF抗体、蛋白酶体抑制剂(例如马里佐米)、烷基化剂(例如替莫唑胺或洛莫司汀)和抗癫痫药的第二药剂。在一些实施方式中,试剂盒包括a)组合物,该组合物包括mTOR抑制剂纳米颗粒组合物(例如西罗莫司/白蛋白纳米颗粒组合物),和b)用于向个体施用mTOR抑制剂纳米颗粒组合物,任选地与选自抗VEGF抗体、蛋白酶体抑制剂(例如马里佐米)、烷基化剂(例如替莫唑胺或洛莫司汀)和抗癫痫药的第二药剂组合以治疗CNS障碍的说明。在一些实施方式中,试剂盒包括a)组合物,该组合物包括mTOR抑制剂纳米颗粒组合物(例如西罗莫司/白蛋白纳米颗粒组合物),b)选自抗VEGF抗体、蛋白酶体抑制剂(例如马里佐米)、烷基化剂(例如替莫唑胺或洛莫司汀)和抗癫痫药的第二药剂,和c)用于向个体施用mTOR抑制剂纳米颗粒组合物和选自抗VEGF抗体、蛋白酶体抑制剂(例如马里佐米)、烷基化剂(例如替莫唑胺或洛莫司汀)和抗癫痫药的第二药剂以治疗CNS障碍的说明。在一些实施方式中,试剂盒包括a)组合物,该组合物包括mTOR抑制剂纳米颗粒组合物(例如西罗莫司/白蛋白纳米颗粒组合物),b)选自抗VEGF抗体、蛋白酶体抑制剂(例如马里佐米)、烷基化剂(例如替莫唑胺或洛莫司汀)和抗癫痫药的第二药剂,c)用于评估mTOR激活异常的第三药剂,和d)用于向个体施用mTOR抑制剂纳米颗粒组合物和选自抗VEGF抗体、蛋白酶体抑制剂(例如马里佐米)、烷基化剂(例如替莫唑胺或洛莫司汀)和抗癫痫药的第二药剂以治疗CNS障碍的说明。mTOR抑制剂纳米颗粒组合物(例如西罗莫司/白蛋白纳米颗粒组合物)和选自抗VEGF抗体、蛋白酶体抑制剂(例如马里佐米)、烷基化剂(例如替莫唑胺或洛莫司汀)和抗癫痫药的第二药剂可以存在于单独的容器或单个容器中。例如,试剂盒可以包括一种独特的组合物或两种或更多种组合物,其中一种组合物包括mTOR抑制剂纳米颗粒组合物(例如西罗莫司/白蛋白纳米颗粒组合物)和另一种组合物包括选自抗VEGF抗体、蛋白酶体抑制剂(例如马里佐米)、烷基化剂(例如替莫唑胺或洛莫司汀)和抗癫痫药的第二药剂。
本申请的试剂盒处于合适的包装中。合适的包装包括但不限于小瓶、瓶子、广口瓶、软包装(例如密封的Mylar或塑料袋)等。试剂盒可以任选地提供额外的组分,例如缓冲液和解释性信息。因此,本申请还提供了制品,其包括小瓶(例如密封的小瓶)、瓶子、广口瓶、软包装等。
涉及使用mTOR抑制剂纳米颗粒组合物(例如西罗莫司/白蛋白纳米颗粒组合物)和选自抗VEGF抗体、蛋白酶体抑制剂(例如马里佐米)、烷基化剂(例如替莫唑胺或洛莫司汀)和抗癫痫药的第二药剂的说明通常包括关于预期治疗的剂量、剂量时间表和施用途径的信息。容器可以是单位剂量、大包装(例如多剂量包装)或亚单位剂量。例如,可以提供试剂盒,该试剂盒包括如本文所述的足够剂量的mTOR抑制剂纳米颗粒组合物(例如西罗莫司/白蛋白纳米颗粒组合物)和选自抗VEGF抗体、蛋白酶体抑制剂(例如马里佐米)、烷基化剂(例如替莫唑胺或洛莫司汀)和抗癫痫药的第二药剂,以向个体提供长期的有效治疗,例如一周、8天、9天、10天、11天、12天、13天、2周、3周、4周、6周、8周、3月、4月、5月、7月、8月、9月、12月、24月或更长的任一。试剂盒也可以包括多个单位剂量的mTOR抑制剂纳米颗粒组合物(例如西罗莫司/白蛋白纳米颗粒组合物)和选自抗VEGF抗体、蛋白酶体抑制剂(例如马里佐米)、烷基化剂(例如替莫唑胺或洛莫司汀)和抗癫痫药的第二药剂以及使用说明,其包装的量足以在药房(例如医院药房和复方药房)中储存和使用。
本领域技术人员将认识到,在本申请的范围和精神内,数个实施方式是可能的。现在将通过参考以下非限制性的实施例更详细地描述本申请。以下实施例进一步说明了本申请,但是,当然,不应理解为以任何方式限制本申请的范围。
示例性实施方式
实施方式1.治疗个体中CNS障碍的方法,包括向个体全身性施用有效量的包括纳米颗粒的组合物,该纳米颗粒包括mTOR抑制剂和白蛋白。
实施方式2.实施方式1的方法,其中每次施用的纳米颗粒组合物中mTOR抑制剂的量为约0.1mg/m
实施方式3.实施方式1或实施方式2的方法,其中纳米颗粒组合物每周一次、每三周两次或每四周三次被施用。
实施方式4.实施方式1-3中任一项的方法,其中纳米颗粒组合物中纳米颗粒的平均直径不大于约200nm.
实施方式5.实施方式1-4中任一项的方法,其中纳米颗粒组合物中白蛋白与mTOR抑制剂的重量比不大于约9:1.
实施方式6.实施方式1-5中任一项的方法,其中纳米颗粒包括与白蛋白缔合的mTOR抑制剂。
实施方式7.实施方式1-6中任一项的方法,其中纳米颗粒包括包被有白蛋白的mTOR抑制剂。
实施方式8.实施方式1-7中任一项的方法,其中纳米颗粒组合物被施用持续至少约一至六个周期,其中每个周期由21或28天组成。
实施方式9.实施方式1-8中任一项的方法,其中mTOR抑制剂是莫司药物。
实施方式10.实施方式9的方法,其中mTOR抑制剂是雷帕霉素。
实施方式11.实施方式1-10中任一项的方法,其中CNS障碍是癫痫。
实施方式12.实施方式11的方法,其中个体已经历癫痫手术。
实施方式13.实施方式12的方法,其中个体在癫痫手术后的30天内至少5次癫痫发作或在癫痫手术后不具有一周的无癫痫发作。
实施方式14.实施方式11-13中任一项的方法,其中方法进一步包括向个体施用有效量的抗癫痫药剂。
实施方式15.实施方式11-14中任一项的方法,其中每次施用的纳米颗粒组合物中mTOR抑制剂的量为约0.1mg/m
实施方式16.实施方式1-10中任一项的方法,其中CNS障碍是恶性胶质瘤。
实施方式17.实施方式16的方法,其中恶性胶质瘤是复发性恶性胶质瘤。
实施方式18.实施方式16的方法,其中恶性胶质瘤是新诊断的恶性胶质瘤。
实施方式19.实施方式18的方法,其中个体在开始纳米颗粒施用之前已经历新诊断的恶性胶质瘤的手术切除。
实施方式20.实施方式16-19中任一项的方法,进一步包括向个体施用有效量的第二药剂,该第二药剂选自抗VEGF抗体、烷基化剂和蛋白酶体抑制剂。
实施方式21.实施方式16-20中任一项的方法,其中每次施用的纳米颗粒组合物中mTOR抑制剂的量为约20mg/m
实施方式22.实施方式20或实施方式21的方法,其中第二药剂是抗VEGF抗体。
实施方式23.实施方式22的方法,其中抗VEGF抗体是贝伐单抗。
实施方式24.实施方式22或实施方式23的方法,其中每次施用的抗VEGF的量为约1mg/kg至约5mg/kg。
实施方式25.实施方式22-24中任一项的方法,其中抗VEGF抗体每两周一次被施用。
实施方式26.实施方式22或实施方式23的方法,其中抗VEGF抗体以每周小于约5mg/kg的量被施用。
实施方式27.实施方式22-26中任一项的方法,其中抗VEGF抗体在施用纳米颗粒的一小时内被施用。
实施方式28.实施方式20或实施方式21的方法,其中第二药剂是蛋白酶体抑制剂。
实施方式29.实施方式28的方法,其中蛋白酶体抑制剂是马里佐米。
实施方式30.实施方式28或实施方式29的方法,其中每次施用的蛋白酶体抑制剂的量为约0.1mg/m
实施方式31.实施方式28-30中任一项的方法,其中蛋白酶体抑制剂每四周三次被施用。
实施方式32.实施方式28-31中任一项的方法,其中蛋白酶体抑制剂在施用纳米颗粒的一小时内被施用。
实施方式33.实施方式20或实施方式21的方法,其中第二药剂是烷基化剂。
实施方式34.实施方式33的方法,其中烷基化剂是替莫唑胺。
实施方式35.实施方式33或34的方法,其中烷基化剂的量为约25mg/m
实施方式36.实施方式35的方法,其中烷基化剂的量为约50mg/m
实施方式37.实施方式33-36中任一项的方法,其中烷基化剂每天被施用.
实施方式38.实施方式36或37的方法,其中烷基化剂每天被施用持续至少约三周。
实施方式39.实施方式34或35的方法,其中每次施用的烷基化剂的量为约125mg/m
实施方式40.实施方式39的方法,其中烷基化剂每四周约4-6次被施用。
实施方式41.实施方式40的方法,其中烷基化剂每四周连续五天每天被施用。
实施方式42.实施方式41的方法,其中烷基化剂被施用持续至少六个周期,其中每个周期由28天组成。
实施方式43.实施方式34-42中任一项的方法,其中烷基化剂被口服施用。
实施方式44.实施方式34-43中任一项的方法,其中方法进一步包括放射疗法。
实施方式45.实施方式44的方法,其中放射疗法是局部放射疗法。
实施方式46.实施方式45的方法,其中局部放射疗法每天被施用。
实施方式47.实施方式45或实施方式46的方法,其中约40-80Gy的局部放射疗法每周被施用。
实施方式48.实施方式33的方法,其中烷基化剂是亚硝基脲化合物。
实施方式49.实施方式48的方法,其中化合物是洛莫司汀。
实施方式50.实施方式48或实施方式49的方法,其中每次施用的亚硝基脲化合物的量为约80mg/m
实施方式51.实施方式48-50中任一项的方法,其中亚硝基脲化合物被口服施用。
实施方式52.实施方式48-51中任一项的方法,其中亚硝基脲化合物每六周一次被施用。
实施方式53.实施方式16-52中任一项的方法,其中恶性胶质瘤包括mTOR-激活异常。
实施方式54.实施方式53的方法,其中mTOR-激活异常包括PTEN异常。
实施方式55.实施方式1-54中任一项的方法,其中个体是人。
实施方式56.实施方式1-55中任一项的方法,其中纳米颗粒组合物被肠胃外施用至个体。
实施方式57.实施方式56的方法,其中纳米颗粒组合物被静脉内施用至个体。
实施方式58.实施方式56的方法,其中纳米颗粒组合物被皮下施用至个体。
实施方式59.试剂盒,其包括用于治疗CNS障碍的纳米颗粒组合物,该纳米颗粒组合物包括mTOR抑制剂和白蛋白。
实施方式60.实施方式59的试剂盒,进一步包括选自抗VEGF抗体、烷基化剂和蛋白酶体抑制剂的药剂。
实施方式61.实施方式59或60的试剂盒,进一步包括用于评估mTOR激活异常的药剂。
实施例
实施例1:在患有复发性恶性胶质瘤(rGBM)的患者中Nab-雷帕霉素作为单一药物疗法或与第二药物组合的用途
ABI-009(“nab-雷帕霉素”)是用于注射悬浮液的雷帕霉素蛋白结合的纳米颗粒(白蛋白结合的)。该研究是ABI-009(nab-雷帕霉素)在贝伐单抗首次实验的受试者(
A.疗法施用
2.nab-雷帕霉素作为单一药剂使用
ABI-009在每21天周期的第1天和第8天以100mg/m
3.nab-雷帕霉素与贝伐单抗(BEV)组合的使用
ABI-009在每28天周期的第1、8和15天以56mg/m
贝伐单抗(BEV)在每28天周期的第1和15天以5mg/kg的固定剂量作为静脉内输液(第一剂量90分钟,第二剂量60分钟,并且30分钟后,假设耐受性(assumingtolerability))被施用。BEV在ABI-009结束后的大约10分钟被施用。不受理论约束,假设较低的BEV剂量可能会潜在地改善化疗递送,并最终改善患者结果(Weathers et al.2016)。在一项回顾性分析中,与10mg/kg的正常剂量强度的贝伐单抗相比,低剂量强度的贝伐单抗(<5mg/kg/周)与改善的PFS和OS相关联,剂量强度与总生存期之间呈反比关系(Lorgis etal.2012)。因此,本研究选择5mg/kg的BEV剂量。
4.nab-雷帕霉素与马里佐米(MRZ)组合的使用
ABI-009在每28天周期的第1、8和15天以56mg/m
MRZ在每28天周期的第1、8和15天0.8mg/m
5.nab-雷帕霉素与替莫唑胺(TMZ)组合的使用
ABI-009在每28天周期的第1、8和15天以56mg/m
TMZ每天以50mg/m
6.nab-雷帕霉素与洛莫司汀(CCNU)组合的使用
ABI-009在每21天周期的第1和第8天以56mg/m
CCNU每6周以90mg/m
以上述任何一种疗法的受试者继续接受疗法,直到疾病进展、不可接受的毒性,直到研究人员认为受试者不再从疗法中受益、或受试者自行决定。
B.评估疗效和安全性的终点和标准
1.终点
该研究的一级终点是客观总体缓解率(ORR,由使用RANO 2010标准通过独立放射学评估来确定)。该研究的二级终点包括缓解持续时间(DOR)、6个月无进展生存(PFS)率、PFS、总生存期(OS)和安全性。该研究还具有探索性的终点,包括:1)评估治疗前存档的肿瘤样品的mTOR通路的活性以及与活性/耐受性的相关性(例如,每周癫痫发作次数、生活质量(QOL));2)如果可行的话,进展后的肿瘤生物标志(例如,每周或过程期间的癫痫发作次数,QOL);和3)每周治疗后雷帕霉素的谷水平。
2.评估疗效的标准
对于接受ABI-009与BEV、MRZ或TMZ联合疗法的受试者,肿瘤反应(肿瘤缓解,tumorresponse)(包括完全缓解(CR)、部分缓解(PR)、稳定疾病(SD)或进行性疾病(PD))根据RANO2010标准(包括:放射线缓解率;无进展生存期(PFS)和总生存期(OS)),每2个周期(每8周,在疗法的每个偶数编号周期结束时)用MRI成像进行评估。对于接受ABI-009单一药剂疗法和ABI-009与CCNU联合疗法的受试者,每6周通过MRI成像评估肿瘤反应。
在疾病进展之后,每12周或根据需要更频繁地关注(follow)患者的生存情况,直到死亡、撤回同意书或研究结束,以最早者为准。
一级终点是通过独立放射学审查的ORR,并且被定义为达到根据RANO 2010标准的确定的PR或CR的受试者的比例。使用Kaplan-Meier(KM)分析来总结DOR、6个月时的PFS、中位PFS和OS。总结具有95%CI的四分位数。
3.评估安全性的标准
如果受试者接受至少一剂量的ABI-009,则对其进行安全性分析评估。通过持续报告治疗紧急和与治疗相关的不良事件(AE),具体关注的AE,实验室异常以及由于AE经历剂量调整、剂量延迟/未给予、剂量中断和/或提前终止IP的患者的发生率,来监测安全性和耐受性。从患者签署知情同意书的时刻到最后一次剂量的IP后28天,研究人员记录所有AE。不良事件通过National Cancer Institute(NCI)Common Terminology Criteria forAdverse Events(CTCAE)v4.03分级。
监测身体检查、生命体征、实验室评估(例如血清化学、血液学)和ECOG行为状态。关注所有SAE(无论与IP的关系如何)直至解决。实验室分析将按照研究时间表进行。
所治疗的人群(全分析集)是所有安全性分析的分析人群。不良事件使用医疗活动医学词典(MedDRA)进行编码,并按其系统器官类别和优选项进行分组。总结的表包括具有AE、严重AE、致命AE和其他感兴趣的AE的患者的数量和百分比。
C.患者
仅当满足以下所有标准时,患者才有资格纳入本研究。1.所有受试者必须具有恶性胶质瘤的组织学证据和复发或疾病进展的放射影像证据(定义为最大增强二维产物的大于25%增加——新的增强病变或T2 FLAIR的显著增加)。根据RANO标准(在2个垂直直径中≥10mm),受试者必须具有至少1个可测量的病变。2.受试者必须之前完成标准的放射疗法并已经经受替莫唑胺。3.接受上述任何疗法的受试者均未接受mTOR抑制剂的先前治疗。接受ABI-009和BEV联合疗法的受试者未接受BEV或任何其他抗血管生成剂(包括索拉非尼、舒尼替尼、阿西替尼、帕唑帕尼或西仑吉肽)的先前治疗。接受ABI-009和MRZ联合疗法治疗的受试者未接受MRZ或任何其他蛋白酶体抑制剂(包括硼替佐米(BTZ)、卡非佐米(CFZ)或依沙佐米(IXZ))的任何先前治疗。4.本研究入组之前,距手术切除至少4周,和距放射疗法结束至少12周,除非肿瘤活检或放射领域外新病变证实复发,或如果有两次MRI确认进行性疾病相距约8周。5.卡尔诺夫斯基行为状态(KPS)得分≥70%。6.在首次剂量的研究药物之前的4周内没有研究药剂。7.先前疗法和手术引起的所有AE必须解决为NCI-CTCAE(v.4.03)等级≤1(以下概述的实验室参数除外)。8.足够的血液、肾和肝功能(在研究治疗之前的14天内进行评估),包括:a)中性粒细胞绝对计数≥1.5×10
D.治疗持续时间
该研究从第一位患者入组到最后一位患者随访大约花费32个月,包括大约24个月的入组期、估计的6个月治疗(或直到可接受的毒性或疾病进展)以及在最后一次治疗后4周(+/-7天)的治疗就诊(visit)的结束。
研究结束(EOS)定义为最后一位患者完成研究的最后一次就诊日期,或如协议中预先指定的,从一级、二级和/或探索性分析所需的最后一位患者的最后一个数据点的接收日期二者之一。
将患者的治疗结束(EOT)定义为ABI-009最后一次剂量的日期。患者的治疗就诊结束是在最后一次治疗后进行安全性评估和程序时,其必须在ABI-009的最后一次剂量后至少4周(±7天)进行。
随访期是EOT就诊后的研究时间段。所有中止研究药物且未撤回完全同意参加研究的患者将继续进入生存和开始抗癌治疗的随访阶段。大约每12周(+/-3周)进行随访,直到死亡、撤回同意书或研究结束(以最早的时间为准)。该评估可以通过记录审查和/或电话联系来进行。
E.ABI-009(nab-雷帕霉素)在具有复发性高级神经胶质瘤的贝伐单抗首次实验的患者中的2期开放标签研究。
如下详细讨论的在不同群体(cohort)中的患者使用ABI-009治疗。群体2-4中的患者也使用第二药剂治疗。
1.群体1,100/mg/m
患者1具有4级GBM并且已经历用于ndGBM的完成的手术、标准的TMZ/RT治疗、Optune装置,和用于复发性疾病的手术。患者1用100mg/m
患者2具有4级GBM并且已经历用于ndGBM的完成的手术、标准的TMZ/RT治疗,用于复发性疾病的手术。患者2用100mg/m
患者3具有4级GBM并且已经历用于ndGBM的完成的手术、标准的TMZ/RT治疗和用于复发性疾病的手术。患者3用100mg/m
患者4具有4级GBM并且已经历用于ndGBM的完成的手术、标准的TMZ/RT治疗。患者4没有用于复发性疾病的治疗。患者4用100mg/m
2.群体2,60/mg/m
患者1具有4级GBM并且已经历用于ndGBM的完成的手术和标准的TMZ/RT治疗。患者1没有用于复发性疾病的治疗。患者1用60mg/m
3.群体3,60/mg/m
患者1具有3级间变型少突胶质细胞瘤并且已经历用于新诊断的高级神经胶质瘤(ndHGG)的完成的手术和用于复发性疾病的手术。患者用60mg/m
患者2具有4级GBM并且已经历用于ndGBM的完成的手术和标准的TMZ/RT治疗。患者2没有用于复发性疾病的治疗。患者2用60mg/m
4.群体4,60/mg/m
患者1具有4级GBM并且已经历用于ndGBM的完成的手术和标准的TMZ/RT治疗、Optune装置、马里佐米,和用于复发性疾病的CAR-T细胞免疫疗法。患者1用60mg/m
实施例2:在患有新诊断的胶质母细胞瘤(ndGBM)的患者中Nab-雷帕霉素作为单一药物疗法或与第二药剂组合的用途
如上所述,ABI-009(“nab-雷帕霉素”)是用于注射悬浮液的雷帕霉素蛋白结合的纳米颗粒(白蛋白结合的)。该研究是ABI-009(nab-雷帕霉素)在患有新诊断的恶性胶质瘤的受试者中的2期开放标签研究,旨在评估以下的安全性和活性:1)ABI-009作为单一药剂(参见以下起始治疗),2)ABI-009、替莫唑胺(TMZ)和放射疗法(RT)的组合(请参见伴随治疗(concomitant treatment)),以及3)ABI-009和TMZ的组合。
A.疗法施用
疗法包括三个阶段的治疗:a)起始治疗;b)伴随治疗;和c)辅助治疗。
1.起始治疗
ndGBM的手术切除后3-4周开始起始治疗。对于具有通过MRI检测到的增强肿瘤的受试者,ABI-009以100mg/m
2.伴随治疗
伴随治疗在起始治疗完成后1周开始,并持续6周。ABI-009在每21天周期的第8天和第15天以56mg/m
3.辅助治疗
辅助治疗在伴随治疗完成后4周开始,并将持续24周。ABI-009在每28天周期的第1、第8和第15天以56mg/m
B.评估疗效和安全性的终点和标准
1.终点
该研究的一级终点是客观总体缓解率(ORR,由使用RANO 2010标准通过独立放射学评估来确定)。该研究的二级终点包括PFS、OS和安全性。该研究还具有探索性的终点,包括:1)评估治疗前存档的肿瘤样品的mTOR通路的活性以及与活性/耐受性的相关性(例如,每周癫痫发作次数、生活质量(QOL));2)如果可行的话,进展后的肿瘤生物标志(例如,每周或过程期间中的癫痫发作次数,QOL);和3)每周治疗后雷帕霉素的谷水平。
2.评估疗效的标准
在起始治疗完成后1周,放射疗法完成后4周以及此后每3个月,通过MRI成像评估肿瘤反应。
在疾病进展之后,每12周或根据需要更频繁地关注患者的生存情况,直到死亡、撤回同意书或研究结束,以最早者为准。
一级终点是通过独立放射学审查的ORR,并且被定义为达到根据RANO 2010标准的确定的PR或CR的受试者的比例。使用Kaplan-Meier(KM)分析来总结DOR、6个月时的PFS、中位PFS和OS。总结具有95%CI的四分位数。
3.评估安全性的标准
如果受试者接受至少一剂量的ABI-009,则对其进行安全性分析评估。通过持续报告治疗紧急和与治疗相关的不良事件(AE),具体关注的AE,实验室异常以及由于AE经历剂量调整、剂量延迟/未给予、剂量中断和/或提前终止IP的患者的发生率,来监测安全性和耐受性。从患者签署知情同意书的时刻到最后一次剂量的IP后28天,研究人员记录所有AE。不良事件通过National Cancer Institute(NCI)Common Terminology Criteria forAdverse Events(CTCAE)v4.03分级。
监测身体检查、生命体征、实验室评估(例如血清化学、血液学)和ECOG行为状态。关注所有SAE(无论与IP的关系如何)直至解决。实验室分析将按照研究时间表进行。
所治疗的人群(全分析集)是所有安全性分析的分析人群。不良事件使用医疗活动医学词典(MedDRA)进行编码,并按其系统器官类别和优选项进行分组。总结的表包括具有AE、严重AE、致命AE和其他感兴趣的AE的患者的数量和百分比。
C.患者
仅当满足以下所有标准时,患者才有资格纳入本研究。1.从组织学上证实患者患有新诊断的恶性胶质瘤。2.患者已进行手术,并且在手术后通过MRI检测到可测量的造影后病变。3.之前没有使用mTOR抑制剂治疗,也没有用于GBM的局部或全身疗法。4.卡尔诺夫斯基行为状态(KPS)得分≥70%。5.在首次剂量的研究药物之前的4周内没有研究药剂。6.先前疗法和手术引起的所有AE必须解决为NCI-CTCAE(v.4.03)等级≤1(以下概述的实验室参数除外)。7.足够的血液、肾和肝功能(在研究治疗之前的14天内进行评估),包括:a)中性粒细胞绝对计数≥1.5×10
D.治疗持续时间
该研究从第一位患者入组到最后一位患者随访大约花费24个月,包括大约16个月的入组期、长达的12个月治疗(或直到可接受的毒性或疾病进展)以及在最后一次治疗后4周(+/-7天)的治疗就诊的结束。
研究结束(EOS)定义为最后一位患者完成研究的最后一次就诊日期,或如协议中预先指定的,从一级、二级和/或探索性分析所需的最后一位患者的最后一个数据点的接收日期二者之一。
将患者的治疗结束(EOT)定义为ABI-009最后一次剂量的日期。患者的治疗就诊结束是在最后一次治疗后进行安全性评估和程序时,其必须在ABI-009的最后一次剂量后至少4周(±7天)进行。
随访期是EOT就诊后的研究时间段。所有中止研究药物且未撤回完全同意参加研究的患者将继续进入生存和开始抗癌治疗的随访阶段。大约每12周(+/-3周)进行随访,直到死亡、撤回同意书或研究结束(以最早的时间为准)。该评估可以通过记录审查和/或电话联系来进行。
实施例3:Nab-雷帕霉素在患有手术难治性癫痫的患者中的用途
如上所述,ABI-009(“nab-雷帕霉素”)是用于注射悬浮液的雷帕霉素蛋白结合的纳米颗粒(白蛋白结合的)。这是一项前瞻性、单中心、I期安全性研究,旨在调查患有癫痫手术失败的医学上难治性癫痫的患者中的安全性、耐受性、癫痫发作控制和生活质量。尽管在癫痫手术(旨在治愈的切除手术)后至少3个月,这些患者继续癫痫发作。入组后,患者继续,并观察其先前已有的、临床的处方抗癫痫药(AED)方案,持续1个月。在1个月大关时,在3名患者每个使用标准的3+3剂量探索设计的群体中,患者每周静脉内接受不同剂量水平的ABI-009。ABI-009总共持续24周。然后中止ABI-009,并观察患者另外的3个月。
A.疗法施用
1.ABI-009
对于剂量探索,在3名患者每个使用标准的3+3剂量探索设计的群体中,在每4周周期的第1、8、15和28天,以5mg/m
表1.
在前两个治疗周期(6周)中未观察到DLT后,升级至下一个剂量水平,出现了3名患者的新群体。不允许患者内剂量升级。如果群体中发生DLT,则会招募另外的3名患者至群体。如果没有进一步的DLT发生,则可以入组以下一个更高剂量水平的3名患者的新群体。如果2/6患者在剂量水平1下经历了DLT,则该群体不再进一步入组,而3名患者则以下一个较低的剂量水平入组,依此类推。MTD是其中≤1位患者具有DLT的最高剂量水平。
ABI-009每7天(第1、8、X+7天等)被静脉内施用,持续总共24周。
2.伴随用药
允许用于癫痫的标准疗法,但以下禁用药物部分中注明的治疗除外。对于长时间的癫痫发作事件或阵发性癫痫发作(cluster of seizure),允许使用抢救药物。
在参加试验期间禁止以下药物变化,并且因此将被视为违反协议。1.导致AED方案剂量发生任何变化的疗法,除非仅针对亚治疗水平的AED,如治疗神经病学家确定的。2.在参与期间导致受试者的AED方案中增加或去除AED的疗法,除非医学上必要的并与研究人员讨论。
3.对照
在入组后开始用ABI-009治疗之前,受试者通过继续其先前已有的AED方案1个月,而作为其自己的对照。在治疗时,为了继续进行药物施用,受试者必须在30天之内具有>8次癫痫发作,而不具有2周的无癫痫发作。
B.目标和终点
1.目标
该研究的一级目标如下:1)确定患有手术难治性癫痫的患者的ABI-009的剂量限制性毒性(DLT)和最大耐受剂量(MTD);2)对手术切除失败的医学上难治性癫痫用ABI-009疗法,结合其先前已有的AED方案施用,记录AE并记载其严重程度;3)记录家庭对药物的依从性,并记录自愿或因继发AE而必须退出治疗的患者数目。
二级目标是:1)在开始使用ABI-009结合先前已有的AED方案治疗之后0-4周(基线)至16周和24周,然后在治疗结束后3个月,癫痫发作频率的变化(患者百分比证明≥50%的减少);2)评估在在用ABI-009结合先前已有的AED方案治疗之前、期间和之后,受试者的生活质量指数。
2.终点
一级终点包括下列:1)DLT;2)MTD;3)不良事件的发生率和临床上显著的异常实验室值;4)退出研究的受试者数目;5)遵守规定的ABI-009方案。
二级终点包括:1)癫痫发作频率,表示为每周癫痫发作次数和相对于基线癫痫发作频率的减少百分比二者;2)生活质量和行为指标。
3.患者
仅当满足以下所有标准时,患者才有资格纳入本研究。1.患者在第一次就诊时不超过26岁且不小于三岁。2.患者具有诊断为医学上难治性癫痫的证明文件,其定义为至少有2种适当剂量和耐受的AED无法消除6个月时间段内(癫痫手术之前)的所有临床癫痫发作。3.患者具有在适当术前评估后切除性癫痫手术的证明文件。4.患者具有持续性临床癫痫发作的证明文件,这种癫痫发作在切除性癫痫手术后至少3个月持续。在治疗时,为了继续进行药物施用,患者具有在过去30天内>8的癫痫发作,而不具有2周的无癫痫发作。5.患者具有文件证明:该受试者不是候选人,或拒绝任何额外的切除癫痫手术。6.患者先前未曾使用全身性mTOR抑制剂治疗癫痫。但是,允许与雷帕霉素或依维莫司一起使用护肤霜。7.患者具有足够的骨髓功能(ANC≥1,000/mm
表2.
该表中的肌酐阈值源自Schwartz公式,其用于利用CDC发布的儿童身高和身材数据估算GFR。
D.用ABI-009治疗的具有手术难治性癫痫的患者
参与患者是抗癫痫药难治的,甚至在脑部手术后仍继续癫痫发作。
参与患者具有4周的基线观察期,以获得基线癫痫发作频率和癫痫发作率。在基线期之后,参与者开始分配的ABI-009剂量,每周给予一次,持续共3周,并测量癫痫发作频率和癫痫发作率。根据NCI CTCAE v5记录并报告了任何不良事件。
四名患者同意进行研究。患者3在开始研究之前撤回了同意书,因此有3位患者(患者1、2和4)的数据可用。3位患者每周一次接受在3分钟内通过静脉内推注以5mg/m
疗效结果列于下表。
表3.
表4.
表5.
患者1是患有2A型和2B型脑皮质发育不良的18岁男性。他在基线具有相对较低的癫痫发作率(平均约2次癫痫发作/周)。用ABI-009治疗3周后,未观察到癫痫发作,无癫痫发作天数的百分比从74%增加到100%。
患者2是在左额叶区域内具有脑皮质发育不良的15岁女性。她在基线具有中等的癫痫发作率率(平均约11次癫痫发作/周)。用ABI-009治疗3周后,癫痫发作频率没有降低。
患者4是患有难治性婴儿痉挛和左侧先天性轻偏瘫的12岁男性。他在基线具有高癫痫发作率(平均约24次癫痫发作/周)。用ABI-009治疗3周后,癫痫发作频率降低了75%,并且无癫痫发作天数的百分比从6%增加到71%。
因此,在手术和抗癫痫药物均难治的3名患者中的2名对用ABI-009的治疗响应。目前没有针对这些患者的批准的治疗。
安全性:与药物相关的不良事件为轻度(均为1级),包括天冬氨酸转氨酶增加、嗜酸性粒细胞增多、腹泻、肌痛和血小板计数降低。
实施例4:单次静脉内施用ABI-009后雷帕霉素分布到不同器官
该实施例描述了在啮齿动物中单次静脉内施用ABI-009后雷帕霉素分布到包括脑在内的不同器官。
在该研究中,雌性SD大鼠接受1.7、9.5和17mg/kg的ABI-009的单次静脉内剂量,具有10ml/kg的给药体积。施用后的2、8、24、72和120小时,从以每个ABI-009剂量的3个动物收集全血和器官样本。将全血收集到预先冷却的K2EDTA管中,并储存在-80℃下,而收集脑、心脏、肝脏、肺和胰腺,将其用盐水冲洗以除去血液,分成2部分,在单独标记的管中速冻,并储存在-80℃下。
将所有组织样品称量并以每克组织5ml匀浆溶剂的比例添加溶剂后匀浆,之后进行分析。通过使用50:50的甲醇:硫酸锌通过蛋白沉淀从裂解的全血或组织匀浆中提取雷帕霉素。在提取之前,添加他克莫司作为内标。涡旋混合和离心后,将一部分上清液转移至干净的平板上,并注入使用具有梯度乙酸铵/水/甲酸/乙腈流动相的Synergi Polar-RP柱的LC-MS/MS系统。通过MS-MS监测用Sciex API5000产生的正离子进行检测。
血液、脑、心脏、肝脏、肺和胰腺中雷帕霉素的浓度在图3中列出。
在单次ABI-009静脉内给药后,2小时至24小时之间,血液雷帕霉素水平迅速下降。在这些较早的时间点,随着ABI-009剂量的升高,血液雷帕霉素水平以很大程度上剂量成比例的方式增加。72小时后,血液中仅存在痕量的雷帕霉素,在不同的ABI-009剂量组之间未观察到差异(图1)。
在包括心脏、肝脏、肺和胰腺在内的充分灌注的器官中,雷帕霉素浓度曲线与血液中的浓度曲线相似,具有在较早时间点的高峰,并在2小时至24小时之间的时间迅速下降。与血液相反,在72和120小时后,心脏、肝脏、肺和胰腺中仍然存在显著水平的雷帕霉素,这表明这些器官在ABI-009静脉内施用后很长一段时间可以保持治疗水平的雷帕霉素,并支持ABI-009每周一次或甚至更低频率给药以治疗这些器官中的疾病状况(图1)。在所有时间点,雷帕霉素浓度的器官/血液比率很高,这表明使用ABI-009,雷帕霉素有效地从血液中提取并分布到器官中(图2)。在第2、8和24小时的较早时间点,在充分灌注的器官中,随着ABI-009剂量的升高,雷帕霉素的水平以很大程度上剂量成比例的方式增加。72小时后,在不同的ABI-009剂量组中,这些器官中的雷帕霉素水平相似。
与充分灌注的器官相反,脑中雷帕霉素的浓度在2小时时相对较低,但随时间保持在稳定水平。进入脑的较低的初始分布可能是由于血脑屏障的存在。5天后,与其他器官相比,雷帕霉素在脑中的水平类似或更高,这表明利用ABI-009向脑中实质的和延长的药物分布。随着血液雷帕霉素水平的下降,大多数器官的器官/血液比率随时间增加;然而,脑/血液雷帕霉素浓度比率随时间增加最显著。同样与其他器官相比,随着ABI-009初始剂量的升高,在所有时间点,特别是在72小时和120小时之后,脑中雷帕霉素水平和雷帕霉素水平脑/血液比率也增加。总而言之,单次静脉内ABI-009给药后的脑分布曲线与其他器官显著不同。ABI-009静脉内施用导致在脑中在延长的时间内显著且稳定的雷帕霉素的浓度,其远远超过mTOR抑制剂所需的5-20ng/ml的最低治疗水平。该PK研究的结果强烈支持每周一次甚至更低频率的用ABI-009静脉内施用来治疗脑中不同疾病状况,并证明使用更高的初始ABI-009剂量可以达到脑中更高可持续的雷帕霉素水平。
该研究的出乎意料的发现包括以下内容。
除了显示相当平坦或增加的组织水平的脑外,对于所有器官,雷帕霉素的组织水平在前24小时内都有最初的快速下降。
组织水平的剂量反应仅在前24小时内可见。在72小时及其后的时间里,在除脑外的所有组织中均未观察到剂量反应。
这些数据表明脑在120小时内缓慢地积聚药物,而所有其他组织在24小时后迅速清除药物。
除脑外,所有器官的组织水平均遵循雷帕霉素的血液清除曲线。通过在实验期间观察雷帕霉素的组织/血液比率,进一步证明了这一点。除脑外,所有组织的组织/血液比率在120小时内保持相当恒定。相对而言,脑/血液比率在相同段内增加。
对于120小时观察到的任何器官,雷帕霉素优先积累到脑中,其具有最高的组织提取比率。
在所有时间和所有剂量下,脑中雷帕霉素的组织水平都远高于治疗活性所需的5-20ng/ml(或ng/g)的阈值。
临床前研究表明,其他mTOR抑制剂(依维莫司和替西罗莫司)的脑渗透性差,这限制了它们在治疗脑中疾病状况中的潜在用途。相对而言,ABI-009静脉内施用可以使脑雷帕霉素浓度远高于所需的5-20ng/ml的最低治疗水平。
在施用后120小时(5天)后,脑是唯一显示出针对组织水平的剂量反应的组织。对于所有其他器官,在使用不同的初始ABI-009剂量的72小时后,未观察到雷帕霉素浓度的显著差异。
这些结果也支持,高的ABI-009剂量可能是期望的,以实现对于脑中疾病状况治疗的改善的临床益处。
实施例5:在Sprague Dawley(SD)大鼠中ABI-009皮下和静脉内给药后的药物动力学研究
雌性SD大鼠皮下(即“SC”或“subQ”)或静脉内(IV)接受单剂量的nab-雷帕霉素(ABI-009)。该研究设计在下表6中总结。与盐水对照(载体)相比,在任何时间点在皮下注射部位施用后均未观察到炎症或毒性。
皮下或静脉内注射ABI-009后,在不同时间点测量全血中的雷帕霉素浓度。全血收集的结果如图4-6中所示,并总结在下面的表7和表8中。
令人惊讶地,如在图7和以下表9中总结的,与静脉内施用相比,皮下施用增强了生物利用度,如曲线下总面积(AUC)所指示的。仅0.56mg/kg的ABI-009皮下施用以1/3的静脉内ABI-009(1.7mg/kg)剂量产生了相似的药物暴露。进一步,皮下施用降低了达到的最大浓度(Cmax)并延迟了达到最大浓度的时间(Cmax时间)。随着皮下ABI-009剂量的升高,血液中的雷帕霉素的峰水平和AUC增加。
实施例6:在大鼠中施用后ABI-009的生物分布
在通过ABI-009的皮下(subQ)或静脉内(IV)途径施用后24小时或168小时二者之一时(参见表6的研究设计),从以上实施例5中所述的大鼠中收获组织。施用后24或168小时,雷帕霉素在具体大鼠组织中的浓度在图8(骨髓和脑)、图9(心脏和肺)和图10(肺和胰腺)中表明。
皮下施用途径导致显著分布到所有测试的器官,包括骨髓、脑、心脏、肝脏、肺和胰腺。皮下和静脉内之间的器官分布模式相似,但是以0.56mg/kg剂量的皮下施用能够产生与以1.7mg/kg剂量的静脉内施用相似的组织浓度。在充分灌注的器官(包括心脏、肝脏、肺和胰腺)中,雷帕霉素浓度在24至168小时之间显著下降。然而,脑浓度在24至168小时之间相对稳定。
为了进一步阐明雷帕霉素的脑和血液分布之间的差异,用大鼠进行了进一步的实验。给大鼠皮下施用1.7mg/kg、9.5mg/kg或17mg/kg剂量的单剂量nab-雷帕霉素(ABI-009)。在24、72和120小时处死小鼠,并收集全血和脑组织。在每个样品的每个时间点测量雷帕霉素浓度。如图11所示,观察到脑雷帕霉素水平的剂量依赖性增加。令人惊讶的是,尽管即使在高剂量17mg/kg的情况下,雷帕霉素的血液水平迅速接近基线,但即使在最低剂量下,脑雷帕霉素水平也能在整个120小时内良好保持。
实施例7:在SD大鼠中ABI-009重复皮下给药后的毒理学研究
该研究的目标是评估在SD大鼠中重复ABI-009皮下注射后的总体安全性和在注射部位的局部毒性。观察临床困扰的迹象以确定毒性。通过组织病理学分析了来自注射部位的皮肤样品的炎症和坏死的迹象。
在该研究中使用了十五只体重160-180g的雌性Sprague Dawley(SD)大鼠。将ABI-009溶解在盐水中以制备储备溶液(10mg/ml),然后进一步在HSA 0.9%盐水溶液中稀释以准备皮下用(体积:1.0ml/kg)。
A.研究设计
将大鼠分成5组,每组3只动物。每4天给大鼠称重并按表10中指定的皮下给药,持续4周(7次注射)。
表10:治疗组
SC=皮下注射
每天检查动物的总体毒性的临床迹象,并检查局部注射部位对皮下注射的反应。
在每次注射之前,对接受ABI-009的动物(第3、4和5组)收集全血样品,并分析西罗莫司谷(trough)水平。
所有动物在4周后被安乐死,并通过组织病理学检查来自局部注射部位的皮肤样品的局部毒性迹象。
B.实验程序
1.给药溶液制备
载体对照由0.9%盐水溶液和在0.9%盐水溶液中的HAS组成。基于测试制品ABI-009(制造批次#C345-001,Fisher批次#51394.2)的9∶1的白蛋白:西罗莫司比,HSA溶液的最终浓度为90mg/ml。每个小瓶的ABI-009(C345-001)均含有97.4mg西罗莫司和874mg人白蛋白。从20%Grifols白蛋白储备溶液(200mg/ml)中稀释HSA盐水溶液。
对于ABI-009给药溶液,首先制备10mg/ml的ABI-009储备溶液,然后使用HSA-盐水溶液稀释至给药溶液的所需浓度。将100mg小瓶的ABI-009溶解在10ml的0.9%盐水中以制备10mg/ml的溶液。
通过用0.6ml的HSA-0.9%盐水稀释0.6ml的储备溶液(10mg/ml)来制备5mg/ml的ABI-009溶液,以制备用于第4组的5.0mg/ml的溶液。通过用0.6ml的HSA-0.9%盐水稀释0.3ml的第4组的ABI-009溶液(5.0mg/ml)来制备1.7mg/ml的-009溶液,以制备用于第3组的1.7mg/ml的溶液。
2.给药
将大鼠麻醉、称重并根据表11通过每4天皮下(SC)注射施用ABI-009溶液、HSA溶液和盐水,持续4周(7次注射)。
表11.给药体积
每天一次检查大鼠的总毒性的临床迹象以及局部注射部位对皮下注射的反应。观察临床困扰的迹象以确定毒性。竖毛、体重减轻、嗜睡、排泄、神经系统症状、发病率、注射部位发红和发炎、以及任何其他被认为动物行为异常的迹象。在SC注射之前和之后,为所有大鼠的注射部位拍摄照片。
3.样品收集与分析
对于用ABI-009治疗的大鼠(第3组、4和5),在每次施用之前将大鼠麻醉并流血取样至预冷的K2EDTA管中(第一剂量除外)。收集全血,将其储存在-80℃下的标记的Eppendorf管中,并分析西罗莫司谷浓度。
所有动物在第29天(第4周第25天ABI-009施用后96小时)的最终安乐死时间点处进行安乐死。在最后的安乐死时间点,收集全血样品以分析西罗莫司谷水平。收集脑、肺、肝脏、心脏、胰腺和骨髓,将其用盐水冲洗以除去血液,分成两部分,并在单独标记的试管中速冻,并且储存在-80℃下。将来自ABI-009治疗组(第3组、4和5)的冷冻血液样品在干冰上运送到BASi。西罗莫司谷血液水平通过LC/MS/MS法由BASi分析。
在最终的安乐死时间点,切除SC施用区域的皮肤和真皮下层用于通过H&E染色的组织学分析,以通过组织病理学分析炎症迹象。对十五份福尔马林固定的大鼠皮肤样品进行组织病理学测量并常规处理。从每个块切下一张切片,并用苏木精和依红(H&E)染色。切片由职业认证的兽医病理学家使用光学显微镜进行评估。组织学病变按严重性分级为0-5(0=不存在/正常、1=最小、2=轻度、3=中度、4=明显、5=严重)。通过t检验分析不同组的平均得分。
C.结果
1.全身毒性
每天观察临床困扰的迹象以确定毒性。竖毛、体重减轻、嗜睡、排泄、神经系统症状、发病率、注射部位发红和发炎,以及任何其他被认为动物行为异常的迹象。在目前的剂量方案(1.7-10mg/kg,7次剂量)下,在盐水、HSA和ABI-009给药后大鼠正常,在研究期间未观察到临床压力的迹象。
没有体重减轻(<20%),并且在研究期间所有治疗组均增加了体重(表12)。结果表明,大鼠耐受1.7-10.0mg/kg的剂量范围内的皮下注射ABI-009。
表12.治疗对大鼠体重的影响
2.局部毒性
来自皮下施用区域的十五个福尔马林固定的大鼠皮肤样品经受组织病理学测量。皮肤样品中的组织病理学发现包括血管周区中坏死和混合炎症细胞浸润;在皮下组织/皮下层中均观察到病变。
坏死是局灶性的,并且其特征在于正常细胞的丢失、嗜中性粒细胞浸润、出血和血纤蛋白渗出的区域,具有可变的邻近的纤维组织形成。仅在以5mg/kg(第4组,1只动物具有最少坏死)和10mg/kg(第5组,所有3只动物具有轻度到明显坏死)剂量水平的ABI-009治疗的动物的样品中观察到坏死,而盐水(第1组)、HSA(第2组)和1.7mg/kg的ABI-009(第3组)没有造成坏死。参见表13和图12。仅10mg/kg的最高剂量的ABI-009与HSA组相比显示出显著增加的坏死得分(P=0.02,t检验)。
表13.治疗对大鼠体重的影响
在表皮下血管周区中的混合炎症细胞浸润的特征在于淋巴细胞、浆细胞、巨噬细胞、偶发的多核巨细胞和可变数目的嗜中性粒细胞的浸润和聚集。在所有治疗组中均观察到混合炎症细胞浸润,其中在用HSA(第2组)和以10mg/kg的ABI-009治疗的动物(第5组)中,平均得分最高。对于1.7mg/kg的低剂量ABI-009注射(第3组),平均得分与接受盐水注射的对照组(第1组)相似。参见表13和图12。在HSA组(第2组)中观察到的与盐水对照相比(P=0.01,t检验)的高混合炎症细胞浸润表明局部炎症很大程度上是由注射异蛋白(heteroprotein)人血清白蛋白引起的。
每组中大鼠的代表性组织学图像显示在图13-17中。
对于ABI-009治疗组,随着ABI-009剂量的增加,局部毒性剂量相关的增加。在1.7mg/kg的最低剂量的ABI-009下,局部注射部位的组织学与盐水对照组相似;而在以10mg/kg的剂量水平的ABI-009治疗的动物中,坏死和皮下组织炎性细胞浸润最为严重。
3.西罗莫司谷血液水平
在每次注射之前(在第5、9、13、17、21、25、29天)对用ABI-009治疗的组收集的西罗莫司谷血液样品(第1天的第一剂量除外),并通过BASi使用LC/MS/MS方法进行分析。单个谷水平在表14中显示。皮下注射后4天,大多数西罗莫司谷血液水平始终在2-20ng/ml的范围内。10mg/kg的ABI-009组(第5组)中的两个样品明显是异常值。这种观察的原因无法确定。但是,异常高的谷水平仅发生在最高ABI-009剂量组中,该剂量组在皮下组织中也显示出轻度至明显的坏死,这表明皮肤病变可能会阻碍ABI-009的正常吸收并导致延长的药物保留。
表14.西罗莫司谷血液水平
对于每个ABI-009治疗组,在研究持续时间中没有显著的药物积累,因为西罗莫司谷血液水平大体上保持稳定。随着ABI-009剂量的增加,西罗莫司平均谷血液水平剂量依赖性的增加。与1.7mg/kg的ABI-009组相比,在5mg/kg的ABI-009组(P=0.06)和10mg/kg的组(P=0.01)中观察到更高的谷水平(图18)。
总之,在当前剂量方案(1.7-10mg/kg,7次剂量)下,大鼠在ABI-009给药后正常,在研究期间未观察到体重减轻。组织病理学结果表明剂量相关的局部毒性迹象,在最高的ABI-009剂量(10mg/kg)下具有轻度至明显的坏死。混合炎症细胞浸润可能是由异蛋白HSA引起的。1.7mg/kg(溶液浓度1.7mg/ml)的ABI-009显示出类似于盐水对照的局部注射反应。重复皮下注射后没有显著的药物积累。随着ABI-009剂量的升高,西罗莫司谷血液水平增加。
结果显示,大鼠全身性耐受皮下注射在1.7-10.0mg/kg的范围内的多剂量的ABI-009。在局部上,对1.7mg/ml浓度的ABI-009溶液良好耐受。对于该剂量水平没有观察到不良作用。
- 通过mTOR抑制剂和白蛋白的纳米颗粒的施用治疗中枢神经系统障碍的方法
- 皮下施用包含mTOR抑制剂和白蛋白的纳米颗粒以治疗疾病
