桑黄菌激光脉冲强光联合诱变菌株及其超声强化发酵方法
文献发布时间:2023-06-19 09:46:20
技术领域
本发明属于食品加工技术领域,特别涉及桑黄菌激光脉冲强光联合诱变菌株及其超声强化发酵方法。
背景技术
桑黄菌作为我国稀有大型真菌,具有明显的药用价值,并广泛应用于韩国、日本。桑黄的药用特性最早记载于《本草纲目》中,自古就有“如果得到附着在桑树上的黄色疙瘩,死人也可以复活”的说法,现代药理学研究证明桑黄菌具有多种药理作用。研究指出桑黄菌多糖、黄酮、粗三萜类化合物具有多种生物活性。近些年来桑黄的研究备受关注。尤其是桑黄菌多糖具有明显的抗肿瘤、抗癌等功效,同时具有明显的抗氧化、免疫调节等活性。但桑黄菌本身的生物学特性决定了桑黄菌在自然及人工栽培的条件下生长速度缓慢,因此很难满足医药需求;相关研究指出桑黄菌发酵菌丝体较子实体含有丰富的多糖、黄酮和多种有益矿物元素,并指出发酵菌粉同样具有开发价值。因此通过工业发酵获得桑黄菌菌丝体,是获取更多资源的途径之一。因此,通过研究桑黄菌液态深层培养条件来开发一种新颖,高效同时获得桑黄菌多糖和黄酮产物的方法成为备受关注的课题。
近年来,高强度超声波作为一种经济、简单、有效的工业手段经常被用来提高活细胞生物产量和以及代谢酶和一些次级代谢产物的量。有研究表明超声处理在促进细菌、真菌和植物培养过程中产生有价值产物起着重要的作用。本课题组曾经开展过利用超声波强化桑黄菌发酵,提高多糖产量的研究(张赫男.桑黄菌的物理诱变及其超声辅助发酵研究.江苏大学博士学位论文,2014)。研究结果表明,在发酵第3.8天、超声时间65min的条件下,多糖产量值为1.8g/L。但是这个方案没有考虑黄酮产量提升促进的问题。迄今为止通过利用超声波同时提高桑黄菌菌丝发酵胞内多糖和黄酮产量的文章或专利尚未见报道。
发明内容
本发明的目的是提供桑黄菌激光脉冲强光联合诱变菌株及其超声强化发酵方法。
实现本发明的技术如下:
为实现上述目的,本发明采取的技术方案为:
桑黄菌激光脉冲强光联合诱变菌株及其超声强化发酵方法按照下述步骤进行:
在桑黄菌菌株(Phellinus igniarius JQ9)接种后,在26℃下进行发酵,总发酵时间是10天。第一段超声处理的目的是提高多糖的产量,处理条件为:在发酵的第2~6天施加超声波,每天施加2次,共处理5天,每次施加时长15min、超声频率为(20+40)kHz双频组合、超声功率密度40W/L、超声波间歇比为10:3;第二阶超声处理的目的是提高黄酮的产量,处理条件为:在发酵的第7~9天施加超声波,每天施加超声1次,共处理3天;每次时长10min,频率组合(20+40)kHz、功率密度120W/L、间歇比10:7。结束发酵后,对发酵液中的菌丝体、菌丝体多糖和黄酮分别进行提取与分析检测。
上述桑黄菌菌株(Phellinus igniarius JQ9),保藏编号:CGMCC NO.17078;保藏单位:中国微生物菌种保藏管理委员会普通微生物中心;保藏地址:北京市朝阳区北辰西路1号院3号;保藏日期:2019年3月6日;建议的分类命名为:鲍氏针层孔菌Inonotus baumii。
本发明的优点,表现在:
(1)与原始菌株比较,诱变菌株JQ9发酵菌丝体产量提高了46.6%,菌丝体多糖、黄酮、多酚和三萜的产量分别提高了27.17%、68.18%、60.73%和3.6%。
(2)两段式超声波强化,兼顾了多糖和黄酮两种活性成分产量和含量的提升。与无超声比较,多糖和黄酮的产量分别提高了15.86%和45.04%,菌丝体多糖和黄酮的含量分别提高了25.15%和56.68%。
附图说明
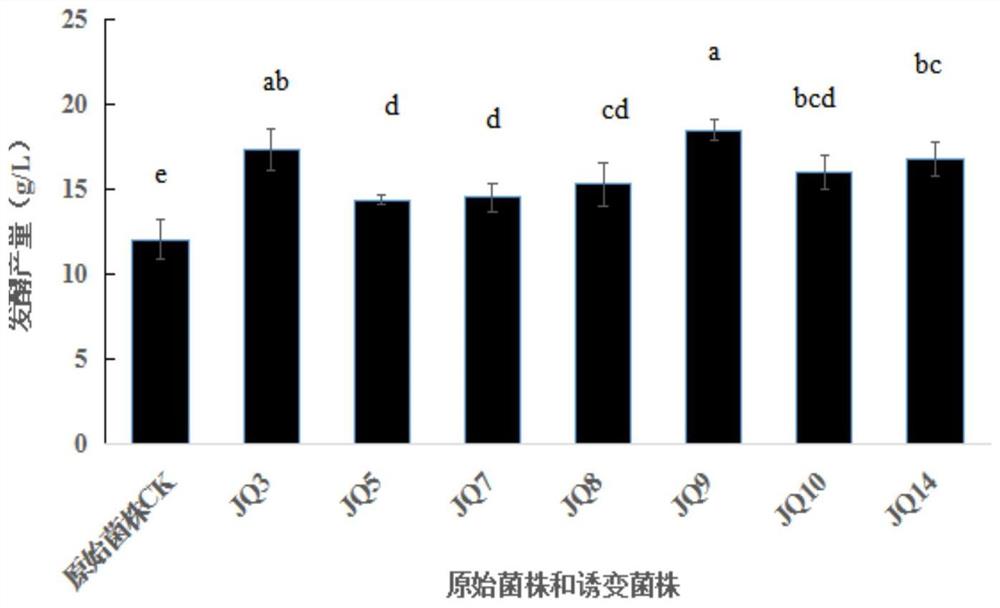
图1筛选诱变菌株和原始菌株的摇瓶发酵菌丝体产量。
图2为原始发菌株和诱变菌株菌丝体显微镜观察。
图3为诱变菌株JQ9系统进化树分析。
图4为诱变菌株JQ9和原始菌株之间的拮抗现象。
图5为诱变菌株和原始菌株之前的同工酶电泳分析。
图6为诱变菌株JQ9和原始菌株RAPD快速扩增。
具体实施方式
本发明桑黄菌菌株(Phellinus igniarius JQ9),保藏编号:CGMCC NO.17078;保藏单位:中国微生物菌种保藏管理委员会普通微生物中心;保藏地址:北京市朝阳区北辰西路1号院3号;保藏日期:2019年3月6日;建议的分类命名为:鲍氏针层孔菌Inonotusbaumii。
上述菌株是通过采用He-Ne激光-脉冲强光联合处理桑黄菌原生质体,利用含有愈创木酚的甘露醇突变体筛选平板上进行初步筛选,经过5代的初筛及5代传代复筛最终获得的,诱变和筛选过程,按照以下步骤进行:
步骤一:
原生质体的制备与诱变:(Phellinus igniarius)购自中国普通微生物菌种保藏管理中心,菌株编号为CGMCC NO.5.95。
1.1菌株活化及培养:
将斜面保藏的原始菌株(附图中CK)(Phellinus igniarius,购自中国普通微生物菌种保藏管理中心,菌株编号为CGMCC NO.5.95)接种在含有桑枝粉的PDA培养基的平板上进行培养,当菌株生长7d后待用;取改良PDA平板上生长旺盛的菌丝块(5mm×5mm)5块,接种在容量为250mL的包含有100mL的种子培养基的三角瓶中,26℃恒温静止培养10天。
1.2原生质体的制备:
种子培养液经过4℃低温高速离心机离心,10000×g,10min,获得桑黄菌菌丝体,再用无菌蒸馏水将菌丝体清洗3遍,4℃,10000×g离心10min,目的是为除去菌丝体表面的培养基。用无菌滤纸将洗涤好的菌丝体表面水分吸去。取0.4g湿菌丝体于1.5mL灭菌EP管中,加入1mL混合酶解液(经0.22μm细菌过滤器过滤除菌)(酶解液包含有1%溶壁酶和0.25%崩溃酶和终浓度为0.6mol/L的甘露醇作为渗透压稳定剂),30℃,120r/min恒温振荡,酶解3h。用G-3砂心漏斗过滤,将收集的滤液在4℃、3500r/min条件下离心10min,弃上清,沉淀用0.6mol/L的甘露醇洗涤2-3次,得到纯化的原生质体。
1.3原生质体的诱变:
原生质体的制备按照上述方法,并用血球计数板计数将原生质体稀释至1×10
步骤二:诱变菌株的筛选
2.1诱变菌株的初筛:
取He-Ne激光联合脉冲强光处理后的菌液100μL均匀涂布于含有愈创木酚的再生培养基上,于26℃培养箱中培养10d后,诱变菌株再生出来,挑取菌落较大的,菌丝密集的诱变菌株,且漆酶颜色较深的诱变菌株作为第一代,转接到普通PDA培养基上并依次进行5代传代筛选(15d/代),测定5代后长势较好的菌株测定发酵菌丝体产量,用1mL无菌枪头定量接种5-6块于100mL液体培养基内,种子培养10d,取10%接种量接种到发酵培养基中,培养8d,菌丝体清洗过滤冻干,测定其摇瓶生物量。拮抗现象明显的发酵产量如图1所示:
2.2诱变菌株的复筛:
选取初筛获得的诱变菌株,一次经过5次传代拮抗实验,15d/代,最终选出性状稳定的稳定的菌株。
步骤三:诱变菌株的鉴定
3.1形态学鉴定
菌落生长缓慢,菌落边缘全缘或轻微锯齿状。菌落颜色由白色到微带奶油黄色、黄褐色、蜜黄色。边缘绒毛状、酥松,较老的部位为毡状,菌丝致密。菌落扁平,无明显纹饰,在培养基上微凸起,高度1-4mm;生长新区反面无变化,老区反面奶油黄色到黄褐色。生长新区无渗出物,老区部分菌落有少量褐色液滴渗出。
菌丝具有生殖菌丝和骨架菌丝。气生菌丝多为骨架菌丝,分枝稀少、黄色。基内菌丝为生殖菌丝,透明多分枝,无分隔。生长老区的菌丝呈纤维状,壁明显加厚,黄色,很多菌丝紧密规则地排列在一起,形成束状结构。部分生殖菌丝上观察到锁状联合的现象。
诱变菌株的形态学性状同原始菌株,结果如图2所示。
3.2分子生物学鉴定
采用大型真菌DNA提取试剂盒法提取诱变菌株JQ9的全基因组DNA,并验证提取DNA的纯度OD260/OD280>1.70。选定文献中设计的引物,ITS-PF:AGTCGTAACAAGGTTTCCGTA;ITS-PR:TCCTCCGCTTATTGATATGC。
RAPD-PCR扩增条件:
扩增后进行电泳分析,确定为单一条带后送至上海生工进行测序,系统进化树运用MEGA7进行系统发育分析和进化树构建,以Kimura 2-parameter模型计算遗传距离,所有对位排列结果中的空位或缺失数据作完全删除处理。用NJ构建进化树,进行1000次自展抽值检验分子进化树可靠性。结果如图3所示。3.3拮抗试验:
拮抗试验是一种快速鉴定菌株遗传差异的方法,不仅可以用来确定不同种之间的关系,也可以用来鉴定同种的菌株是否产生了变异。结果如图4所示,诱变菌株与原始菌株产生了明显的拮抗现象,从菌丝形态方面证实了菌株的遗传物质发生了改变。
3.4同工酶电泳:
将筛选到的突变体菌株和原始菌株(CK)进行菌丝体摇瓶发酵,获得足量菌丝体,无菌蒸馏水反复洗涤3次,高速离心10000×g,15min获得表面洁净的菌丝体,储存于-20℃冰箱以备提取蛋白。取1g同株菌丝体加入液氮于干净的研钵中研磨20min。研磨好的菌丝体粉末加入2mL蛋白提取缓冲溶液(0.065mol/L Tris-柠檬酸,pH8.2),然后将混合液转移至1.5mL无菌EP管中。4℃高速冷冻离心10,000×g,10min。上清液分装到1.5mL无菌EP管,储存在-70℃冰箱用于同工酶分析。在4℃下进行非变性凝胶垂直电泳,其类似于SDS-PAGE,不同在于凝胶中没有SDS和β-巯基乙醇,而蛋白样品也没有进行热水浴蛋白变性处理。酯酶(EST;EC 3.1.1.1)同工酶分析,凝胶组分为10%的分离胶和4%的浓缩胶,缓冲溶液中含有0.2%的甘氨酸和0.62%的Tris。蛋白电泳稳压100V,5h结束。过氧化氢酶(CAT;EC1.11.1.6)同工酶,凝胶组分为7.5%的分离胶和4%的浓缩胶,缓冲溶液中含有14.11%的甘氨酸和3%的Tris。蛋白电泳稳压100V,3h结束。对凝胶进行染色。
其中凝胶染色剂配制如下:
1)酯酶同工酶凝胶染色剂:
称取醋酸-α-萘酯、坚牢蓝、醋酸-β-萘酯分别为50mg,100mg和50mg。各加5mL丙酮溶解,溶解后将溶液混合100mL的0.1mol/L磷酸盐缓冲液(pH6.4)中,充分混匀,该染色剂要现用现配。
2)过氧化物酶同工酶凝胶染色剂:
5%EDTA-Na溶液:称取5g EDTA-Na,加入dd水进行溶解,用NaOH溶液调整pH值约为6.0,至终体积为100mL。
4%氯化铵溶液:称取4g NH
0.3%H
联苯胺溶液:称取2g联苯胺,加入15mL冰醋酸高温溶解,加dd水定容至100mL,溶液现用现配。
最后将上面配好的溶液各取10mL加dd水混匀后定容至100mL以备染色。
结果如图5所示,挑取的诱变菌株和原始菌株酯酶同工酶和过氧化氢酶具有一定的差异,也表明诱变菌株与原始菌株之间具有一定的差异。
3.5RAPD随机引物扩增:
采用大型真菌DNA提取试剂盒法提取出发菌株和诱变菌株的DNA,并验证提取DNA的纯度OD260/OD280>1.70。从16条引物中筛选出稳定性较好,可以反应菌株之间差异的引物S17:AGGGAACGAG;S48:GTGTGCCCCA;S60:ACCCGGTCAC。
RAPD-PCR扩增体系:
RAPD-PCR扩增条件:
具体条带差异的结果如图3所示。图6可以看出,诱变菌株JQ9与原始菌株在S17、S48和S60引物下的电泳条带具有较为明显的差异,出现了条带消失以及增加的现象,电泳结果证明诱变菌株JQ9和出发菌株在分子水平具有一定差异,遗传物质发生了变化。
步骤四:活性成分的测定
4.1多糖含量的测定:采用总糖含量减还原糖的方法进行测定。
(1)总糖测定:方法采用苯酚硫酸法进行测定。
样品的提取:准确称取样品0.1g,将样品小心倒入250mL磨口锥形瓶中,加50mL水和15mL浓盐酸。装上冷凝回流装置,于100℃水浴中水解3h。冷却至室温后过滤。再用蒸馏水洗涤滤渣,合并滤液及洗液,用水定容至250mL,此溶液即为试样总糖测试液。
标准曲线及样品的测定:分别吸取0、0.2、0.4、0.6、0.8、1.0mL的0.1mg/mL的葡萄糖标准溶液至10mL具塞试管中,用蒸馏水补至1.0mL。向试管中加入1.0mL 5%苯酚溶液,然后快速加入5.0mL浓硫酸,反应静止放置10min。使用旋涡振荡器使反应液混合,然后将试管放置于30℃水浴锅中反应20min。取适量反应液于分光光度计490nm处测定吸光度值。准确吸取测试样品0.1mL于具塞试管中,用蒸馏水补至1.0mL,按照总糖标准曲线绘制方法操作,以空白溶液调零,测吸光度值,按照标准曲线测定总糖含量。
(2)还原糖的测定采用DNS方法。
样品的提取:准确称取样品0.25g,放入100mL烧杯中,然后加入50mL蒸馏水,摇匀,置于70℃水浴总保温20min,使还原糖全部浸出,取出冷却后过滤,沉淀用20mL蒸馏水再洗1次,过滤,将2次滤液合并至100mL容量瓶中,用蒸馏水定容至刻度,混匀。次溶液即为试样还原糖测试液。
标准曲线及样品测定:分别吸取0、0.2、0.4、0.6、0.8、1.0、1.2mL,0.1mg/mL葡萄糖标准溶液至25mL具塞试管中,用蒸馏水补至3mL,再向试管中加入1.5mL,3,5-二硝基水杨酸(DNS)试剂。然后将试管摇匀,在沸水浴中准确加热5min,取出,冷却至室温,用蒸馏水定溶至25mL,加塞后颠倒混匀,于分光光度计上540nm测定吸光度值。准确吸取试样还原糖测试液3mL于具塞试管中,按照标准曲线的绘制方法操作,以空白溶液调零,测定吸光度值,测定样品还原糖含量。
4.2粗多酚含量采用福林酚法进行测定:
样品多酚的提取:采用国标的方法进行提取。称取样品0.1g,于10mL离心管中,加入在70℃中预热过的70%的甲醇溶液5mL,用玻璃棒充分搅拌均匀,立即移入70℃水浴中,浸提10min,隔5min搅拌一次,浸提后冷却至室温,转入离心机在3500r/min转速下离心10min,将上清液转移至10mL容量瓶。残渣再用5mL的70%甲醇溶液提取一次,重复以上操作。合并提取液定容至10mL,摇匀,过0.45μm膜,待用。
标准曲线及样品的测定:分别吸取没食子酸标准溶液(100μg/mL)0.1mL、0.2mL、0.4mL、0.6mL、0.8mL、1.0mL,水(空白),于15mL离心管中,用水补充至1.0mL,每个试管内加入5.0mL福林酚试剂(10%),摇匀。反应3-8min内,加入4.0mL 7.5%Na
4.3粗三萜类化合物的测定采用香草醛-冰醋酸的方法:
样品三萜类化合物的提取:粉碎机将冻干的菌丝体粉碎,过60目筛,称取0.1g,菌丝粉置于10mL离心管中,加入100%无水乙醇5mL,混匀后,75℃恒温水浴浸提120min,取出,冷却15min,5000r/min离心15min,上清液待测。
标准曲线及样品的测定:分别吸取齐墩果酸标准溶液(1mg/mL)40μL、60μL、80μL100μL、120μL、140μL、160μL、180μL、200μL于25mL具塞试管中,用乙醇补至1mL,80℃水浴蒸干,再加5%香草醛-冰醋酸溶液0.3mL,高氯酸1.0mL,混匀后,60℃水浴15min,取出,冰水浴冷却15min,加冰醋酸10mL,于548nm测定吸光度值。
4.4黄酮类化合物的测定,方法采用NaNO
样品黄酮的提取:称取0.5g桑黄菌菌粉,加入10倍体积的70%乙醇,室温浸泡12h,离心倒出上清溶液,残渣用相同浓度和体积的乙醇再浸泡12h,3500r/min离心15min合并提取液,待测定。
标准曲线及样品的测定:精密量取标准溶液各0、0.1、0.2、0.5、1、2、3、4、5、6mL,置于25mL容量瓶中,分别加入60%乙醇溶液至10mL,再依次加入1mL 5%亚硝酸钠溶液,摇匀,放置6min后,加入1mL 10%硝酸铝溶液,摇匀,放置6min再加入4%NaOH溶液1mL,再加60%乙醇定溶,摇匀,15min静止反应后,在500nm处测定吸光度值,制作标准曲线。吸取6mL样品,用60%乙醇溶液定容至10mL,测定步骤同标准曲线。
原始菌株和诱变菌株活性物质含量及产量比较如表1所示。由图1和表1可以看出,诱变菌株JQ9发酵菌丝体产量提高了46.6%,菌丝体多糖、黄酮、多酚和三萜的产量分别提高了27.17%、68.18%、60.73%和3.6%。
表1原始菌株和诱变菌株活性物质含量及产量
本发明提高桑黄菌菌丝胞内多糖和黄酮产量的两段式超声波强化液体发酵方法,按照下述步骤进行:
(1)培养基及桑黄菌菌丝体培养条件
桑黄菌菌株(Phellinus igniarius JQ9),接种在无菌PDA斜面(PDA培养基配方:马铃薯浸1000mL,葡萄糖20g,琼脂20g,pH自然)上26℃培养,一周后将从斜面上切除5块大约为5×5mm的菌丝,并接种于250mL的三角烧瓶中,其中含有100mL无菌种子培养基(PDA液体培养基配方:马铃薯浸1000mL,葡萄糖20g,pH自然),摇床转速为130转/分钟,26℃培养8d后利用均质器使培养液中菌丝球分散均匀作为种子液。将种子培养液按10%(v/v)接种量接种至含有100ml无菌发酵培养基的250mL三角烧瓶中,发酵培养基的组成成分(g/L)如下:小麦粉(50),麸皮(15),桑枝粉(10),KH
(1)。三角烧瓶置于摇床上130转/分钟,26℃培养并进行超声波处理(超声波处理条件,见实施例1)。
(2)分析检测
发酵结束后,菌丝通过离心(5000转,10min)收集,并用蒸馏水洗涤两次后冷冻干燥。干燥菌丝体研磨成粉末。多糖和黄酮提取分析的步骤如下:
多糖的提取和测定方法步骤为:多糖提取采用传统热水提取法,称取超声波处理后的冻干样品0.1g,按照1:20的比例90℃热水提取2h,4000r/min离心20min后取上清,重复提取2次后,合并三次提取的上清,按照比例1:4(v/v)溶剂比例加入95%乙醇进行醇沉,4℃冰箱静止过夜后离心,除去上清液,挥发干样品中残留乙醇后用加入适当蒸馏水溶解后,采用苯酚硫酸法测定多糖含量。黄酮的提取和测定方法步骤为:黄酮提取测定方法采用AlNO
对比实施例1:
对比实施例1是以提升多糖产量为目标的单段强化超声波辅助发酵。发酵温度26℃,发酵总时间10d,施加超声时段在发酵的第2~6五天、每天施加2次,每次施加时长15min、超声频率为(20+40)kHz双频组合、超声功率密度40W/L,超声波间歇比为10:3。同时进行无超声的对照试验。测定结果如表2所示,桑黄菌发酵菌丝体多糖含量及多糖发酵产量比对照分别提高22.65%和18.89%。
对比实施例2:
对比实施例2是以提升黄酮产量为目标的单段强化超声波辅助发酵。发酵温度26℃,发酵总时间10d,在发酵的第7~9三天施加超声波、每天施加超声1次、每次时长10min,超声功率密度120W/L、频率组合(20+40)kHz、间歇比10:7。同时进行无超声的对照试验。测定结果如表2所示,桑黄菌发酵菌丝体黄酮含量及黄酮发酵产量比对照分别提高63.54%和69.84%。
实施例1:
发酵温度26℃,发酵总时间10d。第一阶段超声处理条件同对比实施例1,即施加超声时段在发酵的第2~6天,每天施加2次,每次施加时长15min,超声频率为(20+40)kHz双频组合,超声功率密度40W/L,超声波间歇比为10:3;第二阶段超声处理条件同对比实施例2,即在发酵的第7~9天施加超声波,每天施加超声1次,每次时长10min,超声功率密度120W/L,频率组合(20+40)kHz、间歇比10:7。同时进行无超声的对照试验。测定结果如表2所示,菌丝体多糖和黄酮的含量分别提高了25.15%、56.68%;多糖和黄酮的产量分别提高了15.86%、45.04%。
表2不同超声发酵工艺对桑黄菌发酵产物中多糖和黄酮合成量影响结果
- 桑黄菌激光脉冲强光联合诱变菌株及其超声强化发酵方法
- 桑黄菌激光脉冲强光联合诱变菌株及其超声强化发酵方法
