使用含CO2的工业气体生产富集甲烷的气体组合物的方法
文献发布时间:2023-06-19 12:07:15
技术领域
本发明涉及一种使用含二氧化碳的排放物和/或废气来生产生物源甲烷的方法。
背景技术
在全世界范围内,从欧洲委员会,美国商业团体与环境和政府协会,在福岛灾难事件的善后中企图用核能代替电力供应的日本,到七个新兴经济体,以较低的环境成本寻求高效的能源供应解决方案是气候行动计划所提出的挑战,因此,成员国在全球范围内为应对气候变化并最终稳定地球温度做出了努力。最终目标是满足对可持续和可再生能源的日益增长的需求,同时应对气候变化向低碳现代经济过渡。
制定可行的法律和技术措施以有效减少对化石燃料的需求还将帮助成员国遵守共同商定的2020年、2030年和最终2050年的能源和气候指标以及各自框架和政策内更广泛的能源联盟目标。因而,很明显,无论是发现、设计或从现有能源中选择哪种能源,以有效解决能源需求,该能源也都应该充分解决降低环境影响的要求。
在化石燃料中,甲烷每个碳原子的能量密度最高,并且其能量转换的潜力远大于任何其他天然气,通过在氧气存在下燃烧或使用燃料电池发电而直接获得。作为化石燃料的甲烷源自产甲烷微生物的代谢活动,所述产甲烷微生物在深海中或地壳深处将二氧化碳以及其他气体和底物转化为甲烷:这种类型的来自地质渗流和自然活动的甲烷占天然气的很大一部分;然而,根据最近对全球化石燃料甲烷排放量的向上修正,大气中存在的甲烷中有相当大一部分是人为衍生物,并且由于农业、养牛业、垃圾填埋场和废物降解,以及煤炭开采或石油钻探,以及化石燃料工业操作的一般化石燃料处理、运输、提炼和燃烧,而释放到大气中。
在20年的时间跨度内,以摩尔计,甲烷的储热/捕集能力是二氧化碳的38倍(McAnulty等人,2017)。
由于甲烷的储热能力,它极大地促进了温室效应。就能量产量而言,使用甲烷作为燃料非常方便,并且其燃烧产生的碳足迹较低(少量的通常可重复使用的CO
因此,作为天然气,甲烷是一种可持续且可再生的能源,并且如今已经越来越多地取代煤炭和其他化石燃料。然而,还没有完成对环境影响大幅降低及其生产、储存和运输的可行性的附带要求。
大规模开采甲烷的主要技术缺点之一与例如天然气甲烷中残留的大量污染物有关,因此需要昂贵的纯化程序。此外,还有一长串尚待解决的问题,例如需要有足够的甲烷储存设备,对更好的加压密封系统的相关需求,大量气体(主要是天然气中富含硫的污染物)产生的气味,爆炸的风险,运输和储存期间的泄漏,以及最先进技术生产的可扩展性的相对低效,所有这些目前都阻碍并延迟了甲烷的开采。
尽管如此,甲烷在能源生产方面的潜力在全球市场上变得越来越重要。
因此,最近的研究集中在开发和改进用产甲烷菌(例如古菌)生产甲烷的方法,其能够非常有效地从二氧化碳和氢气产生甲烷。目前,最先进技术描述了通过使用产甲烷微生物产生的甲烷来富集气体组合物的若干尝试。
这种类型的甲烷生产发生在合适的反应器/单元中,并且在全世界范围内在任何基础设施匮乏的情形下都可容易地建立,其需要通常存在于大气中的原料。最重要的是,它通常产生富集甲烷和较少量污染物的气体组合物,其中预计此类组合物在准备供入能量供应系统之前所需的工作量较小。此外,在化石燃料中,甲烷转化为能量(仅产生二氧化碳和水)是最清洁的。
例如在WO 2014016815 A2中已经描述了一些尝试,其中通过在水性生长基质中提供并在高温下培养的厌氧古菌培养产生甲烷导致生成气体组合物中约20体积%的甲烷。一些高度专用的厌氧产甲烷菌可在优化的高压和高温下提供在这种气体组合物中甚至高达30体积%的甲烷。这种工艺的特征在于使用用于产甲烷菌的加压水性生长基质和含有二氧化碳作为进料源的高压流体。除了相对较低的甲烷生产率之外,由于加热和/或加压专用的产甲烷古菌的培养物需要大量的能量输入,因此这种工艺远非具成本效益的。另外,加压容器的利用严重阻碍了所述方法的可扩展性和大量推广。
US 2011/0165667 A1描述了含有一种或多种厌氧古菌物种或甚至其混合物的水性悬浮液用于生产甲烷的进一步用途。应注意的是,本文所述的工艺的特征在于将纯H
尽管可证明产甲烷古菌在暴露于这些气体组分后仍幸存并最终恢复了甲烷产生,但这些结果表明,为了满足将甲烷供入标准气体分配网的高标准甲烷生产,需要仅含H
作为在这方面的进一步发展,US 2014/0377830 A1描述了关于非严格无氧环境中的专用的产甲烷古菌的先前已知工艺的部署,以及因此使产甲烷工艺适于允许用作替代供气源例如来自工业过程的含 CO
之前已经知道并且在US 2014/0377830中已经描述,在培养条件下,其允许在存在气体污染物的情况下维持或恢复甲烷生产,并且例如其特征在于氢气输入的百分比较高,因此排出气体也将含有大量的氢气。这种排出气体混合物不仅由于其氧气和氢气含量而具有爆炸性,而且由于其纯度不足而不适合供入气体分配网。
将生物甲烷生产升级为公认的可扩展且可靠的可再生能源被证明仍然是一项挑战,尤其是由于需要连续供应过程。
然而,由于潜力巨大,生物甲烷的大规模利用正受到细致的政治和经济审查,以使该技术具有合算且具成本效益,并且利用甲烷已被确定为生物化学工程最重要的近期目标。因此,迫切需要针对上述缺点的有效解决方案以及由产甲烷古菌驱动的生产工艺的改进。
发明内容
因此,本发明的一个目的是提供一种富集甲烷的气体组合物的可扩展的、可靠且连续的生产工艺,所述生产工艺可在使用含CO
先前的出版物,特别是US 2014/0377830,已经描述了在甲烷生产系统中使用被氧气或一氧化碳污染的含CO
此外,以前已经报道过,产甲烷古菌的生长和存活通常需要碱性氮源氨的供应,并且此外,使用硫化物并认为有必要将其保持在固定相的甲烷生产培养物中以代替活性微生物;然而,这些补充物的添加带来了新的挑战。例如,发现氨增加了产甲烷微生物培养物的缓冲能力,因此提高了引起甲烷释放的代谢过程的稳定性。发现对氨的敏感性取决于产甲烷微生物培养物的组成,因此大量的氨可抑制甲烷化活性,而少量的氨可抑制乙酸发酵型(acetoclastic)产甲烷活性,即通过乙酸的转化来产生甲烷(Procházka等人,2012)。
在人工培养条件下,并应用基本纯净的H
当前技术发展的另一个目的是稳定化和改进使用这种工业废气或地热气体组合物的甲烷生产工艺,而同时仍然保证排出甲烷气体满足供给到气体分配网中的严格要求。
在该技术进步的框架内,如权利要求中明确规定的,本发明提供了关于如何改善甲烷生产工艺并且特别是古菌的甲烷生成以将含 CO
根据本发明,气体应理解为富含CO
这些气体根据其来源可包含非常不同的气体组成。它们的主要共同点在于:与空气相比,它们含有相对大量的CO
尽管关于甲烷化工艺充分地描述了氧气和一氧化碳的抑制作用,但特别是H
如上文所简述,众所周知,溶解的硫化物确实会抑制古菌的氢营养型甲烷生成,即通过使用氢作为还原剂将二氧化碳转化来产生甲烷。尽管与乙酸发酵型甲烷生成相比,这种形式的甲烷生成对硫化物抑制作用似乎很稳固(参见上文),但来自Maillacheruvu等人,1996的数据表明,氢营养型甲烷生成仍受到硫化物毒性影响。
此外,已证明向产甲烷微生物中添加硫化氢会导致甲烷生成的非竞争性抑制,无论是利用厌氧污泥还是单一生物(Koster等人,1986; O'Flaherty等人,1998)。
另外,硫化氢形式的硫化物证明比解离的硫化物离子毒性更大,这是由于以下事实:不受假说所束缚,H
为了至少部分地克服上述文献中列出的最先进技术的缺点,已根据权利要求书中描述的方法改进了甲烷化工艺。
根据本发明,在生物反应器中由含CO
在对本发明的理解中,生物反应器代表生物学反应器,并且是生物反应容器,或生物反应箱,或生物反应槽,和/或至少生物反应室,和/或单元,或它们的组合,如最先进技术所预期的那样,其能够承受例如温度和/或压力等的变化,和/或能够维持在反应过程之前、之后或期间被指定或必须维持的例如温度和/或压力的任何赋予值,并且其中可发生与实施本发明有关的预期反应。此类反应被理解为生物反应,因为它们是关于其中涉及微生物的反应的结构域,并且在本文中指的是它们的正常生理学,例如代谢发酵,或需氧或厌氧消化,因此需要存在合适的环境、合适的微生物培养物、合适的培养基和合适的反应物。为了实现所公开的方法,本发明意义上的生物反应器在每个变量的容许值内可靠地运行,并且预期允许所列出的步骤随时间推移可靠地进行。
仅作为示例,用于培养产甲烷微生物的合适的反应器可以是振荡槽生物反应器、连续搅拌槽生物反应器、间歇搅拌槽生物反应器、中空纤维膜生物反应器、鼓泡塔生物反应器、内环气提生物反应器、外环气提生物反应器、流化床生物反应器、填充床生物反应器、光生物反应器、滴流床反应器、微生物电解池和/或它们的组合。
生物反应器的操作模式分为分批工艺、补料分批工艺和连续工艺。根据本文提出的方法的不同实施方案,可选择最接近解决培养物的具体动力学或由此提取甲烷的便利性的反应器。在本发明的一个实施方案中,鼓泡塔反应器或其变体,例如气提生物反应器或连续搅拌槽反应器,和/或以上任何一种,可用于方便地进行如所述的方法,并且优选连续培养,其中观察到接近平衡的生长,几乎没有营养物、代谢产物、细胞数量和生物量的波动。
在本发明的意义上,并且如上文所讨论,气体包括工业和/或地热活动的产物和副产物(例如废物)气体,其中,所述活动可能导致个别气体或气体混合物的排放,包括例如原始地热气体,因此包括可变量的二氧化碳、一氧化碳、氧气、硫化氢、氮气、氩气、氦气、乙炔、氢气和若干其他气体,这取决于工业过程。
利用可用气体将低能量密度的气体转化为高能量密度的气体(例如甲烷)提供双重优点:一方面,它重复使用气体,所述气体如果释放到大气中则可能会促进温室效应,特别是在由工业活动副产物产生的废气不直接旨在生产气体以供进一步使用的情况下;另一方面,它产生高纯度的富含能量的气体,其可立即用于为其他活动供能,从而产生与废物几乎相同量的低能量密度的气体,这些气体可进一步重新用作培养进料或营养物以生产更多的生物甲烷,与其他长期存在的能源供应方法相比,对环境的影响较小。
根据本发明,在生物反应器中培养产甲烷微生物以产生生物甲烷。这样的产甲烷微生物或自养产甲烷微生物可以是厌氧古菌,或者甚至是最近分类的需氧古菌,其为纯菌株,或与多个(即两个或更多个)菌株的联合体,或混合培养物,其中不同物种之间的营养交换也可能促进甲烷化。
产甲烷古菌的活性通常被认为是严格厌氧的,具有生产率损失 (表示为甲烷产量降低),并最终在发生例如氧污染时导致培养物死亡。在严格厌氧条件下操作培养物可能会导致关于所需设备的严格限制;然而,最近的发现表明,当对氧气暴露或对其他气体污染物的暴露进行认真控制以便调节有可能在极端条件下严重降低甲烷化程度并且当采取应对措施以将关键参数维持在运行水平时,也可保持甲烷的产量并因此保持培养物的活性水平。
因此,在产甲烷微生物开发的总体领域中,寻求包括在不降低甲烷产量的情况下对培养物进行气体污染的可能性的方法是有意义的。发明人的可靠发现是,在pH控制/调节的培养物中进行需氧操作不会限制所述培养物的生存能力,因此其甲烷产量增加了在存在气体污染物的情况下培养各种产甲烷菌的可能性,在本发明中就是这种情况。
自养产甲烷微生物在本文中意为例如通过还原二氧化碳以进行甲烷的生物合成而从与其周围环境的无机反应而获得营养的微生物。自养微生物的一个实例是氢营养型微生物,其营养来自利用氢气;特别是,氢营养型产甲烷微生物能够将氢气和二氧化碳转化为甲烷,这是其代谢过程的一部分。产甲烷微生物在生态系统中的作用是独特的,因为它有助于在有机物腐败的最后阶段去除过量的二氧化碳和发酵产物。在不存在甲烷生成的情况下,来自腐败物质的化合物所结合的大量碳会在厌氧环境中积聚。
来自广古生菌界(Euryarchaeota)的产甲烷古菌纲(涵盖产甲烷菌及其表型多样的亲缘物)基本上包括单细胞微生物,这些微生物能够通过其代谢活性从一小部分底物(包括氢气和二氧化碳)中产生甲烷:这种活性主要在于用氢气和/或其他氢化合物将二氧化碳还原成甲烷。
如最先进技术所报道的那样,适于进行本发明所述方法的产甲烷古菌培养物可从微生物的公共收集物中获得和/或可以可替代地从许多环境来源中分离出来。产甲烷微生物的合适环境来源的实例包括厌氧土壤和沙子,酸沼,树沼,草沼,河口,致密的藻类垫,陆地和海洋的泥浆和沉积物,例如潮汐沉积物的地表下,深海和深井底,污水和有机废物场所和处理设施,以及动物肠道和粪便。
如下文所报道,已经在五个不同的纲(目)下对适用于实施本发明所述方法的产甲烷古菌进行了分类学描述,即甲烷杆菌纲 (Methanobacteria)、甲烷球菌纲(Methanococci)、甲烷微菌纲 (Methanomicrobia)、甲烷嗜盐碱古菌纲(Methanonatronarchaeia)和甲烷火菌纲(Methanopyri),这些纲中的每一者都包含许多属,其中每个属分为多个科,每个科涵盖大量已知的和经过广泛研究的物种(在分类意义上)和未知物种(在未分类意义上)。
在下文中,列出了特别适合于实施本发明所述方法的那些产甲烷古菌,并根据其纲进行了组织;在纲名称后的括号中列出了属于不同科的物种,并用分号分隔;然后将每个物种用逗号分隔。
根据本发明,合适的产甲烷古菌选自来自以下的产甲烷古菌列表:甲烷杆菌纲(例如奥尔胡斯甲烷杆菌(Methanobacterium aarhusens e),聚集甲烷杆菌(Methanobacterium aggregans),嗜碱甲烷杆菌(Met hanobacterium alcaliphilum),北极甲烷杆菌(Methanobacterium arctic um),北京甲烷杆菌(Methanobacteriumbeijingense),布氏甲烷杆菌(M ethanobacterium bryantii),同源甲烷杆菌(Methanobacterium congolen se),弯曲甲烷杆菌(Methanobacterium curvum),埃氏甲烷杆菌(Metha nobacterium espanolae),铁锈甲烷杆菌(Methanobacterium ferruginis),柔性甲烷杆菌(Methanobacterium flexile),甲酸甲烷杆菌(Methanobact eriumformicicum),伊氏甲烷杆菌(Methanobacterium ivanovii),卡纳甲烷杆菌(Methanobacterium kanagiense),湖泊甲烷杆菌(Methanobact erium lacus),Methanobacterium movens,Methanobacterium movile nse,水稻甲烷杆菌(Methanobacterium oryzae),沼生甲烷杆菌(Metha nobacterium paludis),沼泽甲烷杆菌(Methanobacterium palustre),石油甲烷杆菌(Methanobacterium petrolearium),地下甲烷杆菌(Methano bacterium subterraneum),热聚集甲烷杆菌(Methanobacteriumtherma ggregans),泥沼甲烷杆菌(Methanobacterium uliginosum),Methanoba cteriumveterum,甲烷杆菌属某种(Methanobacterium sp.);耐酸甲烷短杆菌(Methanobrevibacter acididurans),嗜树木甲烷短杆菌(Methan obrevibacterarboriphilus),韩国牛甲烷短杆菌(Methanobrevibacter bo viskoreani),弯曲甲烷短杆菌(Methanobrevibacter curvatus),薄皮甲烷短杆菌(Methanobrevibactercuticularis),丝状甲烷短杆菌(Methano brevibacter filiformis),戈氏甲烷短杆菌(Methanobrevibacter gottschal kii),米勒氏甲烷短杆菌(Methanobrevibactermillerae),奥雷氏甲烷短杆菌(Methanobrevibacter olleyae),口腔甲烷短杆菌(Methanobrevibact er oralis),瘤胃甲烷短杆菌(Methanobrevibacter ruminantium),史氏甲烷短杆菌(Methanobrevibacter smithii),共存甲烷短杆菌(Methanobr evibacterthaueri),沃斯氏甲烷短杆菌(Methanobrevibacter woesei),沃利尼甲烷短杆菌(Methanobrevibacter wolinii),甲烷短杆菌属某种 (Methanobrevibacter sp.),兔甲烷球形菌(Methanosphaera cuniculi),斯塔曼甲烷球形菌(Methanosphaera stadtmanae),细毛甲烷嗜热杆菌 (Methanothermobacter crinale),污泥甲烷嗜热杆菌(Methanothermoba cter defluvii),马尔堡甲烷嗜热杆菌(Methanothermobactermarburgen sis),马尔堡甲烷嗜热杆菌马尔堡菌株(Methanothermobacter marburg ensisstr.Marburg),Methanothermobacter tenebrarum,热自养甲烷嗜热杆菌(Methanothermobacter thermautotrophicus),热自养甲烷嗜热杆菌ΔH菌株(Methanothermobacter thermautotrophicus str.Delta H),热自养甲烷嗜热杆菌冬季菌株(Methanothermobacter thermautotr ophicus str.Winter),嗜热弯曲甲烷嗜热杆菌(Methanothermobacter t hermoflexus),嗜热甲烷嗜热杆菌(Methanothermobacterthermophilus),沃尔非甲烷嗜热杆菌(Methanothermobacter wolfeii),甲烷嗜热杆菌属某种(Methanothermobacter sp.),炽热甲烷嗜热菌(Methanothermus fe rvidus));和/或甲烷球菌纲(例如巴氏甲烷暖球菌(Methanocaldococcus bathoardescens),夫文斯甲烷暖球菌(Methanocaldococcus fervens),印度甲烷暖球菌(Methanocaldococcus indicus),下层甲烷暖球菌(Metha nocaldococcus infernus),詹氏甲烷暖球菌(Methanocaldococcus janna schii),绒毛甲烷暖球菌(Methanocaldococcus villosus),火山甲烷暖球菌(Methanocaldococcus vulcanius),甲烷暖球菌属某种(Methanocaldococcus sp);甲酸甲烷炎菌(Methanotorris formicicus),火红甲烷炎菌 (Methanotorrisigneus),甲烷炎菌属某种(Methanotorris sp.);风产甲烷球菌(Methanococcusaeolicus),海沼甲烷球菌(Methanococcus mari paludis),万尼氏甲烷球菌(Methanococcus vannielii),沃尔特氏甲烷球菌(Methanococcus voltae),甲烷球菌属某种(Methanococcus sp.);琉球甲烷嗜热球菌(Methanothermococcus okinawensis),热自养甲烷嗜热球菌(Methanothermococcus thermolithotrophicus),甲烷嗜热球菌属某种(Methanothermococcus sp.));和/或甲烷微菌纲(例如稻田甲烷胞菌(Methanocellaarvoryzae),康拉德氏甲烷胞菌(Methanocella conrad ii),泥居甲烷胞菌(Methanocellapaludicola),甲烷胞菌属某种(Metha nocella sp.);嗜碱甲烷卵圆形菌(Methanocalculus alkaliphilus),中兴甲烷卵圆形菌(Methanocalculuschunghsingensis),耐盐甲烷卵圆形菌 (Methanocalculus halotolerans),嗜盐碱甲烷卵圆形菌(Methanocalcul us natronophilus),短小甲烷卵圆形菌(Methanocalculuspumilus),台湾甲烷卵圆形菌(Methanocalculus taiwanensis),甲烷卵圆形菌属某种(Methanocalculus sp.);聚集甲烷粒菌(Methanocorpusculum aggregan s),巴伐利亚甲烷粒菌(Methanocorpusculum bavaricum),拉布雷亚甲烷粒菌(Methanocorpusculumlabreanum),拉布雷亚甲烷粒菌(Methan ocorpusculum labreanum),小甲烷粒菌(Methanocorpusculum parvu m),中国甲烷粒菌(Methanocorpusculum sinense),甲烷粒菌属某种(M ethanocorpusculum sp.);嗜热食氢甲烷袋状菌暂定种(Candidatus Methanoculleus thermohydrogenotrophicum),布雷斯甲烷袋状菌(Methano culleusbourgensis),Methanoculleus chikugoensis,幌延甲烷袋状菌(M ethanoculleushoronobensis),氢营养型甲烷袋状菌(Methanoculleus hy drogenitrophicus),黑海甲烷袋状菌(Methanoculleus marisnigri),Met hanoculleus palmolei,石油甲烷袋状菌(Methanoculleus receptaculi),沉积物甲烷袋状菌(Methanoculleus sediminis),海底甲烷袋状菌(Meth anoculleus submarinus),台湾甲烷袋状菌(Methanoculleustaiwanensi s),嗜热甲烷袋状菌(Methanoculleus thermophilus),甲烷袋状菌属某种(Methanoculleus sp.);海水甲烷泡菌(Methanofollis aguaemaris),乙醇甲烷泡菌(Methanofollis ethanolicus),台湾甲烷泡菌(Methanofollis formosanus),泥游甲烷泡菌(Methanofollis liminatans),泥游甲烷泡菌 (Methanofollis liminatans),Methanofollis tationis,甲烷泡菌属某种(M ethanofollis sp.);Methanogeniumboonei,卡利亚奇产甲烷菌(Methan ogenium cariaci),嗜冷产甲烷菌(Methanogeniumfrigidum),海洋产甲烷菌(Methanogenium marinum),嗜器官产甲烷菌(Methanogeniumorganophilum),产甲烷菌属某种(Methanogenium sp.);帕氏甲烷叶形菌(Methanolaciniapaynteri),石油甲烷叶形菌(Methanolacinia petrole aria);内共生甲烷盘菌(Methanoplanus endosymbiosus),居沼泽甲烷盘菌(Methanoplanus limicola),甲烷盘菌属某种(Methanoplanus sp.); Methanomicrobium antiguum,运动甲烷微菌(Methanomicrobium mobi le);嗜中温甲烷绳菌(Methanolinea mesophila),迟缓甲烷绳菌(Metha nolinea tarda);Methanoregula boonei,甲酸甲烷规则菌(Methanoreg ulaformicica);沼泽甲烷小球菌(Methanosphaerula palustris);亨氏甲烷螺菌(Methanospirillum hungatei),腔隙甲烷螺菌(Methanospirillum lacunae),耐冷甲烷螺菌(Methanospirillum psychrodurum),Methanos pirillum stamsii,甲烷螺菌属某种(Methanospirillum sp.);Candidatus Methanoperedens nitroreducens,CandidatusMethanoperedens sp.等;竹节状甲烷鬃毛菌(Methanosaeta harundinacea),远洋甲烷鬃毛菌(Me thanosaeta pelagica),索氏甲烷丝菌(Methanothrix soehngenii),嗜热乙酸甲烷丝菌(Methanothrix thermoacetophila),甲烷鬃毛菌属某种(M ethanosaeta sp.);(Methanimicrococcus blatticola),甲烷微球菌属某种 (Methanimicrococcus sp.));和/或甲烷嗜盐碱古菌纲(Methanonatronar chaeia)(例如甲烷嗜盐碱古菌属(Methanonatronarchaeum),嗜热甲烷嗜盐碱古菌(Methanonatronarchaeumthermophilum),甲烷嗜盐古菌属暂定种(Candidatus Methanohalarchaeum),嗜热甲烷嗜盐古菌(Candi datus Methanohalarchaeum thermophilum));和/或甲烷火菌纲(例如坎氏甲烷火菌(Methanopyrus kandleri),甲烷火菌属某种(Methanopyrus sp.)),或它们的任何组合。
这些不同的属、科和种中的每一个都包括许多已鉴定和未分类的不同微生物,或遗传修饰的菌株和相关环境物种,存在进行中的测序活动以分离更多物种。除了上述适于实施本发明的微生物外,国家生物技术信息中心(NCBI)网站的分类浏览器(TaxonomyBrowser)还提供了这种分类的完整列表。
此外,通常可通过简单的培养条件以及自然选择和适应机制来选择或修饰任何上述天然存在的物种。在特定的实施方案中,反应器的培养物的最终组成可能已经被改变,使得处于特定生长阶段的生物相对于其他生物或根据反应器的状态处于休眠或运行/活性状态而享有特权。
为了使特定菌株适应特定条件,存在若干关于特定菌株的基因操作的研究。通常,本发明的方法反而是依赖于天然存在的微生物。
根据本发明的一些实施方案,甲烷嗜热杆菌以及其他嗜热自养甲烷嗜热杆菌(Methanothermobacter thermoautotrophicus)、马尔堡甲烷嗜热杆菌和/或其混合物和/或其衍生物揭示特别适合于实施如后续实施例1-7中所述或证明的本发明方法。
进一步根据本发明的一些实施方案,炽热甲烷嗜热菌、嗜树木甲烷短杆菌(Methanobrevibacter arboriphilicus)、甲烷球菌属和甲烷暖球菌属某种以及其他巴氏甲烷暖球菌、夫文斯甲烷暖球菌、印度甲烷暖球菌、下层甲烷暖球菌、詹氏甲烷暖球菌、绒毛甲烷暖球菌、火山甲烷暖球菌和/或其混合物和/或其衍生物揭示特别适合于实施如后续实施例中所述或证明的本发明方法。
在这方面,应当指出,最令人感兴趣的是,本发明的发明人还发现,实施例8中使用的甲烷杆菌(例如炽热甲烷嗜热菌)当分别在约7.0 或稍高于约7.0的调节pH下培养时能够执行稳定且出乎意料的优异的甲烷化(参见实施例8和9,示出pH 7.2和7.4)。这一发现与最先进技术知识形成鲜明对比,该技术教导,炽热甲烷嗜热菌偏爱“弱酸性pH并等于6.5,而在pH高于7.0下则无法观察到生长”(参见Anderson 等人,2010,第316页,右栏,第4-6行;和Stetter等人,1981)。
响应于已进行培养的特定条件,原始培养物可能已经经历了自然修饰。培养条件受若干参数的影响,例如温度、pH、压力、细胞密度、体积、湿度、盐含量、电导率、碳含量、氮含量、维生素含量、氨基酸含量、矿物质含量或它们的组合,并且根据这些条件中的每一个,反应器环境内的任何数量的物种都可进行特定的适应过程。
根据本发明,本文公开的方法涉及在连续工艺中培养产甲烷微生物,其中这种连续性应理解为甲烷生产中的连续性和培养物中的连续性,其中不需要从菌落的活性成员中分离无活性的末端生物质的步骤。相反,鼓励在若干生长阶段中将死的生物材料与活性成员一起保持在反应器中,因为发现所述生物质或生物材料为活性培养物提供进一步的底物是有利的,从而增强了营养可利用性。在对甲烷生产和培养物的这种连续性的理解中,还包括如下理解:对培养物连续供应合适的反应物(例如工业气体、地热气体),从而使其能够执行甲烷生产任务,而不会显著改变在整个培养中以及在反应器操作阶段内从任何产甲烷活性周期获得的甲烷产生量(即甲烷产量)的测量值。
确保连续的甲烷生产是本发明的重要特征,并且是实施所述方法的步骤的有利效果。根据本发明,甲烷是由产甲烷古菌从单一菌株或在混合培养物中产生的,其中混合培养物是也可使用多个(因此两个或更多个)菌株的培养物,或者是多个其他物种与产甲烷古菌或其任何组合相互作用的培养物。
根据本文公开的方法,提供给培养物的气体含有CO
在如上文所定义的富含二氧化碳和例如硫化氢等的气体中,还包括原始地热气体,其包含合适量的二氧化碳和硫化氢,但不排除此类气体组成,其也包含痕量或污染的氧气。
另外,报道了涉及特定实施方案的实验,其中使用了处理过的地热气体,其含有合适量的二氧化碳和减少量的硫化氢,但不排除也包含痕量或污染的氧气的这种气体组合物。
因此,在本发明的范围内,还包括提供给产甲烷微生物的培养物的气体并且特别是CO
本发明的方法的确包括培养产甲烷古菌的步骤,其基于古菌的典型培养条件,所述条件先前已经描述过并且是专业人员已知的。根据专业人员的技能,这些条件会受到影响培养的常见参数的影响和控制,所述参数包括温度、压力、体积、湿度、盐含量、电导率、碳含量、氮含量、维生素含量、氨基酸含量、矿物质含量,或它们的任何组合。
根据本发明,在所述方法中培养产甲烷微生物以在生物反应器中从含CO
此外,提供给产甲烷生物的培养物的普通培养基或生长培养基可包括一种或几种普通的无机元素,呈其元素形式或其任何合适的无毒盐,选自由以下组成的组:钠,钾,镁,钙,铁,镍,钴,锰,锌,铜,硼,铝,钼,钨,硒,氯,硫源,例如硫化氢或元素硫,磷源,例如磷酸盐,氮源,例如铵、硝酸盐或氮气。根据本发明用于培养产甲烷生物的典型盐是NaCl、NaHCO
本发明人发现,其他参数例如pH的调节允许反应器的整个活性周期内的甲烷化,并且即使在存在气体污染物的情况下也能够连续产生甲烷。
因此,本发明的特征在于连续控制pH值的步骤。在这种情形下,控制在一般通用含义上应理解为:使用本领域已知的通用方法和测量仪器,对与培养有关的参数保持持续监测并在本质上测量所述参数或状态指标,因为它可能不足以保持持续监测,因此只能控制培养物的 pH;因此,本发明的另一个实施方案特别包括连续调节pH值。在本申请的理解中,调节意为通过使用适当的手段来进行,主动地保持参数的给定值,例如培养物的pH。
根据本发明的一个实施方案,通过连续添加合适量的合适的酸或碱,产甲烷微生物培养物被连续地控制和/或调节,即被稳定化以保持在如下pH值:低于或处于pH 10的给定值,或者低于或处于pH 9 的给定值,或者低于或处于pH 8或者处于pH 7的给定值。
不受假说的束缚,据信调节培养物的pH对于保持甲烷化活性的连续性特别重要,这决定了所要求保护的方法的效率。
根据本发明的另一个实施方案,通过用合适量的例如NaOH/HCl 或NH
根据本发明的“给定值”可以是具有给定的容差,测量系统内的容差或由于培养物内的可变性或由于培养物多样性而引起的容差的限定值,其中所述值适合于实现甲烷化;或者给定值可以是合适值的范围,这些值对甲烷化作用的效果与给定值相同。
在本申请的上下文中,甲烷化或甲烷生成或生物甲烷化应理解为如由产甲烷微生物,例如包括在适合于进行如上所述的本发明的产甲烷微生物列表中的那些所进行的甲烷或富集甲烷的气体组合物的产生。
特别地,如先前已知并且根据本发明合适的甲烷化反应以4:1的化学计量消耗H
根据本发明的一个实施方案,作为培养物的营养物而提供的气体或废气(指的是地热气体)可含有比例不同于4:1的H
有趣的是,当在连续工艺中使用产甲烷微生物培养物进行时,根据本发明的方法证实在甲烷化活性的持久性方面仍然有效,所述产甲烷微生物培养物被供给具有极为不同且令人惊讶地相异的H
另外,本发明人可证明,即使在这些基本上不同的化学计量比 H
因此,所要求保护的工艺优化(包括pH值控制和/或调节)的主要优点之一在于,即使在进料气不足或进料气中断的情况下,甲烷化也可降低,但仍在运行,或者其可能甚至保持不变并且可快速恢复。
在本申请的上下文中,使用所述方法生产的富集甲烷的气体组合物意为主要由甲烷组成的气体组合物,和/或其中甲烷是主要组分的气体组合物,和/或其甲烷含量为90体积%和更多或至多96体积%的气体组合物,并且特别地如所述方法的产物是主要包含甲烷的气体组合物,该气体组合物可直接供给至用于产生热量和功率的管道系统;因此,本发明的富集甲烷的气体组合物具有非常低的污染物含量,并且与需要从不能直接燃烧的污染物进行纯化的天然气不同,如所公开的富集甲烷的组合物可与氧气直接相互作用以有效地发热和发电,以直接供给至国家能源网。
在本申请的含义中,通过如所公开的方法生产的富集甲烷的气体组合物符合对生物甲烷的理解。
人们认为是常识,但仍然应该再次提及,用于控制和/或调节微生物培养物中参数值的适当手段会根据参数的性质而有所改变。在 pH值的情况下,调节和或稳定化是通过提供经校正以达到给定pH 值的精确量的碱性或酸性溶液来进行的。合适溶液的实例包括但不限于氢氧化钾、氢氧化钠、盐酸和硫酸溶液和/或已使用或已知与生物过程相容的任何碱性或酸性溶液。
因此,在本申请的意义上以及为了在整个培养期间并及时地实现并稳定化连续甲烷化活性的目的,调节是连续地或以连续方式实现的,使得在任何给定的时间,培养物的参数(例如培养物的pH)在测量时发现具有与给定值相同的值。
此外,根据本发明的方法的有利步骤是有规律地或连续地从培养基中除去过量的水分和/或过量的代谢水或所谓的游离水,从而确保培养基中的营养物的适当稀释和/或分散。根据本发明的代谢水是指水或H
尽管温度可根据培养物内所选微生物物种的存在而改变,但每种微生物在设定的温度范围内都能生长得更好,对于大多数产甲烷微生物而言,升高的温度是无害的,并且它们甚至可能有助于优化细胞代谢以及因此代谢周转或甚至甲烷化。在工业过程中,必须通过能量调节来控制温度;在这方面,通过实现温度控制来减少能量消耗被认为是有价值的特征。
因此,在优化的培养温度与针对能量输入成本的相应的氢溶解性之间取得平衡非常重要。有趣的是,发现本发明的方法在大气压下在 32℃至90℃之间或32℃至85℃之间或者50至70℃或者进一步62℃左右的温度范围内是最有效的。
对于其他温度或压力范围,氢溶解性可用作比较特征。因此,本发明还涉及在高压例如16巴、20巴、35巴、40巴或60巴以及相应地更高温度下的培养方法,这将允许与在大气压下在32℃至90℃之间或32℃至85℃之间或者50至70℃或者进一步62℃左右的温度范围下相同的氢溶解性。
通常,产甲烷微生物还可在高达甚至远高于100℃(例如140℃) 的多个其他和甚至极端温度范围内生存和生长;因此,以上温度范围是优选范围的指示,但不应理解为限制本发明的范围。
根据本发明的另一个实施方案,在另外添加的硫化物,优选但不限于以Na
氢氧化铵也称为氨水并且是一种无色的水溶液。因此,氢氧化铵可单独使用或与其他氮化合物或甚至气体组合使用,以有助于在菌落或培养物生长的若干阶段中提供可行的氮源培养基。
通常,将通常营养物或特别是氮源如氢氧化铵添加到培养物中的步骤不应理解为是对本发明的限制,而应被认为对专业人员是有帮助的。通常,产甲烷微生物在多种氮源的存在下也可生存和生长。
根据本发明的另一个实施方案,培养产甲烷微生物直至培养物中微生物的密度OD
根据本发明的另一个实施方案,培养产甲烷微生物培养直至培养物中微生物的密度OD
培养物中微生物的光密度是在每个时间点测量细胞计数或浓度的可行参数。给定细胞计数与培养物中微生物效率之间的直接关系似乎尚未普遍建立,尽管如此,在理解根据本发明的方法的结果时,高密度培养物在甲烷生产和产量方面产生有利的结果。
特别是,根据本发明的培养物的光密度(OD)是利用本领域已知的常用方法和标准来测量的。使用分光光度计进行光密度或相反浊度测量(作为细胞计数的一种形式),分光光度计通常在600nm左右或600 nm下操作,但是相应地其他波长也可能适合。
由于光密度可能会根据测量设置而变化,因此通常有用的是指示培养物中微生物的干重或生物量密度,作为给定时间点或生长期中培养物中存在的细胞数量的量度。使用本领域已知的标准方法,通过建立在不同浓度下获得的培养物的许多不同OD值的曲线并相应地测量培养物的干燥样品的干重,可在给定生长阶段的给定培养物的OD 测量结果与干重测量结果之间建立相关性。这将提供一组作为光密度函数的干重的数据点;这种数据集的回归线的斜率通常定义了干重与光密度之间的相关性。根据发明人,在本申请中,OD
根据本发明的一个实施方案,通过将培养物成员在其整个生命阶段即从若干生长阶段(活跃的生长阶段、静止的生长阶段、几乎静止的生长阶段)到其末期阶段保持在反应器中,从而使无活性的细胞体的残留物可为培养物的活性成员提供营养物,可获得培养物中微生物的高计数,这决定了高的光密度。
根据本发明,可将产甲烷微生物的培养物引导或引入OD
如本申请中描述的方法的发明人确实表明,根据本发明的其他实施方案,如所描述的方法使用选自古菌或古细菌界的产甲烷微生物特别有效,其中该组包括甲烷杆菌属、甲烷短杆菌属、甲烷嗜热杆菌属、甲烷球菌属、甲烷八叠球菌属(Methanosarcina)、甲烷火菌属 (Methanopyrus)、甲烷嗜热菌属(Methanothermus)或它们的混合物,并且本发明人进一步表明,特别是甲烷嗜热杆菌属、甲烷嗜热菌属或甲烷短杆菌属被证明是非常有效的。
根据本发明的另一个实施方案,所选择的产甲烷微生物是厌氧的,但是耐氧的,例如通过适应。
如上文所解释,本发明中利用的产甲烷古菌可同时包括需氧和严格厌氧物种,它们在存在污染物的情况下仍保持甲烷化的能力,并且当执行控制和调节培养物的pH的步骤时,绕过其他方法或培养中所见的沉默步骤,并将甲烷化保持在预期水平。在本申请的上下文中,以及在本领域的一般情形下,沉默意为产甲烷微生物对敌对环境的反应而中断甲烷化活性。
根据本发明,步骤i的合适的液体培养基是适度盐性环境,其中阴离子浓度即Cl
氯阴离子可作为NaCl、MgCl、KCl、NH
在对本申请的理解中,微生物的生长和活性的另一个因素也可以是液体培养基中通常存在的盐的量,其允许生物质的繁殖和连续增加,代谢活性连续进行,因此,具有将二氧化碳还原成甲烷的理想转化效率以及连续高甲烷输出。
特别地,尽管大多数产甲烷微生物天然存在于大海深处,其中对于生活在水面的任何其他生物而言盐度都非常高,但是本发明人惊奇地发现,能够在中等盐性环境中生存和繁盛的根据本发明的产甲烷微生物在要求保护的方法中是特别适合的。
使用现代生物反应器技术,使用能够在适度盐性环境中生存和繁盛的根据本发明的这种产甲烷微生物是特别有利的;避免了例如与高盐性环境相关的严重腐蚀、氧化和失去光泽的损害的后果,所述高盐性环境将是不适应的嗜盐菌产甲烷物种所需并且揭示出对复杂的生物反应器设施非常有害。
在本发明中,产甲烷微生物选自自然选择的或天然适应的微生物、适应的嗜盐微生物、基因工程微生物的组,它们都能够在这样的适度盐性环境中生存和繁盛,其中NaCl浓度或盐度因而低于或处于海水中NaCl浓度的一半左右,并且通常选择为约12-14g/L。
在对本发明的理解中,适应的微生物意为在其初始状态下不具有的微生物,即当被添加到培养物中时,在培养物中持久一段时间之后,其才具有所有相同的属性和/或能力,或其任何程度。在相同的理解中,这样的属性和/或能力可能不是原始微生物物种中常见的特征,然而可在培养一段时间或永久培养后获得,所述时期是可变的,取决于例如微生物和/或培养物,其中在与培养物中存在的其他微生物种群相互作用时和/或响应于培养环境的任何其他参数和/或要素,例如特定营养物和/或特定污染物的浓度和/或可用性,和/或在与原始微生物的任何其他相似的代谢源或任何其他改变(包括本领域技术人员已知的那些)相互作用时,所述属性和/或能力或其任何程度改变。
根据本发明的实施方案,含CO
通常,并且根据本发明的优选实施方案,气体中的CO
另外,并且根据本发明的其他实施方案,含CO
另外,根据本发明的其他实施方案,含CO
根据本发明的一些其他实施方案,含CO
特别地,并且根据一个实施方案,根据本发明的经处理的地热气体是通过在
表1中给出了实施例6中包括的经处理的地热气体的另一种典型组成。
虽然已知显著更高水平的H
根据本发明的另一个实施方案,可在大气压条件下和/或在加压条件下执行整个程序或至少一个步骤。如果根据一些实施方案,根据本发明的方法的一个或多个步骤是在加压气氛中进行的,则压力被选择为优选地高达16巴,或者高达20巴,或者高达50巴,或者高达 68巴,或者高达110巴,或甚至高达420巴。
根据本发明,所收集的甲烷或所产生的富集甲烷的气体组合物基本上不含固体污染物,例如泡沫、小固体粒子如灰尘和污垢颗粒,呈悬浮液,油脂,或气态污染物,例如水蒸气、硫化氢、硅氧烷、氨和卤素化合物(氯化物、氟化物),挥发性有机化合物(VOC),例如柠檬烯和其他萜烯,以及其他痕量污染物。这些痕量组分可能会在装置和管道系统中堆积,并可能导致腐蚀、沉积和设备损坏,因此应在收集排出气体后去除。
为了实现高纯度甲烷收集,使用若干方法,例如过滤、低温分离、除湿、生物氧化、化学吸附、物理吸附。
根据本发明生产的生物甲烷的高纯度决定了其在连续生产周期中作为能源的即时可用性,因此证明了本发明要求保护的方法的优越性。
连续生产高纯度甲烷是如本文所述方法的结果,其中将富含硫化氢的底物(其任选地甚至可包含氧气)用于培养产甲烷古菌的物种或物种混合物,以获得实际上不含污染物的甲烷或富集甲烷的气体组合物,其立即准备重新进入能量循环,即使在能源需求高的装置和设施中,也提供具有每个碳原子最高能量产率的清洁燃料,而其他来源,即使是具有每个碳原子较低能量产率和高环境影响的燃料,也是稀缺、昂贵、不切实际的。
所述方法进一步重新利用了甲烷的燃烧产物,为生物培养物提供了更多的底物,从而重新开始甲烷生产循环。
由于如上所述方法的这些有希望的结果,本发明人进一步研究了在不同pH值下培养所述产甲烷微生物对甲烷化的影响,从而导致发现了本发明的另一方面。
因此,在另一方面,本发明提供了一种在生物反应器中由CO
a.在第一组培养条件下用CO
b.在第二组培养条件下,即在第二pH下连续培养所述微生物;
c.控制并任选地调节所述pH值以处于给定值;
d.收集甲烷或富集甲烷的气体组合物。
在根据本发明的另一方面的第一实施方案中,第一pH值在pH 5.5至7.0的范围内以诱导产甲烷微生物的快速复制和生长,并且其中第二pH值在pH 7.1至10的范围内以相较于步骤a的甲烷生产来增加和优化甲烷生产,即较低的pH范围。
或者,第二pH值可在pH 4.5至6.5的范围内,并且任选地低于第一pH。
本发明的发明人可证明,分别为酸性至中性pH范围的初始第一 pH范围和处于碱性至中性pH范围的第二pH范围的转变对于激活甲烷代谢是重要的,并因此导致甲烷生产相较于在培养期间使用的第一 pH范围下测得的甲烷生产有显著增加。
因此,利用根据本发明的方法,可显著增加甲烷生产。已经发现,关于pH值的转变似乎在培养产甲烷生物的阶段期间基本上诱导了甲烷代谢,因此,在第二pH范围内导致平均甲烷化率相较于第一pH 范围下的甲烷化率增加至少15%至高达100%,或者至少30%至高达80%,或者至少50%至高达70%。
有趣的是,还发现即使在第一pH范围为中性至第二pH范围为酸性的转变下,也可引发甲烷化率的相当可观的显著增加。
根据本发明的所述其他实施方案,甲烷化方法包括将分别处于酸性至中性pH范围的初始第一pH范围至处于碱性pH至中性pH范围的第二pH范围的所述转变基本上用于激活甲烷代谢,并因此导致甲烷生产相较于在用于培养的第一pH下测得的甲烷生产有显著增加。
附图说明
图1:根据实施例1和2,在添加H
图2:使用热自养甲烷嗜热杆菌的培养物,在添加至多24000mg/L 的S
图3:使用热自养甲烷嗜热杆菌培养物的CO
图4:将进料气从CO
图5:根据使用热自养甲烷嗜热杆菌的培养物的实施例5,仅使用处理过的地热气体进行甲烷化的持久性。根据本发明方法的一个实施方案,数据表明即使维持非常低的H
图6:在添加24mg/L的S
图7:在添加24mg/L的S
图8:在第一pH值(pH<7.2)下以及在将pH转变为高于第一pH 值的碱性第二pH值(pH<7.45)后,嗜树木甲烷短杆菌培养物的平均 CO2转化率。
具体实施方式
以下实施例说明了根据预期实施所述方法的可行方式,而无意将本发明限于所述实施例。
实施例1:使用热自养甲烷嗜热杆菌的培养物模拟硫化氢对标准甲烷化工艺的影响
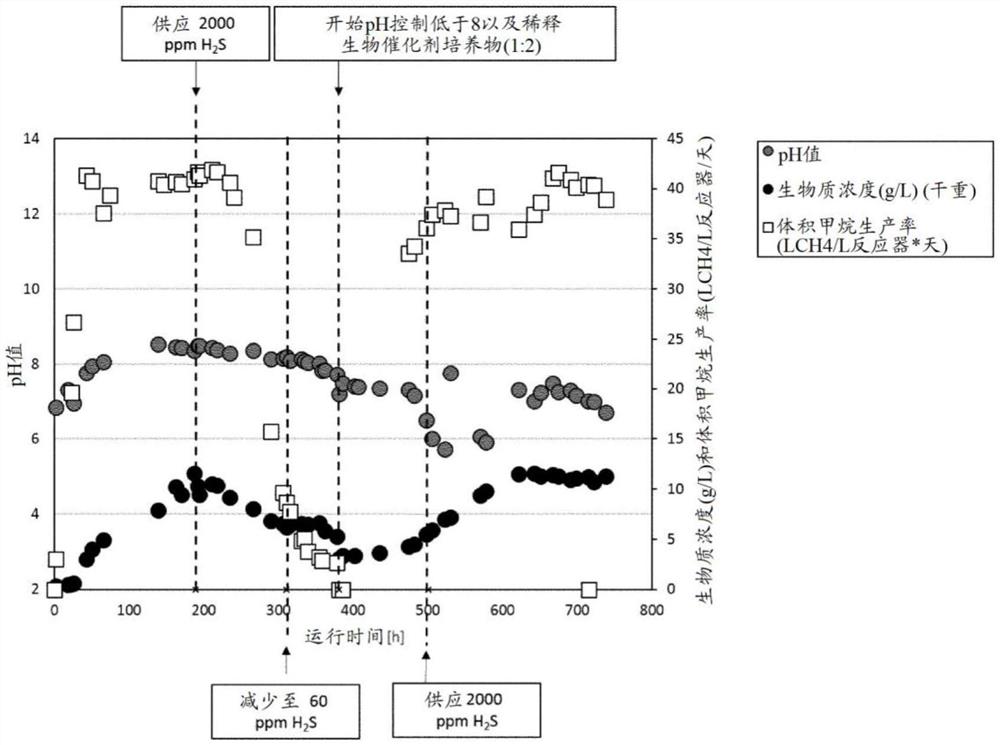
在实验开始时,使用产甲烷古菌(热自养甲烷嗜热杆菌的培养物) 的生物甲烷化工艺处于恒定的性能条件下(稳定的生物质浓度为10至12g/L并且甲烷的体积生产率为约40L
为了在规定的时间点(参见图1,在189小时运行时间)开始实验,将2000ppm H
因此,添加2000ppm H
不受假说的束缚,我们推测添加这些相对较高量的H
实施例2:使用热自养甲烷嗜热杆菌的培养物,pH调节能够耐受高达24000mg/L的高浓度硫化物(S
在图2中,显示了报告根据本发明的方法的热自养甲烷嗜热杆菌的培养物的甲烷化活性的曲线,如以H
在前2个实验中,以Na
实验3显示了在无pH调节下将24000mg/L的硫化物(S
实验4和5显示了在pH调节下将24000mg/L的硫化物(S
通过将实验3的结果与实验4和5的结果进行比较,可推断出,根据本发明的方法进行pH调节的培养物不仅可承受高浓度的硫化物且不损失甲烷化工艺的性能或连续性,而且可提高其自身性能。
实施例3:通过使用热自养甲烷嗜热杆菌的培养物调节pH值来改进工艺
为了在添加H
为此,在实施例1的实验设置之后,将工艺培养物用新鲜培养基以1:2稀释(图1中381小时运行时间)。在该实验中,使用了稀释方法,因为这是降低生物催化剂悬浮液中不需要的组分(例如先前沉淀的金属盐)浓度的简易方法,而无需完全重新启动该过程。另外,pH值设置为7(约±0.3)的范围。在这个起始阶段,所供应的H
在稀释且pH稳定的培养条件下,生物催化剂培养物重新启动甲烷生产率和生物质生产两者(图1;运行时间450h)。
在501h运行时间下,H
在约500h与630h之间的pH波动是由于以下事实:必须手动调节pH投料,并且必须首先确定足以维持pH 7的新投料速率。pH 控制碱的供应不足导致pH值下降到大约pH 6的pH值,这也显示了甲烷生产率的损失。
实施例4:使用热自养甲烷嗜热杆菌的培养物在浓度高达16000 ppm的H
利用根据实施例3的pH控制策略,还可将远远更高的浓度(例如高达16000ppm的H
为此,当添加60ppm H
当本发明人重新启动该工艺并手动降低培养物的pH值(其通常在8至8.5之间,降低至少一个log到pH值为7左右)时,在高水平 H
令人惊讶的是,这种改进使得在添加高达16000ppm H
实施例5:使用热自养甲烷嗜热杆菌的培养物在额外氧气的影响下甲烷化工艺对硫化氢的耐受
根据实施例4的结果是在使用热自养甲烷嗜热杆菌的培养物的实验设置中再现的,其中添加了高达12000ppm H
同时加入H
实施例6:使用热自养甲烷嗜热杆菌的培养物利用预处理的地热气体的甲烷化工艺
地热气体的原始不可冷凝级分可含有相当高量的H
应注意的是,处理过的地热气体通常含有浓度高达约2%的氧气 (O
迄今为止,从未对这种高H
表1示出了处理过的地热气体的典型组成:
表1.处理过的地热气体的典型组成。
所述工艺由纯CO
实施例7:仅使用热自养甲烷嗜热杆菌的培养物利用处理过的地热气体的甲烷化工艺
在此应特别提及一项测试,因为该实验特别成功,在该实验中完全关闭了添加电解H
为此,仅使用热自养甲烷嗜热杆菌的培养物对处理过的地热气体建立了如上所述的工艺。这确实允许在不将电解器安装在仅(处理过的)地热气体上的情况下进行甲烷化工艺。
处理过的地热气体的H
“总”CO
实施例8:使用嗜树木甲烷短杆菌的培养物在高浓度硫化物下的甲烷化
在图6中,显示了三条曲线,其报告了在有和没有应用本发明的 pH控制和调节方法的情况下嗜树木甲烷短杆菌培养物的甲烷化活性,如以H
在第一个实验(黑色实心圆圈)中,将24mg/L浓度的硫化物(S
在第二个实验中,当施用5倍高浓度121mg/L的硫化物并同时在约7.2的初始pH值下提供pH调节时,通过使用嗜树木甲烷短杆菌培养物(灰色实心圆圈)观察到了相似的结果。这些条件导致在所述浓度121mg/L的硫化物存在下,出乎意料且令人惊讶的高甲烷化和培养物的连续性能。
在第三个实验中,分析了在没有任何pH调节的情况下分别向培养物中施用12.700mg/L的硫化物时的甲烷化。图6示出了在初始pH 值8.7下,即在约pH值9下的结果(参见空心圆圈)。在没有pH调节的这种情形下,初始pH增加到高于9.0的pH值,因此在实验持续时间内甲烷化急剧降低。
实施例9:使用炽热甲烷嗜热菌的培养物在高浓度硫化物下的甲烷化
与图6相比,在图7中,显示了三条曲线,其报告了在有和没有应用本发明的pH控制和调节方法的情况下,炽热甲烷嗜热菌培养物的甲烷化活性,如以H
考虑24mg/L浓度的硫化物(S
在其中在没有任何pH调节的情况下分别向培养物中施用12.700 mg/L的硫化物时分析甲烷化的第三个实验中,收到与使用嗜树木甲烷短杆菌的第三个实验的情况相似的结果。图7示出了结果(参见空心圆圈)。在没有pH调节的这种情形下,初始pH 8.7增加到高于9.0 的pH值,因此在实验持续时间内甲烷化急剧降低。
从实验1和实验2的结果与嗜树木甲烷短杆菌和炽热甲烷嗜热菌的实验3的结果的比较,可推断出,根据本发明的方法进行pH调节的另外两个不同的微生物属的培养物可一致地承受高浓度的硫化物,而不会损失甲烷化工艺的性能或连续性。
实施例10:改进的培养方法
为了试图进一步改进甲烷化,本发明人还改进了产甲烷微生物的培养技术。简而言之,嗜树木甲烷短杆菌培养物在pH≤7.2(平均7.1) 下在稳定条件下生长约400小时。在这些条件下,观察到平均(CO
最初开始培养后,pH不断增加到高于7.45(平均7.6)。随着时间的推移,对甲烷化的令人惊讶的影响描绘于图8中。这种向升高pH 的pH转变导致平均(CO
在其中嗜树木甲烷短杆菌培养物首先在pH≤6.5下在稳定条件下生长的一个类似实验中,在pH不断转变到高于7.45后,显示出相当出乎意料且有利的甲烷化增加(数据未示出)。
从这些实验中,本发明的发明人得出以下结论,在不受理论束缚的情况下,针对最先进技术知识的任何预测,向pH值增加的转变对产甲烷微生物的代谢和甲烷化性能具有有利的影响,如本发明关于不同甲烷杆菌物种的实施例所示。
参考文献:
Maillacheruvu,K.Y.,Parkin,G.F.,Peng,C.Y.,Kuo,W.C.,Oonge,Z.I.,Lebduschka,V.,Sulfide toxicity in anaerobic systems fed sulfate and variousorganics,Water Environment Federation,Vol.65(2), pp.100-109(1993)
Koster,I.W.,Rinzema,A.,De Vegt,A.L.,Letinga,G.,Sulite inhibition ofthe methanog enic activity of granular sludge at various pH-levels,WaterResearch,Vol.20(12),pp.1561-1567(1986)
O’Flaherty,V.,Mahony,T.,O’Kennedy,R.,Colleran,E.,EffectofpH on growthkinetics and sulphide toxicity thresholds of a range of methanogenic,syntrophic and sulphate-reducing bacteria,Process Biochemistry,Vol.33,lssue5,pp.555-569(1998)
Paula Jr.,D.R.,Foresti,E.,Sulfide toxicity kinetics of a uasbreactor,Braz.J.Chem.Eng.,Vol.26 no. 4,pp.669-675(2009)
Edgcomb,V.P.,Molyneaux,S.J.,Saito,M.A.,Lloyd,K.,
McAnulty,M.J.,Poosarla,V.G.,Kim,K.-Y.,Jasso-Chávez,R.,Logan,Br.E.,Wood,T.K.,Electricity from methane by reversing methanogenesis,Nat.Comm.,Vol.8,art.15419(2017)
Procházka,J.,
Anderson I,Djao OD,Misra M,Chertkov O,Nolan M,Lucas S,Lapidus A,DelRio TG,Tice H,Cheng JF,Tapia R,Han C,Goodwin L,Pitluck S,Liolios K,lvanova N,Mavromatis K,Mikhailova N,Pati A, Brambilla E,Chen A,Palaniappan K,Land M,Hauser L,Chang YJ,Jeffries CD,Sikorski J,Spring S, Rohde M,Eichinger K,HuberH,Wirth R,
Stetter KO,Thomm M,Winter J,Wildgruber G,Huber H,Zillig W,Jané-CovicD,K6nig H,Palm P, Wunderl S..Methanothermus feryidus,sp.nov.,a novelextremely thermophilic methanogen isolated from an icelandic hotspring.Zentralbl Bakteriol Parasitenkd Infektionskr HygAbt 1 Orig C2 1981;2:166-178。
