一种肿瘤诊疗药物及其制备方法和应用
文献发布时间:2023-06-19 10:25:58
技术领域
本申请涉及生物医药领域,具体涉及一种肿瘤诊疗药物及其制备方法和应用。
背景技术
癌症是威胁人类健康的重大恶性疾病之一,对癌症的精确诊断和有效治疗是本领域长期以来研究的热点与难点。
光热治疗是利用光热材料吸收近红外光,将其转化为局部热能使肿瘤区域温度升高,从而杀死肿瘤细胞。与其他癌症治疗手段相比,光热治疗对正常组织的损伤性较小。然而,目前的光热材料仍存在肿瘤特异性差、体内循环时间短以及生物相容性差的问题。另外,单一的光热材料并不能确定肿瘤治疗部位,在治疗过程中仍需配合诊断试剂的使用。因此,为了有效确定治疗部位,实时监测治疗进程与治疗效果,提高诊断的灵敏性和治疗的有效性,亟需开发一种体内循环时间长、具有良好靶向性和生物相容性的诊疗一体化制剂。
发明内容
有鉴于此,本申请提供了一种肿瘤诊疗药物,该肿瘤诊疗药物可同时实现荧光成像和光热治疗,达到诊疗一体化,并且具有良好的靶向性和生物相容性,在体内具有较长的循环时间,能够满足临床应用的需求。本申请还提供了一种肿瘤诊疗药物的制备方法和应用。
本申请第一方面提供了一种肿瘤诊疗药物,包括吲哚菁绿类化合物和白蛋白;所述吲哚菁绿类化合物与所述白蛋白通过静电作用结合;所述吲哚菁绿类化合物的结构式为:
本申请提供的肿瘤诊疗药物中,吲哚菁绿类化合物是由吲哚菁绿与iRGD环肽通过酰胺反应得到,吲哚菁绿在近红外区具有很好的光学吸收,能够实现荧光成像和光热治疗;将iRGD环肽与吲哚菁绿连接可提高肿瘤诊疗药物的靶向性,增强治疗效果;将白蛋白与吲哚菁绿类化合物结合能够提高肿瘤诊疗药物的生物相容性,延长药物在体内的循环时间,实现在肿瘤部位精准、持续地给药。
可选地,所述白蛋白包括人血清白蛋白和牛血清白蛋白中的一种或多种。
可选地,所述吲哚菁绿类化合物与所述白蛋白的质量比为1∶(0.1-1)。
可选地,所述肿瘤诊疗药物还包括通过化学键连接在所述吲哚菁绿类化合物上的磁性材料。
可选地,所述磁性材料包括Gd-DTPA、Gd-DOTA、Gd-DTTA和Gd-HOPO中的一种或多种。
可选地,所述吲哚菁绿类化合物与所述磁性材料的摩尔比为1∶(1-100)。
可选地,所述肿瘤诊疗药物的激发波长为600nm-1100nm。
可选地,所述肿瘤诊疗药物的光热转换效率为15%-50%。
可选地,所述肿瘤诊疗药物的粒径为1nm-100nm。
本申请第一方面提供的肿瘤诊疗药物具有良好的靶向性,能够增强药物靶向肿瘤细胞的能力,使药物富集在肿瘤部位,降低药物对正常细胞的损伤并增强治疗效果;该肿瘤诊疗药物还具有良好的稳定性和生物相容性,在体内的循环时间长,能够很好地应用到肿瘤的治疗当中;该肿瘤诊疗药物能够同时实现荧光成像和光热治疗,为肿瘤的可视化诊疗提供重要的帮助。
第二方面,本申请提供了一种肿瘤诊疗药物的制备方法,包括如下步骤:
将吲哚菁绿溶解于溶剂中,分别加入N-羟基琥珀酰亚胺、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐和iRGD环肽,反应后得到吲哚菁绿类化合物;
将所述吲哚菁绿类化合物与白蛋白混合,得到肿瘤诊疗药物。
可选地,所述iRGD环肽的序列为CRGDKGPDC。
可选地,所述吲哚菁绿与所述iRGD环肽的摩尔比为1∶(0.8-1.2)。
可选地,所述吲哚菁绿、所述N-羟基琥珀酰亚胺和所述1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐的摩尔比为1∶(1-4)∶(1-4)。
可选地,所述溶剂包括甲醇、乙醇、二甲基甲酰胺和二甲基亚砜中的一种或多种。
可选地,所述吲哚菁绿的浓度为0.01mg/mL-10mg/mL。
可选地,所述吲哚菁绿类化合物与所述白蛋白的质量比为1∶(0.1-1)。
本申请第二方面提供的肿瘤诊疗药物的制备方法,通过加入N-羟基琥珀酰亚胺和1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐来活化吲哚菁绿的羧基,促进吲哚菁绿与iRGD环肽的键合;iRGD环肽有效增强了吲哚菁绿对肿瘤细胞的靶向性;将吲哚菁绿类化合物与白蛋白混合可使其通过静电作用结合,得到肿瘤诊疗药物。该制备方法所形成的肿瘤诊疗药物结构稳定,具有良好的肿瘤靶向性、生物相容性以及较长的体内循环时间。本申请提供的肿瘤诊疗药物制备方法简单,有利于进行工业化量产。
第三方面,本申请提供了一种利用上述肿瘤诊疗药物在制备用于治疗肿瘤疾病的药物中的应用。
本申请中的肿瘤诊疗药物在近红外区具有强的光吸收特性,在激光照射下能够产生热量进而杀死肿瘤细胞,实现光热治疗;并且该肿瘤诊疗药物还具有强的荧光性能,能够实现在荧光成像模式下指导的光热治疗,促进诊疗一体化。
附图说明
图1为本申请的吲哚菁绿类化合物的制备过程图;
图2为本申请实施例1提供的ICG-iRGD的质谱图;
图3为本申请一实施例提供的ICG-iRGD和HSA-ICG-iRGD的吸收光谱图;
图4为本申请一实施例提供的ICG-iRGD和HSA-ICG-iRGD的荧光光谱图;
图5为本申请一实施例提供的ICG-iRGD和HSA-ICG-iRGD的光热升温曲线图;
图6为本申请一实施例提供的ICG-iRGD和HSA-ICG-iRGD的细胞毒性测试图。
图7为本申请一实施例提供的ICG-iRGD代谢效果图;
图8为本申请一实施例提供的HSA-ICG-iRGD代谢效果图;
图9为本申请一实施例提供的小鼠肿瘤磁共振成像图;
图10为本申请一实施例提供的小鼠光热治疗效果图。
具体实施方式
下面将结合本申请实施例中的附图,对本申请实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本申请一部分实施例,而不是全部的实施例。基于本申请中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本申请保护的范围。
本申请实施例提供了一种肿瘤诊疗药物,包括吲哚菁绿类化合物(ICG-iRGD)和白蛋白(HAS);吲哚菁绿类化合物与白蛋白通过静电作用结合形成肿瘤诊疗药物(HAS-ICG-iRGD);吲哚菁绿类化合物的结构式为:
本申请中,吲哚菁绿类化合物是由吲哚菁绿(ICG)与iRGD环肽通过酰胺反应得到的,其中,吲哚菁绿与iRGD环肽通过酰胺键连接。请参阅图1,图1为本申请的吲哚菁绿类化合物的制备过程图。本申请实施方式中,吲哚菁绿类化合物中,吲哚菁绿与iRGD环肽的比例为1:1,即单个吲哚菁绿仅连接一个iRGD环肽。控制吲哚菁绿类化合物中吲哚菁绿与iRGD环肽的比例能够保证吲哚菁绿类化合物仍具有空余的结合位点,有利于吲哚菁绿类化合物与白蛋白结合形成肿瘤诊疗药物(HAS-ICG-iRGD)。
本申请以吲哚菁绿(ICG)作为肿瘤诊疗药物的光敏剂。吲哚菁绿(ICG)在近红外区具有很好的光学吸收和荧光性质,可以实现实时动态的荧光成像;并且吲哚菁绿在激光照射下能够产生热量,可用于光热治疗中。采用吲哚菁绿作为光敏剂可实现荧光成像指导下的光热治疗,促进肿瘤治疗的诊疗一体化。
本申请实施方式中,将iRGD环肽与吲哚菁绿连接可以使吲哚菁绿具有良好的肿瘤靶向性。在肿瘤细胞及肿瘤新生血管内皮细胞中,整合素αvβ3和整合素αvβ5具有高表达,而iRGD环肽可以与整合素αvβ3和整合素αvβ5特异性结合。具体地,iRGD环肽的序列为CRGDKGPDC,其中的RGD序列具有整合素靶向的功能,能够靶向到整合素表达较高的肿瘤部位,从而使肿瘤诊疗药物富集在肿瘤部位,提高诊疗效果并减少对正常组织的损伤。并且iRGD环肽具有肿瘤穿膜特性,能够与肿瘤细胞表面的神经菌毛素(NRP-1)作用,介导细胞膜穿透效应,使药物更加有效地渗入肿瘤细胞内部而发挥治疗作用。除此之外,iRGD环肽具有良好的水溶性,将iRGD环肽与吲哚菁绿连接可提高肿瘤诊疗药物在水中的溶解性,从而扩大药物的临床应用范围。
本申请实施方式中,将iRGD环肽与吲哚菁绿连接得到吲哚菁绿类化合物(ICG-iRGD),再将ICG-iRGD与白蛋白(HAS)通过静电作用结合即形成肿瘤诊疗药物(HAS-ICG-iRGD)。本申请中,由于吲哚菁绿类化合物易被人体降解而不能够满足临床诊疗的需求,故采用白蛋白与吲哚菁绿类化合物结合来增强肿瘤诊疗药物的稳定性,延长药物在人体内的循环时间。除此之外,将白蛋白与吲哚菁绿类化合物结合还能够增强肿瘤诊疗药物的荧光性能,有利于提高荧光成像的准确度。
本申请中,吲哚菁绿类化合物带有负电,而白蛋白为正电,因此白蛋白能够通过静电作用与吲哚菁绿类化合物结合。本申请实施方式中,吲哚菁绿类化合物是与白蛋白二级结构中的II和III结构域通过静电作用结合的。
本申请实施方式中,白蛋白包括人血清白蛋白和牛血清白蛋白中的一种或多种。上述白蛋白与吲哚菁绿类化合物有较强的结合作用,能够提高肿瘤诊疗药物的稳定性,并且生物相容性好,有利于临床应用。
本申请实施方式中,吲哚菁绿类化合物与白蛋白的质量比为1∶(0.1-1)。本申请一些实施方式中,吲哚菁绿类化合物与白蛋白的质量比为1∶(0.2-0.7)。吲哚菁绿类化合物与白蛋白的质量比具体可以但不限于为1∶0.1、1∶0.2、1∶0.4、1∶0.6、1∶0.8或1∶1。控制吲哚菁绿类化合物与白蛋白的质量比能够保证吲哚菁绿类化合物与白蛋白充分结合。
本申请实施方式中,肿瘤诊疗药物还包括通过化学键连接在吲哚菁绿类化合物上的磁性材料,其中,化学键包括酰胺键。将磁性材料与HAS-ICG-iRGD结合可以使肿瘤诊疗药物具有磁共振成像的功能,磁共振成像具有高的灵敏度和空间分辨率,与吲哚菁绿类化合物的荧光成像结合可以实现磁光双模态成像功能,减小单一成像的局限性,可有效增强对肿瘤诊断的精准性,提高治疗效率。
本申请实施方式中,磁性材料包括Gd-DTPA、Gd-DOTA、Gd-DTTA和Gd-HOPO中的一种或多种。上述磁性材料不仅磁共振成像的效果好并且在人体内较稳定,产生的过敏反应少。本申请实施方式中,吲哚菁绿类化合物与磁性材料的摩尔比为1∶(1-100)。吲哚菁绿类化合物与磁性材料的摩尔比具体可以但不限于为1∶1、1∶3、1∶5、1∶10、1∶20、1∶50、1∶70或1∶100。在上述摩尔比范围内,磁性材料对HAS-ICG-iRGD本身结构无影响,并且能够与HAS-ICG-iRGD共同实现磁光双模态成像功能,提高肿瘤成像的灵敏度。本申请一些实施方式中,吲哚菁绿类化合物与磁性材料的摩尔比为1∶10。当吲哚菁绿类化合物与磁性材料的摩尔比为1∶10时,吲哚菁绿类化合物的荧光成像能够与磁性材料的核磁共振成像互相协同实现良好的磁光双模态成像效果,有利于提高肿瘤成像的准确性。
本申请实施方式中,肿瘤诊疗药物的激发波长为600nm-1100nm。本申请一些实施方式中,肿瘤诊疗药物的激发波长为700nm-850nm。肿瘤诊疗药物的激发波长具体可以但不限于为600nm、700nm、730nm、750nm、780nm、790nm、793nm、795nm、798nm、800nm、850nm、900nm、1000nm或1100nm。在上述激发波长下,人体的皮肤、组织和血液对光的吸收和散射较低,能够减少激光对正常组织损伤,并且肿瘤诊疗药物在该波段下对光的吸收能力强,能够将光能有效转化为热能,有利于提高治疗效率。本申请一些实施方式中,肿瘤诊疗药物的激发波长为790nm-800nm,在该波段下,肿瘤诊疗药物对激光具有很好的吸收。
本申请中,肿瘤诊疗药物在600nm-1100nm的激发波长下,能够有效地将光能转化为热能,从而升高肿瘤部位的温度,进而杀死肿瘤细胞,实现光热治疗。本申请实施方式中,肿瘤诊疗药物的光热转换效率为15%-50%。肿瘤诊疗药物的光热转换效率具体可以但不限于为15%、20%、25%、30%、40%或50%。
本申请实施方式中,肿瘤诊疗药物的粒径为1nm-100nm。在该粒径范围下肿瘤诊疗药物具有良好的分散性能,并且具有较长的体内血液循环时间,能够在肿瘤部位实现持续地给药。
本申请提供的肿瘤诊疗药物具有良好的靶向性,并且药物在体内的循环时间长、生物相容性好,治疗的效率高,还能够实现诊疗一体化,满足临床的需求。
本申请还提供了一种上述肿瘤诊疗药物的制备方法,包括如下步骤:
步骤100:将吲哚菁绿(ICG)溶解于溶剂中,加入N-羟基琥珀酰亚胺(NHS)和1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC),反应后得到ICG-NHS;
步骤200:将ICG-NHS和iRGD环肽进行反应,得到ICG-iRGD;
步骤300:将ICG-iRGD与白蛋白(HSA)混合,反应后得到肿瘤诊疗药物(HSA-ICG-iRGD)。
本申请实施方式中,步骤100中,将ICG与EDC和NHS反应可以活化ICG的羧基,有利于ICG的羧基与iRGD环肽的氨基反应。本申请实施方式中,溶解吲哚菁绿的溶剂包括甲醇、乙醇、二甲基甲酰胺和二甲基亚砜中的一种或多种,采用上述溶剂有利于吲哚菁绿充分溶解。本申请实施方式中,ICG的浓度为0.01mg/mL-10mg/mL。ICG的浓度具体可以但不限于为0.01mg/mL、0.05mg/mL、0.1mg/mL、0.5mg/mL、1mg/mL、5mg/mL或10mg/mL。
本申请实施方式中,ICG与NHS和EDC的摩尔比为1∶(1-4)∶(1-4)。ICG与NHS和EDC的摩尔比具体可以但不限于为1∶1∶1、1∶2∶2、1∶3∶3或1∶4∶4。控制ICG与NHS和EDC的摩尔比可以保证ICG上的羧基被充分活化,进而保证后续步骤中iRGD环肽能够与ICG反应。
本申请实施方式中,ICG与EDC和NHS的反应(简称为EDC/NHS反应)是在惰性气体保护下进行的,惰性气体可以是氮气、氦气和氩气中的一种或多种。本申请实施方式中,EDC/NHS反应的温度为15℃-30℃,反应的时间为20h-40h。本申请一些实施方式中,EDC/NHS反应的温度为20℃-25℃,反应的时间为25h-30h。本申请实施方式中,在EDC/NHS反应结束后向反应液中加入冷丙酮使ICG-NHS析出,过滤后将滤渣用冷丙酮进行洗涤,再将滤渣进行真空干燥即可得到ICG-NHS。
本申请实施方式中,步骤200中,将ICG-NHS和iRGD环肽进行反应的过程具体为:将ICG-NHS溶解在溶剂中,加入iRGD环肽,制得ICG-iRGD。本申请实施方式中,溶解ICG-NHS的溶剂包括甲醇、乙醇、二甲基甲酰胺和二甲基亚砜中的一种或多种,采用上述溶剂有利于ICG-NHS充分溶解。本申请实施方式中,ICG-NHS的浓度为0.01mg/mL-10mg/mL。ICG-NHS的浓度具体可以但不限于为0.01mg/mL、0.05mg/mL、0.1mg/mL、0.5mg/mL、1mg/mL、5mg/mL或10mg/mL。
本申请实施方式中,ICG-NHS与iRGD环肽的摩尔比为1∶(0.8-1.2)。ICG-NHS与iRGD环肽的摩尔比具体可以但不限于为1∶0.8、1∶0.9、1∶1、1∶1.1或1∶1.2。控制ICG-NHS和iRGD环肽的摩尔比可以保证ICG-iRGD具有较高的产率。
本申请实施方式中,ICG-NHS与iRGD环肽的反应温度为15℃-30℃。ICG-NHS与iRGD环肽的反应温度具体可以但不限于为15℃、20℃、25℃或30℃。控制反应温度能够保证ICG-iRGD具有良好的稳定性,不易发生分解。本申请实施方式中,ICG-NHS与iRGD环肽的反应时间为12h-24h。本申请一些实施方式中,ICG-NHS与iRGD环肽的反应时间为15h-20h。本申请实施方式中,ICG-NHS与iRGD环肽的反应结束后将反应液通过分子截流量为100-1500的透析袋进行除杂,透析的时间为40h-80h。本申请一些实施方式中,透析袋的分子截流量为500,透析的时间为70h。本申请实施方式中,透析结束后将滤液进行冷冻干燥得到ICG-iRGD。
本申请实施方式中,步骤300中,将ICG-iRGD与白蛋白(HSA)混合的步骤具体为:将ICG-iRGD和白蛋白分散在PBS溶液中,混合一段时间后得到HSA-ICG-iRGD。本申请实施方式中,PBS溶液的pH为6-8。本申请实施方式中,ICG-iRGD的浓度为0.01mg/mL-10mg/mL。ICG-iRGD的浓度具体可以但不限于为0.01mg/mL、0.05mg/mL、0.1mg/mL、0.5mg/mL、1mg/mL、5mg/mL或10mg/mL。
本申请实施方式中,白蛋白包括人血清白蛋白和牛血清白蛋白中的一种或多种。本申请实施方式中,ICG-iRGD与白蛋白的质量比为1∶(0.1-1)。ICG-iRGD与白蛋白的质量比具体可以但不限于为1∶0.1、1∶0.3、1∶0.5、1∶0.7或1∶1。控制ICG-iRGD与白蛋白的质量比可保证吲哚菁绿类化合物与白蛋白能够充分结合。
本申请一些实施方式中,在制备得到HSA-ICG-iRGD后还可以将磁性材料与HSA-ICG-iRGD进行反应连接,从而制备得到含有磁性材料的肿瘤诊疗药物。本申请实施方式中,磁性材料为Gd螯合物。本申请一些实施方式中,磁性材料包括Gd-DTPA、Gd-DOTA、Gd-DTTA和Gd-HOPO中的一种或多种。其中,DTPA、DOTA、DTTA和HOPO均表示配体,具体地,DTPA为二乙基三胺五乙酸;DOTA为1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸;DTTA为二乙三胺四乙酸;Gd-HOPO为羟基吡啶酮。
本申请一些实施方式中,磁性材料为Gd-DTPA,所制备得到的肿瘤诊疗药物为Gd-DTPA-HSA-ICG-iRGD。本申请实施方式中,Gd-DTPA-HSA-ICG-iRGD的制备方法为:将HSA-ICG-iRGD分散在PBS溶液中,加入DTPA-NHS(经过羧基活化的二乙基三胺五乙酸),在15℃-30℃下反应1h-20h,再向反应液加入GdCl3,在25℃-30℃下反应0.5h-10h,制得Gd-DTPA-HSA-ICG-iRGD。所得的Gd-DTPA-HSA-ICG-iRGD可同时实现磁共振成像和荧光成像,有利于实现对肿瘤的精准定位。
本申请提供的肿瘤诊疗药物的制备方法操作简单,所制备出的肿瘤诊疗药物具有良好的靶向性和生物相容性,并且该肿瘤诊疗药物在近红外光区具有强的光吸收特性和光热转换性能,能够同时实现肿瘤成像和光热治疗,有利于实现在肿瘤成像模式下指导的光热治疗,促进诊疗一体化。
本申请还提供了一种利用上述肿瘤诊疗药物在制备用于治疗肿瘤疾病的药物中的应用。
本申请实施方式中,肿瘤诊疗药物的药物剂型包括混悬剂、散剂、片剂和胶囊剂中的任意一种。
下面分多个实施例对本申请的技术方案进行进一步的说明。
实施例1
一种肿瘤诊疗药物的制备方法,包括如下步骤:
ICG-NHS的制备:将2mg的ICG、1mg NHS和2mg EDC在氮气的保护下溶解在2mL无水DMSO中,在20℃搅拌反应30h后加入20mL冷丙酮,溶液产生大量沉淀,将沉淀过滤得到固体,用冷丙酮将固体洗涤三遍,真空干燥得到ICG-NHS;
ICG-iRGD的制备:将2mg的ICG-NHS溶解在2mL无水DMSO中,加入2mg iRGD环肽,在30℃下反应12h,制得ICG-iRGD。将溶液用500分子截留量的透析袋在纯水中透析72h后,将溶液冷冻干燥制得ICG-iRGD。
HSA-ICG-iRGD的制备:将2mg ICG-iRGD与80mg HSA在PBS溶液中混合即可得到HSA-ICG-iRGD。
实施例2
1)ICG-NHS的制备:将3mg的ICG、2mg NHS和5mg EDC在氮气的保护下溶解在5mL无水DMSO中,在20℃搅拌反应30h后加入过量的冷丙酮,溶液产生大量沉淀,将沉淀过滤得到固体,用冷丙酮将固体洗涤三遍,真空干燥得到ICG-NHS;
2)ICG-iRGD的制备:将3mg的ICG-NHS溶解在5mL无水DMSO中,加入3mg iRGD环肽,在30℃下反应12h,制得ICG-iRGD。将溶液用1000分子截留量的透析袋在纯水中透析72h后,将溶液冷冻干燥制得ICG-iRGD。
3)HSA-ICG-iRGD的制备:将3mg ICG-iRGD与120mg HSA在PBS溶液中混合即可得到HSA-ICG-iRGD。
4)Gd-DTPA-HSA-ICG-iRGD的制备:将3mg HSA-ICG-iRGD溶解在2mL PBS中,加入1.4mg DTPA-NHS反应2h,再向反应液加入0.6mg GdCl3,将溶液冷冻干燥制得Gd-DTPA-HSA-ICG-iRGD。
实施例3
一种肿瘤诊疗药物的制备方法,包括如下步骤:
1)ICG-NHS的制备:将2mg的ICG、3mg NHS和15mg EDC在氮气的保护下溶解在10mL甲醇中,在15℃搅拌反应20h后加入过量的冷丙酮,溶液产生大量沉淀,将沉淀过滤得到固体,用冷丙酮将固体洗涤三遍,真空干燥得到ICG-NHS;
2)ICG-iRGD的制备:将2mg的ICG-NHS溶解在10mL甲醇中,加入2mg iRGD环肽,在30℃下反应12h,制得ICG-iRGD。将溶液用500分子截留量的透析袋在纯水中透析40h后,将溶液冷冻干燥制得ICG-iRGD。
3)HSA-ICG-iRGD的制备:将2mg ICG-iRGD与80mg HSA在PBS溶液中混合即可得到HSA-ICG-iRGD。
效果实施例
为验证本申请制得的肿瘤诊疗药物的结构和性能,本申请还提供了效果实施例。
对实施例1制得的ICG-iRGD用质谱仪测定其结构,测试结果见图2。由图2可得,所制备的ICG-iRGD分子量及分子离子峰与ICG-iRGD的分子量以及分子离子峰一致。
对肿瘤诊疗药物的光学性能进行表征。将实施例1中的HSA-ICG-iRGD和ICG-iRGD配制成相同质量浓度的分散液,对分散液的光学性能进行表征,请参阅图3,图3为本申请一实施例提供的ICG-iRGD和HSA-ICG-iRGD的吸收光谱图。具体地,图3中的实线为HSA-ICG-iRGD分散液的吸收光谱图,图3中的虚线为ICG-iRGD分散液的吸收光谱图。由图3可以看出HSA-ICG-iRGD的吸收波段为600nm-900nm,最大吸收峰的波长为800nm,而ICG-iRGD最大吸收峰的波长为793nm,HSA-ICG-iRGD相比于ICG-iRGD的最大吸收峰发生红移,这说明ICG-iRGD与HAS发生了特异性结合。
本申请还对肿瘤诊疗药物的荧光性质进行表征,请参阅图4,图4为本申请一实施例提供的ICG-iRGD和HSA-ICG-iRGD的荧光光谱图,其中,图4中的实线为HSA-ICG-iRGD分散液的荧光光谱图,图4中的虚线为ICG-iRGD分散液的荧光光谱图。由图4可以看出ICG-iRGD的荧光发射峰位于1000nm处,将白蛋白与ICG-iRGD结合形成HSA-ICG-iRGD后,HSA-ICG-iRGD的荧光强度大大增强,这说明将白蛋白与吲哚菁绿类化合物结合能够增强肿瘤诊疗药物的荧光性能。
对肿瘤诊疗药物的光热升温效果进行测试,测试具体过程如下:将实施例1中的HSA-ICG-iRGD和ICG-iRGD配制成浓度为0.2mg/mL的分散液,将分散液放在圆形表面皿中(光程1cm,面积1cm2),以808nm波长的激光进行照射,测量分散液在0-5分钟的温度变化曲线,每隔半分钟记录一次溶液的温度,其中激光的功率密度为0.8W·cm-2,测试结果请参阅图5。图5为本申请一实施例提供的ICG-iRGD和HSA-ICG-iRGD的光热升温曲线图,其中,图5中PBS指的是PBS缓冲液,为对照组。通过图5可以看出ICG-iRGD和HSA-ICG-iRGD经激光激发后可以迅速产生热量,使体系的温度升高,在照射5min时,ICG-iRGD和HSA-ICG-iRGD的温度均达到55.8℃,这说明肿瘤诊疗药物具有良好的光热转化率,有利于应用到光热治疗中。
对肿瘤诊疗药物的细胞毒性进行测试,测试具体过程如下:将C6细胞分别用含不同浓度HSA-ICG-iRGD或ICG-iRGD的培养基培养24h。其中,HSA-ICG-iRGD和ICG-iRGD的浓度分别为1.5μg/mL、3μg/mL、6μg/mL、12μg/mL和25μg/mL,实验结果请参阅图6,图6为本申请一实施例提供的ICG-iRGD和HSA-ICG-iRGD的细胞毒性测试图。通过图6可以看出C6细胞的存活率均在94%以上,这说明HSA-ICG-iRGD对于具有较低的细胞毒性。
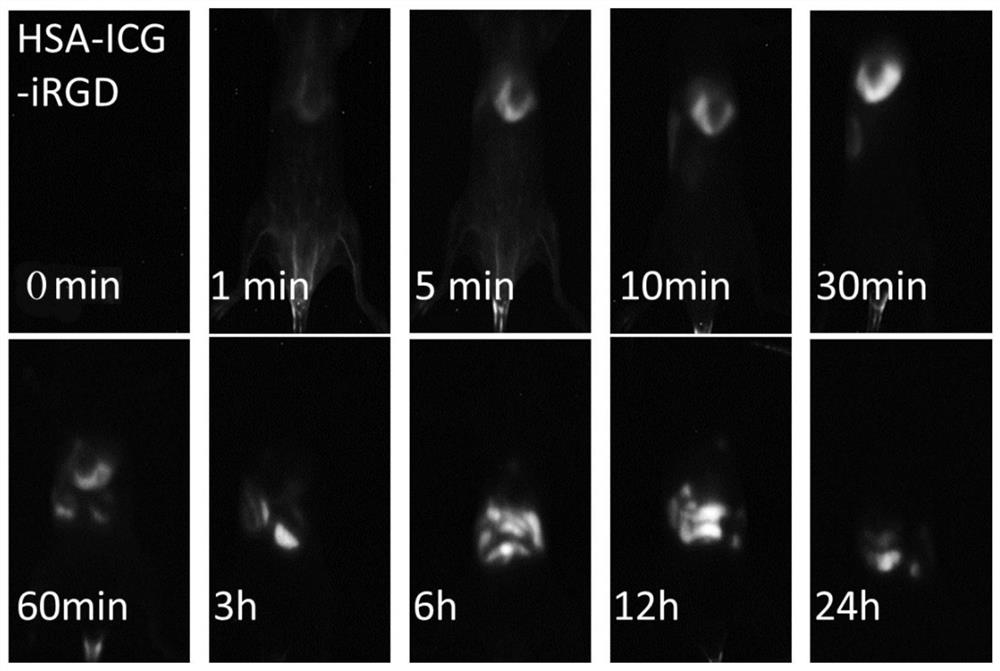
对肿瘤诊疗药物的循环稳定性进行测试,测试具体过程如下:向小鼠分别注射2mg/kg ICG-iRGD和HSA-ICG-iRGD,观察不同时间下小鼠腹部的荧光成像情况,结果请参阅图7和图8,图7为本申请一实施例提供的ICG-iRGD代谢效果图,图7为本申请一实施例提供的HSA-ICG-iRGD代谢效果图。通过图6可以看出ICG-iRGD在30min时便基本完全代谢,通过图8可以看出HSA-ICG-iRGD在24h后仍具有较强的荧光成像,这说明HSA-ICG-iRGD具有较长的体内循环时间,即将HSA与ICG-iRGD可以增强药物的稳定性,延长肿瘤诊疗药物在体内的循环时间,提高药物的利用率。
对肿瘤诊疗药物的磁共振成像性质进行测试,向小鼠注射2mg/kg的Gd-DTPA-HSA-ICG-iRGD(实施例2制得),对小鼠的肿瘤部位进行磁共振成像,实验结果请参阅图9,图9为本申请一实施例提供的小鼠肿瘤磁共振成像图,通过图像可以看出肿瘤诊疗药物具有良好的肿瘤成像性能。
对肿瘤诊疗药物的光热治疗效果进行测试,测试具体过程如下:向接种脑胶质瘤的三只小鼠分别注射生理盐水、ICG-iRGD和HSA-ICG-iRGD,其中,ICG-iRGD和HSA-ICG-iRGD的注射量为2mg/kg。将808nm激光的光斑对准小鼠的脑胶质瘤接种部位进行辐照,用红外热相仪监测该过程小鼠大脑部位的温度变化。实验结果请参阅图10,图10为本申请一实施例提供的小鼠光热治疗效果图,通过图像可以看出,将三只小鼠以相同的激光辐照5min后,HSA-ICG-iRGD升温最高,这说明HSA-ICG-iRGD具有良好的光热治疗效果。
以上所述是本申请的优选实施方式,但并不能因此而理解为对本申请范围的限制。应当指出,对于本技术领域的普通技术人员来说,在不脱离本申请原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也视为本申请的保护范围。
- 一种肿瘤诊疗药物及其制备方法和应用
- 一种基于磁靶向的多功能介孔氧化铁纳米诊疗制剂的构建及其在制备抗肿瘤药物中的应用
