一株可转化鞣花单宁调控线粒体自噬的植物乳杆菌及其应用
文献发布时间:2023-06-19 19:30:30
技术领域
本发明涉及一株可转化鞣花单宁调控线粒体自噬的植物乳杆菌及其应用,属于生物技术领域。
背景技术
鞣花酸(ellagic acid,EA)通过肠道微生物转化为尿石素类物质(Urolithin,Uro),这些代谢物比它们的前体更容易被吸收。并且EA对健康的影响,被认为主要归因于其肠道菌群代谢产物Uro。Uro对人体具有有益的生物学作用,但不同个体的Uro生产能力已被证明存在差异。因此,筛选生物转化Uro的菌株以及探析Uro的生物功能具有重要意义。
EA是一种天然多酚,在自然界中主要以缩合形式——鞣花单宁(ellagitannins,ETs)存在。ETs与健康效应具有一定的关联性,但其是大分子,且极性较强,故而难以被胃肠道直接吸收,在组织和血浆中的含量不足以达到其发挥生物活性的浓度,即生物利用度很低,从而导致其功能在生物体内无法得到有效发挥。并且一项健康人体药代动力学研究证明即使摄入更多的游离EA,也无法提高EA的生物利用度,只能够提升Uro的产量(公开于Journal of Functional Foods,2015,19(15):225-235.)。对无菌小鼠灌胃EA后,无法检测到Uro,用人体粪便菌群孵育EA可以产生Uro(公开于Journal of Agricultural and FoodChemistry,2005,53(14):5571-5576.)。这些研究证明了Uro是ETs、EA的肠道菌群代谢产物之一。
ETs在胃和小肠被水解并转化形成EA,然后未被胃肠道消化吸收的EA直接到达哺乳动物胃肠道的远端(结肠)经由定殖的肠道菌群代谢为更容易吸收的二苯并吡喃6-酮衍生物,即Uro,并且在生理学以及适用人群方面都优于EA。
植物化学物质的生物活性通常依赖于肠道菌群,ETs被肠道菌群代谢为Uro。而大量的试验数据表明,Uro是富含ETs的物质在生物体内发挥功效的真正活性物质,在调节雌激素受体、抗氧化、抗炎、抑菌、抗癌、抗肥胖、抗衰老等方面有着重要的功效,受到食品、医疗、化妆品等行业的重点关注(公开于Trends in Food Science&Technology,2020,106(20):64-77.)。
多项研究表明,Uro中的尿石素A(Urolithin A,Uro-A)可通过诱导功能失调线粒体自噬和调节线粒体的生物合成来抑制线虫的功能失调线粒体随年龄而积累,达到延长线虫寿命的作用,并且Uro-A对其的抗衰老功能显著优于其它型Uro(公开于NatureMedicine,2016,22(8):879-888)。此外,Uro抗氧化活性的相关研究开展较多,Uro可通过抗氧化能力来达到其他有益功效,形成“Uro-抗氧化-有益功效”途径。高分子量的ETs是石榴汁发挥体外抗氧化能力的主要贡献者,这归功于更多的酚羟基官能团,即ETs和EA的抗氧化能力与羟基化程度呈正相关。随着逐步脱羟基,相应产物的抗氧化能力逐渐减弱。发酵虽然降低了体外抗氧化能力,但是将大分子物质(ETs)转化为了小分子物质(Uro),从而提高了生物利用度,进而有效提高了体内的抗氧化功效(公开于Oxid Med Cell Longev.2020;2020:5194508.)。
目前,人们对EA在肠道菌群作用下生成Uro这一过程所涉及的细菌种类知之甚少。截至目前,人们已发现了两株具有Uro-C生产能力的戈登氏菌属(Gordonibacter genus)菌株:产尿石素戈登氏杆菌(G.urolithinfaciens DSM 27213T=CCUG 64261T)、帕梅拉戈登氏杆菌(G.pamelaeae DSM 19378T=CCUG 55131T)(记载于公开号为CN 110225978 A的中国发明专利申请文本中);一株具有iso-Uro-A生产能力的异乌拉氏杆菌属(Ellagibactergenus)菌株:异乌拉氏杆菌(E.isourolithinifaciens DSM 104140T=CCUG 70284T)(记载于公开号为CN110325638A的中国发明专利文本中);以及一株具有Uro-A生产能力的双歧杆菌属菌株:假小链双歧杆菌(Bifidobacterium pseudocatenulatum INIA P815)(公开于Journal of Functional Foods,2018,45(18):95-99)。虽然这些Uro产生菌具有作为特殊益生菌并应用到功能性食品和保健品的潜力,但是由于其不属于可食用菌种目录从而限制了它们的应用发挥。
发明内容
本发明提供可转化ETs产生Uro-A(但不局限于Uro-A)并处于可食用菌种目录中的益生菌,并提供该菌的后生元及合生元通过调控线粒体自噬进而干预秀丽隐杆线虫衰老中的应用,为Uro及具有Uro转化能力的菌株的进一步开发利用及工业化生产提供理论参考依据。
本发明对目标菌株及其后生元进行了深入的活性和机制方面的探究,最终发现了一株具有转化ETs产生Uro-A能力的植物乳杆菌CCFM1286,并且其发酵提取物可通过改善线粒体功能和降低活性氧水平来达到抗衰老的功效,本发明还提供了基于该菌开发的靶向抗衰老层面的合生元制剂。
本发明提供了一株植物乳杆菌(Lactiplantibacillus plantarum)CCFM1286,所述植物乳杆菌保藏于广东省微生物菌种保藏中心,保藏编号为:GDMCC No:62800,保藏日期为2022年09月15日。
所述植物乳杆菌(Lactiplantibacillus plantarum)CCFM1286菌株来源于健康人群的粪便,菌株经测序分析,16S rDNA序列如SEQ ID NO.1所示,将得到的序列在NCBI中进行核酸序列比对,结果显示菌株为乳杆菌属植物乳杆菌(Lactiplantibacillusplantarum),命名为植物乳杆菌CCFM1286。属于乳杆菌属(Lactiplantibacillus)的微生物,其产生尿石素类物质Uro。
所述植物乳杆菌CCFM1286在BHI固体培养基上的圆形状凸起,色泽呈乳白色、表面光滑,直径约2~3mm。
本发明提供了一种微生物菌剂,所述微生物菌剂中,含有所述植物乳杆菌CCFM1286,或含有植物乳杆菌CCFM1286的发酵液,或含有植物乳杆菌CCFM1286的冻干粉,或含有植物乳杆菌CCFM1286灭活的菌体,或含有植物乳杆菌CCFM1286的裂解物,或含有植物乳杆菌CCFM1286提取物。
在本发明的一种实施方式中,所述微生物菌剂中,植物乳杆菌CCFM1286的含量不低于10
本发明还提供了一种产品,所述产品中含有所述植物乳杆菌CCFM1286或上述微生物菌剂。
在本发明的一种实施方式中,所述产品为食品或保健品。
在本发明的一种实施方式中,所述食品为保健食品;或所述食品为使用含有上述植物乳杆菌CCFM1286的发酵剂生产得到的乳制品、豆制品或果蔬制品;或所述食品为含有上述植物乳杆菌CCFM1286的饮料或零食。
本发明还提供了一种延缓衰老的药品,所述药品中含有上述植物乳杆菌CCFM1286或上述微生物菌剂。
本发明还提供了上述植物乳杆菌CCFM1286,或上述微生物菌剂在制备延缓衰老的产品中的应用。
在本发明的一种实施方式中,所述产品为药品或保健品。
在本发明的一种实施方式中,所述产品中,植物乳杆菌CCFM1286的含量不低于10
本发明还提供了一种制备尿石素A的方法,所述方法为,采用上述植物乳杆菌CCFM1286,以含有鞣花单宁或鞣花酸的物质为底物,进行反应,制备得到反应液,从反应液中提取得到尿石素A。
在本发明的一种实施方式中,所述含有鞣花单宁的物质包含:石榴、桑葚、覆盆子、草莓、核桃、开心果、胡桃。
在本发明的一种实施方式中,所述反应的条件为30~37℃,150~200rpm,时间为24-72h。
在本发明的一种实施方式中,其以ETs或EA为原料产生所述的尿石素类物质Uro。
在本发明的一种实施方式中,所述植物乳杆菌CCFM1286在有氧的条件下进行。
在本发明的一种实施方式中,所述植物乳杆菌CCFM1286于150-250rpm转速震荡培养。
在本发明的一种实施方式中,所述反应在30-37℃生化培养箱中进行。
在本发明的一种实施方式中,所述反应进行时间为36-60h。
在本发明的一种实施方式中,所述含有鞣花单宁的物质为果汁,所述果汁是石榴汁。
在本发明的一种实施方式中,所述石榴汁为市售NFC石榴汁、胰蛋白胨10g/L、酵母粉5g/L、磷酸氢二钾2g/L、柠檬酸二胺2g/L,并将pH调至7.0±0.2。
本发明还提供了用于预防或缓解疾病状态的植物提取物、其活性成分或一种或多种可从其分离获得的或生物合成的活性组分或代谢物,所述疾病状态始于或特征于线粒体功能障碍、衰老等退行性疾病等。
本发明提供了用于线粒体功能调控物的浆果提取物、其活性成分或一种或多种可从其中分离获得的组分或代谢物。
另一方面,本发明提供了用于预防或缓解疾病状态的浆果提取物、其活性成分或一种或多种可从其中分离获得的组分或代谢物,所述疾病状态始于或特征于线粒体功能随年龄增长而出现的衰退。
本发明还提供了一种增加或维持线粒体功能及数量的方法。所述方法包括下述步骤:喂食受试动物有效剂量的富含Uro的植物乳杆菌CCFM1286发酵提取物,以调控线粒体自噬和生物发生,从而维持线粒体的功能及数量。
有益效果
本发明提供了一株可生产Uro-A的菌株:植物乳杆菌CCFM1286,将该菌株的有以下优势(以下数值均为四个平行实验的值所取得平均值):
(1)将本发明的菌株以2%的接种量接种至浆果汁中发酵48h,即可使膳食中的ETs先脱糖苷,再脱一个内酯环,最后通过多次脱羟基转化为以Uro-A为代表的各类Uro,发酵液中的Uro-A的含量为15.90±1.46μM,Uro-A的转化率为6.00±0.42%,除Uro-A以外的Uro总产量为236.19±10.40μM。
(2)本发明提供的植物乳杆菌CCFM1286后生元及合生元制剂通过短期促进功能障碍的线粒体自噬以及长期促进线粒体的生物发生来延长秀丽隐杆线虫的寿命,分别延长了26.04%、16.65%。
(3)本发明提供的后生元制剂中,植物乳杆菌CCFM1286发酵虽然使得其体外抗氧化能力(DPPH、ABTS自由基清除能力)略有下降,但是将大分子物质(ETs)转化为了小分子物质(Uro),显著提高了生物利用度,进而有效提高了体内的抗氧化功效。表观现象表现为:后生元制剂提高了线虫抗氧化应激能力,25mM百草枯氧化应激条件下线虫的存活百分比增加了41.30%;分子现象表现为:后生元制剂使得线虫体内的超氧化物歧化酶(SOD)酶活显著提高了95.25%,活性氧(ROS)含量显著降低了46.25%。
生物材料保藏
一株植物乳杆菌(Lactiplantibacillus plantarum)CCFM1286,分类学命名为Lactiplantibacillus plantarum,已于2022年09月15日保藏于广东省微生物菌种保藏中心,保藏编号为GDMCC No:62800,保藏地址为广州市先烈中路100号大院59号楼5楼,广东省科学微生物研究所。
附图说明
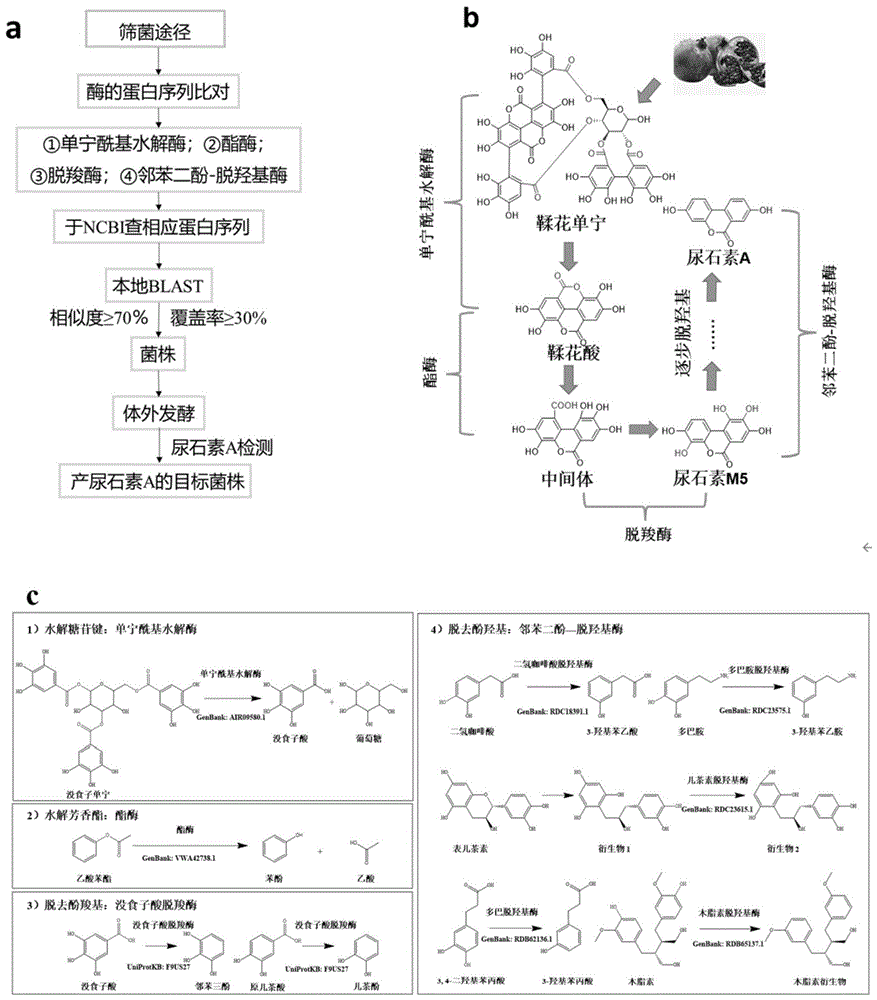
图1:转化鞣花单宁产生尿石素的菌株筛选途径;(a)转化ETs产生Uro的益生菌的筛选途径;(b)石榴汁来源的ETs转化成Uro代谢途径中作用的部位及相应的酶类别;(c)基于b所述的四大步骤,列举了一些目前已报道的具有水解糖苷键、芳香族酯类物质的酯键和脱去酚羧基和酚羟基的酶及相应的化学反应。
图2:植物乳杆菌CCFM1286的菌落特征。
图3:植物乳杆菌CCFM1286发酵石榴汁的HPLC和LCMS/MS图谱;(a)石榴汁发酵提取物HPLC图谱;(b)石榴汁发酵提取物的总离子流图。
图4:植物乳杆菌CCFM1286发酵过程中的尿石素A积累量变化。
图5:后生元及合生元干预下线虫的存活率。
图6:后生元的抗氧化能力及其对线虫抗氧化应激能力的影响;(a)后生元体外抗氧化能力测定;(b)后生元干预后线虫体内的SOD酶活;(c)后生元干预后线虫虫体的活性氧水平;(d)后生元干预8天后测定线虫在25mM百草枯诱导的氧化应激下的存活率。
图7:后生元及合生元改善了线虫的线粒体功能;(a)后生元及合生元干预8天后,通过JC-1染色测量红绿荧光强度比值以此来衡量线虫线粒体的膜电位;(b)后生元及合生元干预8天后,测定线虫虫体的ATP水平;(c)后生元及合生元干预对线虫线粒体数量的影响。
图8:后生元干预8天后线虫的基因表达情况。
图9:延长线虫寿命的信号通路示意图。
具体实施方式
下面结合具体实施例和附图对本发明进行进一步阐述。
下述实施例中涉及的ETs和Uro-A均购自sigma,纯度≥97%;下述实施例中涉及的NFC石榴汁、冻干石榴粉均购自无锡欧尚超市。下述实施例中所涉及的秀丽隐杆线虫为:N2野生型秀丽隐杆线虫,来自于江南大学食品生物技术中心菌种保藏中心。下述实施例中所涉及的冻干石榴粉购自:淘宝(产品品牌:Navitas Organics)。
下述实施例中所涉及的线粒体膜电位检测试剂盒(JC-1)购自:Solarbio(货号:M8650),ATP含量检测试剂盒购自:Solarbio(货号:BC0300)。
下述实施例中涉及的培养基如下:
BHI固体培养基:蛋白胨10.0g/L、脱水小牛脑浸粉12.5g/L、脱水牛心浸粉5.0g/L、氯化钠5.0g/L、葡萄糖2.0g/L、磷酸氢二钠2.5g/L,pH值调至7.0±0.2(25℃)。
BHI固体培养基:蛋白胨10.0g/L、脱水小牛脑浸粉12.5g/L、脱水牛心浸粉5.0g/L、氯化钠5.0g/L、葡萄糖2.0g/L、磷酸氢二钠2.5g/L、琼脂15.0g/L,pH值调至7.0±0.2(25℃)。
石榴汁发酵液:NFC石榴汁、胰蛋白胨10g/L、酵母粉5g/L、磷酸氢二甲2g/L、柠檬酸二胺2g/L,pH值调至7.0±0.2(25℃)。
NGM培养基:蛋白胨2.5g/L、氯化钠3.0g/L、氯化钙0.111g/L、硫酸镁0.12g/L、胆固醇0.005g/L、磷酸二氢钾3.4g/L、琼脂17.0g/L,pH值调至7.3±0.2(25℃)。
LB液体培养基:胰蛋白胨10.0g/L、酵母提取物5.0g/L、氯化钠10.0g/L,pH值调至7.0±0.2(25℃)。
M9缓冲液:氯化钠5g/L、磷酸二氢钾3g/L、磷酸氢二钠6g/L、硫酸镁0.12g/L。
下述实施例中所涉及的检测方法如下:
Uro-A的含量的检测,采用HPLC检测Uro-A的含量,使用Q Exactive液质联用仪进一步确认产物Uro-A的存在:
HPLC检测:使用Waters 1525液相色谱仪,液相柱X Bridge RC18(250×4.6mm,5μm);流动相:0.1%甲酸水(A相),甲醇(B相);紫外检测器,306nm;洗脱条件:流速1.0ml/min,梯度洗脱。安石榴苷具有两种同分异构体,分别为α型和β型,且不断相互转化。α-安石榴苷出峰时间:8.5min;β-安石榴苷出峰时间:18.1min。Uro-A出峰时间:19.1min。
LCMS检测:使用Q Exactive液质联用仪进一步确认产物Uro-A的存在,色谱柱C18,流动相:0.1%甲酸水(A相),乙腈(B相)。Uro-A,出峰时间为10.88min,分子式为C
实施例1:目标的筛选、鉴定、观察和保藏
1、筛选
底物ETs到产物Uro-A的过程需要各类催化酶(脱糖苷酶、酯酶、脱羧酶、脱酚羟基酶)的作用(图1b),其中脱酚羟基酶是核心酶,因其特异性较强,作用的底物范围非常窄,而整个转化途径中需历经连续三个脱酚羟基反应,即表明这个代谢途径涉及多种脱酚羟基酶的作用。目前尚未报道ETs到Uro-A这个代谢过程的相关酶。但是已报道存在一些作用于相似结构底物的酶(图1c)。分别将这些酶的序列在本地基因组数据库进行BLAST比对,初步筛选出相似度≥70%、覆盖率≥30%的菌株(筛选流程见图1)。
然后取这些菌分别进行体外发酵,发酵液经处理后,再通过waters液相(HPLC)和QE高分辨液质联用分析仪(LCMS/MS)定性定量检测,筛选出具有转化ETs产生Uro-A的菌株,共计1株植物乳杆菌。
2、鉴定
将筛选得到的目标菌株的16S rDNA进行扩增和测序(核苷酸序列如SEQ ID NO.1所示),再将获得的序列于NCBI-Blast中进行核酸序列比对,结果显示菌株为植物乳杆菌,命名为植物乳杆菌CCFM1286;
其中,16S rDNA扩增所用引物如下:
27F(正向):5’-AGAGTTTGATCCTGGCCTCA-3’;
1492R(反向):5’-GGTTACCTTGTTACGACTT-3’。
16S rDNA扩增程序如下:
94℃5min;共重复30个循环(94℃30s;55℃30s;72℃2min);72℃10min;12℃2min。
3、观察
挑取划有植物乳杆菌CCFM1286的平板上的单菌落接入BHI固体培养基,37℃倒置培养24-48h,观察该植物乳杆菌在BHI固体培养基上的菌落特征(图2)。
经观察可得,所述植物乳杆菌在BHI固体培养基上的菌落圆形状凸起,色泽呈乳白色、表面光滑,直径约2-3mm。
4、保藏
挑取植物乳杆菌CCFM1286的单菌落接入BHI液体培养基,37℃培养24h,取1.0mL菌液至菌种保藏管,平行5份,6000rpm离心3min,于超净台中弃去上清,加入1.0mL 30%(m/m)无菌甘油生理盐水,用旋涡振荡器充分混匀后,于-80℃保藏。
实施例2:植物乳杆菌CCFM1286发酵石榴汁制备尿石素A
1、植物乳杆菌CCFM1286制备尿石素A
(1)植物乳杆菌CCFM1286的活化
利用接种环从上述保菌管中蘸取少量植物乳杆菌CCFM1286的菌液在BHI固体培养基上三区划线,然后在37℃有氧条件下倒置培养24~48h;挑取单菌落接种至BHI液体培养基中,在37℃有氧条件下倒置培养24~48h,传代3-5次,最终得到活化的菌液。
(2)石榴汁发酵用培养液的制备
取一定量的市售NFC石榴汁,加入10g/L胰蛋白胨、5g/L酵母粉、2g/L磷酸氢二钾、2g/L柠檬酸二胺,磁力搅拌器搅拌均匀后,pH值调至7.0±0.2,然后85℃、20min杀菌,接着立即放入4℃环境骤冷使得菌体破灭,于4℃环境下备用(巴杀灭菌是为了防止石榴汁在115℃高温环境下发生美拉德反应)制备得到处理过后的石榴汁。
(3)植物乳杆菌石榴汁发酵
将步骤(1)获得的植物乳杆菌活化后的菌液以2%(v/v)的接种量接种至步骤(2)所述的石榴汁发酵液,于37℃环境下150~250rpm震荡培养72h,并在0、18、27、48、72h处取发酵液用于后续测定不同发酵时间点Uro的产量。
(4)Uro-A含量的检测
取1mL步骤(3)的发酵液,分别用相同体积的乙醚和乙酸乙酯连续萃取3次,再用冷冻真空离心浓缩仪处理萃取液至近干状,加入原发酵体积的色谱级甲醇,超声30min促溶,过0.22μm有机系滤膜后,转移至进样瓶中,检测尿石素A(Uro-A)含量。结果如表1所示:
结果如表1所示:
表1:不同发酵时间的Uro-A的产量
结果显示,植物乳杆菌CCFM1286在石榴汁发酵液中可将ETs(安石榴苷)转化为Uro-A等Uro,随着菌体的生长,发酵液中的Uro-A的含量逐渐增加;发酵至48h后,发酵液中Uro-A产量趋于饱和,保持基本稳定状态(图4)。
以发酵液中底物ETs的摩尔质量的减少量计算,发酵48h时,发酵底物ETs到发酵产物Uro-A的转化率为6.00±0.42%,Uro-A的产量为15.90±1.46μM,其他类型的Uro总产量为236.19±10.40μM。其中,底物减少量减去尿石素A的增加量,就是其他类型尿石素的产量。
2、后生元的制备:
将步骤1中的第(1)步获得的植物乳杆菌CCFM1286活化后的菌液以2%(v/v)的接种量接种至步骤1中的第(2)步所述的石榴汁发酵液,于37℃环境下150~250rpm震荡培养48h;
取发酵48h处的石榴汁发酵液进行过滤,滤液杀菌并2000~3000r/min离心10~20min,收集上清液,获得所述后生元制剂。
实施例3:合生元制剂的制备
本发明提供了一种具有抗衰老功效的合生元制剂,包括益生元、益生菌和冻干保护剂。益生元包括膳食来源的ETs,益生菌为具有转化ETs产生Uro-A的植物乳杆菌CCFM1286,冻干保护剂包括10%脱脂奶粉、3%甘油、10%麦芽糊精、20%海藻糖。
制备方法如下:
(1)配制冻干保护剂:
冻干保护剂是使用无菌水与保护剂原料混合制备而成,其含有质量分数为10%脱脂奶粉、3%甘油、10%麦芽糊精、20%海藻糖。
(2)利用接种环从上述保菌管中蘸取少量植物乳杆菌CCFM1286的菌液在BHI固体培养基上三区划线,然后在37℃有氧条件下倒置培养24~48h;挑取单菌落接种至BHI液体培养基中,在37℃有氧条件下倒置培养24~48h,传代3-5次,最终得到活化的菌液;
取活化后的植物乳杆菌CCFM1286,以2~4%(v/v)的接种量接种于MRS液体培养基中,37℃培养18-24h,制备得到种子液;
(3)将制备得到的种子液在6000rpm条件下离心3min收集菌泥,并采用pH=7.0的磷酸盐缓冲液漂洗3次,再用步骤(1)所述冻干保护剂重悬到10
(4)取冻干石榴粉与植物乳杆菌CCFM1286益生菌菌粉混合,得到所述合生元制剂;冻干石榴粉与植物乳杆菌CCFM1286菌粉按质量比为2:5的比例进行混合。经检测,所述合生制剂中植物乳杆菌CCFM1286活菌数(1.0~1.4)×10
实施例4:后生元及合生元制剂延长秀丽隐杆线虫寿命
具体步骤如下:
1、大肠杆菌OP50的培养
用接种环从保菌管中蘸取少量大肠杆菌OP50的菌液在LB固体培养基上三区划线,然后将平板置于37℃有氧条件下倒置培养18~24h;再挑取单菌落接种至LB液体培养基中,再在上述环境下进行培养,传代3次,得到活化的菌液。
2、秀丽隐杆线虫的复苏、传代及同步化
于-80℃冰箱中取出先前已保藏好的线虫,融化后用涂布棒涂布于接种OP50的NGM固体培养基上,置于20℃生化培养箱里正置培养。传代时,可用无菌手术刀切下面积为1cm
用M9缓冲溶液清洗并收集NGM培养基上的秀丽隐杆线虫,静置10min使得虫体及虫卵沉淀到底部,此时大肠杆菌OP50悬浮在上清,弃去上清,按含有秀丽隐杆线虫的M9缓冲液:5% NaClO:1M NaOH=2:1:2的体积比例进行混合,混合后在漩涡振荡器上充分震荡4~6min,期间使用体式显微镜观察虫体状态,待虫体裂解完全后立即6000rpm离心2min,弃去上清(主要为裂解液),然后加入M9缓冲溶液润洗并再一次离心(清洗虫卵从而避免裂解液对虫卵造成损伤),重复该步骤3~5次以充分除去残余的裂解液,最后将虫卵置于3-5mL M9缓冲溶液中并于20℃摇床孵育,虫卵基本上于24h内完成孵化,得到同步化线虫。
3、后生元对秀丽隐杆线虫寿命的影响
(1)按照实施例2的方法制备得到后生元制剂(实验组1);
(2)取未发酵的石榴汁(实施例2步骤1的第(2)步骤制备得到的处理过后的石榴汁)上清作为对照组1;
(3)含有干预液的NGM培养基制备
用等量的乙醚和乙酸乙酯连续分别萃取对照组1和后生元制剂(实验组1)3次,收集萃取液并冻干,加入DMSO溶解至原体积的1/100,再用OP50菌液稀释100倍到原体积(即DMSO的终浓度为1%,文献表明1% DMSO对秀丽隐杆线虫基本不产生影响)得到干预液;
将NGM培养基表面均匀涂抹80μL干预液,得到含有干预液的NGM培养基。
(4)将步骤2中同步化后的线虫置于20℃环境下培养48h得到L4期线虫后,将线虫转移至涂有干预液的NGM培养基中进行干预,直至所有线虫死亡。期间为了避免杂菌污染以及确保NGM培养基中干预液浓度的稳定,平均2天更换1次培养基;并且每个培养基配制时额外添加150μM 5-氟-2'-脱氧尿苷来抑制秀丽隐杆线虫的产卵,防止其子代对寿命相关实验的影响。每天记录线虫的存活情况,直至全部死亡。
4、合生元制剂对秀丽隐杆线虫寿命的影响
(1)按照实施例3的方法制备得到合生元制剂(实验组2);
(2)将合生制剂制备过程中的植物乳杆菌CCFM1286菌粉替换为大肠杆菌OP50菌粉,从而制备的复合制剂作为对照组2;
(3)将对照组2和合生元制剂(实验组2)水溶后分别涂至NGM培养基上,分别得到干预培养基;
(4)将步骤2中同步化后的线虫置于20℃环境下培养48h得到L4期线虫后,将线虫转移至干预培养基中进行干预,直至所有线虫死亡。期间为了避免杂菌污染以及确保NGM培养基中干预液浓度的稳定,平均2天更换1次培养基;并且每个培养基配制时额外添加150μM5-氟-2'-脱氧尿苷来抑制秀丽隐杆线虫的产卵,防止其子代对寿命相关实验的影响。每天记录线虫的存活情况,直至全部死亡。
结果显示:
(1)与对照组1相比,后生元组(实验组1)将线虫的寿命延长了26.04%;
(2)相比于对照组2,合生元组(实验组2)将线虫的寿命延长了16.65%(图5)。
实施例5:后生元制剂的体内外抗氧化能力测定
1、体外抗氧化能力测定(DPPH自由基清除能力)
具体步骤如下:
(1)配制1mmol/L DPPH工作液体:3.9432mg DPPH溶于10mL无水乙醇。
(2)样品液的制备:
发酵前石榴汁:取一定量的市售NFC石榴汁,加入10g/L胰蛋白胨、5g/L酵母粉、2g/L磷酸氢二钾、2g/L柠檬酸二胺,磁力搅拌器搅拌均匀后,pH值调至7.0±0.2,然后85℃、20min杀菌,接着立即放入4℃环境骤冷使得菌体破灭,于4℃下待测;
发酵后石榴汁:将植物乳杆菌活化后的菌液以2%(v/v)的接种量接种至石榴汁发酵液(即上述的发酵前石榴汁),于37℃环境下200rpm震荡培养48h,置于4℃下待测;
50μM ETs:2.7118mg ETs(安石榴苷)先溶于500μL DMSO,再溶于50mL去离子水,充分混匀,获得50μM ETs,置于4℃下待测;
50μM EA:0.7555mg EA先溶于500μL DMSO,再溶于50mL去离子水,充分混匀,获得50μM EA,置于4℃下待测;
50μM Uro-A:0.5705mg Uro-A先溶于500μL DMSO,再溶于50mL去离子水,充分混匀,获得50μM Uro-A,置于4℃下待测。
(3)反应体系
1mM DPPH(100μL)+100μL样品液,室温暗反应30min,于517nm处测定OD值。使用无水乙醇代替DPPH为样品空白组,使用水代替样品液为空白组。DPPH清除率(%)=A空白-A(实验)-A(样品空白)/A空白*100%。结果如图6a及下表所示:
表2:DPPH自由基清除率
结果显示:随着逐步脱羟基,相应产物的体外抗氧化能力(清除DPPH自由基的能力)逐渐减弱:ETs>EA>Uro-A,发酵前>发酵后(图6a)。结果表明,发酵虽然略微降低了体外抗氧化能力,但是将大分子物质(ETs)转化为了小分子物质(Uro),从而提高了生物利用度,进而有效提高了体内的抗氧化功效。
2、体外抗氧化能力测定(ABTS自由基清除能力)
具体步骤如下:
(1)配制7.2mM ABTS:39.5mg ABTS溶于10mg水;
配制2.5mM K
(2)样品液的制备
按照步骤1的方法制备得到样品液
ABTS(30μL)+170μL样品液,室温暗反应15min,于734nm处测定OD值。使用水代替ABTS为样品空白组,使用水代替样品液为空白组。ABTS清除率(%)=A空白-A(实验)-A(样品空白)/A空白*100%。结果如图6a及下表所示:
表3:ABTS自由基清除率
结果显示:随着ETs的逐步降解,相应产物EA、Uro-A的体外抗氧化能力(清除ABTS自由基的能力)逐渐减弱:ETs>EA>Uro-A,发酵前>发酵后(图6a)。
即ETs是石榴汁在体外发挥抗氧化能力的主要贡献者。发酵将一部分ETs转化为Uro-A,但是鉴于底物ETs含量的充足,发酵后体外抗氧化能力仅略微出现下降(下降了不到2%)。
3、体内抗氧化能力测定(SOD酶活、ROS含量)
发酵虽然略微降低了体外抗氧化能力,但是将大分子物质(ETs)转化为了小分子物质(Uro),从而提高了生物利用度,进而有效提高了体内的抗氧化功效。基于此,本发明还测定了后生元制剂对线虫体内抗氧化能力的影响。
具体实施方式同实施例4的步骤1~3;
按照实施例4中后生元制剂干预线虫的方法,用未发酵的石榴汁上清(对照组1)和后生元制剂分别对线虫进行干预8天,然后测量线虫体内的SOD酶活以及ROS含量。
结果显示:相比于对照组1,后生元组的线虫的SOD酶活增加了约95.25%(图6b),并且ROS含量降低了46.25%(图6c),后生元通过增强SOD酶活性来减少ROS的含量,从而实现了体内抗氧化能力的提高。
4、抗氧化应激能力的检测
具体实施方式同实施例4的步骤1~3;
按照实施例4中后生元制剂干预线虫的方法,分别用未发酵的石榴汁上清(对照组1)和后生元干预线虫8天后,将线虫转移至补充有25mM百草枯的NGM培养基中(百草枯是线粒体活性氧产生的诱导剂),每12h记录一次死亡的线虫数量,直至对照组1所有线虫都死亡。结果如表4和图6d所示。
表4秀丽隐杆线虫寿命试验相关数据汇总
表注:右侧三行是三次独立平行实验数据,左侧是三次累计计算。
结果表明:在百草枯处理1.5天(由图6d得出)后,对照组1约50%的线虫死亡,而相比之下,后生元干预组的线虫表现出了高抗氧化应激的能力,线虫的存活百分比显著增加了41.30%(由表4计算得到)。
综上,这些实验结果表明后生元显著提高了线虫体内的抗氧化能力,进而增强了线虫的抗逆性(抗氧化应激能力)。
实施例6:后生元及合生元改善了线虫的线粒体功能
正常的膜电位(Membrane Potential,MMP)是维持线粒体进行氧化磷酸化、产生三磷酸腺苷(ATP)的先决条件,MMP的稳定有利于维持细胞的正常生理功能。线粒体MMP的下降是细胞凋亡早期的一个标志性事件。因此,参考实施例4中后生元和合生元干预线虫的方法。
(1)具体实施方式同实施例4的步骤1~4;
按照实施例4中的方案,用对照组1、后生元组、对照组2和合生元组分别对同步化并培养至L4期的线虫进行干预,持续8天,然后测量各组线虫的线粒体功能状况(MMP、ATP含量)。使用线粒体荧光染料JC-1和ATP含量检测试剂盒分别检测各组线虫体内线粒体的MMP及ATP含量(表5)。
表5:ATP含量
单位:nmol/mg蛋白质。
结果显示:实验组(后生元组、合生元组)干预8天后的线虫体内红/绿荧光的比值更高,即实验组MMP显著高于对照组(图7a);实验组线虫的ATP水平高于对照组(图7b),并且ATP含量的多少与膜电位的高低具有正相关性。
(2)此外,有研究表明Uro-A可促进功能障碍的线粒体自噬和健康的线粒体生物发生。
具体实施方式同实施例4的步骤1~4;
按照实施例4中的方案,我们还检测了用对照组1、后生元组、对照组2和合生元组分别对同步化并培养至L4期的线虫进行干预后的线虫的线粒体含量,即,从L4期开始用实验组、对照组处理的年轻(第1天)和老年(第8天)线虫的线粒体含量。
结果显示,在年轻线虫中(第1天),与对照组相比,实验组均导致线虫体内线粒体含量降低(图7c);而在老年线虫中(第8天),经实验组干预后的线虫的线粒体含量恢复/超过对照组的水平(图7c)。
综上实验结果,在短期后生元或合生元干预之后功能障碍的线粒体出现自噬,线粒体含量下降;长期干预之后线粒体含量恢复/超过对照组线粒体水平,并且线粒体功能状态优于对照组。这些现象表明了后生元和合生元促进了功能障碍的线粒体自噬和健康线粒体的生物发生,从而抑制了线粒体功能随年龄增长而出现的衰退,最终达到抗衰老的功效。
实施例7:尿石素介导的线虫寿命延长需要线粒体自噬及活性氧下降
后生元可能会通过改善线粒体功能或降低活性氧的含量来发挥其有益功效。因此,本发明在分子水平上进一步进行了相关的验证。
具体实施方式同实施例4的步骤1~3;
按照实施例4中后生元干预线虫的方法,用后生元对线虫持续干预8天,然后检测了干预8天后的秀丽隐杆线虫的抗逆基因和自噬基因的表达情况,包括过氧化氢酶基因(ctl-1)、过氧化物歧化酶基因(sod-1)、谷胱甘肽转移酶基因(gst-1)、自噬基因(bec-1、sqst-1和vps-34)和线粒体自噬基因(pink-1、dct-1和skn-1)。
实验结果发现后生元干预后老年线虫(第8天)的自噬基因和线粒体自噬基因的表达显著增加(图8);而在后生元干预组中,除了自噬基因和线粒体自噬基因的表达增加以外,sod-1、hsp-70的表达也显著增加。
上述实验结果表明了,后生元和合生元制剂主要通过促进功能障碍的线粒体自噬和健康线粒体的生物发生来重构线粒体功能,最终实现延长线虫寿命的作用,此外,后生元还通过增强SOD的酶活性来减少活性氧的含量(延长线虫寿命的信号通路示意图见图9,本图由Figdraw绘制)。
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
